Anti-NMDAR protilátky u demyelinizačních onemocnění
Anti-NMDAR Antibodies in Demyelinating Diseases
Introduction:
Antibodies against N-methyl D-aspartate receptor (anti-NMDAR) are directly pathogenic autoantibodies associated with encephalitis. Cases reporting the presence of anti-NMDAR antibodies associated with a demyelinating disease have been published, some without symptoms of NMDAR encephalitis. The aim of our study was to describe characteristics of a demyelinating disease in patients with anti-NMDAR antibodies.
Material and methods:
Anti-NMDAR antibodies were investigated in the serum and cerebrospinal fluid of patients with clinically suspected autoimmune encephalitis by indirect immunofluorescence using cell-based assay on fixed cells transfected for the antigen. The clinical course and MRI findings consistent with a demyelinating disease were assessed in accordance with the current diagnostic criteria.
Results:
Eleven patients with autoimmune encephalitis and positive anti-NMDAR were identified between 2012 to 2015. Ten of them met criteria of NMDAR encephalitis, one patient had an acute onset (de novo status epilepticus) with MRI and CSF findings corresponding with acute disseminated encephalomyelitis and regression following corticosteroid treatment. Subsequently, due to MRI dynamics, this patient met the criteria of multiple sclerosis. One patient with NMDAR encephalitis developed an optic neuritis 20 months later and MRI showed demyelinating changes with dissemination in time and space. Following corticosteroid and azathioprine treatment, the patient is clinically stable but with persisting MRI disease activity. In both patients, demyelinating lesions were also identified in the spinal cord.
Conclusion:
In patients with an atypical manifestation of a demyelinating disease (prominent psychiatric or cognitive symptoms, seizures or extrapyramidal signs) anti-NMDAR testing should be performed and an appropriate immunotherapy should be started in positive cases. In some patients, NMDAR encephalitis may result in an onset of a demyelinating disease.
Key words:
demyelinating disease – anti-NMDAR
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Chinese summary - 摘要
抗NMDAR抗体在脱髓鞘疾病中的应用介绍:
针对N-甲基D-天门冬氨酸受体(抗NMDAR)的抗体是与脑炎症相关的直接致病性自身抗体。报告了与脱髓鞘疾病相关的抗NMDAR抗体的存在的病例已经出版,一些没有NMDAR脑炎的症状。我们研究的目的是描述抗NMDAR抗体患者脱髓鞘疾病的特征。
材料和方法:
通过间接免疫荧光法检测临床疑似自身免疫性脑炎患者的血清和脑脊液中的抗NMDAR抗体,使用基于细胞的测定法将固定的细胞转染入抗原。根据目前的诊断标准评估与脱髓鞘疾病一致的临床过程和MRI结果。
结果:
在2012年至2015年期间,确定了11例自身免疫性脑炎和阳性抗NMDAR患者。其中10例符合NMDAR脑炎症标准,其中1例发生急性发作(从头状癫痫),MRI和CSF发现与急性播散性脑脊髓炎和回归皮质类固醇治疗后。随后,由于MRI动力学,该患者符合多发性硬化症的标准。一名NMDAR脑炎患者20个月后出现视神经炎症,MRI显示随着时间和空间传播的脱髓鞘变化。在皮质类固醇和硫唑嘌呤治疗后,患者临床稳定但持续存在MRI疾病活动。在两名患者中,脊髓中也鉴定出脱髓鞘病变。
结论:
在具有脱髓鞘疾病(突出的精神病或认知症状,癫痫发作或锥体外系征象)的非典型表现的患者中,应进行抗NMDAR检测,并在阳性情况下开始适当的免疫治疗。在一些患者中,NMDAR脑炎可能导致脱髓鞘疾病的发作。
关键词:
脱髓鞘疾病 - 抗NMDAR
Autoři:
M. Elišák 1; E. Meluzínová 1; J. Hanzalová 1,2; P. Lišková 1; D. Krýsl 3; I. Doležalová 4; I. Štětkářová 5; P. Marusič 1
Působiště autorů:
Neurologická klinika 2. LF UK a FN Motol, Praha
1; Ústav imunologie, 2. LF UK a FN Motol, Praha
2; Institute of Neuroscience and Physiology, Department of Clinical Neuroscience and Rehabilitation, Sahlgrenska Academy, University of Gothenburg, Gothenburg, Sweden
3; 1. neurologická klinika LF MU a FN u sv. Anny v Brně
4; Neurologická klinika 3. LF UK a FN Královské Vinohrady, Praha
5
Vyšlo v časopise:
Cesk Slov Neurol N 2017; 80/113(3): 332-335
Kategorie:
Krátké sdělení
doi:
https://doi.org/10.14735/amcsnn2017332
Souhrn
Úvod:
Protilátky proti N-metyl D-aspartátovému receptoru (anti-NMDAR) jsou přímo patogenní autoprotilátky sdružené s difuzní encefalitidou. V poslední době byly popsány případy, kdy s nálezem těchto protilátek byly sdruženy projevy demyelinizačního onemocnění, a to i u pacientů bez klinických projevů NMDAR encefalitidy. Cílem práce je popsat charakteristiky demyelinizačního onemocnění u pacientů s pozitivitou anti-NMDAR v našem souboru.
Metodika a soubor:
Vyšetření anti-NMDAR bylo indikováno při klinickém podezření na autoimunitní encefalitidu a bylo provedeno v séru a v likvoru nepřímou imunoflurescencí metodou cell-based assay na fixovaných buňkách transfekovaných pro daný antigen. Klinický průběh a MR nález odpovídající demyelinizačnímu onemocnění byl hodnocen dle příslušných diagnostických kritérií.
Výsledky:
V období 2012– 2015 jsme identifikovali 11 pacientů s autoimunitní encefalitidou a pozitivitou anti-NMDAR. Deset z nich splňovalo kritéria NMDAR encefalitidy, u jedné pacientky odpovídal iniciální obraz akutní diseminované encefalomyelitis (de novo rozvinutý status epilepticus) s odpovídajícím MR a likvorovým nálezem i s regresí po kortikoterapii. Tato pacientka vzhledem k vývoji MR nálezu následně splnila kritéria roztroušené sklerózy. U jedné pacientky s NMDAR encefalitidou se za 20 měsíců od počátku onemocnění vyvinula optická neuritida s nálezem demyelinizačních změn na MR. Kontrolní vyšetření prokázalo diseminaci v čase a v prostoru, po pulzní kortikoterapii a při chronické imunosupresi azathioprinem je pacientka klinicky stabilizovaná, na MR mozku ale přetrvávají známky aktivity onemocnění. U obou uvedených pacientek byly demyelinizační léze prokázány i na MR míchy.
Závěr:
U pacientů s atypickými projevy demyelinizačního onemocnění (dominující psychiatrické či kognitivní symptomy, epileptické záchvaty a exptrapyramidové příznaky) je vhodné doplnit vyšetření anti-NMDAR a dle výsledku zvolit vhodnou imunoterapii. Demyelinizační onemocnění se může rozvinout i u pacientů po prodělané NMDAR encefalitidě.
Klíčová slova:
demyelinizační onemocnění – anti-NMDAR
Úvod
Autoprotilátky proti N-metyl D-aspartátovému glutamátovému receptoru (anti-NMDAR) jsou asociovány s akutní autoimunitní panencefalitidou s charakteristickým klinickým průběhem – NMDAR encefalitidou. Jde přímo o patogenní autoprotilátky třídy IgG, jejichž epitopem je GluN1 (podjednotka NMDAR). Diagnóza NMDAR encefalitidy je založena na pozitivitě anti-NMDAR v séru nebo v likvoru, spolu s charakteristickým klinickým průběhem. Výskyt anti-NMDAR byl v poslední době popsán i u dalších neuropsychiatrických onemocnění, např. epilepsie [1], schizoafektivní poruchy [2] nebo u systémových autoimunit s neurologickými projevy (např. systémový lupus erythematodes) [3]. U těchto onemocnění není role anti-NMDAR doposud vyjasněna – mimo jiné proto, že byla v některých případech popsána přítomnost i jiných typů anti-NMDAR protilátek (IgM protilátky nebo protilátky s vazbou na jiné podjednotky NMDA receptoru), metodika detekce byla rozdílná a ve všech případech nebylo vyšetřováno zároveň sérum a likvor pacientů.
V posledních letech byl u některých pacientů s NMDAR encefalitidou popsán výskyt klinických i radiologických nálezů odpovídajících demyelinizačnímu onemocnění. Tyto změny mohou předcházet nebo následovat projevy NMDAR encefalitidy [4]. Byly publikovány kazuistiky, kdy byl stejný typ anti-NMDAR protilátek přítomen u pacientů, u kterých průběh onemocnění odpovídal demyelinizačnímu onemocnění [5]. Mimo jiné i vzhledem k různé metodice detekce zůstává role anti-NMDAR a volba nejvhodnějšího terapeutického postupu u těchto pacientů zatím nejasná.
Cílem práce je popsat klinický obraz u pacientů s demyelinizačními projevy a pozitivitou anti-NMDAR vyšetřených na našem pracovišti.
Metodika a soubor
Pacienti byli vyšetřováni na přítomnost antineuronálních protilátek (protilátky proti membránovým a synaptickým antigenům, dobře charakterizované onkoneurální protilátky při klinickém podezření na autoimunitní encefalitidu). Za suspektní autoimunitní encefalitidu jsme považovali onemocnění u pacientů s akutním rozvojem encefalopatie, de novo rozvinutými epileptickými záchvaty, psychiatrickými příznaky a dále s obrazem serózního zánětu v likvoru a/nebo přítomnost oligoklonálních pásů. Jako nález odpovídající demyelinizačnímu onemocnění na magnetické rezonanci (MR) byly hodnoceny T2 hyperintenzní multifokální a extenzivní supratentoriální změny, infratentoriální změny a míšní postižení. Kontrolní MR byla provedena u všech pacientů. Klinický i MR nález byly hodnoceny dle diagnostických kritérií pro autoimunitní encefalitidu [6], roztroušenou sklerózu [7], akutní diseminovanou encefalomyelitidu (ADEM) [6] a neuromyelitis optica (NMO), resp. NMO-spectrum disorder [8]. Protilátky byly vyšetřovány v likvorologické laboratoři FN Motol, kromě protilátek anti-MOG, které byly vyšetřovány v neuroimunologické laboratoři Univerzitní nemocnice Schleswig-Holstein v Kielu. Přítomnost anti-NMDAR ve třídě IgG byla hodnocena pomocí komerčně dostupných kitů pro nepřímou imunofluorescenci na fixovaných buňkách HEK293 transfekovaných genem pro daný antigen – GluN1 podjednotka NMDA receptoru (Autoimmune encephalitis mosaic 1, Euroimmun AG). Tento kit detekuje také další protilátky proti membránovým a synaptickým antigenům (anti-AMPAR1 a 2, anti-GABAbR, anti-LGI1 a anti-CASPR2). Anti-MOG ve třídě IgG byly detekovány na transfekovaných fixovaných buňkách HEK293 připravovaných v neuroimunologické laboratoři v Kielu. Sérum všech pacientů bylo vyšetřeno na přítomnost dobře charakterizovaných onkoneurálních protilátek (anti-Hu, anti-Yo, anti-Ri, anti-Ma2, anti-CV2/CRMP5, anti-amfifyzin) pomocí komerčně dostupných kitů pro Western blot (Euroimmun AG). Dále byly vyšetřovány protilátky proti tkáňové peroxidáze (anti-TPO), gliadinu a transglutamináze, dexarboxyláze kyseliny glutamové (anti-GAD), anti-kardiolipinové a anti-fosfolipidové protilátky, antinukleární protilátky (ANA), protilátky proti cytoplazmě neutrofilů (ANCA), proti extrahovatelným nukleárním antigenům (ENA) se subtypizací, protilátky proti endotelu a proti dvojspirálové DNA (ds-DNA). V případech odpovídajících demyelinizaci byly vyšetřovány i protilátky proti akvaporinu 4 (anti-AQP4) a protilátky proti myelinovému oligodendrocytárnímu glykoproteinu (anti-MOG). Do souboru byli zařazeni pouze pacienti splňující kritéria pro autoimunitní encefalitidu.
Výsledky
V období 1/2012–6/2015 jsme identifikovali 11 pacientů s rozvojem akutní encefalitidy a s pozitivitou anti-NMDAR. Při prvním vyšetření byly tyto protilátky pozitivní v séru i v likvoru (n = 8), izolovaně v likvoru (n = 1), izolovaně v séru (n = 1) nebo v séru u pacienta bez současného vyšetření likvoru (n = 1). U 10 pacientů klinický i MR obraz odpovídal NMDAR encefalitidě. U jedné pacientky byla přítomna akutní encefalopatie s non-konvulzivním epileptickým statem, zánětlivým nálezem v likvoru a s vícečetnými demyelinizačními změnami charakteru ADEM. U jedné pacientky (kazuistika 1 s anamnézou NMDAR encefalitidy došlo několik měsíců po prodělané NMDAR encefalitidě k rozvoji retrobulbární neuritidy a dynamika nálezu na MR potvrdila diagnózu roztroušené sklerózy). U další pacientky z této skupiny byly iniciální příznaky monokulární porucha zraku a parestezie levých končetin bez korelátu při vyšetření zrakové evokovaných potenciálů (VEP) a na MR mozku a míchy, následované s odstupem 1 měsíce rozvojem akutní psychózy. Tato pacientka nesplnila kritéria demyelinizačního onemocnění. U žádného z dalších pacientů, kteří prodělali NMDAR encefalitidu, nedošlo k recidivě nebo k rozvoji klinických projevů odpovídajících demyelinizaci (medián sledování 26 měsíců).
Iniciální MR mozku byla abnormální u osmi z 11 pacientů. U šesti z nich byl nález nespecifických nevýrazných gliových změn supratentoriálně bez progrese při kontrolním vyšetření (medián sledování 20 měsíců). U jedné pacientky (kazuistika 2) odpovídal MR nález demyelinizačním změnám. U jedné pacientky v době probíhající NMDAR encefalitidy byl nález T2 hyperintenzní léze frontálně vlevo, sytící se po gadoliniu, s regresí nálezu na kontrolních MR korelující s klinickým zlepšením.
Kazustika 1
Dosud zdravá pacientka (25 let) byla hospitalizována 12/ 2011 pro generalizovaný tonicko-klonický epileptický záchvat (GTCS), kterému předcházela několik týdnů trvající schizoafektivní porucha. Během hospitalizace došlo k rozvoji periorálních dyskinéz a recidivě GTCS. Iniciální nález na MR mozku byl v normě, elektroencefalografie (EEG) prokazovala nespecifickou abnormitu s difuzní příměsí pomalých vln, v likvoru byla lymfocytární pleocytóza s intratékální syntézou protilátek, anti-NMDAR byly pozitivní v likvoru i v séru. Byla aplikována série plazmaferéz a pulz metylprednizolonu s následným perorálním „taperem“ kortikosteroidů s příznivým klinickým efektem. Vzhledem k opakovaným epileptickým záchvatům byl nasazen levetiracetam. U pacientky došlo k vymizení většiny příznaků, přetrvávaly pouze drobné periorální dyskinézy. Opakovaný onkologický skríning neprokázal tumor. Sedm měsíců od začátku onemocnění byly vzhledem k příznivému klinickému průběhu kortikoidy vysazeny, ale po 5 měsících (12/2012) došlo k relapsu onemocnění, které se manifestovalo afektivní poruchou s opětovnou pozitivitou NMDAR protilátek v likvoru i v séru. Cyklus plazmaferéz s pulzem metylprednizolonu byl jen s částečným efektem, proto byly aplikovány intravenózní imunoglobuliny v celkové dávce 120 g. Následně došlo k úplné klinické remisi i vymizení anti-NMDAR. Byla zahájena chronická imunosuprese – prednizon v kombinaci s azathioprinem. Po půl roce došlo k rozvoji retrobulbární neuritis vlevo potvrzené vyšetřením VEP, na MR se nově objevila T2 hyperintenzní ložiska supratentoriálně periventrikulárně a jedno ložisko v hrudní míše, jehož rozsah nepřesahoval jeden míšní segment. Kontrolní vyšetření likvoru prokázalo 11 oligoklonálních pásů (OCB), anti-AQP4, IgG v séru byly negativní. Po aplikaci pulzu metylprednizolonu došlo k úpravě zraku. Klinicky byla pacientka dále zcela stabilizovaná, ale na kontrolní MR přibyla po půl roce tři drobná ložiska periventrikulárně. Vývojem na MR byla naplněna diagnostická kritéria pro relapsremitentní formu roztroušené sklerózy. Zpětně byla zjištěna pozitivita anti-MOG v séru při ředění 1 : 40. Vzhledem k dynamice na MR na stávající imunosupresi jsme přikročili ke změně terapie a pacientka je t.č. léčena pulzy IvIg v dávce 20 g měsíčně.
Kazuistika 2
Dosud zdravá pacientka (33 let) byla přijata v 3/2014 pro náhle vzniklou bolest hlavy a zmatenost. Vstupní CT mozku odhalilo nespecifické hypodenzní změny v obou hemisférách, na MR mozku byla přítomna četná ložiska prstenčitě se sytící s perifokálním edémem s maximem periventrikulárně, ojedinělá ložiska v levé mozečkové hemisféře a v pontu (obr. 1). Vyšetření likvoru v den přijetí ukázalo obraz serózního zánětu (18/3 buněk s lymfocytární převahou), bez poruchy hematoencefalické bariéry, s pozitivní intratékální syntézou (11 OCB v likvoru a 2 OCB v séru). EEG odpovídalo non-konvulzivnímu epileptickému statu. Po intravenózním loadu levetiracetamem došlo k výraznému zlepšení EEG i klinického stavu. Sérologické vyšetření neprokázalo infekční etiologii (herpetické viry, HIV, toxoplazma, mycoplazma, chlamydia trachomatis, borelie). Vzhledem k rozsahu nálezu na MR byl zvažován i lymfom, vyšetření průtokovou cytometrií v likvoru i v séru však neprokázalo přítomnost nádorových buněk, obdobně imunologický panel systémových vaskulitid, anti-TPO a anti-GAD. Vzhledem k pravděpodobné autoimunitní etiologii byl podán metylprednizolon v celkové dávce 5 g. Opakované kontrolní EEG prokázalo pouze přetrvávající příměs pomalých vln nad přední části lbi. Na kontrolní MR mozku došlo po aplikaci kortikoidů k regresi sycení, byla ale zjištěna i ložiska v oblasti krční míchy, VEP byly v normě. Zpětně byla zjištěna pozitivita anti-NMDAR v séru i v likvoru ze vzorků v době rozvoje onemocnění, anti-AQP4 i anti-MOG jsou negativní. Neuropsychologické vyšetření potvrdilo deficit v oblasti exekutivních funkcí a ve verbální pracovní paměti. Kontrolní MR 6/2014 prokázala dynamiku nálezu (částečná regrese původních ložisek, nová vícečetná drobná T2 hyperintenzní ložiska supratentoriálně odpovídající demyelinizaci), a pacientka tedy splnila MR kritéria (progrese v čase a prostoru) pro roztroušenou sklerózu. Od 10/2014 byla zahájena terapie interferonem β, na které je pacientka dosud stabilizovaná.
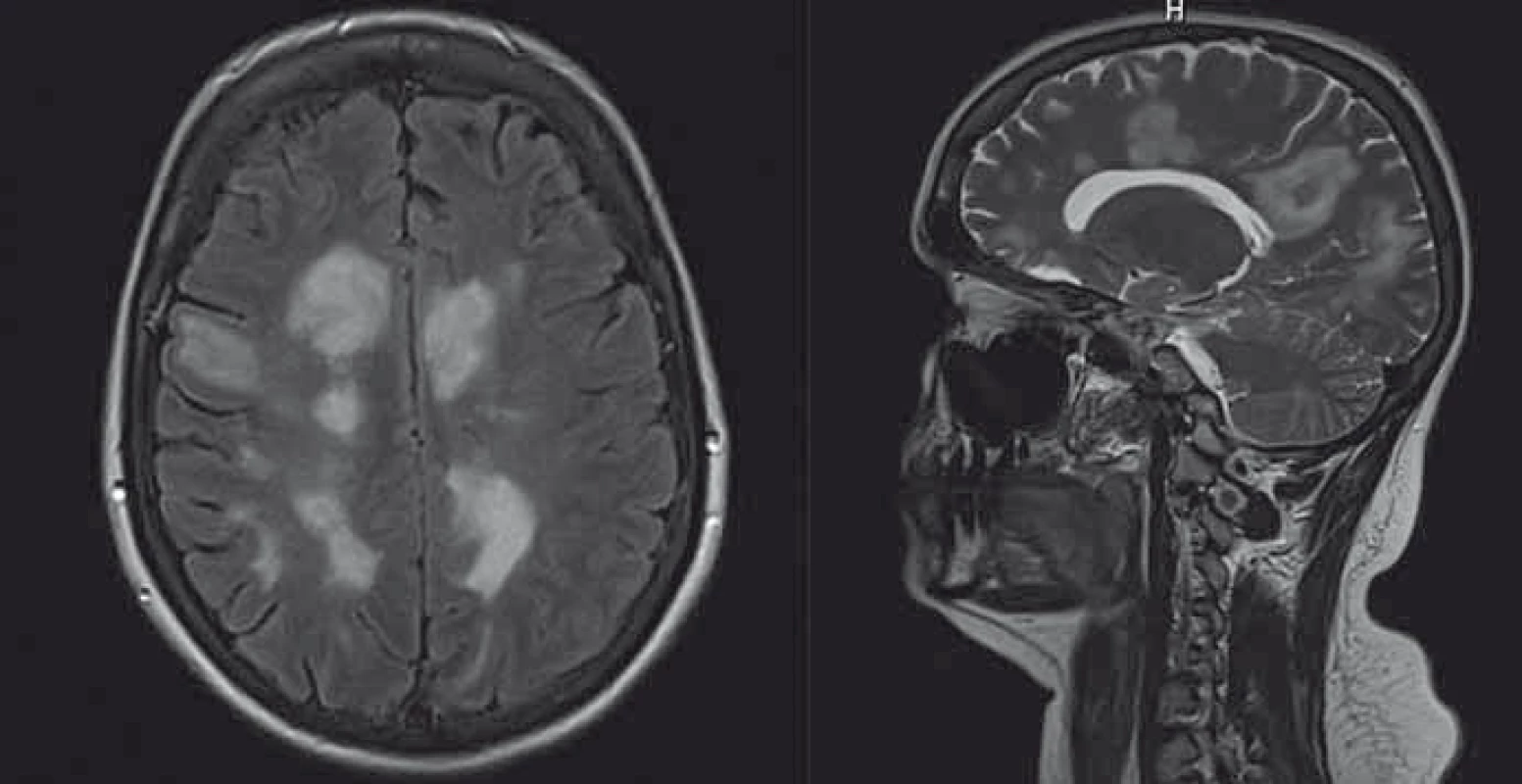
Diskuze
NMDAR encefalitida je klinicky charakterizovaná jednotka. Jedná se o autoimunitní či méně často paraneoplastickou akutní difuzní encefalitidu, která se typicky manifestuje nejprve jako akutní psychóza s kognitivním deficitem. Obvykle následují epileptické záchvaty, extrapyramidové příznaky, kvantitativní porucha vědomí a autonomní instabilita. Ne u každého pacienta ale dochází k rozvoji všech těchto příznaků [9]. Diagnóza NMDAR encefalitidy se opírá (kromě charakteristického klinického obrazu) o průkaz patogenních protilátek v séru nebo pouze izolovaně v likvoru. MR mozku je většinou normální nebo s nálezem nespecifických změn.
S rozšiřujícím se počtem publikovaných pacientů jsou popisovány jednak méně typické (např. oligosymptomatické) průběhy NMDAR encefalitidy, jednak se objevují nové přidružené příznaky, které mohou napodobovat klinický průběh NMO s negativitou anti-AQP4 [10], ADEM [5], nebo se NMDAR encefalitida může sdružovat s myelitidou [11]. Byly publikovány kazuistiky pacientek, které splňovaly iniciálně kritéria pro roztroušenou sklerózu, otěhotněly a v poporodním období se u nich rozvinuly psychiatrické a kognitivní příznaky spolu s nálezem výrazných T2 hyperintenzích změn na MR mozku. U těchto pacientek byla následně prokázána pozitivita anti-NMDAR protilátek [12,13].
Role anti-NMDAR protilátek v rozvoji demyelinizačních projevů zůstává nejasná. Jednak pro malý počet dosud popsaných případů, jednak pro různé metodiky používané k detekci anti-NMDAR. Může se jednat o souběh dvou nezávislých imunologických procesů, kdy různé klinické projevy jsou zprostředkovány různými typy protilátek (či na protilátkách nezávislými mechanizmy). Byla např. popsána současná pozitivita anti-NMDAR a anti-AQP4 či anti-MOG [4]. Byly ale publikovány též případy pacientů s demyelinizačními projevy a s izolovanou pozitivitou anti-NMDAR (bez současné pozitivity anti-AQP4 i anti-MOG). Vzhledem k přítomnosti NMDAR receptorů na oligodendrocytech nelze vyloučit ani postižení myelinu přímo způsobené anti-NMDAR protilátkami, i když pro toto tvrzení zatím chybí experimentální model.
Role autoprotilátek u demyelinizačních onemocnění není dosud jednoznačně objasněna. B buněčně zprostředkovaná imunita hraje u roztroušené sklerózy roli, mj. i vzhledem k zařazení pozitivity OCB v likvoru mezi diagnostická kritéria. Za nejvýznamnější specifické autoprotilátky jsou v současné době považovány anti-MOG, anti-AQP4 a právě anti-NMDAR [6]. Výskyt těchto specifických autoprotilátek se ale nezdá být častý – v retrospektivní skupině 51 pacientů s ADEM, 34 pacientů s klinicky izolovaným syndromem, 41 pacientů NMO spectrum disorder a 89 pacientů splňujících kritéria roztroušené sklerózy byla pozitivita anti-NMDAR prokázána pouze u jediné pacientky, u které byla roztroušená skleróza následována rozvojem kognitivního deficitu a psychiatrických příznaků [13]. Zejména v případech výskytu atypických projevů (dyskinézy, dominující psychiatrické příznaky) demyelinizačního onemocnění by měla být možná asociace s anti-NMDAR pozitivitou zvažována. Protilátky anti-MOG byly popsány u pacientů s NMO spectrum disorder i u pacientů s rozlišným fenotypem roztroušené sklerózy [14].
Možnost různých imunopatologických procesů vede k otázce výběru vhodné dlouhodobé imunosupresivní léčby u těchto pacientů. U pacientů s NMO jako modelovým demyelinizačním onemocněním způsobeným autoprotilátkami bylo popsáno zhoršení stavu po interferonu [15]. U pacientů s pozitivitou anti-NMDAR ani anti-MOG zatím podobná práce nebyla publikována. Proto jsme u pacientky prezentované v kazuistice 2 i přes zpětně zjištěnou pozitivitu anti-NMDAR a anti-MOG vzhledem ke stabilizovanému stavu na terapii interferonem β zatím nepřikročili ke změně terapie. S přihlédnutím k patogenezi a k průkazu účinnosti u roztroušené sklerózy i NMDAR encefalitidy mohou být lékem volby v těchto případech kortikosteroidy či intravenózní imunoglobuliny, u kterých byla popsána srovnatelná účinnost s léky první volby v terapii roztroušené sklerózy [16] a prokázán efekt u anti-NMDAR encefalitidy [17]. Při vyšší klinické a MR aktivitě jsou možností léčby rituximab či cyklofosfamid, které snižují riziko opakování relapsu u NMDAR encefalitidy [17].
Závěr
Vyšetření anti-NMDAR protilátek by mělo být zváženo u všech pacientů s atypickými projevy demyelinizačního onemocnění (zejména s dominujícími psychiatrickými a extrapyramidovými příznaky či iniciální akutní encefalopatií), protože nález pozitivity anti-NMDAR může modifikovat strategii imunoterapie a prognózu onemocnění. Vzhledem k dosud malému počtu diagnostikovaných pacientů a zřejmě vzácnému výskytu je optimální léčebná strategie předmětem dalšího výzkumu. Lékem volby je nyní imunoterapie, jejíž účinnost byla prokázána jak u autoimunitních encefalitid, tak demyelinizačních onemocnění. Není dosud jasné, zda se v případech výskytu demyelinizačního onemocnění jedná o rozšíření klinického fenotypu NMDAR encefalitidy nebo o souběh dvou nezávislých autoimunitně podmíněných onemocnění centrálního nervového systému.
Seznam použitých zkratek
ADEM – akutní diseminovaná encefalomyelitida
anti-AQP4 – autoprotilátky proti akvaporinu 4
anti-AMPAR – autoprotilátky proti receptoru α-amino-3-hydroxy-5-metyl-4-isoxazol propionové kyseliny
anti-CASPR2 – autoprotilátky proti contactin-associated protein-like 2
anti-GABAbR – autoprotilátky proti b podjednotce gama-aminomáselné kyseliny
anti-GAD – autoprotilátky proti dekarboxyláze kyseliny glutamové
anti-LGI1 – autoprotilátky proti leucine-rich glioma inactivated 1
anti-MOG – autoprotilátky proti myelinovému oligodendrocytárnímu glykoproteinu
anti-NMDAR – autoprotilátky proti N-metyl D-aspartát glutamátovým receptorům
anti-TPO – autoprotilátky proti tkáňové peroxidáze
DNA – deoxyribonukleová kyselina
EEG – elektroencefalografie
GluN – podjednotky glutamátového NMDA receptoru
IgG – imunoglobuliny třídy G
IgM – imunoglobuliny třídy M
IvIg – intravenózní imunoglobuliny
NMO – neuromyelitis optica
OCB – oligoklonální pásy
VEP – zrakové evokované potenciály
Práce byla podpořena Alzheimer nadačním fondem a Nadačním fondem AVAST a Grantovou agenturou Univerzity Karlovy (projekt č. 189215).
Poděkování doc. Frankovi Leypoldtovi a Martině Jansen za vyšetření anti-MOG v laboratoři Institutu klinické biochemie Univerzitní nemocnice v Kielu.
MUDr. Martin Elišák
Neurologická klinika
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: martin.elisak@gmail.com
Přijato k recenzi: 20. 9. 2016
Přijato do tisku: 30. 1. 2017
Zdroje
1. Ekizoglu E, Tuzun E, Woodhall M, et al. Investigation of neuronal autoantibodies in two different focal epilepsy syndromes. Epilepsia 2014;55(3):414– 22. doi: 10.1111/ epi.12528.
2. Kayser MS, Titulaer MJ, Gresa-Arribas N, et al. Frequency and characteristics of isolated psychiatric episodes in anti– N-methyl-d-aspartate receptor encephalitis. JAMA Neurol 2013;70(9):1133– 9.
3. Levite M. Glutamate receptor antibodies in neurological diseases: anti-AMPA-GluR3 antibodies, anti-NMDA-NR1 antibodies, anti-NMDA-NR2A/ B antibodies, anti-mGluR1 antibodies or anti-mGluR5 antibodies are present in subpopulations of patients with either: epilepsy, encephalitis, cerebellar ataxia, systemic lupus erythematosus (SLE) and neuropsychiatric SLE, Sjogren‘s syndrome, schizophrenia, mania or stroke. These autoimmune anti-glutamate receptor antibodies can bind neurons in few brain regions, activate glutamate receptors, decrease glutamate receptor‘s expression, impair glutamate-induced signaling and function, activate blood brain barrier endothelial cells, kill neurons, damage the brain, induce behavioral/ psychiatric/ cognitive abnormalities and ataxia in animal models, and can be removed or silenced in some patients by immunotherapy. J Neural Transm (Vienna) 2014;121(8):1029– 75. doi: 10.1007/ s00702-014-1193-3.
4. Titulaer MJ, Höftberger R, Iizuka T, et al. Overlapping demyelinating syndromes and anti-N-methyl-D-aspartate receptor encephalitis. Ann Neurol 2014;75(3):411– 28.
5. Lekoubou A, Viaccoz A, Didelot A, et al. Anti-N-metyl-D-aspartate receptor encephalitis with acute disseminated encephalomyelitis-like MRI features. Eur J Neurol 2012;19(2):e16– 7. doi: 10.1111/ j.1468-1331.2011.03617.x.
6. Graus F, Titulaer MJ, Balu R, et al. A clinical approach to diagnosis of autoimmune encephalitis. Lancet Neurol 2016;15(4):391– 404. doi: 10.1016/ S1474-4422(15)00401-9.
7. Polman CH, Reingold SC, Banwell B, et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann Neurol 2011;69(2):292– 302. doi: 10.1002/ ana.22366.
8. Wingerchuk DM, Banwell B, Bennett JL, et al; International Panel for NMO Diagnosis. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology 2015;85(2):177– 89. doi: 10.1212/ WNL.0000000000001729.
9. Irani SR, Bera K, Waters P, et al. N-methyl-D-aspartate antibody encephalitis: temporal progression of clinical and paraclinical observations in a predominantly non-paraneoplastic disorder of both sexes. Brain 2010;133(6):1655– 67. doi: 10.1093/ brain/ awq113.
10. Kruer MC, Koch TK, Bourdette DN, et al. NMDA receptor encephalitis mimicking seronegative neuromyelitis optica. Neurology 2010;74(18):1473– 5. doi: 10.1212/ WNL.0b013e3181dc1a7f.
11. Pennington C, Livingstone S, Santosh C, et al. N-methyl D-aspartate receptor antibody encephalitis associated with myelitis. J Neurol Sci 2012;317(1– 2):151– 3. doi: 10.1016/ j.jns.2012.02.034.
12. Fleischmann R, Prüss H, Rosche B, et al. Severe cognitive impairment associated with intrathecal antibodies to the NR1 subunit of the N-methyl-D-aspartate receptor in a patient with multiple sclerosis. JAMA Neurol 2015;72(1):96– 9. doi: 10.1001/ jamaneurol.2014.1817.
13. Ramberger M, Bsteh G, Schanda K, et al. NMDA receptor antibodies: a rare association in inflammatory demyelinating diseases. Neurol Neuroimmunol Neuroinflamm 2015;2(5):e141. doi: 10.1212/ NXI.0000000000000141.
14. Spadaro M, Gerdes LA, Krumbholz M, et al. Autoantibodies to MOG in a distinct subgroup of adult multiple sclerosis. Neurol Neuroimmunol Neuroinflamm 2016;3(5):e257. doi: 10.1212/ NXI.0000000000000257.
15. Kim SH, Kim W, Li XF, et al. Does interferon beta treatment exacerbate neuromyelitis optica spectrum disorder? Mult Scler 2012;18(10):1480– 3.
16. Sørensen PS, Fazekas F, Lee M. Intravenous immunoglobulin G or the treatment of relapsing-remitting multiple sclerosis: a meta-analysis. Eur J Neurol 2002;9(6):557– 63.
17. Titulaer MJ, McCracken L, Gabilondo I, et al. Treatment and prognostic factors for long-term outcome in patients with anti-NMDA receptor encephalitis: an observational cohort study. Lancet Neurol 2013;12(2):157– 65. doi: 10.1016/ S1474-4422(12)70310-1.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2017 Číslo 3
Nejčtenější v tomto čísle
- Myotonická dystrofie – jednota v různosti
- Riziko poškození plodu v důsledku rentgenových výkonů u gravidních žen
- Febrilní křeče – méně je někdy více
- Vertebrogenní algický syndrom – medicína založená na důkazech a běžná klinická praxe. Existuje důvod něco změnit?
