Měření atrofie corpus callosum a porovnání s ostatními metodami monitorace roztroušené sklerózy
Measurement of Corpus Callosum and Comparison of MRI Techniques for Monitoring of Multiple Sclerosis
Aim:
To compare contemporary MRI measures for prediction of future clinical disability in multiple sclerosis patients (MS) by analysis of our MRI data (brain atrophy, T2 lesion volume, T1 lesion volume and corpus callosum atrophy).
Methods:
Long-term (seven years) longitudinal MRI data of 178 patients were analyzed in the same protocol: FLAIR and T1WI 3D. Using an originally developed software named ScanViewCZ (developed at our MR unit), lesion load was measured automatically from FLAIR sequence (T2 lesion volume), the brain atrophy, brain parenchymal fraction and T1 lesion volume were assed from T1W 3D sequence. Measurement of corpus callosum atrophy: area of the central slice in sagittal reconstruction of T1 W 3D was determined automatically by the originally developed software. Clinical disability was assessed with Expanded Disability Status Scale (EDSS). Patients were divided into two groups: clinically stable and those with sustained progression over seven years.
Results:
Statistically significant correlation of future sustained disability progression (as characterized by EDSS score) was found in association with brain atrophy and corpus callosum atrophy. Correlation with lesion load was low. Using the corpus callosum MRI, clinically stable patients were statistically significantly (p = 0.0024) different from patients with sustained progression as soon as within the first year.
Conclusions:
This retrospective study shows that monitoring of the corpus callosum atrophy is the most useful for stratification of patients into “stable” and “sustained progression” groups.
Key words:
multiple sclerosis – magnetic resonance imaging – corpus callosum – monitoring
Autoři:
M. Vaněčková 1; J. Krásenský 1; D. Horáková 2; M. Mašek 1; A. Burgetová 1; E. Havrdová 2; Z. Seidl 1
Působiště autorů:
1. LF UK a VFN v Praze
Oddělení MR, Radiodiagnostická klinika
1; 1. LF UK a VFN v Praze
Neurologická klinika a Centrum klinických neurověd
2
Vyšlo v časopise:
Cesk Slov Neurol N 2012; 75/108(6): 742-747
Kategorie:
Krátké sdělení
Souhrn
Cíl:
Hledání nejvhodnějšího MR markeru na odlišení pacientů s roztroušenou sklerózou (RS), u kterých v budoucnu dojde k zhoršení klinického stavu (sustained progression), od pacientů dlouhodobě stabilních.
Soubor a metodika:
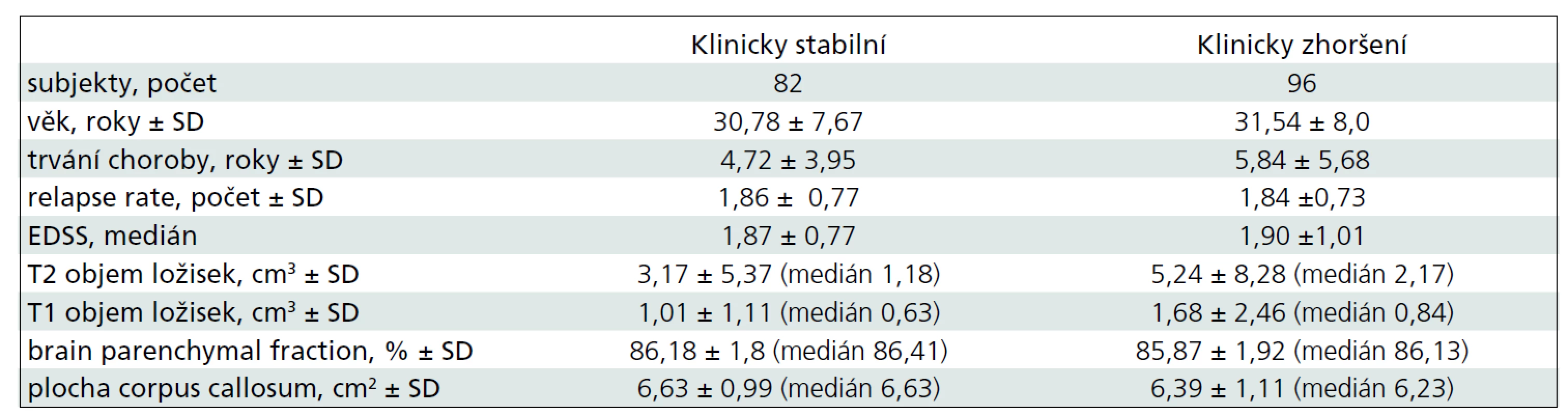
Dlouhodobé sledování (sedm let) 178 pacientů s RS. Na MR byli vyšetřeni ve stejném MR protokolu (v sekvenci FLAIR a v T1W/3D obraze). Byl zjišťován T2 objem ložisek, T1 objem ložisek, atrofie mozku a měření atrofie corpus callosum. Měření byla prováděna pomocí programu vyvinutého na našem pracovišti (ScanViewCZ). Klinický stav byl určen dle rozšířené stupnice míry klinického postižení (EDSS skóre). Při retrospektivní studii byli pacienti rozděleni do dvou skupin: klinicky stabilní a pacienty, u kterých došlo k trvalému zhoršení klinického stavu (zhoršení bylo přesně definováno – sustained progression). Klinicky stabilních bylo po dobu sledování sedmi let 82 pacientů, 96 pacientů dosáhlo sustained progression.
Výsledky:
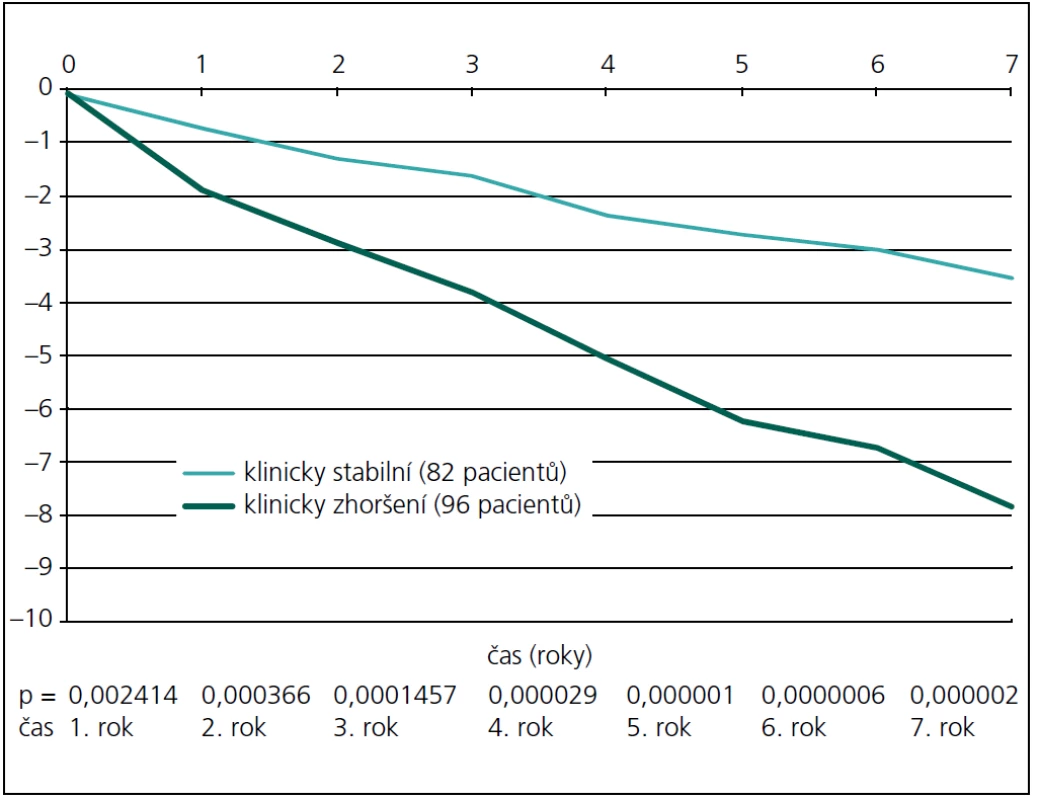
Statisticky signifikantní korelace mezi budoucím klinickým stavem a MR měřením byla nalezena pro měření mozkové atrofie a atrofie corpus callosum. Korelace T2 objemu ložisek i T1 objemu ložisek byla nižší, rozlišení obou skupin dle velikosti objemu ložisek bylo statisticky významné již při vstupním vyšetření, jistota určení skupiny se v průběhu dalšího sledování však jen mírně zvyšovala. Nejrobustněji odlišilo obě skupiny měření atrofie corpus callosum, již v prvním roce se obě skupiny od sebe liší statisticky významně (p = 0,0024).
Závěr:
Tato práce ukazuje, že měření atrofie corpus callosum je z hlediska odlišení pacientů, kteří se v budoucnu zhorší, od těch klinicky stabilních nejpřínosnější, časné rozlišení má velký význam pro určení pacientů, u kterých by mělo dojít k eskalaci léčby.
Klíčová slova:
roztroušená skleróza – magnetická rezonance – corpus callosum – monitorování
Úvod
Roztroušená skleróza (RS) je chronické zánětlivé multifaktoriální onemocnění centrálního nervového systému. Magnetická rezonance (MR) má u tohoto onemocnění dvě hlavní role:
- podpora klinického podezření na RS a vyloučení jiných onemocnění,
- monitorování průběhu onemocnění, resp. léčby a především predikci klinického zhoršení [1].
Právě technikám MR monitoringu a z něj rezultující predikce budoucího klinického zhoršení se v uplynulém desetiletí věnuje maximální pozornost. Vzhledem k vývoji nových léků, které umožňují větší variabilitu v léčbě RS, je v posledních několika letech velký tlak na individuální predikci budoucího klinického stavu na základě objektivních měření na MR [2–4].
Měření objemu ložisek v T2W obraze byla první metodika, která se snažila kvantifikovat jeden z hlavních patofyziologických dějů probíhajících u RS – zánět [3]. Bohužel obraz RS v T2W obraze, resp. FLAIR (FLuid Attenuated Inversion Recovery) je značně variabilní a nespecifický, a proto má tato metodika jen nízký stupeň korelace s klinickým stavem [5]. Další metodou MR monitorování bylo měření mozkové atrofie, která kvantifikuje neurodegenerativní procesy u RS [4]. Zde byl v poslední dekádě velký pokrok v softwarovém zpracování, určuje se Brain Parenchymal Fraction (BPF) nebo procentuální úbytek či objem jen určitých oblastí – frakcionované měření bílé a šedé hmoty [6–9].
Pro monitoring léčby RS se v části mezinárodních studiích již používají některé nekonvenční MR techniky, především vyšetření s magnetizačním transferem [10]. Další nekonvenční MR techniky se stále používají u RS experimentálně: difuzní tenzor, resp. traktografie, funkční MR, relaxometrie [11,12]. Tyto techniky přinášejí nové informace z hlediska patofyziologického procesu probíhajícího u RS. Jejich nevýhodou je však nárůst délky MR protokolu (vyšetření s magnetizačním transferem při tloušťce řezů 3 mm trvá sekvence v průměru přes 15 min), horší reprodukovatelnost, větší variabilita mezi různými typy přístrojů a v neposlední řadě někdy i ne zcela jednoznačná interpretace nálezů. Toto vše je důvod, proč nejsou používány v běžné klinické praxi [1,13].
Na našem pracovišti, kde máme již desetileté zkušenosti s monitoringem pacientů s RS, jsme si kladli otázku, zda by nešel monitoring pacientů ještě více zjednodušit, a tím i přiblížit běžné klinické praxi. Vyjma obvyklého sledování objemu ložisek (objem ložisek v T2W obraze a v T1W obraze) a atrofie jsme hledali marker, jehož měření by bylo ještě méně softwarově náročné a který by dostatečně robustně a rychle předpovídal budoucí klinický stav pacientů. Vzhledem k nálezům histopatologických studií se nám jevil jako vhodný MR marker sledování atrofie corpus callosum [14–17]. Corpus callosum je u RS jedním z míst, kde dochází k výrazné demyelinizaci a axonální ztrátě [18,19].
Soubor a metodika
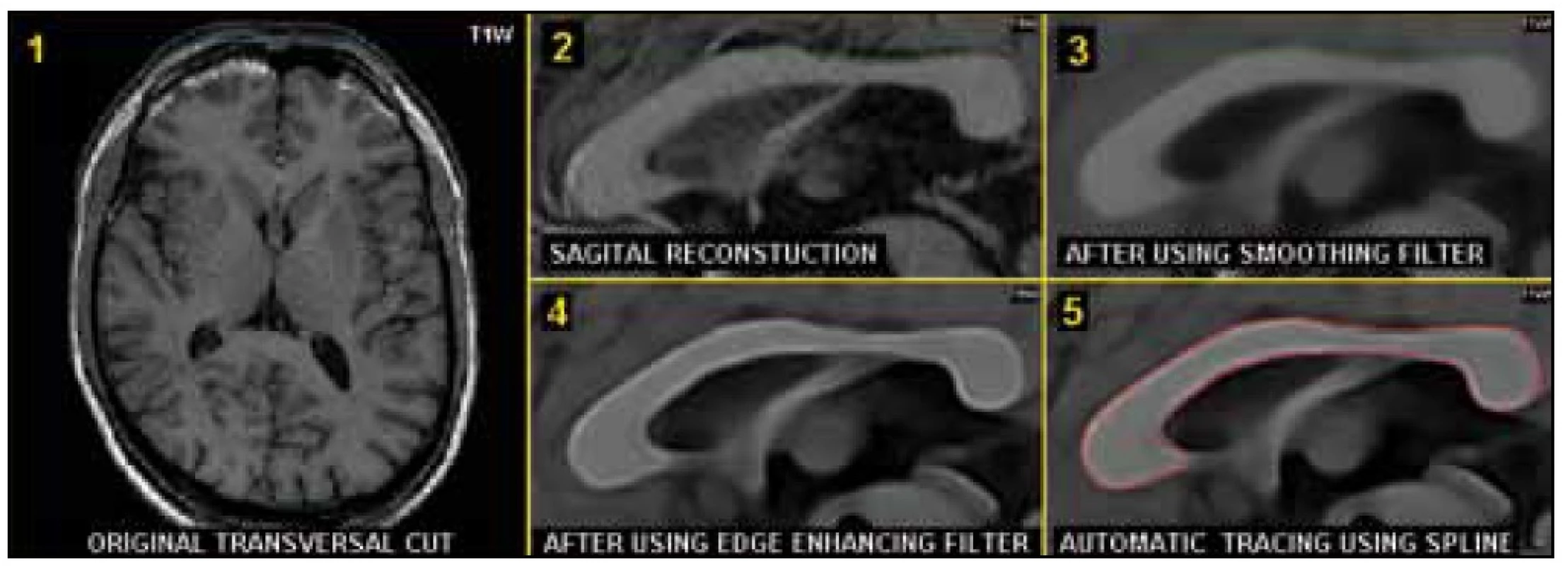
Retrospektivně jsme vyhodnotili MR měření od 178 pacientů, kteří byli dlouhodobě sledováni (sedm let) jak klinicky, tak i monitorováni pomocí MR. Všichni pacienti zařazení do studie splňovali jasně definovaná kritéria (klinicky definitivní RS, potvrzená nálezem na MR, alespoň dva oligoklonální pásy v mozkomíšním moku, věk v intervalu 18–55 let, forma relaps remitentní, EDSS ≤ 3,5, aktivita choroby definována alespoň dva relapsy během 12 měsíců nebo tři relapsy během 24 měsíců těsně před zařazením do studie) [20]. Před vstupem do studie nebyly pacientům podávány léky modifikující průběh choroby (DMD), první kontrola byla před zahájením léčby (MR i EDSS). Průměrný věk pacientů byl 31 let, průměr trvání choroby v době zahájení studie byl pět let (tab. 1). MR měření bylo vyhodnocováno každý rok (1.–7. rok, resp. 2.–7. rok), první dva roky mělo 117 pacientů MR každých osm týdnů, ostatní probandi měli MR každých osm týdnů pouze první rok. Pacienti byli vyšetřováni na přístroji 1,5 T, Philips Gyroscan ve stejném protokolu: v transverzální rovině řezu v sekvenci FLAIR s tloušťkou řezů (THK) 1,5/0 mm a T1W/3D obraze, THK 1,0/0 mm [12,19]. Objem hypersignálních ložisek v sekvenci FLAIR (resp. T2 objem ložisek), objem ložisek v T1W/3D obraze (T1 objem ložisek), atrofie mozku (BPF a procentuální změna mozkové tkáně) byly měřeny pomocí programu vyvinutém na našem pracovišti (ScanViewCZ) [19,21]. Pro stanovení objemu bílé a šedé hmoty bylo nejprve provedeno předzpracování programem ScanViewCZ (vyrovnání do standardní pozice a homogenizace signálu), poté byla vlastní separace pomocí programu SIENAX [22]. Při měření atrofie corpus callosum byla nejprve provedena z transverzálních řezů (T1W/3D) sagitální rekonstrukce, po té byla určována plocha corpus callosum na přesně středovém sagitálním řezu. V prvním kroku byl aplikován 3D filtr, který zvýraznil okraje corpus callosum. Na takto vyfiltrovaných obrazech byla jako obtahová křivka použita Coonsova kubika (uzavřená hladká křivka mající v každém bodě spojitou druhou derivaci). Na vyfiltrovaném obraze byl automaticky stanoven bod na okraji corpus callosum, kde byl maximální gradient. Tato Coonsova kubika byla po té automaticky přimknuta k bodům okraje corpus callosum tak, aby součet čtverců kolmých vzdáleností od bodu obtahové křivky k bodům maximálního grandientu byl minimální (obr. 1). Chyba měření (rescan) byla 0,2–0,3 %.
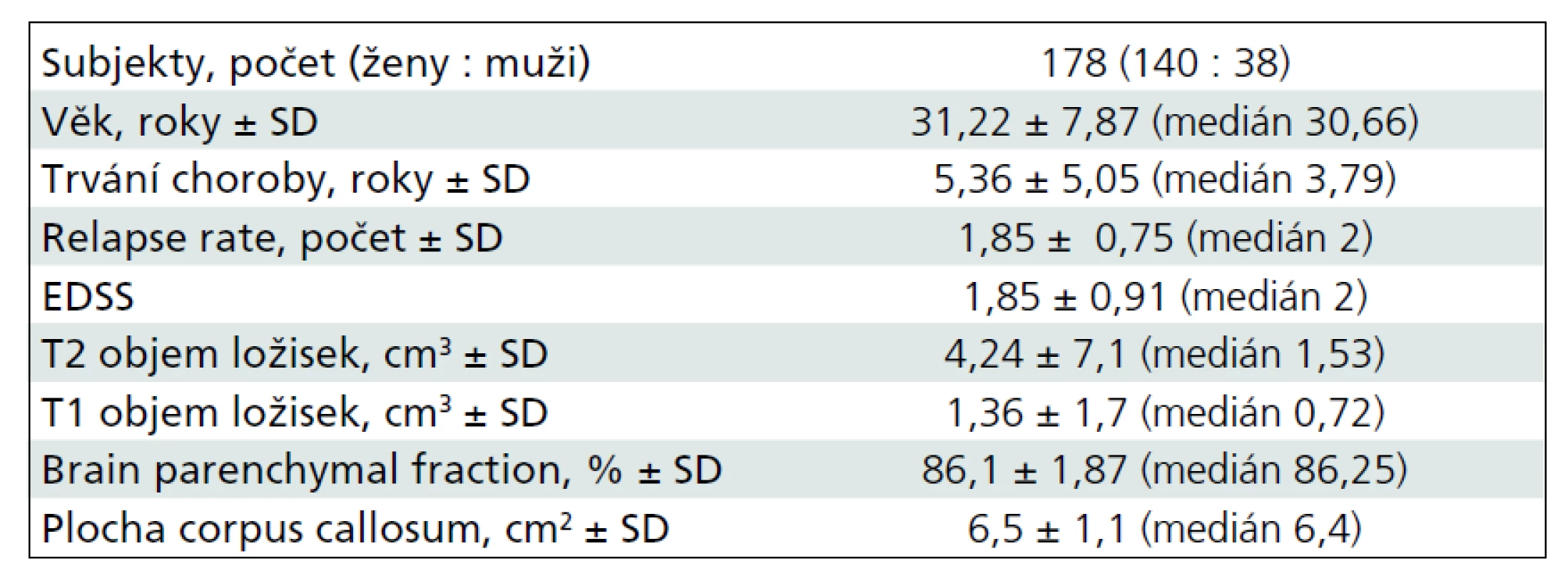
Vstupní průměrná hodnota T2 objemu ložisek byla 4,2 cm3, T1 objemu ložisek 1,4 cm3, BPF 86 %, plocha středního řezu corpus callosum 6,5 cm2 (tab. 1).
Klinický stav byl hodnocen pomocí rozšířené stupnice míry klinického postižení – Expanded Disability Status Scale (EDSS skóre). Při retrospektivní studii byli pacienti rozděleni do dvou skupin na pacienty klinicky stabilní a pacienty, u kterých došlo k přesně definovanému zhoršení klinického stavu (sustained progression – zhoršení klinického stavu dle EDSS o jeden bod v délce trvání alespoň šest měsíců). Klinicky stabilních bylo po dobu sledování sedmi let 82 pacientů, 96 pacientů dosáhlo sustained progression (tab. 2). Obě skupiny jsou porovnatelné, co se týče velikosti skupin, trvání choroby a hodnoty vstupního EDSS (tab. 2). Při statistickém zpracování byla použita popisná statistika. Na testování hypotézy, zda lze podle výsledků MR měření odlišit obě výše uvedené skupiny pacientů, byl použit dvouvýběrový t-test.
Výsledky
Byla nalezena statisticky signifikantní korelace budoucího klinického zhoršení (charakterizované EDSS skórem) a změny monitorovacího MR parametru pro atrofii mozku a atrofii corpus callosum.
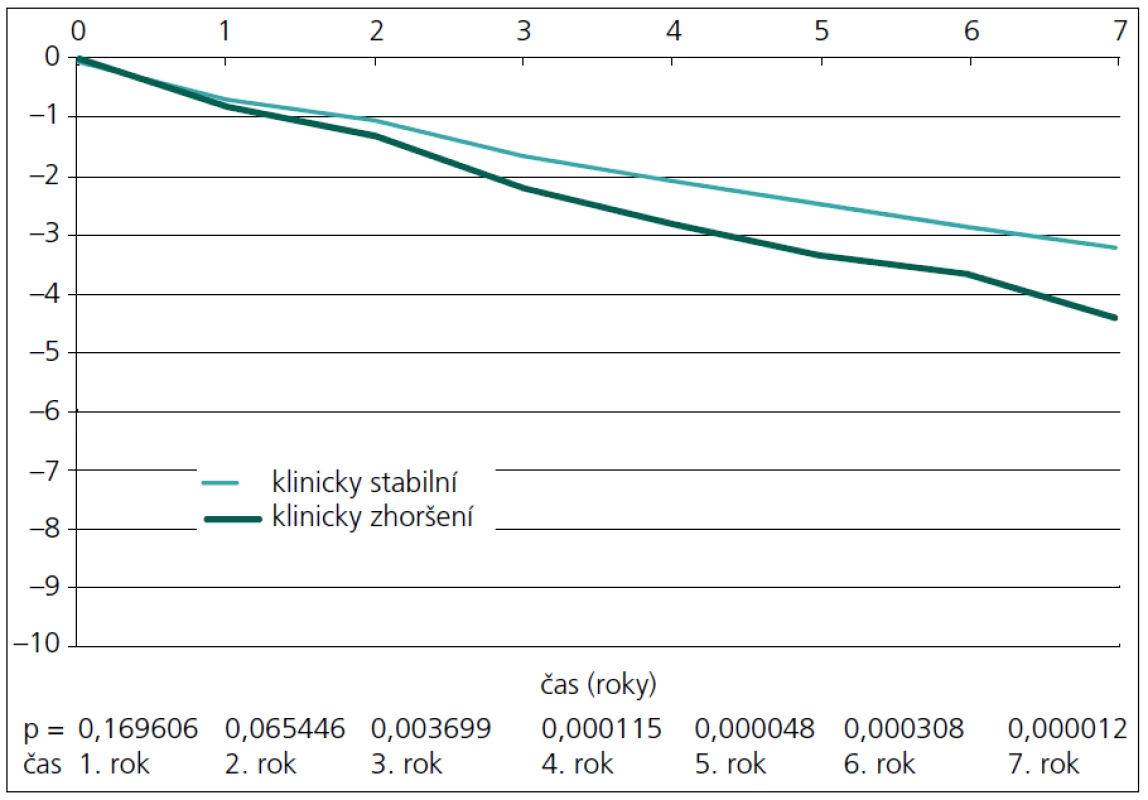
Na obr. 2 je patrné, že již v prvním roce jsou obě skupiny odlišitelné podle atrofie corpus callosum (p = 0,0024). Vzhledem k zjištění, že podle atrofie corpus callosum lze obě skupiny pacientů rozlišit již od prvního roku, byla provedena dodatečná analýza, kde byla užita všechna MR vyšetření (byla prováděna každých osm týdnů). Data byla poté interpolována a vyhlazena pomocí časového filtru s kernelem sedm měsíců. Z této detailní analýzy je patrné, že již od 5. měsíce jsou obě skupiny významně odlišné (obr. 3).
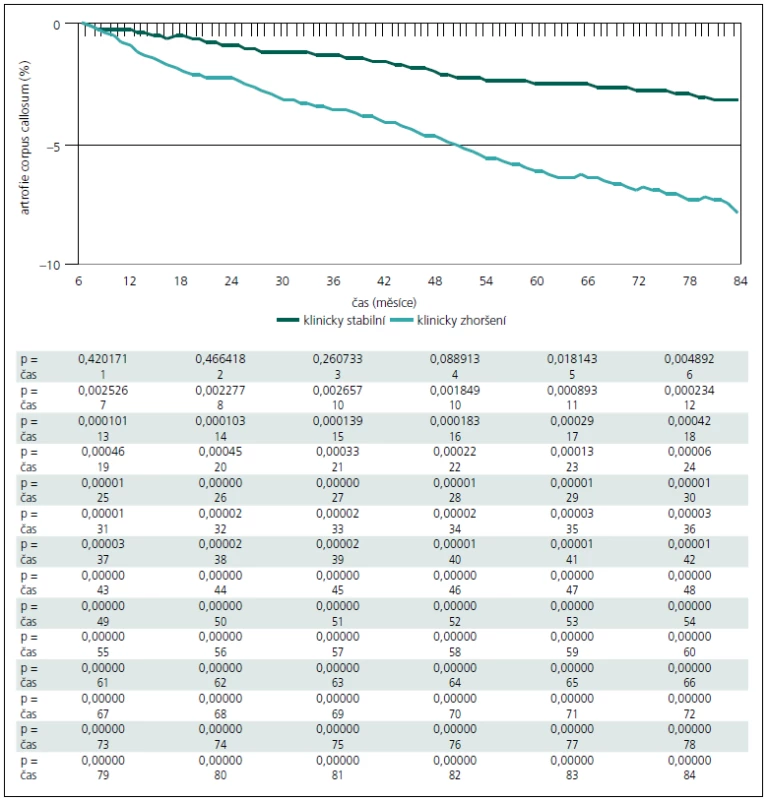
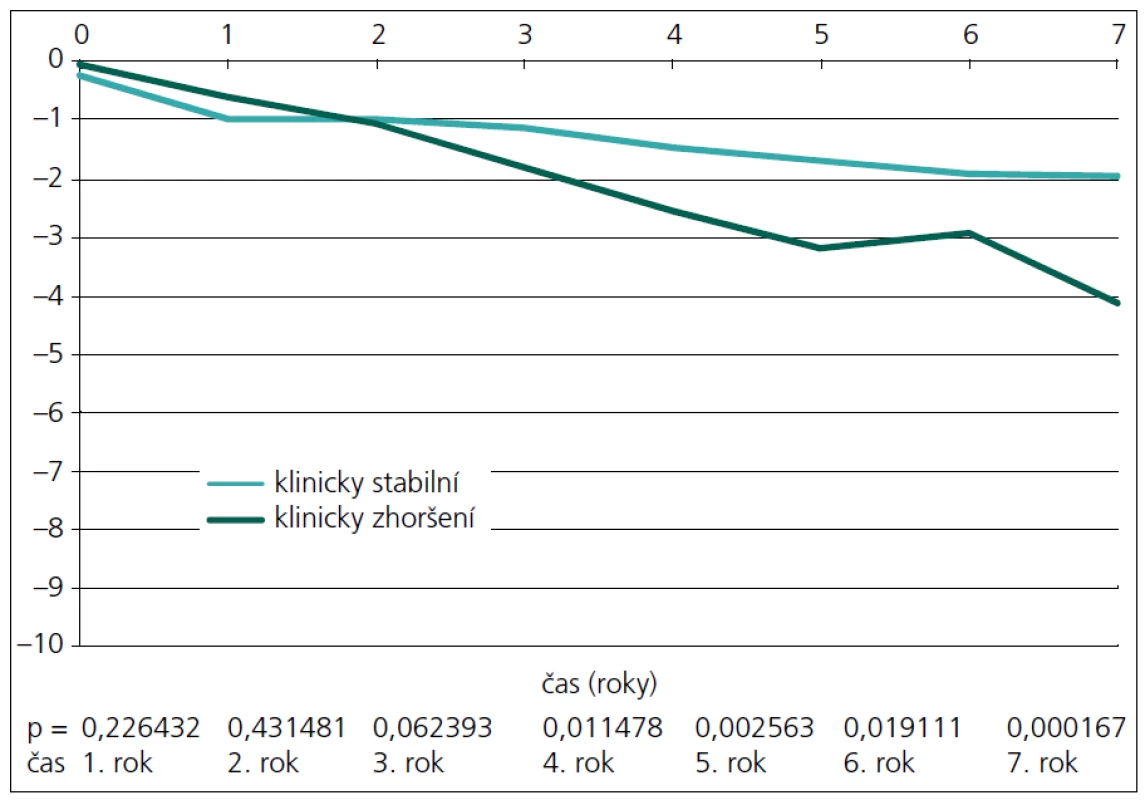
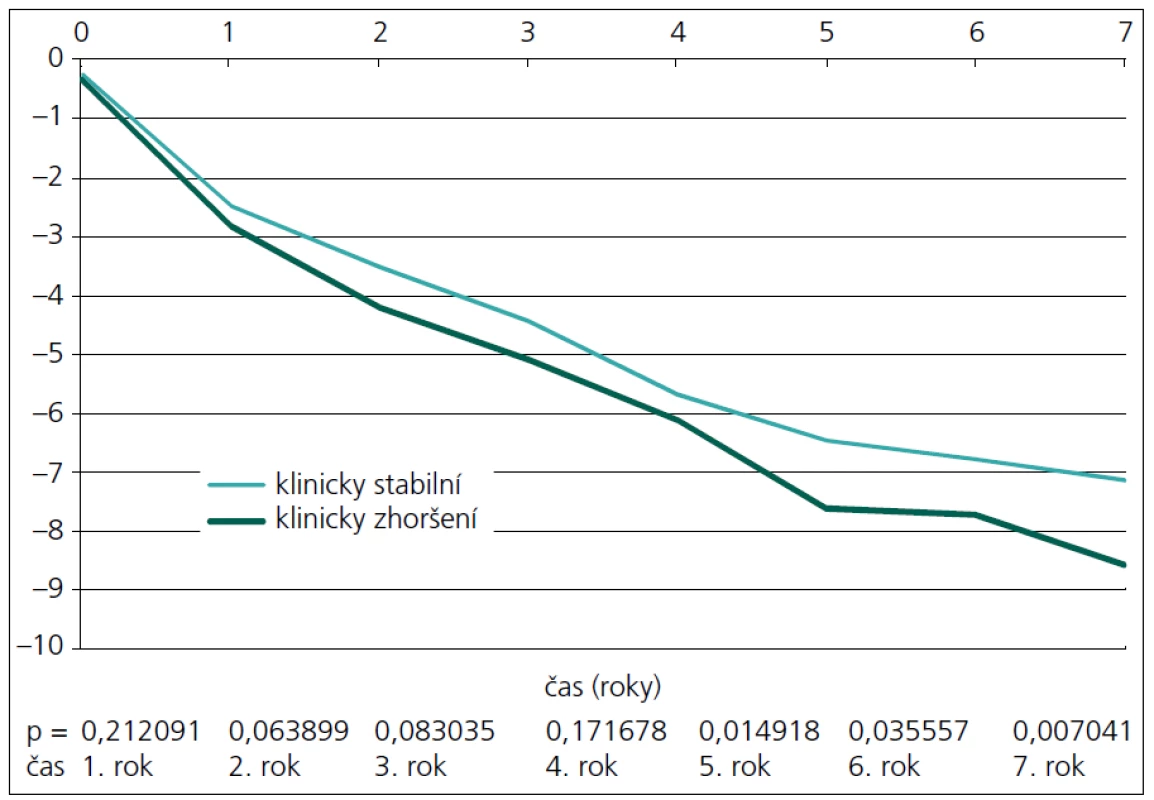
Při měření celkové atrofie se tyto dvě skupiny liší statisticky významně (p = 0,0037) až od 3. roku (obr. 4). Když se provede separace bílé a šedé hmoty, lze obě skupiny odlišit dle atrofie bílé hmoty od 4. roku (obr. 5), u atrofie šedé hmoty ještě o rok později až od 5. roku (obr. 6).
Dle velikosti objemu ložisek (T2 objem ložisek i T1 objem ložisek) byly obě skupiny odlišitelné již při první kontrole, jistota odlišení se však v průběhu dalšího sledování jen mírně zvyšovala.
Diskuze
Pro klinického lékaře je důležité vytipovat pacienty, kteří se v budoucnu zhorší, u nichž je třeba eskalovat léčbu, a odlišit je od těch, kteří budou klinicky stabilní. Roztroušená skleróza je značně heterogenní onemocnění, co se týče variability klinického nálezu i nálezu na MR. Nález na MR předchází klinickému zhoršení. Naším cílem bylo zhodnotit MR kvantitativní metodiky a určit, jak rychle a jak robustně lze od sebe tyto dvě skupiny odlišit. Jejich odlišení by mohlo být prvním krokem pro zařazení pacientů k určitému léčebnému schématu. Vzhledem k tomu, že nemoc je nejlépe ovlivnitelná na začátku, je nutné klást důraz na velmi rychlé rozlišení těchto skupin [1,2].
V této práci jsme kromě obvykle používaných metod MR monitorování (T2 objem ložisek, BPF, atrofie šedé a bílé hmoty a T1 objem ložisek) použili i novou kvantitativní MR techniku a tou je měření atrofie corpus callosum. Navázali jsme na práci Yaldizliho et al, kteří popsali měření indexu corpus callosum, jenž je jednoduchým markerem mozkové atrofie. V jejich práci se používal jen rozměr, zde je však měřena plocha středového řezu corpus callosum, což je metodika přesnější s menší variabilitou [18].
Dali jsme si otázku, zda by některá struktura mozku mohla být lepším prediktivním markerem než měření celkové atrofie, která byla dosud považována za nejrobustnější marker pro předpověď budoucího klinického stavu. Dále jsme se snažili vybrat strukturu, jejíž měření by bylo jednodušší než softwarové zpracování při měření celkové atrofie mozku či separované bílé a šedé hmoty. Tato studie ukazuje, že právě měření corpus callosum by mohlo být tím jednoduchým sledovacím markerem.
Práce Sampata et al ukázala, že corpus callosum je struktura důležitá z hlediska vývoje RS, resp. měření regionálních oblastí bílé hmoty (corpus callosum a objem prodloužené míchy), je jednoduchým markerem schopným odlišit od sebe jednotlivé subtypy RS [19].
Tato práce ukazuje, že měření atrofie corpus callosum je z hlediska odlišení pacientů, kteří se v budoucnu zhorší od těch klinicky stabilních v porovnání s ostatními MR měřeními nejvýnosnější a také nejrychlejší. Stejně jako Lin et al jsme dospěli k závěru, že toto měření by mohlo být velice časným markerem pro budoucí zhoršení klinického stavu [23]. Jak ukázal náš pilotní projekt dlouhodobého sledování menší skupiny pacientů (39 pacientů po dobu devíti let), atrofie corpus callosum predikuje změny v klinickém stavu v dlouhodobějším horizontu [24]. To si myslíme, že je i důvod, proč u jiných prací zabývajících se touto problematikou byla predikční schopnost corpus callosum nižší, protože doba sledování byla oproti naši práci kratší [18,25]. Předností měření atrofie corpus callosum na rozdíl od ostatních metod je jeho nenáročnost, lze měřit i manuálně, což by umožnilo použití techniky v široké klinické praxi [24].
Limitace této práce je především v použití hodnotící škály (EDSS), pro korelace klinického stavu s atrofií corpus callosum je vhodnější použít jiný test (MSFC, Multiple Sclerosis Functional Composite). Výhodou EDSS skóre je, že se jedná o nejběžněji používaný test v rutinní klinické praxi [26]. Do budoucna bude MSFC zařazen do klinického hodnocení stavu pacienta.
Závěr
Měření atrofie corpus callosum je z hlediska odlišení pacientů, kteří se v budoucnu zhorší, od těch klinicky stabilních v porovnání s ostatními MR měřeními nejpřínosnější (nejrobustnější a i nejrychlejší). Časné odlišení těchto dvou skupin má velký význam pro léčbu, resp. pro eskalaci léčby u pacientů, kterým hrozí trvalé zhoršení klinického stavu.
Práce byla podpořena výzkumnými záměry RVO-VFN64165/2012 a MSM 0021620849, vyšetření na MR bylo podpořeno firmami Schering Plough a Biogen Idec Inc.
doc. MUDr. Manuela Vaněčková, Ph.D.
Oddělení MR Radiodiagnostická klinika
1. LF UK a VFN
Kateřinská 30
128 08 Praha 2
mail: man.van@post.cz
Přijato k recenzi: 8. 12. 2011
Přijato do tisku: 27. 3. 2012
Zdroje
1. Vaněčková M, Seidl Z. Roztroušená skleróza mozkomíšní a magnetická rezonance: současnost a nové trendy. Cesk Slov Neurol N 2008; 71/104(6): 664–672.
2. Ge Y. Multiple sclerosis: the role of MR imaging. AJNR Am J Neuroradiol 2006; 27(6): 1165–1176.
3. Miller DH, Grossman RI, Reingold SC, McFarland HF. The role of magnetic resonance techniques in understanding and managing multiple sclerosis. Brain 1998; 121 (Pt 1): 3–24.
4. Filippi M, Grossman RI. MRI techniques to monitor MS evolution: the present and the future. Neurology 2002; 58(8): 1147–1153.
5. Barkhof F. The clinico-radiological paradox in multiple sclerosis revisited. Curr Opin Neurol 2002; 15(3): 239–245.
6. Horakova D, Dwyer MG, Havrdova E, Cox JL, Dolezal O, Bergsland A et al. Gray matter atrophy and disability progression in patients with early relapsing-remitting multiple sclerosis: a 5-year longitudinal study. J Neurol Sci 2009; 282(1–2): 112–119.
7. Miller DH, Barkhof F, Frank JA, Parker GJ, Thompson AJ. Measurement of atrophy in multiple sclerosis: pathological basis, methodological aspects and clinical relevance. Brain 2002; 125 (Pt 8): 1676–1695.
8. Rudick RA, Fisher E, Lee JC, Simon J, Jacobs L. Use of the brain parenchymal fraction to measure whole brain atrophy in relapsing-remitting MS. Neurology 1999; 53(8): 1698–1704.
9. Smith SM, Zhang Y, Jenkinson M, Chen J, Matthews PM, Federico A et al. Accurate, robust, and automated longitudinal and cross-sectional brain change analysis. Neuroimage 2002; 17(1): 479–489.
10. van den Elskamp IJ, Knol DL, Vrenken H, Karas G, Meijerman A, Filippi M et al. Lesional magnetization transfer ratio: a feasible outcome for remyelinating treatment trials in multiple sclerosis. Mult Scler 2010; 16(6): 660–669.
11. Rovaris M, Gass A, Bammer R, Hickman SJ, Ciccarelli O, Miller DH et al. Diffusion MRI in multiple sclerosis. Neurology 2005; 65(10): 1526–1532.
12. Burgetová A, Seidl Z, Vaněčková M, Krásenský J, Horáková D. Magnetická rezonanční relaxometrie u roztroušené sklerózy – měření T2 relaxačního času v centrální šedé hmotě. Cesk Slov Neurol N 2010; 73/106(1): 26–31.
13. Vaněčková M, Seidl Z, Krásenský J, Horáková D, Havrdová E, Němcová J et al. Naše zkušenosti s MR monitorací pacientů s roztroušenou sklerózou v klinické praxi. Cesk Slov Neurol N 2010; 73/106(4): 716–720.
14. Evangelou N, Konz D, Esiri MM, Smith S, Palace J, Matthews PM. Regional axonal loss in the corpus callosum correlates with cerebral white matter lesion volume and distribution in multiple sclerosis. Brain 2000; 123 (Pt 9): 1845–1849.
15. Gean-Marton AD, Vezina LG, Marton KI, Stimac GK, Peyster RG, Taveras JM et al. Abnormal corpus callosum: a sensitive and specific indicator of multiple sclerosis. Radiology 1991; 180(1): 215–221.
16. Barkhof FJ, Elton M, Lindeboom J, Tas MW, Schmidt WF, Hommes OR et al. Functional correlates of callosal atrophy in relapsing-remitting multiple sclerosis patients. A preliminary MRI study. J Neurol 1998; 245(3): 153–158.
17. Coombs BD, Best A, Brown MS, Miller DE, Corboy J, Baier M et al. Multiple sclerosis pathology in the normal and abnormal appearing white matter of the corpus callosum by diffusion tensor imaging. Mult Scler 2004; 10(4): 392–397.
18. Yaldizli O, Atefy R, Gass A, Sturm D, Glassl S, Tettenborn B et al. Corpus callosum index and long-term disability in multiple sclerosis patients. J Neurol 2010; 257(8): 1256–1264.
19. Sampat MP, Berger AM, Healy BC, Hildenbrand P, Vass J, Meier DS et al. Regional white matter atrophy – based classification of multiple sclerosis in cross--sectional and longitudinal data. AJNR Am J Neuroradiol 2009; 30(9): 1731–1739.
20. Havrdova E, Zivadinov R, Krasensky J, Dwyer MG, Novakova I, Dolezal O et al. Randomized study of interferon beta-1a, low-dose azathioprine, and low--dose corticosteroids in multiple sclerosis. Mult Scler 2009; 15(8): 965–976.
21. Vaněčková M, Seidl Z, Krásenský J, Obenberger J, Havrdová E, Viták T et al. Sledování objemu ložisek u roztroušené sklerózy mozkomíšní (tzv. lesion load) v obraze magnetické rezonance. Cesk Slov Neurol N 2002; 65/98(3): 175–179.
22. Vaneckova M, Seidl Z, Krasensky J, Havrdova E, Horakova D, Dolezal O et al. Patients‘ stratification and correlation of brain magnetic resonance imaging parameters with disability progression in multiple sclerosis. Eur Neurol 2009; 61(5): 278–284.
23. Lin F, Yu C, Liu Y, Li K, Lei H. Diffusion tensor group tractography of the corpus callosum in clinically isolated syndrome. AJNR Am J Neuroradiol 2011; 32(1): 92–98.
24. Vaneckova M, Kalincik T, Krasensky J, Horakova D, Havrdova E, Hrebikova T, Seidl Z. Corpus Callosum Atrophy: a Simple Predictor of Multiple Sclerosis Progression (Longitudinal 9-year Study), Eur Neurol 2012; 68: 23–27.
25. Figueira FF, Santos VS, Figueira GM, Silva AC. Corpus callosum index: a practical method for long--term follow-up in multiple sclerosis. Arq Neuropsiquiatr 2007; 65(4A): 931–935.
26. Ozturk A, Smith SA, Gordon-Lipkin EM, Harrison DM, Shiee N, Pham DL et al. MRI of the corpus callosum in multiple sclerosis: association with disability. Mult Scler 2010; 16(2): 166–177.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2012 Číslo 6
Nejčtenější v tomto čísle
- Epidemie roztroušené sklerózy ve světě?
- Spinální kongres
- Kortikální patologie u roztroušené sklerózy – morfologické, imunopatologické a klinické souvislosti
- Fázový model neurorehabilitace
