Klinický pohled na výpočetní tomografii u akutní ischemie mozku
A Clinical Approach to Computed Tomography in Acute Cerebral Ischemia
Progress in reperfusion methods of treatment of acute cerebral ischemia has been reflected in the growing importance of imaging methods in the selection of patients profiting from the treatment. Unenhanced computed tomography brain imaging without the administration of the contrast substance is a standard examination procedure today in patients with cerebrovascular accident. Progress in computed tomography in recent years has allowed for its use for relatively thorough examination of the cerebral venous bed and of perfusion comparable with other imaging methods. The article provides basic theoretical and practical information important for correct interpretation of the results of such examination. With the knowledge of the potential and limits of the method, multimodal computed tomography can become a valuable tool and assistance to the clinician and a method of choice for patients with acute cerebrovascular accident thanks to its availability, safety and simplicity of performance.
Key words:
acute cerebral ischemia – computed tomography – brain perfusion – perfusion computed tomography – computed tomography angiography
Authors:
V. Rohan 1; P. Ševčík 1; J. Polívka 1; Z. Ambler 1; B. Kreuzberg 2; J. Ferda 2
Authors‘ workplace:
Neurologická klinika LF UK a FN Plzeň
1; Radiodiagnostická klinika LF UK a FN Plzeň
2
Published in:
Cesk Slov Neurol N 2007; 70/103(6): 643-652
Category:
Review Article
Práce podpořena VZ MŠM 00 21620816.
Overview
S rozvojem reperfuzních metod léčby akutní ischemie mozku stoupá význam zobrazovacích metod při výběru pacientů profitujících z této léčby. Zobrazení mozku výpočetní tomografií bez podání kontrastní látky je dnes standardním vyšetřením pacientů s cévní mozkovou příhodou. Zdokonalení výpočetní tomografie v posledních letech umožnilo její využití k poměrně dokonalému vyšetření mozkového cévního řečiště i perfuze srovnatelné s ostatními zobrazovacími metodami. V článku přinášíme základní teoretické i praktické informace důležité pro správnou interpretaci výsledků tohoto vyšetření. Multimodální výpočetní tomografie se při znalosti možností a limitů metody může stát klinikovi cenným pomocníkem a pro svoji stále se zvyšující dostupnost, bezpečnost a jednoduchost provedení metodou volby u pacienta s akutní cévní mozkovou příhodou.
Klíčová slova:
akutní ischemie mozku – výpočetní tomografie – mozková perfuze – perfuzní výpočetní tomografie – výpočetní tomografická angiografie
Úvod
Cévní mozkové příhody (CMP) jsou ve vyspělých zemích po kardiovaskulárních a nádorových onemocněních třetí nejčastější příčinou smrti [1] a nejčastější příčinou invalidity obyvatelstva ve věku nad 60 let. Mají proto značný osobní i společenský dopad. Ischemické CMP tvoří 80-85 % všech cévních mozkových příhod, jejich roční incidence v ČR je přibližně 250 případů na 100 000 obyvatel [2].
Rozvoj poznatků o patofyziologii ischemického iktu, zejména poznání, že část mozku vystavená akutní ischemii, ischemická penumbra [3], se může ušetřit, změnilo původní klinický nihilizmus ke hledání nových terapeutických možností. Zavedení trombolytické terapie v akutním stadiu [4,5,6] je nesporným přínosem. Dosud uznávaná indikační kriteria jsou však s ohledem na časový interval poněkud restriktivní, na druhé straně nedokáží zcela eliminovat výskyt intracerebrálních krvácení při reperfuzi příliš pokročilého ischemického ložiska. Proto je snaha o zpřesnění časné diagnostiky iktu s důrazem na získání dat prakticky využitelných pro léčbu.
Informace o aktuálním stavu mozkové perfuze lze získat celou škálou grafických metod: výpočetní tomografie (CT), magnetické rezonance (MR) [7], xenonová CT (XeCT), jednofotonová emisní počítačové tomografie (SPECT), pozitronové emisní tomografie (PET), sonografie nebo jejich kombinacemi.
Při kontaktu s pacientem s pravděpodobnou diagnózou ischemické CMP máme před sebou tyto základní otázky, jejichž správné zodpovězení značně přispěje ke správnému zvolení adekvátní léčby:
- Jedná se opravdu o ischemickou CMP?
- Jaká je lokalizace a velikost ischemického ložiska?
- Jaký je aktuální rozsah infarktových změn s ohledem na potencionálně životaschopnou tkáň?
- Jaká je příčina ischemie, je přítomen cévní uzávěr nebo jde o hemodynamický iktus?
V akutním stadiu iktu má na získání těchto informací klinik a hlavně pacient značně omezený časový prostor, a proto je třeba zvolit metodu dostupnou místně i časově, kterou lze provést i u pacienta omezeně kooperujícího, mnohdy s velmi kusými anamnestickými údaji.U pacienta s akutně vzniklým neurologickým deficitem centrálního původu patří nativní CT mozku v našich podmínkách již ke standardnímu vyšetření [8] pro svoji velmi dobrou dostupnost, rychlost, minimalizující vznik pohybových artefaktů u omezeně spolupracujících pacientů, suverénní odlišení intrakraniálního krvácení a v neposlední řadě nízkou cenu.
Proto byla na jeho základě stanovena kriteria pro podání trombolytické terapie do 3 hodin od počátku příznaků ischemického iktu (nepřítomnost krvácení nebo hypodenzity větší než 1/3 povodí a. cerebri media). I s těmito omezeními a dodržením všech kontraindikací podání trombolytické terapie [4,5] má tato léčba značné riziko krvácivých komplikací [9]. Proto je nastolen požadavek na přesnější výběr pacientů profitujících z této léčby, případně i nad rámec současně daného 3hodinového časového intervalu.
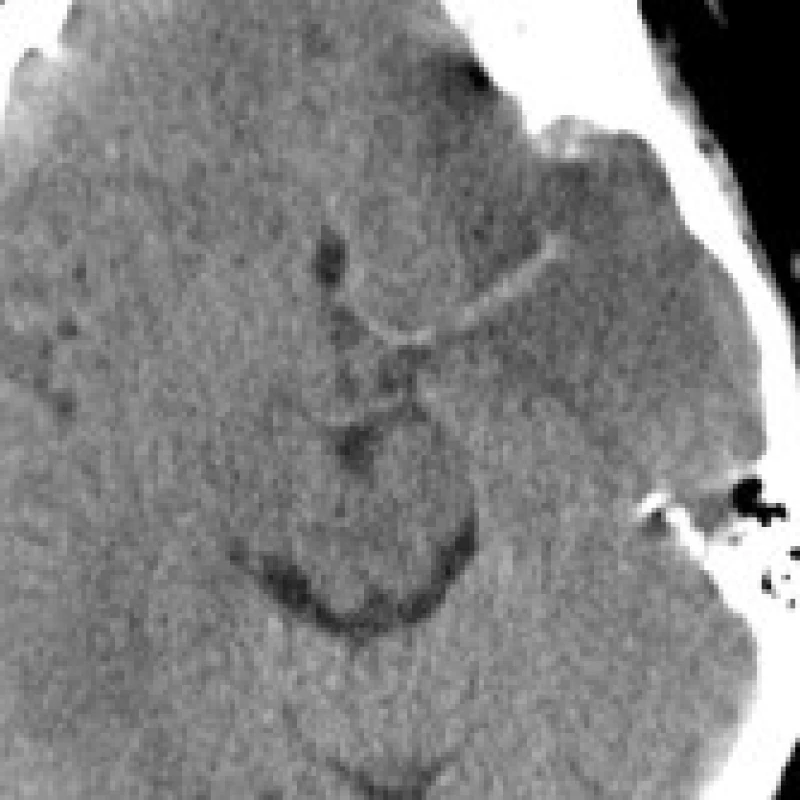
Nativní CT mozku
Samotné nativní CT vyšetření téměř s jistotou vyloučí intracerebrální krvácení. Oproti tomu senzitivita pro akutní ischemii mozku v prvních 6 hodinách zůstává kolem 75 % ve srovnání s difuzně váženým MR zobrazením (DWI) [10,11,12,13,14]. Tato hodnota může být vylepšena při znalosti anamnézy a objektivního neurologického nálezu [14]. Mezi známky akutní ischemie mozku v CT obraze patří hypodenzita, setření rozlišení šedé a bílé hmoty kortikálních a subkortikálních struktur, zúžení sulků a vyhlazení gyrifikace. Jsou to známky časného cytotoxického edému a ireverzibilního poškození ischemické tkáně [15]. Především hypodenzita v nativním CT zobrazení ischemie do 6 hodin je značně specifická pro nevratné poškození mozku [16], ačkoliv v některých případech, jako přítomnost vasogenního edému, mohou být tyto změny vratné. Dalším nálezem potvrzujícím podezření na ischemické postižení může být hyperdenzní zobrazení kmene nebo velkých větví trombózované mozkové tepny zásobující příslušnou oblast mozku (hyperdensity media sign). Ischemické změny v časných fázích iktu mohou být pouze diskrétní a jejich hodnocení do značné míry subjektivní, záležející na zkušenosti hodnotícího lékaře [17,18]. Určitého zlepšení senzitivity CT vyšetření lze dosáhnout nastavením optimálních parametrů zobrazení (window width, center level) [19].
Ve fázi IV severoamerické studie byl vypracován kvantitativní systém hodnocení časných CT změn (the Alberta Stroke Programme Early CT Score, ASPECTS). Podle této studie rozsah ischemických změn koreloval s vyšší četností intracerebrálních krvácení (ICH) a špatným klinickým stavem po 3 měsících [20]. Podobné závěry byly učiněny i dalšími autory [21,22,23,24,25]. Na druhou stranu, retrospektivní analýzou dat od NINDS skupiny [4] v 3hodinovém časovém okně po očištění od dalších faktorů závislost výskytu symptomatických ICH na výskytu časných ischemických změn nalezena nebyla [26]. Shodně ani ve studii ASK (The Australian Streptokinase Trial) v 4hodinovém časovém okně a studii Proact II (The second Prolyse in Acute Cerebral Thromboembolism Trial ) v 6hodinovém časovém okně tato závislost nebyla nepotvrzena [27,28]. Tyto rozdílné výsledky mohou být dány jednak zanedbáním dalších faktorů jako krevní tlak a tíže neurologického deficitu ve studii ASPECTS, ale i nižší záchytem ischemických změn ve studii NINDS a ASK danou staršími CT přístroji nižší třídy s menší technickou kvalitou a citlivostí zobrazení [29]. Recentní trombolytické studie DIAS (The Desmoteplase in Acute Ischemic Stroke Trial) [30] a DEDAS (Dose Escalation of Desmoteplase for Acute Ischemic Stroke) [31] založené na výběru pacientů pomocí MRI ukázaly další faktory ovlivňující riziko ICH, jako věk, tíže neurologického deficitu, hypertenze, hyperglykémie a hypofibrinogenemie. Uvedené informace ukazují nejednotnost názorů na možnosti nekontrastního CT detekovat akutní ischemické změny a určit riziko ICH při podání trombolytické léčby.
Lze shrnout, že nativní CT mozku pacienta v akutním stadiu CMP slouží především k vyloučení nitrolebního krvácení a pokročilých ischemických změn jako hypodenze více než 1/3 povodí a. cerebri media, které jsou většinou autorů považovány za kontraindikace podání trombolytické terapie do 3 hodin od počátků příhody, ale zůstává samo o sobě pro posouzení rozsahu ischemie postižení nedostatečné. Rozšíření CT protokolu o vyšetření s podáním kontrastní látky se nabízí jako nejjednodušší způsob získání dalších informací o patofyziologii ischemického postižení.
Perfuzní CT vyšetření mozku
Obecné principy
Perfuzní CT (CTP) je ve své podstatě funkční vyšetření mozkové tkáně charakterizující stav mozkové perfuze pomocí několika parametrových map, získaných sériovou akvizicí dat při průchodu bolu kontrastní látky mozkovou tkání. I když tyto dynamické studie byly prováděny již od počátků CT [32], byly omezeny pro technickou náročnost pouze na sledování určité oblasti. Průchod bolu kontrastní látky mozkem trvající několik sekund umožnily kvalitně zachytit až moderní multidetektorové spirální CT přístroje, schopné získat a zpracovat velké množství dat v tomto krátkém časovém úseku. Během CTP vyšetření se po rychlé aplikaci bolu 40 ml kontrastní látky (dávkovačem cca 4-7 ml/s do periferní žíly kanylou průměru alespoň 18 G (1,2 mm)) provádí sériová akvizice dat vrstvy mozkové tkáně s odstupem 0,75-1,0 s po dobu 40-60 s postačující k zachycení prvního průchodu kontrastní látky celým mozkovým řečištěm, i s ohledem na individuální srdeční výdej a opožděný průtok leptomeningeálními anastomózami. Přesné rozsahy vyšetření a parametry snímání se liší podle jednotlivých přístrojů, moderní 64-detektorové CT přístroje poskytují pokrytí až 4 cm (čtyři 10 mm nebo osm 5 mm paralelních řezů) mozkové tkáně na jeden bolus. Výběr těchto řezů je dán očekávanou patologií a nutností ortogonálního zachycení velké mozkové tepny pro správné nastavení vstupních parametrů pro výpočet perfuzních map.
Srovnání CT a MR perfuzního zobrazení (MR-PWI – perfusion-weighted imaging)
I když se CTP i MR-PWI snaží zhodnotit složitost hemodynamiky na kapilární úrovni, jsou mezi těmito technikami nezanedbatelné rozdíly. MR-PWI DSC (dynamic susceptibility contrast) technika je založena na nepřímém T2* efektu indukovaném v okolní tkáni vysokou koncentrací intravaskulárního gadolinia. Podstatou CTP je přímá vizualizace kontrastního materiálu. Lineární vztah mezi koncentrací kontrastní látky a CT atenuací lépe umožňuje kvantifikaci mozkové perfuze, což u MR-PWI není možné. MR-PWI je náchylnější na kontaminaci velkými cévními strukturami a je omezeno v některých oblastech efektem magnetické susceptibility okolních struktur. Tyto faktory se mohou podílet na lepším vizuálním zhodnocení jádra a penumbry ischemie při CTP než MR perfuzi [33].
Nepominutelnou výhodou CT je praktická dostupnost a jednoduchost vyšetření, zvláště pokud jde o nespolupracující nebo kriticky nemocné pacienty vyžadující monitorování, případně podporu vitálních funkcí. CT je také volba pro pacienty s absolutní kontraindikací MR vyšetření, např. implantovaný kardiostimulátor, nebo ty, u kterých toto nelze vyloučit.
Hlavní nevýhodou současné CTP techniky je omezený rozsah vyšetření, to je však závislé hlavně na dostupné CT technologii. CTP vyšetření vyžaduje ionizující záření a jodovou kontrastní látku. Bezpečnost se neliší od standardního kontrastního CT vyšetření mozku a je v literatuře rozsáhle diskutována [34]. Protokol CTP je z tohoto hlediska optimalizován k dosažení maximálního rozlišení při minimu radiační dávky při nižší použité voltáži.
Neionická jodová kontrastní látka se ukázala jako bezpečná z hlediska poškození mozku i v případě mozkové ischemie [35,36,37]. K samotnému CTP vyšetření je podle současných protokolů potřeba 40 ml jodové kontrastní látky. Dalších 60-100 ml aplikovaných při CT angiografii (CTA) představuje celkové množství, které u starých, většinou aktuálně ještě dehydratovaných pacientů nelze pominout z hlediska možného rozvoje kontrastem navozené nefropatie [38]. Adekvátní hydratace, případně použití isoosmolární neionické kontrastní látky toto riziko minimalizuje. Počítačové zpracování zdrojových CTP a CTA řezů je obdobně časově náročné jako u MRA a MR-PWI, a lze tak během několika minut získat kvantitativní perfuzní mapy i kvalitativní 3-D rekonstrukce celého mozkového cévního řečiště.
Perfuzní parametry
Termín mozková perfuze znamená průtok krve mozkem na tkáňové úrovni. Tento průtok může být charakterizován různými parametry, z nichž nejvíce užívané jsou průtok krve mozkem (CBF, cerebral blood flow), objem krve v mozkové tkáni (CBV, cerebral blood volume) a střední čas průchodu krve mozkovou tkání (MTT, mean transit time), jejichž normální hodnoty uvádí tabulka (tab. 1). Porozumění dynamickým vztahům těchto parametrů při poklesu mozkového perfuzního tlaku při akutní CMP je nezbytné pro interpretaci perfuzních map. Definice těchto parametrů jsou následující:
CBV je definován jako celkový objem krve v dané jednotce objemu mozku. Tato definice zahrnuje krev ve tkáni i ve velkých kapacitních cévách jako arterie, arterioly, kapiláry, venuly a vény. Jeho jednotkou je ml/100 g mozkové tkáně. CBV mapa se získá matematickou integrací funkce koncentrace kontrastní látky v čase.
CBF je definován jako objem krve, který proteče daným objemem mozkové tkáně za danou dobu, jednotkou je ml/ 100 g/min.
MTT je definován jako průměrná hodnota času, za který daným objemem tkáně proteče krev z arteriální do žilní části řečiště. Tranzitní čas krve mozkovou tkání je závislý na vzdálenosti mezi arteriálním přítokem a žilním odtokem. Matematická závislost MTT, CBV a CBF je podle principu centrálního objemu dána vztahem MTT = CBV / CBF [39,40,41].
Teorie a modelování
I když jsou perfuzní parametry celkem jasně definovány, jejich kvantifikace může být obtížná. Při CTP vyšetření se využívá sériového snímání změny denzity mozkové tkáně při prvním průchodu (first-pass effect) bolu intravenózně podané jodové kontrastní látky. Vychází se z předpokladu, že kontrastní látka není difuzibilní, při svém průchodu mozkem není ani absorbována, ani metabolizována. Únik kontrastní látky mimo intravaskulární prostor, ke kterému může dojít poruchou hematoencefalické bariery při nádorech nebo zánětech, vyžaduje odlišný, složitější matematický model. Jiné metody vyšetření mozkové perfuze, jako např. XeCT , SPECT, PET využívají model s difuzibilní značenou látkou, který je vzhledem k dosažení ustáleného stavu obecně jednodušší než metody využívající dynamický first-pass effect model užívaný při MR a CT perfuzním zobrazení. Při výpočtech těchto modelů lze použít dvě matematické metody, dekonvoluční, podle modelu centrálního objemu (central volume principle), a non-dekovoluční metodu, využívající maximal slope model.
Non-dekonvoluční metoda je založena na aplikaci Fickova principu na danou zájmovou oblast (ROI, region of interest) mozku v průběhu průchodu bolu kontrastní látky. Podle tohoto principu je změna kontrastního zvýraznění ROI za jednotku času přímo úměrná průtoku danou ROI násobeným rozdílem koncentrace v přívodné tepně a odvodné žíle této oblasti. Matematicky je vztah vyjádřen jako dCt(t)/dt = CBF x [Ca(t) - Cv(t)], kde Ct(t) je koncentrace kontrastní látky ve tkáni v čase (také označována jako TDC, time density curve), Ca(t) je TDC přívodné arterie (také AIF – arterial input function) a Cv(t) je TDC pro drénující žíly (také VOF – venous output function). Model vyžaduje, aby maxima AIF bylo dosaženo před vzestupem VOF, což vyžaduje rychlé podání bolu kontrastní látky a dobrý srdeční výdej pacienta. Klinicky bylo ověřeno, že hodnoty CBF byly jinak systematicky podhodnocovány [42]. V praxi však postačují rychlosti aplikace 5-6ml/s.
CBV, definovaný jako poměr objemu krve v daném objemu tkáně, může být vyjádřen jako maximální enhancement dané tkáně vztažený k maximálnímu enhancementu v čistém cévním objemu. To lze jednoduše určit z maxima TDC dané tkáně a TDC sinus sagitalis sup. (VOF). Výhoda této metody spočívá v tom, že k výpočtu CBV i CBF využívá pouze krátký úsek TDC do prvního maxima a není tudíž zapotřebí gama-variantní úpravy. To činí metodu méně citlivou k pohybovým artefaktům a zároveň výrazně zrychluje matematické zpracování. Na druhou stranu, tato metoda poskytuje pouze relativní údaje, nikoliv přesná kvantitativní data. Současné CTP software, které nepočítají s recirkulační korekcí a dekonvolučním algoritmem jsou závislé na časových parametrech jako TP (time to peak perfusion) a TS (time to start perfusion) místo MTT. TP je definován jako doba vzestupné části TDC dané části tkáně, TS zpoždění počátku vzestupné části TDC tkáně oproti počátku vzestupu AIF.
Dekonvoluční metoda poskytuje jak kvalitativní, tak kvantitativní data o průtoku krve a narozdíl od non-dekonvoluční metody připouští pomalejší aplikaci bolu kontrastu [43]. Tato metoda je matematicky vyjádřena jako Ct(t) = CBF x [Ca(t) R(t)], kde Ct(t) TDC mozkové tkáně, Ca(t) je TDC přívodné arterie, představuje matematický dekonvoluční operátor. R(t), impulse residue function, je definována jako teoretická ideální TDC mozkové tkáně, která by byla získána, pokud by byl bolus kontrastní látky aplikován najednou do přívodné tepny. Trvání plateau funkce R(t) odráží délku času, po který je aplikovaná kontrastní látka v kapilárním řečišti (tj. MTT). Použitím dekonvolučního procesu může být určen jak R(t), tak CBF. Protože je dekonvoluční proces značně citlivý na přítomnost šumu snímků, vyžaduje pro analýzu dat speciální matematické algoritmy, např. Fourierovu transformaci nebo metodu singular value decomposition. Tyto metody se liší svou citlivostí na faktory jako přesná cévní anatomie vyšetřované mozkové tkáně a míra zpoždění a rozložení bolu kontrastní látky mezi TDC přívodné cévy a mozkové tkáně [44]. V současnosti klinický software používá častěji metodu singular value decomposition, která je právě více citlivá k faktorům časové disperze kontrastu než specifické lokální cévní anatomii. Dekonvoluční metoda výpočtu CBF je ověřena a úspěšně užívána pro perfuzní CT i MR zobrazení [45,46].
Zpracování zdrojových CTP snímků
V urgentních případech lze změny perfuze odhadovat okamžitě po snímkování vizuálním hodnocením zdrojových řezů na monitoru CT přístroje, případně na monitoru nemocniční počítačové sítě pomocí některého z grafických systémů (např. Picture Archiving and Communication System - PACS). Sledováním nástupu kontrastu lze zhruba identifikovat oblasti s výrazným prodloužením TTP a snížením CBV. K přesnějšímu zhodnocení jemných změn a kvantifikaci je však zapotřebí počítačová analýza sériově nasnímaných zdrojových snímků. Výpočet kvantitativních perfuzních map obvykle vyžaduje zadání následujících vstupů:
Arteriální oblast (arterial input ROI) – ve středu ortogonálně zachycené velké tepny k výpočtu AIF s maximální vrcholovou hodnotou, většinou a. cerebri media nebo a. cerebri anterior.
Žilní oblast (venous outflow ROI) - ve středu zachyceného žilního splavu, většinou sinus sagitalis sup.
Základní linie (baseline) - plochá část AIF před vzestupem daným přítomností kontrastní látky.
Koncový bod analýzy TDC před opětovným vzestupem daným recirkulací kontrastní látky.
Zadání těchto hodnot je u moderních programů poloautomatické a vyžaduje pouze případnou korekci, stejně jako nastavení ostatních parametrů k dosažení validního výsledku [41].
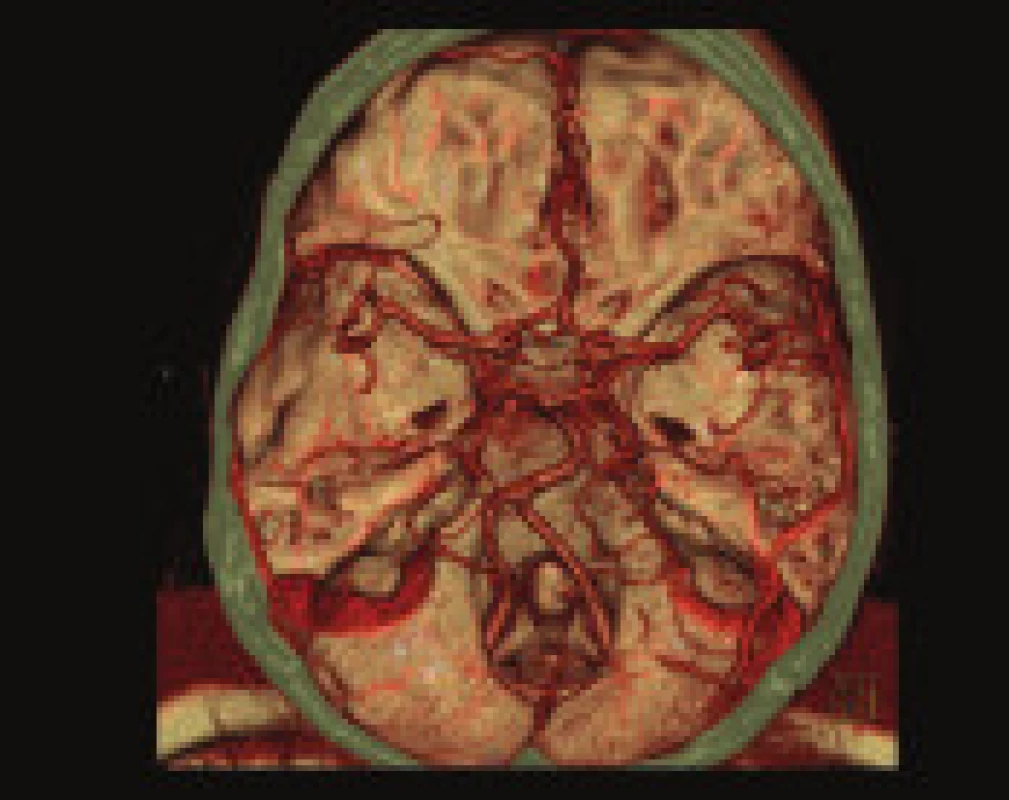
CT angiografie
Podstatou CT angiografie (CTA) je akvizice dat z objemu dané tkáně obsahující intravaskulárně kontrastní látku. V případě CMP se provádí vyšetření od aortálního oblouku po vertex. Primárním cílem CT angiografie u akutní ischemické CMP je přímé zobrazení tepenného uzávěru, zhodnocení cévního řečiště a identifikace případného zdroje embolizace, hlavně při patologii v oblasti karotické bifurkace. CTA má v porovnání s digitální subtrakční angiografií (DSA) jako zlatým standardem výbornou senzitivitu (98,4 %) i specifitu (98,1 %) v detekci intrakraniálních stenóz a okluzí velkých cév [47], odlišení okluze a vlasové stenózy extrakraniální krkavice je o něco horší (95 % a 85 %) [48].
Vzhledem k tomu, že vyšetření CTA využívá snímkování za ustáleného stavu kontrastní látky v arteriálním řečišti, lze zdrojové řezy (CTA-SI – source images) hodnotit také z hlediska CBV. I když CTA-SI poskytují informaci pouze o snížení aktuálního objemu krve, nikoliv o životaschopnosti tkáně, při srovnání s DWI nebyly nalezeny statisticky významné rozdíly v objemu postižené tkáně [49]. Stupeň snížení denzity tkáně se ukázal jako rizikový faktor pro rozvoj hemorhagické transformace po intraarteriální trombolýze [50].
Vyšetření se provádí v návaznosti na nativní CT, případně CTP vyšetření. Bolus neionické jodové kontrastní látky je podán do periferní žíly (preferenčně pravé kubitální žíly) kanylou minimálně 20 G v množství většinou 60 ml rychlostí 4 ml/s po dobu 40 s pokračující aplikací 50 ml fyziologického roztoku stejnou rychlostí k dosažení maximální opacifikace v celém průběhu současné akvizice dat. Získávány jsou 0,6mm řezy od aortálního oblouku po vertex, při použití moderních multidetektorových spirálních přístrojů trvá akvizice dat cca 5 s.
Zpracování zdrojových CTA snímků
Již bezprostředně při snímkování lze při listování CTA-SI identifikovat výpad opacifikace velkých cévních kmenů, případně výpad sycení mozkové tkáně v povodí uzavřené mozkové tepny. Pro podrobnější zhodnocení zvláště v oblasti vinutých cév a periferie je však zapotřebí počítačové zpracování.
Nejrychlejším způsobem je poloautomatická rekonstrukce ve formě MIP (maximal intensity projection), kdy v daném objemu jsou promítnuty do požadované roviny oblasti s maximální intenzitou. I při použití subtrakce kostních struktur toto zobrazení je částečně limitováno v zobrazení kalcifikovaných stenóz a kostních úseků cév. Obdobou MIP s lepším rozlišením kalcifikovaných plátu je rekonstrukce MPR (multiplanar reformat) pracující se střední hodnotou atenuace, ukazující v tenkých řezech lépe reziduální lumen v oblasti kalcifikované stenózy. V případě zobrazení vinutých cév je výhodnější rekonstrukce v rovině kopírující osu cévy, která umožňuje i přesná měření v dané rovině CR, CPR (curved reformat, curved planar reconstruction). Poloautomatická 3D rekonstrukce VRT (volume rendering technique) zobrazující prostorově pouze cévní a kostní struktury slouží k rychlému přehlédnutí celého cévního řečiště a vyhledání patologie, kterou však nutno hodnotit na základě studia zdrojových řezů, případně výše uvedených cílených rekonstrukcí [41].
Klinické využití multimodálního CT
Přínosem multimodálních zobrazovacích vyšetření u akutní ischemické CMP je výběr pacientů profitujících z trombolytické terapie a naopak těch, u kterých je vysoké riziko krvácivých komplikací, prodloužení tříhodinového časového okna pro intravenózní a šestihodinového pro intraarteriální trombolýzu, ověření pokročilosti ischemických změn u iktu bez přesného časového určení, jako ikty vzniklé ve spánku nebo s epileptickým záchvatem v úvodu [50,51,52]. Dosud publikované studie jsou založeny převážně na identifikaci penumbry a jádra infarktu pomocí MRI [30,31].
Na rozdíl od MR-DWI, které detekuje jádro infarktu na základě snížení pohyblivosti vodíkových jader v extracelulárním prostoru při cytotoxickém edému, CTA-SI ukazuje snížení CBV pod hranici minima k zachování integrity mozkové tkáně. Řada studií prokázala, že jak MR-DWI, CBV mapy, tak CTA-SI jsou použitelné pro zobrazení jádra ischemie bez ohledu na případnou úspěšnou rekanalizaci [52,53,54]. Na druhou stranu jiní autoři zjistili, že při časné úplné rekanalizaci, stejně tak jako DWI, ani CTA-SI hypodenzita nemusí zcela odpovídat konečnému infarktu [55,56]. Jedna studie porovnávající velikost finálního infarktu pomocí MR FLAIR (fluid-attenuated inversion recovery) sekvencí ukázala lepší korelaci s časnými CBV mapami než s MR-DWI [57]. Při konstrukci kvantitativních CBV map se pro identifikaci jádra infarktu jako optimální ukázala hodnota 2 ml/100 g mozkové tkáně [58].
K definování penumbry na základě CTP parametrů jsou různé koncepty založené jednak na absolutním CBF prahu [59,60], nebo na základě cerebrální vaskulární autoregulace s kombinací CBF a CBV hodnot [49,53,54,61,62,63,64].
V oblasti ischemické penumbry je průtok krve snížen pod hranici nutnou k udržení funkce, ale dostatečný k alespoň dočasnému zachování integrity mozkové tkáně. Vzhledem k zachování cévní autoregulace dochází k vasodilataci, otevření případných kolaterál, a tím zvýšení objemu krve tekoucí nižší rychlostí. Proto penumbra může být charakterizována kromě snížení CBF zvýšením CVB a prodloužením MTT. Prodloužení průtoku kontrastní látky je nejvýraznějším znakem snížené perfuze. Na druhou stranu, absolutní prodloužení MTT a TP může být dáno i extracerebrálními faktory jako nízký srdeční výdej nebo hypotenze. Regionální prodloužení pak může nastat v případě proximální cévní obstrukce, kde dostatečná perfuze může být zachována prostřednictvím kolaterálního zásobení. Na časových mapách je objem ischemické oblasti největší. Snížení CBF je pro ischemii mozkové tkáně specifičtější ale, vzhledem k tomu, že normální hodnoty CBF v šedé a bílé hmotě se značně liší (tab. 1) a jsou i věkově závislé [65], nejsou absolutní hodnoty CBF pro identifikaci penumbry ideálním parametrem. I když hodnoty MTT se mezi šedou a bílou hmotou liší méně, absolutní hodnota MTT může být značně prodloužena i u reverzibilní ischemie. To vysvětluje, proč prodloužení MTT musí být k identifikaci ohrožené tkáně značné (MTT>7 s, relativní MTT>145 %, ) [58].

Vzhledem k ne zcela dořešeným teoretickým problémům matematického modelování mozkové perfuze a technické problematice získávání zdrojových dat (optimalizace kinetiky kontrastní látky, nastavení technických parametrů přístroje, filtrace šumu, pohybových artefaktů,...) se zatím jeví očekávání přesných kvantitativních hodnot perfuze jako nerealistické. Z praktického pohledu se za současného stavu zdá optimální hodnocení relativních hodnot perfuzních parametrů vzhledem k okolní i kontralaterální mozkové tkáni. Parametrem nejvíce odpovídajícím jádru mozkového infarktu je regionální pokles CBV, zvláště v korelaci s prodloužením časových parametrů (TP, MTT). Ohroženou, potencionálně zachovatelnou tkáň charakterizuje prodloužení MTT případně TP bez výraznějšího poklesu CBV, který může být i zvýšen. CBF je sekundární parametr vypočtený z hodnot CBV a MTT, což dále zvyšuje jeho možnou nepřesnost. Hodnocení samotných CBF map k identifikaci penumbry a jádra ischemie je nevhodné [58,67]. Z hlediska rutinního použití je zajímavá práce australských autorů aplikující hodnocení ASPECTS kromě nekontrastního CT na CTP a CTA-SI u pacientů v 6hodinovém časovém okně. S velikostí finálního infarktu nejlépe koreloval CBV ASPECTS. Ideální kandidát trombolýzy se ukázal pacient s CTA-
SI >6, CBV >6, MTT a CBF < CBV ASPECTS, zvláště při CTA prokázaném cévním uzávěru [68].
Přínos multimodálního CT pro indikaci intravenózní trombolýzy lze shrnout následovně:
- Nekontrastní CT bezpečně odliší krvácivou cévní mozkovou příhodu.
- Riziko hemorhagické transformace se zvyšuje s velikostí časné hypodenzity mozkové tkáně v postiženém cévním teritoriu.
- Jádru ischemie nejlépe odpovídá defekt na CBV mapách. Riziko krvácení po trombolýze se zvyšuje při velikosti defektu CBV >100 ml, případně CBV ASPECTS <7.
- Efekt trombolýzy závisí na rozsahu penumbry, které nejlépe odpovídá oblast s prodloužením MTT ev. TP bez současného výpadu CBV.
- Proximální uzávěr na CTA (a. carotis interna, úsek M1 a. cerebri media) má menší šanci na rekanalizaci, při které má vyšší riziko hemorhagické transformace, zvláště při absenci kolaterálního cévního zásobení (zpětného plnění periferních větví).
- Absence cévního uzávěru na CTA spolu se snížením perfuze v interteritoriálních oblastech ukazuje na hemodynamický iktus, a tedy svědčí proti indikaci trombolýzy.
Závěr
Vyšetření mozkové perfuze u akutní ischemické CMP může přinést významné informace k rozhodnutí o dalším postupu léčby a prognóze nemocného. Samotné nativní CT mozku se z tohoto hlediska i vzhledem k postupně se rozvíjejícím dalším rekanalizačním metodám (intraarteriální trombolýza a trombotrypse, sonotrypse...) stává insuficientní. Rozšíření nativního CT vyšetření o kontrastní vyšetření kombinací CTP a CTA se jeví v současné době jako optimální vzhledem ke stále širší dostupnosti multidetektorových CT přístrojů, jednoduchosti, rychlosti a relativní bezpečnosti provedení i u polymorbidních, omezeně kooperujících nemocných bez nutnosti delší sedace nebo intubace. I když zpracování zdrojových řezů je poněkud časově i personálně náročnější, lze první informace získat okamžitě vizuálním hodnocením zdrojových řezů. Během cca 15 min získáme konečné výsledky, relativně přesně charakterizující stav mozkového cévního řečiště a tkáňové perfuze s ohledem na jádro infarktu a penumbru, srovnatelné s informacemi poskytnutými MR [53]. Tyto informace pak mohou rozhodnout o indikaci trombolytické terapie nad rámec v současné době přijatého tříhodinového časového okna, v případě nálezu prokazatelně nového cévního uzávěru relativizovat časové omezení pro opětovné podání trombolýzy, případně indikovat razantnější endovaskulární způsob léčby. Na druhou stranu, ušetří nemocné s dokonanými, lakunárními nebo border zone infarkty této přece jen potencionálně rizikové terapie.
Přijato k recenzi: 8. 3. 2007
Přijato do tisku: 9. 7. 2007
MUDr. Vladimír Rohan
Neurologická klinika
FN Plzeň
Alej svobody 80
323 00 Plzeň
e-mail: rohan@fnplzen.cz
Sources
1. 1999 World Health Organization. International society of hypertension guidelines for the management of hypertension. Guidelines subcommitee. J Hypertens 1999; 17: 151-183.
2. Cerebrovaskulární sekce České lékařské společnosti JEP. Národní cerebrovaskulární program. Available from: URL: http://www.cmp.cz/ncp.doc
3. Astrup J, Siesjo BK, Simon L. Thresholds in cerebral ischemia: the ischemic penumbra. Stroke 1981; 12: 723-725.
4. The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group. Tissue plasminogen activator for acute ischemic stroke. N Engl J Med 1995; 333: 1581-1587.
5. Furlan A, Higashida R, Wechsler L, Gent M, Rowley H, Kase C et al. Intra-arterial prourokinase for acute ischemic stroke: The PROACT II Study: A randomized controlled trial. JAMA 1999; 282: 2003-2011.
6. Marler JR, Tilley BC, Lu M, Brott TG, Lyden PC, Grotta JC, et al. Early stroke treatment associated with better outcome: the NINDS rt-PA stroke study. Neurology 2000; 55(11): 1649-1655.
7. Kalvach P, Keller J. Variace mozkového průtoku v zobrazovacích metodách. Česk Slov Neurol N 2007; 70/103: 118-128.
8. Mikulík R, Neumann J, Školoudík D, Václavík D. Standard pro diagnostiku a léčbu pacientů s mozkovým infarktem. Česk Slov Neurol N 2006; 69/102: 320-325.
9. Mayer TE, Schulte-Altedorneburg G, Dorste DW, Brückmann H. Serial CT and MRI of ischemic cerebrál infarcts: frequency and clinical impact of haemorrhagic transformation. Neuroradiology 2000; 42: 233-239.
10. Barber PA, Darby DG, Desmond PM, Gerraty RP, Zang O, Li T et al. Identification of major ischemic change. Diffusion-weighted imaging versus computed tomography. Stroke 1999; 30: 2059-2065.
11. Feibach J, Jansen O, Schellinger P, Knauth M, Hartmann M, Heiland S et.al. Comparison of CT with diffusion-weighted MRI in patients with hyperacute stroke. Neuroradiology 2001; 43: 628-632.
12. Jaillard a, Hommel M, Baird AE, Linfante I, Llinas RH, Caplan LR et al. Significance of early CT signs in acute stroke – a CT scan-diffusion MR study. Cerebrovasc Dis 2002; 13: 47-56.
13. Lansberg MG, Albers GW, Beaulieu C, Marks MP. Comparison of diffusion-weighted MRI and CT in acute stroke. Neurology 2000; 54: 1557-1561.
14. Mullins ME, Lev MH, Schellingerhout D, Koroshetz WJ, Gonzalez RG. Influence of availability of clinical history on detection of early stroke using unenhanced CT and diffusion-weighted MR imaging. AJNR Am J Neuroradiol 2002; 179: 223-228.
15. Del Zoppo GJ, von Kummer R, Hamann GF. Ischemic damage of brain microvessels: inherent risks for trombolytic treatment in stroke. J Neurol Neurosurg Psychiatry 1998; 65: 1-9.
16. von Kummer R, Bourquain H, Bastianello S, Bozzao L, Manelfe C, Meier D, et al. Early prediction of irreversible brain damage after ischemic stroke at CT. Radiology 2001; 219: 95-100.
17. Von Kummer R. Effect of training in reading CT scans on patient selection for ECASS II. Neurology 1998; 51: 850–852.
18. Grotta JC, Chiu D, Lu M, Patel S, Levine SR, Tilley BC et al. Agreement and variability in the interpretation of early CT changes in stroke patients qualifying for intravenous rtPA therapy. Stroke 1999; 30: 1528–1533.
19. Lev MH, Farkas J, Gemmete JJ, Hossain ST, Hunter GJ, Koroshetz WJ et al. Acute stroke: improved nonenhanced CT detection: benefits of soft-copy interpretation by using variable window width and center level settings. Radiology 1999; 213: 150–155.
20. Barber PA, Demchuk AM, Zhang J, Buchan AM. Validity and reliability of a quantitative computed tomography score in predicting outcome of hyperacute stroke before thrombolytic therapy. ASPECTS Study Group. Alberta Stroke Programme Early CT Score. Lancet 2000; 355: 1670–1674.
21. Levy DE, Brott TG, Haley EC Jr, Marler JR, Sheppard GL, Barsan W et al. Factors related to intracranial hematoma formation in patients receiving tissue-type plasminogen activator for acute ischemic stroke. Stroke 1994; 25: 291–297.
22. Hacke W, Kaste M, Fieschi C, Toni D, Lesaffre E, von Kummer R et al. Intravenous thrombolysis with recombinant tissue plasminogen activator for acute hemispheric stroke: the European Cooperative Acute Stroke Study (ECASS). JAMA 1995; 274: 1017–1025.
23. Larrue V, von Kummer RR, Muller A, Bluhmki E. Risk factors for severe hemorrhagic transformation in ischemic stroke patients treated with recombinant tissue plasminogen activator: a secondary analysis of the European-Australasian Acute Stroke Study (ECASS II). Stroke 2001; 32: 438–441.
24. Jaillard A, Cornu C, Durieux A, Moulin T, Boutitie F, Lees KR et al. Hemorrhagic transformation in acute ischemic stroke: the MAST-E study. MAST-E Group. Stroke 1999; 30: 1326–1332.
25. Tanne D, Kasner SE, Demchuk AM, Koren-Morag N, Hanson S, Grond M et al. Markers of increased risk of intracerebral hemorrhage after intravenous recombinant tissue plasminogen activator therapy for acute ischemic stroke in clinical practice: the Multicenter rt-PA Stroke Survey. Circulation 2002; 105: 1679–1685.
26. Patel SC, Levine SR, Tilley BC, Grotta JC, Lu M, Frankel M et al. Lack of clinical significance of early ischemic changes on computed tomography in acute stroke. JAMA 2001; 286: 2830–2838.
27. Gilligan A, Markus R, Read S, Srikanth V, Hirano T, Fitt G et al. Baseline blood pressure and not early CT changes predict major hemorrhage after streptokinase in acute ischemic stroke. Stroke 2002; 33: 2236-2242.
28. Roberts HC, Dillon WP, Furlan AJ, Wechsler LR, Rowley HA, Fischbein NJ et al. Computed tomographic findings in patients undergoing intra-arterial thrombolysis for acute ischemic stroke due to middle cerebral artery occlusion: results from the PROACT-II trial. Stroke 2002; 33: 1557–1565.
29. Donnan GA, Davis SM. Neuroimaging, the ischemic penumbra, and selection of patients for acute stroke therapy. Lancet Neurology 2002; 1: 417-425.
30. Hacke W, Albers G, Al-Rawi Y, Bogousslavsky J, Davalos A, Eliasziw M et al. The Desmoteplase in Acute Ischemic Stroke Trial (DIAS): a phase II MRI-based 9-hour window acute stroke thrombolysis trial with intravenous desmoteplase. Stroke 2005; 36: 66–73.
31. Furlan AJ, Eyding D, Albers GW, Al-Rawi Y, Lees KR, Rowley HA et al. Dose Escalation of Desmoteplase for Acute Ischemic Stroke (DEDAS): evidence of safety and efficacy 3–9-hours after stroke onset. Stroke 2006; 37:1227–1231.
32. Traupe H, Heiss WD, Hoeffken W, Zulch KJ. Hyperperfusion and enhancement in dynamic computed tomography of ischemic stroke patients. J Comput Assist Tomogr 1979; 3: 627-632.
33. Coutts SB, Simon JE, Tomanek AI, Barber PA, Chan J, Hudon ME et al. Reliability of assessing percentage of diffusion-perfusion mismatch. Stroke 2003; 34(7): 1681-3.
34. Cohnen M, Wittsack HJ, Assadi S, Muskalla K, Ringelstein A et al. Radiation Exposure of Patients in Comprehensive Computed Tomography of the Head in Acute Stroke. AJNR Am J Neuroradiol 2006; 27: 1741-1745.
35. Kendell B, Pullicono P. Intravascular contrast injection in ischemic lesions, II. Effect on prognosis. Neuroradiology 1980; 19: 241-243.
36. Doerfler A, Engelhorn T, von Kummer R, Weber J, Knauth M, Sartor K et al. Are iodinated contrast agents detrimental in acute cerebral ischemia? An experimental study in rats. Radiology 1998; 206: 211-217.
37. Palomaki H, Muuronen A, Raininko R, Piilonen A, Kaste M. Administration of nonionic iodinated contrast medium does not influence the outcome of patients with ischemic brain infarction. Cerebrovasc Dis 2003; 15(1–2):45-50.
38. Aspelin P, Aubry P, Fransson SG, Strasser R, Willenbrock R, Lundkvist J. Nephrotoxic effects in high-risk patients undergoing angiography. N Engl J Med 2003; 348(6): 491-499.
39. Meier P, Zieler K. On the theory of the indicator dilution method for measurement of blood flow and volume. J Appl Physiol 1954; 6: 731-744.
40. Roberts G, Larson K. The interpretation of mean transit time measurements for multi-phase tissue systems. J Theor Biol 1973; 39:447-75.
41. Ferda J. CT angiografie. 1st ed. Praha: Galén 2004.
42. König M, Klotz E, Heuser L. Cerebral perfusion CT: theoretical aspects, practical implementation and clinical experience in acute ischemic stroke (German). Fortschr Röntgenstr 2000; 172: 210-218.
43. Wintermark M, Maeder P, Thiran JP, Schnyder P, Meuli R. Quantitative assessment of regional cerebral blood flows by perfusion CT studies at low injection rates: a critical review of the underlying theoretical models. Eur Radiol 2001; 11(7): 1220-1230.
44. Wirestam R, Andersson L, Ostergaard L, Bowling M, Aunola JP, Lindgren A et al. Assessment of regional cerebral blood flow by dynamic susceptibility contrast MRI using different deconvolution techniques. Magn Reson Med 2000; 43(5): 691-700.
45. Cenic A, Nabavi DG, Craen RA, Gelb AW, Lee TY. Dynamic CT measurement of cerebral blood flow: a validation study. AJNR Am J Neuroradiol 1999; 20(1): 63-73.
46. Nabavi DG, Cenic A, Craen RA, Gelb AW, Bennett JD, Kozak R et al. CT assessment of cerebral perfusion: experimental validation and initial clinical experience. Radiology 1999; 213(1): 141-149.
47. Lev MH, Farkas J, Rodriguez VR, Schwamm LH, Hunter GJ, Gonzalez RG et al. CT angiography in the rapid triage of patients with hyperacute stroke to intraarterial thrombolysis accuracy in the detection of large vessel thrombus. J Comput Assist Tomogr 2001; 25(4): 520–528.
48. Lev MH, Romero JM, Goodman DNF, Bagga R, Kim HYK, Gonzalez RG. Total occlusion versus hairline residual lumen of the internal carotid arteries accuracy of single section helical CT angiography. AJNR Am J Neuroradiol 2003 24: 1123–1129.
49. Schramm P, Schellinger PD, Klotz E, Maeder P, Thiran JP, Schnyder P et al. Comparison of perfusion computed tomography and computed tomography angiography source images with perfusion-weighted imaging and diffusion-weighted imaging in patients with acute stroke of less than 6 hours’ duration. Stroke 2004; 35: 1652–1658.
50. Schwamm LH, Rosenthal ES, Swap CJ, Rosand J, Rordorf G, Lev HM et al. Hypoattenuation on CT Angiographic Source Images Predicts Risk of Intracerebral Hemorrhage and Outcome after Intra-Arterial Reperfusion Therapy. AJNR Am J Neuroradiol 2005; 26: 1798-1803.
51. Sylaja PN, Dzialowski I, Krol A, Roy J, Federico P, Demchuk AM, and Calgary Stroke Program. Role of CT Angiography in Thrombolysis Decision-Making for Patients With Presumed Seizure at Stroke Onset. Stroke 2006; 37(3): 915-917.
52. Lev MH, Segal AZ, Farkas J, Hossain ST, Putman C, Hunter GJ et al. Utility of perfusion-weighted CT imaging in acute middle cerebral artery stroke treated with intraarterial thrombolysis: prediction of final infarct volume and clinical outcome. Stroke 2001; 32(9): 2021-2028.
53. Schramm P, Schellinger PD, Fiebach JB, Heiland S, Jansen O, Knauth M et al. Comparison of CT and CT angiography source images with diffusion-weighted imaging in patients with acute stroke within 6 hours after onset. Stroke 2002; 33(10): 2426-2432.
54. Wintermark M, Fischbein NJ, Smith WS, Ko NU, Quist M, Dillon WP. Accuracy of dynamic perfusion CT with deconvolution in detecting acute hemispheric stroke. AJNR Am J Neuroradiol 2005; 26(1): 104-112.
55. Kidwell CS, Saver JL, Mattiello J, Starkman S, Vinuela F, Duckwiler G et al. Thrombolytic reversal of acute human cerebral ischemic injury shown by diffusion/perfusion magnetic resonance imaging. Ann Neurol 2000; 47(4): 462-469.
56. Hunter GJ, Silvennoinen HM, Hamberg LM, Koroshetz WJ, Buonanno FS, Schwamm LH et al. Whole-brain CT perfusion measurement of perfused cerebral blood volume in acute ischemic stroke: probability curve for regional infarction. Radiology 2003; 227(3): 725-730.
57. Bisdas S, Donnerstag F, Ahl B, Bohrer I, Weissenborn K, Becker H et al. Comparison of perfusion computed tomography with diffusion-weighted magnetic resonance imaging in hyperacute ischemic stroke. J Comput Assist Tomogr 2004; 28(6): 747-755.
58. Wintermark M, Flanders AE, Velthuis B, Meuli R, van Leeuwen M, Goldsher D et al. Perfusion-CT Assessment of Infarct Core and Penumbra. Stroke 2006; 37: 979-985.
59. Eastwood JD, Lev MH, Wintermark M, Fitzek C, Barboriak DP, Delong DM et al. Correlation of early dynamic CT perfusion imaging with whole-brain MR diffusion and perfusion imaging in acute hemispheric stroke. AJNR Am J Neuroradiol 2003; 24: 1869–1875.
60. Eastwood JD, Lev MH, Azhari T, Lee TY, Barboriak DP, Delong DM et al. CT perfusion scanning with deconvolution analysis: pilot study in patients with acute middle cerebral artery stroke. Radiology 2002; 222: 227–236.
61. Wintermark M, Reichhart M, Cuisenaire O, Maeder P, Thiran JP, Schnyder P et al. Comparison of admission perfusion computed tomography and qualitative diffusion- and perfusion-weighted magnetic resonance imaging in acute stroke patients. Stroke 2002; 33: 2025–2031.
62. Wintermark M, Reichhart M, Thiran JP, Maeder P, Chalaron M, Schnyder P et al. Prognostic accuracy of cerebral blood flow measurement by perfusion computed tomography, at the time of emergency room admission, in acute stroke patients. Ann Neurol 2002; 51: 417–432.
63. Mayer TE, Hamann GF, Baranczyk J, Rosengarten B, Klotz E, Wiesmann M et al. Dynamic CT perfusion imaging of acute stroke. AJNR Am J Neuroradiol 2000; 21: 1441–1449.
64. Reichenbach JR, Rother J, Jonetz-Mentzel L, Rosengarten B, Klotz E, Wiesmann M et al. Acute stroke evaluated by time-to-peak mapping during initial and early follow-up perfusion CT studies. AJNR Am J Neuroradiol 1999; 20: 1842–1850.
65. Schaefer PW, Roccatagliata L, Ledezma C, Hoh B, Schwamm LH, Koroshetz W et al. First-pass quantitative CT perfusion identifies thresholds for salvageable penumbra in acute stroke patients treated with intra-arterial therapy. AJNR Am J Neuroradiol 2006; 27: 20–25.
66. Marchal G, Rioux P, Petit-Taboue MC, Sette G, Travere JM, Le Poec C et al. Regional cerebral oxygen consumption, blood flow, and blood volume in healthy human aging. Arch Neurol 1992; 49: 1013–1020.
67. Murphy BD, Fox AJ, Lee DH, Sahlas DJ, Black SE, Hogan MJ et al. Identification of penumbra and infarct in acute ischemic stroke using computed tomography perfusion-derived blood flow and blood volume measurements. Stroke 2006; 37: 1771–1777.
68. Parsons MW, Pepper EM, Chan V, Siddique S, Rajaratnam S, Bateman GA et al. Perfusion Computed Tomography: Prediction of Final Infarct Extent and Stroke Outcome. Ann Neurol 2005; 58: 672–679.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2007 Issue 6
Most read in this issue
- Obrna lícního nervu
- Poruchy polykání ve vztahu k vertebrogenním dysfunkcím
- Protilátky proti glykokonjugátům v diagnostice autoimunitních neuropatií
- Dercumova choroba (lipomatosis dolorosa) – zriedkavo diagnostikované ochorenie: kazuistika

















