Sulcus temporalis superior a jeho funkční význam
Superior Temporal Sulcus and its Functions
Paper summarizes the current knowledge on superior temporal sulcus (STS) and its role in social cognition, biological movement perception, face perception, speech processing, polymodal integration and detection of rare stimuli. It emphasises its role in social behavior. In conclusion, STS plays role in particular at integrative and associative processing of stimuli, which are potentially behavioraly and socialy relevant.
Key words:
superior temporal sulcus – social behavior – biological movement perception – speech processing – polymodal integration – rare stimuli detection
Authors:
P. Haitová1ihash2ihash4ihash6ihash8 ,2 ,3 ,3 ,2 ,2
Authors‘ workplace:
Výzkumná skupina pro behaviorální a sociální neurovědy, Středoevropský technologický institut (CEITEC), MU, Brno
1; I. neurologická klinika LF MU a FN u sv. Anny v Brně
2; Výzkumná skupina Molekulární a funkční zobrazování, Středoevropský technologický institut (CEITEC), MU, Brno
3
Published in:
Cesk Slov Neurol N 2012; 75/108(2): 154-158
Category:
Review Article
Overview
Práce shrnuje poznatky o sulcus temporalis superior (STS) a jeho roli v sociální kognici, percepci biologického pohybu, percepci tváří, zpracování řeči, polymodální integraci a detekci vzácných podnětů. Zdůrazňuje především jeho roli v sociálním chování. Shrnuje, že STS se podílí zejména na integračním a asociačním zpracování potenciálně behaviorálně a sociálně významných stimulů.
Klíčová slova:
sulcus temporalis superior – sociální chování – percepce biologického pohybu – zpracování řeči – polymodální integrace – detekce vzácných podnětů
Úvod
Sulcus temporalis superior (STS) je brázda, která anatomicky odděluje gyrus temporalis superior a gyrus temporalis medius. Z hlediska cytoarchitektonické Brodmannovy organizace se STS rozkládá na pomezí areí 21 a 22. Podrobnější anatomickou parcelaci STS navrhli Seltzer a Pandya na základě studií s primáty dle aferentace do této oblasti. Podle tohoto členění existují v STS oblasti reagující na podněty jednak unimodální – ať už sluchové (kraniální část STS), zrakové nebo senzorické (kaudální část STS), a jednak multimodální, reagující na různé percepční modality („dno“ brázdy) (obr. 1) [1,2].
![Schéma anatomické parcelace STS, jak ji navrhli Seltzer a Pandya [1].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/4423c04846b918a9040297fd311643db.png)
Dle studií na primátech je dále známo, že STS má anatomické spoje s ventrálním i laterálním prefrontálním kortexem [3], orbitofrontálním kortexem [4], amygdalou [5] a parahipokampální oblastí [6].
Dlouhou dobu se znalosti o STS opíraly pouze o data získaná studiem primátů. O studie zabývající se postižením lidských mozků zahrnujícím STS se nebylo možné opřít.
Jednak proto, že STS není centrem žádné konkrétní, dobře definovatelné funkce, kterou by bylo možno při postižení této struktury pozorovat (na rozdíl např. od primárního motorického kortexu či Brocova řečového centra). Další příčinou je skutečnost, že prakticky nedochází k postižení limitovanému na STS, neboť bývá poškozen v rámci rozsáhlejšího temporálního postižení a kvůli tomu nelze jednoznačně určit, jakou měrou se na následném deficitu podílí. Teprve rozvoj moderních zobrazovacích a elektrofyziologických metod (zejména funkční magnetické rezonance – fMR, dále pozitronové emisní tomografie – PET a evokovaných potenciálů vázaných na událost – ERP) dovolil bližší zkoumání STS i u člověka. Výsledky těchto studií umožňují komplexnější pohled na STS a sdělují nám, že se podílí na mnoha kognitivních funkcích, zdánlivě velmi rozdílných. Bližší zkoumání však prozrazuje, že mají mnoho společných rysů [7].
Sociální chování
Funkce STS se nejčastěji dává do souvislosti se sociálním chováním, zejména s „theory of mind“ („teorií mysli“ nebo „duševních stavů“, přestože pojem „mind“ v tomto významu představuje spíše psychiku než „mysl“). Jedná se o schopnost správně přisoudit sobě i ostatním různé duševní stavy (jako jsou touhy, úmysly a přesvědčení), pochopit, že jsou tyto stavy u různých osob odlišné, a na základě jejich správné interpretace porozumět chování druhých. Testuje se nejčastěji pomocí jednoduchých příběhů nebo komiksů, z jejichž kontextu lze odvodit, co si myslí osoba na obrázku. K jejich správné interpretaci je třeba použít výše uvedené schopnosti (obr. 2). Na těchto procesech se kromě STS (převážně pravostranného v zadní části) podílí zejména orbitofrontální/mediální prefrontální kortex, temporální pól a amygdala [9,10]. Předpokládá se, že jedna z klíčových rolí STS v těchto kognitivních úlohách spočívá v percepci a interpretaci komunikačních signálů, jako je zejména směr pohledu [11], ale například i natočení hlavy a těla nebo gesta jako ukazování prstem [12]. Tyto signály nám sdělují množství sociálně relevantních informací nejen o tom, kam směřuje pozornost sledované osoby, ale i o její náladě a úmyslech.

Abnormalitám v těchto procesech v souvislosti s STS je věnována pozornost zejména v souvislosti s autizmem [13]. Osoby postižené autizmem v testech požadujících použití „theory of mind“ selhávají behaviorálně – nedokážou úkol správně interpretovat [14] – a v souvislosti s tím mají sníženou aktivaci v STS oblasti [15]. V souladu s těmito nálezy je u autistů popisována v STS snížená koncentrace šedé hmoty [16].
Percepce biologického pohybu
Biologickým pohybem zde myslíme pohyb, který provádí člověk nebo jiný savec. Takovýto pohyb vyvolá selektivní aktivitu v STS (opět zejména pravostranného v zadní části), jež není pozorována při sledování pohybu, který provádí například stroj [17,18]. Rozpoznání biologického pohybu patří zřejmě ke starým vývojovým mechanizmům a funguje jako určitý „detektor živého“ [19]. Předpokládá se, že je důležitým signálem pro interpretaci chování ostatních, a to jak na úrovni nesociální (k odhalení možného predátora), tak sociální [20]. K jeho percepci stačí poměrně málo vizuálních informací – ke spolehlivému rozpoznání lokomoce a odpovídající aktivitě v STS dochází i při sledování světlých bodů na černém pozadí, které kopírují pohyby hlavních kloubů kráčející imaginární osoby (obr. 3) [21,22].
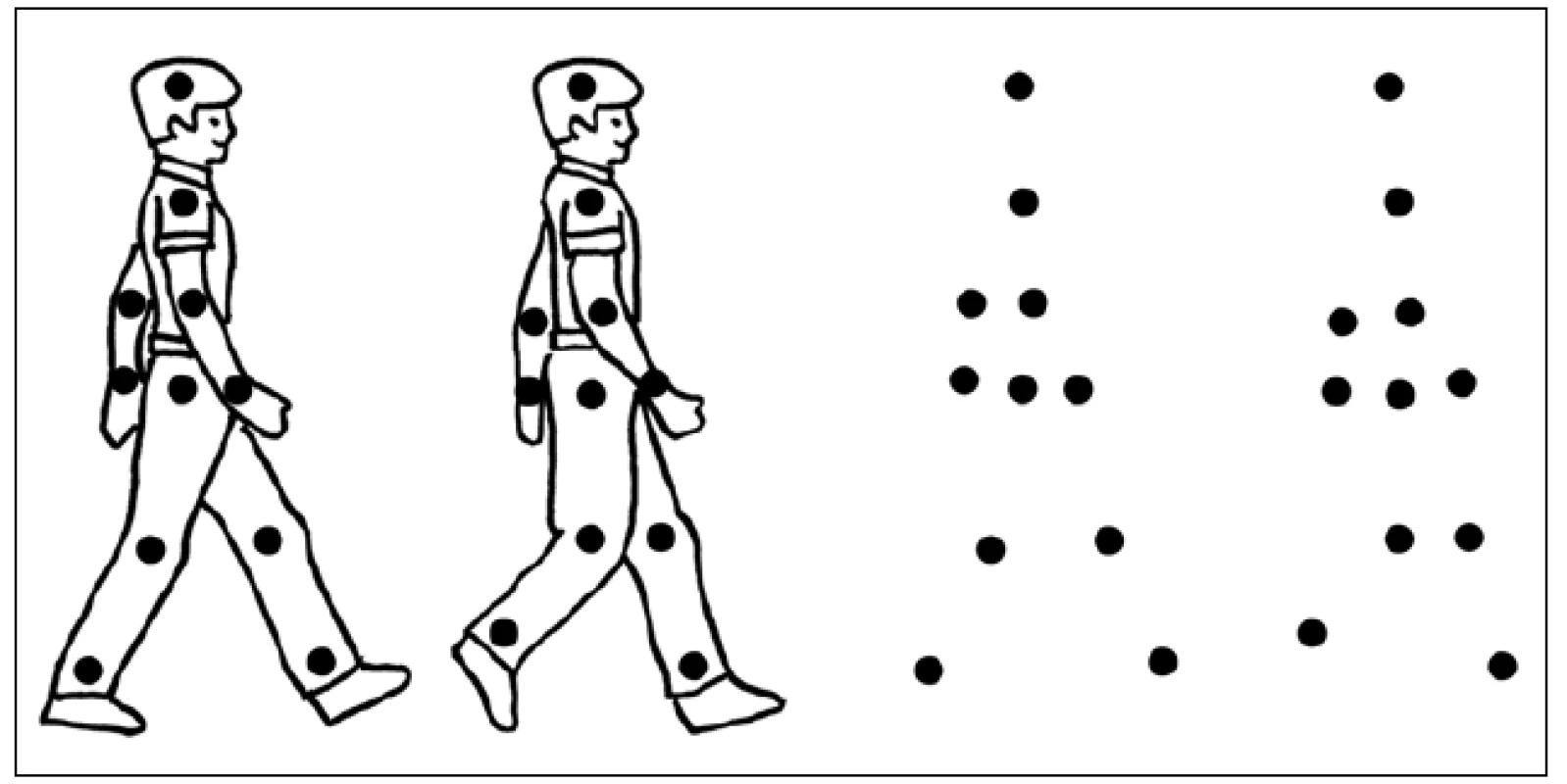
STS se aktivuje i při sledování lidského pohybu ve srovnání s pohybem nářadí (např. při srovnání jednoduchého pohybu ruky s pohybujícím se kladívkem) [23], a dokonce se aktivuje i při pouhé představě biologického pohybu [24]. Skupiny neuronů v STS specializovaných na různé typy pohybu úst, končetin nebo celého těla či na účelné pohyby rukama, jako jsou sbírání předmětů nebo manipulace s nimi, byly popsány rovněž u primátů [25]. Též bylo popsáno narušení těchto schopností při lézi STS [26–28].
Akiyama et al publikovali ojedinělý případ ženy, která utrpěla po hemoragické mozkové příhodě lézi limitovanou na pravý gyrus temporalis superior, jež zasahovala zejména kraniální část STS. Následné neuropsychologické vyšetření neprokázalo postižení intelektu, paměti ani sociální kognice, ale byla narušena schopnost vnímat změnu směru pohledu sledované osoby [29]. Podobná neschopnost vnímat směr pohledu při lézi STS byla popsána i u primátů [30,31].
Percepce tváří
Předpokládá se, že STS (zejména pravostranný v zadní části) je rovněž jedním z prvků sítě, která se aktivuje při percepci tváří (bez ohledu na to, zda jsou známé nebo emočně významné). Role STS v tomto procesu pravděpodobně spočívá ve zpracování měnlivých aspektů obličeje, jako je např. celkový výraz nebo již zmiňovaný směr pohledu či pohyby rtů [32,33], a zřejmě rovněž souvisí se sociálním chováním.
Zpracování řeči
Zpracování jazyka a řeči je další oblastí, na které se STS podílí [34,35] – a to zřejmě v souvislosti s fonologickou informací, jež obsahuje. Bývá popisována aktivita oboustranně, přestože někteří autoři se přiklánějí spíše k levostranné dominanci. Aktivita v STS nesouvisí jen s detekcí lidského hlasu, ale i s detekcí jiných akustických signálů produkovaných člověkem (kašel, zívání…). Může v této situaci tedy sloužit jako jakýsi detektor „lidskosti“ a z toho vyplývajícího potenciálního sociálního významu vnímaného zvuku [36]. Dále tato aktivita v STS pozitivně koreluje s intenzitou emoční prozódie vnímané řeči, která může být behaviorálně významná [37]. STS také reaguje na pohyby rtů napodobujících řeč ve srovnání s pohyby rtů napodobujících nesmyslné zvuky [38], což zřejmě souvisí se zmiňovanou percepcí biologického pohybu. Podobné oblasti STS, jaké se podílejí na percepci řeči, se pravděpodobně podílejí i na řečové produkci [39].
Polymodální integrace
Existence heteromodálních oblastí v STS (tj. reagujících na podněty různých senzorických modalit) byla prokázána už při studiích s primáty [1]. S přihlédnutím k anatomické blízkosti STS a zrakového a sluchového kortexu vyššího řádu se zdá být tato oblast dobře situována k vytváření vztahů mezi zrakovými a sluchovými vlastnostmi podnětů [40]. U člověka jejich existenci potvrdily experimenty využívající fMR – byly prokázány oblasti s vyšší aktivací při současné audiovizuální prezentaci podnětů (např. simultánní prezentace obrázku zvířete a zvuku, který vydává) než při prezentaci unimodální [41,42]. Tato aktivita je ještě více potencována, pokud dané podněty spolu souvisí časově nebo prostorově [43]. Aktivita v STS pozitivně koreluje i s potenciálním behaviorálním „ziskem“ při správně provedené klasifikaci podnětů [44]. Zároveň se po takovýchto podnětech zvyšuje funkční konektivita STS a asociačních oblastí [45]. STS integruje podněty nejen audio-vizuální, ale i audio- a vizuosenzitivní [46]. Předpokládá se, že STS v této souvislosti může fungovat jako nástroj asociačního učení [40].
Uvedené informace do jisté míry potvrzují i data získaná od nemocných s postižením temporálního kortexu. Studie pacientů s levostrannou temporální lézí nezasahující Heschlovy gyry zjistila, že mají problém rozpoznat a lokalizovat zvuky z prostředí, přestože mají normální audiometrické vyšetření [47]. Jiná studie s afatickými pacienty s levostrannou temporální lézí prokázala, že mají narušenu schopnost rozeznávat běžné nonverbální sluchové podněty a přiřadit je ke správným obrázkům [48].
Detekce vzácných podnětů
STS (zejména pravostranný) se aktivuje kromě výše uvedených komplexních dějů i při mnohem jednodušším procesu, jakým je detekce vzácného podnětu [49–52]. Tu zkoumáme nejčastěji prostřednictvím tzv. oddball úkolu. Při něm je dobrovolníkovi opakovaně prezentován jeden typ podnětu (nejčastěji jednoduchý geometrický obrázek nebo tón, ale podněty můžou být obecně jakékoliv modality). Mezi těmito podněty je však občasně a nepravidelně prezentován podnět odlišný – „oddball“ (jiný obrázek, tón o jiné frekvenci...), který je třeba rozeznat a reagovat na něj – nejčastěji sčítáním či stiskem tlačítka. Zdánlivě se jedná o velmi jednoduchou úlohu; dochází u ní ale k aktivaci řady kognitivních funkcí – zapojuje se jednak pozornost, dále však i pracovní paměť, musí dojít ke kategorizaci podnětu a zpracování jeho potenciálního významu. V neposlední řadě též k aktivaci exekutivních funkcí zahajujících požadovanou reakci. Je třeba si uvědomit, že detekce odlišného podnětu je z biologického hlediska velmi důležitá vlastnost, která může být klíčová pro přežití jedince. STS se v rámci tohoto úkolu podílí spíše než na časných fázích souvisejících s pozorností na fázích nastupujících později, souvisejících s dalším zpracováním percipovaného podnětu. Předpokládáme, že funkčně souvisí zejména s ventrolaterálním prefrontálním kortexem a podílí se na paměťových procesech vztahujících se k rozpoznání terčového podnětu, umožňujícímu zahájení adekvátní odpovědi [53,Haitová et al – odesláno k publikaci].
Závěr
Z uvedených informací vyplývá, že STS je zapojen do celé řady neuronálních sítí (obr. 4) a jeho funkce v dané situaci je dána funkcí právě aktivované sítě v závislosti na prováděném úkolu. Podílí se zejména na integračních a asociačních aspektech kognice, což je v souladu s výsledky histologických dat a studií zaměřených na anatomickou konektivitu u primátů. Jeho hlavním úkolem jsou především procesy, při kterých je třeba zhodnotit a integrovat polymodální podněty ze zevního prostředí, jež mohou být potenciálně biologicky významné, a správným způsobem je interpretovat. To umožní iniciaci vhodné behaviorální reakce. U člověka má významnou roli zejména v sociálním chování, což potvrzují mimo jiné i poznatky o jeho dysfunkci u osob s autizmem.
Obecně se jako významnější jeví STS nedominantní hemisféry, až na nejednoznačné výsledky studií zaměřených na řečovou percepci. Oblasti aktivní v souvislosti s percepcí řeči jsou také popisovány spíše v přední části STS, na rozdíl od ostatních zmiňovaných funkcí, které jsou lokalizovány spíše v jeho zadní části.
Nabízí se představa, že hlavní rolí (zejména nedominantního) STS je působit jako jakýsi detektor monitorující prostředí, který zaznamenává nové, nečekané podněty a zjišťuje, zda jsou živé, zda jsou lidské a jestli se chovají tak, jak bychom očekávali. Dále můžeme spekulovat, že tím umožňuje prefrontálnímu kotexu takovéto informace dále zpracovávat a „rozhodovat“, jak s nimi pak naložit.
Nepředpokládáme, že by detailní znalost funkcí všech kortikálních struktur byla cílem a zájmem lékaře působícího zejména klinicky. Přesto se domníváme, že je důležité si uvědomovat, že postižení oblastí na první pohled „nedůležitých“ a zanedbatelných se může významně podílet na mechanizmech neurologických a psychiatrických poruch. Moderní neurovědní výzkum nám pomáhá do těchto složitých vztahů alespoň nahlédnout, přestože často přináší více otázek než odpovědí.
Práce byla vytvořena za podpory Výzkumného záměru Ministerstva školství MSM0021622404.
Přijato k recenzi: 2. 5. 2011
Přijato do tisku: 1. 8. 2011
MUDr. Petra Haitová
I. neurologická klinika
LF MU a FN u sv. Anny
Pekařská 53
656 91 Brno
e-mail: petra.haitova@gmail.com
Sources
1. Seltzer B, Pandya DN. Afferent cortical connections and architectonics of the superior temporal sulcus and surrounding cortex in the rhesus monkey. Brain Res 1978; 149(1): 1–24.
2. Zheng ZZ, Wild C, Trang HP. Spatial organization of neurons in the superior temporal sulcus. J Neurosci 2010; 30(4): 1201–1203.
3. Seltzer B, Pandya DN. Frontal lobe connections of the superior temporal sulcus in the rhesus monkey. J Comp Neurol 1989; 281(1): 97–113.
4. Barbas H. Anatomic organization of basoventral and mediodorsal visual recipient prefrontal regions in the rhesus monkey. J Comp Neurol 1988; 276(3): 313–342.
5. Aggleton JP, Burton MJ, Passingham RE. Cortical and subcortical afferents to the amygdala of the rhesus monkey (Macaca mulatta). Brain Res 1980; 190(2): 347–368.
6. Blatt GJ, Pandya DN, Rosene DL. Parcellation of cortical afferents to three distinct sectors in the parahippocampal gyrus of the rhesus monkey: an anatomical and neurophysiological study. J Comp Neurol 2003; 466(2): 161–179.
7. Hein G, Knight RT. Superior temporal sulcus – it’s my area: or is it? J Cogn Neurosci 2008; 20(12): 2125–2136.
8. Allison T, Puce A, McCarthy G. Social perception from visual cues: Role of the STS region. Trends Cogn Sci 2000; 4(7): 267–278.
9. Pelphrey KA, Morris JP, McCarthy G. Grasping the intentions of others: the perceived intentionality of an action influences activity in the superior temporal sulcus during social perception. J Cogn Neusoci 2004; 16(10): 1706–1716.
10. Carrington SJ, Bailey AJ. Are there theory of mind regions in the brain? A review of the neuroimaging literature. Hum Brain Mapp 2009; 30(8): 2313–2335.
11. Pelphrey KA, Carter EJ. Brain mechanisms for social perception: lessons from autism and typical development. Ann N Y Acad Sci 2008; 1145: 283–299.
12. Materna S, Dicke PW, Thier P. The posterior superior temporal sulcus is involved in social communication not specific for the eyes. Neuropsychologia 2008; 46(11): 2759–2765.
13. Redcay E. The superior temporal sulcus performs a common function for social and speech perception: implications for the emergence of autism. Neurosci Biobehav Rev 2008; 32(1): 123–142.
14. Baron-Cohen S, Campbell R, Karmiloff-Smith A, Grant J, Walker J. Are children with autism blind to the mentalistic significance of the eyes? Br J Dev Psychol 1995; 13(4): 379–398.
15. Castelli F, Frith C, Happé F, Frith U. Autism, Asperger syndrome and brain mechanisms for the attribution of mental states to animated shapes. Brain 2002; 125(8): 1839–1849.
16. Boddaert N, Chabane N, Gervais H, Good CD, Bourgeois M, Plumet MH. Superior temporal sulcus anatomical abnormalities in childhood autism: a voxel-based morphometry MRI study. Neuroimage 2004; 23(1): 364–369.
17. Cross ES, Hamilton AF, Grafton ST. Building a motor simulation de novo: observation of dance by dancers. Neuroimage 2006; 31(3): 1257–1267.
18. Puce A, Perrett D. Electrophysiology and brain imaging of biological motion. Philos Trans R Soc Lond B Biol Sci 2003; 358(1431): 435–45.
19. Troje NF, Westhoff C. The inversion effect in biological motion perception: Evidence for a “life detector”? Curr Biol 2006; 16(8): 821–824.
20. Van Overwalle F, Baetens K. Understanding others’ actions and goals by mirror and mentalizing systems: a meta-analysis. Neuroimage 2009; 48(3): 564–584.
21. Grezes J, Fonlupt P, Bertenthal B, Delon-Martin C, Segebarth C, Decety J. Does perception of biological motion rely on specific brain regions? Neuroimage 2001; 13(5): 775–785.
22. Thompson JC, Clarke M, Stewart T, Puce A. Configural processing of biological motion in human superior temporal sulcus. J Neurosci 2005; 25(36): 9059–9066.
23. Beauchamp MS, Lee KE, Haxby JV, Martin A. Parallel visual motion processing streams for manipulable objects and human movements. Neuron 2002; 34(1): 149–159.
24. Grossman E, Donnelly M, Price R, Pickens D, Morgan V, Neighbor G et al. Brain areas involved in perception of biological motion. J Cogn Neurosci 2000; 12(5): 711–720.
25. Jellema T, Baker CI, Wicker B, Perrett DI. Neural representation for the perception of the intentionality of hand actions. Brain Cogn 2000; 44(2): 280–302.
26. Orban GA, Saunders R, Vandenbussche E. Lesions of the superior temporal cortical motion areas impair speed discrimination in the macaque monkey. Eur J Neurosci 1995; 7(11): 2261–2276.
27. Pasternak T, Merigan WH. Motion perception following lesions of the superior temporal sulcus in the monkey. Cereb Cortex 1994; 4(3): 247–259.
28. Lauwers K, Saunders R, Vogels R, Vandenbussche E, Orban GA. Impairment in motion discrimination tasks is unrelated to amount of damage to superior temporal sulcus motion areas. J Comp Neurol 2000; 420(4): 539–557.
29. Akiyama T, Kato M, Muramatsu T, Saito F, Nakach R, Kashima H. A deficit in discriminating gaze direction in a case with right superior temporal gyrus lesion. Neuropsychologia 2006; 44(2): 161–170.
30. Yamasaki DS, Wurtz RH. Recovery of function after lesions In the superior temporal sulcus in the monkey. J Neurophysiol 1991; 66(3): 651–673.
31. Campbell R, Heywood CA, Cowey A, Regard M, Landis T. Sensitivity to eye gaze in prosopagnosic patients and monkeys with superior temporal sulcus ablation. Neuropsychologia 1990; 28(11): 1123–1142.
32. Ishai A, Schmidt CF, Boesiger P. Face perception is mediated by a distributed cortical network. Brain Res Bull 2005; 67(1–2): 87–93.
33. Haxby JV, Hoffman EA, Gobbini MI. The distributed human neural system for face perception. Trends Cogn Sci 2000; 4(6): 223–233.
34. Hickok G. The functional neuroanatomy of language. Phys Life Rev 2009; 6(3): 121–143.
35. Price CJ. The anatomy of language: contributions from functional neuroimaging. J Anat 2000; 197(3): 335–359.
36. Belin P, Zatorre RJ, Lafaille P, Ahad P, Pike B. Voice-selective areas in human auditory cortex. Nature 2000; 403(6767): 309–312.
37. Ethofer T, Erb M, Anders S, Wiethoff S, Herbert C, Saur R et al. Effects of prosodic emotional intensity on activation of associative auditory cortex. Neuroreport 2006; 17(3): 249–253.
38. Campbell R, MacSweeney M, Surguladze S, Calvert G, McGuire P, Suckling J et al. Cortical substrates for the perception of face actions: an fMRI study of the specificity of activation for seen speech and for meaningless lower-face acts (gurning). Brain Res Cogn 2001; 12(2): 233–243.
39. Okada K, Hickok G. Left posterior auditory-related cortices participate both in speech perception and speech production: neural overlap revealed by fMRI. Brain Lang 2006; 98(1): 112–117.
40. Beauchamp MS, Lee KE, Argall BD, Martin A. Integration of auditory and visual information about objects in superior temporal sulcus. Neuron 2004; 41(5): 809–823.
41. Calvert GA. Crossmodal processing in the human brain: insights from functional neuroimaging studies. Cereb Cortex 2001; 11(12): 1110–1123.
42. Beauchamp MS. See me, hear me, touch me: multisensory integration in lateral occipital – temporal cortex. Curr Opin Neurobiol 2005; 15(2): 145–153.
43. Stevenson RA, James TW. Audiovisual integration in human superior temporal sulcus: inverse effectiveness and the neural processing of speech and object recognition. Neuroimage 2009; 44(3): 1210–1223.
44. Campanella S, Belin P. Integrating face and voice in person perception. Trends Cogn Sci 2007; 11(12): 535–543.
45. Kreifelts B, Ethofer T, Grodd W, Erb M, Wildgruber D. Audiovisual integration of emotional signals in voice and face: An event-related fMRI study. Neuroimage 2007; 37(4): 1445–1456.
46. Beauchamp MS, Yasar NE, Frye RE, Ro T. Touch, sound and vision in human superior temporal sulcus. Neuroimage 2008; 41(3): 1011–1020.
47. Clarke S, Bellmann A, Meuli RA, Assal G, Steck AJ. Auditory agnosia and auditory spatial deficits following left hemispheric lesions: evidence for distinct processing pathways. Neuropsychologia 2000; 38(6): 797–807.
48. Saygin AP, Dick F, Wilson W, Dronkers F, Bates E. Neural resources for processing language and environmental sounds: evidence from aphasia. Brain 2003; 126(4): 928–945.
49. Opitz B, Mecklinger A, Friederici AD, von Cramon DY. The functional neuroanatomy of novelty processing: integrating ERP and fMRI results. Cereb Cortex 1999; 9(4): 379–391.
50. Ngan ET, Vouloumanos A, Cairo TA, Laurens KR, Bates AT, Anderson CM et al. Abnormal processing of speech during oddball target detection in schizophrenia. Neuroimage 2003; 20(2): 889–897.
51. Stevens MC, Pearlson GD, Kiehl KA. An FMRI auditory oddball study of combined-subtype attention deficit hyperactivity disorder. Am J Psychiatry 2007; 1461(11): 1737–1749.
52. Brázdil M, Mikl M, Marecek R, Krupa P, Rektor I. Effective connectivity in target stimulus processing: a dynamic causal modeling study of visual oddball task. Neuroimage 2007; 35(2): 827–835.
53. Halgren E, Marinkovic K, Chauvel P. Generators of the late cognitive potentials in auditory and visual oddball tasks. Electroencephalogr Clin Neurophysiol 1998; 106(2): 156–164.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2012 Issue 2
Most read in this issue
- Využití perkutánní endoskopické gastrostomie – přehled indikací, popis techniky a současné trendy v neurologii
- Posturálna instabilita, poruchy chôdze a pády pri Parkinsonovej chorobe
- Algoritmus vyšetření likvoru v návaznosti na doporučení Sekce neuroimunologie a likvorologie České neurologické společnosti JEP
- Obstrukční spánková apnoe a CPAP – má význam řešit nosní průchodnost?
