Vztah časných metabolických změn mozku a vybraných vstupních parametrů u pacientů posubarachnoidálním krvácení z prasklého aneuryzmatu
An Association Between Early Metabolic Changes in the Brain and Selected Baseline Parametres in Patients after Subarachnoid Haemorrhage Due to Ruptured Intracranial Aneurysm
Aim:
In this retrospective study of patients with subarachnoid haemorrhage from a ruptured aneurysm we explored associations between the initial condition at the time of patient admission (clinical and radiological) and concentration of selected metabolites in the white brain matter as measured by microdialysis.
Methods:
We included 15 patients after subarachnoid haemorrhage who were treated surgically or endovascularly from 2012 to 2015. A probe measuring intracranial pressure and a microdialysis catheter for monitoring of the metabolic condition of the brain tissue were introduced following treatment. The condition of patients at the time of clinical admission was evaluated according to the Hunt-Hess scale. Images were assessed for the presence of global cerebral oedema. These parameters were statistically evaluated against lactate and pyruvate concentrations and their ratio.
Results:
Patients with global cerebral oedema had a statistically significantly lower concentration of pyruvate and a higher lactate/pyruvate ratio within the first 24 hours of monitoring. Patients with at least one episode of metabolic crisis (glucose < 0.7 mmol/l and lactate/pyruvate ratio > 40) showed statistically significantly higher value of lactate/pyruvate ratio during the first 24 hours. Furthermore, a statistically significant association was confirmed between severity of a patient’s baseline condition (Hunt-Hess 4) and concentration of lactate and lactate/pyruvate ratio within the first 24 hours of monitoring. A statistically significant association was also found between at least one episode of metabolic crisis during the entire monitoring and poorer clinical outcome 1 month after subarachnoid haemorrhage due to ruptured intracranial aneurysm (modified Rankin score 4–6).
Key words:
subarachnoid haemorrhage – neuromonitoring – microdialysis – global cerebral oedema
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Chinese summary - 摘要
关系早期在脑内代谢改变和选定蛛网膜下腔后,患者输入参数
从动脉瘤破裂出血
摘要
目标:
澄清代谢过程的关系监视的脑透析液放射学和临床参数的病人蛛网膜下腔出血后动脉瘤破裂。
方法:
在2012 - 2015年这项研究涵盖15例蛛网膜下腔后出血谁是手术或血管内治疗。在这些患者中,后
治疗与传感器出血源颅内压力导管的测量微透析监测脑组织的代谢状态。输入临床状态根据亨特 - 赫斯的规模,他进行了评价。当评估影像学表现关注全球脑水肿(GEM)的标识。这些参数是
统计学与乳酸盐,丙酮酸盐,以及它们的关系的浓度相比较。
结果:
在组患者的创业板是丙酮酸显著较低浓度和更高乳酸/丙酮酸比率在第一个24小时监视。患者
据报道代谢危机(葡萄糖<0.7毫摩尔/升的至少一个情节和乳酸/丙酮酸比值> 40)中首次展出的乳酸/丙酮酸比率较高的值24小时测量。此外,证实了较重的输入之间的统计学显著关系临床状态(亨特 - 赫斯4)和乳酸和值较高浓度最初的24小时监控中乳酸/丙酮酸比值。统计显著
关系也是代谢危机中的至少一个情节的存在期间蛛网膜下腔后全程监控,更糟糕的临床结果1个月
从动脉瘤破裂出血(改良Rankin比分4-6)。
关键词:
蛛网膜下腔出血 – 大脑检测 - 微透析 - 全球脑水肿
Authors:
J. Adamkov 1; J. Náhlovský 1; T. Česák 1; J. Habalová 1; M. Kanta 1; J. Kremláček 3; A. Krajina 2; S. Řehák 1
Authors‘ workplace:
Neurochirurgická klinika LF UK a FN Hradec Králové
1; Ústav patologické fyziologie, LF UK v Hradci Králové
2; Radiologická klinika LF UK a FN Hradec Králové
3
Published in:
Cesk Slov Neurol N 2017; 80/113(1): 75-79
Category:
Original Paper
Overview
Cíl:
Objasnění vztahu metabolických dějů sledovaných mozkovou mikrodialýzou k radiologickým a klinickým parametrům u pacientů po subarachnoidálním krvácení z prasklého aneuryzmatu.
Metodika:
Do studie bylo v letech 2012–2015 zařazeno 15 pacientů po subarachnoidálním krvácení, kteří byli ošetřeni chirurgicky nebo endovaskulárně. U těchto pacientů byl po ošetření zdroje krvácení spolu s čidlem pro měření nitrolebního tlaku zaveden katétr mikrodialýzy k monitoraci metabolické kondice mozkové tkáně. Vstupní klinický stav byl hodnocen dle Huntovy-Hessovy stupnice. Při hodnocení zobrazovacího nálezu byl důraz kladen na identifikaci globálního edému mozku (GEM). Tyto parametry byly statisticky konfrontovány s koncentrací laktátu, pyruvátu a jejich poměru.
Výsledky:
Ve skupině pacientů s GEM byla statisticky významně nižší koncentrace pyruvátu a vyšší hodnoty laktát/ pyruvát poměru v prvních 24 hod monitorace. Pacienti, u kterých byla zaznamenána minimálně jedna epizoda metabolické krize (glukóza < 0,7 mmol/l a laktát/ pyruvát poměr > 40), vykazovali vyšší hodnoty laktát/ pyruvát poměru v prvních 24 hod měření. Dále se potvrdil statisticky významný vztah mezi těžším vstupním klinickým stavem (Hunt-Hess 4) a vyššími koncentracemi laktátu a hodnot laktát/pyruvát poměru v průběhu iniciálních 24 hod sledování. Statisticky významný vztah byl také mezi přítomností alespoň jedné epizody metabolické krize v průběhu celého monitoringu a horšího klinického výsledku 1 měsíc po subarachnoidálním krvácení z prasklého aneuryzmatu (modifikovaná Rankinova škála 4–6).
Klíčová slova:
subarachnoidální krvácení – neuromonitorace – mikrodialýza – globální edém mozku
Úvod
Subarachnoidální krvácení (SAK) z prasklého aneuryzmatu je impulzem k řetězci procesů, které ohrožují energetický metabolizmus mozkových buněk. Bezprostředně po SAK nastává rychlý nárůst nitrolebního tlaku (Intracranial Pressure; ICP) dosahující hodnot mezi systolickým a diastolickým tlakem [1]. Spolu s trombocyto-fibrinózní zátkou v místě ruptury aneuryzmatu představuje zvýšený ICP důležitý mechanizmus kontroly krvácení [1]. I když se ICP po několika minutách u části pacientů vrací k fyziologickým hodnotám, porucha cévní autoregulace a patologické procesy na úrovni mikrocirkulace mohou vést k nerovnováze mezi energetickou potřebou a aktuální kyslíkovou a substrátovou nabídkou [1]. Experimenty na zvířecích modelech uvádějí, že vysoká intracelulární hladina Ca, excitotoxicita a mitochondriální dysfunkce mohou představovat důležité faktory vzniku cytotoxického edému časně po SAK [2]. Invazivní tkáňový monitoring pacientů po SAK umožňuje lépe sledovat a interpretovat tyto časné metabolické změny, které přicházejí s časovým předstihem před klinickou a grafickou manifestací, což nám nabízí prostor terapeuticky zasáhnout [3,4]. U 20–60 % pacientů po SAK může být časně přítomen globální edém mozku (GEM), který ovlivňuje výsledný stav nemocných po SAK [5]. Jeho přítomnost se vysvětluje jako výsledek akcelerovaného energetického metabolizmu (vysoká koncentrace laktátu a pyruvátu, laktát/pyruvát poměr v normě) nebo metabolického stresu (nízká hladina pyruvátu, elevace laktát/ pyruvát poměru, mozkový O2 beze změny) [6,7].
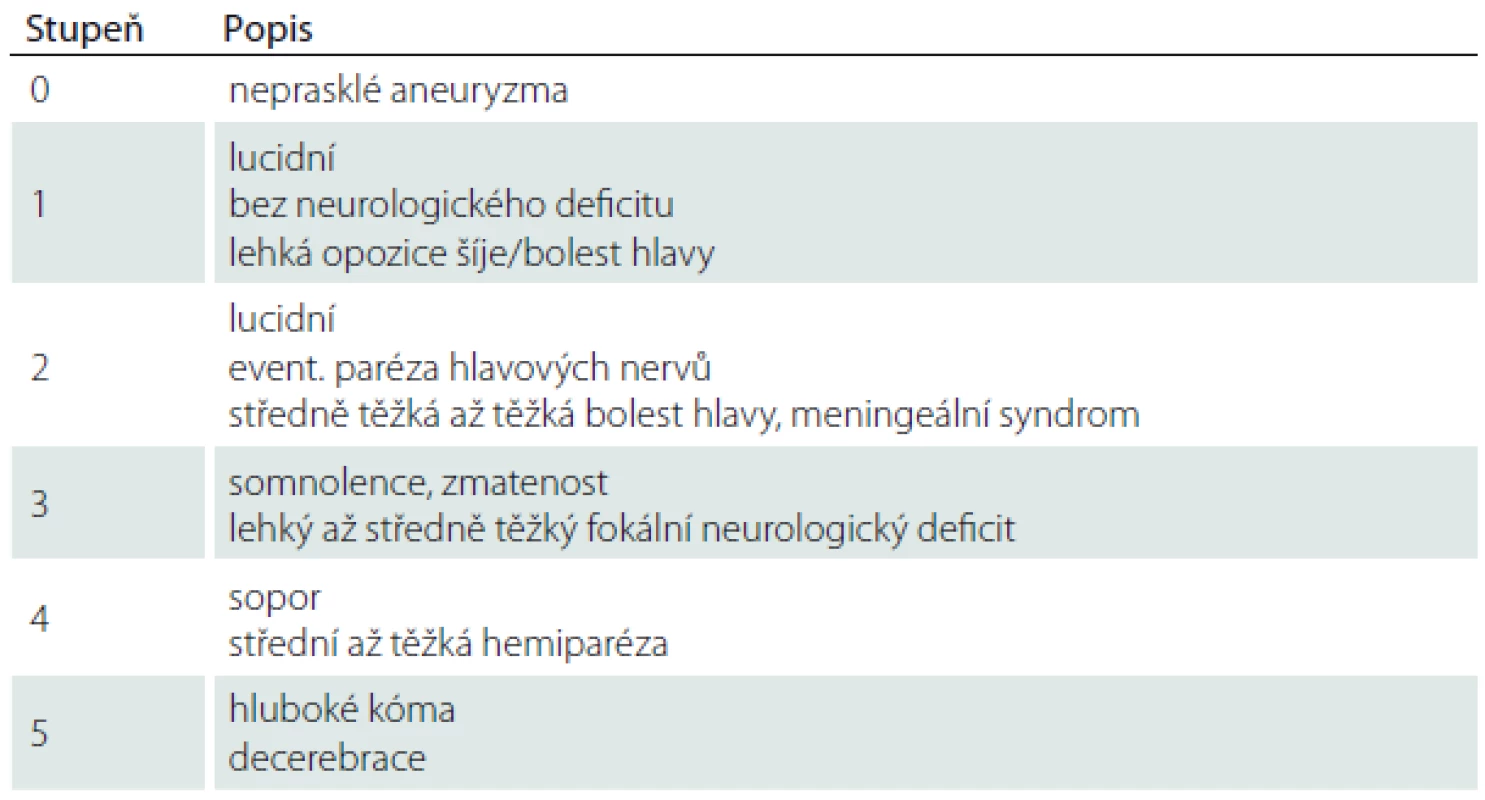
Cílem této retrospektivní studie bylo sledovat vztah mezi mozkovou koncentrací vybraných energetických metabolitů (laktát, pyruvát a jejich poměr; L/P poměr) v prvních 24 hod po implantaci katétru mikrodialýzy a vstupním klinickým stavem hodnoceným Huntovou-Hessovou škálou (HH) (tab. 1), časným GEM na iniciálním vyšetření počítačovou tomografií (CT) a výskytem metabolických krizí v průběhu monitorace. Dále jsme zkoumali vztah mezi přítomností metabolických krizí v průběhu monitorovaného období a výsledným klinickým stavem hodnoceným modifikovanou Rankinovou škálou (mRS) 1 měsíc po krvácení (tab. 2).

Materiál a metodika
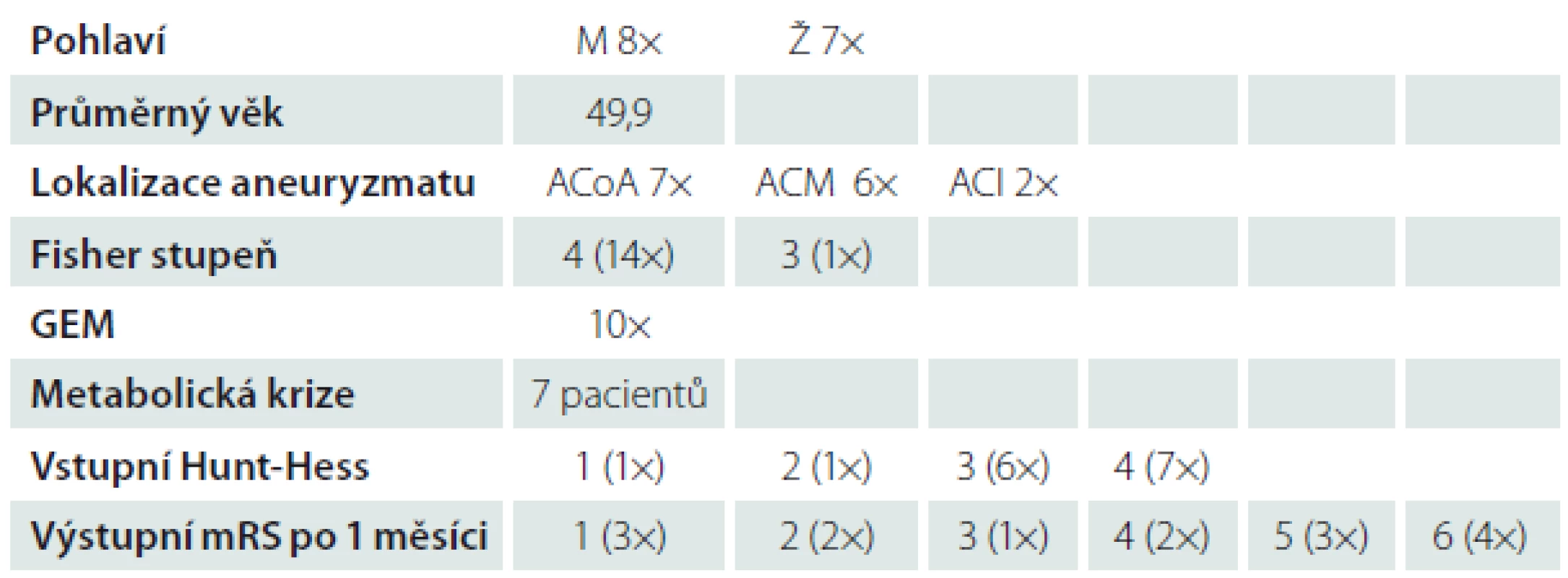
V období od února 2012 do prosince 20015 jsme implantovali katétr mikrodialýzy a čidlo pro měření nitrolebního tlaku v rámci multimodálního monitoringu (MMM) u 15 pacientů po SAK. Jednalo se o pacienty, u kterých nebyl předpoklad časné extubace a klinické monitorace. U pěti pacientů v klinickém stavu HH 1–3 byly důvody prolongované sedace a řízené ventilace následující: jeden pacient po současné intoxikaci metanolem, jeden pacient s již přítomnými cerebrovaskulárními spazmy a těžkou interní komorbiditou, tři pacienti s časnou bronchopneumonií a respirační insuficiencí na podkladě aspirace před ošetřením aneuryzmatu. V případě symetrické distribuce krve v subarachnoidálních prostorech na vstupním CT jsme implantovali katétr do bílé hmoty F laloku nedominantní hemisféry. Při lateralizaci krve v bazálních cisternách a Sylviovské fisuře byl katétr umístěn do bílé hmoty F laloku, vždy ipsilaterálně k predilekci krevní distribuce. Katétr mikrodialýzy jsme zavedli 1.–3. den po SAK. V hodinových intervalech byly odebírány vzorky s mikrodialyzátem, které se okamžitě zpracovaly v analyzátoru Iscus (CMA Microdialysis AB, Švédsko). Tímto způsobem jsme stanovili intersticiální mozkovou koncentraci laktátu, pyruvátu, glukózy a glycerolu. Zahájení MMM vždy navazovalo na obliteraci zdroje krvácení, a to buď chirurgickou nebo endovaskulární technikou. Ošetření aneuryzmatu bylo provedeno v den ataky SAK (dva pacienti) nebo následující den po krvácení (13 pacientů). Operační výkon (klip) podstoupilo v našem souboru šest pacientů, endovaskulárně (koil, resp. koil + stent) bylo ošetřeno osm pacientů. U jednoho nemocného jsme zdroj krvácení ošetřili kombinovaně. U všech pacientů byly podepsány informované souhlasy vždy dle aktuálního klinického stavu (pacient, resp. nejbližší příbuzní).
Základní charakteristiku souboru zobrazuje tab. 3.
Na vstupním CT jsme identifikovali známky GEM. Patří mezi ně:
a) vyhlazení subarachnoidálních prostorů na konvexitě mozku;
b) setření hranice mezi šedou a bílou hmotou mozku v úrovni centrum semiovale. Na základě přítomnosti GEM jsme rozdělili pacienty do dvou skupin.
Klinický stav byl hodnocen dle Huntovy-Hessovy škály. Na základě této škály jsme rozdělili pacienty do dvou skupin (HH 1–3 a HH 4).
Z dat mozkové mikrodialýzy jsme u jednotlivých pacientů v celém monitorovaném období identifikovali epizody metabolické krize (poměr L/P > 40 a koncentrace glukózy < 0,7 mmol/l). Tímto kritériem jsme rozdělili náš soubor na dvě skupiny (skupina pacientů, u kterých byla zjištěna minimálně jedna epizoda metabolické krize, a skupina nemocných bez této epizody).
Všechny uvedené skupiny pacientů byly konfrontovány s koncentrací laktátu, pyruvátu a L/P poměru.
Výsledný klinický stav pacientů byl hodnocen mRS 1 měsíc po SAK. Na základě mRS jsme pacienty rozdělili do dvou skupin (mRS 1–3 a mRS 4–6). Sledovali jsme vztah mezi výsledným klinickým stavem a přítomností epizod metabolické krize v průběhu celého monitorovaného období. Získaná data nevykazovala normální rozložení (Andersonův-Darlingův test), proto byl pro srovnání skupin použit neparametrický Wilcoxonův test a pro hodnocení korelací Spearmanův rank koeficient. Za hranici statistické významnosti byl považován výsledek menší než 0,05. Standardním cílem léčby v průběhu MMM bylo dosažení mozkové perfuze (CPP) > 60 a nitrolebního tlaku (ICP) < 20 torrů.
Výsledky
GEM a metabolizmus
V průběhu prvních 24 hod MMM ve skupině pacientů s GEM byla koncentrace pyruvátu nižší (p = 0,01; graf 1a) a hodnoty L/P poměru naopak vyšší (p = 0,004; graf 1b) ve srovnání se skupinou pacientů bez GEM. GEM byl identifikován u 10 pacientů (66 %).


Klinický stav pacienta při přijetí a mozkový metabolizmus
Ve skupině pacientů v těžším klinickém stavu (HH 4) byly naměřeny vyšší koncentrace laktátu (p = 0,06) a zaznamenány vyšší hodnoty L/P poměru (p = 0,04; graf 2a, b) ve srovnání se skupinou pacientů v lehčím klinickém stavu (HH 1–3).


Metabolická krize a mozkový metabolizmus
Skupina pacientů s alespoň jednou epizodou metabolické krize vykazovala vyšší hodnoty L/P poměru (p = 0,06) v průběhu iniciální 24hod monitorace.
Metabolická krize a výsledný klinický stav
U pacientů s minimálně jednou epizodou metabolické krize v průběhu celého monitorovaného období jsme prokázali horší klinický výsledek 1 měsíc po SAK (mRS 4– 6; p = 0,01; graf 3).

Diskuze
SAK způsobené rupturou aneuryzmatu je příčinou náhlého nárůstu nitrolebního tlaku s následným poklesem mozkové perfuze [1]. I když hodnoty nitrolebního tlaku v následujících minutách klesají a často se vrací k normálu, vzniká porucha v mikrocirkulaci mozkového řečiště. V případě, že tato hypoperfuze postihne větší část mozku, vzniká globální mozková ischemie, kterou zpravidla doprovází porucha vědomí. Tuto fázi střídá krátkodobá hyperemie, na kterou navazuje prolongovaná hypoperfuze, jejíž příčinou je porucha autoregulace mozkových cév a s ní spojená vazokonstrikce [8]. Ta přispívá k nedostatečnému přísunu substrátů a kyslíku mozkovým buňkám. V hypoxickém prostředí vzniká metabolický stres s následným posunem v redox stavu nervových buněk [3]. Převládající anaerobní pochody již nejsou tak energeticky výhodné a tímto způsobem alterovaný buněčný metabolizmus není schopen udržet homeostázu vnitřního prostředí [9,10]. Vzniká cytotoxický edém, který můžeme detekovat časně po SAK vstupním CT vyšetřením – GEM [9]. V době vzniku ireverzibilních změn na buněčné úrovni ztrácí hematoencefalická bariéra svoji integritu a vzniká vazogenní edém. Tyto nevratné změny nastávají mezi 3. a 7. dnem po SAK [11]. Mluvíme tak o časném poškození mozku. Zetterling et al uvádějí, že ve skupině pacientů s časným GEM zaznamenali vyšší koncentraci laktátu a pyruvátu při normálních hodnotách L/P poměru v časovém intervalu 60–90 hod po SAK. Tyto výsledky interpretují jako zvýšený glukózový metabolizmus s posunem do hyperglykolytického stavu, který představuje reparační proces při zvýšené energetické spotřebě [6]. Helbok et al zaznamenali nižší hladiny pyruvátu a vyšší hodnoty L/P poměru ve skupině pacientů s GEM po SAK a tyto nálezy popisují jako obraz metabolického stresu. Obě srovnávané skupiny (s GEM a bez něj) nevykazovaly rozdíly v hodnotách tkáňového (mozkového) kyslíku a mozkové perfuze [7]. Stacionární koncentraci O2 v mozkovém intersticiu ve skupině pacientů s GEM vysvětlují autoři poruchou jeho utilizace v dysfunkčních mitochondriích [7]. Závěry citovaných studií přinášejí dvě odlišné metabolické situace u pacientů s časným GEM. Výsledkem první studie je popis akcelerovaného metabolizmu s vyšší utilizací glukózy, zatímco druhá práce interpretuje své výsledky jako metabolický stres s mitochondriální poruchou [6,7]. Tyto odlišné výsledky mohou být způsobeny dvěma faktory. Prvním je rozdílné zastoupení pacientů v těžkém klinickém stavu v obou studiích (19 % World Federation of Neurological Surgeons, WFNS 5 vs. 33 % HH 5). Druhým je časově rozdílná monitorovaná perioda po SAK (60–80 hod po SAK vs. 1–3 dny po SAK). Koncentrace pyruvátu ve skupině s GEM byla nižší také v našem souboru (p = 0,01). L/P poměr byl naopak ve stejné skupině vyšší (p = 0,004). V naší sestavě nebyli pacienti v nejtěžším klinickém stavu (HH 5) a začátek monitorace byl v intervalu 1.–3. den po SAK.
Dalším zkoumaným jevem byla přítomnost epizod metabolické krize. Ta je definována hodnotou L/P poměru nad 40 a kritickou hladinou mozkové glukózy pod 0,7 mmol/l [12]. V naší sestavě pacientů s GME byla tato epizoda zaznamenána minimálně jednou u 50 % pacientů (vs. 40 % ve skupině bez GEM). Pacienti s minimálně jednou epizodou metabolické krize v monitorovaném období vykazovali v našem souboru vyšší hodnoty L/P poměru v prvních 24 hod měření (p = 0,06) a horší klinický výsledek (hodnoceno mRS) 1 měsíc po SAK (p = 0,01). Tato data poukazují na určitou kontinuitu v metabolickém obraze pacientů po SAK. Iniciálně po krvácení je u části pacientů přítomen časný GEM, který jak už bylo řečeno, může souviset s metabolickým stresem [7]. Tato diskrétní změna by mohla představovat iniciální energetickou poruchu, jež může progredovat do metabolické krize, která je již obrazem dominance anaerobního metabolizmu a akutní hrozbou ireverzibilního ischemického poškození. Přítomnost metabolické krize může být známkou vážnější energetické alterace s následným klinickým dopadem. Identifikace epizod metabolické krize v průběhu monitorace může být tak jedním z prediktivních znaků neuspokojivého klinického výsledku.
Helbok uvádí, že ve skupině pacientů s GEM, u kterých byla větší mozková perfuze, zaznamenal nižší hodnoty L/P poměru [7]. Na základě tohoto pozorování doporučuje zvýšení perfuzního tlaku jako cílený terapeutický zásah u pacientů s GEM [7]. Klinický a metabolický dopad tohoto kroku bude jistě v budoucnu předmětem dalšího zkoumání.
Nedílnou součástí hodnocení klinického stavu po SAK je stupnice podle HH. V naší studii jsme sledovali koncentrace energetických metabolitů u pacientů v lehčím (HH 1–3) a těžkém (HH 4) klinickém stavu. Pacienti v těžkém klinickém stavu (HH 4) měli vyšší úvodní 24hod hodnoty L/P poměru ve srovnání s pacienty v lepší klinické kondici (HH 1–3) (p = 0,04). Korelace těchto dvou parametrů nám nabízí určitou spojitost od monitorace klinického stavu spontánně ventilujícího, neurologicky vyšetřitelného pacienta až po sedovaného, ventilovaného, a tudíž neurologicky již nehodnotitelného nemocného. Tato kontinuita potvrzuje opodstatněnost sledování ventilovaného pacienta po SAK za pomocí invazivní neuromonitorace.
Závěr
SAK je spouštěcí impulz komplexní, multisystémové a multiefektorové reakce, jejímž výsledkem je onemocnění s devastujícím potenciálem a vysokou mortalitou (40–45 % do 30 dnů) [13– 15]. V současnosti není možné poukázat na jeden konkrétní patogenetický mechanizmus, který by mohl být v centru zájmu při hledání účinné terapie nebo dokonce prevence. Jsou patrné především snahy o identifikaci jednotlivých, dílčích, na sebe navazujících a navzájem se ovlivňujících reakcí časně po SAK [16]. Mezi tyto časné změny patří také GEM, který je spojován s metabolickým stresem a častějším výskytem metabolických krizí [7]. Sledování těchto dějů za pomoci invazivní MMM nabízí jedinečný pohled na metabolizmus ohrožených tkání, a svým dílem tak přispívá k rozplétání sítě složitých interakcí.
Podpořeno programem PRVOUK P37/4.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Jaroslav Adamkov
Neurochirurgická klinika
LF UK a FN Hradec Králové
Sokolská 571
500 05 Hradec Králové
e-mail: jaroslav.adamkov@fnhk.cz
Přijato k recenzi: 29. 2. 2016
Přijato do tisku: 26. 7. 2016
Sources
1. Prunell GF, Mathiesen T, Diemer NH, et al. Experimental subarachnoid hemorrhage: subarachnoid blood volume, mortality rate, neuronal death, cerebral blood flow, and perfusion pressure in three different rat models. Neurosurg 2003;52(1):165– 75.
2. MacGregor DG, Avshalumov MV, Rice ME. Brain edema induced by in vitro ischemia: causal factors and neuroprotection. J Neurochem 2003;85(6):1402– 11.
3. Vespa P, Bergsneider M, Hattori N, et al. Metabolic crisis without brain ischemia is common after traumatic brain injury: a combined microdialysis and positron emission tomography study. J Cereb Blood Flow Metab 2005;25(6):763– 74.
4. Adamkov J, Náhlovský J, Habalová J, et al. Cerebrální vazospazmy po subarachnoidálním krvácení – možnosti diagnostiky, monitorace a léčby. Cesk Slov Neurol N 2014;77/ 110(2):158– 67.
5. Claassen J, Carhuapoma JR, Kreiter KT, et al. Global cerebral edema after subarachnoid hemorrhage: frequency, predictors, and impact on outcome. Stroke 2002;33(5):1225– 32.
6. Zetterling M, Hallberg L, Hillered L, et al. Brain energy metabolism in patients with spontaneous subarachnoid hemorrhage and global cerebral edema. Neurosurg 2010;66(6):1102– 10. doi: 10.1227/ 01.NEU.0000370893.04586.73.
7. Helbok R, Ko SB, Schmidt M, et al. Global cerebral edema and brain metabolism after subarachnoid hemorrhage. Stroke 2011;42(6):1534– 9. doi: 10.1161/ STROKEAHA.110.604488.
8. Harukuni I, Bhardwaj A. Mechanisms of brain injury after global cerebral ischemia. Neurol Clin 2006;24(1):1– 21.
9. Qureshi AI, Sung GY, Suri MA, et al. Prognostic value and determinants of ultraearly angiographic vasospasm after aneurysmal subarachnoid hemorrhage. Neurosurgery 1999;44(5):967– 73.
10. Hejčl A, Sameš M. Mikrodialýza v neurochirurgii. Cesk Slov Neurol N 2009;72/ 105(6):511– 7.
11. Thal SC, Sporer S, Klopotowski M. Brain edema formation and neurological impairment after subarachnoid hemorrhage in rats. Laboratory investigation. J Neurosurg 2009;111(5):988– 94. doi: 10.3171/ 2009.3.JNS08412.
12. Hillered L, Vespa PM, Hovda DA. Translational neurochemical research in acute human brain injury: the current status and potential future for cerebral microdialysis. J Neurotrauma 2005;22(1):3– 41.
13. King JT jr. Epidemiology of aneurysmal subarachnoid hemorrhage. Neuroimaging Clin N Am 1997;7(4):659– 68.
14. Hansen-Schwartz J, Vajkoczy P, Macdonald RL, et al. Cerebral vasospasm: looking beyond vasoconstriction. Trends Pharmacol Sci 2007;28(6):252– 6.
15. Macdonald RL, Pluta RM, Zhang JH. Cerebral vasospasm after subarachnoid hemorrhage: the emerging revolution. Nat Clin Pract Neuro 2007;3(5):256– 63.
16. Sehbaand FA, Friedrich V. Early microvascular changes after subarachnoid hemorrhage. Acta Neurochir 2011;110(1):49– 55. doi: 10.1007/ 978-3-7091-0353-1_9.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2017 Issue 1
Most read in this issue
- Základní neurologické vyšetření – nastal čas pro změny?
- Současný pohled na kontraindikace a komplikace elektromyografie
- Endoskopická exstirpace koloidní cysty III. mozkové komory
- Periodické pohyby končetinami ve spánku jsou závažnější u narkolepsie s kataplexií než u narkolepsie bez kataplexie
