Difuzní gliomy mozkového kmene u dětí. Noční můra dětského onkologa.
Diffuse brainstem gliomas in children. A nightmare for a paediatric oncologist.
Children with diffuse brainstem gliomas represent the cathegory of patients with extremly poor prognosis. Their diagnosis is based upon typical magnetic resonance imaging, histological confirmation is usually not required. Radiotherapy has been essential and the only accepted treatment modality, but it only extends progression free survival. The role for chemotherapy is unclear an it has been a part of investigational studies. Less then 10% of children with diffuse brainstem gliomas survive 2 years. These children are the ideal cancidates for new therapeutic strategies.
Key words:
difusse brainstem glioma, chemotherapy, radiotherapy, prognosis
:
Z. Pavelka 1; K. Zitterbart 1; T. Pavlík 2; L. Křen 3; M. Votava 4; J. Ventruba 5; E. Brichtová 5; J. Skotáková 6; P. Šlampa 7
; H. Ošlejšková 8
:
Klinika dětské onkologie LF MU a FN Brno-PDM
1; Institut biostatistiky a analýz PřF MU a LF MU Brno
2; Ústav patologie LF MU a FN Brno-PMDV
3; Ústav soudního lékařství LF MU a FN U sv. Anny v Brně
4; Neurochirurgické oddělení, KDCHOaT LF MU a FN Brno-PDM
5; Klinika dětské radiologie LF MU a FN Brno-PDM
6; Klinika radiační onkologie, Masarykův onkologický ústav, Brno
7; Klinika dětské neurologie, LF MU a FN Brno-PDM
8
:
Cesk Slov Neurol N 2008; 71/104(1): 41-46
:
Review Article
Děti s difuzními gliomy mozkového kmene představují kategorii pacientů s extrémně špatnou prognózou. Diagnóza se opírá o typický obraz při vyšetření magnetickou rezonancí, histologická verifikace není vyžadována. Radioterapie je základní a jedinou akceptovanou léčebnou modalitou, ale poskytuje pouze prodloužení doby do progrese. Role chemoterapie je nejasná a nadále je součástí klinických studií. Méně než 10 % dětí s difuzními gliomy kmene přežívá 2 roky. Tyto děti jsou ideálními kandidáty nových léčebných strategií.
Klíčová slova:
difuzní gliom mozkového kmene, chemoterapie, radioterapie, prognóza
Úvod
Gliomy mozkového kmene (brainstem gliomas, BSG) představují heterogenní skupinu nádorů s rozdílným biologickým chováním a prognózou [1]. Nicméně lze odlišit dvě základní kategorie: a) difuzní intrinsické pontinní gliomy (DBSG), b) nedifuzní nádory mozkového kmene (NDBSG). DBSG představují u dětí nejčastější variantu, difuzně infiltrují pons a mají extrémně špatnou prognózu. Nedifuzní nádory zahrnují: 1) fokální nádory středního mozku zejméjna z oblasti tecta mezencefala, 2) dorzální exofytické nádory, 3) cervikomedulární nádory [1,2]. Většina těchto nádorů je pomalu rostoucí, s low grade histologií, častěji jsou operovatelné a mají lepší prognózu [3]. Diagnostiku tumorů mozkového kmene značně usnadnilo a zpřesnilo zavedení MRI do rutinní praxe včetně diferenciální diagnostiky nenádorových ložisek.
Epidemiologie
BSG tvoří 10-20 % primárních nádorů CNS u dětí. 75 % BSG je diagnostikováno u dětí před 10. rokem života. Celkové přežití 5 let od diagnózy (OS5) pro všechny nádory kmene je 20-30 %. Difuzní pontinní gliomy reprezentují 80 % všech pediatrických BSG. Medián do progrese činí pro DBSG 6 měsíců a pouze 5-6 % dětí přežívá dva roky od diagnózy [4].
Patologie
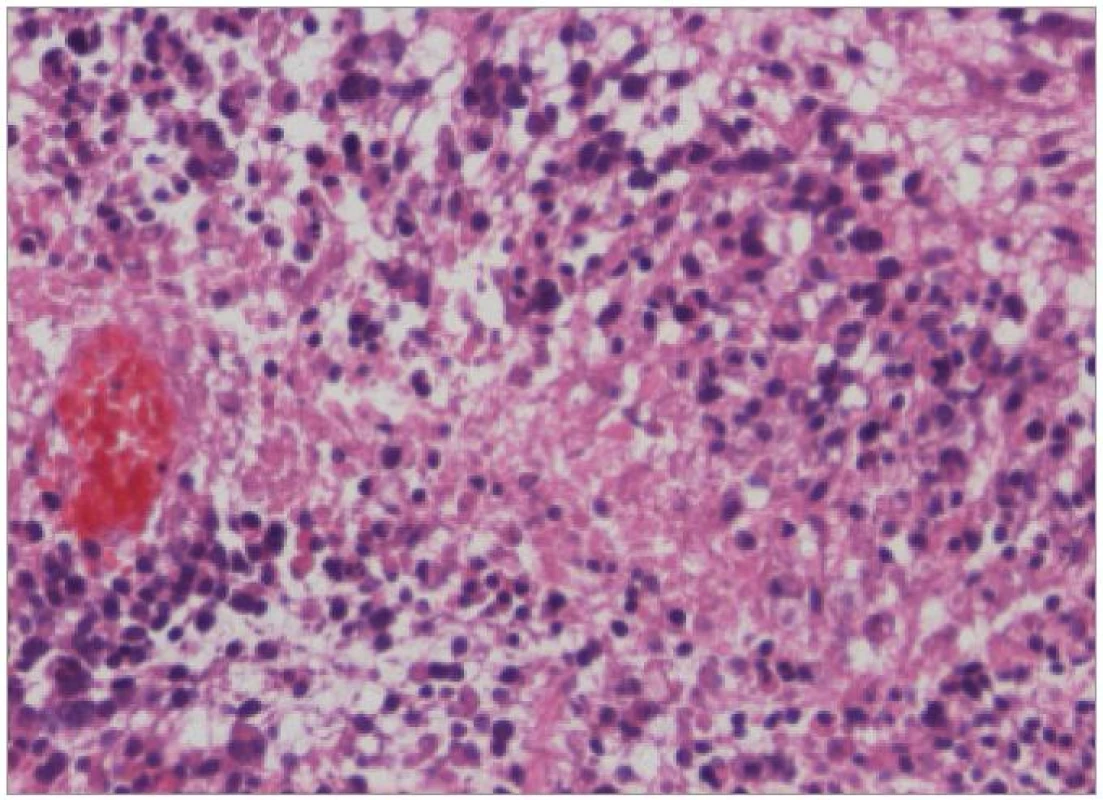
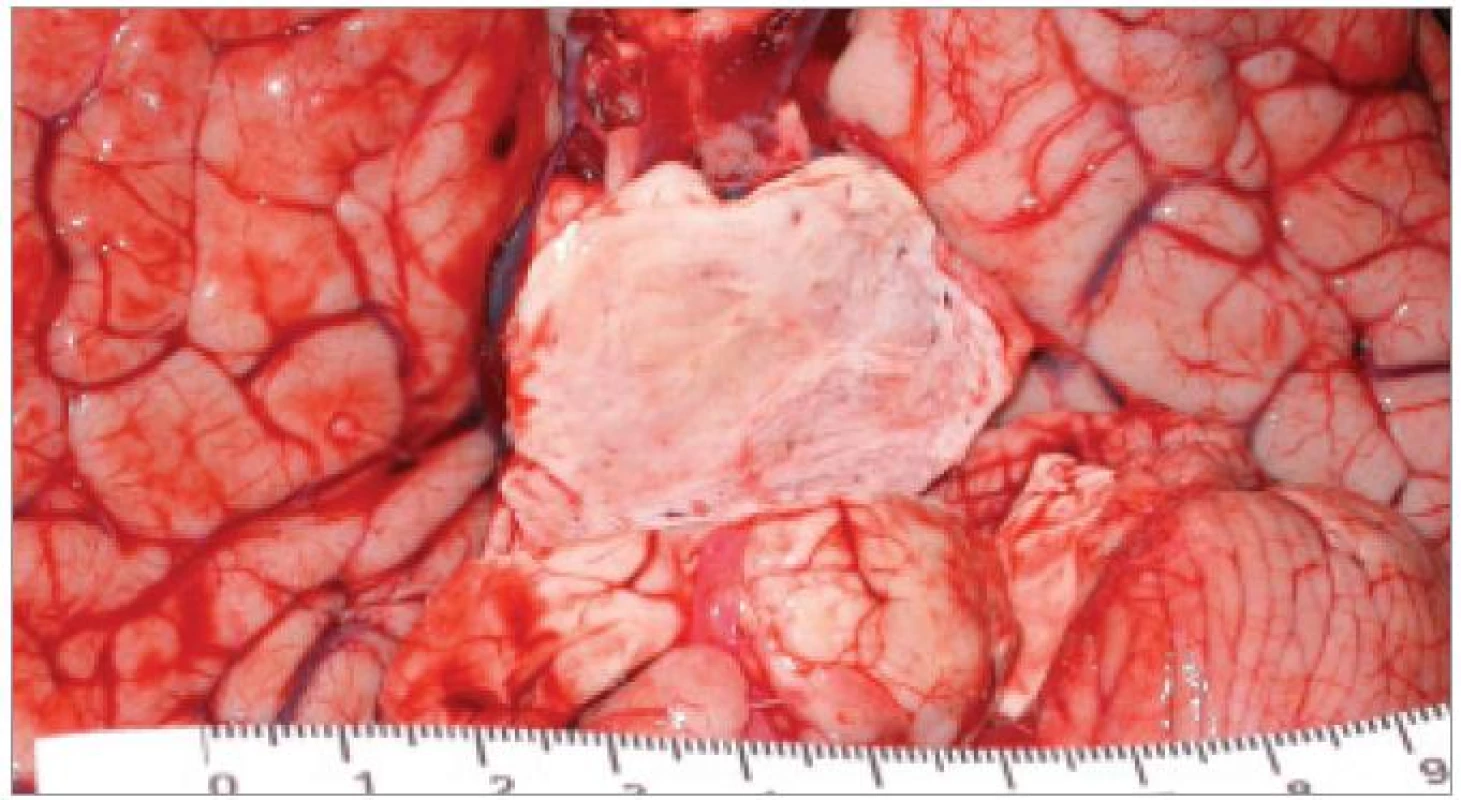
Nádory kmene nepředstavují samostatnou kategorii ve WHO klasifikaci nádorů CNS, ale jsou definovány svojí lokalizací v rámci anatomických struktur mozkového kmene. 90 % je gliálního původu. Zatímco gliální nádory mezimozku a prodloužené míchy jsou častěji nízkého stupně malignity, DBSG jsou typicky představovány maligními nádory stupně 3 nebo 4. Nejčastěji se jedná o anaplastický astrocytom, anaplastický gangliogliom nebo glioblastoma multiforme (obr. 1). Imunohistochemicky vykazují reaktivitu pro GFAP a vimentin [3]. Frekvenci zastoupení jednotlivých histologických typů je obtížné přesně stanovit vzhledem k faktu, že bioptována je naprostá menšina případů, a to navíc zpravidla formou stereotaktické biopsie s rizikem nereprezentativního odběru. Omezené informace tak pocházejí pouze z autopsií (obr. 2).
Cytogenetika a molekulární biologie
Znalosti nádorové biologie BSG jsou limitovány omezeným množstvím případů, kdy máme k dispozici vzorek nativní nádorové tkáně. Podle jedné recentní studie se z autoptických materiálů u poloviny dětí s DBSG prokázala somatická mutace či delece onkogenu p53, zatímco podobné změny nebývají přítomny u mozečkových low-grade gliomů [5,6]. Tyto alterace jsou naopak typické pro sekundární glioblastomy dospělých. U části tumorů histologicky maligních bývá také zjištěna zvýšená exprese receptoru pro epidermální růstový faktor (EGFR) či mutace onkogenu PTEN. Dalším relativně častým nálezem bývá alelická ztráta na dlouhém raménku 10. chromozomu [3, 7]. Prognostický význam popsaných změn zatím zůstává nejasný a v současnosti neovlivňují volbu léčebné strategie.
Klinické příznaky
Klinické příznaky závisí na věku dítěte a lokalizaci nádoru v rámci mozkového kmene. DBSG postihující Varolův most se nejčastěji prezentují kombinací příznaků dysfunkce hlavových nervů (VI. a VII.), kortikospinálních a mozečkových drah. Typické je krátké trvání příznaků před stanovením diagnózy (medián 1 měsíc), pouze u 10 % dětí se časně rozvíjí obstrukční hydrocefalus [1,2].
Stanovení diagnózy
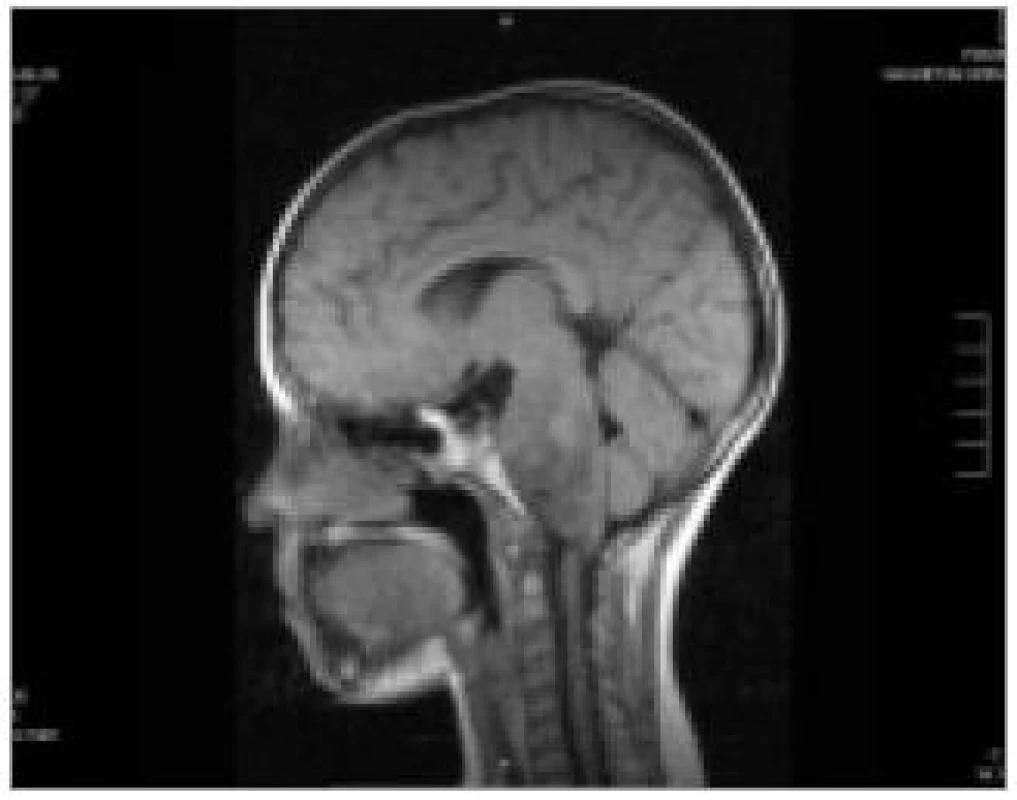
Ve většině případů nádorů mozkového kmene nemáme k dispozici vzorek pro histologické vyšetření. Vlastní diagnóza je tak stanovena zpravidla na základě nálezu na zobrazovacím vyšetření, dle charakteristik růstu lze usuzovat i na typ nádoru. CT popisuje DBSG jako izodenzní nebo hypodensní ložisko se slabým vychytáváním kontrastu. Vyšetření MRI je tak pro nádory kmene, zejména DBSG metodou volby [1]. DBSG se zobrazují jako hypointenzní v T1 zobrazení, hyperintenzní v T2 váženém obraze. Většinou není přítomno signifikantní vychytávání gadolinia, někdy pouze heterogenní enhancement (obr. 3) [1,2].
V minulosti proběhla odborná debata na téma indikace biopsie u nádorů kmene. V současnosti většina faktů hovoří proti nutnosti biopsie a otevřená biopsie není považována za indikovanou, pokud je MRI nález s diagnózou DBSG konzistentní [8,9]. Informace získaná biopsií má většinou malý dopad na prognózu a je zatížena rizikem morbidity i mortality. Také stereotaktická biopsie je zatížena neúměrným rizikem, i když je výrazně bezpečnější v porovnání s otevřeným výkonem (mortalita pod 1 % a morbidita kolem 6 %), ovšem významné je riziko nereprezentativního odběru. Recentně je tedy stereotaktická biopsie indikována pouze v případech, kdy nález na MRI není konzistentní s DBSG – u nádorů fokálního typu [10,11]. Je možné, že v budoucnu se role biopsie posílí v souvislosti s rozvojem molekulárně cílené terapie, která potřebuje identifikovat jasný terč v nádorové tkáni.
S rozvojem techniky MRI se některé obrazové charakteristiky nádorů kmene zařadily mezi prognostické faktory (viz níže).
Prognostické faktory
Mezi negativní prognostické faktory nádorů kmene zjistitelné na MRI patří lokalizace v pontu (proti středními mozku a prodloužené míše), výrazné rozšíření kmene (proti mírnému), obraz difuzní infiltrace. Prognóza dětí s DBSG je uniformně velmi špatná. Klinickými faktory nepříznivé prognózy jsou krátký interval mezi začátkem příznaků a stanovením diagnózy a přítomnost/absence floridního neurologického deficitu z postižení kmene [8]. Tyto nepříznivé rysy však nese většina typických DBSG. Poněkud lepší prognózu mají děti s kombinací DBSG a přítomnosti neurofibromatózy typu 1 [12]. Pokud je k dispozici histologie, pak negativní dopad na prognózu má mimo vlastní průkaz maligního nádoru vysoká mitotická aktivita [13].
Přehled terapie difuzních gliomů mozkového kmene
Radioterapie (RT)
Léčebné možnosti DBSG jsou značně omezené. Medián přežití neléčených dětí je přibližně 20 týdnů. Léčbou volby je nadále zevní frakcionovaná radioterapie dávkou 54 - 60 Gy, aplikovaná nejlépe konformní technikou s denní frakcí 1,8 - 2,0 Gy [8,14]. 60-70 % pacientů dočasně na tuto terapii odpoví zpravidla formou částečné regrese, následuje však nezadržitelná progrese. Některá pracoviště zkoušela a stále užívají hyperfrakciovanou zevní radioterapii (HFRT) (celková dávka nad 64 Gy, formou dvou denních dávek po 1 Gy, celkem 6 týdnů), avšak studie fáze III u dětí neprokázaly žádnou statistickou diferenci ve výsledcích [15]. Největší množství informací lze čerpat ze studií organizovaných od 80. a 90. let minulého století severoamerickými odbornými skupinami dětské onkologie Pediatric Oncology Group (POG) a Children´s Cancer Study Group (CCSG), které se posléze sloučily do jednotné Children´s Oncology Group. Například studie POG, která randomizovala pacienty léčené konvenční radioterapií a léčené HFRT, skončila neúspěchem: medián do smrti byl 8,5 měsíců pro konvenční RT proti 8 měsícům ve skupině léčené HFRT [16]. U déle přežívajících je také HFRT zatížena větší frekvencí nežádoucích účinků (radionekróza apod).
Chemoterapie
Role chemoterapie v léčbě DBSG zůstává nadále nejasná. Různé chemoterapeutické režimy včetně kombinovaných obsahující cytostatika BCNU, cisplatinu, ifosfamid a nověji topotekan byly užity k léčbě rekurentních DBSG po předchozí radioterapii bez signifikantního efektu, nebo pouze s dočasnou odpovědí [8,14,17,18].
Výsledky studií pro nově diagnostikované DBSG založené na konkomitantní chemo a radioterapii nebo sekvenčním podání chemoterapie dopadly podobně špatně. Z velkého množství studií lze zmínit radioterapii spolu s tamoxifenem, HFRT s konkomitantním etoposidem a karboplatinou [19,20]. Bohužel výhodu nepřineslo ani zařazení vysoce dávkované chemoterapie (busulfan, thiotepa) po radioterapii [21]. Jedinou velkou dětskou randomizovanou studií, která srovnávala rameno se samotnou RT proti ramenu RT + chemoterapie (vinkristin, CCNU, prednison) byla dnes již historická studie Children´s Cancer Study Group z 80. let 20. století. Celkové pětileté přežití pro rameno s chemoterapií nebylo lepší, medián přežití byl 9 měsíců pro obě ramena [22]. Kombinace radioterapie s podáním radiosenzibilizujícího agens (např. cisplatina) také nevedla ke zlepšení výsledků [17]. Výsledky všech výše uvedených historických i více recentních studií jsou obdobně špatné. Medián přežití bývá udáván v rozmezí 8-15 měsíců [17,18,19,23]. V současnosti probíhající studie fáze III vedená americkou Children´s Oncology Group ověřuje efektivitu RT v kombinaci s konkomitantním metronomicky dávkovaným temozolomidem následovanou blokovým podáním [17,24]. Metronomické dávkování znamená aplikaci cytostatika v relativně nízkých netoxických dávkách, a to v častých, zpravidla denních intervalech. Cílovou strukturou účinku takto podaných léků jsou endoteliální buňky novotvořených cév nádoru a nikoliv vlastní nádorové buňky, jak je tomu u konvenčních dávek chemoterapie. Výsledky výše zmíněné studie zatím nejsou k dispozici.
Jiný, dnes již také v podstatě opuštěný přístup z 90. let, zahrnoval kombinaci radioterapie a imunoterapie (nejčastěji interferon - alfa nebo beta). Výsledy byly špatné. Packer et al léčili děti s DBSG kombinací radioterapie (HFRT) a vzestupných dávek interferonu-beta: u 30 ze 32 pacientů došlo k progresi s mediánem 5 měsíců [25].
Standardem léčby DBSG u dětí je tedy konvenční radioterapie. Některá pracoviště nadále při preferenci rodiny neindikují aktivní protinádorovou terapii a zaměřují se na léčbu symptomatickou. Na druhou stranu tristní výsledky činí tyto pacienty kandidáty pro nové strategie. Klinický výzkum je zaměřen na oblast molekulární terapie specificky cílené na klíčové hráče v tumorigenezi, anti-angiogení terapie, překonání hematoencefalické bariéry apod. Z velkého množství biologických agens studií fáze 1 a 2 lze zmínit imatinib mesylát (inhibitor PDGFR), gefitinib (EGFR inhibitor), tipifarnib (inhibitor farnesyltransferázy). Jako potencionální agens zvyšující citlivost k radioterapii je zkoušen například gadolinium texaphyrin [26-30]. Jinou slibnou oblast představuje imunoterapie formou adjuvantní vakcinace autologními dendritickými buňkami připravenými kultivací v nádorovém homogenátu. Různé studie fáze 1 již demonstrovaly proveditelnost a bezpečnost tohoto postupu u pacientů s rekurentními maligními gliomy [31]. Limitaci v případě DBSG ovšem představuje omezená dostupnost nativní nádorové tkáně k přípravě vakcíny.
Vlastní výsledky
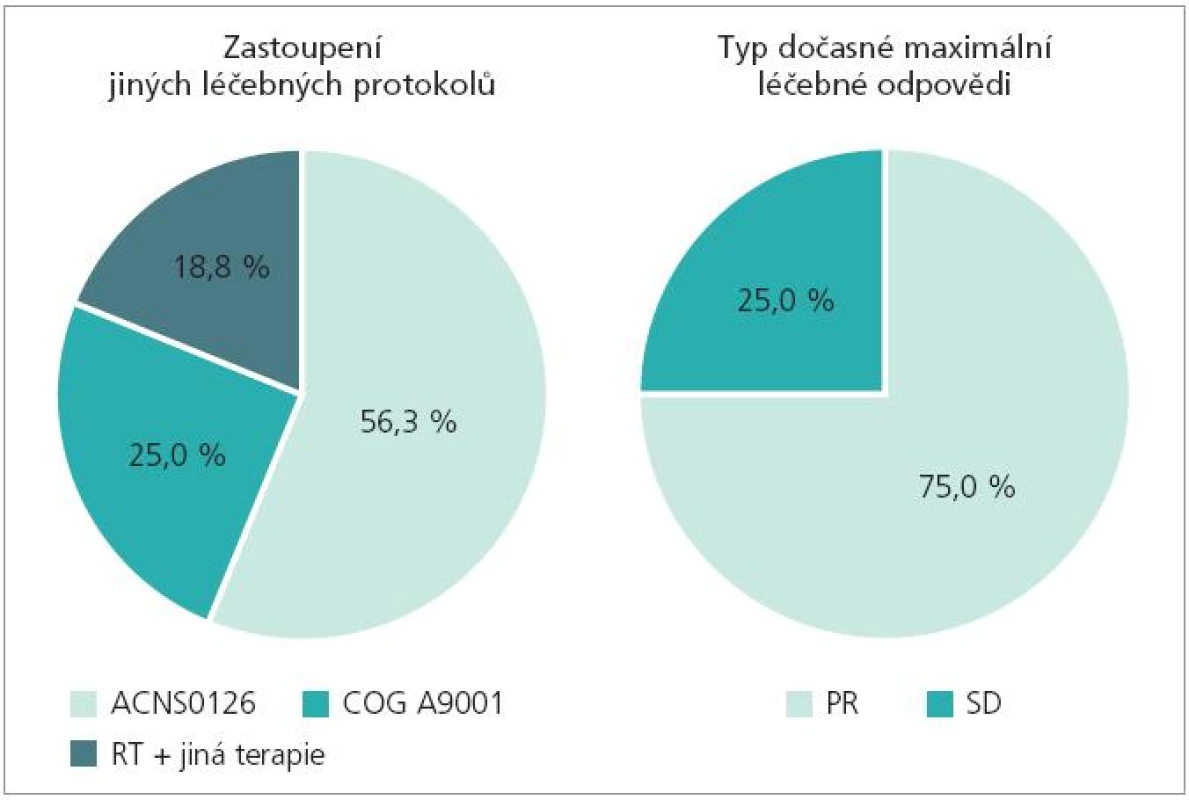
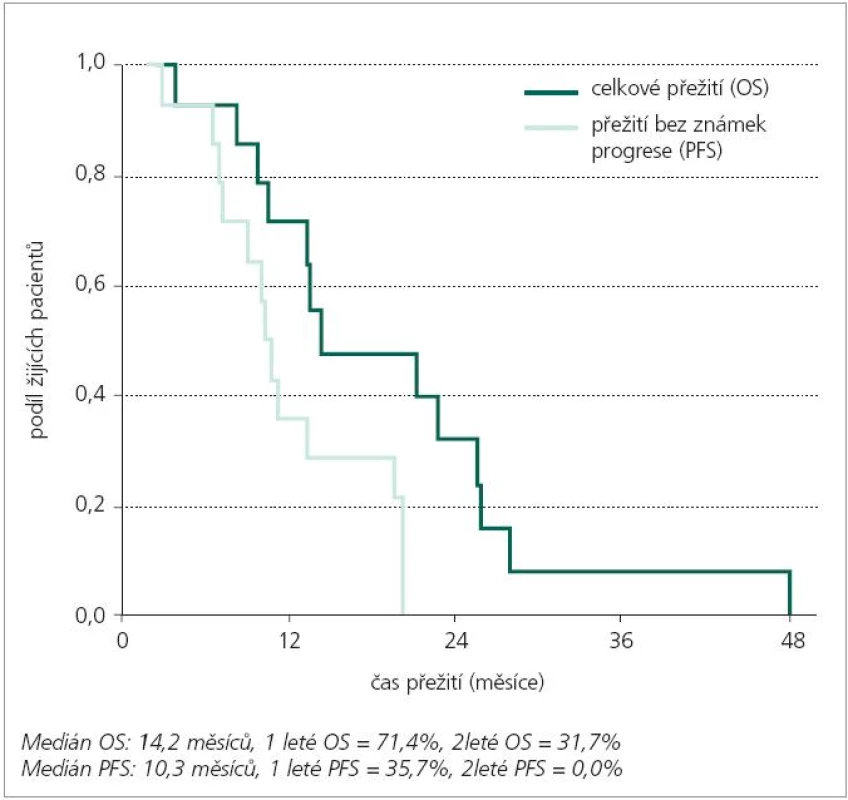
Za dobu existence našeho pracoviště jsme ošetřili 16 dětí s diagnózou DBSG. Ve všech případech byla tato diagnóza stanovena na základě kompatibilního nálezu na MRI bez bioptické verifikace. Medián věku při diagnóze činil 6 let, medián od počátku příznaků do stanovení rentgenologické diagnózy 1 měsíc (obr. 4). Zastoupení obou pohlaví v souboru bylo ekvivalentní. V uvedeném období jsme terapeuticky používali celkem 3 léčebné protokoly: 1) COG ACNS 0126 (radioterapie + metronomicky dávkovaný konkomitantní temozolomid, následně blokový temozolomid): 56,3 % pacientů, 2) COG A9001 (radioterapie + metronomicky dávkovaný konkomitantní temozolomid, následně bloky chemoterapie BCNU/CDDP): 25 % pacientů, 3) jiná terapie (radioterapie a konkomitantní interferon-beta): 18,8 % pacientů (obr. 5). Hlavní léčebnou modalitou všech uvedených studií je radioterapie. Dávka na oblast tumoru s bezpečnostním lemem podaná konformní formou byla v rozmezí od 50 Gy do 59,4 Gy (dávka na frakci 1,8 Gy). Ve shodě s obecnými zkušenostmi jsme u ¾ pacientů viděli přechodnou léčebnou odpověď typu parciální remise jak klinické, tak rentgenologické (obr. 5). U prakticky všech dětí však došlo posléze k progresi základní nemoci, která již není terapeuticky ovlivnitelná. (Medián doby do progrese 10,3 měsíců, medián doby do úmrtí 14,3 měsíců) (obr. 4). Celkové smutné křivky přežití jsou následující: 2leté celkové přežití OS2 činí 31,7 %, 2leté přežití bez progrese PFS2 činí 0 % (obr. 6)! V jednom případě dívenky s DBSG léčené dle protokolu ACNS0126 (radioterapie + temozolomid) byla po radioterapii dosažena překvapivě kompletní remise onemocnění. Dívenka je stále na adjuvantní terapii blokovým temozolomidem, interval od diagnózy je v době publikace sdělení ovšem krátký (6 měsíců). Rozhodne další sledování.

Z důvodu malého počtu pacientů v našem souboru na jednotlivých typech léčby nelze statisticky relevantně srovnat, zda je některý z užitých protokolů v našich rukou superiorní. Jak bylo konstatováno výše, smutný osud dětí s DBSG vede ke snaze hledat nové léčebné možnosti pro tuto krajně prognosticky nepříznivou kategorii pacientů. Jednou z oblastí je tzv. anti-angiogenní léčba a vývoji látek s anti-angiogenním působením je v současnosti věnována velká pozornost [26]. Inhibice angiogeneze byla prokázána též u řady cytostatik, zejména jsou-li tato podávána v nižším a dlouhodobém chronickém dávkování (označovaném jako metronomické), než je obvyklé při konvenční chemoterapii [24]. Při tomto schématu podání zasahují cytostatika nejen vlastní nádorové buňky, ale i endotelie vstupující opakovaně do buněčného cyklu. Tímto mechanizmem může být vysvětlena trvající (nebo nová) léčebná odpověď na stejný lék i v situaci, když již nádor neodpovídá na terapii konvenční dávkou cytostatika pro vznik rezistence [27,30]. Na našem pracovišti máme zkušenost s aplikací kombinace čtyř látek (celekoxib, low-dose temozolomid a etoposid, 13-cis retinová kyselina) formou dlouhodobého kontinuálního orálního podávání. Cílovou skupinou jsou děti s refrakterní nebo recidivující malignitou včetně nádorů CNS. V případě DBSG pak je tato kombinace podávána při progresi na v současnosti užívaném protokolu ACNS0126 (radioterapie + temozolomid). Dosavadní zkušenosti na omezeném vzorku pacientů jsou příznivé stran tolerance preparátů. Léčba je převážně dobře tolerována s mírnou hematologickou (trombopenie) a kožní (cheilitis) toxicitou, které si jen výjimečně vyžádají dočasné přerušení léčby. Dopad na ukazatele přežití, tedy zejména ovlivnění času do progrese zatím nelze zhodnotit pro krátký interval sledování a omezený počet pacientů [32].
Závěr
Navzdory pokrokům v diagnostice a léčbě řady jiných dětských nádorů CNS zůstávají děti s DBSG krajně nepříznivou kategorií onkologických pacientů. Nezbývá než doufat, že nové poznatky z oblasti nádorové biologie a molekulární genetiky vnesou nové impulzy do problematiky a pomohou změnit smutný osud takto nemocných dětí.
Přijato k recenzi: 3.8. 2007
Přijato do tisku: 5. 10. 2007
Korespondující autor:
MUDr. Zdeněk Pavelka
Klinika dětské onkologie FN Brno-PDM a LF MU Brno
Černopolní 9, 625 00 Brno,
E-mail: zpavelka@fnbrno.cz
Sources
1) Gupta N, Banerjee A, Hass-Kogan D. Pediatric CNS tumors. Berlin (Germany): Springer 2004.
2) Walker DA, Perilongo G, Punt Jonathan AG, Taylor RE. Brain and spinal tumors of childhood. London: Arnold 2004.
3) Kleihues P, Cavanee WK. Pathology and genetics of tumors of the nervous system. Lyon: International Agency for Research on Cancer (IARC) Press 2000.
4) Rickert CH, Paulus W. Epidemiology of central nervous system tumors in childhood and adolescence based on the new WHO classification. Childs Nerv Syst 2001; 17(9): 503–511.
5) Sure U, Ruedi D, Tachibana O, Yonekawa Y, Ohgaki H, Kleihues P et al. Determination of p53 mutations, EGFR overexpression, and loss of p16 expression in pediatric glioblastomas. J Neuropathol Exp Neurol 1997; 56(7): 782-789.
6) Pollack IF, Finkelstein SD, Woods J, Burnham J, Holme EJ, Hamilton RL et al. Expression of p53 and prognosis in children with malignant gliomas. N Engl J Med 2002; 346(6): 420-427.
7) Gilbertson RJ, Hill DA, Hernan R, Kocak M, Geyer R, Olson J, et al. ERBB1 is amplified and overexpressed in high-grade diffusely infiltrative pediatric brain stem glioma. Clin Cancer Res 2003; 9 : 3620-3624.
8) Finlay JL, Zacharoulis S. The treatment of high grade gliomas and diffuse intrinsic pontine tumors of childhood and adolescence: a historical – and futuristic – prespective. J Neurooncol 2005; 75(3): 253-266.
9) Lesniak MS, Klem JM, Weingart J, Carson BS Sr. Surgical outcome following resection of contrast-enhanced pediatric brainstem gliomas. Pediatr Neurosurg 2003; 39(6): 314-322.
10) Albright AL, Packer RJ, Zimmerman R, Rorke LB, Boyett J, Hammond GD. Magnetic resonance scans should replace biopsies for the diagnosis of diffuse brain stem gliomas: a report from the Children’s Cancer Group. Neurosurgery 1993; 33(6): 1026-1029.
11) Pincus DW, Richter EO, Yachnis AT, Bennet J, Bhatti MT, Smith A. Brainstem stereotactic biopsy sampling in children. J Neurosurg 2006; 104(2 Suppl): 108-114.
12) Molloy PT, Bilaniuk LT, Vaughan SN, Needle MN, Liu GT, Zackai EH et al. Brainstem tumors in patients with neurofibromatosis type 1: a distinct clinical entity. Neurology 1995; 45(10): 1897-1902.
13) Pollack IF, Hamilton RL, Burnham J, Holmes EJ, Finkelstein SD, Sposto R et al. Impact of proliferation index on outcome in childhood malignant gliomas: results in a multi-institutional cohort. Neurosurgery 2002; 50(6): 1238-1244.
14) Freeman CR, Farmer JP. Pediatric brainstem gliomas: a review. Int J Radiat Oncol Biol Phys 1998, 40(2): 265–271.
15) Freeman CR. Hyperfractionated radiotherapy for diffuse intrinsic brain stem tumors in children. Pediatr Neurosurg 1996; 24 : 103-10.
16) Mandell LR, Kadota R, Freeman C, Douglass EC, Fontanesi J, Cohen ME et al. There is no role for hyperfractionated radiotherapy in the management of children with newly diagnosed diffuse intrinsic brainstem tumors: results of a Pediatric Oncology Group phase III trial comparing conevtional vs. hyperfractionated radiotherapy. Int J Radiat Biol Phys 1999; 43 : 959-964.
17) Freeman CR, Perilongo G. Chemotherapy for brainstem gliomas. Childs Nerv Syst 1999; 15 : 545–553.
18) Childrensoncologygroup.org [homepage on the Internet]. Available from: http://members.childrensoncologygroup.org/protocols/.
19) Broniscer A, Leite CC, Lanchote VL, Machado TM, Cristofani LM. Radiation therapy nad high-dose tamoxifen in the treatment of patients with diffuse brainstem gliomas: results of a Brazilian cooperative study. Brainstem Glioma Cooperative Group. J Clin Oncol 2000; 18 : 1246–1253.
20) Walter AW, Gajjar A, Ochs JS, Langston JW, Sanford RA, Kun LE et al. Carboplatin and etoposide with hyperfractionated radiotherapy in children with newly diagnosed diffuse pontine gliomas: a phase I/II study. Med Pediatr Oncol 1998; 30 : 28–33.
21) Bouffet E, Raquin M, Doz F, Gentet JC, Radary C, Demeocq F et al. Radiotherapy followed by high dose busulfan and thiotepa: a prospective assessment of high dose chemotherapy in children with diffuse pontine gliomas. Cancer 2000; 88 : 685–692.
22) Sposto R, Ertel IJ, Jenkin RD, Boesel CP, Venes JL, Ortega JA et al. The effectiveness of chemotherapy for treatment of high grade astrocytoma in children: results of a randomized trial. A report from the Children’s Cancer Study Group. J Neurooncol 1989; 7 : 165-177.
23) Freeman CR, Kepner J, Kun LE, Sanford RA, Kadota R, Mandell L et al. A detrimental effect of a combined chemotherapy-radiotherapy approach in children with diffuse intrinsic brainstem gliomas? Int J Radiat Oncol Biol Phys 2000; 47 : 561–564.
24) Sterba J, Pavelka Z, Slampa P. Concomitant radiotherapy and metronomic temozolomide in pediatric high-risk brain tumors. Neoplasma 2002; 49(2): 117-120.
25) Packer RJ, Prados M, Phillips P, Nicholson HS, Boyett JM, Goldwein J et al. Treatment of children with newly diagnosed brainstem gliomas with intravenous recombinant beta-interferon and hyperfractionated radiation therapy: a Children´s Cancer Group phase I/II study. Cancer 1996; 77 : 2150–2156.
26) Bello L, Carrabba G, Giussani C, Lucini V, Cerutti F, Scaglione F et al. Low-dose chemotherapy combined with an antiangiogenic drug reduces human glioma growth in vivo. Cancer Res 2001; 61(20): 7501-7506.
27) Fine HA, Figg WD, Jaeckle K, Wen PY, Kyritsis AP, Loeffler JS et al. Phase II trial of the angiogenic agent thalidomide in patients with recurrent high-grade gliomas. J Clin Oncol 2000; 18 (4): 708-715.
28) Joki T, Heese O, Nikas DC, Bello L, Zhang J, Kraeft SK et al. Expression of cyclooxygenase 2 (COX-2) in human glioma and in vitro inhibition by a specific COX-2 inhibitor, NS-398. Cancer Res 2000; 60 (17): 4926-4931.
29) Heimberger AB, Learn CA, Archer GE, McLendon RE, Chewning TA, Tuck FL et al. Brain tumors in mice are susceptible to blockade of Epidermal Growth Factor Receptor (EGFR) with the oral, specific, EGFR-Tyrosine Kinase Inhibitor ZD1839 (Iressa). Clin Cancer Res 2002; 8 (11): 3496-3435.
30) Fisher MJ, Adamson PC. Anti-angiogenic agents for the treatment of brain tumors. Neuroimaging Clin N Am 2002; 12 (4): 477-499.
31) Rutkowski S, De Vleeschouwer S, Kaempgen E, Wolff JE, Kuhl J, Demaerel P et al. Surgery and adjuvant dendritic cell/based tumour vaccination for patiens with relapsed malignant glioma, a feasibility study. Br J Cancer 2004; 91(9): 1656-1662.
32) Sterba J, Valik D, Mudry P, Kepak T, Pavelka Z, Bajciova V et al. Combined oral metronomic biodifferentiating and antiangiogenic therapy is feasible and clinically effective in relapsed solid tumors: Single institution pilot study of oral salvage/maintenance therapy for relapsed, primary refractory or very high-risk solid tumors in children. Karger Onkologie 2006; 29(7): 308-313.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2008 Issue 1
-
All articles in this issue
- Clinical use of antibodies in multiple sclerosis
- Idiopathic generalised epilepsies with typical absences in adults
- Diffuse brainstem gliomas in children. A nightmare for a paediatric oncologist.
- Safety of MRI in patients with metal implants and implanted devices
- Microscopic detection of Cryptococcus in the cerebrospinal fluid as the first symptom of the advanced stage of AIDS – a case study
- Myastenia with Positive Anti-MuSk-positive Antibodies in a Young Man: A Case Report
- Myasthenia gravis
- The Impact of L-DOPA and Entacapon Therapy on Plasma Level of Homocysteine in Parkinson’s Disease Patients
- The Effect of Low Doses of Mannitol on Serum Osmolality
- Mechanical embolectomy by means of the Merci retriever in patients with acute occlusion of brain arteries
- Carotid Endarterectomy and Carotid Angioplasty Stenting as Complementary Treatment Methods: Three Years Experience
- Agenesis of the lateral semicircular canal: a case study
- Optic neuritis caused by mucocele of paranasal sinuses – a casual link or a coincidence? A case study
- A case of multifocal steroid-responsive encephalitis as a cause of intractable frontal lobe seizures
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Safety of MRI in patients with metal implants and implanted devices
- Diffuse brainstem gliomas in children. A nightmare for a paediatric oncologist.
- Myasthenia gravis
- Clinical use of antibodies in multiple sclerosis
