Etiopatogeneze a diagnostika progresivní multifokální leukoencefalopatie u pacientů léčených natalizumabem
Etiopathogenesis and diagnostics of progressive multifocal leukoencephalopathy in patients treated with natalizumab
Etiologickým agens progresivní multifokální leukoencefalopatie (PML) je polyomavirus JCV (John Cunnigham virus). PML se vyskytuje u imunosuprimovaných pacientů vč. pacientů s RS léčených imunomodulačními léky. Aktivace JCV v nervovém systému a rozvoj PML je výsledkem dysregulace zahrnující genetické a imunitní buněčné mechanizmy. Z klinického pohledu je při léčbě natalizumabem přínosem vypracování léčebného algoritmu zohledňujícího míru rizika PML s ohledem na délku léčby, předchozí užívání imunosupresiv a hodnotu protilátkového indexu JCV. Současně s využitím MR lze diagnózu PML stanovit v preklinické fázi onemocnění a zlepšit prognózu onemocnění.
Keywords:
etiopathogenesis – progressive multifocal leukoencephalopathy – natalizumab
Authors:
P. Štourač 1; J. Bednářová 2; Z. Pavelek 3
Authors‘ workplace:
Neurologická klinika LF MU a FN Brno
1; Oddělení klinické mikrobiologie, FN Brno
2; Neurologická klinika LF UK, a FN Hradec Králové
3
Published in:
Cesk Slov Neurol N 2021; 84/117(2): 135-138
Category:
Review Article
doi:
https://doi.org/10.48095/cccsnn2021135
Overview
Etiologickým agens progresivní multifokální leukoencefalopatie (PML) je polyomavirus JCV (John Cunnigham virus). PML se vyskytuje u imunosuprimovaných pacientů vč. pacientů s RS léčených imunomodulačními léky. Aktivace JCV v nervovém systému a rozvoj PML je výsledkem dysregulace zahrnující genetické a imunitní buněčné mechanizmy. Z klinického pohledu je při léčbě natalizumabem přínosem vypracování léčebného algoritmu zohledňujícího míru rizika PML s ohledem na délku léčby, předchozí užívání imunosupresiv a hodnotu protilátkového indexu JCV. Současně s využitím MR lze diagnózu PML stanovit v preklinické fázi onemocnění a zlepšit prognózu onemocnění.
Klíčová slova:
etiopatogeneze – progresivní multifokální leukoencefalopatie – natalizumab
Úvod
John Cunnigham virus (JCV) je cirkulární dvoušroubovnicový DNA polyomavirus, který byl poprvé izolován z mozkové tkáně pacienta s Hodgkinovou nemocí v roce 1971 [1]. Jedná se o etiologické agens progresivní multifokální leukoencefalopatie (PML) poprvé popsané Äströmem et al v roce 1958 [2]. Je známo, že většina světové populace je tímto neurotropním polyomavirem latentně infikována [3]. Primární JCV infekce se obvykle vyskytuje v prvních dvou dekádách života a séroprevalence s věkem narůstá [4]. Vazba na různé typy buněk se uskutečňuje receptorovým mechanizmem. N-glykoprotein s á-(2,6) vázanou sialovou kyselinou je jedním z těchto buněčných receptorů a dalším receptorem je serotoninergní 5-HT 2á receptor umožňující infekci astrocytů, epiteliálních buněk ledvin, B-lymfocytů a gliových buněk in vivo [4]. Virová DNA obsahuje jednak regulační geny spojené s virovou transformací, genovou regulací a replikací, jednak geny strukturální, které kódují proteiny virové kapsidy. Uvedené geny jsou odděleny nekódující regulační oblastí, která je nejvariabilnější částí virového genomu a obsahuje promotorové geny [5].
U imunokompromitovaných pacientů, zejména u pacientů s infekcí HIV a u pacientů léčených monoklonálními protilátkami s imunosupresivním účinkem v různých indikacích, může dojít k reaktivaci JCV a následné infekci oligodendrocytů produkujících myelin v CNS. Tento proces vede k destrukci oligodendrocytů s rozsáhlou demyelinizací nervového systému a vzniká tak klinický obraz PML. I když je dlouhodobě známo, že JCV je původcem PML, mechanizmy jeho latence a aktivace jak u zdravých, tak u imunokompromitovaných jedinců nejsou plně objasněny. PML postihuje dospělé a výjimečně i dětské pacienty. Zpočátku se onemocnění nejčastěji prezentuje neuropsychiatrickými symptomy, poruchami zraku a centrální hemiparézou. Strukturálně jsou léze lokalizovány hemisferálně poblíž kortikálních struktur a jsou tvořeny zvětšenými oligodendrocyty a astrocyty s velkými vícečetnými jádry. Přirozený průběh onemocnění je progresivní, s mortalitou cca 20 %. V oblasti autoimunitních onemocnění, zejména u RS, Crohnovy nemoci, psoriázy a revmatoidní artritidy, je výskyt PML registrován u pacientů léčených natalizumabem, efalizumabem a rituximabem a v menší míře i u některých dalších monoklonálních protilátek. Objasnění interakce mezi JCV a imunitním systémem za fyziologických i patofyziologických podmínek je předpokladem úspěšné léčby tohoto onemocnění [6].
Patofyziologie PML
Přenos JCV a imunitní odpověď jsou předmětem aktuálního výzkumu. Kolem 80 % dospělé populace je séropozitivní a přítomnost JCV DNA v B lymfocytech a v buňkách stromatu tonzil naznačují, že tonzily jsou primárním místem virové infekce [7]. Virus se dostane do horních dýchacích cest kapénkovou nákazou nebo kontaminovaným předmětem a hematogenní cestou se rozšíří do míst sekundární infekce, jako jsou ledviny, kostní dřeň, lymfatická tkáň a mozek, kde vzniknou ložiska perzistující infekce [8]. Existují i alternativní cesty přenosu, např. transplacentární, krevní transfúzí, spermatem a orgánovou transplantací [9]. Imunologická kontrola JCV je zprostředkována především buněčnou imunitní odpovědí. Cytotoxické CD8+ T lymfocyty rozpoznávají epitopy proteinů viru prezentované pomocí HLA třídy I a omezují tak šíření viru. Cytotoxické CD8+ lymfocyty jsou v patologických lézích PML a jsou agregovány kolem infikovaných buněk [10]. Specifické CD4+ T lymfocyty byly detekovány v krvi pacientů, kteří přežili PML, a počet těchto buněk koreloval s náloží JCV v mozkomíšním moku [11]. Pokud dojde k imunosupresi se snížením subpopulací CD8+ a CD 4+ lymfocytů, jako je tomu u HIV infekce nebo imunomodulační terapie (natalizumab a další), JCV vstupuje do mozku buď v B-buňkách nebo volně a infikuje a destruuje oligodendrocyty s následnou demyelinizací. Ztráta této buněčné imunologické surveillance (dohledu) vede ke zvýšené aktivaci transkripčních faktorů, zejména NFAT 4 (nuclear factor of activated T cells) a NFêB (nuclear factor kappaB), které jsou pod vlivem prozánětlivých cytokinů a vedou k transkripci genů JCV [12,13]. Naopak C/ EBPâ (family transcription factors controlling the ACC-alpha gene expression) potlačuje transkripci JCV v odpovědi na prozánětlivý cytokin TNF-á. Vzájemné působení mezi pozitivním účinkem NF-êB a negativním účinkem C/ EBPâ na genovou transkripci JCV může být klíčovým faktorem v rovnováze mezi latencí JCV a reaktivací JCV lokalizovaného v oligodendrocytech a astrocytech. Jejich aktivace zánětlivými cytokiny umožňuje virovou expresi a replikaci viru [14]. B-lymfocyty mohou rovněž hrát důležitou roli v patogenezi PML jako rezervoár JCV a na základě skutečnosti, že při léčbě natalizumabem došlo ke změnám transkripčních faktorů při B-lymfocytární proliferaci s ovlivněním transkripce JCV vč. transkripčního faktoru Spi-B [15]. I když je dysfunkce imunitního systému klíčovým předpokladem rozvoje PML, výrazný rozdíl mezi vysokou prevalencí JCV a nízkou incidencí PML nabízí i možnost specifických charakteristik JCV, které jsou významné v progresi od asymptomatické JCV infekce k PML. Povrchový virový protein VP1 (viral protein 1) je významný faktor v infekčnosti JCV. Gen VP1 je vysoce polymorfní a v současnosti je identifikováno 13 podtypů. Mutace VP1 na pozicích 55 a 269 významně mění receptorově vazebné vlastnosti viru, které mohou podpořit invazi viru do CNS omezením vazby na receptory v periferii a být dalším významným faktorem v patogenezi PML [16].
Imunomodulační léčba natalizumabem a PML
Progresivní multifokální leukoencefalopatie, která se vyskytuje při léčbě autoimunitních chorob monoklonálními protilátkami, přináší otázky ohledně bezpečnosti této léčby a také poskytuje nové informace ohledně patogeneze PML. Natalizumab (Tysabri, Biogen, Ženeva, Švýcarsko) je monoklonální protilátka používaná v léčbě relaps remitentní RS vázající se na buněčnou adhezivní molekulu VLA-4 (very late antigen -4) a á4â7 integriny na hematopoetických buňkách. Tato vazba zabraňuje adhezi aktivovaných lymfocytů na vaskulární buněčnou adhezivní molekulu (vascular cell adhesion molecule; VCAM), a tak zabraňuje jejich přestupu přes hematoencefalickou bariéru. Protože léčba natalizumabem není spojena s jinými oportunními infekcemi kromě PML, musí existovat specifický mechanizmus, který vede ke vzniku PML. Natalizumab se váže na CD34+ hematopoetické prekurzorové buňky, zvyšuje jejich počet v krvi a kostní dřeni a rovněž zvyšuje počet B-lymfocytů obsahujících transkripční faktor Spi-B v periferii, a tak může zvyšovat riziko aktivace JCV [17]. Tyto změny vytvářejí příhodné prostředí pro JCV v latentním stavu v kostní dřeni, kdy může dojít za pomoci B-lymfocytů k virové replikaci. Zabránění vstupu dendritických buněk a CD4+ lymfocytů a B-lymfocytů do CNS může vést k dramatickému snížení imunosurveillance. U většiny pacientů, kteří vyvinuli PML při léčbě natalizumabem, došlo po obnovení imunokompetence k rozvoji syndromu IRIS (immune reconstitution inflammatory syndrome), který zvyšuje morbiditu a mortalitu onemocnění. IRIS je způsoben rychlým obnovením T-lymfocytární populace po odstranění natalizumabu (plazmaferéza, imunoadsorpce) a vede k masivnímu přestupu specifických lymfocytů přes hematoencefalickou bariéru a k masivní infiltraci lézí PML cytotoxickými CD8+ lymfocyty. Léčba plazmaferézou s cílem odstranit natalizumab a rekonstituovat imunitní systém neprokázala zlepšení v přežití a klinických parametrech a je doporučena obezřetnost při jejím použití v budoucnosti, nicméně IRIS není považován za důsledek léčby plazmaferézou. V současnosti není k dispozici specifická antivirová léčba při výskytu PML.
Laboratorní diagnostika JCV
Infekce JCV je předpokladem rozvinutí PML. Pro detekci protilátek JCV v séru byla vytvořena v roce 2012 dvoukroková ELISA (enzyme–linked immunosorbent assay) druhé generace s vysokou senzitivitou a specificitou. JCV protilátkový index se vypočítá jako poměr optické denzity protilátek detekovaných metodou ELISA v séru pacienta a optické denzity kontrolního vzorku sér získaných od anti-JCV pozitivních zdravých dárců. Metoda je schopna detekovat koncentrace 1,7 ng/ ml s využitím humanizované monoklonální protilátky anti-JCV se senzitivitou 97,5 %. Specificita metody byla testována za použití příbuzného BK polyomaviru, který má 80% homologii s JCV, a činí 95 % [19,20]. Metodou pro detekci JCV v likvoru je metoda polymerázové řetězové reakce (polymerase chain reaction; PCR), která detekuje JCV DNA v mozkomíšním moku s extrémně vysokou specificitou [21]. Přestože se metoda PCR neustále zlepšuje, je nutné si být vědom i negativního průkazu DNA JCV v mozkomíšním moku, a to i u pacienta s prokázanou PML v důsledku nízkého počtu kopií. Přítomnost viru v mozkomíšním moku nekoreluje jednoznačně s přítomností DNA JCV v mozkové tkáni [22].
Aktuální výskyt PML u pacientů léčených natalizumabem
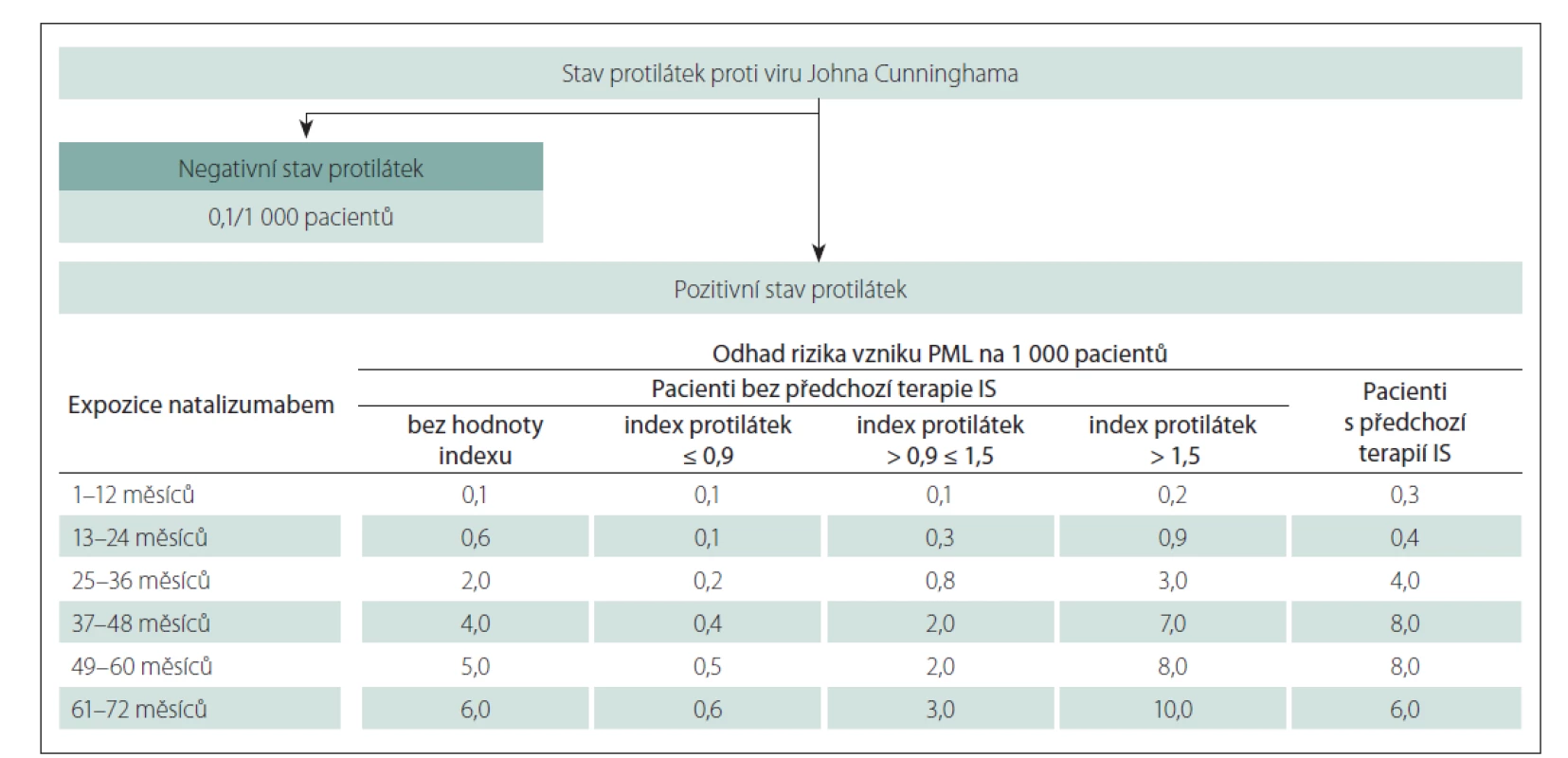
Natalizumab je vysoce účinným lékem u RS. Natalizumab je humanizovaná monoklonální protilátka, která se selektivně váže na á4 podjednotku á4â1 - a á4â7-integrinů exprimovaných na povrchu lidských leukocytů. Natalizumab je schválen k léčbě relabujicí-remitentní RS. Natalizumab signifikantně redukuje roční počet relapsů (relapse rate) o 68 % (p < 0,001), riziko potvrzené progrese disability o 42 % (p < 0,0001) a akumulaci nových T2 hyperintenzních a rozšiřujících se ložisek v mozku v obraze MR o 83 % (p < 0,001) ve srovnání s placebo skupinou a rovněž snižuje progresi mozkové atrofie [23]. Léčba je však spojena se zvýšeným rizikem vzniku PML. V současnosti jsou známé rizikové faktory spojené s léčbou natalizumabem. Jsou to délka léčby natalizumabem více než 2 roky, pozitivní specifický protilátkový index JCV-AI (JCV antibody index) a předchozí léčba imunosupresivy, např. azathioprinem. K datu 2. března 2020 byla globální kumulativní incidence PML ve spojitosti s léčbou natalizumabem 3,99/ 1 000 pacientů (95 % CI 3,73–4,27/ 1 000 pacientů). K uvedenému datu bylo evidováno 832 potvrzených případů PML, 829 případů s léčenou RS, 3 pacienti s diagnózou Crohnovy choroby, z toho 76 % pacientů onemocnění PML přežilo s různým stupněm disability. Ke stejnému datu byl počet dávek natalizumabu od zahájení léčby do rozvoje PML v rozmezí od 8 do 148 dávek, průměrná doba do rozvoje PML tak byla 51 měsíců [24]. Vzhledem k tomu, že do klinické praxe byl zaveden princip stratifikace rizika na základě výše uvedených parametrů, je zajímavé sledovat vývoj incidence PML u pacientů léčených natalizumabem v čase. Byly publikovány výsledky potvrzující skutečnost, že celková incidence PML při léčbě natalizumabem je od roku 2016 stabilní. Tato stabilizace je v časové koincidenci se zavedením principů stratifikace rizika do klinické praxe od roku 2016. Největší nárůst incidence PML byl letech 2009–2013. Z přiložené tabulky stratifikace rizika (obr. 1) vyplývá, že pokud je JCV protilátkový index ≤ 0,9, je rozmezí rizika rozvoje PML 0,1–0,6/ 1 000 pacientů. Pokud je protilátkový index v rozmezí > 0,9 ≤ 1,5, pak je míra rizika rozvoje PML 0,1–3/ 1 000 pacientů, a pokud je hodnota protilátkového indexu > 1,5, pak je riziko rozvoje PML v rozmezí 0,2–10/ 1 000 pacientů léčených natalizumabem. Pokud je pacient ve skupině s nejvyšší mírou rizika, provádíme kontrolní vyšetření MR mozku každé 3 měsíce, pokud je ve střední míře rizika, provádíme vyšetření alespoň dvakrát ročně, a u pacientů ve skupině s nejnižší mírou rizika jedenkrát ročně. Při dodržení tohoto bezpečnostního algoritmu je vyšší pravděpodobnost záchytu PML v asymptomatické fázi s lepšími klinickými výsledky. V ČR bylo v období 2009–2018 diagnostikováno celkem 14 případů PML u pacientů s RS léčených natalizumabem, jejichž klinická a radiologická charakteristika byla publikována [25]. Stratifikace rizika a pravidelné vyšetření pacientů MR vedou k zajištění maximální bezpečnosti této jinak vysoce účinné léčby [26]. Další alternativou ke zvýšení bezpečnosti léčby natalizumabem – při zachované účinnosti – je prodloužení intervalu podávání ze 4 na 6 týdnů ověřené v souboru 25 pacientů při očekávání potvrzení výsledků tohoto léčebného schématu na základě evropské multicentrické randomizované studie [27].
IS – imunosupresiva; PML – progresivní multifokální leukoencefalopatie
Fig. 1. PML risk estimation algorithm.
IS – immunosuppressants; PML – progressive multifocal leucoencephalopathy
Závěr
John Cunnigham virus je polyomavirus způsobující závažné onemocnění PML. Etiopatogeneze tohoto onemocnění není plně prozkoumána, ale je zřejmé, že mutace viru a imunitní dysregulace zejména v buněčných subpopulacích jsou významnými faktory. Léčba RS natalizumabem přes svoji vysokou účinnost přináší specifické riziko vzniku PML. Toto riziko může být významně sníženo za použití algoritmu stratifikace rizika. Další poznatky v etiopatogenezi onemocnění mohou nakonec vést k eliminaci této závažné komplikace.
Grantová podpora
Tato práce byla podpořena MZČR, RVO(FNBr,65269705).
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů
doc. MUDr. Pavel Štourač, Ph.D.
Neurologická klinika
LF MU a FN Brno
Jihlavská 340/20
625 00 Brno
e-mail: stourac.pavel@fnbrno.cz
Přijato k recenzi: 10. 9. 2020
Přijato do tisku: 16. 4. 2021
Sources
1. Padgett BL, Walker DL, ZuRhein GM et al. Cultivation of papova-like virus from human brain with progressive multifocal leucoencephalopathy. Lancet 1971; 1(7712): 1257–1260. doi: 10.1016/ s0140-6736(71)91777-6.
2. Åström KE, Mancall EL, Richardson EP Jr et al. Progressive multifocal leuko-encephalopathy, a hitherto unrecognized complication of chronic lymphatic leukaemia and Hodgkin’s disease. Brain 1958; 81(1): 93–111. doi: 10.1093/ brain/ 81.1.93.
3. Knowles WA, Pipkin P, Andrews N et al. Population-based study of antibody to the human polyomaviruses BKV and JCV and the simian polyomavirus SV40. J Med Virol 2003; 71(1): 115–123. doi: 10.1002/ jmv.10450.
4. Brew BJ, Davis NW, Cinque P et al. Progressive multifocal leukoencephalopathy and other forms of JC virus disease. Nat Rev Neurol 2010; 6(12): 667–679. doi: 10.1038/ nrneurol.2010.164.
5. Pietropaolo V, Videtta M, Fioriti D et al. Rearrangement patterns of JC virus noncoding control region from different biological samples. J Neurovirol 2003; 9(6): 603–611. doi: 10.1080/ 13550280390246507.
6. Major EO. Progressive multifocal leukoencephalopathy in patients on immunomodulatory therapies. Annu Rev Med 2010; 61 : 35–47. doi: 10.1146/ annurev.med.080708.082655.
7. Monaco MC, Jensen PN, Hou J et al. Detection of JC virus DNA in human tonsil tissue: evidence for site of initial viral infection. J Virol 1998; 72(12): 9918–9923. doi: 10.1128/ JVI.72.12.9918-9923.1998.
8. Chapagain ML, Nerurkar VR. Human polyomavirus JC (JCV) infection of human B lymphocytes: a possible mechanism for JCV transmigration across the blood-brain barrier. J Infect Dis 2010; 202(2): 184–191. doi: 10.1086/ 653823.
9. Jiang M, Abend JR, Johnson SF et al. The role of polyomaviruses in human disease. Virology 2009; 384(2): 266–273. doi: 10.1016/ j.virol.2008.09.027.
10. Lima MA, Marzocchetti A, Autissier P et al. Frequency and phenotype of JC virus – specific CD8+ T lymphocytes in the peripheral blood of patients with progressive multifocal leukoencephalopathy. J Virol 2007; 81(7): 3361–3368. doi: 10.1128/ JVI.01809-06.
11. Tan CS, Koralnik IJ. Progressive multifocal leukoencephalopathy and other disorders caused by JC virus: clinical features and pathogenesis. Lancet Neurol 2010; 9(4): 425–437. doi: 10.1016/ S1474-4422(10)70040-5.
12. Manley K, O’Hara BA, Gee GV et al. NFAT4 is required for JC virus infection of glial cells. J Virol 2006; 80(24): 12079–12085. doi: 10.1128/ JVI.01456-06.
13. Wollebo HS, Safak M, Del Valle L et.al. Role for tumor necrosis factor-alfa in JC virus reactivation and progressive multifocal leukoencephalopathy. J Neuroimmunol 2011; 233(1–2): 46–53. doi: 10.1016/ j.jneuroim.2010.11.013.
14. Perez-Liz G, Del Valle L, Gentilella A et al. Detection of JC virus DNA fragments but not proteins in normal brain tissue. Ann Neurol 2008; 64(4): 379–387. doi: 10.1002/ ana.21443.
15. Lindberg RL, Achtnichts L, Hoffmann F et al. Natalizumab alters transcriptional expression profiles of blood cell subpopulations of multiple sclerosis patients. J Neuroimmunol 2008; 194(1–2): 153–164. doi: 10.1016/ j.jneuroim.2007.11.007.
16. Gorelik L, Reid C, Testa M et al. Progressive multifocal leukoencephalopathy (PML) development is associated with mutations in JC virus capsid protein VP1 that change its receptor specificity. J Infect Dis 2011; 204(1): 103–114. doi: 10.1093/ infdis/ jir198.
17. Marshall LJ, Dunham L, Major EO. Transcription factor Spi-B binds unique sequences present in the tandem repeat promoter/ enhancer of JC virus and support viral activity. J Gen Virol 2010; 91(12): 3042–3052. doi: 10.1099/ vir.0.023184-0.
18. Tan IL, McArthur JC, Clifford DB et al. Immune reconstitution inflammatory syndrome in natalizumab – associated PML. Neurology 2011; 77(11): 1061–1067. doi: 10.1212/ WNL.0b013e31822e55e7.
19. Plavina T, Bergman M, Njenga M et al. Multi-site analytical validation of an assay to detect anti-JCV antibodies in human serum and plasma. J Clin Virol 2012; 53 : 65–71. doi: 10.1016/ j.jcv.2011.10.003.
20. Lee P, Plavina T, Castro A et al. A second-generation ELISA (Stratify JCV™ DxSelect™) for detection of JC virus antibodies in human serum and plasma to support progressive multifocal leukoencephalopathy risk stratification. J Clin Virol 2013; 57(2): 141–146. doi: 10.1016/ j.jcv.2013.02.002.
21. Cinque P, Scarpellini P, Vao L et al. Diagnosis of central nervous system complications in HIV-infected patients: cerebrospinal fluid analysis by the polymerase chain reaction AIDS 1997; 11(1): 1–17. doi: 10.1097/ 00002030-199701000-00003.
22. Marzocchetti A, Di Giambenedetto S, Cingolani A et al. Reduced rate of diagnostic positive detection of JC virus DNA in cerebrospinal fluid in cases of suspected progressive multifocal leukoencephalopathy in the era of potent antiretroviral therapy. J Clin Microbiol 2005; 43(8): 4175–4177. doi: 10.1128/ JCM.43.8.4175-4177.2005.
23. Polman CH, O’Connor PW, Havrdova E et al. A randomized, placebo-controlled trial of natalizumab for relapsing multiple sclerosis. N Engl J Med 2006; 354(9): 899–910. doi: 10.1056/ NEJMoa044397.
24. Global Natalizumab (Tysabri) Postmarketing PML Update. Updated March 2020, Biogen Tysabri (Natalizumab). [online]. Available from URL: https:/ / www.tysabrihcp.com/ .
25. Vaněčková M, Martinková A,Tupý R et al. Spektrum MR nálezů progresivní multifokální leukoencefalopatie u kohorty pacientů s roztroušenou sklerózou v ČR. Cesk Slov Neurol N 2019; 82/ 115(4): 381–390. doi: 10.14735/ amcsnn2019381.
26. Giovannoni G, Kappos L, Berger J et al. Incidence of natalizumab associated progressive multifocal leukoencephalopathy and Its relationship with the pattern of natalizumab exposure over time. ECTRIMS Online Library. Giovannoni G. 10/ 10/ 18; 228448; P604.
27. Petržalka M, Meluzínová E, Mojžíšová H et al. Efektivita prodlouženého dávkovacího intervalu natalizumabu u pacientů s roztroušenou sklerózou. Cesk Slov Neurol N 2020; 83/ 116(1): 79–83. doi: 10.14735/ amcsnn202079.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2021 Issue 2
Most read in this issue
- Mortonova neuralgie, metatarzalgie
- Nemoc moyamoya
- Správná a chybná pojmenování obrázků pro náročnější test písemného Pojmenování obrázků a jejich vybavení (dveřní POBAV)
- Etiopatogeneze a diagnostika progresivní multifokální leukoencefalopatie u pacientů léčených natalizumabem
