Mechanizmy spasticity a její hodnocení
Mechanisms of Spasticity and its Assessment
Spasticity is one of the complex motor system disorders and is a sign of central motor neuron disorder caused by trauma, ischemia or haemorrhage, inflammation, degenerative process or tumour. Spasticity is a symptom associated with a lesion within the central motor neuron. In addition to increased muscle activity, muscle contraction and paresis also occurs. Voluntary movement is associated with co-contractions and synkinesis, adversely affecting dexterity and muscle strength. Flexor and extensor spasms also have a negative effect. There are two types of spasticity: cerebral and spinal. Cerebral lesions occur either above the level of brainstem or at the level of brainstem. Due to these lesions, cerebral cortex looses its control over the inhibitory structures of the brainstem. Spinal lesions lead to severe spastic dystonia with predominant involvement of flexors. An objective examination is required to assess the type and degree of spasticity. An objective examination should be performed at the start of treatment and it is the main parameter determining further management. Routine clinical practice mainly relies on clinical evaluation scales. Neurophysiological, physical and biochemical methods are used less frequently and mainly at specialised centres. Rather than complete amelioration of spasticity, the aim of treatment is to alleviate its negative effects on activities that limit the patient. Achievable aims should be set by the patient and the physician at the initiation of treatment. Rehabilitation has a crucial role in the treatment of patients with spasticity. Pharmacotherapy is used, also due to uncomplicated application. Owing to its high efficacy and low incidence of adverse effects, botulinum toxin has an exclusive place in the treatment of focal spasticity. Administration of baclofen via intrathecal pump systems has been proven as highly effective in patients with severe generalized spasticity. New technologies and new treatment modalities, including advanced use of robots, are being developed.
Key words:
spasticity – pathophysiological mechanisms – central motor neuron syndrome – evaluation of spasticity – rehabilitation – botulinum toxin – intrathecal baclofen
Autoři:
I. Štětkářová
Vyšlo v časopise:
Cesk Slov Neurol N 2013; 76/109(3): 267-280
Kategorie:
Minimonografie
Souhrn
Spasticita se řadí ke komplexním poruchám motoriky. Je projevem poruchy centrálního motoneuronu, jehož příčinou je trauma, ischemie nebo hemoragie, zánět, degenerativní proces či nádor. Spasticita je jedním z příznaků, který doprovází lézi centrálního motoneuronu. Jeho další součástí je kromě zvýšené svalové aktivity zkrácení svalu a paréza. Při volním pohybu se objevují ko ‑ kontrakce a synkinézy, které nepříznivě ovlivňují zručnost a svalovou sílu. Negativní vliv mají flexorové a extenzorové spazmy. Rozlišujeme dva typy spasticity: cerebrální a spinální. U cerebrálních lézí je možno diferencovat léze nad úrovní kmene a léze v úrovni mozkového kmene. Dochází ke ztrátě vlivu mozkové kůry na kmenové inhibiční struktury. U spinálních lézí je přítomna spastická dystonie těžkého stupně a převažuje postižení flexorů. Pro posouzení typu a stupně spasticity je nezbytné objektivní vyšetření. Je důležité na začátku léčby a je výchozím parametrem určujícím směr další terapie. V běžné praxi se hlavně používají klinické hodnotící škály. Neurofyziologické, fyzikální a biochemické metody se uplatňují méně a většinou na specializovaných pracovištích. Cílem léčby spasticity není její úplné odstranění, ale zmírnění negativního vlivu při aktivitách, které nemocného omezují. Na začátku léčby je nutné stanovit reálné cíle, jichž chce pacient a lékař dosáhnout. Rehabilitace hraje v organizaci péče o tyto pacienty nezastupitelnou roli. Nejčastějším a také nejjednodušším způsobem léčby spasticity je farmakoterapie. Botulotoxin má v léčbě fokální spasticity své výlučné místo díky vysoké efektivitě a nízkému výskytu nežádoucích účinků. U těžké generalizované spasticity je prokázán velmi dobrý efekt podávání intratékálního baklofenu pumpovými systémy. Rozvíjejí se nové technologie a nové léčebné modality včetně robotizace.
Klíčová slova:
spasticita – patofyziologické mechanizmy – syndrom centrálního motoneuronu – hodnocení spasticity – rehabilitace – botulotoxin – intratékální baklofen
Úvod
Spasticita se řadí ke komplexním poruchám motoriky a označuje se termínem „spastic movement disorder“ [1]. Je projevem poruchy centrálního motoneuronu, jehož příčinou je trauma, ischemie nebo hemoragie, zánět, degenerativní proces či nádor. Spasticitu ale nelze oddělovat od jiných příznaků centrální poruchy hybnosti, které jsou následkem poškození pyramidového i extrapyramidového systému [1 – 5].
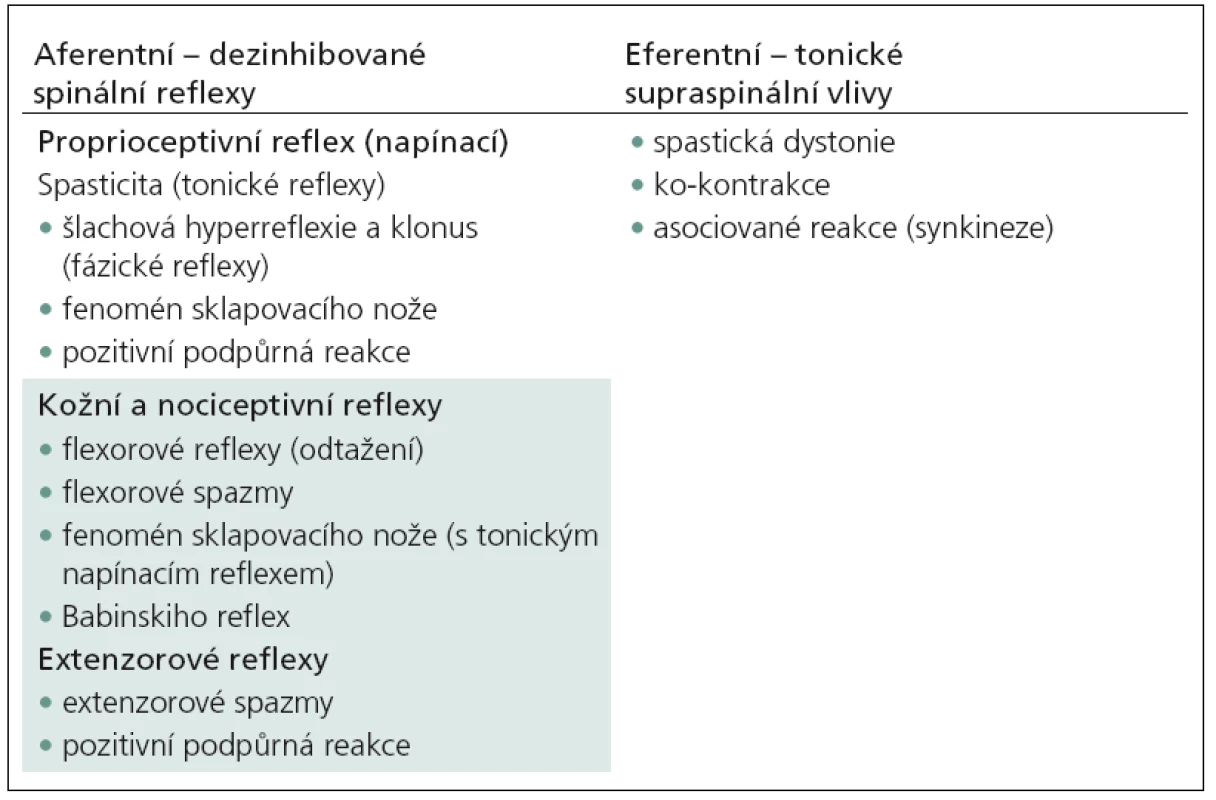
Sama definice a přesné vymezení pojmu jsou problematické. Pod pojem „spasticita“ se zahrnují všechny klinické projevy, které poruchu centrálního motoneuronu doprovázejí. Hovoříme o spasticitě v širším slova smyslu, což je v rozporu s původní klasickou definicí podle Lanceho [6],tj. „zvýšení svalového tonu, které se projeví při rychlém protažení svalu“. Tato definice byla podrobena kritice zejména proto, že popisuje spasticitu pouze jako nadměrný svalový hypertonus [2 – 4]. Spasticita je jen jedním z příznaků, která lézi centrálního motoneuronu doprovází. Většina z nich se týká spinálních jevů (hyperreflexie, klonus, nadměrné únikové reakce), jež vznikají díky poruše suprasegmentálních inhibičních mechanizmů [1].V tab. 1 je uvedena podrobná klasifikace pozitivních příznaků u syndromu centrálního motoneuronu na podkladě patofyziologických mechanizmů. Rozdělena je podle aferentních dezinhibovaných míšních reflexů a eferentních tonických supraspinálních vlivů.
Rostrálně v oblasti kmene jsou centra ovlivňující a řídící svalový tonus [7]. Důležitou roli mají vestibulospinální a retikulospinální dráhy. Vliv má i mnoho dalších faktorů, např. lokalizace a rozsah poruchy pyramidové dráhy, rychlost vzniku léze, současné postižení dalších centrálních descendentních drah [8]. Základem je porucha pyramidové a parapyramidové dráhy, která začíná v suplementární motorické korové oblasti. Dochází k dysbalanci řízení motoriky na úrovní míšního segmentu, doprovázené nadměrnou funkcí gama‑kličky, jež představuje základní mechanizmus zvýšeného svalového tonu.
Tento klinický syndrom se nazývá syndrom centrálního motoneuronu. Jeho součástí je kromě zvýšené svalové aktivity také zkrácení svalu a paréza (tab. 2). Zvýšená svalová aktivita zhoršuje parézu a přispívá ke zkracování svalu, zkracování svalu zvýrazňuje oslabení a zesiluje svalovou aktivitu [9]. Jde o začarovaný kruh podmíněný řadou zpětných vazeb. Za klidového stavu jde především o spastickou dystonii, která vede k abnormálnímu držení paretické končetiny [10 – 12]. Při volním pohybu se objevují ko ‑ kontrakce a synkinézy, jež nepříznivě ovlivňují zručnost a svalovou sílu. Negativní vliv mají také flexorové a extenzorové spazmy. O jednotlivých součástech syndromu centrálního motoneuronu budeme hovořit dále.
![Charakteristické rysy syndromu centrálního motoneuronu, modifikováno dle Sheeana 2002 [1] a Barnese 2001 [2].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/c4af2aaa2c6032b90321e4bb40058577.png)
Senzomotorická integrace
Jedním ze základních projevů člověka je jeho pohyb v okolním prostředí. Neustále se hýbeme, chodíme, stojíme nebo vykonáváme jiné specializované činnosti. Každý pohyb je výsledkem složité senzomotorické integrace na různých úrovních. Tam řadíme základní reflexní děje spojené se změnou napětí a délky svalu až po složitou organizaci komplexního volního pohybu. V centrálním nervovém systému se na této integraci podílejí jednotlivé úrovně různou měrou (kůra, podkoří, kmen, mícha).
Napínací reflex
Základním pohybovým reflexem je napínací reflex („stretch ‑ reflex“), který je vyvolán náhlým protažením svalu. Vzniká podrážděním svalového vřeténka. Vzruch se vede aferentními vlákny k alfa‑motoneuronu příslušného svalu v míše. Tento reflex je nezbytný pro zajištění a řízení svalového tonu. Je základním předpokladem tvorby všech pohybů a zachování vzpřímené polohy těla. Bazální lokomoční vzorec – dvojkrok – je naprogramován v míšních strukturách. Jde o tzv. míšní pacemaker, který má vlastní autonomní funkci, ale podléhá supraspinálním vlivům. Vzpřímená poloha se udržuje pomocí řady složitých míšních, šíjových a labyrintových reflexů s nadřazenou kontrolou supraspinálními mechanizmy (mozeček, retikulární formace, vestibulární a extrapyramidový systém).
Při pohybu, stoji nebo určité poloze jsou svaly neustále napínány a jejich délka se mění. Změna délky svalu a jeho napětí dráždí svalové a šlachové receptory, tj. svalová vřeténka a šlachová tělíska. Střední část svalového vřeténka obsahuje senzitivní zakončení, která jsou citlivá na protažení svalu. Koncové části svalového vřeténka jsou inervovány gama‑motoneurony, jež jsou uloženy v míše. Gama systém reguluje dráždivost svalových vřetének a přizpůsobuje se změnám v délce svalu. Funkční koordinace tohoto systému je zajišťována descendentním systémem retikulární formace v pontu.
Podráždění šlachových tělísek vyvolává podráždění inhibičních míšních interneuronů a jejich vlivem dochází k útlumu alfa‑motoneuronů příslušného svalu tak, aby nenastalo poškození z přetížení. Jedná se o tzv. inverzní napínací reflex, který je charakterizován ochabnutím svalu v závislosti na extrémním napnutí. Současně jsou aktivovány i alfa‑motoneurony antagonistických svalů [13].
Supraspinální mechanizmy
Významný podíl aferentních podnětů přichází z vyšších oblastí CNS [14]. Centripetálně směřující axony tvoří synapse s excitačními nebo inhibičními interneurony v oblasti předních rohů míšních. Přímé centrální monosynaptické dráhy, tvořené axony motorických buněk v mozkové kůře nebo v kmeni, ovlivňují přímo ty míšní motoneurony, které jsou zapojeny do flexorového nebo extenzorového reflexního oblouku. Směřují k nejdistálnějším svalům, např. na ruce. Současně s aktivací alfa‑motoneuronů, které působí na extrafuzální svalová vlákna vedoucí ke kontrakci, jsou drážděny i gama‑motoneurony, jež podmiňují zkracování intrafuzálních vláken ve svalovém vřeténku. Ze svalového vřeténka je zabezpečena zpětná vazba signálu k motoneuronu prostřednictvím silných myelinizovaných aferentních vláken Ia, která vytvářejí po rozvětvení excitační monosynaptické spoje s těmito motoneurony v předních rozích míšních, jež inervují příslušný sval a jeho synergisty. Druhá část tohoto rozvětvení přes inhibiční interneuron vytváří spojení s motoneurony, které inervují antagonisticky působící svaly [13]. Tak je zajištěn princip reciproční inhibice, jež je základem svalového pohybu v příslušném kloubu. Celý tento proces je ovlivňován a modulován centrálními descendentními drahami, které mají spoje s inhibičními interneurony Ia. Kromě těchto monosynaptických a bisynaptických spojení existují polysynaptická excitační spojení zejména na motoneuronech inervujících flexory. Přijímají informace z mnoha různých typů aferentních vláken, např. vláken bolesti, která po vstupu do míchy a po přepojení se na příslušné motoneurony vyvolají flexi končetiny, a ta se vzdálí od místa bolestivého podráždění. V oblasti předních rohů míšních jsou velmi komplexní, složitá a dynamická polysynaptická propojení mezi aferentními a eferentními vlákny, motoneurony a interneurony. Kromě dlouhých zpětnovazebných okruhů, které tvoří aferentní vlákna z periferie a centrální descendentní dráhy, existují v předních rozích míšních i krátké zpětnovazebné okruhy zprostředkované kolaterálami axonů motoneuronů. Kolaterály axonu mají spojení s inhibiční Renshawovou buňkou, jež má synapse buď přímo s motoneuronem, nebo prostřednictvím dalšího inhibičního interneuronu. Interneurony Ia mají inhibiční vliv na motoneuron a při spojení s Renshawovou buňkou může docházet k procesu snižování inhibice, tj. dezinhibičnímu procesu.
Spasticita
Spasticita je charakterizována zvýšením odporu při pasivním protažení svalu a tento odpor se zvětšuje při zvýšení rychlosti protažení. U delšího nebo většího svalu a při rychlejším nebo prudším protažení je spastická odpověď výraznější. Extrémní spastická odpověď může pasivní pohyb končetinou prakticky zastavit. Za klidového stavu spasticitu na pacientovi nevidíme. Výjimkou je klonus, který se manifestuje rytmickým opakováním napínacího reflexu.
Spasticita je přítomna u řady neurologických onemocnění (tab. 3). U chronického poranění mozku se spasticita vyskytuje u 25 – 30 % nemocných [15]. Častěji vzniká u závažných a těžkých úrazů mozku a u nemocných s lézí v oblasti kmene a podkoří [16]. Spasticita se po cévní mozkové příhodě (CMP) vyskytuje v širokém rozmezí 4 – 42,6 %, s prevalencí těžké spasticity mezi 2 a 13 % [17].Rovněž u roztroušené sklerózy se udává velmi značný výskyt spasticity, a to až u 80 – 85 % nemocných [18]. Až 40 % nemocných s chronickým míšním poraněním má středně těžký a těžký stupeň spasticity [19]. Spasticita se rovněž vyskytuje u mozkových a míšních nádorů, u zánětlivých afekcí centrálního nervového systému (myelitidy, encefalitidy), u neurodegenerativních onemocnění (amyotrofická laterální skleróza).

Spasticita se objevuje v různé intenzitě a v různé době od začátku poruchy [4,20,21]. Bohužel nelze dopředu odhadnout, u kterého pacienta a kdy se spasticita rozvine. V době mezi 1. a 4. týdnem po CMP je popsán výskyt spasticity již mezi 4 a 27 %. V 1. – 3. měsíci po CMP je spasticita vyjádřena u 19 – 26,7 % a v chronickém stadiu dokonce u 17 – 42,6 % [17]. Rok po míšním traumatu vyžaduje až 80 % nemocných některou z forem léčby spasticity [19]. Při výrazné spasticitě je omezen aktivní i pasivní pohyb v kloubu, dochází k změně viskoelasticity svalů i šlach a k náhradě kolagenním vazivem. Vznikají fixované svalové kontraktury. Při omezeném pohybu končetin se objevují deformity kloubů a osteoporóza.
Za fyziologických okolností jsou pohyby prováděny v jednotlivých segmentech vždy alespoň ve dvou směrech. Flexe v lokti je brzy následována extenzí předloktí, pronace se vzápětí mění v supinaci. U syndromu centrálního motoneuronu je regulace pohybu jiná a převažuje pohyb v jednom směru. Je přítomna snížená aktivace svalů při volních pohybech a naopak je výrazně zvýšena mimovolní svalová aktivita, která vede k vynucenému držení končetiny (např. Wernicke ‑ Mannovo držení u spastické hemiparézy).
Klinický obraz léze centrálního motoneuronu určuje její lokalizace, zejména postižení pyramidových i parapyramidových drah. Prvotní příčina je málo významná. Pyramidové dráhy začínají převážně v motorickém kortexu (Broadmanova area 4) a v premotorickém kortexu (area 6) a menší část vzniká v primární somatosenzorické kůře (arey 3, 1, 2) a v parietálním kortexu (arey 5 a 7). Při izolované poruše pyramidové dráhy (vycházející z arey 4 motorického kortexu) dochází pouze k paréze [22]. Postiženy jsou hlavně akrální končetinové svaly. Naproti tomu současná porucha vláken vycházejících z arey 4 i z premotorické oblasti (area 6) vede k rozvoji spasticity. Proto se část pyramidové dráhy vycházející z arey 6 nazývá parapyramidová dráha.
Spastická dystonie
Spastické dystonie si na pacientovi všimneme nejdříve. Na rozdíl od spasticity je přítomna v klidu, kdy se žádný volní pohyb nevykonává. Dystonie je měnlivá a zvyšuje se při protažení svalů, ale někdy se může při déle trvajícím pasivním protažením snížit [11,12]. Nemocní s lézí centrálního motoneuronu zaujímají různé pozice, které se mohou více podobat hemiparetické či dekortikační postuře. „Hemiplegická postura“ se vyznačuje flexí v lokti, zápěstí a prstech, addukce v rameni a pronací předloktí. Dolní končetina je extendována v kyčli a koleně, je plantární flexe s inverzí nohy a addukce stehna.
Flexorové a extenzorové spazmy
Typickým klinickým projevem zvýšené svalové aktivity u nemocných s lézí centrálního motoneuronu jsou flexorové a extenzorové spazmy. Původ mají ve zvýšených flexorových a extenzorových reflexech. Flexorové spazmy jsou časté u spinální léze. Tyto spazmy jsou provokovány zjevnými zevními stimuly (např. malá změna polohy nohy ve vozíku vyvolá současný spazmus flexorů kyčle, kolene i nártu), objevují se i bez výrazného podnětu (při výraznější náplni močového měchýře, stlačením močového katétru, roztažením rekta stolicí, u dekubitů). Extenzorové spazmy jsou rovněž provokovány zevními podněty. Na dolní končetině je typickým spazmem extenze kyčle, kolene a plantární flexe nártu nebo palce. Vyskytují se častěji u míšního poranění a u poranění hlavy. Svalové spazmy bývají velmi bolestivé. Někdy však pacient flexorové nebo extenzorové spazmy využije k pohybu, např. při otočení v posteli nebo při oblékání.
Ko‑kontrakce
Ko ‑ kontrakce jsou důležitým mechanizmem řízení hybnosti. Umožňují posturální stabilitu či fixaci určitého pohybového segmentu. Za normálních podmínek aferentní vlákna ze svalového vřeténka typu Ia inhibují alfa‑motoneurony antagonisty, a tím usnadňují pohyb v segmentu ve směru aktivity agonisty. U pacienta s poruchou centrálního motoneuronu dochází k poruše supraspinální kontroly této reciproční inhibice. Při volním pohybu nebo při pokusu o pohyb se objevují simultánní kontrakce agonistů a antagonistů ve stejném svalovém segmentu. Ko ‑ kontrakci si lze představit jako mobilní (fázickou) dystonii, která je superponována na spastickou (tonickou) dystonii přítomnou v klidu. Hyperaktivita antagonistů je podkladem nevyvážené kontrakce svalů, jež omezuje pohyby. Může dokonce vést k opačnému pohybu, než chtěl nemocný původně udělat. V konečném důsledku vzniká další oslabení již původně slabých agonistů.
Asociované motorické reakce
Jde o asociované pohyby, které doprovázejí volní pohyb. Analogickým termínem jsou „synkineze“ [23]. Na rozdíl od ko ‑ kontrakcí se synkineze vyskytují v jiných svalových segmentech než v těch, které jsou zapojeny do volního pohybu. U syndromu centrálního motoneuronu může být aktivita v jedné oblasti spojena s nepotřebnou mimovolní aktivitou v jiné oblasti. Typickým příkladem je narůstající flexe v loketním kloubu, která se objevuje a zhoršuje v průběhu chůze u nemocných s hemiparézou po cévní mozkové příhodě. Tyto asociované motorické pohyby se nazývají „hemiplegická postura“, což je určitá nepřesnost, jež nevyjadřuje původ této motorické reakce. Asociované pohyby spastické končetiny mohou být vyvolány také volními pohyby zdravé končetiny.
Asociované motorické reakce byly ozna-čeny jako uvolněné posturální reakce zbavené volní kontroly. Dewald a Rymer [24]předpokládali, že neporušená bulbospinální motorická dráha převezme úlohu poškozené kortikospinální dráhy, což vede k těmto sdruženým pohybům. Cestou polysegmentálních propojení motoneuronů má bulbospinální dráha difuznější vliv na axiální svaly a proximální segmenty končetin a její aktivace může být podkladem pozorovaných asociovaných reakcí. Také vestibulospinální reflexy se mohou podílet na řízení pohybů ovlivněním excitability „antigravitačních“ motoneuronů. Dezinhibicí vestibulospinální dráhy dochází k aktivaci motoneuronů s rozvojem flexe v lokti a extenze v kolenním kloubu, což vede k typickému klinickému obrazu.
Asociovanou motorickou reakcí je například mimovolní flexe či extenze nohy, která doprovází volní pohyb ruky. Asociovanou reakcí je i sdružený pohyb ramenem při volním pohybu akrem končetiny, zrcadlový pohyb na druhostranné končetině nebo sdružená flexe či extenze paže anebo předloktí. Asociované pohyby jsou stereotypní, jednosměrné a bývají spojeny i s charakteristickým způsobem chování. Patří mezi ně i motorické projevy končetin a trupu, které se objevují při zívání, kýchání či kašlání. Vznikají v důsledku aberantního přesměrování aktivity na jiné svalové skupiny již na úrovni motorického kortexu nebo míchy. Příčinou jsou pravděpodobně neúčelné neuroplastické změny CNS, kdy funkční kortex ovlivňuje původní svalové segmenty, ale částečně i segmenty, které řídící funkci kortexu ztratily. Vzniká tak nadměrná aktivita (fenomén „overflow“), kdy při volním pohybu v žádoucím segmentu dochází k nechtěným synkinézám v segmentu vzdáleném.
Cerebrální a míšní spasticita
Spastický syndrom lze pro přehlednost rozdělit na dvě základní formy: cerebrální a míšní typ spasticity [3].
U cerebrálních lézí je možno diferencovat léze kortikální, subkortikální a v hlubokých strukturách, tj. nad úrovní kmene a léze v úrovni mozkového kmene. Dochází ke ztrátě vlivu mozkové kůry na kmenové inhibiční struktury. Spasticita cerebrálního typu bývá méně výrazná, mívá fokální či multifokální charakter s maximem nadměrné svalové aktivity v oblasti jednoho anebo více kloubů, vyskytuje se výraznější podíl spasticity extenzorů, a to zejména na dolních končetinách. Je méně flexorových spazmů, i klony jsou málo výrazné. Typickým příkladem cerebrálního typu spasticity je hemiparetické postavení končetin při lézi v oblasti capsula interna.
U spinálních lézí je přítomna spastická dystonie těžkého stupně, převažuje postižení flexorů a dominantní postižení dolních končetin je flekčního typu. Vyskytují se výrazné spazmy flexorů, je častěji přítomen fenomén sklapovacího nože a klonu. Spinální spasticita je difuznější, postiženy jsou i trupové svaly a proximální segmenty končetin, nejsou výrazné projevy izolované fokální spasticity. U nekompletních míšních lézí převládá na dolních končetinách zvýšený tonus extenzorů. Jsou porušeny pyramidové dráhy i dorzální retikulospinální dráha, která má inhibiční vliv na svalový tonus. Zachována je ventrální retikulární dráha s excitačním vlivem na alfa‑motoneuron. Obraz nekompletní míšní léze lze charakterizovat jako „paraplegia ‑ in‑extension“. Při dalším rozvoji spinální léze nastane kompletní přerušení drah, včetně excitačních, a mícha pod úrovní léze je zcela bez supraspinálního vlivu. Dojde k dezinhibici napínacích reflexů a rozvine se těžká flekční spasticita dolních končetin. Ta vede rychle k rozvoji svalových kontraktur a k anatomickým kloubním změnám („paraplegia ‑ in‑flexion“). U spinálního typu postižení je převážně flekční postavení v kloubech na horních končetinách a extenční postavení na dolních končetinách.
Paréza
Je hlavním negativním projevem syndromu centrálního motoneuronu a hlavním klinickým projevem, který si pacient uvědomuje. Oslabení svalové síly kolísá od lehké parézy do obrazu plegie a je zpravidla hlavní příčinou invalidity nemocného. Úkolem funkční diagnostiky je správně rozpoznat, zda se na prohloubení parézy paradoxně rovněž nepodílí zvýšená svalová aktivita. Při rychlém protažení svalu volním stahem agonisty dojde vlivem spasticity ke kontrakci antagonisty, a tím k oslabení agonisty. Podobný efekt nastává např. v došlapné fázi kroku, který je kvůli paréze relativně rychlý a vede k prudkému protažení m. triceps surae a v důsledku toho k jeho spastické kontrakci a k funkčnímu oslabení extenzorů nohy. Kromě spasticity oslabuje svalovou sílu také spastická dystonie, protože se vyskytuje v klidu a ovlivňuje výchozí stav před zahájením pohybu. Zpravidla převažuje ve flexorech a volní extenze je tím zásadně oslabena. Svalová síla a koordinace pohybů je zásadně oslabena díky ko‑kontrakcím, které se vyskytují výhradně při volním pohybu. Volní stah agonistů vede k současnému aberantnímu stahu antagonistů, což se projeví oslabením agonistů. Na rozdíl od spasticity však k tomu dochází i při pomalých pohybech. Paréza je potencována také samotným zkrácením spastického svalu. Zkrácený sval totiž postrádá schopnost se dále kontrahovat i při částečně zachované inervaci. Při správně zvolené terapii zaměřené na oslabení antagonistů, posilování a protahování agonistů lze očekávat funkční zlepšení parézy.
Zkrácení svalu
Omezený rozsah pohybu ovlivňuje kromě zvýšeného svalového tonu i změna viskoelasticity v okolních tkáních – ve vazech, šlachách i ve vlastním svalu. K těmto změnám dochází již několik hodin po nástupu parézy a lze je pozorovat i při prosté imobilizaci končetiny u zdravých osob. Sval ztrácí objem a jeho nové zkrácené délce se přizpůsobují okolní měkké tkáně včetně zásobujících cév. Konečným důsledkem dlouhodobě zkráceného svalu je vznik fixovaných svalových kontraktur, které nejdou pasivně mobilizovat. Vhodně zvolené cvičení a důsledné protahování svalu může těmto změnám zabránit. Doporučuje se cvičit až dvě hodiny denně, používat dlahování, protahování nebo v indikovaných případech navrhnout chirurgickou rekonstrukční operaci. Pokud není jasné, zda je omezení rozsahu pohybu dáno svalovou kontrakturou nebo zvýšeným svalovým napětím, doporučuje se lokálně provést blok nervu lokálním anestetikem anebo aplikovat botulotoxin. Postupující změny ve svalech vedou k vzniku kloubních deformit a může se objevit odvápnění kostí. Dochází k zhoršování hygieny, je znesnadněno polohování a přesun a vzniká riziko dekubitů.
Komplikace spojené se spasticitou
Spasticita je spojena s mnoha dalšími orgánovými komplikacemi a je třeba zvážit, zda působí přímo na cílový orgán, nebo ovlivňuje jeho funkci až druhotně. Příkladem může být spastická dyssynergie svěrače močového měchýře s přímým ovlivněním jeho funkce nebo vliv spasticity adduktorů stehen, která zhorší péči o močení a hygienu v této oblasti. Nadměrná antispastická medikace navozující výrazné svalové uvolnění může změnit a zhoršit motorické vzorce, které byly funkčně využívány na začátku léčby (např. extenční spasticita dolních končetin umožňující vertikalizaci). Spasticita zvyšuje bolest, mění architektoniku spánku, ovlivňuje psychiku nemocného.
Bolest
U části nemocných se spasticitou se vyskytuje nociceptivní, viscerální a neuropatická bolest [25 – 28]. Dlouhotrvající svalová kontrakce a nadměrná aktivace motorických drah vede k zvýšené konzumpci oxygenu a zároveň ke snížení cévního zásobení. Důsledkem je hypoxie a ischemizace svalové tkáně. Nociceptivní vlákna jsou nadměrně aktivována a uvolňují se neurotrasmitery přenosu bolesti. Ukazuje se, že aplikace botulotoxinu snižuje bolest působením na senzitizované nociceptory [26]. V tkáni snižuje uvolňování glutamátu, subtance P a neuropeptidů obsahujících CGRP (Calcitonin‑Gene Related Peptide).
Po přetížení horních i dolních končetin se objevují chronické muskuloskeletární bolesti. Příčinou viscerálních bolestí jsou močové kameny, záněty močového měchýře, gastrointestinální poruchy (zácpa, ileus, žaludeční vřed, cholecystolitiáza apod.). Bolest negativně ovlivňuje celou řadu funkcí včetně sexuálních a kognitivních, působí na náladu, ruší spánek a zvyšuje úzkost a zhoršuje depresi.
Centrální bolest se vyskytuje u řady afekcí nervového systému [27,28]. Nejčastěji se objeví při postižení zadní části thalamu, zadního raménka capsula interna, dorzolaterální oblasti prodloužené míchy a centrálních míšních lézí. Centrální bolesti spojené se spasticitou mají nemocní po cévní mozkové příhodě, u roztroušené sklerózy, po chronickém míšním poranění, cervikální kompresivní myelopatii či syringomyelii. Truini et al [29] zjistili, že z 302 nemocných s roztroušenou sklerózou mělo 30 % nociceptivní bolest a 14 % neuropatickou bolest. Nemocní s neuropatickou bolestí měli horší skóre disability podle EDSS než nemocní, kteří bolestí netrpěli. U osob s dětskou mozkovou obrnou dominují bolesti muskuloskeletární, jež nastávají při dlouhodobých kostních a kloubních deformitách a fixovaných svalových kontrakturách.
Velkým problémem u spasticity bývá vznik syndromu zmrzlého ramene, který se projevuje bolestivostí a omezením pohyblivosti v ramenním kloubu. Omezuje nemocného a zabraňuje mu v cílené rehabilitaci. U nemocných s hemiparézou po cévní mozkové příhodě je prevalence bolestivého ramene 23 %, u nemocných v cíleném rehabilitačním programu dokonce 55 % [30]. Vzácně se může rozvinout i komplexní regionální bolestivý syndrom (KRBS).
Zdrojem bolestí jsou svalové spazmy, které vznikají i po mírné nociceptivní aktivaci. Spazmus psoatu nebo adduktorů stehen může vést k vyprázdnění moči nebo náhlému uvolnění stolice (tzv. mass reflex).
Sfinkterové a sexuální funkce
Spasticita, svalová slabost, porucha koordinace pohybu, bolest, zvýšené šlacho ‑ okosticové reflexy, nadměrné svalové spazmy – to vše vede k zhoršení sfinkterových i sexuálních funkcí. Při výrazné spasticitě adduktorů stehen jsou problematické zejména přesuny na vozík a postel a dostatečná hygiena v oblasti perinea. Léčba poruch močení je nutná ve spolupráci s urologem, kdy lze použít spazmolytika, anticholinergika či myorelaxancia. Aplikace botulotoxinu je účinná u hyperaktivního detruzoru močového měchýře. Nežádoucím efektem bývá postmikční reziduum, které je třeba řešit například přechodnou autokatetrizací.
Při imobilizaci se uvolňuje vápník z kostí, vylučuje se zvýšeně močí a může dojít k tvorbě močových kamenů. Toto riziko je potencováno přítomností infekce a poruchou evakuace moči. Prevencí je optimální denní diuréza, správná derivace moči a intenzivní rehabilitace pohybového aparátu. Recidivující močové infekce, dyssynergie detruzoro‑sfinkterová, stagnace moči v měchýři, nekontrolovatelné úniky moči, to vše predisponuje k narušení antireflexního mechanizmu [31]. Ledviny jsou ohroženy chronickým městnáním a recidivující infekcí.
Spánek
Poruchy spánku mohou být přítomny již před vznikem nemoci, ale často jsou s nově vzniklou poruchou nervového systému spojeny. Antispastické léky působí zvýšenou sedaci, a tak řada pacientů pociťuje ospalost i během dne. Nemocní s chronickým míšním postižením mohou vykazovat periodické pohyby dolních končetin během nočního spánku nebo se u nich může projevit syndrom neklidných nohou [32]. Obtížný spánek zhoršuje spasticitu a naopak výrazná spasticita ruší klidné spaní. Důležitá je instruktáž pacienta, v které poloze v posteli má odpočívat, jak a kdy protáhnout zkrácené svaly, kdy se má ukládat ke spánku a kdy vstávat.
Snížená fyzická aktivita
Omezení hybnosti a pohyblivosti vede k zvýšenému riziku vzniku hluboké žilní trombózy. Ta hrozí některým nemocným v začátku nemoci, zejména u iniciálního stadia paraparézy se sníženým svalovým tonem. Pokles vazomotorického tonu, absence svalové pumpy a metabolické změny endotelia vedou k venostáze a vzniku trombózy. V časných fázích spojených s omezenou hybností nemocného na lůžku je nutná důsledná profylaxe.
Pokles fyzické aktivity je spojen s nižším energetickým výdejem a úbytkem aktivní svalové hmoty. Dochází ke změně bazálního metabolizmu, mění se poměr HDL a LDL cholesterolu v neprospěch HDL. Obezita a hypercholesterolemie predisponuje k vzniku aterosklerózy, ischemické chorobě srdeční a diabetes mellitus. Prevencí je redukce tělesné hmotnosti s dietním omezením a pravidelnou fyzickou aktivitou nejméně 3krát týdně.
Ztráta nebo výrazné omezení pohybu vede k trvalým změnám ve svalech a kostech. Snížení kontraktilní schopnosti svalových vláken je dáno tím, že jsou nahrazeny vazivem a tukovou tkání. Dále dochází k odvápnění kostí a vzniká osteoporóza, jejímž konečným důsledkem jsou zlomeniny.
U imobilních pacientů může dojít k vytvoření heterotopických osifikací v mimokloubních oblastech velkých končetinových kloubů, nejčastěji kyčelních kloubů. Osifikace omezují kloubní hybnost, mění posturu sedu a stoje, zhoršují soběstačnost a jsou zdrojem velkých bolestí. U nemocných s míšním poraněním se objevují velmi brzy, a to i do několika dnů až týdnů po úraze. Naštěstí je jejich výskyt vzácný. Léčba je operační, ale je zatížena recidivou a zvýšeným rizikem krvácení z velkých cév.
Nadměrné a asymetrické přetěžování vede k akceleraci degenerativních změn ve velkých kloubech. Často jsou postiženy ramenní a kyčelní klouby. Vzniká syndrom bolestivého ramene, který vede k rozvoji syndromu rotátorové manžety nebo adhezivní kapsulitidě [30]. Nadměrným přetěžováním relativně dobře funkčních končetin dochází k tendovaginitidám.
Imobilizace často přispívá ke vzniku kožních defektů. Léčba patří do rukou ošetřujícího personálu a spočívá v odlehčování a nepřetěžování postiženého kožního místa. U rozsáhlého dekubitu je nemocný ohrožen septickým stavem se všemi jeho riziky. Pokud je zasažena kost a vzniká chronická osteomyelitida, je šance na úplné vyléčení minimální. Léčba dekubitu je v prvé řadě založena na trpělivosti nemocného i ošetřujícího personálu, neboť je dlouhodobá a svízelná. Může trvat měsíce a recidivy jsou časté. Operační řešení spočívá v odstranění nekrotických částí s plastickým překrytím kožním a tkáňovým krytem.
Hodnocení spasticity
Pro posouzení typu a stupně spasticity je nezbytné objektivní vyšetření [33,34]. Je důležité zejména na začátku léčby a je výchozím parametrem určujícím směr další terapie. Vzhledem k nejednoznačné definici spasticity nejsou v současnosti k dispozici pevné hodnotící škály, což je dáno i různými přístupy k hodnocení stupně spasticity. Neurofyziologické metody užívané pro hodnocení spasticity bohužel nevykazují jednoznačné a stabilní parametry, aby se mohly rutinně používat v běžné praxi [35], proto se hlavně uplatňují klinické hodnotící škály. V menší míře se sahá k fyzikálním a biochemickým metodám [36].
Klinické škály hodnocení spasticity
Hodnotící škály vycházejí většinou z klinického vyšetření nemocného. Můžeme použít i dotazníkové metody. Základním parametrem řady škál je kvantifikace odporu, který klade spastický sval vůči pasivnímu pohybu. Pomocí škál je možno posoudit stupeň svalového hypertonu, dystonickou posturu končetiny, polohu části končetiny a úhel, který svírá v kloubním spojení, míru svalových spazmů, poruchu funkce jednotlivých svalů a svalových skupin. V současné době je již validizována řada hodnotících škál. Mají různě vysokou spolehlivost při hodnocení jedním lékařem ‑ specialistou v různých časových intervalech (intra ‑ rater reliability) i při hodnocení různými vycvičenými zdravotníky v jednotlivé dané škále (inter ‑ rater reliability) [37]. Škály se používají k indikaci léčby (fyzikální, myorelaxační, botulotoxin, intratékální baklofen), k průběžnému sledování (účinek aplikace botulotoxinu, implantace baklofenové pumpy), hodnocení nákladnosti léčby (srovnání botulotoxinu, rehabilitace) a k indikaci chirurgického zákroku (drezotomie, selektivní radikulotomie). Škály mají rovněž široké uplatnění v rámci klinických studií i ve výzkumu.
Použití vhodné škály záleží na tom, co chceme měřit a sledovat. Můžeme zvolit různé přístupy a podle toho i rozdělit jednotlivé škály a dotazníky.
Hodnocení svalového tonu, rozsahu pohybu a frekvence spazmů
Ashworthova škála (tab. 4) [38] využívá hodnocení odporu k pasivnímu protažení svalů nemocného, jejž provádí vyšetřující osoba. Principem je pasivní protažení spastického svalu v průběhu jedné sekundy. Hodnotí se vždy pouze první provedení testu. Při opakování již často dochází ke snížení spastického hypertonu svalu a pohyb je pak volnější.
![Škála hodnocení svalového hypertonu dle Ashwortha [38].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/b50e87404f68350e59338c1f1c6859b4.png)
V roce 1987 Bohannon a Smith [39] zvýšili senzitivitu původní Ashworthovy škály tím, že přidali stupeň 1+, který odpovídá mírnému zvýšení svalového napětí s náhlým zvýšením odporu („catch“ – záškub) v méně než polovině rozsahu pohybu při protažení svalu. Tato škála se nazývá Modifikovaná Ashworthova škála (tab. 5). Klinickým problémem je správně definovat a testovat „catch and release“ (záškub a uvolnění), ať se již jedná o klinické či biochemické fenomény. Rovněž rozlišení záškubu s následným uvolněním od minimálního zvýšení odporu na konci pohybu je obtížné.
![Modifikovaná stupnice dle Ashwortha [39].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/21617a9443425ed1cb63f84a6e22f7d4.png)
Při praktickém použití obou škál je třeba hodnotit první pokus – pasivní protažení celého svalu v průběhu jedné sekundy. Nelze hodnotit svalový hypertonus po opakovaných protaženích svalu – změní se viskoelastické vlastnosti a nakonec i reflexní odpověď (přes aferentní podněty ze svalového vřeténka a gama‑kličku). V klinických studiích je nejlepší, když testování provádí vždy tentýž lékař (či fyzioterapeut).
Obě předchozí škály hodnotí neurální a periferní (viskoelastickou) složku svalového tonu dohromady. Přínosem Tardieuovy škály (tab. 6) [40] je vyšetření v různých rychlostech, což umožní rozlišit podíl neurální a biomechanické komponenty hypertonu [41,42]. Při použití různé rychlosti protažení spastického svalu dochází k reflexní odpovědi („catch“) v různém stupni protažení, a tím lze podstatně přesněji hodnotit reflexní polysynaptickou odpověď. Modifikovaná Tardieuova škála [43]používá standardní metody k vybavení základního napínacího reflexu a hodnotí také úhel, ve kterém se objeví kontrakce svalu.
V klinické praxi se často uplatňuje škála frekvence spazmů (tab. 7), která stanoví počet spazmů během 24 hodin [44].
![Škála frekvence spazmů [44].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/d3bf231d4233f9855db0a02cc41625b9.png)
Jiná škála hodnotí svalový tonus v adduktorech kyčlí (tab. 8). Hodí se pro selektivní zhodnocení stupně svalového tonu v těchto svalech. Slouží např. k hodnocení efektu léčby (snazší cévkování, lepší péče o stolici, celkové zlepšení hygieny v perianogenitální oblasti apod.) [45].
![Hodnocení tonu adduktorů [45].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/cce72b13a1acc09e118a501ad61962b9.png)
Hodnocení celkového motorického postižení včetně denních aktivit
Index Barthelové hodnotí schopnost vykonávat běžné denní činnosti (Activity of Daily Living, ADL) (tab. 9) včetně činnosti střev, močového měchýře, úpravy zevnějšku, použití WC, stravování, přemisťování, mobility, oblékání, chůze a koupání. Skóre se pohybuje mezi 0 a 20 body [45].Test funkční soběstačnosti (Functional Independence Measure, FIM) je mezinárodně používaný a uznávaný test, který informuje o aktuálním stavu soběstačnosti nemocného a jeho postupném vývoji, včetně potřeby pomoci v běžných denních činnostech (tab. 10). Test tvoří sedmibodová škála, která je odstupňována od úplné závislosti k úplné soběstačnosti. Testuje se soběstačnost, sfinktery, mobilita, lokomoce, komunikace a sociální adaptace [45]. Škála hodnocení disability (Disability Assessment Scale, DAS) hodnotí ve třech bodech aktivitu nemocného a ve čtvrtém bodě posuzuje bolest a dyskomfort nemocného (tab. 11). Tato škála do určité míry odráží i stupeň zátěže osoby pečující o nemocného se spasticitou [45].
![Index Barthelové [45].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/00a0e3d3f98fe6279b344403d5374ee2.png)
![Test funkční soběstačnosti [45].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/5996cbad3baabad812c63f08ff4c4550.png)
![Škála hodnocení disability [45].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/d78ce5fa48acd60fc2a3dd1268297d7a.png)
Škála dosažení cíle (Goal Attainment Scale, GAS) hodnotí výsledek léčby, ať již se jedná o rehabilitační, medikamentózní či chirurgickou terapii (tab. 12). Po důkladné analýze průběhu, klinického nálezu se po diskuzi s nemocným (a příbuznými) zvolí nejvhodnější léčebný postup. Vyberou se tři parametry, které se určí za cíle léčby. Zhodnotí se význam jednotlivých parametrů a stanoví se jejich důležitost i obtížnost. Po absolvované léčbě a po předem stanovené délce terapie se hodnotí výsledek pomocí 5stupňové škály (výrazně horší – mírně horší – stejný – mírně zlepšen – výrazně zlepšen). Jednotlivé parametry se zadají do předem určeného vzorce, jehož výsledek nám určí i stupeň zlepšení. A ten je možné porovnat s naším odhadem na počátku léčby. K hodnocení spasticity byla prvně použita v r. 2006 [46,47].
![Škála dosažení cíle [46,47].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/8007457735048527d290afb5edc840f4.png)
Hodnocení síly a funkce končetin, chůze
Svalový test informuje o síle jednotlivých svalů nebo svalových skupin (tab. 13). Používá stupnice 0 až 5, kde 5 je normální stah svalu s velmi dobrou funkcí a 0, kdy sval při pokusu o pohyb nejeví nejmenší známky stahu [48]. Dále lze použít test k zhodnocení motorických funkcí po cévní mozkové příhodě (STroke REhabilitation Assessment of Movement, STREAM), u spinálních traumat nebo u roztroušené sklerózy se využívá dvouminutový test chůze a test vstávání a chůze na čas [49]. Pro posouzení obratnosti horní končetiny je vhodný modifikovaný Frenchayský test paže (Modified Frenchay Arm Test, MFAT) a 9HPT – nine Hole Peg Test, celkovou hybnost hodnotí Rivermeadské hodnocení motoriky [33,34].
Velmi důležitým parametrem účinnosti léčby je dotazník kvality života. Používá se zkrácená verze „short ‑ form“ s 36 otázkami, které se týkají pacientova vlastního vnímání zdravotního stavu a z toho plynoucího funkčního omezení.
Neurofyziologické metody
Neurofyziologické metody užívané pro hodnocení spinálních mechanizmů spasticity určují excitabilitu míšních alfa motoneuronů i míšních interneuronů, ale také je možné sledovat míšní inhibiční děje [50,51].
Většina neurofyziologických metod využívá k sledování stupně svalového hypertonu modulace H ‑ reflexu [13,52]. Například intratékálně podaný baklofen snižuje amplitudu H ‑ reflexu již v prvních 15 min po podání [53]. Tento účinek je dán spinálními mechanizmy. Baklofen má efekt i centrální, a to zejména v oblasti kmene, kde inhibuje oligosynaptické a polysynaptické kmenové reflexy, což bylo prokázáno studiemi s mrkacím reflexem, úlekovou reakcí, masseterovým inhibičním reflexem apod. [54].
V běžné klinické praxi doporučujeme kromě stanovení H ‑ reflexu i provedení F vlny a případně flexorového reflexu nebo tonického vibračního reflexu [55,56].
Základní cíle léčby spasticity
Cílem léčby spasticity není její úplné odstranění, ale zmírnění negativního vlivu při aktivitách, jež nemocného omezují. Proto je důležité si na začátku léčby stanovit reálné cíle, kterých chce pacient a lékař dosáhnout včetně úvahy, kdy a jak může být spasticita pro pacienta užitečná [20]. U některého nemocného snížením spasticity zmírníme obtěžující doprovodné bolesti a zlepšíme spánek, u jiného pacienta bude důležité zlepšení komunikace, polykání a řeči. Je nutné vyloučit i všechny bolestivé podněty, které by spasticitu mohly zhoršovat. Nárůst spasticity může být totiž signálem vznikající močové infekce, ledvinné koliky nebo dekubitů. Výsledkem léčby je také ovlivnění celkové kvality života nemocného a snížení zátěže pečovatelů (zejména rodinných příslušníků).
Rehabilitace
Rehabilitace hraje nezastupitelnou roli v organizaci péče o pacienty se spasticitou [2,4]. Součástí je fyzioterapie, ergoterapie, logopedie a další disciplíny, které zvyšují kvalitu života pacienta. Terapie je ovlivněna dalšími souvisejícími onemocněními, osobností nemocného a variabilitou funkčního omezení způsobeného jednotlivými příznaky. Pro vhodná doporučení a použití jednotlivých rehabilitačních postupů je důležitá jejich průkaznost podle studií založených na důkazech (EBM). Některé léčebné postupy se běžně používají, ale jejich efektivita nebyla dostatečně prokázána. Používané preventivní a léčebné postupy u nemocných se syndromem centrálního motoneuronu jsou souborně uvedeny v tab. 14 [57].
![Přehled preventivních a terapeutických rehabilitačních postupů u nemocných se syndromem centrálního motoneuronu [57].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/ad2392eada199f9fa33a801302b02e38.png)
Důležité je postupovat od nejméně invazivních metod k těm složitějším „step ‑ by ‑ step“. Například v akutním stavu po traumatu mozku nebo míchy je nutná stabilizace vitálních funkcí pacienta na jednotce intenzivní péče a poté okamžitě začít s pasivním polohováním a strečinkem k zábraně svalových kontraktur a k omezení tvorby heterotopických osifikací. Následná léčba se zaměřuje na hledání vhodných kompenzačních pomůcek k usnadnění běžných denních aktivit, úprava pracovního a domácího prostředí, motivace rodiny k aktivnímu začlenění. Používá se strečink, dlahování, ortézy, cílený nácvik základních úkonů (stoj, chůze, přesuny, sed ve vozíku, úchopové funkce ruky apod.). Důležitá je fyzioterapie, ergoterapie a logopedie a zajištění vhodných protetických pomůcek.
Botulotoxin
Botulotoxin má v léčbě fokální spasticity své výlučné místo [58 – 62] a je z farmakologické léčby na prvním místě před podáním perorálních myorelaxancií. Nejčastějšími jeho indikacemi jsou spasticita a dystonie po cévní mozkové příhodě a v rámci dětské mozkové obrny, což bylo opakovaně prokázáno ve světě i v našem písemnictví [63 – 65]. Díky velmi dobrému efektu a současně nízkému výskytu nežádoucích účinků se jednoznačně považuje za lék první volby u nemocných po cévní mozkové příhodě [66,67], a to již v prvních třech měsících. Dokáže zmírnit nejen spasticitu (např. klonus), ale především spastickou dystonii a ko ‑ kontrakce, které pacienta invalidizují nejvíce. Zmírněním svalového napětí lze zkrácený sval lépe protáhnout, což příznivě potencuje následnou rehabilitační léčbu. Není cílem prohloubení parézy spastického svalu, ale omezení jeho ko ‑ aktivace v situacích, kdy se patologicky kontrahuje coby antagonista a oslabuje volní stah agonisty. V takových případech lze po aplikaci botulotoxinu paradoxně očekávat zlepšení samotné parézy.
Botulotoxin se v indikaci léčby spastické dystonie podává intramuskulárně. Nespornou výhodou je minimální výskyt nežádoucích účinků. Může dojít k bolesti v místě vpichu, otoku, vzácně k tvorbě hematomu. Mechanizmus účinku botulotoxinu je dán blokádou uvolnění acetylcholinu na nervosvalové ploténce. Vzniká denervační syndrom daného svalu, tzv. chemodenervace. Reaplikace botulotoxinem u nemocných s fokální spasticitou jsou nutné po 3 – 4 měsících, kdy dojde k regeneraci nervosvalové ploténky a obnoví se neuromuskulární přenos.
Perorální antispastické léky
I když není příliš mnoho EBM studií potvrzujících jednoznačně efekt léčby spasticity pomocí perorálních antispastických léků, přesto je tento způsob nejčastější a také nejjednodušší při léčbě spasticity [68]. Důležitá je však kombinace různých způsobů léčby, tj. včetně rehabilitace a léčby botulotoxinem [69]. Používá se široká paleta léků s rozmanitým místem působení a samozřejmě i s četnými nežádoucími účinky zejména ve vysokých dávkách [70,71]. Perorální antispastické léky se používají při lehkém stupni spasticity. U těžšího stupně svalového hypertonu může systémové podání léků prohloubit funkční deficit oslabením nepostižených skupin svalů, například dojde k zhoršení sedu ve vozíku v důsledku oslabení zádových svalů nebo se objeví podlamování dolních končetin při stoji. Lék se sedativním účinkem je možné podat u pacienta s bolestivými nočními spazmy. Je vhodné zvolit lék s prodlouženým účinkem a podat jej ve večerních hodinách, aby došlo k úlevě během noci. Naopak u pacienta, u kterého se objeví spazmy a zvýšené svalové napětí v ranních hodinách před hygienou nebo plánovanými přesuny, bude vhodnější hned po probuzení podat lék, jenž se rychle vstřebá. Obecně je lepší podávat nižší dávky těm nemocným, kteří spasticitu využívají k chůzi, stoji a k opěrným úkonům než nemocným na vozíku nebo ležícím v posteli. Hlavní zásadou léčby je začít v malých dávkách a pomalu zvyšovat do účinných hodnot. Při dodržení tohoto postupu je možné včas rozpoznat výskyt nežádoucích účinků a pružně pak upravit dávku léku nebo lék vyměnit. Nastavení optimální dávky léku může trvat i několik týdnů. Používá se široká paleta léků s rozmanitým místem působení, ale nejvíce se užívá baklofen, analog GABA ‑ B receptorů. Při běžném perorálním podání není bohužel příliš účinný, což prokazují multicentrické studie [72,73]. Ve vysokých dávkách je jeho podávání zatíženo četnými nežádoucími účinky, zejména určitým stupněm sedace, který nemocného ovlivňuje negativně ve všech činnostech včetně cílené rehabilitace. Úvodní dávka bývá 5 – 10 mg denně, maximální denní dávka by neměla přestoupit 100 – 150 mg denně. U tizanidinu se začíná 2 mg podávanými 2krát denně, ale může se dospět až k maximální denní dávce, která je 36 mg.
Intratékální baklofen
U těžké generalizované spasticity je prokázán velmi dobrý efekt podávání intratékálního baklofenu pumpovými systémy. Od doby první studie [74] byl následně prokázán účinek léčby intratékálním baklofenem u cerebrální i míšní spasticity, zejména u traumatického poranění mozku a míchy, DMO, roztroušené sklerózy či u cévních mozkových příhod [75 – 78]. Tato léčba je považována za velmi účinnou metodu ke snížení svalového hypertonu, zmírnění frekvence bolestivých svalových spazmů a k celkovému zkvalitnění života.
Nové léčebné možnosti
Přibývají stále nové technologie a moderní léčebné modality, které umožňují funkční zlepšení postižených osob a jejich kvalitní zapojení do běžného života. Patří sem například transkraniální magnetická stimulace (přímá stimulace – dTMS, repetitivní stimulace – rTMS), virtuální realita, elektrická stimulace, robotická léčba, léčba „zabráněním“ pohybu (Constraint ‑ Induced Movement Therapy – CIMT), trénink na chodítku s podporou váhy těla, apod. [79 – 82]. Transkraniální magnetická stimulace se využívá v rehabilitaci k posílení neuroplastických a reparačních změn, které nastávají po lézi nervové tkáně [83]. V současné době se zkoumají různá paradigmata stimulace rTMS s cílem zmírnit svalový hypertonus, zvětšit rozsah pohybu, a tím posílit funkčnost postižené končetiny po inzultu [84,85]. U pacientů se spastickou rukou po cévní mozkové příhodě, kteří byli léčeni lokálně botulotoxinem, se prokázala pomocí funkční magnetické rezonance normalizace aktivovaných oblastí mozku v době maximálního efektu této léčby [86].
Robotická léčba je další moderní způsob léčby, který využívá elektronické pomůcky ke snížení spasticity a k návratu hybných funkcí po lézi centrálního nervového systému. Těchto systémů je celá řada, ale nevýhodou je vysoká cena. Zatím nejsou podle literatury uváděna žádná jednoznačná doporučení, který systém je nejvýhodnější použít.
Závěr
Spasticitu není těžké určit, ale definovat její přesné patofyziologické mechanizmy je již obtížnější a stejně tak je obtížná i její léčba. Proto je dobré pochopit její definici, mechanizmy vzniku a znát i další příznaky syndromu centrálního motoneuronu. K léčbě je také nutné správné sledování její efektivity a k tomu slouží řada hodnotících škál.
V poslední době prochází léčba spasticity „renesancí“, neboť se objevují možnosti jejího ovlivnění jak intervenční farmakologické, tak neuromodulační. V éře robotizace a počítačové techniky a v přílivu nových technických postupů a přístrojů se neustále rozvíjejí a zdokonalují léčebné postupy umožňující odhalení a posílení funkčních rezerv u postižených osob. Důležité je jejich kvalitní zapojení do běžného života, alespoň s částečným návratem do pracovního procesu.
Komplexní léčba spasticity vyžaduje multidisciplinární přístup a stanovení reálných cílů s přihlédnutím k potřebám každého nemocného. Výsledkem je nižší výskyt komplikací, menší zátěž pro pečovatele, snížení ekonomické náročnosti a v konečném důsledku zlepšení kvality života pacienta včetně jeho začlenění v sociálním kontextu.
Pozn. autora: O problematice diagnostiky a léčby spasticity se můžete dozvědět více v publikaci Štětkářová I, Ehler E, Jech R. Spasticita a její léčba. Praha: Maxdorf 2012.
Autor deklaruje, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Ivana Štětkářová, CSc.
Neurologická klinika
3. LF UK a FN Královské Vinohrady
Ruská 87
100 00 Praha 10
e-mail: ivana.stetkarova@fnkv.cz
Přijato k recenzi: 11. 4. 2013
Přijato do tisku: 7. 5. 2013
Recenzenti
prof. MUDr. Zdeněk Ambler, DrSc.
prof. MUDr. Martin Bareš, Ph.D.
doc. MUDr. Robert Jech, Ph.D.
Práce byla podpořena výzkumným projektem Univerzity Karlovy PRVOUK P34.
doc. MUDr. Ivana Štětkářová, CSc.
Ivana Štětkářová promovala summa cum laude v roce 1987 na LF UK v Praze, kde získala cenu ministra školství za mimořádné studijní výsledky. Nastoupila do interní aspirantury v SZÚ v Prazea tam pracovala ve výzkumné skupině průmyslové neurologie a neurotoxikologie. V roce 1993 obhájila kandidátskou práci na téma „Somatosenzorické evokované potenciály u osob exponovaných organickým rozpustidlům“. Od roku 1988 do 1991 pracovala na Neurologické klinice FTN v Praze, kde byla rovněž asistentkou ILF. V roce 1992 získala stipendium a nastoupila roční pobyt jako Postdoctoral Fellow na Baylor College of Medicine v Houstonu. Absolvovala řadu stáží na dalších prestižních pracovištích v zahraniční (University Hospital v Innsbrucku, Shulthess Klinik v Curychu, Mississippi Methodist Rehabilitation Center v Jacksonu, Guttmann Institute v Badaloně, University Hospital v Basileji apod). V letech 1995–2011 pracovala na neurologickém oddělení Nemocnice Na Homolce a zároveň již od roku 2000 přednášela na Neurologické klinice 3. LF UK a FKNV. Po úspěšné obhajobě práce „Mícha a její funkce v klinické neurofyziologii“ byla v roce 2003 jmenována docentkou neurologie. Od roku 2011 pracuje jako přednostka Neurologické kliniky 3. LF UK a FNKV a vedoucí Centra pro léčbu roztroušené sklerózy. Věnuje se problematice spasticity, neurorehabilitace a neurofyziologie. Byla u zrodu využití metody magnetické stimulace ve výzkumu i v praxi. Od roku 2004 prosazuje projekt léčby těžké spasticity intratékálním baklofenem a v současné době je hlavním specialistou v ČR na tuto léčbu. Dále se zabývá problematikou roztroušené sklerózy, neuromuskulárních chorob, vertebrologie a chronické bolesti. Je členkou zahraničních odborných společností (International Society for Restorative Neurology and Human Neurobiology, International Neuromodulation Society, Eurospine), působí ve výboru České společnosti pro míšní léze a ve výboru České neuromodulační společnosti, v revizní komisi České neurofyziologické společnosti, je členkou České spondylochirurgické společnosti. Recenzuje řadu našich i zahraničních časopisů (ČSNN, European Spine Journal, Spinal Cord, Journal of Neural Transmission). Přednesla více než 250 přednášek, z toho řadu v zahraničí. Je autorkou a spoluautorkou více než 80 publikací (polovina prací je s IF), s citačním ohlasem 220, H-indexem 7. Jako hlavní autorka se zasloužila o vznik monografie Spasticita a její léčba, která vyšla v roce 2012 v nakladatelství Maxdorf. Spolupracuje na mezinárodním poli s odborníky pro neurofyziologii a míšní problematiku.
Zdroje
1. Sheean G. The pathophysiology of spasticity. Eur J Neurol 2002; 9 (Suppl 1): 3 – 9.
2. Barnes MP, Johnson GR. Upper motor neurone syndrome and spasticity. Cambridge: Cambridge University Press 2001.
3. Kaňovský P. Patofyziologie spasticity v dospělosti. In: Kaňovský P, Bareš M, Dufek J et al (eds). Spasticita, mechanismy, diagnostika a léčba. Praha: Maxdorf 2004 : 83 – 88.
4. Brashear A, Elovic E. Spasticity. Diagnosis and Management. New York: Demos Medical Publishing, LLC 2011.
5. Ward AB. A literature review of the pathophysiology and onset of post‑stroke spasticity. Eur J Neurol 2012; 19(1): 21 – 27.
6. Lance JW. Symposium synopsis. In: Feldman RG, Young RR, Koella WP (eds). Spasticity: disordered motor control. Chicago: Yearbook Medical 1980 : 485 – 449.
7. Elbasiouny SM, Moroz D, Bakr MM, Mushahwar VK. Management of spasticity after spinal cord injury: current techniques and future directions. Neurorehabil Neural Repair 2010; 24(1): 23 – 33.
8. Pandyan AD, Gregoric M, Barnes MP, Wood D, Van Wijck F, Burridge J et al. Spasticity: clinical perceptions, neurological realities and meaningful measurement. Disabil Rehabil 2005; 27(1 – 2): 2 – 6.
9. Gracies JM, Bayle N, Vinti M, Alkandari S, Vu P, Loche CM et al. Five ‑ step clinical assessment in spastic paresis. Eur J Phys Rehabil Med 2010; 46(3): 411 – 421.
10. Stevenson V, Jarrett L. Spasticity management: a practical multidisciplinary guide. London: Informa Healthcare 2006.
11. Gracies JM. Pathophysiology of spastic paresis. II: Emergence of muscle overactivity. Muscle Nerve 2005; 31(5): 552 – 571.
12. Gracies JM. Pathophysiology of spastic paresis: I: Paresis and soft tissue changes. Muscle Nerve 2005; 31(5): 535 – 551.
13. Pierrot ‑ Deseilligny E, Burke D. The circuity of the human spinal cord. Cambridge: Cambridge University Press 2005 : 63 – 112.
14. Brown P. Pathophysiology of spasticity. J Neurol Neurosurg Psychiatry 1994; 57(7): 773 – 777.
15. Hinderer SR, Dixon K. Physiologic and clinical monitoring of spastic hypertonia. Phys Med Rehabil Clin N Am 2001; 12(4): 733 – 746.
16. Zafonte R, Elovic EP, Lombard L. Acute care management of post‑TBI spasticity. J Head Trauma Rehabil 2004; 19(2): 89 – 100.
17. Wissel J, Manack A, Brainin M. Toward an epidemiology of poststroke spasticity. Neurology 2013; 80 (3 Suppl 2): S13 – S19.
18. Rizzo MA, Hadjimichael OC, Preiningerova J, Vollmer TL. Prevalence and treatment of spasticity reported by multiple sclerosis patients. Mult Scler 2004; 10 : 589 – 595.
19. Noreau L, Proulx P, Gagnon L, Drolet M, Laramee MT. Secondary impairments after spinal cord injury: a population‑based study. Am J Phys Med Rehabil 2000; 79(6): 526 – 535.
20. Balakrishnan S, Ward AB. The diagnosis and management of adults with spasticity. Handb Clin Neurol 2013; 110 : 145 – 160.
21. Burke D, Wissel J, Donnan GA. Pathophysiology of spasticity in stroke. Neurology 2013; 80 (3 Suppl 2):S20 – S26.
22. Woolsey CN. Discussion on experimental hypertonia in the monkey: interruption of pyramidal or pyramidal ‑ extra pyramidal cortical projections. Trans Am Neurol Assoc 1971; 96 : 164 – 166.
23. Bourbonnais D. Quantification of upper limb synkinesis in hemiparetic subject. Rehabilitation R and D Progress Report 1994, Dept of Veteran Affairs 1995; 32 : 118 – 119.
24. Dewald IP, Rymer WZ. Factors underlying abnormal posture and movement in spastic hemiparesis. In: Thilmann AF, Burke DJ, Rymer WZ (eds). Spasticity: mechanisms and management. Berlin: Springer ‑ Verlag 1933 : 123 – 138.
25. Černý R, Opavský J. Neurologické aspekty bolesti. In: Rokyta R et al (eds). Bolest. Praha: Tigis 2006 : 253 – 266.
26. Francisco GE, Tan H, Green M. Do botulinum toxins have a role in the management of neuropathic pain: a focused review. Am J Phys Med Rehabil 2012; 91(10): 899 – 909.
27. OʼDonnell MJ, Diener HC, Sacco RL, Panju AA, Vinisko R, Yusuf S. PRoFESS Investigators. Chronic Pain Syndromes After Ischemic Stroke: PRoFESS Trial. Stroke 2013; 44(5): 1238 – 1243.
28. Wissel J, Müller J, Dressnandt J, Heinen F, Naumann M, Topka H et al. Management of spasticity associated pain with botulinum toxin A. J Pain Symptom Manage 2000; 20(1): 44 – 49.
29. Truini A, Galeotti F, La Cesa S, Di Rezze S, Biasiotta A, Di Stefano G et al. Mechanisms of pain in multiple sclerosis: a combined clinical and neurophysiological study. Pain 2012; 153(10): 2048 – 2054.
30. Kalichman L, Ratmansky M. Underlying pathology and associated factors of hemiplegic shoulder pain. Am J Phys Med Rehabil 2011; 90(9): 768 – 780.
31. Ronco E, Denys P, Bernede ‑ Bauduin C, Laffont I, Martel P, Salomon J et al. Diagnostic criteria of urinary tract infection in male patients with spinal cord injury. Neurorehabil Neural Repair 2011; 25(4): 351 – 358.
32. Telles SC, Alves RC, Chadi G. Periodic limb movements during sleep and restless legs syndrome in patients with ASIA A spinal cord injury. J Neurol Sci 2011; 303(1 – 2): 119 – 123.
33. Biering ‑ Sørensen F, Nielsen JB, Klinge K. Spasticity ‑ assessment: a review. Spinal Cord 2006; 44(12): 708 – 722.
34. Rekand T. Clinical assessment and management of spasticity: a review. Acta Neurol Scand Suppl 2010; 190 : 62 – 66.
35. Pierrot ‑ Deseilligny E. Electrophysiological assessment of the spinal mechanisms underlying spasticity. In: Rossini PM, Mauguiere F (eds). New trends and advanced techniques in clinical neurophysiology (EEG Suppl. 41). Amsterdam: Elsevier Science Publishers 1990 : 264 – 273.
36. Wood DE, Burridge JH, van Wijck FM, McFadden C, Hitchcock RA, Pandyan AD et al. Biomechanical approaches applied to the lower and upper limb for the measurement of spasticity: a systematic review of the literature. Disabil Rehabil 2005; 27(1 – 2): 19 – 32.
37. Ghotbi N, Nakhostin Ansari N, Naghdi S, Hasson S. Measurement of lower‑limb muscle spasticity: intrarater reliability of Modified Ashworth Scale. J Rehabil Res Dev 2011; 48(1): 83 – 88.
38. Ashworth B. Preliminary trial of carisoprodol in multiple sclerosis. Practitioner 1964; 192 : 540 – 542.
39. Bohannon RW, Smith MB. Interrater reliability of a modified Ashworth scale of muscle spasticity. Phys Ther 1987; 67(2): 206 – 207.
40. Tardieu G, Shentoub S, Delarue R. A la recherche d’une technique de mesure de la spasticite imprime avec la periodique. Rev Neurol 1954; 91(2): 143 – 144.
41. Haugh AB, Pandyan AD, Johnson GR. A systematic review of the Tardieu Scale for the measurement of spasticity. Disabil Rehabil 2006; 28(15): 899 – 907.
42. Patrick E, Ada L. The Tardieu Scale differentiates contracture from spasticity whereas the Ashworth Scale is confounded by it. Clin Rehab 2006; 20(2): 173 – 182.
43. Boyd RN, Graham HK. Objective measurement of clinical findings in the use of botulinum toxin A in the management of children with cerebral palsy. Eur J Neurol 1999; 6 (Suppl 4): S23 – S35.
44. Snow BJ, Tsui JK, Bhatt MH, Varelas M, Hashimoto SA, Calne DB. Treatment of spasticity with botulinum toxin: a double‑blind study. Ann Neurol 1990; 28(4): 512 – 515.
45. Štětkářová I, Ehler E. Hodnocení spasticity. In: Štětkářová I, Ehler E, Jech R (eds). Spasticita a její léčba. Praha: Maxdorf 2012 : 33 – 58.
46. Skinner A, Turner ‑ Stokes L. The use of standardized outcome measures in rehabilitation centres in the UK. Clin Rehabil 2006; 20(7): 609 – 615.
47. Turner ‑ Stokes L. Goal attainment scaling (GAS) in rehabilitation: a practical guide. Clin Rehabil 2009; 23(4): 362 – 370.
48. Medical Research Council of the UK. Memorandum No.45. London: Pendragon House 1976 : 6 – 7.
49. Podsiadlo D, Richardson S. The timed „Up & Go“: a test of basic functional mobility for frail elderly persons. J Am Geriatr Soc 1991; 39(2): 142 – 148.
50. Yablon SA, Stokic DS. Neurophysiologic evaluation of spastic hypertonia: implications for management of the patient with the intrathecal baclofen pump. Am J Phys Med Rehabil 2004; 83 (Suppl 10): S10 – S18.
51. Kumru H, Stetkarova I, Schindler C, Vidal J, Kofler M. Neurophysiological evidence for muscle tone reduction by intrathecal baclofen at the brainstem level. Clin Neurophysiol 2011; 122(6): 1229 – 1237.
52. Leis AA, Stetkarova I, Beric A, Stokic DS. The relative sensitivity of F wave and H reflex to changes in motoneuronal excitability. Muscle Nerve 1996; 19(10): 1342 – 1344.
53. Stetkarova I, Kofler M. Differential effect of baclofen on cortical and spinal inhibitory circuits. Clin Neurophysiol 2013; 124(2): 339 – 345.
54. Kumru H, Kofler M, Valls ‑ Solé J, Portell E, Vidal J. Brainstem reflexes are enhanced following severe spinal cord injury and reduced by continuous intrathecal baclofen. Neurorehabil Neural Repair 2009; 23(9): 921 – 927.
55. Stokic DS, Yablon SA, Hayes A. Comparison of clinical and neurophysiologic responses to intrathecal baclofen bolus administration in moderate ‑ to ‑ severe spasticity after acquired brain injury. Arch Phys Med Rehabil 2005; 86(9): 1801 – 1806.
56. Dressnandt J, Auer C, Conrad B. Influence of baclofen upon the alpha ‑ motoneuron in spasticity by means of F ‑ wave analysis. Muscle Nerve 1995; 18(1): 103 – 107.
57. Hoskovcová M, Gál O. Rehabilitace a spasticita. In: Štětkářová I, Ehler E, Jech R (eds). Spasticita a její léčba. Praha: Maxdorf 2012 : 177 – 212.
58. Comella CL, Pullman SL. Botulinum toxins in neurological disease. Muscle Nerve 2004; 29(5): 628 – 644.
59. Ranoux D, Gury C. Practical handbook on botulinum toxin. Marseille: SOLAL 2007.
60. Jankovic J, Albanese A, Attassi MZ, Dolly JO, Hallet M, Mayer NH. Botulinum toxin. Therapeutic clinical practice and science. Philadelphia: Saunders Elsevier 2009.
61. Ehler E, Štětkářová I. Botulotoxin v léčbě spasticity. Cesk Slov Neurol N 2009; 72/ 105(4): 317 – 321.
62. Ehler E. Použití botulotoxinu v neurologii. Cesk Slov Neurol N 2013; 76/ 109(1): 7 – 21.
63. Bareš M, Kaňovský P. Praktické použití botulotoxinu A v léčbě spasticity dospělé populace. Cesk Slov Neurol N 2002; 65/ 98(6): 421 – 425.
64. Kaňovský P, Bareš M, Severa S, Benetin J, Kraus J,Richardson A et al. Functional benefit of botulinum toxin (Dysport) in the treatment of dynamic equinus cerebral palsy spasticity: a prospective, multicentre, double‑blind, placebo controlled study. Cesk Slov Neurol N 2004; 67/ 100(1): 16 – 23.
65. Kaňovský P, Bareš M, Severa S, Richardson A. Long‑term efficacy and tolerability of 4 - monthly versus yearly botulinum toxin type A treatment for lower‑limb spasticity in children with cerebral palsy. Dev Med Child Neurol 2009; 51(6): 436 – 445.
66. Ehler E, Vaňásková E, Štětkářová I. Standard komplexní léčby spasticity po cévní mozkové příhodě. Cesk Slov Neurol N 2009; 72/ 105(2): 179 – 181.
67. Kanovsky P, Slawek J, Denes Z, Platz T, Comes G, Grafe S et al. Efficacy and safety of treatment with incobotulinumtoxin A (botulinum neurotoxin type a free of from complex proteins; Nt 201) in post‑stroke upper limb spasticity. J Rehab Med 2011; 43(6): 486 – 492.
68. Lapeyre E, Kuks JB, Meijler WJ. Spasticity: revisiting the role and the individual value of several pharmacological treatments. NeuroRehabilitation 2010; 27(2): 193 – 200.
69. Simon O, Yelnik AP. Managing spasticity with drugs. Eur J Phys Rehabil Med 2010; 46(3): 401 – 410.
70. Taricco M, Pagliacci MC, Telaro E, Adone R. Pharmacological interventions for spasticity following spinal cord injury: results of a Cochrane systematic review. Eura Medicophys 2006; 42(1): 5 – 15.
71. Montané E, Vallano A, Laporte JR. Oral antispastic drugs in nonprogressive neurologic diseases: a systematic review. Neurology 2004; 63(8): 1357 – 1363.
72. Olvey EL, Armstrong EP, Grizzle AJ. Contemporary pharmacologic treatments for spasticity of the upper limb after stroke: a systematic review. Clin Ther 2010; 32(14): 2282 – 2303.
73. Feldman RG, Kelly ‑ Hayes M, Conomy JP, Foley JM. Baclofen for spasticity in multiple sclerosis. Double‑blind crossover and three‑year study. Neurology 1978; 28(11): 1094 – 1098.
74. Penn RD, Kroin JS. Intrathecal baclofen alleviates spinal cord spasticity. Lancet 1984; 1(8385): 1078.
75. Coffey R, Cahill D, Steers W. Intrathecal baclofen for intractable spasticity of spinal origin: results of a long‑term multicenter study. J Neurosug 1993; 78(2): 226 – 232.
76. Ordia JI, Fischer E, Adamski E, Spatz EL. Chronic intrathecal delivery of baclofen by a programmable pump for the treatment of severe spasticity. J Neurosurg 1996; 85(3): 452 – 457.
77. Zahavi A, Geertzen JH, Middel B, Staal M, Rietman JS. Long term effect (more than five years) of intrathecal baclofen on impairment, disability, and quality of life in patients with severe spasticity of spinal origin. J Neurol Neurosurg Psychiatry 2004; 75(11): 1553 – 1557.
78. Štětkářová I, Šroubek J, Vrba I, Peregrin J, Havrdová E. Jednorázové intratékální podání baklofenu a následné zavedení pumpového systému v léčbě těžké spasticity u osob s roztroušenou sklerózou. Cesk Slov Neurol N 2007; 70/ 103(2): 190 – 195.
79. Perez MA, Field ‑ Fote EC, Floeter MK. Patterned sensory stimulation induces plasticity in reciprocal ia inhibition in humans. J Neurosci 2003; 23(6): 2014 – 2018.
80. Jurkiewicz MT, Mikulis DJ, Fehlings MG, Verrier MC. Sensorimotor cortical activation in patients with cervical spinal cord injury with persisting paralysis. Neurorehabil Neural Repair 2010; 24(2): 136 – 140.
81. Fung J, Richards CL, Malouin F, McFadyen BJ, Lamontagne A. A treadmill and motion coupled virtual reality system for gait training post‑stroke. Cyberpsychol Behav 2006; 9(2): 157 – 162.
82. Jaffe DL, Brown DA, Pierson ‑ Carey CD, Buckley EL, Lew HL. Stepping over obstacles to improve walking in individuals with poststroke hemiplegia. J Rehabil Res Dev 2004; 41(3A): 283 – 292.
83. Centonze D, Koch G, Versace V, Mori F, Rossi S, Brusa L et al. Repetitive transcranial magnetic stimulation of the motor cortex ameliorates spasticity in multiple sclerosis. Neurology 2007; 68(13): 1045 – 1050.
84. Khedr EM, Ahmed MA, Mohamed KA. Motor and visual cortical excitability in migraineurs patients with or without aura: transcranial magnetic stimulation. Neurophysiol Clin 2006; 36(1): 13 – 18.
85. Nowak DA, Grefkes C, Dafotakis M, Eickhoff S, Küst J, Karbe H et al. Effects of low ‑ frequency repetitive transcranial magnetic stimulation of the contralesional primary motor cortex on movement kinematics and neural activity in subcortical stroke. Arch Neurol 2008; 65(6): 741 – 747.
86. Senkárová Z, Hlustík P, Otruba P, Herzig R, Kanovský P. Modulation of cortical activity in patients suffering from upper arm spasticity following stroke and treated with botulinum toxin A: an fMRI study. J Neuroimaging 2010; 20(1): 9 – 15.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2013 Číslo 3
-
Všechny články tohoto čísla
- Mechanizmy spasticity a její hodnocení
- Náklady na poruchy mozku v České republice
- Sclerosis multiplex – úloha regulačných T‑lymfocytov v patogenéze a biologickej liečbe choroby
- Lidské prionové nemoci v České republice – 10 let zkušeností s diagnostikou
- Kolaterální cirkulace mozku – potenciální cíl terapie mozkových infarktů
- Neinvazívne stanovenie hemisferálnej dominancie rečových funkcií a horných končatin u zdravých subjektou
- Extrakraniálně metastazující meningeomy
- Intervenční léčba ischemické cévní mozkové příhody systémem EkoSonic SVTM
- Význam zadněprovazcové symptomatiky v diferenciální diagnostice hereditárních ataxií
- Rizikový profil pacientů s prodělanou ischemickou cévní mozkovou příhodou – analýza dat z registru IKTA
- Srovnání epidemiologických dat u akutních cévních mozkových příhod podle metodiky ÚZIS a IKTA ve zlínském okrese a v ČR
- Mnohočetný ložiskový proces mozku u HIV pozitivní pacientky – kazuistika
- Myozitida s inkluzními tělísky se slabostí šíjových svalů a pozitivním efektem imunoglobulinu – kazuistika
- Apoplexie Rathkeho cysty – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XXXIX. Statistické nástroje pro posouzení homogenity a korekci odhadů poměru šancí a relativního rizika -
X. afaziologické sympozium s českou a slovenskou účastí
14.–15. března 2013, Brno
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Mechanizmy spasticity a její hodnocení
- Lidské prionové nemoci v České republice – 10 let zkušeností s diagnostikou
- Myozitida s inkluzními tělísky se slabostí šíjových svalů a pozitivním efektem imunoglobulinu – kazuistika
- Extrakraniálně metastazující meningeomy

![Tardieu škála [40].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/42c92e2f12f680dfdc3a5f9e6d400bbc.png)
![Svalový test [48].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/8a9c24480678625aedb36c72a8b9b711.png)
