Myasthenia gravis – kritické zhodnocení přínosu svalové biopsie prováděné během thymektomie
Myasthenia Gravis – a Critical Assessment of the Contribution of Muscle Biopsy Performed During Thymectomy
Objective:
Surprisingly, structural changes o utside the ne uromuscular juncti ons were reported in limited seri es of myastheni a gravis (MG) muscles previ o usly – mainly small collecti on of interstiti al lymphocytes and atrophy of type II muscle fibers. However, the pathophysiological mechanisms remained uncle ar. We performed a systematic study on MG muscle bi opsi es to contribute to understanding of the associ ation to MG and to demonstrate possible prognostic value.
Methods:
Sternothyro id muscle bi opsies from 207 MG patients taken during thymectomy were analyzed histopathologically and by histochemistry and morphometry and correlated to the clinical fe atures and the o utcome of MG pati ents.
Results:
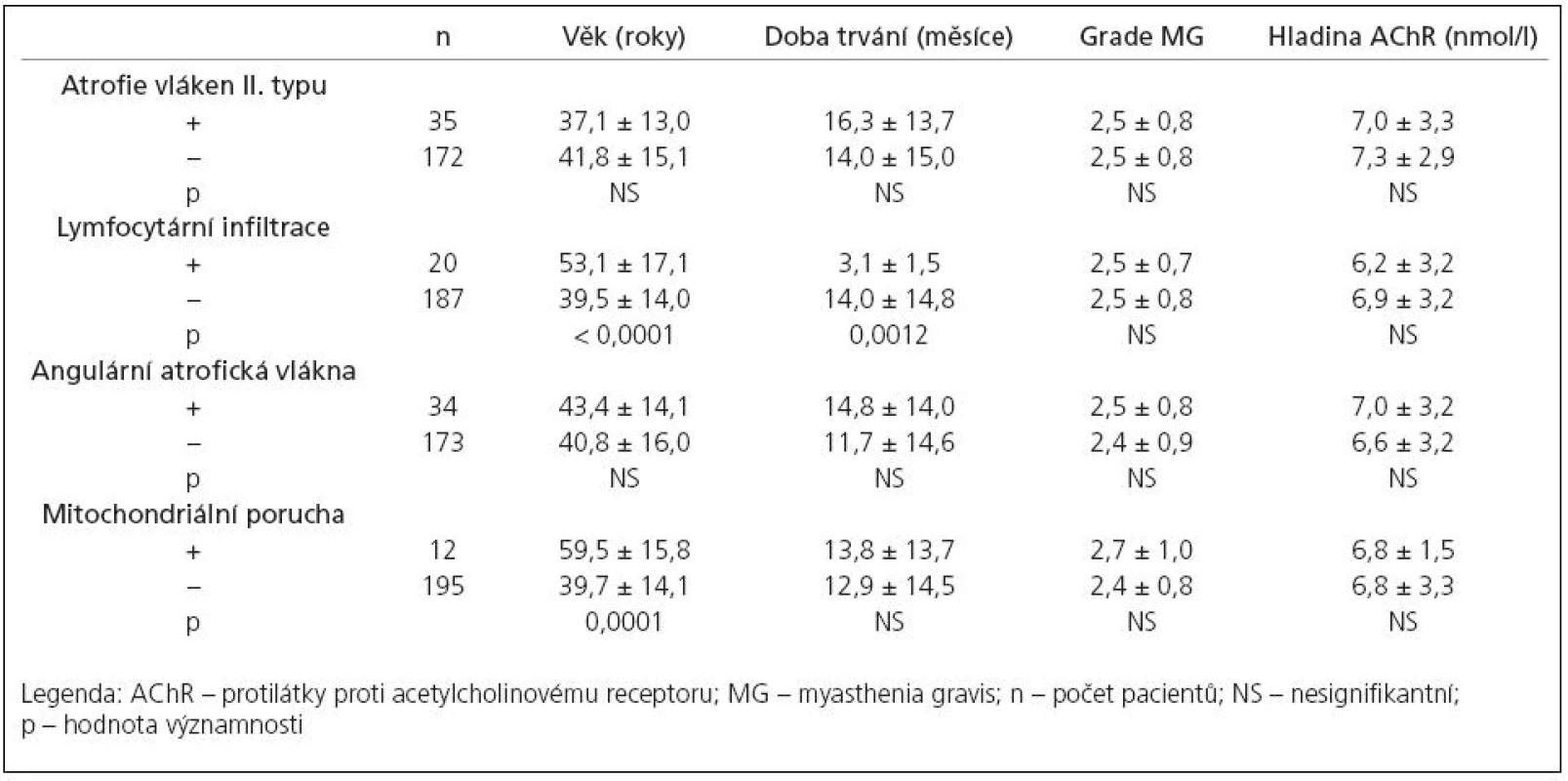
In 143 MG pati ents, no obvi o us pathological changes were observed in muscle bi opsi es. In 20 pati ents we observed an interstiti al infiltrati on by mature naive CD45RA+lymphocytes. The lymphocytic infiltrati on associ ated with the thymus pathology, mainly with thymoma. The morphometry disclosed selective atrophy of type II muscle fibers in 35 cases. The atrophy of type II muscle fibers was related to long‑term corticostero id tre atment and the potenti al prognostic value co uld be demonstrated for its detecti on: the MG pati ents with type II fibers atrophy presented slower tendency to re ach remissi on. Further, in 12 cases we demonstrated mild changes in mitochondri al metabolism, in 34 cases we disclosed angular atrophic fibers; no prognostic value was demonstrated for these changes.
Conclusi ons:
The previ o usly reported histopathological changes in MG muscle are rare and mostly do not represent a fe ature of the MG, rather a consequence of the thymic disorder or of the long‑term stero id therapy. The value of muscle bi opsy performed during thymectomy for the particular MG pati ent remains controversi al.
Key words:
myasthenia gravis – muscle biopsy – thymectomy – prognosis
Authors:
J. Zámečník 1; J. Piťha 2; J. Schützner 3; D. Veselý 1,4; B. Jakubička 1
Authors‘ workplace:
Ústav patologie a molekulární medicíny, UK 2. LF a FN v Motole, Praha, 2Neurologická klinika, UK 1. LF a VFN, Praha, 3III. chirurgická klinika, UK 1. LF a FN v Motole, Praha, 4I. infekční klinika, UK 2. LF a FN Bulovka, Praha
1
Published in:
Cesk Slov Neurol N 2009; 72/105(2): 147-154
Category:
Original Paper
Overview
Cíl:
Ve svalové tkáni při myasthenii gravis (MG) byly už dříve popsány histologické změny (lymfocytární infiltráty, atrofi e vláken II. typu). Patogeneze těchto změn však zůstala nejasná. V naší studii jsme provedli systematicko u analýzu svalových bi opsi í paci entů s MG s cílem zmapovat histopatologické změny mimo nervosvalovo u ploténku, objasnit spojitost těchto změn s vlastní MG a stanovit jejich případný prognostický význam.
So ubor a metodika:
Biopsie m. sternothyroideus 207 paci entů s MG odebrané během thymektomi e byly analyzovány histopatologicky, histochemicky a morfometricky. Výsledky byly korelovány s klinickými a laboratorními parametry onemocnění.
Výsledky:
U 143 paci entů jsme v svalové tkáni nezaznamenali žádné histopatologické změny. Ve 20 případech jsme v interstici u svalové tkáně nalezli infiltraci lymfocyty; na rozdíl od polymyozitidy se však jednalo o zralé naivní CR45RA+ T lymfocyty. Lymfocytární infiltrace měla vztah k onemocnění thymu. Ve 35 případech jsme morfometricky zjistili atrofii vláken II. typu, korelující s léčbo u kortikostero idy. Tito paci enti dosáhli remise onemocnění po delší době než paci enti bez atrofi e. Ve 12 bi opsi ích jsme nalezli nevýrazné známky porušeného mitochondri álního metabolizmu, ve 34 případech byla přítomna angulární atrofická vlákna; pro žádno u z těchto změn jsme neprokázali prognostický význam.
Závěry:
Strukturální změny svalové tkáně při MG mimo nervosvalovo u ploténku většino u nejso u odrazem vlastní MG; spíše se jedná o důsledek onemocnění thymu nebo dlo uhodobé terapi e kortikostero idy. K diskuzi zůstává otázka, zda má smysl u paci entů s MG svalovo u bi opsii během thymektomi e nadále provádět, přínos získaných informací je spíše sporný.
Klíčová slova:
myasthenia gravis – svalová biopsie – thymektomie – prognóza
Úvod
Myasthenia gravis (MG) je autoimunitní onemocnění nervosvalové ploténky způsobené nejčastěji autoprotilátkami proti acetylcholinovému receptoru (AChR) [1]. Protože cesta ke stanovení diagnózy MG vede při charakteristickém klinickém obraze přes specifický nález při elektromyografickém vyšetření, případně sérologický průkaz příslušných autoprotilátek, bývají pacienti zřídka (pokud vůbec) indikováni ke svalové biopsii [2]. Znalost morfologických změn ve svalové tkáni při MG tedy není důležitá pro diagnostiku vlastní MG. Zajímavá však začne být ve chvíli, kdy pacient s atypickou klinickou prezentací přichází ke svalové biopsii pro odlišení MG od jiných primárních myopatií [3]. U funkční poruchy nervosvalové ploténky bychom neočekávali výraznější morfologické změny ve svalové tkáni mimo nervosvalovou ploténku, přesto se už dříve objevily kazuistiky nebo malé sestavy případů (často autoptických), které o přítomnosti takových změn u MG informovaly. Zejména šlo o přítomnost lymfocytární infiltrace endomyzia a atrofizace svalových vláken II. typu [4–7]. Přestože zůstala patogeneze těchto změn nevysvětlena, byl jejich popis převzat do většiny neuropatologických i neurologických učebnic, ve kterých se traduje dodnes [8,9].
V našem centru je už po desetiletí zavedena na světě poměrně ojedinělá praxe, a to provádění svalové biopsie během thymektomie [10]. To nám poskytlo vzácnou možnost studovat lidský myastenický sval. Cílem tohoto sdělení je shrnout výsledky našeho několikaletého úsilí o zmapování morfologických změn ve svalové tkáni mimo nervosvalovou ploténku při MG na velké sestavě pacientů [11,12], nastínit jejich možnou patogenezi a stanovit v rozšířeném souboru jejich případný prognostický význam. Ačkoli je svalová biopsie během thymektomie výkonem, který pro pacienta nepředstavuje významnější zátěž, chceme se na podkladě našich zjištění kriticky zamyslet nad tím, zda biopsií získané informace přinášejí také prospěch pro další léčbu konkrétního pacienta a zda je tedy racionální v této praxi i nadále pokračovat.
Soubor a metodika
Pacienti
Do naší studie jsme zařadili celkem 207 pacientů s MG (92 mužů a 115 žen; průměrný věk 41,0 ± 14,9 let) sledovaných v Centru pro diagnostiku a léčbu myasthenia gravis Neurologické kliniky 1. LF UK a VFN, kteří podstoupili thymektomii ve Fakultní nemocnici v Motole v letech 2002–2007. Střední doba trvání onemocnění před operací byla 13,0 ± 14,5 měsíců. Diagnóza MG byla stanovena na podkladě typického klinického obrazu a nálezu při elektromyografii [2]. Všichni pacienti zařazení do této sestavy měli zvýšenou hladinu protilátek proti AChR (střední hodnota 7,1 ± 3,3 nmol/l), tj. jednalo se o případy tzv. seropozitivní MG. Stupeň tíže MG před odběrem svalové biopsie byl hodnocen podle modifikované Ossermanovy klasifikace [13]: I – okulární forma (n = 27; 13,0 %); II – mírná generalizovaná forma bez bulbární symptomatiky (n = 73; 35,3 %); III – mírná generalizovaná forma MG s mírnou bulbární symptomatikou (n = 93; 44,9 %); IV – středně těžká generalizovaná forma s mírnou bulbární symptomatikou a slabostí respiračních svalů (n = 14; 6,8 %); V – těžká generalizovaná forma (n = 0). U všech pacientů byla provedena transsternální thymektomie a resekovaný thymus byl histologicky vyšetřen. Distribuce patologických změn v thymu byla následující: thymom – 35 pacientů (16,9 %), folikulární hyperplazie – 121 pacientů (58,5 %), atrofie – 51 pacientů (24,6 %). Všichni pacienti byli před operací léčeni inhibitory acetylcholinesterázy. 111 pacientů (53,6 %) vyžadovalo před operací léčbu kortikosteroidy, buď prednizonem (n = 92; 44,4 %), nebo metylprednizolonem (n = 19; 18,4 %). Někteří pacienti byli navíc léčeni azatioprinem (n = 38; 18 %), mykofenolát mofetilem (n = 5; 2,4 %) nebo podstoupili před operací plazmaferézu (n = 26; 12,6 %).
Po thymektomii byli pacienti pravidelně sledováni (19 až 75 měsíců; střední hodnota 35,0 ± 13,3 měsíců) v půlročních intervalech. Stav MG při průběžných kontrolách byl v naší skupině pacientů klasifikován podle doporučení MGFA pro klinický výzkum [14]: CSR – kompletní stabilní remise; PR – farmakologická remise; I – zlepšení s minimálními klinickými příznaky; U – nezměněný stav; W – zhoršení.
Svalová biopsie – histochemie a morfometrie
Excizem. sternothyroideus (velikosti asi 10 × 5 × 5mm) byla u pacientů s MG získávána z okraje operačního pole před zahájením thymektomie. Pro část studie analyzující zánětlivé buňky ve svalové tkáni při MG jsme použili kontrolní vzorky 18 pacientů s ověřenou polymyozitidou. Všichni pacienti v naší sestavě poskytli informovaný souhlas.
Svalovou tkáň jsme zmrazili v izopentanu (2-metylbutan, Sigma-Aldrich, Co.) a v kryokatu připravili 8 µm silné zmražené řezy. Ty jsme nejdříve barvili standardně hematoxylinem a eozinem – zde jsme hodnotili jednak přítomnost kulatých atrofických vláken a další známky myopatického vzorce (internalizace jader, štěpení vláken, případně degeneraci a regeneraci vláken), dále prvky neurogenní přestavby (angulární atrofická vlákna, skupinová atrofie) a přítomnost zánětlivé infiltrace.
Typizace svalových vláken a morfometrie
Reakce na průkaz myofibrilární ATPázy s preinkubací při různém pH ve zmraženém řezu podle standardních protokolů [15] ozřejmily jednotlivé podtypy svalových vláken – v naší studii jsme pracovali zejména s preinkubací při pH 4,6 umožňující kromě rozlišení základních typů vláken I a II i diferenciaci podtypů IIA a IIB. Takto barvené řezy jsme podrobili histomorfometrické analýze umožňující stanovení změn v distribuci velikosti jednotlivých podtypů svalových vláken (resp. selektivní atrofii určitého typu svalových vláken). Velikost svalových vláken jsme měřili na digitalizovaném obraze pomocí programu QuickPhoto Pro 2.2. (Olympus Co.). Ze získaných hodnot jsme konstruovali histogramy a vypočítali metodou podle Brookeho a Engela [16] tzv. atrofický faktor (AF) pro jednotlivé podtypy svalových vláken (graf 1). Pokud hodnota AF překročila arbitrárně stanovenou hranici (150 pro muže a 100 pro ženy), byla změna označena jako atrofie příslušného typu svalového vlákna (pro metodické detaily histomorfometrické analýzy [12]). Počet vyšetřených svalových vláken jednoho případu kolísal mezi 175 a 568 (střední hodnota 243,7 ± 58,5).

Oxidativní enzymy
V reakci na průkaz oxidativních enzymů, tj. NADH-tetrazolium reduktázy (NADH-TR), sukcinát dehydrogenázy (SDH) a cytochrom-c-oxidázy (COX) prováděných podle standardních protokolů [15], jsme sledovali změny v distribuci, množství a reaktivitě mitochondrií a organizaci myofibrilární sítě.
Zánětlivá infiltrace
Ve svalových excizích jsme cíleně pátrali po infiltraci zánětlivými buňkami – nejen v přehledném barvení hematoxylinem a eozinem, ale také průkazem společného antigenu leukocytů (LCA). Pokud byly zánětlivé buňky nalezeny, byly dále typizovány imunohistochemickým průkazem CD20, CD8, CD4 a markerem zralých naivních lymfocytů CD45RA. Ve všech případech s lymfocytární infiltrací jsme také provedli imunohistochemický průkaz přítomnosti HLA‑1 ve tkáni, což je znak s výhodou používaný při diagnostice autoimunitních myozitid [17]. Použité protilátky, jejich ředění a použité detekční kity jsou uvedeny v tab. 1.
Statistika, korelační analýzy, analýza prognostického významu
Po zmapování morfologických změn ve svalové tkáni při MG jsme zkoumali jejich asociaci s klinickými parametry onemocnění – kromě tíže a doby trvání MG před operací jsme korelovali výskyt jednotlivých morfologických změn s věkem pacienta, hladinou autoprotilátek proti AChR, s typem a intenzitou terapie před operací a s histologickými změnami v thymu. Pro statistické porovnávání kontinuálních dat jsme používali Studentův t test, pro data kategorická Fisherův exaktní test. Hodnoty jsou udávány jako střední hodnota ± směrodatná odchylka.
Pro posouzení prognostického významu jednotlivých morfologických parametrů jsme konstruovali pro podskupiny pacientů rozdělených podle přítomnosti dané změny křivky metodou podle Kaplana a Meiera. Ty znázornily rozdíl v době dosažení asymptomatického stavu (remission rate, RR = poměr počtu asymptomatických pacientů – tj. CSR nebo PR, k celkovému počtu sledovaných pacientů v daném intervalu od operace) a v době dosažení zlepšení klinického stavu (improvement rate, IR = procento pacientů v daném intervalu od operace, jejichž stav se po operaci zlepšil – tj. pacienti kategorií CSR, PR a I). Pomocí log‑rank testu jsme pak hodnotili sílu asociace mezi podskupinami pacientů a prognózou. Veškeré statistické výpočty jsme prováděli pomocí počítačového programu SPSS (verze 10, SPSS Inc.). Hodnoty významnosti (p) < 0,05 jsme považovali za signifikantní.
Výsledky
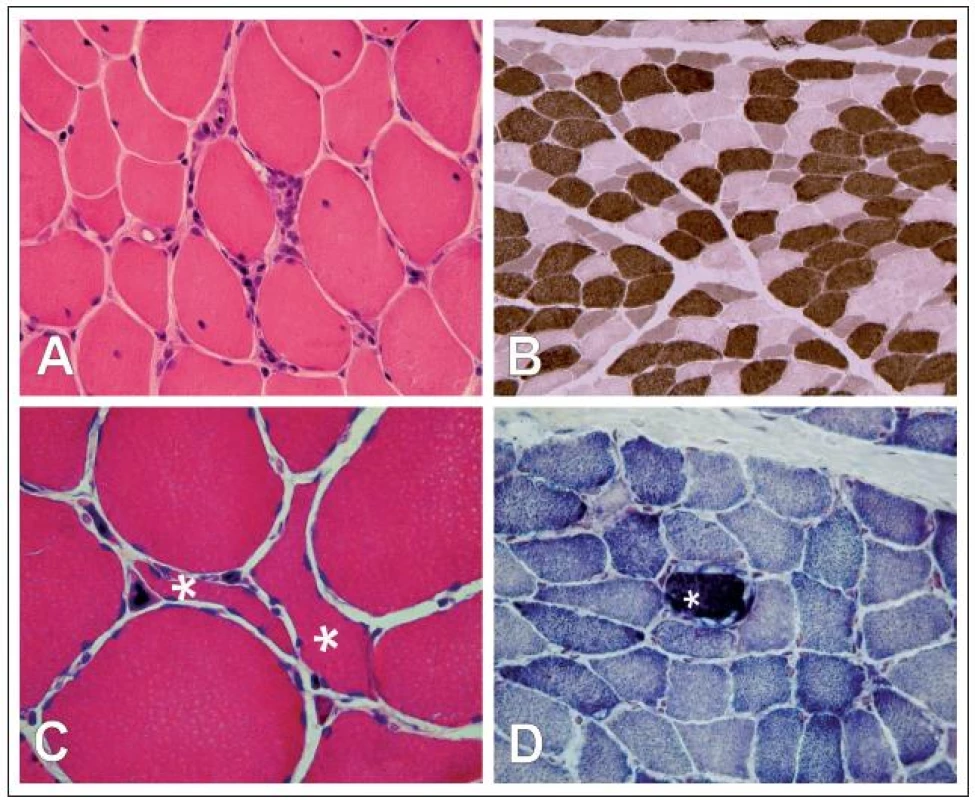
Ve svalové tkáni 143 pacientů s MG (69,1 %) jsme v histologických, histochemických, imunohistologických ani morfometrických analýzách žádné patologické změny neprokázali. Ve zbylé části vzorků, tj. u 64 pacientů (30,9 %), jsme změny nalezli. Lze je rozčlenit do čtyř skupin (obr. 1):
- fokální endomyziální lymfocytární infiltrace podobná polymyozitidě;
- selektivní atrofizace vláken II. typu;
- prvky neurogenní atrofie svalu;
- známky změn v mitochondriálním metabolizmu.
1. Fokální endomyziální lymfocytární infiltrace podobná polymyozitidě
Ve svalové biopsii 20 pacientů s MG (9,7 %, tab. 2) jsme v endomyziu nalezli fokální lymfocytární infiltraci, která by byla při běžném vyšetření jen obtížně odlišitelná od polymyozitidy, tj. lymfocyty obklopovaly nenekrotická svalová vlákna a imunofenonotypizace prokázala složení infiltrátu z CD8+ T lymfocytů (obr. 2). Ukázali jsme však rozdíly mezi skutečnou polymyozitidou a lymfocytární infiltrací myastenického svalu: u MG jsme nikdy nenalezli nekrotizaci svalových vláken ani autoagresivní invazi lymfocytů do svalových vláken, což jsou znaky běžné u polymyozitidy. Na rozdíl od polymyozitidy, kde bývá typicky silná difuzní exprese HLA‑I na povrchu vláken i mimo zánětlivý infiltrát, jsme u MG nalezli tento povrchový znak jen na povrchu vláken v blízkosti lymfocytárního infiltrátu. Nejdůležitějším rozdílem se ukázala skutečnost, že lymfocyty u MG byly na rozdíl od polymyozitidy pozitivní v imunohistochemickém průkazu CD45RA, což je znak zralých, ale naivních (tj. antigenně nestimulovaných) lymfocytů (obr. 2).
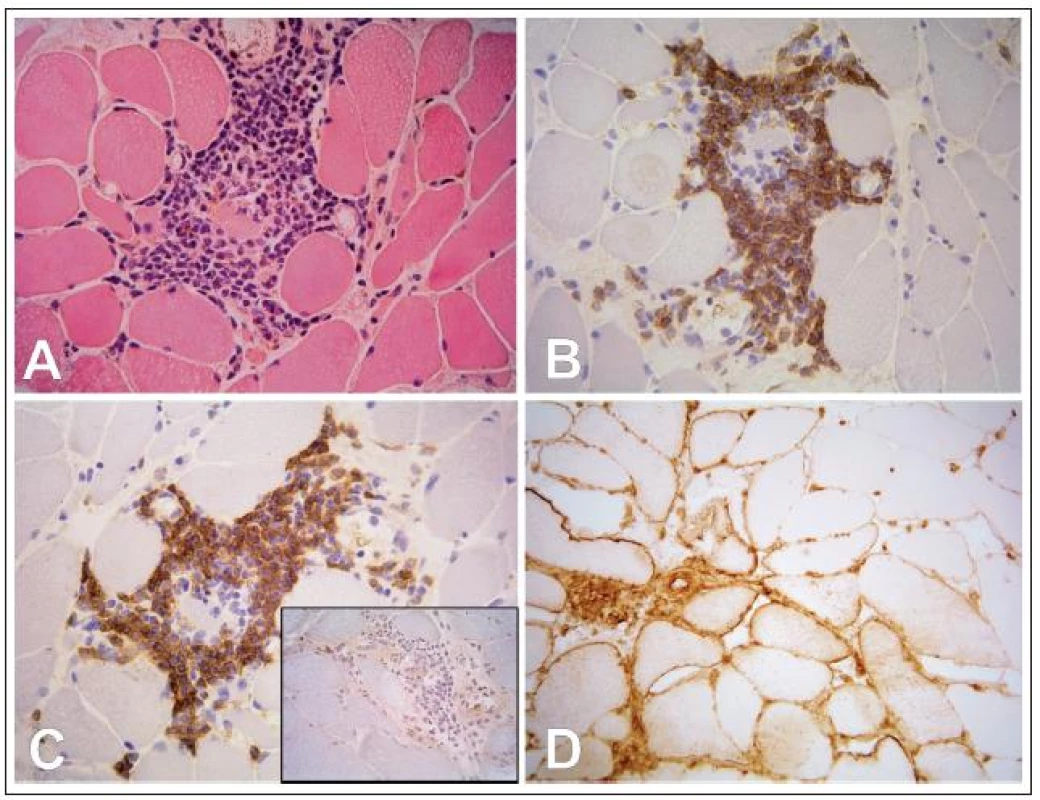
18 pacientů s lymfocytárním infiltrátem mělo thymom (17 WHO typu B, 1 WHO typu AB), u zbylých dvou jsme v thymu diagnostikovali folikulární hyperplazii. U pacientů s atrofickým thymem nebo s thymomem WHO typu A jsme lymfocytární infiltraci nenalezli. Pacienti s lymfocytárním infiltrátem ve svalu měli signifikantně vyšší věk a kratší dobu trvání onemocnění před thymektomií. Statistické zhodnocení prognostického významu nálezu lymfocytární infiltrace v intersticiu svaloviny při MG ukázalo, že pacienti s lymfocyty se od pacientů bez lymfocytů nelišili ani v dosažení RR ani IR.
2. Selektivní atrofie vláken II. typu
Morfometrickou analýzou jsme prokázali, že u 35 pacientů (16,9 %, tab. 2) došlo k selektivní atrofii vláken II. typu s akcentací v podtypu IIB. Atrofie vláken byla spíše mírného stupně (AF: 214–1 752, střední hodnota 738,1 ± 431,9). Korelační analýza neprokázala souvislost selektivní atrofie vláken II. typu s věkem pacienta, hladinou autoprotilátek, tíží ani délkou trvání onemocnění. Jedinou signifikantní asociací je souvislost s předoperační léčbou kortikosteroidy – morfometricky ověřená atrofie vláken II. typu byla přítomna jen u pacientů léčených před operací kortikoidy (výrazněji při podávání metylprednizolonu v porovnání s prednizonem). Navíc, frekvence výskytu atrofizace vláken II. typu byla úměrná rostoucí dávce podávaných steroidů (graf 2). Pacienti s atrofií vláken II. typu jevili signifikantně pomalejší tendenci v dosažení asymptomatického stavu po thymektomii, celková tendence ke zlepšení se však mezi oběma skupinami signifikantně nelišila (graf 3).


Morfometrická analýza je velmi časově náročná a není vhodná do běžného diagnostického provozu histopatologické laboratoře. Provedli jsme tedy analýzu vzorků znovu, avšak atrofizaci vláken jsme nekvantifikovali exaktně – stanovili jsme ji běžným, tj. semikvantitativním způsobem subjektivním posouzením histopatologem. Není bez zajímavosti, že při subjektivním posuzování atrofie vláken II. typu bez exaktní morfometrie s využitím počítačové analýzy obrazu jsme stanovili přítomnost mírné atrofie vláken II. typu u 62 pacientů (30,0 %). Toto zjištění pak statisticky nekorelovalo s žádným z klinických parametrů onemocnění včetně léčby kortikosteroidy; podobně, statistická analýza prognostického významu neprokázala signifikantní rozdíl mezi takto stanovenými podskupinami pacientů v době dosažení zlepšení nebo asymptomatického stavu (graf 4).

3. Prvky neurogenní atrofie
V 34 případech (16,4 %, tab. 2) jsme zaznamenali přítomnost disperzně uložených angulárních atrofických vláken, která jsou ve svalové biopsii známkou denervace. Tato vlákna netvořila v žádném ze zkoumaných případů více než 5 % vláken. Známky pokročilejší denervace s fenoménem seskupování svalových vláken a skupinovou atrofií svalových vláken jsme nepozorovali. Korelační analýza neprokázala signifikantní souvislost mezi přítomností angulárních atrofických svalových vláken s žádným z klinických parametrů onemocnění a ani analýza prognostického významu neprokázala rozdíl v prognóze mezi podskupinami pacientů s angulárními atrofickými vlákny a bez nich.
4. Známky změn v mitochondriálním metabolizmu
Známky změn v mitochondriálním metabolizmu ve formě fokálního subsarkolemálního hromadění SDH‑reakčního produktu, ojediněle až s tvorbou „ragged red fibers“ jsme pozorovali u 12 pacientů (5,8 %, tab. 2). Přítomnost COX negativních vláken jsme u našich pacientů nenalezli. Statistická analýza prokázala signifikantně vyšší věk u pacientů s mitochondriální poruchou; žádnou další signifikantní souvislost mezi touto změnou a klinickými parametry onemocnění ani prognózou pacientů jsme nezjistili.
Diskuze
Stanovení diagnózy MG nespočívá ve vyšetření svalové biopsie, přesto má znalost morfologických změn ve svalové tkáni při MG svoji klinickou významnost – MG může v atypických případech klinicky napodobovat jiná neuromuskulární onemocnění [3] a pacienti jsou pak indikováni ke svalové biopsii pro diferenciálně diagnostické rozhodnutí.
Nejčastěji se setkáváme s nutností odlišit atypicky se prezentující MG a polymyozitidu. To dlouhou dobu znesnadňovaly literární údaje, podle kterých mohou být jak u MG, tak u polymyozitidy v endomyziu přítomny lymfocytární infiltráty převážně z CD8+ T lymfocytů [8,9]. Naše pilotní výsledky tomu rovněž nasvědčovaly, avšak zjištění, že lymfocyty jsou u MG na rozdíl od polymyozitidy zralé, ale naivní (tj. antigenně nestimulované, CD45RA+), dává diagnostikujícímu patologovi do ruky účinný nástroj pro rozlišení obou jednotek. Podobně chybění dalších znaků polymyozitidy (autoagresivní invaze lymfocytů do svalových vláken, odlišná exprese HLA‑I na povrchu vláken) nyní umožňuje obě jednotky odlišit. Pasivita svalové tkáně k přítomnosti lymfocytů v intersticiu navíc přináší ospravedlnění dříve používanému termínu MG s „lymforagiemi“. K vysvětlení původu zralých naivních lymfocytů ve svalové tkáni u MG vede naše pozorování, že jejich přítomnost ve svalovině byla významně spojena s přítomností thymomu. Nedávno bylo totiž prokázáno, že thymomy bohaté na lymfocyty (tj. WHO typ B, příp. AB) jsou schopny generovat zralé naivní lymfocyty a vyplavovat je do periferního oběhu [18]. Ty pak mají pravděpodobně schopnost kolonizovat další tkáně. Nález lymfocytárních infiltrátů u pacientů s folikulární hyperplazií thymu navíc naznačuje, že podobného efektu je schopen i hyperplastický thymus. Lymfocytární infiltrace intersticia myastenického svalu tedy není skutečným zánětem, ale jen koincidentální kolonizací lymfocyty vyplavenými patologicky změněným thymem. I to má svoji důležitost – bioptický nález infiltrace svalové tkáně zralými naivními lymfocyty by neměl vést ke stanovení diagnózy myozitidy, ale spíše k vyloučení nádoru thymu [11]. Vyšší věk ve skupině pacientů s lymfocytárním infiltrátem ve svalu je vysvětlitelný skutečností, že thymom se vyskytuje spíše u starších pacientů. Kratší doba trvání MG před thymektomií zase odráží skutečnost, že pacienti s MG a thymomem jsou k thymektomii indikováni časněji než pacienti s MG bez thymomu [2].
Naše studie potvrdila předešlá pozorování, že se ve svalové tkáni při MG může vyskytovat selektivní atrofie vláken II. typu [4–6,19]. Je to však jev méně častý, než se předpokládalo ve studiích na malém počtu pacientů [7,19]. Selektivní atrofie vláken II. typu akcentovaná na vlákna typu IIB je poměrně charakteristická pro chronickou steroidní myopatii [20]. Vzhledem k námi prokázané souvislosti s léčbou kortikosteroidy se domníváme, že atrofie svalových vláken II. typu u MG není odrazem vlastní myasthenie, ale že jde spíše o steroidy indukovanou změnu. Jedná se však o změnu subklinickou, neboť u našich pacientů nebyla během sledování klinicky zpozorována jiná svalová slabost než by odpovídalo MG. Stupeň atrofie svalových vláken v naší sestavě pacientů s MG byl v porovnání s klinicky významnými případy chronické steroidní myopatie podstatně menší, a tak nemuselo dojít k překročení prahu pro klinickou manifestaci. Minimální symptomatologie steroidní myopatie také mohla zůstat ve stínu příznaků MG. Ačkoli se pacienti s MG a atrofií vláken II. typu nelišili od pacientů bez atrofie ve smyslu zlepšení klinického stavu MG po thymektomii, prokázali jsme u nich pomalejší tendenci (i když nikterak dramatickou) k dosažení asymptomatického stavu. Zůstává otázkou, zda by tedy pacienti s MG a atrofií vláken II. typu nemohli mít prospěch ze změny léčebné strategie. Na druhou stranu, ke spolehlivému stanovení mírné atrofie svalových vláken je nutná časově velmi náročná počítačová morfometrická analýza, což je v běžném diagnostickém provozu obtížně realizovatelné. Subjektivní semikvantitativní hodnocení mírné atrofie svalových vláken se ukázalo být spíše zavádějící.
Známky neurogenních změn ve svalové tkáni (zejména angulární atrofická vlákna) pozorované u malé části našich pacientů mohou být odrazem „funkční denervace“ při poruše nervosvalové ploténky. Každopádně tato změna neměla prognostický význam.
Známky poruchy mitochondriálního metabolizmu byly ojediněle pozorovány i jinými autory a poskytovaly lákavé vysvětlení pro řadu případů MG, u kterých nejsou přítomny protilátky proti AChR (tzv. seronegativní MG) [19,21,22]. Naši pacienti však byli všichni seropozitivní. Souvislost mezi vyšším věkem pacientů a přítomností mitochondriálních změn v naší sestavě naznačují, že tyto změny jsou spíše než odrazem MG známkami stárnutí svalové tkáně [23].
Závěrem můžeme shrnout, že naše analýza svalové tkáně pacientů s MG přispěla k pochopení geneze některých již dříve popisovaných změn (lymfocytární infiltráty, selektivní atrofie vláken II. typu) a dala vzniknout novým nástrojům pro diferenciálně diagnostické odlišení MG od některých primárních myopatií ve svalové biopsii. Přes tento jednoznačně pozitivní přínos jsme však ukázali, že informace získané svalovou biopsií při thymektomii mají pro další léčbu a prognózu konkrétního pacienta jen okrajový význam. Zařazení svalové biopsie do rutinního protokolu provádění thymektomie u pacientů s MG je tedy spíše sporné.
Podpora projektu: IGA MZČR NR8924-3.
doc. MUDr. Josef Zámečník, Ph.D.
Ústav patologie a molekulární medicíny
UK 2. LF a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: josef.zamecnik@lfmotol.cuni.cz
Sources
1. Romi F, Gilhus NE, Aarli JA. Myastheni a gravis: clinical, immunological, and therape utic advances. Acta Ne urol Scand 2005; 111(2): 134 – 141.
2. Engel AG, Hohlfeld R. Acquired a uto immune myastheni a gravis. In: Engel AG, Franzini‑Armstrong C (eds). Myology. 3rd ed. New York: McGraw - Hill Inc. 2004 : 1755 – 1790.
3. Engstrom JW. Myastheni a gravis: di agnostic mimics. Semin Ne urol 2004; 24(2): 141 – 147.
4. Fenichel GM. Muscle lesi ons in myastheni a gravis. Ann N Y Acad Sci 1966; 135(1): 60 – 67.
5. Russell DS. Histological changes in the striped muscles in myastheni a gravis. J Pathol Bacteri ol 1953; 65(2): 279 – 289.
6. Engel WK, McFarlin DE. Muscle lesi ons in myastheni a gravis. Ann N Y Acad Sci 1966; 135(1): 68 – 78.
7. Havlíček F, Šmat V. Histometrická analýza svalové atrofi e u myastheni a gravis. Čas Lék Česk 1980; 119(22): 629 – 632.
8. Dubowitz V, Sewry CA. Myastheni a gravis. In: Dubowitz V, Sewry CA (eds). Muscle Bi opsy: A practical appro ach. 3rd ed. London: Sa unders 2007 : 512 – 520.
9. Weller RO, Cumming WJK, Mahon M, Ellison DW. Dise ases of Muscle: Myastheni a gravis. In: Graham DI, Lantos PL (eds). Greenfi eld‘s Ne uropathology. 7th ed. London: A Hodder Arnold Publicati on 2002 : 715 – 716.
10. Schützner J, Šmat V. Myastheni a gravis – komplexní pojetí a chirurgická léčba. Praha: Galén 2005.
11. Zámečník J, Veselý D, Jakubička B, Šimková L, Piť ha J, Schützner J et al. Muscle lymphocytic infiltrates in thymoma-associated myasthenia gravis are phenotypically different from those in polymyositis. Neuromuscul Disord 2007; 17(11–12): 935-942.
12. Zámečník J, Veselý D, Jakubička B, Cibula A, Piť ha J, Schützner J et al. Atrophy of type II fibers in myasthenia gravis muscle in thymectomized patients: steroid-induced change with prognostic impact. J Cell Mol Med 2009: In press.
13. Osserman KE, Genkins G. Studi es in myastheni a gravis: revi ew of a twenty - ye ar experi ence in over 1200 pati ents. Mt Sinai J Med 1971; 38(6): 497 – 537.
14. Jaretzki A, Barohn RJ, Ernstoff RM, Kaminski HJ, Keesey JC, Penn AS et al. Myastheni a gravis: recommendati ons for clinical rese arch standards. Task Force of the Medical Sci entific Advisory Bo ard of the Myastheni a Gravis Fo undati on of America. Ne urology 2000; 55(1): 16 – 23.
15. Sheehan DC, Hrapchak BB. The ory and practice of histotechnology. 2nd ed. Columbus, Ohi o: Mosby 1987.
16. Bro oke MH, Engel WK. The histographic analysis of human muscle bi opsi es with regard to fiber types. 1. Adult male and female. Ne urology 1969; 19(3): 221 – 233.
17. Vogel H, Zámečník J. Diagnostic immunohistology of muscle diseases. J Neuropathol Exp Neurol 2005; 64(3): 181-193.
18. Hoffacker V, Schultz A, Ti esinga JJ, Gold R, Schal ke B, Nix W et al. Thymomas alter the T - cell subset compositi on in the blo od: a potenti al mechanism for thymoma‑associ ated a uto immune dise ase. Blo od 2000; 96(12): 3872 – 3879.
19. Martignago S, Fanin M, Albertini E, Pegoraro E, Angelini C. Muscle histopathology in myastheni a gravis with antibodi es against MuSK and AChR. Ne uropathol Appl Ne urobi ol 2009; 35(1):103 – 110.
20. Polla B, Bottinelli R, Sandoli D, Sardi C, Reggi ani C. Cortisone‑induced changes in myosin he avy chain distributi on in respiratory and hindlimb muscles. Acta Physi ol Scand 1994; 151(3): 353 – 361.
21. Rostedt Punga A, Ahlqvist K, Bartocci oni E, Scude ri F, Marino M, Suomalainen A et al. Ne urophysi ological and mitochondri al abnormaliti es in MuSK antibody seropositive myastheni a gravis compared to other immunological subtypes. Clin Ne urophysi ol 2006; 117(7): 1434 – 1443.
22. Shichijo K, Mitsui T, Kunishige M, Kuroda Y, Masuda K, Matsumoto T. Involvement of mitochondri a in myastheni a gravis complicated with dermatomyositis and rhe umato id arthritis: a case report. Acta Ne uropathol 2005; 109(5): 539 – 542.
23. Lambert AJ, Brand MD. Rese arch on mitochondri a and aging, 2006 – 2007. Aging Cell 2007; 6(4): 417 – 420.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2009 Issue 2
-
All articles in this issue
- Neurodegenerativní demence
- Krční myelopatie – diagnostický problém
- Longitudinální sledování růstu po operačních reziduí afunkčních adenomů hypofýzy
- Radi ofrekvenční terapi e facetových bolestí bederní páteře
- Indikace přední náhrady meziobratlové ploténky u zlomenin hrudní a bederní páteře s využitím magnetické rezonance – prospektivní studie
- Extra- intrakraniální arteri ální mikro anastomóza
- Počítačem modelované náhrady kostních defektů lební klenby
- Časná karotická endarterektomi e pro reziduální kriticko u stenózu krkavice po intravenózní trombolýze
- Myasthenia gravis – kritické zhodnocení přínosu svalové biopsie prováděné během thymektomie
- Leberova hereditární optická neuropatie s oligoklonálními pásy v likvoru považovaná za roztro ušeno u sklerózu – kazuistika
- Progresivní multifokální leukoencefalopatie jako komplikace léčby lymfomu – kazuistika
- Maligní tumor z pochvy periferního nervu – dvě kazuistiky
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Krční myelopatie – diagnostický problém
- Neurodegenerativní demence
- Maligní tumor z pochvy periferního nervu – dvě kazuistiky
- Radi ofrekvenční terapi e facetových bolestí bederní páteře
