Diazepam i. m. – nejčastěji užívaný, ale nevhodný lék ke zvládání akutní úzkosti, agitovanosti a agresivity
Diazepam i. m. – the Most Common, but Inappropriate Medication for Management of Acute Anxiety, Agitation and Aggression
Introduction:
There is a need for intramuscular (IM) administration of benzodiazepines for acute restlessness, anxiety and agitation. In the Czech Republic, diazepam is frequently used. The aim of this study was to determine the variability of serum diazepam concentrations after IM administration and evaluate its clinical effect.
Methods:
We included six men, who were administered 10 mg of diazepam IM in an outpatient setting. Measurements were carried out 30 minutes (T1), 4 (T2) and 24 hours (T3) after diazepam administration. The diagnosis was determined using the Mini-International Neuropsychiatric Interview, anxiety was quantified by the Hamilton Anxiety Rating Scale (HAMA).
Results:
The mean levels of diazepam in the serum were 14.6 ng/ml at T1 (after 30 minutes), 48.6 ng/ml at 4 hours and 28.7 ng/ml at 24 hours after administration. The values at T1 ranged from 0.5 ng/ml to 148.0 ng/ml. We found no relationship between the scores of HAMA and concentrations of diazepam. Anxiety decreased to normal values (HAMA < 13) at the time T1 in all patients.
Conclusions:
Concentrations of diazepam were lower 30 minutes after the administration than after 4 and 24 hours, respectively. We observed the largest variability in concentrations 30 minutes after the administration, when the concentrations between patients differed 280-times. This finding confirms international experience that IM diazepam administration should not be used. We discuss the differences between individual SPCs and guidelines that force inappropriate use of diazepam IM and do not permit other than off-label use of midazolam.
Key words:
diazepam – pharmacokinetics – agitation – aggression – intramuscular administration
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
:
J. Vevera 1,2; Z. Oktábec 3,4; F. Perlík 5; V. Marešová 3; A. Kopecká 3; J. Raboch 1; M. Novotná 6
:
Psychiatrická klinika 1. LF UK a VFN v Praze
1; 7. polní nemocnice AČR
2; Oddělení toxikologie, Ústav soudního lékařství a toxikologie, 1. LF UK a VFN v Praze
3; Klinika adiktologie 1. LF UK a VFN v Praze
4; Farmakologický ústav, 1. LF UK a VFN v Praze
5; Therapia VIVA s. r. o., psychiatrická ambulance
6
:
Cesk Slov Neurol N 2014; 77/110(6): 760-764
:
Short Communication
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amcsnn2014760
Úvod:
Při neklidu, úzkosti a agitovanosti je někdy nutné přikročit k intramuskulární (i. m.) aplikaci benzodiazepinů. V ČR je často používán diazepam. Cílem práce je zjistit interindividuální variabilitu koncentrací diazepamu v séru po i. m. aplikaci a hodnotit klinický efekt léku.
Metodika:
Do hodnocení jsme zařadili šest mužů, kterým bylo při ambulantní léčbě aplikováno 10 mg diazepamu i. m. Měření farmakokinetických parametrů a anxiety byla prováděna po 30 min (T1), dále po 4 (T2) a 24 hod (T3). Diagnóza byla stanovena pomocí Mini-International Neuropsychiatric Interview, anxietu jsme kvantifikovali Hamiltonovou škálou úzkosti (HAMA).
Výsledky:
V čase T1 (po 30 min) byly průměrné (geometrický průměr) hladiny diazepamu v séru 14,6 ng/ ml, za 4 hod 48,6 ng/ ml a za 24 hod 28,7 ng/ ml. Hodnoty v čase T1 se pohybovaly v rozmezí 0,5 – 148,0 ng/ ml. Nenalezli jsme vztah mezi skórem HAMA a koncentracemi diazepamu. U všech pacientů došlo k poklesu úzkosti v čase T1 na normální hodnoty (HAMA < 13). Při dalším sledování už nebyly hodnoty HAMA zvýšené.
Závěr:
Koncentrace diazepamu byly v průměru u pacientů 30 min po aplikaci výrazně nižší než po 4 i 24 hodinách. Největší variabilitu koncentrací jsme pozorovali za 30 min, kdy byl rozdíl mezi nemocnými 280násobný. Tato zjištění potvrzují zahraniční zkušenosti, podle kterých diazepam v i. m. formě nemá být užíván k ovlivnění akutních stavů. Diskutujeme o rozdílech mezi SPC jednotlivých přípravků a oficiálních doporučujících pokynů, které nutí k nevhodné aplikaci diazepamu i. m. a zároveň neumožňují jiné než off - label užití v guidelines doporučovaného midazolamu.
Klíčová slova:
diazepam – farmakokinetika – agitovanost – agresivita – intramuskulární podání
Úvod
V ambulancích i během hospitalizace se standardně setkáváme se stavy akutní agitovanosti, úzkosti a násilí [1]. Jejich etiologie je různorodá, zahrnující intoxikace, syndrom z odnětí návykové látky, delirantní stavy, infekce CNS, hypoglykemie, hypertenze, akutní reakce na stres a poruchy přizpůsobení, dekompenzace stavu při schizofrenních, afektivních a úzkostných poruchách při organických poruchách CNS. Část nemocných pod vlivem svého onemocnění odmítá medikaci a ta jim musí být aplikována proti jejich vůli. Zde je často nutné přikročit k intramuskulární aplikaci. V českých doporučených postupech péče [2,3] je v souladu s informacemi v SPC jedním z léků volby diazepam. Tomu odpovídá i skutečnost, že tento lék je v intramuskulární formě nejčastěji užíván ke zvládání akutního neklidu [4] a dle SPC je tato forma podání možná i při status epilepticus. Někteří autoři tuto praxi nepovažují za optimální [4,5]. Poukazují především na problematické a pomalé vstřebávání intramuskulárně podaného diazepamu.
Cílem sledování je zjistit variabilitu koncentrací diazepamu po i. m. aplikaci a hodnotit klinický efekt léku.
Metodika
Studii schválila etická komise 1. LF UK a VFN v Praze.
Do hodnocení jsme zařadili šest ambulantně léčených mužů s poruchou přizpůsobení (čtyři), úzkostnou poruchu osobnosti (jeden) a akutní reakcí na stres (jeden), kteří kontaktovali ambulantního psychiatra pro úzkosti. Diagnóza byla stanovena pomocí Mini-mezinárodního neuropsychiatrického interview (M.I.N.I.), anxieta byla kvantifikována Hamiltonovou škálou úzkosti (HAMA). Škála se skládá ze 14 položek, které nabývají hodnoty od 0 do 4, výsledky se tedy pohybují v rozmezí 0 až 56 bodů. Hodnoty v rozmezí 14 – 17 značí mírnou, hodnoty 18 – 24 střední a hodnoty nad 25 intenzivní úzkost. Sledovaní muži byli somaticky zdrávi, bez závislostí na návykových látkách, neužívali žádnou medikaci, průměrný věk 39,6 let. Vyšetření prováděl jeden psychiatr (JV). Všichni sledovaní vykazovali středně intenzivní příznaky úzkosti (průměr HAMA = 19). Nitrosvalově jsme aplikovali 10 mg diazepamu (APAURIN 10 mg/ 2 ml inj. Krka, d.d., Slovinsko).
Anxieta byla hodnocena a krevní vzorky byly odebírány po 30 min (T1), dále po 4 (T2) a 24 hod (T3) po podání diazepamu. Koncentrace léčiva a jeho metabolitu nordiazepamu v séru byla určována ultraúčinnou kapalinovou chromatografií ve spojení s tandemovou hmotnostní spektrometrií (UPLC - MS/ MS) s ESI ionizační technikou; detekce probíhala v režimu SRM (Selected Reaction Monitoring). Kvantifikace byla provedena pomocí kalibrační křivky za použití diazepamu - D5 jako vnitřního standardu. Z koncentrací eliminační fáze diazepamu jsme stanovili dvoubodový odhad farmakokinetických parametrů pomocí vzorce 1.
Vzorec 1
Vzorec pro odhad eliminační konstanty ke (C4 a C24 jsou koncentrace diazepamu naměřené v časových intervalech (t) za 4 a 24 hod po aplikaci léčiva).
Poločas (t½) jsme pak spočítali pomocí vzorce 2.
Vzorec 2
Vzorec pro výpočet poločasu t½.
Zdánlivý distribuční objem (Vd) jsme vypočítali dle vzorce 3.
Vzorec 3
Vzorec pro výpočet zdánlivého distribučního objemu Vd (d je podaná dávka diazepamu a C0 jeho koncentrace zpětně extrapolovaná v čase 0).
Celkovou clearance (CL) jsme určili podle vzorce 4.
Vzorec 4
Vzorec pro výpočet celkové clearance CL.
Výsledky
Ve sledovaných intervalech jsme pozorovali výrazné interindividuální rozdíly v koncentracích diazepamu a nordiazepamu (tab. 1 a graf 1). V čase T1 byly průměrné hladiny diazepamu 14,6 ng/ ml, za 4 hod 48,6 ng/ ml a za 24 hod 28,7 ng/ ml. Hodnoty v čase T1 se pohybovaly v rozmezí 0,5 – 148,0 ng/ ml. V dalších časových intervalech se variabilita koncentrací diazepamu postupně zmenšovala. Nenalezli jsme vztah mezi skórem HAMA a koncentracemi diazepamu. U všech pacientů došlo k poklesu úzkosti v čase T1 (po 30 min) na normální hodnoty (HAMA < 13). Při dalším sledování už nebyly hodnoty HAMA zvýšené.
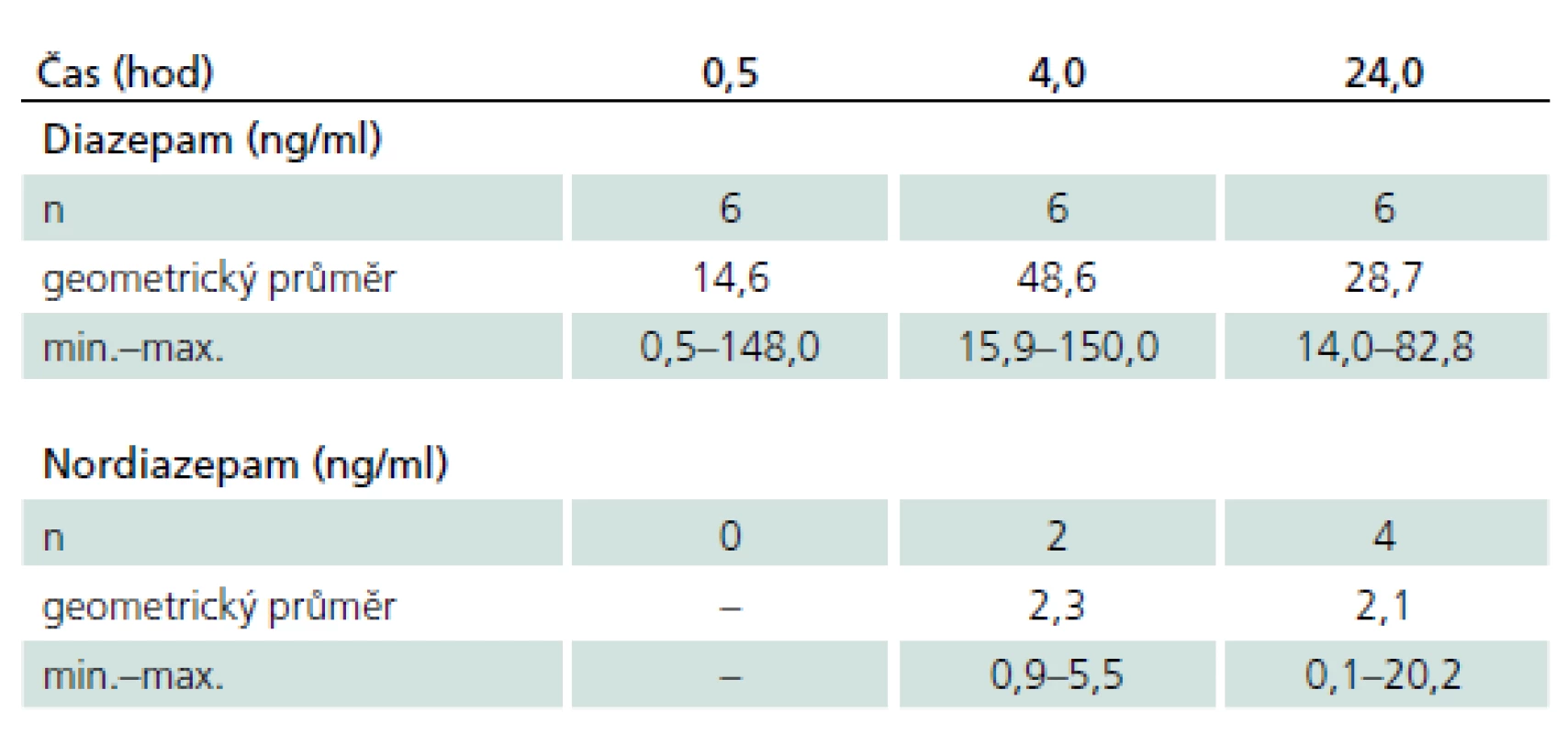

Měřitelné koncentrace diazepamu jsme prokázali u všech nemocných, zatímco nordiazepamu pouze u dvou nemocných za 4 hod a u čtyř nemocných za 24 hod po jednorázové nitrosvalové aplikaci 10 mg diazepamu. Pokles koncentrací mateřské látky v eliminační fázi nám umožnil dvoubodový odhad farmakokinetických parametrů u pěti nemocných našeho souboru (tab. 2).

Diskuze
Naše zjištění potvrzují zahraniční zkušenosti, podle kterých by diazepam v intramuskulární formě neměl být užíván k ovlivnění akutních stavů úzkosti, agitovanosti a neklidu [6]. Problémem je především špatná absorpce a velmi dlouhá eliminace.
Absorpce
Koncentrace diazepamu byly v průměru u pacientů 30 minut po i. m. aplikaci výrazně nižší než po 4 i 24 hod. Největší interindividuální variabilitu koncentrací diazepamu jsme pozorovali za 0,5 hod, kdy byl rozdíl mezi subjekty 280násobný. Na interindividuální variabilitě farmakokinetiky diazepamu se podílí řada faktorů, zejm. věk, pohlaví, onemocnění jater a ledvin, kouření tabáku a etnické vlivy. Naše studie byla realizována na relativně etnicky homogenní skupině (v porovnání se studiemi z USA) fyzicky zdravých mužů středního věku, kavkazské populace. Domníváme se, že výraznou interindividuální variabilitu sérových koncentrací diazepamu za 0,5 hod po aplikaci lze vysvětlit nestandardním vstřebáním léčiva při jeho nitrosvalovém podání tak, jak o tom už v minulosti bylo referováno [7].
Studie zahrnuje jen malý počet pacientů, kteří byli rekrutováni z řad ambulantních, spolupracujících pacientů vykazujících střední intenzitu příznaků úzkosti. Naše výsledky jsou plně v souladu s klasickými údaji o farmakokinetických vlastnostech intramuskulárně podaného diazepamu [8]. Je racionální předpokládat, že u silně agitovaných či agresivních pacientů, kterým je tato medikace často poskytována při omezení v pohybu, by vstřebávaní i. m. podaného léku bylo ještě pomalejší, protože fyzická aktivita intramuskulární vstřebávaní urychluje. To je v souladu s tím, že u jediného pacienta v našem sledování, u kterého byly koncentrace diazepamu po 30 min vyšší než po 4 hod, došlo po podání diazepamu k středně intenzivní tříhodinové aerobní aktivitě.
Eliminace
Při odhadu farmakokinetických parametrů jsme vycházeli z koncentrací diazepamu stanovených za 4 hod a za 24 hod po nitrosvalové injekci. Předpokládali jsme, že představují eliminační fázi poklesu koncentrací léčiva. I při uvedeném zjednodušení průměrné hodnoty farmakokinetických parametrů souboru odpovídají výsledkům uváděným v literatuře [8]. Měřitelné koncentrace aktivního metabolitu nordiazepamu jsme pozorovali pouze u části nemocných. Lze to vysvětlit jeho dlouhým poločasem a jednorázovým podáním mateřské látky. Při opakovaném podání se tento metabolit významně podílí na farmakodynamickém působení diazepamu. Eliminační poločas diazepamu je 20 – 80 hod, jeho hlavní metabolit nordiazepam se vylučuje ještě pomaleji, eliminační poločas je 40 – 120 hod. To znamená, že při akutním podání se na farmakodynamickém působení podílí převážně mateřská látka, při opakované aplikaci je výsledný efekt ovlivněn též dlouhodobým přetrváváním hlavního aktivního metabolitu. To je nutné mít na zřeteli především u starších pacientů, kde je dlouhodobý útlum nežádoucí [9]. Rovněž u osob s onemocněním jater by variabilita farmakokinetiky diazepamu byla ještě vyšší. Tyto skutečnosti jsou důležité, protože nejčastěji se agresivní chování projevuje právě u pacientů s organickými poruchami CNS, typicky u gerontopsychiatrických pacientů s demencí [1] a u pacientů se závislostí či škodlivým užíváním návykových látek, u kterých je poškození jater časté.
Jaké léky užít?
Pokud nejčastěji užívaný diazepam není vhodný, zůstává otázkou, čím jej můžeme nahradit. Dvě cochranské metaanalýzy, které studovaly efekt akutní medikace antipsychotiky a benzodiazepiny [10,11] u agresivních nemocných s psychózou, zjistily, že medikace benzodiazepiny je k ovlivnění akutní agitovanosti (do 1 hod) vhodnější než medikace antipsychotiky. Z klasických antipsychotik byl nejčastěji užit haloperidol. Používání haloperidolu bez přídatné medikace k omezení jeho anticholinergních účinků je dle autorů neetické. Pokud je ale tato podmínka splněna, pak není rozdíl mezi haloperidolem a řádově dražšími antipsychotiky druhé generace. Autoři také kritizují skutečnost, že ve srovnání účinnosti benzodiazepinů a klasických antipsychotik s antipsychotiky druhé generace pravidelně chybí analýzy finančních nákladů. Propagace používaní antipsychotik k tlumení akutní agitovanosti či agrese je spíše výsledkem dobré víry a finančních stimulů ze strany farmaceutických firem než na důkazech založené medicíny [11]. Vzhledem k tomu, že v ČR v praxi používáme k tlumení agitovanosti především diazepam (přípravek APAURIN inj., 10 × 2 ml/ 10 mg, Krka), který se velmi nespolehlivě vstřebává, takže v mnoha případech účinný být nemůže, je empiricky podložená „dobrá víra“ v efekt antipsychotik pochopitelná.
Pokles úzkostné symptomatiky, agitovanosti či agresivity v klinickém sledování může být způsoben i jinými než farmakologickými faktory, např. tím, že pacienti si uvědomí, že je jim věnována pozornost, že se něco děje v jejich prospěch a že je jim poskytována pomoc [12]. Akt omezení v lůžku či umístění do izolační místnosti může sám o sobě vést ke zklidnění. To potvrzují údaje ze studie porovnávající užití benzodiazepinu a placeba ke snížení agitovanosti u pacientů s bipolární poruchou [13]. K poklesu agitovanosti došlo krátkodobě jak u benzodiazepinové, tak u placebové větve výzkumu. Rozdíl v neprospěch placeba byl patrný až ve střednědobém horizontu (1 – 48 hod).
V evropských zemích a v USA se při akutní úzkosti, agitovanosti a neklidu užívá lorazepam, protože má krátký biologický poločas (10 – 20 hod), nemá aktivní metabolity a má příznivý profil lékových interakcí [14]. V ČR je registrován, ale není k dispozici. Z léků dostupných v ČR má nejrychlejší nástup účinku midazolam s eliminačním poločasem (1,5 – 2,5 hod). Bylo prokázáno, že 5 mg midazolamu redukuje agitovanost efektivněji než 10 mg haloperidolu [15]. V dvojitě slepé, randomizované, kontrolované studii násilně se chovajících pacientů byl midazolam účinnější než lorazepam i haloperidol [16]. Zde je nutné upozornit, že získávání kvalitních dat o terapii akutních stavů úzkosti a agitovanosti naráží na vážná metodická úskalí – randomizace, informovaný souhlas atd. Např. po desetiletí doporučovaná medikace k rychlé trankvilizaci, kombinace lorazepamu a haloperidolu, se zakládá na údajích od pouhých 80 pacientů ze čtyř kontrolovaných studií [17]. Do recentních studií vstupují jen ti agitovaní či násilně se chovající nemocní, kteří s účastí písemně souhlasí, a lékař je ochoten riskovat, že neví, jaký lék budou užívat, případně zda jim nebude podáno placebo. Tímto postupem mohou být (a pravděpodobně jsou) vyloučeni pacienti se závažnějšími příznaky. Zmiňovaná úskalí se snažila překonat studie TREC (Tranquilização Rápida - Ensaio Clínico) s pragmatickým designem provedené v Indii [18] a Brazílii [19]. V brazilské studii zjistili, že midazolam i. m. má rychlejší nástup účinku než haloperidol s promethazinem. Dvacet min po aplikaci farmaka bylo zklidněno nebo spalo 89 % pacientů, kterým byl podán midazolam, a 67 % pacientů, jimž byl podán haloperidol s promethazinem. V randomizované studii [20], kde byl ve čtyřech větvích intramuskulárně podáván aktivní preparát, byly nízké dávky midazolamu (7,5 mg) s haloperidolem (2,5 mg) stejně efektivní jako 10 mg olanzapinu. Obě tyto terapeutické strategie byly účinnější než aplikace ziprasidonu (10 mg) a haloperidolu (2,5 mg) s promethazinem (25 mg). Zajímavou cestou administrace midazolamu je intranazální podání, které je známo především z epileptologie [21,22], emergentní medicíny [23], mírnění příznaků klaustrofobie u diagnostických výkonů [24], popř. pediatrie [25]. Tento způsob podání midazolamu je dle farmakokinetických vlastností výhodný – rychlost nástupu účinku se v případě tohoto podání pohybuje okolo 10 min a dosahuje se u něj standardních sérových koncentrací [26]. Bohužel v této formě není midazolam v ČR registrován. Je paradoxní, že v cizině obsolentní podání diazepamu i. m. je v ČR doporučovaný postup, avšak v českém SPC v cizině doporučovaného léčiva – midazolamu – absentuje indikace mírnění akutního neklidu a úzkosti. Jedinou teoretickou možností je tedy podání midazolamu off - label. Nevýhodou aplikace midazolamu může ale být až příliš krátký poločas, což může vést k nutnosti opakování dávek a sedaci [27].
Další teoretickou možností je podání diazepamu i.v., při kterém se lze vyhnout interindividuálně variabilní absorpci. Intravenózně se dá diazepam podávat velmi pomalu, nejvýše 5 mg za 1 min, do velkých žil. Diazepam lze také podávat v infuzním roztoku, např. v 5% až 10% roztoku glukózy nebo v 0,9% roztoku NaCl. Diazepam se může podávat rovněž per rectum; dokonce i v ČR dostupný přípravek uzpůsobený pro toto podání má dle SPC schválenu indikaci k akutní klinické intervenci při stavech úzkosti, napětí a vzrušenosti. Nevýhoda těchto způsobů podání je komplikovanost způsobu podání, které často není možné z důvodu agresivity nebo hyperaktivity pacienta. Podobně je tomu i v případě léčby první fáze status epilepticus, u kterého lze podávat diazepam dospělým v dávce 10 – 20 mg (0,2 mg/ kg/ dosi) i.v. během 2 min, nebo 10 mg diazepamu rektálně. V tomto případě se také snažíme vyhnout podávání diazepamu i. m. Pokud tedy není žilní přístup, pak můžeme v první fázi záchvatu aplikovat také midazolam 5 – 15 mg i. m. nebo již zmiňovaný diazepam rektálně [28].
Je překvapivé, že SPC v ČR dostupného injekčního diazepamu uvádí možnost podání i. m. pro léčbu status epilepticus u dospělých. Naproti tomu u midazolamu, který je pro léčbu status epilepticus v i. m. aplikaci ve standardech péče doporučován [28], SPC tuto možnost neuvádí. Znovu se tedy ukazuje, že použití midazolamu v další indikaci, tentokrát při léčbě status epilepticus, je možné pouze off - label.
Další off - label možností trankvilizace je intramuskulární aplikace ketaminu [6,29], která se užívá k sedaci u dospělých [30,31] i u dětí [32]. Nástup účinku je i po intramuskulární aplikaci velmi rychlý: 3 – 4 min při dávce 5 mg/ kg. Možná je i i.v. aplikace. Zde je dávka 1 – 2 mg/ kg a nástup účinku je 30 s. Výhodou je i analgetický účinek. Proto je některými autory [33] považován za velmi slibný lék pro válečná poranění, což odpovídá i našim zkušenostem z polní nemocnice AČR v Afganistánu.
Závěr
U akutní úzkosti a agitovanosti je na prvním místě perorální medikace benzodiazepiny, kde se využívají jejich sedativní a anxiolytické vlastnosti [5,34]. Pro diazepam ale platí, že perorální medikace má spolehlivější absorpci než aplikace intramuskulární. Tyto poznatky v zahraničí vedly k tomu, že diazepam i. m. není doporučován k tlumení akutních symptomů [6]. V České republice je Státním ústavem pro kontrolu léčiv tento lék k terapii akutních stavů v i. m. aplikaci schválen a je také nejčastěji užíván [4]. Tuto praxi je vhodné změnit a využívat jiné preparáty, které jsou rychleji absorbovány a metabolizovány.
Práce vznikla za podpory projektů PRVOUK P03/LF1/9, PRVOUK P26/LF1/4, GAČR 14-21903S a SVV 260 022.
doc. MUDr. Jan Vevera, Ph.D.
Psychiatrická klinika
1. LF UK a VFN v Praze
Ke Karlovu 11
128 00 Praha 2
e-mail: veverajan@gmail.com
Přijato k recenzi: 6. 6. 2014
Přijato do tisku: 3. 9. 2014
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Sources
1. Vevera J, Uhrová T, Jirák R, Žukov I, Ort V. Násilné chování a možnosti jeho ovlivnění. I. díl – výskyt, rozdělení a klinické koreláty. Psychiatr Prax 2002; 3(5): 226 – 229.
2. Baudiš P, Kališová L, Kitzlerová E, Petr T, Miloš T.Omezovací prostředky. In: Raboch J, Anders M, Praško J, Hellerová P (eds). Psychiatrie: Doporučené postupy psychiatrické péče II. Praha: Infopharm 2006 : 152 – 162.
3. Jirák R. Franková V. Demence. In: Raboch J, Anders M, Hellerová P, Uhlíková P (eds). Psychiatrie: Doporučené postupy psychiatrické péče III. Brno: Tribun EU 2010 : 20 – 53.
4. Kališová L, Vevera J, Nawka A, Raboch J. Zvládání akutního neklidu u nedobrovolně přijatých nemocných v roce 2011 a 2004 – 2006. In: Raboch J, Zrzavecká I, Doubek P (eds). Civilizace, čas a duševní poruchy. Sborník příspěvků IX. sjezdu Psychiatrické společnosti ČLS JEP s mezinárodní účastí: 7. – 10. června 2012, Hotel Harmony, Špindlerův Mlýn. Brno: Tribun 2012 : 274 – 276.
5. Vevera J, Černý M. Zvládání agitovanosti a násilného chování. Psychiatr Prax 2011; 12(2): 69 – 71.
6. National Institute for Health and Clinical Excellence (NICE). Violence. The short-term management of disturbed/ violent behaviour in in-patient psychiatric settings and emergency departments. Royal College of Nursing. 2005. ISBN 1 - 904114 - 21 - 0. Available from URL: http:/ / www.nice.org.uk/ nicemedia/ pdf/ cg025fullguideline.pdf.
7. Mandelli M, Tognoni G, Garattini S. Clinical pharmacokinetics of diazepam. Clin Pharmacokinet 1978; 3(1): 72 – 91.
8. Rang HP, Dale MM, Ritter JM, Flower RJ. Rang and Dale‘s Pharmacology. 6th ed. Edinburgh: Churchill Livingstone 2007.
9. Vevera J, Jirák R., Uhrová T, Žukov I. Možnosti farmakologického ovlivnění násilného chování u pacientů s demencí. Cs Psychiatr 2003; 99(3): 142 – 145.
10. Powney MJ, Adams CE, Jones H. Haloperidol for psychosis-induced aggression or agitation (rapid tranquillisation). Cochrane Database Syst Rev 2012; 11: CD009377. doi: 10.1002/ 14651858.CD009377.pub2.
11. Gillies D, Sampson S, Beck A, Rathbone J. Benzodiazepines for psychosis-induced aggression or agitation. Cochrane Database Syst Rev 2013; 9: CD003079.
12. Blass DM, Steinberg M, Leroi I, Lyketsos CG. Successful multimodality treatment of severe behavioral disturbance in a patient with advanced Huntington‘s disease. Am J Psychiatry 2001; 158(12): 1966 – 1972.
13. Meehan K, Zhang F, David S, Tohen M, Janicak P, Small J et al. A double-blind, randomized comparison of the efficacy and safety of intramuscular injections of olanzapine, lorazepam, or placebo in treating acutely agitated patients diagnosed with bipolar mania. J Clin Psychopharmacol 2001; 21(4): 389 – 397.
14. Taylor D, Paton C, Kerwin R. The Maudsley 2005 – 2006 Prescribing Guidelines. 8th ed. London: Taylor & Francis 2005.
15. Wyant M, Diamond B, O’Neal E, Sloan A, Borison RL.The use of midazolam in acutely agitated psychiatric patients. Psychopharmacol Bull 1990; 26(1): 126 – 129.
16. Nobay F, Simon BC, Levitt MA, Dresden GM. A prospective, double-blind, randomized trial of midazolam versus haloperidol versus lorazepam in the chemical restraint of violent and severely agitated patients. Acad Emerg Med 2004; 11(7): 744 – 749.
17. Ranjan S, Chandra PS. Drug combinations for rapid tranquillisation. Br J Psychiatry 2005; 187 : 192 – 193.
18. Alexander J, Tharyan P, Adams C, John T, Mol C,Philip J. Rapid tranquillisation of violent or agitated patients in a psychiatric emergency setting. Pragmatic randomised trial of intramuscular lorazepam v. haloperidol plus promethazine Br J Psychiatry 2004; 185 : 63 – 69.
19. TREC Collaborative Group. Rapid tranquillisation for agitated patients in emergency psychiatric rooms: a randomised trial of midazolam versus haloperidol plus promethazine. BMJ 2003; 327(7417): 708 – 713.
20. Mantovani C, Labate CM, Sponholz A jr, de Azevedo Marques JM, Guapo VG, de Simone Brito dos Santos ME et al. Are low doses of antipsychotics effective in the management of psychomotor agitation? A randomized, rated - blind trial of 4 intramuscular interventions. J Clin Psychopharmacol 2013; 33(3): 306 – 312. doi: 10.1097/ JCP.0b013e3182900fd6.
21. Mula M. The safety and tolerability of intranasal midazolam in epilepsy. Expert Rev Neurother 2014; 14(7): 735 – 740. doi: 10.1586/ 14737175.2014.925398.
22. Javadzadeh M, Sheibani K, Hashemieh M, Saneifard H. Intranasal midazolam compared with intravenous diazepam in patients suffering from acute seizure: a randomized clinical trial. Iran J Pediatr 2012; 22(1): 1 – 8.
23. Del Pizzo J, Callahan JM. Intranasal medications in pediatric emergency medicine. Pediatr Emerg Care 2014; 30(7): 496 – 501. doi: 10.1097/ PEC.0000000000000171.
24. Hollenhorst J, Münte S, Friedrich L, Heine J, Leuwer M, Becker H et al. Using intranasal midazolam spray to prevent claustrophobia induced by MR imaging. AJR Am J Roentgenol 2001; 176(4): 865 – 868.
25. Chiaretti A, Barone G, Rigante D, Ruggiero A, Pierri F,Barbi E et al. Intranasal lidocaine and midazolam for procedural sedation in children. Arch Dis Child 2011; 96(2): 160 – 163. doi: 10.1136/ adc.2010.188433.
26. Haschke M, Suter K, Hofmann S, Witschi R, Fröhlich J, Imanidis G et al. Pharmacokinetics and pharmacodynamics of nasally delivered midazolam. Br J Clin Pharmacol 2010; 69(6): 607 – 616. doi: 10.1111/ j.1365 - 2125.2010.03611.x.
27. Baldaçara L, Sanches M, Cordeiro DC, Jackoswski AP. Rapid tranquilization for agitated patients in emergency psychiatric rooms: a randomized trial of olanzapine, ziprasidone, haloperidol plus promethazine, haloperidol plus midazolam and haloperidol alone. Rev Bras Psiquiatr 2011; 33(1): 30 – 39.
28. EpiStop. Soubor minimálních diagnostických a terapeutických standardů u pacientů s epilepsií. Epistop. 2013. ISBN 978 - 80 - 903979 - 6 - 5. Dostupné z URL: http:/ / www.clpe.cz/ EPI_standard_2013_web.pdf.
29. Roberts JR, Geeting GK. Intramuscular ketamine for the rapid tranquillisation of the uncontrollable, violent, and dangerous adult patient. J Trauma 2001; 51(5): 1008 – 1010.
30. Reich DL, Silvay G. Ketamine: an update on the first twenty five-years of clinical experience. Can J Anaesth 1989; 36(2): 186 – 197.
31. Strayer RJ, Nelson LS. Adverse events associated with ketamine for procedural sedation in adults. Am J Emerg Med 2008; 26(9): 985 – 1028. doi: 10.1016/ j.ajem.2007.12.005.
32. Green SM, Rothrock SG, Lynch EL, Ho M, Hartus T, Hestdalen R et al. Intramuscular Ketamine for pediatric sedation in the emergency department: safety profile in 1,022 cases. Ann Emerg Med. 1998; 31(6): 688 – 697.
33. Melamed E, Oron Y, Ben - Avraham R, Blumenfeld A,Lin G. The combative multitrauma patient: a protocol for prehospital management. Euro J Emerg Med 2007; 14(5): 265 – 268.
34. Battaglia J, Moss S, Rush J, Kang J, Mendoza R, Leedom L et al. Haloperidol, lorazepam or both for psychotic agitation? A multicenter, prospective, double-blind, emergency department study Am J Emerg Med 1997; 15(4): 335 – 340.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2014 Issue 6
-
All articles in this issue
- Reducing the Door-to-needle Interval, Experience from the Stroke Centre in Kladno
- WHO Grade II Ependymomas of the Fourth Ventricle in Adults – Single Institution Experience
- Diazepam i. m. – the Most Common, but Inappropriate Medication for Management of Acute Anxiety, Agitation and Aggression
- Sporadic Use of Decompressive Hemicraniectomy in a Patient with Brain Abscess – a Case Report
- Missile Head Injury with a Replica of a Historical Weapon – Pathophysiology and a Case Study
- Adult Form of Pompe Disease
- Cognitive Rehabilitation in Patients with Multiple Sclerosis
- Effectiveness of the Temporary Splinting after Carpal Tunnel Release
- Increasing the Sensitivity of Brain Death Confirmation Using the Combination of Auditory and Somatosensory Evoked Potentials
- The Five Point Test – a Test of Nonverbal Fluency: Normative Data for Adults
- Molecular Diagnostics of NF1 in Slovakia Using cDNA and MLPA Analysis
- The Effect of Suboptimal Surgical Treatment of Spinal Fractures on the Course of Spinal Cord Injury
- The Use of Electromagnetic Navigation in Surgeries for Hydrocephalus and Arachnoid Cysts in Children under One Year of Age
- Is Electrophysiology Useful in the Differential Diagnostics of Lumbar Spinal Stenosis and Diabetic Polyneuropathy?
- Epidemiological Study of Neurodegenerative Parkinsonism in “Hornacko”, a Specific Region of the South-eastern Moravia, Czech Republic
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Diazepam i. m. – the Most Common, but Inappropriate Medication for Management of Acute Anxiety, Agitation and Aggression
- Missile Head Injury with a Replica of a Historical Weapon – Pathophysiology and a Case Study
- The Five Point Test – a Test of Nonverbal Fluency: Normative Data for Adults
- Adult Form of Pompe Disease




