Maligní prolaktinom – lze ovlivnit dlouhodobé přežívání?
Authors:
K. Menclová 1; T. Novák 2; D. Netuka 3; M. Kosák 4; Radek Pohnán 1
Authors‘ workplace:
Chirurgická klinika 2. LF UK a ÚVN, Praha
1; Onkologická klinika 2. LF UK a FN Motol, Praha
2; Neurochirurgická a neuroonkologická, klinika 1. LF UK a ÚVN, Praha
3; Interní klinika 1. LF UK a ÚVN, Praha
4
Published in:
Cesk Slov Neurol N 2021; 84/117(3): 274-276
Category:
Letters to Editor
doi:
https://doi.org/10.48095/cccsnn2021274
Vážená redakce,
maligní prolaktinom (MP) je raritním, nicméně druhým nejčastějším zhoubným nádorem hypofýzy s nepříznivou prognózou [1]. Management léčby MP je proto založen na retrospektivní analýze jednotlivých případů. Prezentujeme ojedinělou kazuistiku pacientky, u které jsme postupovali v rámci multioborové etapové léčby s primární resekcí nádoru hypofýzy, systémovou terapií a následnou resekcí jaterní metastázy.
Jedná se o 53letou pacientku vyšetřovanou v červenci 2015 pro bitemporální heteronymní hemianopsii, u které byl diagnostikován makroadenom hypofýzy o velikosti 38 x 29 mm se známkami supraselární propagace na MR (obr. 1). Laboratorně byla zjištěna hyperprolaktinémie s hodnotami nad 2 000 mIU/ l (norma 102–496 mIU/ l). Iniciálně byla nemocná léčena agonisty dopaminu (karbegolin), s korekcí hypokortikalizmu a hypotyreózy. Podle kontrolní MR nicméně nedošlo k žádné regresi ložiska. Progredovaly porucha zraku a bolest hlavy.
Fig. 1. Brain MRI. Prolactinoma with supraselar growth – July 2015.
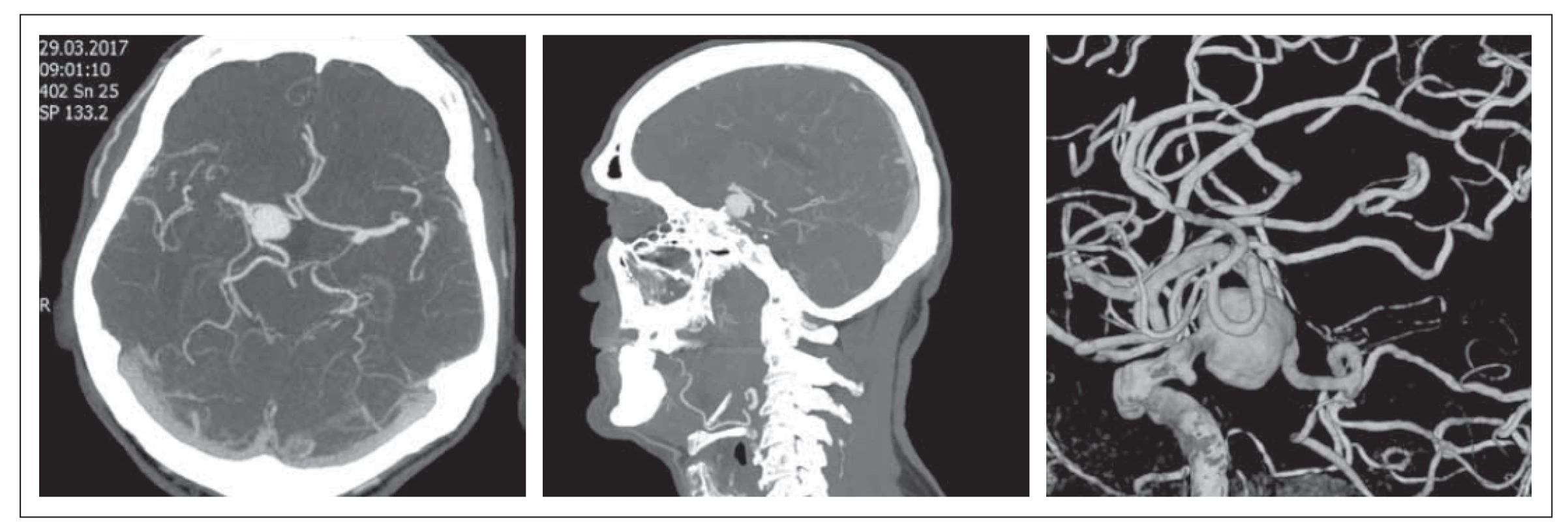
Pacientka proto v říjnu 2015 podstoupila na Neurochirugické a neuroonkologické klinice 1. LF UK a ÚVN endoskopickou endonazální resekci tumoru. Vzhledem k tuhosti nádoru a typu růstu nádoru byla provedena parciální resekce. Histologickým nálezem byl „atypický“ adenom hypofýzy s vysokou proliferační aktivitou nádorových buněk, s přítomností atypických mitóz (14/ 10 velkých zorných polí [high power fields; HPF]) a s ložiskovými nekrózami. Antigen Ki-67 dosahoval 65 %. Pozitivita p53 byla prokázána u 10 % nádorových buněk. Po operaci byla pacientce navýšena dávka karbegolinu. Kontrolní MR zobrazila reziduální tumor v okolí chiazmatu a paraselárně. Pro vysoké intraoperační riziko nebyl další neurochirurgický výkon indikován.
V únoru 2016 byla pacientce na Onkologické klinice 2. LF UK a FN Motol frakcionovaně aplikována stereotaktická radioterapie celkovou dávkou 57,35 Gy do oblasti hypofýzy na zbytkovou masu tumoru. Po ní došlo k výraznému zmenšení nádorového rezidua. Pokračovala léčba karbegolinem. V říjnu 2017 došlo ke skokové elevaci hodnoty prolaktinémie (nad 20 000 mIU/ l). PET CT (18FDG [fludeoxyglukóza]) detekovalo sekundární ložiska v plicích, játrech, ledvinách a kostní dřeni. V játrech byla biopticky verifikována metastáza MP. Na MR v červnu 2017 byla zjištěna další růstová progrese tumorózních hmot v oblasti tureckého sedla a sfenoidálního sinu. Pacientka byla indikována k cytostatické terapii temozolomidem (TMZ). Následně klesly hodnoty prolaktinémie do normy (100–300 mIU/ l). V prosinci 2018 bylo dle PET CT dosaženo kompletní radiologické odpovědi.
V březnu 2019 ukázalo vyšetření PET CT (18FDG) nově solitární resekabilní FDG akumulující jaterní ložisko velikosti 33 mm (obr. 2A). Tento nález byl multidisciplinárním týmem indikován k operačnímu řešení.
FDG – fludeoxyglukóza; RFA – radiofrekvenční ablace
Fig. 2. (A) Liver metastasis on PET/CT (18FDG); (B) Intraoperative ultrasound of the liver metastasis; (C) Liver metastasis of malignant prolactinoma;
(D) RFA probe used in our department
FDG – fluorodeoxyglucose; RFA – radiofrequency ablation
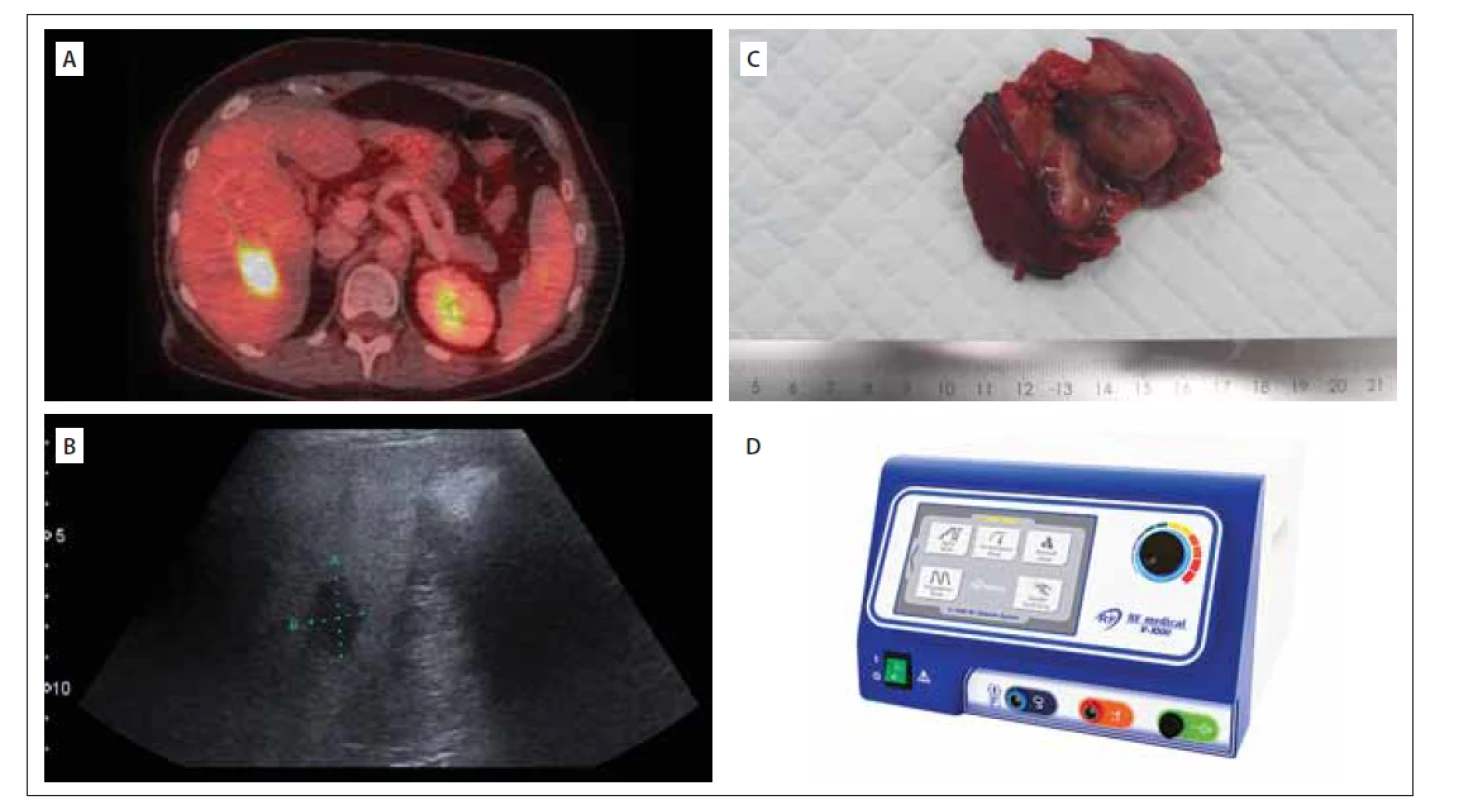
V dubnu 2019 pacientka podstoupila operaci na Chirurgické klinice 2. LF UK a ÚVN. Při peroperační ultrasonografii (obr. 2B) byla mimo známého ložiska v VI. segmentu jater objevena i další dvě drobná (5 x 5 mm) intraparenchymatózní ložiska v segmentu VII. Provedli jsme neanatomickou resekci ložiska v segmentu VI (obr. 2C). Ložiska v segmentu VII jater jsme ošetřili pomocí radiofrekvenční ablace (obr. 2D). Operace i pooperační průběh byly bez komplikací. Histologické vyšetření prokázalo metastázu MP s vysokou mitotickou aktivitou (14/ 5 HPF). Antigen Ki-67 dosahoval 60 % a mutace proteinu p53 byla prokázána u 5 % nádorových buněk. Po zhojení byla pacientka indikována k další terapii TMZ. Kontrolní MR jater 3 měsíce po operaci neprokázala nová ložiska.
Pro další vzestup prolaktinémie (hodnoty okolo 1 000 mIU/ L) bylo v srpnu 2019 doplněno vyšetření PET CT (18FDG), které detekovalo nová drobná FDG akumulující ložiska v jaterních segmentech IV a VII, v retroperitoneálních mízních uzlinách a ve skeletu. Doplněná scintigrafie s 99mTc Tektrotydem neprokázala expresi somatostatinových receptorů.
Při progresi na léčbě TMZ byla pacientka v říjnu 2019 indikována k II. linii systémové léčby s lomustinem a anti-VEGF (bevacizumab). V lednu 2020 byla pacientce frakcionovaně aplikována radioterapie na zasažené retroperitoneální mízní uzliny v celkové dávce 50,04 Gy. Pro progredující hyperprolaktinémii s hodnotami až 12 000 mIU/ l byla v dubnu 2020 systémová léčba II. linie ukončena.
Na základě doplnění dalších molekulárněbiologických vyšetření pacientka absolvovala od května 2020 léčbu III. linií imunoonkologické léčby (ipilumumab, nivolumab). Vyšetření PET CT v srpnu 2020 prokázalo významnou regresi onemocnění. Zobrazila se pouze dvojice ložisek v játrech a v uzlinách retroperitonea. Hladina sérového prolaktinu se navrátila k normě (190 mIU/ l).
Adenomy hypofýzy se podílí ze 14 % na všech intrakraniálních tumorech [1]. Z nich pouze 0,1–0,2 % připadá na vzácné hypofyzární karcinomy [2]. MP se vyskytuje ve středním věku s průměrem 44 let [3,4].
V názvosloví a klasifikaci tzv. „agresivních“ hypofyzárních adenomů panují dlouho neshody. Přepokládá se, že se vyvíjejí z makroadenomů a jen výjimečně mohou vzniknout de novo [5]. Maligní transformace zůstává nejasná. Jejím podkladem je pravděpodobně akumulace genetických aberací [4]. Průměrná doba transformace se udává 4,7 roku [6].
Přibližně 40 % nemocných nepřežívá déle než 12 měsíců od průkazu extrakraniálních metastáz [4,7]. Nemocní s metastázami do CNS přežívají v průměru 2–4 roky [7]. Termín karcinom je rezervován pouze pro nádory s metastázami [1,5]. Histopatologické rozlišení atypického adenomu a karcinomu je nemožné [6–8]. V roce 2017 byla stanovena nová klasifikace WHO těchto endokrinních tumorů. Podle ní atypické adenomy charakterizují jejich časná rekurence po chirurgické léčbě, invazivní růst do kavernózního sinu nebo baze lební a časné selhání klasické léčby [6–8]. Obdobně tomu bylo u naší pacientky. Diagnózu prolaktinogenního karcinomu bylo možné stanovit až po průkazu metastáz.
Histologická agresivita je určována antigenem Ki-67 nad 1, resp. 3 % [3,6,8]. Nejspolehlivěji koreluje s velikostí tumoru a jeho rekurencí. Kontroverzními parametry stanovování agresivity nádoru jsou detekce proteinu p53 v buněčném jádru a zvýšená mitotická aktivita (více než 2/ 10 HPF) [7].
Od začátku léčby vykazovala naše pacientka známky rezistence k agonistům dopaminu. Pacientce byl do terapie přidán TMZ. V kontextu prognózy onemocnění MP jde o přelomový lék. Léčebné odpovědi bývá dosaženo u 55 % nemocných. Nicméně nikdy nebylo zaznamenáno kompletní vymizení MP [8].
Po terapii TMZ došlo u naší pacientky ke krátkodobé kompletní radiologické odpovědi. V průběhu další léčby se objevila recidiva onemocnění v podobě solitární jaterní metastázy a pacientka byla indikována k jaterní resekci. V současnosti neexistují validní data jednoznačně podporující resekci metastáz MP. Přestože chirurgická léčba zde není kurativní metodou, některé práce uvádějí, že opakované resekce rekurentních metastáz mohou v jednotlivých případech prodloužit přežívání [9]. Takto jsme postupovali v léčbě i my. Naše pacientka tak přežívá při dobré kvalitě života již 6. rok od stanovení diagnózy, a to na základě úzké multidisciplinární spolupráce neurochirurgů, onkologů, radiologů a chirurgů.
Grantová podpora
Práce byla podpořena Institucionální podporou MO 1012.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Pplk. MUDr. Kateřina Menclová
Chirurgická klinika 2. LF UK a ÚVN U Vojenské nemocnice 1200 169 02 Praha
e-mail: menclkat@uvn.cz
Přijato k recenzi: 3. 12. 2020
Přijato do tisku: 24. 6. 2021
Sources
1. Moscote-Salazar LR, Satyarthee GD, Calderon-Miranda WG. Prolactin secreting pituitary carcinoma with extracranial spread presenting with pathological fracture of femur. J Neurosci Rural Pract 2018; 9(1): 170–173. doi: 10.4103/ jnrp.jnrp_325_17.
2. Chen C, Yin S, Zhang S. Treatment of aggressive prolactinoma with temozolomide: a case report and review of literature up to date. Medicine (Baltimore) 2017; 96(47): e8733. doi: 10.1097/ MD.0000000000008733.
3. Hong AR, Yoon JH, Kim HK. Malignant prolactinoma with liver metastases masquerading as metastatic gastrointestinal stromal tumor: a case report and literature review. Front Endocrinol (Lausanne) 2020; 11: 451. doi: 10.3389/ fendo.2020.00451.
4. Kars M, Roelfsema F, Pereira AM. Malignant prolactinoma: case report and review of the literature. EJE 2006; 155: 523–534. doi: 10.1530/ eje.1.02268.
5. Di Ieva A, Rotondo F, Syro L. Aggressive pituitary adenomas – diagnosis and emerging treatments. Nat Rev Endocrinol 2014; 10: 423–435. doi: 10.1038/ nrendo.2014.64.
6. Dworakowska D, Grossman AB. Aggressive and malignant pituitary tumours: state-of-the-art. Endocrine-Related Cancer 2018; 25(11): R559–R575. doi: 10.1530/ ERC- 18-0228.
7. Xu L, Khaddour K, Chen J. Pituitary carcinoma: two case reports and review of literature. World J Clin Oncol 2020; 11(2): 91–102. doi: 10.5306/ wjco.v11.i2.91.
8. Oscar DB, Lea JA, Silvia BC. Temozolomide therapy for aggressive pituitary tumors: results in a small series of patients from Argentina. Int J Endocrinol 2015; 2015:587893. doi: 10.1155/ 2015/ 587893.
9. Pernicone PJ, Scheithauer BW, Sebo TJ. Pituitary carcinoma: a clinicopathologic study of 15 cases. Cancer 1997; 79(4): 804–812. doi: 10.1002/ (SICI)1097-0142(19970 215)79:4<804:: AID-CNCR18>3.0.CO;2-3.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2021 Issue 3
Most read in this issue
- Vývojová dysfázie – funkční a strukturální korelace
- Doporučení pro intravenózní trombolýzu v léčbě akutního mozkového infarktu – verze 2021
- Intoxikace etylenglykolem
- Možnosti chirurgické léčby u farmakorezistentní Ménièrovy choroby
