Myastenie s pozitivními anti-MuSK protilátkami u mladého muže: kazuistika
Myastenia with Positive Anti-MuSk-positive Antibodies in a Young Man: A Case Report
Transient diplopia, dysarthria, dysphagia and dysphonia occured in a 21-year muscular man after a mild viral infection. Repetitive stimulation with mild decrement, non-improvement after pyridostigmin and absence of anti-ACHR antibodies gave evidence against neuromuscular transmission disorder. On the contrary signal hyperintensities on brain MRI created the basis for a long follow-up in a neurological outpatient department under the diagnosis brainstem symptomatology probably inflammatory origin. During the following years many attacs of dysarthria, nasolalia and dysphonia occured with only one and last attack of dyspnea. Because of these complaints the patient was newly recommended to neurological department. We made a new evaluation of complaints and clinical finding, EMG studies and at last blood samples for anti-MuSK antibodies were taken. Clinical findings and auxilliary investigations were typical for myasthenie with anti-MuSK antibodies. Clinical findings, comparison with anti-ACHR positive myasthenia, EMG findings and pharmacotherapy are objects of discussion.
Key words:
myasthenia – muscle specific kinase – anti-MuSK antibodies – repetitive stimulation – SF-EMG
Autoři:
E. Ehler; J. Latta
Působiště autorů:
Neurologické oddělení, Krajská nemocnice Pardubice
Vyšlo v časopise:
Cesk Slov Neurol N 2008; 71/104(1): 101-104
Kategorie:
Kazuistika
Souhrn
U 21letého svalnatého muže se po viróze objevila přechodná diplopie, dysartrie, dysfagie a dysfonie. Repetitivní stimulace jen s nevelkým dekrementem, nezlepšení po pyridostigminu a nepřítomnost protilátek proti ACHR (acetylcholinový receptor) svědčily proti poruše nervosvalového převodu. Naopak nález hyperintenzit na MRI byl podkladem pro dlouhodobé sledování v neurologické ambulanci s diagnózou kmenové symptomatologie nejspíše zánětlivého původu. V dalších letech však přicházely ataky s dysartrií, nazolalií a dysfonií a jednou se objevila ataka dušnosti. Pro tyto potíže byl pak znovu odeslán na naše pracoviště, kde byl přehodnocen klinický nález, provedeno EMG vyšetření a nakonec odebrány protilátky proti svalové specifické kináze (MuSK). Nález svědčil pro myastenii s anti-MuSK protilátkami. Předmětem diskuse je klinický nález, srovnání s anti-ACHR (acetylcholinový receptor) pozitivní myastenií, charakteristika EMG nálezů i reakce na farmaka.
Klíčová slova:
myastenie – svalová specifická kináza – protilátky anti-MuSK – repetitivní stimulace – SF-EMG
Úvod
Rozvojem slabosti obličejového svalstva, s dysartrií, diplopií a dysfagií je charakterizována celá skupina neurologických onemocnění. Pokud se tyto potíže rozvíjejí u mladého člověka a po prodělaném infektu horních dýchacích cest, je pak diagnostické úsilí zaměřeno především k mozkovému kmeni. Poruchy nervosvalového přenosu patří do diferenciální diagnostiky těchto potíží. Když jsou však elektrofyziologické nálezy necharakteristické a nejsou přítomny protilátky proti acetylcholinovým receptorům, pak se klinik koncentruje na sledování kmenových funkcí s případnými projevy autoimunitního onemocnění. A protože my jsme se s takovým nemocným setkali a po mnoho let jsme se snažili interpretovat kolísající slabosti svalů jako projevy kmenové dysfunkce, předpokládáme, že tato kazuistika bude nejen zajímavá, ale bude mít svůj praktický význam.
Kazuistika
V únoru 1994 se po virovém onemocnění s febriliemi u tehdy 21letého muže objevila diplopie při pohledu do obou stran, obtížné polykání i artikulace. Potíže vymizely do 14 dnů, a pak se ještě 2krát na několik dnů zopakovaly – vždy s únavností mimiky, diplopií, dysartrií, nazolalií.Tehdy byl hospitalizován na neurologii a vyšetřen včetně likvoru (na neuroinfekce i oligoklonální pásy – negativní) a EMG (užší a nižší MUP - potenciál motorické jednotky - z m. orbicularis oculi, repetitivní stimulace n. axillaris a n. ulnaris s nespecifickým dekrementem amplitudy do 6-7 % a normálním nálezem při SF-EMG (elektromyografie jednoho svalového vlákna) z m. extensor digitorum communis l. sin.). Na podkladě EMG nálezu byla poslána krev na protilátky proti ACHR (acetylcholinový receptor) – nález byl zcela negativní. Rovněž hodnoty kreatinkinázy a volného myoglobinu v séru byly v normě. CT mediastina s normálním nálezem. Při zkusmém podávání pyridostigminu (až 3x60 mg) došlo spíše ke zhoršení potíží (polykání a nazolalie), a proto byl lék vysazen. Následně bylo provedeno MRI mozku (IKEM Praha, 1996), kde byly nalezeny nespecifické změny v bílé hmotě kmene a obou hemisfér. Evokované potenciály (BAEP - sluchový kmenový evokovaný potenciál, VEP - zrakový evokovaný potenciál, SSEP - somatosenzorický evkovaný potenciál) bez jasné patologie. Nemocný byl nadále veden v neurologické ambulanci pod diagnózou kmenové symptomatologie nejspíše zánětlivého původu a ataky zhoršení po virózách či při prochladnutí a jindy v horku byly přičítány tomuto onemocnění.
Až v r. 2005 byl vyšetřen na interním oddělení pro dušnost a tlaky na hrudníku, byla zjištěna pouze hyperkalemie. V r. 2006 došlo po viróze k výraznému zhoršení potíží – diplopie, dysartrie, dysfagie i dysfonie, nevelké atrofie jazyka a mimického svalstva včetně poruchy mimiky, a proto byl hospitalizován na neurologickém odd. KN Pardubice. Nález atrofií jazyka a mimického svalstva s čistě motorickým postižením byl podnětem pro revizi původní diagnózy a dále jsme vyšetření vedli směrem k poruše nervosvalového přenosu, periferně neurogennímu či myogennímu postižení. V laboratoři byl nález normální: CK 1,54; volný myoglobin 37 µg/l (16-76); autoprotilátky i protilátky proti gangliosidům byly negativní. MRI mozku a C úseku s normálním nálezem. EMG – repetitivní stimulace s dekrementem do 6,1 % (m. anconeus) a nízké a úzké MUP m. orbicularis oris (MULTI-MUP: 0,3mV; 4,72 ms; polyfázie 0 %). Výrazně prodloužený jitter (86,34 µs) se 73 % blokování byl prokázán při stimulované SF-EMG m.frontalis vlevo. Po syntostigminu i.m. i po pyridostigminu per os došlo ke zhoršení (dysfagie, nazolalie, dysartrie). Potíže nemocného odezněly a my jsme jej s diagnózou myogenní porucha či netypická porucha nervosvalového převodu propustili domů. Vrátil se až v atace slabosti. Ihned jsme jej vyšetřili EMG s výrazně pozitivním nálezem při repetitivní stimulaci svědčícím pro postsynpatickou poruchu nervosvalového převodu (tab. 1). Po konzultaci jsme postupně nasadili efedrin 3 x 50 mg per os a potíže nemocného se mírně zlepšily a postupně stabilizovaly. Následně jsme odebrali krev na protilátky proti MuSK (svalová specifická kináza), a ty byly pozitivní – 1,35 nml/l (norma: 0-0,35 nml/l, metodou REA) (ÚKBLD VFN Praha).
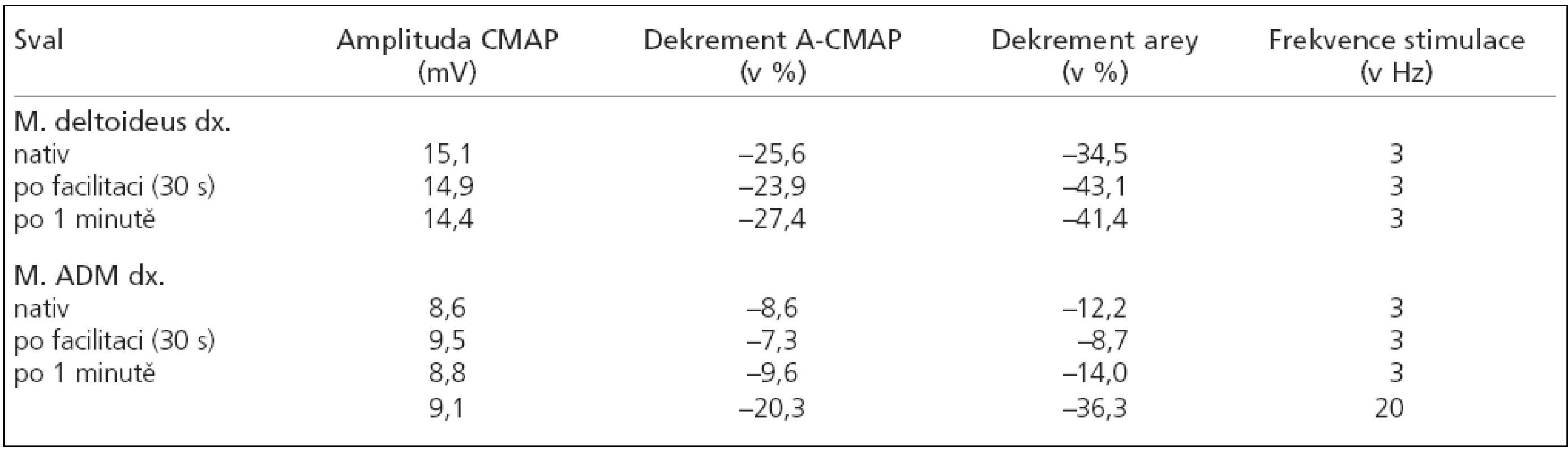
Klinický nález, EMG vyšetření, reakce na farmaka a pozitivní průkaz anti-MuSK protilátek byly podkladem pro stanovení diagnózy myastanie ACHR negativní a MuSK pozitivní. V současné době je tento 34letý muž léčen imunosupresí (prednison a azatioprin) a efedrinem a klinicky stabilizován.
Diskuse
Svalová specifická tyrozin-kináza (MuSK) tvoří součást postsynaptické membrány a v součinosti s agrinem se podílí na agregaci ACHR a jejich fixaci, a tím je nezbytná pro správnou funkci neuromuskulárního přenosu [1,2,3].
Asi u 20 % nemocných s generalizovanou myastenií nebývají přítomny protilátky proti ACHR a v této skupině jsou téměř u poloviny nemocných prokázány protilátky proti MuSK [4,5]. Na patofyziologii myastenie s anti-MuSK protilátkami není dosud jednotný názor. Morfologické poškození nervosvalových plotének je však u těchto nemocných méně výrazné než u pacientů s přítomnými ACHR protilátkami [6]. I když klinické příznaky mohou být u nemocných s anti-MuSK protilátkami stejné jako u nemocných s průkazem protilátek proti ACHR, přesto se velmi často nacházejí příznaky omezené na určitou oblast, a to často s průvodní atrofií svalů. Bývá to často skupina mimického či orofaryngeálního svalstva (tab. 2) [7]. Také náš nemocný měl ihned v počátku nemoci vedle tranzitorní diplopie také déletrvající dysartrii, dysfonii i dysfagii. A při poslední hospitalizaci jsme si všimli atrofických změn mimických svalů i jazyka.
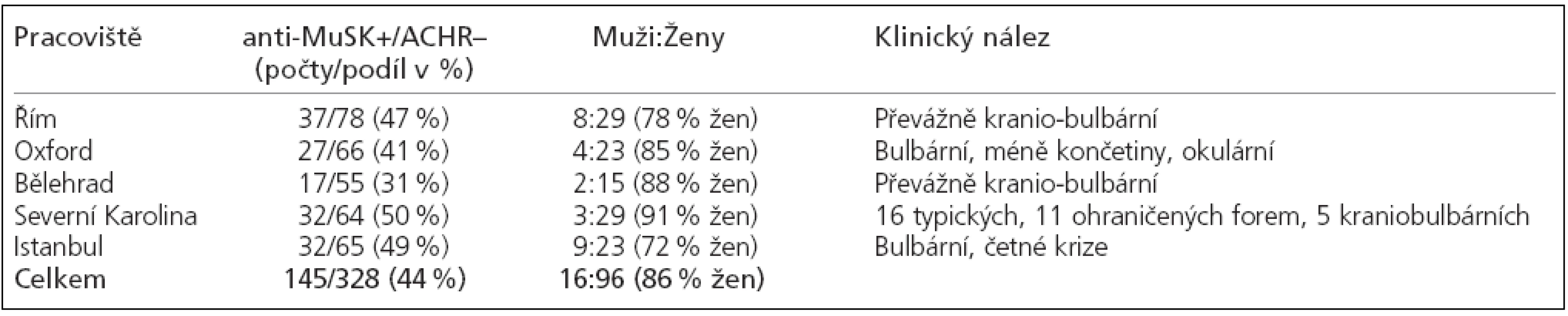
U nemocných s anti-MuSK protilátkami se častěji objevuje dušnost a slabosti šíjového svalstva [8,9]. U našeho nemocného se v roce 2005 objevila dušnost s tlaky na hrudníku, takže byl akutně vyšetřen na ambulanci interního oddělení. Až na nevelkou hyperkalemii (5,7 mmol/l) byl nález normální a dušnost i bolesti rychle vymizely. Příznaky sice bývají omezené na určitou krajinu, ale nebývají jen ohraničeny pouze na okohybné svaly [7,9]. Anti-MuSK protilátky nebyly prokázány u čistě okulární formy MG (až na jednu výjimku) [10] ,ani nebyly nalezeny současně s protilátkami proti ACHR. U našeho nemocného byla únavnost okohybného svalstva jen málo vyznačena. V atakách trvajících několik dnů až týdnů se objevovala dysartrie, nazolalie, dysfagie, dysfonie a porucha mimického svalstva. Ataky se provokovaly lehkou virózou, ale také koupelí v chladné vodě. Jinak pracuje jako zedník, má silné svaly trupu i končetin, chodí do posilovny, a to i při atakách slabosti.
Pokud se vyšetří repetitivní stimulací pouze svaly končetin, neprokáže se dekrement amplitudy či arey [7,11]. Je nutno vyšetřit svaly s klinicky přítomnou slabostí a únavností – zejména mimické svalstvo. Ani u našeho nemocného jsme neprokázali významný a reprodukovatelný dekrement již při vzniku potíží v r. 1994. Ale tehdy jsme stimulovali n. ulnaris a n. axillaris. Až při výrazné atace slabosti, kdy po předchozí dohodě nemocný ihned přišel do EMG laboratoře, jsme prokázali výrazný dekrement v oblasti n. axillaris (27 %), n. ulnaris (9,6 %). Avšak pro anxietu nemocného – a pozitivní nález při stimulaci periferních nervů – jsme od zamýšlené stimulace n. facialis upustili.
Také pro SF-EMG je doporučeno vyšetřit postižené svaly, ve kterých bývá výrazně patologický nález [2,7]. U našeho nemocného jsme v počátku nemoci vyšetřili SF-EMG z m. extensor digitorum communis (jitter 19,4 + 4,4 µs, bez blokování) a v r. 2006 stimulovanou SF-EMG z m. frontalis vlevo s dekrementem a blokováním.
Problémem pro interpretaci nálezu je vyšetření postižených svalů jehlovou elektrodou s nálezem nízkých a úzkých MUP, které svým tvarem i frekvencí pálení připomínají myogenní typ změn. Motorické jednotky jsou totiž zmenšeny tím, že je převod na značnou část motorických vláken zablokován [2,7]. I my jsme se s tímto „myogenním typem MUP“ setkali, a to jak v r. 1994 (m. orbicularis oculi l. dx.: 4,9 ms, 151 ± 101 µV, 20 % polyfazie), tak zejména v r.2007 (m. mentalis l. sin.: 5,54 ms, 176 µV, 0 % polyfazie).
U nemocných s anti-MuSK protilátkami se thymus nejspíše nepodílí na vývoji autoimunitního procesu, jak je tomu u myastenie s protilátkami proti ACHR. Dle literárních údajů nedochází po thymektomii ke zmírnění myastenických potíží [12]. Přitom účinnost imunosuprese, plazmaferézy, intravenózně podaných imunoglobulinů se u anti-MuSK myastenie neliší od myastenie anti-ACHR protilátkami. U našeho nemocného jsme pátrali po zvětšeném thymu již při vzniku onemocnění v r. 1994 (CT mediastina kontrastní látkou) i při zhoršení stavu v r. 2006 (MRI hrudníku). Zvětšený thymus však nebyl nalezen. Po zjištění pozitivity anti-MuSK protilátek jsme při negativním MR nálezu a v souladu s literárními údaji již u našeho nemocného neviděli prospěch z případné thymektomie.
Někteří nemocní s anti-MuSK protilátkami špatně tolerují inhibitory cholinesterázy, a to snad na podkladě určité zvýšené citlivosti na acetylcholin [5,7,9]. Jejich nasazení může vést ke zhoršení včetně poruch ventilace a polykání. Již na počátku nemoci náš nemocný nesnášel pyridostigmin. V r. 2006 po syntostigminovém testu byl bez větší reakce, ale perorálně podávaný pyridostigmin potíže akcentoval. Při nasazení efedrinu se sice objevily 2 dny trvající nevelké vegetativní potíže, ale v dalším již snáší dávku 3 x 50 mg velmi dobře a došlo ke stabilizaci potíží.
Závěr
Myastenie nemusí být vždy podmíněna produkcí autoprotilátek proti ACHR. Asi u poloviny nemocných s nepřítomností těchto protilátek jsou prokázány protilátky proti MuSK. Jiný typ nemocných a zejména rozdílný klinický nález u myasteniků s anti-MuSK protilátkami se teprve nyní dostává do povědomí kliniků. V diagnostickém procesu je to zejména EMG vyšetření, kdy je důležitý jak výběr svalů a nervů, tak metody, a zejména interpretace získaných výsledků. Diagnostika těchto nemocných bývá tedy podstatně delší a léčba značně rozdílná ve srovnání s klasickou formou MG.
doc. MUDr. Edvard Ehler, CSc.
Neurologické oddělení Krajské nemocnice Pardubice, Kyjevská 44, 532 03
e-mail: ehler@nem.pce.cz
Zdroje
1. Evoli A, Tonali PA, Padua L, Lo Monaco M, Scuderi F, Batocchi APOD. Clinical correlates with anti-MuSK antibodies in generalized seronegative myasthenia gravis. Brain 2003; 126 : 2304-2311.
2. Farrugia ME, Kennett RP, Newsom-Davis J, Hilton-Jones D, Vincent A. Single-fiber electromyography in limb and facial muscles in muscle-specific kinase antibody and acetylcholine receptor antibody myasthenia gravis. Muscle Nerve 2006; 33 : 568-570.
3. Piťha J, Ambler Z. Nejčastější chyby a omyly v diagnostice a terapii myasthenia gravis. Neurol pro praxi 2004; 5 : 285-290.
4. Keller O. Myastenie gravis. Trendy v medicíně 2000; 2 : 35-40.
5. Vincent A, Leite MI. Neuromuscular junction autoimmune disease: muscle specific kinase antibodies and treatments for myasthenia gravis. Curr Opin Neurol 2005; 18 : 519-525.
6. Shiraishi H, Motomura M, Yoshimura T, Fukudome T, Fukuda T. Acetylcholine receptors loss and postsynaptic damage in MuSK antibody-positive myasthenia gravis. Ann Neurol 2005; 57 : 289-293.
7. Sanders DB. MuSK-antibody positive myasthenia gravis: clinical and electrodiagnostic findings. In: Trontelj JV (Ed). XVIth international SFEMG and QEMG Course and IXth quantitative EMG conference. Program and Proceedings. Ljubljana 2007 : 119-123.
8. Jaretzki A, Barohn RJ, Ernstoff RM, Kaminski HJ, Keesey JC, Penn AS, Sanders DB. Myasthenia bravis. Recommendations for clinical research standards. Neurology 2000; 55 : 16-23.
9. Sanders DB, El-Salem K, Massey JM, McConville J, Vincent A. Clinical aspects of MuSK antibody positive seronegative MG. Neurology 2003; 60 : 1978-1980.
10. Caress JB, Christopher HH, Batish SD. Anti-MuSK myasthenia gravis presenting with purely ocular findings. Arch Neurol 2005; 62 : 1002-1003.
11. Oh SJ, Hatanaka Y, Hemmi S, Young AM, Scheufele ML, Nations SP. Repetitive nerve stimulation of facial muscles in MuSK antibody-positive myathenia gravis. Muscle Nerve 2006; 33 : 500-504.
12. Leite MI, Ströbel P, Jones M, Micklem K, Moritz R. Fewer thymic changes in MuSK antibody-positive than in MuSK antibody-negative MG. Ann Neurol 2005; 57 : 444-448.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2008 Číslo 1
-
Všechny články tohoto čísla
- Myastenie s pozitivními anti-MuSK protilátkami u mladého muže: kazuistika
- Webové okénko
-
Analýza dat v neurologii. VII.
Reprodukovatelnost a opakovatelnost měření u spojitých dat - Dopis redakci
- Dopis redakci
- Cohen-Gadol AA, Spenser DD. The Legacy of Harvey Cushing. Stuttgart, New York: Thieme 1999. ISBN973-3-13-147861-0.
- Anderson DG, Vaccaro A. Decision Making in Spinal Care. Stuttgart, New York: Thieme 2000. ISBN 3 13 140481-7.
- Klinické využití protilátek u roztroušené sklerózy
- Idiopatické generalizované epilepsie s typickými absencemi v dospělosti
- Difuzní gliomy mozkového kmene u dětí. Noční můra dětského onkologa.
- Bezpečnosť MRI vyšetrenia u pacientov s kovovými implantátmi a implantovanými prístrojmi
- Komentár k článku Nevrlý et al. Ovlivnění plazmatické hladiny homocysteinu u pacientů s Parkinsonovou chorobou terapií L-DOPA a entacaponem.
- Ovlivnění plazmatické hladiny homocysteinu u pacientů s Parkinsonovou chorobou terapií L-DOPA a entacaponem
- Úvodník
- Efekt nízké dávky manitolu na sérovou osmolalitu
- Komentář ke článku Charvát F et al. Mechanická embolektomie pomocí MERCI katétru u nemocných s akutním uzávěrem mozkových tepen.
- Mechanická embolektomie pomocí Merci katétru u nemocných s akutním uzávěrem mozkových tepen
- Myasténia gravis
- Komplementarita stentingu a endarterektomie karotid: tříleté zkušenosti
- Ageneze laterálního semicirkulárního kanálku: kazuistika
- Případ multifokální encefalitidy reagující na léčbu steroidy jako příčiny obtížně zvládnutelných epileptických záchvatů frontálního laloku
- Vznik neuritidy optického nervu v důsledku mukokély vedlejších nosních dutin - příčinná souvislost či koincidence? Kazuistika
- Mikroskopický nález kryptokoka v mozkomíšním moku jako první příznak rozvinutého stadia AIDS. Kazuistika
- Komentář ke článku Ehler E, Latta J. Myastenie s pozitivními anti-MuSK protilátkami u mladého muže: kazuistika
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Bezpečnosť MRI vyšetrenia u pacientov s kovovými implantátmi a implantovanými prístrojmi
- Difuzní gliomy mozkového kmene u dětí. Noční můra dětského onkologa.
- Myasténia gravis
- Klinické využití protilátek u roztroušené sklerózy
