Huntingtonova nemoc
Huntington’s Disease
Huntington’s disease (HD) is an autosomal dominantly inherited neuropsychiatric degenerative condition with a fatal prognosis. It is caused by mutation – the expansion of CAG (containing cytosine-adenine-guanine) triplet repeats 40 and more at the short arm of 4th chromosome. The main clinical features are motor impairment (especially choreatic dyskinesias and the impairment of voluntary movements), progressive cognitive deterioration and personality changes. The product of the mutation is an aberrant protein known as huntingtin with an enlarged polyglutamine stretch. The prevalence of HD is approximately 1 : 10–15,000. The typical onset of HD is in the 4th decade with a minority of cases starting in childhood or adolescence (juvenile HD) or in patients over 65 years of age (late-onset of HD). The initial symptoms are usually non-specific: behavioural changes, personality and affective disorders. As HD progresses, cognitive disturbance appears, leading to severe dementia. Typical motor symptoms are choreatic and/or dystonic dyskinesias, the impairment of voluntary movements, gait disorder, dysfagia and dysarthria. The progression of HD leads inevitably to a marantic, cachectic state and loss of the ability to make voluntary movements, to ingest food, control of urination and defecation, etc. Therapeutic interventions can only target symptoms. The degree of choreatic dyskinesias may be alleviated by antipsychotics, risperidone or tiapride for preference, or by GABAergics (clonazepam) or depletors of dopamine (tetrabenazine). Marked improvement of dystonia may occur with amantadine. In juvenile forms of HD with akinetic syndrome it is possible cautiously to use L-DOPA or amantadine. Irritability and agresivity respond to antipsychotics, sertraline or valproate. Psychotic symptoms may be treated in accord with routine psychiatric protocoles. Adequate (hypercaloric) food intake is extremely important. Sipping or even percutaneous gastrotomy is often indicated in the advanced stages of HD. A multidisciplinary approach (neurology, genetics, psychiatry, speech therapy, physiotherapy and ergotherapy, dietetics, social support etc.) in HD is essential. Genetic testing confirms the clinical diagnosis. Adult and healthy people at risk may be able to request predictive genetical testing, but specific protocolary procedure is realized. Children and adolescents are not tested. Prenatal testing is also available. Pre-implantation genetic diagnosis allows to give the birth of a healthy child without knowing of the genetical state of whichever parent at HD risk.
Key words:
Huntington’s disease – CAG triplet – genetic testing – chorea – dementia
Autoři:
doc. Mudr Jan Roth, CSc.
Působiště autorů:
Univerzita Karlova, Neurologická klinika 1. LF UK a VFN Praha
Vyšlo v časopise:
Cesk Slov Neurol N 2010; 73/106(2): 107-123
Kategorie:
Minimonografie
Souhrn
Huntingtonova nemoc (HN) je autozomálně dominantně dědičné neuropsychiatrické onemocnění s fatálním průběhem. Hlavními klinickými projevy jsou hybné symptomy (především choreatické dyskineze a poruchy volní hybnosti), dále progredující kognitivní deteriorace a různé další psychické změny, především poruchy chování, afektivní symptomy aj. Podstatou mutace je expanze tripletu obsahujícího cytosin‑adenin‑guanin (CAG) s kritickou hranicí 40 a více repeticí na krátkém raménku 4. chromozomu. Produktem mutace je změněný protein nazývaný huntingtin. Prevalence HN je přibližně 1 : 10–15 000. Typický počátek HN je ve 4. dekádě, existují však i poměrně vzácné juvenilní formy HN i formy HN s pozdním počátkem. Počátek psychických symptomů je necharakteristický a převážně se jedná o nespecifické změny osobnosti a chování, afektivní či kognitivní poruchy. Typickými neurologickými projevy jsou poruchy volní hybnosti, choreatické a dystonické dyskineze, porucha chůze, dysfagie, dysartrie, méně často mozečkové příznaky. Progresi HN nelze léčebně ovlivnit, ale řadu symptomů lze alespoň přechodně léčebně tlumit. Průběh HN však vede nezadržitelně k marasmu, kdy postižená osoba není schopna základních denních aktivit. Choreu lze tlumit antipsychotiky (1. volba: tiaprid, risperidon), GABAergními léčivy (klonazepam) či depletory dopaminu (tetrabenazin). U dystonie je účinný amantadin. U vzácné juvenilní formy HN s akineticko‑rigidní symptomatikou se dá použít levodopa či amantadin. Z poruch chování lze ovlivnit především iritabilitu a agresivitu atypickými antipsychotiky nebo v kombinaci s valproátem či antidepresivy typu SSRI. Psychotické projevy se léčí podle běžných terapeutických postupů. Demence je bohužel léčebně neovlivnitelná. Zásadní význam v terapii HN má prevence kachektizace hyperkalorickou stravou, event. enterální výživou, včetně použití PEG v pokročilých případech. V rozvoji HN se objevuje celá řada specifických projevů, které vyžadují multidisciplinární specializovanou péči. Potvrzení klinické diagnózy je prováděno genetickým testem, a zda je mutace přítomna, se dá ověřit i u potomků nemocné osoby – osoby v riziku HN, avšak za použití specifického protokolu. U osob v riziku do 18 let věku se testování neprovádí. Prenatální testování je také dostupné. Technika preimplantační genetické diagnostiky umožňuje narození zdravého dítěte i u osoby v riziku, která nezná svůj genetický stav.
Klíčová slova:
Huntingtonova nemoc – CAG triplet – genetický test – chorea – demence
Definice Huntingtonovy nemoci
Huntingtonova nemoc (HN) je autozomálně dominantně dědičné neuropsychiatrické onemocnění s fatálním průběhem. Hlavními klinickými projevy jsou hybné symptomy (především choreatické dyskineze a poruchy volní hybnosti) a změny psychiky (především kognitivní deteriorace a poruchy chování). Podstatou mutace je expanze tripletu obsahujícího cytosin‑adenin‑guanin (CAG) s kritickou hranicí 40 a více repeticí na krátkém raménku 4. chromozomu. Prevalence HN je přibližně 1 : 10–15 000. Typický počátek HN je ve 4. dekádě, existují však i poměrně vzácné juvenilní formy HN i formy HN s pozdním počátkem.
Historické poznámky
V roce 1872 publikoval 22letý lékař James Huntington charakteristiku onemocnění, které se vyskytovalo v oblasti East Hampton, Long Island, kde se narodil a žil [1]. Jeho dědeček a otec v této oblasti pracovali jako lékaři, a měl tak k dispozici pro svou publikaci nejen svá pozorování, ale také popisy pacientů, jejich rodin a předků v rozsahu předchozích 78 let rodinné lékařské praxe.
Ve své publikaci brilantně shrnul veškeré základní rysy onemocnění: dědičný ráz, fatální průběh, počátek v dospělosti, a samozřejmě i hlavní symptomatiku: poruchu hybnosti, změny chování a demenci. Jeho publikace si povšiml vlivný profesor neurologie William Osler z Univerzity Johna Hopkinse v Baltimoru a nemoc byla brzy akceptována jako nová klinická jednotka.
Onemocnění však bylo, i když ne tak detailně a se všemi charakteristikami, popsáno již dříve. V roce 1842 byl publikován dopis Charlese Oscara Waterse v Practise of Medicine s popisem velmi věrně vystihujícím tuto chorobu a v roce 1860 norský lékař Johan Christian Lund publikoval (bohužel však v norštině) pozorování nemocných s obdobnými projevy [2].
Extrémní význam pro výzkum HN měl objev praktického lékaře jménem Americo Negrette, který v 50. letech 20. století objevil ve Venezuele ohnisko HN v izolovaném společenství při jezeru Maracaibo, kde žije cca 10 000 osob s více než 100 nemocnými HN [9]. Ze vzorků krve postižených osob této oblasti také pochází objev mutace.
Co se historie slova chorea týče, jako první použil tento termín Paracelsus v 16. století. Označoval tím nekoordinované pohyby končetin a trupu připomínající taneční projev (chorea‑choros‑tanec). Použil jako první také termín tanec sv. Víta pro hybné a psychické projevy osob při středověkých náboženských obřadech, tzv. taneční mánie. Zpětně se zdá pravděpodobné, že se mohlo jednat o epileptické projevy či o projevy intoxikace námelovými alkaloidy z potravin z obilí, pojem se však stal synonymem pro Huntingtonovu nemoc (HN). Je bohužel vysoce pravděpodobné, že v historii procesů s čarodějnicemi, posedlými ďáblem atd. byla umučena řada osob nemocných HN.
Epidemiologie
Výskyt HN se v zemích Evropy a Ameriky v současnosti odhaduje na cca 5–10/100 000 obyvatel [3–5]. HN je relativně častější ve všech zemích, kam historicky směřovala emigrace z Evropy (USA, Kanada či Austrálie). Evropa však možná nebude jediným zdrojem mutace genu pro HN. V Japonsku a jiných zemích Dálného východu (a také v Africe) se HN objevuje vzácněji [2]. Nejznámější epidemiologickou studií v Evropě je studie z Jižního Walesu [6,7] a v USA z Marylandu [8].
Typický věk nástupu prvních příznaků HN je mezi 35.–50. rokem věku, obě pohlaví jsou postižena stejně. Průměrná doba přežití je zhruba 15–20 let. Pokud je HN zděděna od otce, je vyšší pravděpodobnost, že se nemoc u potomka projeví v mladším věku než u rodiče (podrobněji viz podkapitola Klinická genetika).
Podstatně vzácněji (cca 5% všech případů) se HN manifestuje v dětském věku (juvenilní forma HN) či do 20. roku věku (HN s časným počátkem). Tato forma nemoci má obvykle jiné klinické projevy než tzv. klasická forma (podrobněji viz podkapitola Klinický průběh). Poměrně vzácná (cca 5%) bývá také forma HN s pozdním počátkem, tedy s prvními projevy po 60. roku věku.
Patologie
Hlavními neuropatologickými změnami CNS v časných stadiích HN je selektivní postižení specifických neuronálních subpopulací – GABAergních neuronů, tzv. středně velkých ostnitých neuronů ve striatu [10, 11]. Podrobná klasifikace neuropatologických změn v bazálních gangliích byla provedena Vonsattelem v roce 1985 [12].
Jako první odumírají ty striatální neu-rony, které produkují mimo GABA také enkefaliny a na nichž jsou uloženy D2 dopaminové receptory. Teprve v dalším průběhu nemoci začnou degenerovat ty striatální neurony, které mimo GABA produkují také substanci P a na nichž jsou uloženy D1 dopaminové receptory. Oba typy neuronů jsou tzv. projekční neurony (tj. spojující striatum s jinými strukturami), interneurony se zdají být poškozeny méně. Tato selektivita postižení v časovém vývoji má i patofyziologické konsekvence (viz podkapitola Patofyziologie HN).
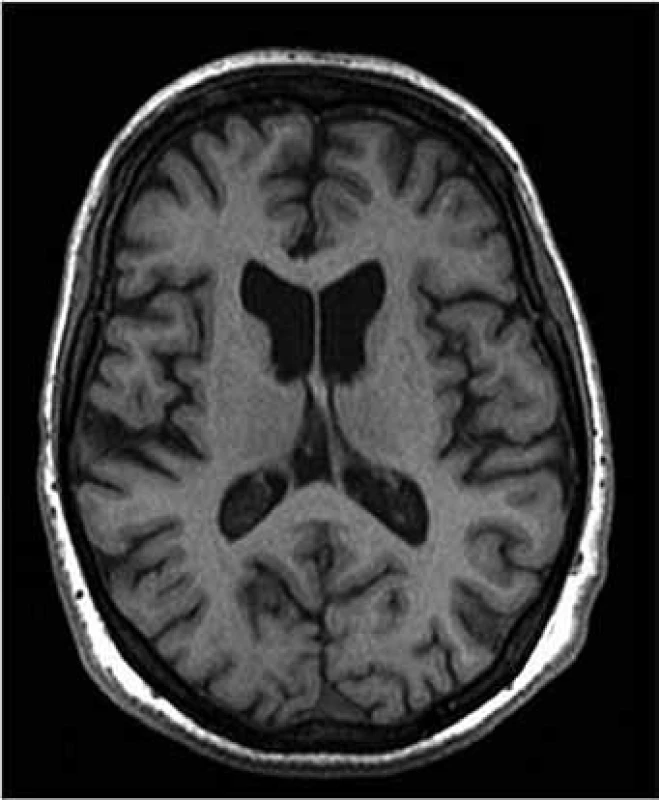
V důsledku buněčné ztráty dochází i k makroskopické atrofii striata, která je patrna v MR (obr. 1) i CT obrazu a lze ji i v časných stadiích nemoci detekovat a kvantifikovat pomocí CT planimetrických [13] či MR volumometrických měření [14,15].
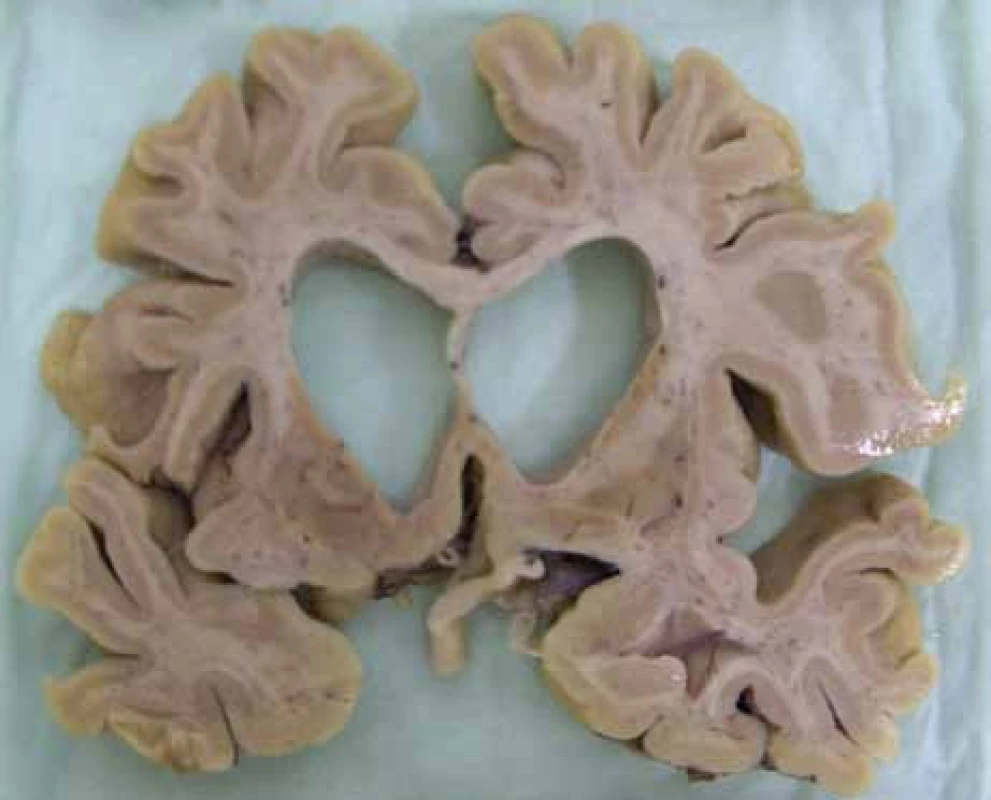
Jak nemoc dále progreduje, objevují se postižení dalších neuronálních subpopulací: v globus pallidus, ncl. subthalamicus, substantia nigra, hipokampu, hypothalamu, cerebelu a thalamu [16,17]. Paralelně s degenerací subkortikálních struktur se odehrávají neuropatologické změny i v kortexu [12], detekovatelné i pomocí MR [18]. Společně s neurodegenerativními změnami se objevuje gliová proliferace reparativního rázu. V pozdních stadiích nemoci dochází k těžké atrofizaci mozku jako celku (obr. 2).
Etiologie a patogeneze
HN je autozomálně dominantně dědičné neurodegenerativní onemocnění vznikající mutací genu IT 15 na krátkém raménku 4. chromozomu [19]. Podkladem mutace je zmnožení tripletu C‑A‑G (cytosin‑adenin‑guanin) na 40 a více repeticí (podrobněji viz níže). Tato mutace mění strukturální a funkční vlastnosti proteinu huntingtinu.
Fyziologický huntingtin je protein o velikosti 350 kDa obsahující polyglutaminovou sekvenci na svém N‑konci. Počet repeticí glutaminu je dán počtem repetic CAG tripletů. Fyziologická role huntingtinu není doposud dokonale prozkoumána. Huntingtin se exprimuje nejvíce v mozku a v testes [20], vyskytuje se však ve všech buňkách lidského těla (patří k tzv. ubikvitérním proteinům). V mozku je vyjádřen v různých oblastech [21] a míra jeho exprese ve striatu nevysvětluje selektivitu patologických procesů v časném stadiu. V neuronech se vyskytuje především v cytoplazmě, kde je zapojen do interakcí s velkým množstvím dalších proteinů a hraje roli v transkripčních procesech a v axonálním transportu [22]. Jeho významnou vlastností je také regulace exprese neurotrofních faktorů (specificky brain derived neurotrophic factor, BDNF). BDNF hraje zásadní roli v podpoře striatálních buněk a jejich vývoje v rámci ontogeneze [23]. Zdá se, že huntingtin má také anti‑apoptotické vlastnosti. Ze zvířecích studií je známo, že deplece fyziologického huntingtinu u myši (tzv. knock‑out model pro gen huntingtinu) vede k poruše neurogeneze závažného stupně, neslučitelné s postnatálním životem [24].
Ke vzniku patologického huntingtinu dochází vlivem zmnožené repetice CAG tripletu, která způsobí prodloužení polyglutaminového řetězce. Toto zmnožení polyglutaminu, označované jako tzv. polyQ, změní strukturu a konformaci huntingtinu. Je velmi pravděpodobné, že se u HN nejedná o ztrátu funkce mutovaného proteinu, ale že dochází ke změně jeho funkce s toxickými důsledky. I mutovaný huntingtin je však potřebný, postačuje k zajištění normálního prenatálního vývoje mozku. K patologickým projevům – důsledkům mutace – dochází až v pozdější době života.
Mechanizmy jeho patogenetického působení nejsou doposud podrobně prozkoumány [25], v mnoha studiích je patrný vliv na veškeré hlavní kandidáty mechanizmů neurodegenerace, přes excitotoxicitu, oxidativní stres, apoptózu, mitochondriální dysfunkci, agregaci proteinů, aktivaci mikroglie až po defekt neurogeneze [26].
V posledních letech se u HN mimoto více a více diskutuje o specifických mechanizmech poruch axonálního a vesikulárního transportu, transkripční poruchy, poruchy postsynaptické signalizace aj. [27]. Také vliv patologického huntingtinu na mechanizmy proteolýzy: ubiquitin‑proteázomový systém [28,29] i na lysozomální systém [30] je zřejmě zásadního významu.
Z důvodů nepostačující proteolýzy zřejmě dochází u HN a dalších neurodegenerativních chorob k intracelulární kumulaci bílkovin – k tvorbě bílkovinných agregátů – inkluzí. Mutovaný huntingtin s obsahem polyQ má navíc sám o sobě tendenci k agregaci. Agregáty a inkluze se hromadí nejen v cytoplazmě, ale i v jádrech neuronů (obr. 3).
Význam agregátů huntingtinu není ještě jednoznačně interpretován – je možné, že agregáty nejsou toxické a nepoškozují neurony, ale že tvorba agregátů je spíše protektivním mechanizmem, jak zabránit toxicitě volných či intermediárních polyQ obsahujících forem huntingtinu. Neurony obsahující inkluze dokonce podle některých studií umírají u HN později než neurony bez inkluzí [31].
Klinická genetika
Podstatou mutace podmiňující vznik HN je zmnožení repetice CAG tripletu.
V současné době je již známo více dědičných chorob, jejichž mutace je dána tripletovou expanzí, jsou to např. spinocerebelární ataxie typu 1, 2, 3, 6, 7, 12, 17, dále spinobulbární svalová atrofie či dentato‑rubro‑pallido‑luysiánská atrofie [35]. Tyto tzv. tripletové choroby sdílejí celou řadu významných podobností: např. počet tripletů se mezigeneračně může měnit (tzv. instabilita), intermediární alely (hraniční počet tripletů, okolo „kritického počtu“ – podrobněji níže) jsou vysoce nestabilní, za určitých okolností je patrný časnější nástup choroby u následujících generací (tzv. anticipace) a fakt, že čím více je přítomno tripletů, tím bývá časnější nástup choroby. Také základní patologický proces – proteinopatie s důsledkem tvorby agregátů a inkluzí – je sdílen.
Jak již bylo napsáno výše, při 40 a více tripletech jedinec zcela jistě onemocní HN (pokud se dožije věku projevů nemoci) [4,32–34]. U osob s 36–39 triplety je prognóza nejistá [4,34]. Počet tripletů mezi 27–35 nemůže sice u svého nositele způsobit HN, ale je považován za tzv. nestabilní – v intergeneračním přenosu se počet tripletů může až v 10% všech případů zvýšit, a to i nad kritickou úroveň nutnou pro vznik HN [36]. Jsou však popsány i kontrakce (redukce počtu) tripletů [37]. Čím vyšší je počet tripletů, tím více je nestabilní [38,39].
Inverzní vztah mezi počtem CAG a věkem nástupu klinických projevů HN (čím více je CAG tripletů přítomno, tím dříve nemoc vypukne) byl prokázán v mnoha studiích [32,33,40,41]. Tento vztah je však zřetelný pouze u osob s velkým (nad 60) a hraničním (36–39) počtem tripletů [33,34]. Počet CAG tripletů je sice hlavní, není však jediný faktor rozhodující o věku klinického počátku HN – určuje jej pouze zčásti [42]. Lze předpokládat existenci celé řady dalších ovlivňujících faktorů, tzv. gene modifiers, které jsou předmětem zkoumání a hledání [42,43]. Z tohoto důvodu se zjišťoval i možný vliv přítomnosti mutace na obou chromozomech (homozygotní kompozice HN) na nástup a průběh HN. Takovéto případy jsou popsány jak u jezera Maracaibo, tak vzácně i jinde. Je zajímavé, že homozygotní kompozice neovlivňuje věk nástupu HN [44], ale predikuje její horší klinický průběh [45].
S velkým počtem CAG tripletů se setkáváme více u osob s paternálním přenosem, protože k expanzi CAG tripletů dochází především během spermatogeneze [39,46,47], či nějakým zatím neznámým mechanizmem závisí na pohlaví předka a embrya potomka [37,48].
U všech tripletových onemocnění, tedy i u HN, existuje také tzv. somatická instabilita neboli mozaicizmus [49]. Tento pojem charakterizuje situaci, kdy v různých buňkách lidského těla existuje různý počet CAG tripletů v daném genu. Tento mechanizmus je u HN nepochybně přítomen, a to jak u zvířecích modelů, tak u člověka [50,51]. Zdá se, že ve striatu se nacházejí nejvyšší počty repeticí [50,51]. In extremis by to mohlo vést i velmi vzácně k falešné negativitě genetického testu (nižší počet repeticí v lymfocytech, ze kterých se provádí genetický test).
Problematika tzv. nových mutací (tj. nepřítomnosti pozitivní rodinné anamnézy i za předpokladu znalostí paternity a zdravotního stavu obou předků) se v současnosti vysvětluje především mechanizmem instability, kdy u předků nemocné osoby se počet repeticí pohyboval mezi 28–35 (viz výše).
Patofyziologie
Komplex bazálních ganglií je funkčně propojen spoji a dráhami, které vytvářejí paralelně pracující okruhy [52]. Tyto okruhy jsou zapojeny do funkčních celků – okruhů napojených do struktur ležících mimo bazální ganglia (thalamus, frontální laloky a limbický systém). V současnosti rozeznáváme pět základních okruhů bazálních ganglií [53]. Úkolem motorického okruhu je řízení hybnosti – podrobněji níže. Oční pohyby řídí zvláštní okulomotorický okruh vycházející z frontálního okohybného pole. Tři další okruhy se podílejí na regulaci psychiky a kognitivních funkcí – viz níže.
V současnosti se za hlavní vstupní bránu do systému bazálních ganglií považuje striatum [54,55], tedy jádro, které je dominantně poškozeno při HN již v incipientních stadiích HN.
Patofyziologický podklad vzniku hlavních motorických symptomů nemoci
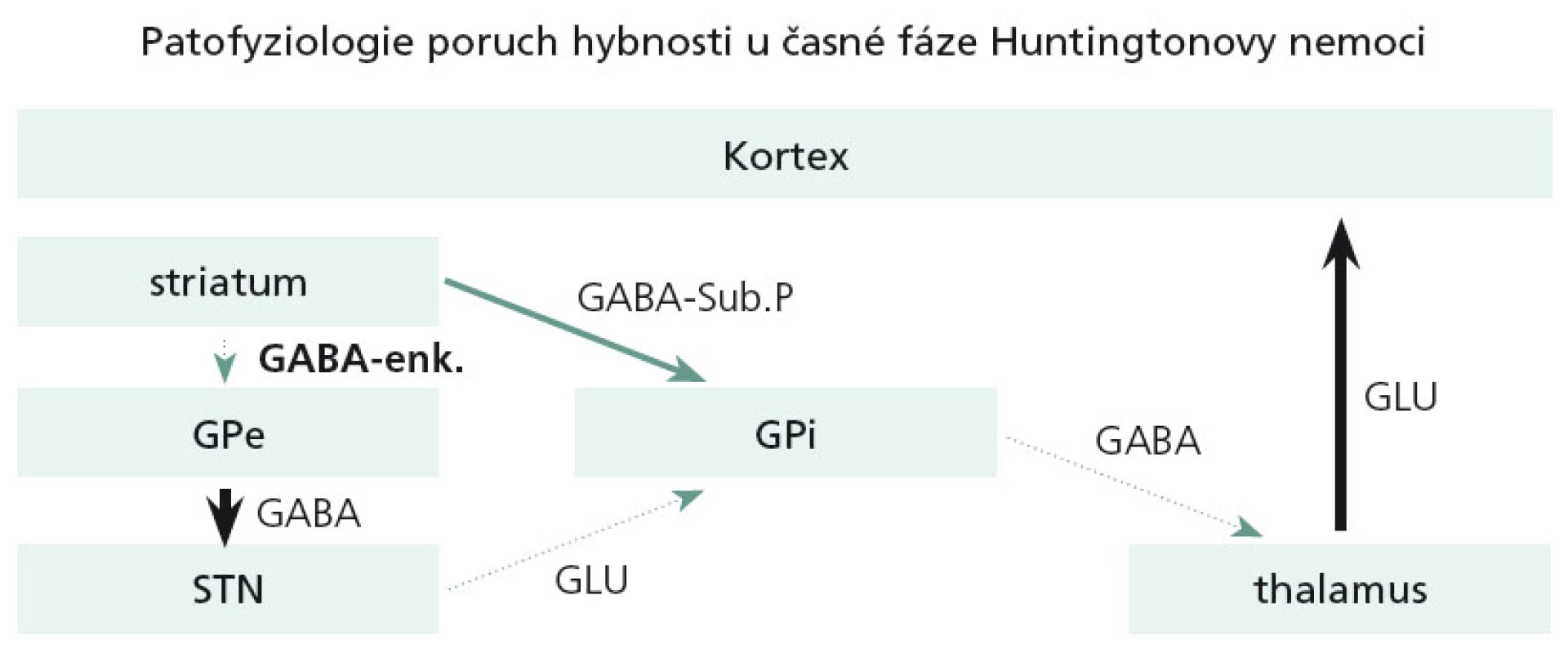
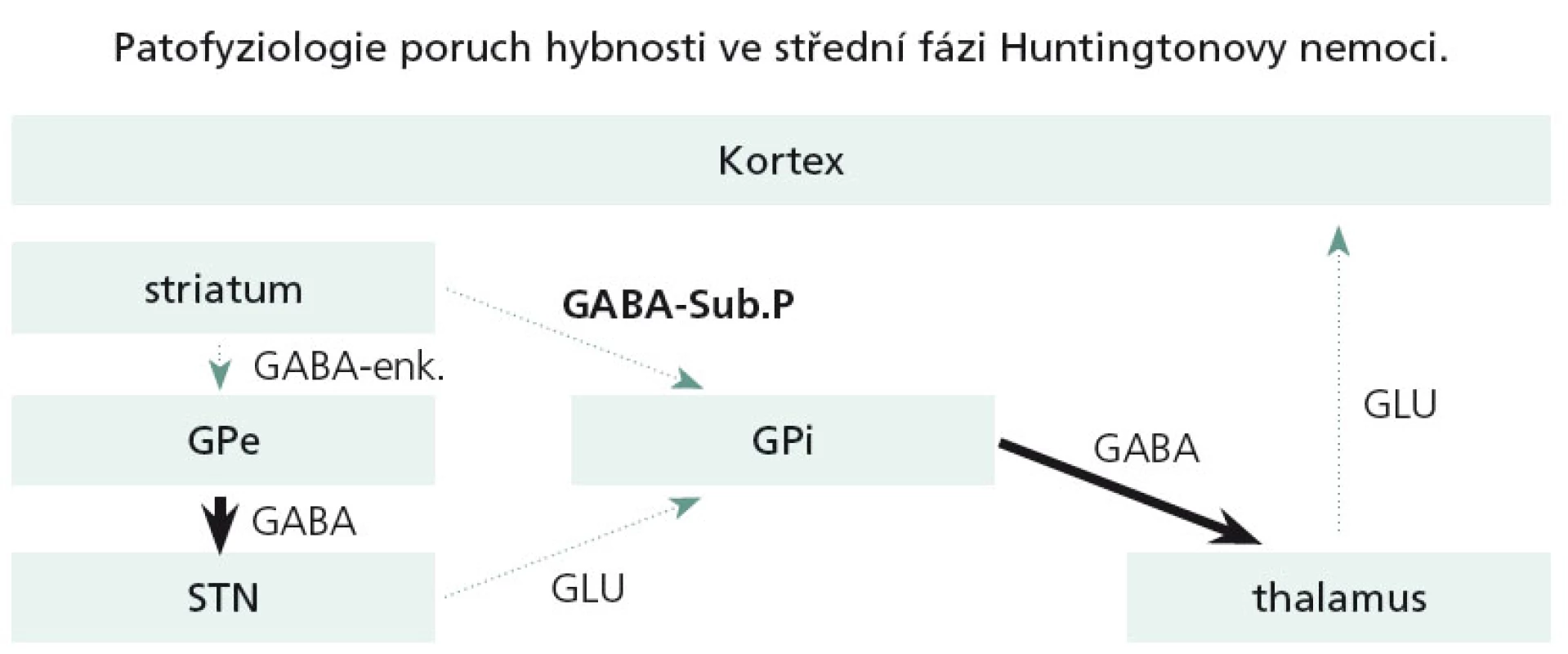
Dominující a velmi časné neuropatologické změny u HN se týkají právě striata. V časných stadiích HN dochází pouze k odúmrti určité subpopulace GABA + enkefalin obsahujících striatálních neuronů, které jsou zapojeny do nepřímé motorické dráhy bazálních ganglií. Tato dysfunkce ve svém důsledku zapříčiní hyperaktivitu thalamokortikálních spojů a tímto mechanizmem se objeví chorea (obr. 4).
V další progresi nemoci odumírají i tzv. GABA + substance P + dynorfin obsahující neurony, zapojené do přímé motorické dráhy. Dysfunkce přímé dráhy způsobí utlumení thalamokortikálních spojů a v důsledku toho se chorea výrazně utlumí či vymizí a objevuje se dystonie a později extrapyramidový akineticko-rigidní syndrom (obr. 5).
Patofyziologický podklad vzniku hlavních mentálních symptomů nemoci
Jednou z dominantních oblastí určujících charakter rozvoje psychopatologických projevů u HN jsou podle současných vědomostí změny ve třech funkčních okruzích striata (především ventrálního) spojených s určitými oblastmi frontálních laloků [56–58]. Nazývají se podle výchozí oblasti kůry frontálních laloků, jež je dále propojena se specifickými oblastmi striata, pallida, substantia nigra a jádry thalamu zpět do frontální kůry: dorzolaterální prefrontální okruh, laterální orbitofrontální okruh a přední cingulátový okruh. Tyto okruhy se daří definovat nejen anatomicky, ale též funkčně podle značně specifických obrazů psychických poruch vznikajících při lézích příslušných oblastí frontálních laloků.
Dorzolaterální prefrontální syndrom se vyznačuje postižením exekutivních kognitivních funkcí, tj. poruchami cílené činnosti a řešení problému, paměti a učení. Orbitofrontální syndrom odpovídá klasickému popisu prefrontálního syndromu s dezinhibovaným chováním a emoční labilitou. Přední cingulátový (mediofrontální) syndrom je charakterizován výraznou apatií až akinetickým mutizmem.
Psychické změny však mohou mít původ i mimo tyto striato‑frontální okruhy. Dochází při nich totiž prakticky vždy i k transmiterovým dysbalancím v ascendentních kmenových systémech. Ty hrají významnou roli v regulaci psychických projevů (serotonin – nuclei raphe – deprese, agrese, anxieta, noradrenalin – locus coeruleus – bdění/spánek, pozornost, dopamin – substantia nigra – mezolimbický a mezokortikální systém – kognitivní, afektivní, motivační funkce, chování) [59]. Změny přední části kaudata, kam vstupují mimo jiné i dráhy z limbického kortexu, jsou zřejmě zodpovědné za velké afektivní poruchy u Huntingtonovy nemoci. Ventrální striatum a nucleus accumbens, podle některých studií oblasti změněné často u schizofrenie, jsou postiženy v pozdějším stadiu HN (mimo tzv. juvenilní formy nemoci, kde dochází k výrazným změnám právě v této oblasti již v počátečních stadiích). Schizoformní stavy často skutečně vznikají v časných fázích především juvenilní formy nemoci.
Diagnostika
Diagnózu HN je jednoduché stanovit zvláště za situace, kdy známe rodinnou anamnézu závažné neuropsychiatrické nemoci (např. postižený předek umřel v psychiatrické léčebně) a současně jsou u aktuálního nemocného přítomny dyskinetické projevy společně s poruchou chování a kognitivním deficitem. Takto jednoduchá však situace v klinických ambulancích nemusí být. Rodinná anamnéza může relativně často chybět (non‑paternita, neinformovanost o jednom z rodičů, např. po rozvodu předků, nová mutace atd.) či ji pacient a rodina v rámci „vytěsnění problému“ popírá. Také klinický obraz může být u jednotlivých pacientů velmi rozdílný, závislý na dominanci projevů (jsou rodiny s dominující psychiatrickou či neurologickou symptomatikou) a stadiu choroby.
Na možnost HN bychom měli myslet vždy, pokud se u dospělého člověka pozvolna rozvíjejí změny chování či kognitivní deficit v kombinaci s hybným postižením, nejčastěji choreatického nebo dystonického rázu, a to i bez záchytu obdobných obtíží v rodinné anamnéze. Pokud máme rodinnou anamnézu pozitivní, bereme velmi vážně i drobné změny chování, poruchy osobnosti či i jen diskrétní poruchy paměti.
Genetický test potvrzuje pouze přítomnost mutace – pozitivita testu u člověka, který nemá žádné projevy HN, neznamená diagnózu HN, ale pouze přítomnost vlohy pro nemoc. Genetický test lze teoreticky provést v několika modelových situacích:
Diagnostický (konfirmační) test
Provádí se v případě důvodného klinického podezření na HN. Test klinickou diagnózu potvrdí či vyloučí, a to s jistotou téměř 100%. Pacient vždy musí být informován, že je odebírána krev na provedení genetického testu k vyloučení či potvrzení HN, musí s provedením testu souhlasit a svůj souhlas písemně potvrdit. Výjimku lze provést pouze v případě postižení pacienta takového stupně, který znemožňuje spolupráci.
Osoby v riziku a prediktivní test (presymptomatický a prenatální)
Provádí se u doposud zdravých osob v riziku HN (presymptomatický test), tj. potomků postižené osoby, kteří si přejí znát, zda zdědili mutaci, či nikoliv. Dále ji lze provádět v průběhu gravidity ženy nemocné, případně pozitivně testované (či ženy nemocného nebo pozitivně testovaného partnera), která si přeje znát genetický status svého ještě nenarozeného dítěte (prenatální test) z plodové vody (amniocentéza, biopsie choria).
Genetické testování osob v riziku HN přineslo velké dilema: v důsledku toho, že diagnostika HN je zcela spolehlivá a dostupná, nicméně zásadnější terapeutické možnosti HN chybí, vznikly závažné etické problémy: HN je doposud zcela nevyléčitelné onemocnění devastujícího rázu a dědičného charakteru, které se obvykle projeví na vrcholu produktivního věku. V důsledku nemoci je člověk postupně vyřazen ze sociálního a pracovního života, trpí celou řadou svízelných zdravotních obtíží (jak hybných, tak psychických), nemoc zkracuje délku jeho života a riziko vzniku nemoci předává svým potomkům.
Na jedné straně provedení testu a sdělení výsledku ukončí jeho nejistotu a umožní lépe se rozhodovat o budoucnosti (uzavření manželství, plánování rodičovství, finanční zabezpečení atd.), na druhé straně však při pozitivitě výsledku ztrácí naději na zdravý život, je konfrontován s mnoha nepříznivými psychosociálními dopady na svou existenci a s pravděpodobností předání vlohy pro nemoc svým potomkům [60].
Každý člověk v riziku HN rozhodující se o provedení testu, a tedy zjištění přítomnosti či absence mutace, je ve velmi těžké situaci a za své rozhodnutí nese plnou zodpovědnost. Proto není prováděno presymptomatické testování u nezletilých.
Existují dvě nezadatelná práva každého člověka v riziku HN, mezi kterými se rozhoduje: právo znát a právo neznat svůj genetický stav. Nikdo by neměl žadatele ovlivňovat, pouze on sám se může rozhodnout s plným vědomím závažnosti.
Motivací žadatele o provedení testu je obvykle touha po sdělení negativního výsledku, tj. že není nositelem mutace. Velmi často také žadatel není dostatečně informován o charakteru nemoci, především o její nevyléčitelnosti a devastujícím rázu. Proto je dodržován tzv. protokolární postup, který žadateli umožní získat potřebné informace a čas na jejich zpracování před konečným rozhodnutím. Toto doporučení bylo vytvořeno Světovou neurologickou federací a Mezinárodní asociací na pomoc při HN [61].
Důležité otázky probírané v průběhu protokolu jsou: Vím, co chci vědět? Proč to chci vědět? Proč to chci vědět právě teď? Co chci a co mohu změnit v závislosti na výsledku testu? Co je pro a co proti provedení testu? Kdo mně pomůže?
Poté, co se lidé v riziku dozvědí o možnosti genetického testování, většina z nich si chce ihned nechat provést test. Průběh protokolárního postupu toto procento výrazně sníží – test je realizován u 9–20% původních žadatelů (hlavní důvody jsou: strach ze ztráty naděje, obavy před sledováním sama sebe a hledáním prvních příznaků atd.) [62].
Doba protokolárního postupu trvá přibližně 10–12 týdnů. Žadatel vstoupí do prvního rozhovoru s klinickým genetikem – specialistou, který mu vysvětlí všechny základní aspekty nemoci a problematiku provedení testu. V intervalu mezi vstupním rozhovorem a další genetickou konzultací absolvuje neurologické vyšetření u lékaře – specialisty, který má vyloučit či potvrdit eventuální iniciální symptomy choroby a také informuje žadatele o nemoci a odpovídá na jeho dotazy. Následuje genetická konzultace, po které žadatel absolvuje psychologické vyšetření. Poté by měl žadatel absolvovat psychiatrické vyšetření (opět k vyloučení symptomů nemoci a k hodnocení duševního stavu v průběhu rozhodování). Při další genetické konzultaci, opět za 3–4 týdny, hodnotí genetik společně se žadatelem jeho motivace, výhody a nevýhody provedení testu atd. Pokud žadatel absolvuje celý protokol a své rozhodnutí nezmění, přijde k závěrečnému pohovoru, po kterém podepíše informovaný souhlas, a následuje odběr krve. Za přibližně 2–3 týdny se osobně dostaví ke sdělení výsledků. Nutný je doprovod rodinného příslušníka, který není v riziku, nebo jiné blízké osoby. Po sdělení pozitivního i negativního výsledku zůstává testovaný subjekt a jeho rodina ve styku s odborným týmem, je kontaktován s pacientskou organizací.
Počet tripletů zjištěných v prediktivním testování neumožní spolehlivou predikci věku nástupu prvních klinických obtíží – většina osob, které onemocní klasickou formou HN, má počet tripletů mezi 40–45 a tam predikce nástupu klinických projevů podle počtu tripletů není možná, vliv modifikujících faktorů může být velmi významný (např. osoba s počtem tripletů 40 může onemocnět dříve než osoba s 45 triplety). Existují však snahy některých výzkumníků vytvořit prediktivní matematické vzorce [63].
Naše zkušenosti s diagnostickým i prediktivním testováním HN jsou shrnuty v publikacích Židovské et al [64,65].
V několika posledních letech je možné i v ČR pomocí preimplantační genetické diagnostiky umožnit párům, kde jedna osoba je člověkem v riziku HN, narození dítěte, které není nositelem mutace HN, a to bez nutnosti osoby v riziku konfrontovat se se svým genetickým stavem (blíže např. http://emedicine.medscape.com/article/273415–overview).
Diferenciální diagnostika
V následujícím textu se budeme zabývat výlučně problematikou diferenciální diagnostiky nemocných, jejichž symptomatika je charakteristická pro HN, nicméně při genetickém vyšetření mají normální alelickou kompozici v genu IT 15. Nebudeme zde probírat problematiku diferenciální diagnostiky choreatických pohybů ani jednotlivé klinické jednotky, které se manifestují izolovanou choreou.
Klinický obraz rozvinuté klasické formy HN je poměrně charakteristický svými hlavními projevy:
- Porucha motoriky, především ve smyslu generalizovaného dyskinetického choreatického syndromu a poruch volní hybnosti.
- Široké spektrum behaviorálních projevů: zejména apatie, iritabilita, deprese, obsese, kompulze.
- Kognitivní deficit s dominující exekutivní dysfunkcí progredující do těžké demence.
Pouze 1% pacientů se symptomatikou typickou pro HN není nositelem mutace v genu pro huntingtin [66]. Tyto případy označujeme jako tzv. huntingtonské fenokopie (HF).
V tab. 1 jsou shrnuty diagnostické možnosti při záchytu HF [67].

Dentato-rubro-pallido-luysianská atrofie (DRPLA) je autozomálně dominantně (AD) dědičná nemoc [68]. Prevalence DRPLA je častější v japonské populaci, v jiných etnických populacích je vzácná [69].
První projevy DRPLA se mohou objevit jak v dětství, tak v mladém dospělém i pokročilém dospělém věku. V populaci nad 40 let věku se klinicky prezentují obvykle ataxií, choreoatetózou a kognitivním deficitem. U mladých dospělých a adolescentů se objevuje ataxie a symptomy progresivní myoklonické epilepsie – myoklonus, různé druhy epileptických paroxysmů, kognitivní deficit je rovněž přítomen. DRPLA je na MR charakterizována celkovou mozkovou atrofií, ale zejména atrofií ncl. caudatus.
SCA‑17 – spinocerebelární ataxie typ 17(někdy je také označována jako Huntington’s disease like 4, HDL 4) je AD dědičná porucha ze skupiny SCA a pravděpodobně je to nejčastější HF v Evropě. Klinické projevy obsahují obvykle HF (kognitivní deficit dle různých prací v cca 80%, choreatické dyskineze v 66%), v přibližně 50% jsou přítomny příznaky postižení pyramidové dráhy, dystonické příznaky a bradykineze, přitom téměř u 100% pacientů se objevuje progredující cerebelární ataxie [70]. Na MR nacházíme mozečkovou a kortikální atrofii, nález ale může být i negativní [71]. Intenzita a kombinace symptomů je však vysoce variabilní.
Choreoakantocytóza (Levineův‑Critchleyův syndrom, ChA) je autozomálně recesivně (AR) dědičné onemocnění vázané na 9. chromozom [72]. Produktem mutovaného genu je abnormní protein chorein. ChA se klinicky manifestuje nejčastěji ve 3. a 4. dekádě. Pro ChA je typická kombinace výskytu choreodystonického dyskinetického syndromu, neuropsychiatrických změn a nápadné atrofie caput ncl. caudati v zobrazovacích metodách. V krevním obrazu je typická přítomnost akantocytů (erytrocyty s abnormálním, ostnatým tvarem). Neuroakantocytózám, tj. onemocněním s přítomností akantocytů společně s progredující neurologickou symptomatikou, je v českém písemnictví věnována publikace Klempíře et al [73]. Pro ChA jsou typické orofaciální dyskineze včetně automutilace rtů a jazyka, dysartrie, dysfagie, poruch dýchání a vokální tiky. V pokročilých stadiích se objevuje tzv. feeding dystonie (jazyk vytlačuje potravu z úst). Typická je bizarní chůze s trupovou dystonií. Až na výjimky je přítomna šlachově okosticová areflexie a neuropatické změny. V séru je často zvýšena kreatinkináza, laktátdehydrogenáza, alaninaminotransferáza (ALT), aspartátaminotransferáza (AST), někdy i gamaglutamyltransferáza (GMT) a vždy snížený haptoglobin (marker hemolýzy akantocytů). Přibližně polovina nemocných trpí častými epileptickými záchvaty, kognitivní deteriorací subkortikálního typu a behaviorálními poruchami. Progrese onemocnění je individuální.
McLeodův syndrom (MLS) je také obvykle doprovázen přítomností akantocytů v periferní krvi. Je to na X chromozom recesivně vázaný, velmi vzácný syndrom [74]. Mutace genu XK vede ke snížení tvorby Kell antigenů systému krevních skupin lokalizovaných na erytrocytární membráně. MLS se manifestuje u mužů, především ve 3. a 4. dekádě. Může být klinicky shodný s ChA. Pro MLS je dále typická přítomnost kongestivní či dilatační kardiomyopatie a poruchy srdečního rytmu (fibrilace síní, tachyarytmie), hepatosplenomegalie. Poruchy hlubokého čití jsou častější než u ChA. Makroskopicky významná je atrofie caput ncl. caudati na MR.
Neuroferitinopatie je vzácné AD dědičné onemocnění způsobené mutací na chromozomu 19 působící v oblasti lehkého řetězce feritinu, s následkem depozit železa a feritinu v mozku, s normální nebo sníženou hladinou železa v séru [75]. Klinické projevy obvykle splňují kritéria HF, i když často převažují motorické příznaky a kognitivní deficit je méně závažný než u HN [76]. MR mozku obvykle odhalí depozita železa (v T2 váženém obrazu hyperintenzity v oblasti BG), v pokročilých případech také cystickou degeneraci ncl. caudatus a putamen. Klinické symptomy se u pacientů objeví typicky ve věku 40–60 let.
Friedreichova nemoc (FRDA) patří k nejčastějším hereditárním ataxiím. Je způsobena expanzí tripletu GAA na 9. chromozomu. Podle kritérií Quebec Cooperative Study [77], která však zhruba 25% pacientů nesplňuje, se FRDA projevuje ataxií osovou i končetinovou, dále může být dysartrie, ztráta vibračního čití a abnormální oční pohyby. Objevuje se však i chorea, v některých případech dokonce zcela bez cerebelární symptomatiky [78]! FRDA začíná obvykle v dětském věku, ale popisován je i vznik klinických obtíží až v dospělém věku. U těchto pacientů jsou méně časté sfinkterové poruchy či kardiomyopatie [79].
Návrh základního diferenciálnědiagnostického postupu u suspektní HF [67]:
1. Anamnéza, objektivní neurologické vyšetření, orientační psychologické vyšetření (detekce změn kognice, chování), event. psychologické a psychiatrické vyšetření.
2. Zhodnocení, zda pacient splňuje dg. kritéria pro huntingtonskou fenokopii.
3. CT či MR vyšetření, vyšetření mutace pro HN.
4A. V případě nálezu atrofie caput ncl. caudati v CT či MR obrazu:
- zopakovat vyšetření mutace pro HN z nezávislého vzorku;
- vyšetření akantocytů, jaterních testů, kreatinkinázy a EMG k vyloučení ChA a MLS;
- vyšetření mutace pro SCA 17 (v ČR zatím nedostupné).
4B. V případě nálezu normální velikosti caput ncl. caudati v CT či MR obrazu:
- u osob mladších 45 let vyloučit Wilsonovu nemoc, SCA 1, 2, 3 a FRDA.
Klinický obraz a průběh
I. Preklinická (prediagnostická) stadia nositelů mutace
Fakt, který velmi znesnadňuje přesnější stanovení začátku klinické manifestace HN, tkví v tom, že objevení se charakteristických symptomů, především choreatických dyskinezí, předchází, a to i o mnoho let, drobné a nespecifické změny chování [80,81]. Poté se objevují pouze velmi drobné kognitivní a hybné symptomy, opět nepostačující pro klinickou diagnostiku. Ve studii Kirkwoodové bylo definováno pět základních komponent postižení: okulomotoriky, rychlosti pohybů, drobných poruch volní hybnosti, kognitivních funkcí a reakčních časů [81]. Zajímavým zjištěním je také specifická neschopnost rozeznávat výrazy obličeje nejen u nemocných s HN, ale i u nositelů mutace HN [82–84].
Období, ve kterém lze pozorovat výše popsané symptomy, může trvat řadu let předcházejících manifestaci a stanovení diagnózy HN [85–87].
Obdobné výsledky byly zjištěny i ve studii s funkční magnetickou rezonancí u osob v riziku HN [88], kdy byly patrny změny ještě před klinickou manifestací HN.
II. Klinické projevy HN
V tab. 2 a 3 jsou vyjmenovány hlavní klinické projevy HN.
![Neurologické symptomy Huntingtonovy nemoci [89].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/79c6ad70faaf4e7e8be86debe4e6851a.png)
![Psychopatologické příznaky Huntingtonovy nemoci [89].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/541e38bf34eaea4b7a649de583d4d9c4.png)
Klasická forma HN
Klasická forma HN je nejčastější (cca 90% všech případů). První příznaky se objevují mezi 35.–50. rokem věku. Jejich charakter a kombinace mohou být velmi různorodé.
Neuropsychiatrické poruchy
Prvními projevy HN bývají obvykle změny chování a osobnosti [90]. Typické jsou zejména dva scénáře vývoje. V prvním modelovém klinickém obrazu se pomalu objevuje a rozvíjí nedostatek zájmu o své okolí, o potomky a jejich potřeby, o partnera či partnerku, o svůj vzhled. Velmi charakteristický bývá brzký rozvoj apatie (nezávisle na event. přítomnosti deprese), emocionálního oploštění [91].
Nemocný člověk začíná selhávat v pracovních činnostech, mimo jiné také v důsledku rozvoje kognitivního deficitu – viz níže. Důsledkem tohoto scénáře jsou opakovaná propuštění z práce a propadání se v sociálním žebříčku.
Takovýto stav může progredovat i více let, než se začnou objevovat drobné choreatické dyskineze, a teprve v této fázi bývá chorea obvykle vodítkem k stanovení klinické diagnózy a provedení genetického testu.
Druhý klinický scénář začíná také rozvojem poruch chování a změnami osobnosti, avšak jiného, produktivního typu. U pacientů se projevuje zvýšená podrážděnost (iritabilita) [92] či úzkostné stavy [93]. Pro úzkost nejsou často schopni nadále řešit dříve banální úkoly. Rodinní příslušníci si například všimnou úzkostné reakce nemocného na běžné a nevýznamné události – pozdní příchod domů; rozhodování, co si vzít na sebe; zda přijmout pozvání na návštěvu apod. Úzkost se u nemocných s HN často a úporně projevuje somatoformními obtížemi (bolesti hlavy, zad, zažívací obtíže), které pacienti velmi často sdělují jako dominantní problémy.
Typický pro toto stadium je také rozvoj deprese, a to u min. 40% všech případů [94], či bipolární afektivní porucha [8]. Závažným problémem této skupiny pacientů je suicidalita. Nemocní páchají sebevraždy 4–6krát častěji oproti zdravé populaci [95]. Některé údaje hovoří v této skupině pacientů o prevalenci sebevražedného jednání dosahující až 13%. Je nutné zdůraznit, že suicidální chování hrozí v kterémkoliv stadiu HN, a to i v případě, že dosud nebyla nemoc diagnostikována.
Prvními projevy mohou být také např. žárlivecké projevy či rysy podezřívavosti. Poměrně často také vidíme obsedantní myšlenky a kompuzivní jednání a perseverace [96,97]. Občas lze u osob s HN v časných fázích pozorovat i problémy spojené s hypersexualitou, případně s ní spojené projevy agresivity, promiskuity nebo sexuálně provokativního chování, avšak častějším problémem nemocných je impotence [98]. V počátku HN se může také objevit i drobná kriminalita (např. krádeže) či problémy s alkoholem [99]. Okolí tyto jevy vnímá jako „bezcharakterní“ projevy, jde však již o chorobné změny. Agresivita verbální i brachiální se častěji projevuje u těch pacientů, kteří k ní měli sklon po celý život. Velmi často je namířena jen vůči nejbližším rodinným příslušníkům. Predispoziční symptomy pro agresivní chování jsou především anxieta, depresivní a psychotické symptomy, obsedantně‑kompulzivní porucha, deliriózní stavy. Provokující faktor bývá často psychosociální stres navozený změnou prostředí, zadáním více úkolů v krátkém čase, pocitem neschopnosti vyplývajícím z nedokonalého rozumění řeči, potížemi s běžnými úkoly či konfliktem s autoritami.
V důsledku tohoto scénáře rozvoje chorobných změn dochází v rodinách nemocných k rozvodům, k odebrání dětí z péče atd. Někdy teprve až po více letech se objeví další klinické projevy HN vedoucí ex post k přiřazení výše popsaných projevů k diagnóze.
Kdykoliv v průběhu rozvoje HN se mohou objevit také psychotické projevy [97].
U HN je častým dominujícím rysem psychotického stavu generalizované paranoidní nastavení (bludy) spojené s iritabilitou a agresivním chováním. Halucinace jsou poměrně vzácnější.
Častým a pro HN obecně typickým symptomem je ztráta náhledu nemoci působící problémy, zejména pokud nemocný chce nadále pokračovat v činnostech, které už není schopen zvládnout (např. řízení auta, nakládání s financemi).
Kognitivní poruchy
Drobné kognitivní změny předcházej často typickému klinickému obrazu s dyskinezemi [100]. Pokles kognitivních funkcí u HN není globální ani rovnoměrně progredující a rychlost rozvoje demence je individuální. V časných stadiích HN dominují izolované kognitivní deficity, zejména poruchy exekutivních funkcí, pozornosti, procesu učení, paměti a změny psychomotorického tempa. Občas lze pozorovat i dlouhodobý stacionární charakter. Míra kognitivní deteriorace nemusí být přímo úměrná behaviorálním ani neurologickým symptomům.
Z paměti je nejvíce postižena pracovní a krátkodobá paměť. Dlouhodobá paměť je poměrně dlouho a dobře zachována. Pro postižení bazálních ganglií obecně (tedy i u HN) jsou typické především poruchy procedurální paměti (nevědomé učení motorickým dovednostem – řízení auta, chůze apod.). U HN není výrazně narušeno skladování informace v paměti, ale její vybavení, které lze usnadnit znovupoznáním (rekognicí), nápovědou (reprodukce s nápovědou) nebo vytvářením asociací.
Poruchy paměti jsou podmíněny i tzv. exekutivní dysfunkcí (neschopnost tvorby konceptu jednání, plánování, porušenou kontrolou průběhu určitého výkonu a jeho časové struktury a zároveň sníženou schopností rychlé změny aktuální činnosti dle zevních požadavků). Exekutivní funkce jsou nepostradatelné i pro výběr podstatných informací, jejich uložení a volné vybavení z paměti. Je to především porucha exekutivních funkcí, která dominuje již od časných stadií HN, a nemocní jsou především proto již velmi brzy v rámci rozvoje HN závažně invalidizováni a neschopni soustavné pracovní činnosti.
S progresí HN se objevuje demence – globální úbytek kognitivních funkcí nepřiměřený věku, který interferuje s denními aktivitami subjektu. Pro HN je typická demence tzv. subkortikálního typu, u které dominují poruchy exekutivních funkcí, změny psychomotorického tempa, poruchy chování (iritabilita, apatie, obsedantně‑kompulzivní projevy apod.), nálady (deprese) a úzkostné projevy. Na rozdíl od demence kortikálního typu (např. u Alzheimerovy nemoci) jsou fatické, praktické a gnostické funkce u HN relativně zachovány [101]. S další progresí kognitivní deteriorace jsou však výrazně postiženy i kortikální funkce.
Podrobněji o psychických změnách u HNv českém písemnictví viz práce Rotha a Klempíře [102].
Motorické poruchy
Chorea je považována za esenciální projev HN a na základě její přítomnosti se velmi často teprve začne zvažovat tato diagnóza. Z časového hlediska rozvoje HN je však chorea přeceňovaným příznakem pro diagnostiku, protože její objevení se je relativně pozdním projevem – obvykle nastupuje až po více letech rozvoje psychopatologie – takže správná diagnóza je obvykle stanovena s velkým zpožděním a je velmi obtížné určit přesněji skutečnou dobu počátku choroby.
Choreatické dyskineze jsou mimovolní, rychlé, nepravidelné a nestereotypní pohyby v náhodné distribuci, a to jak kořenového, tak i akrálního svalstva. Mezi typické choreatické projevy patří neschopnost udržet vyplazený jazyk v klidu (nemocný člověk jej mimovolně zatahuje zpět do úst – tzv. příznak jazyka), nepravidelné povolování a svírání při stisku ruky (tzv. příznak dojičky), grimasování v obličeji a typická kolébavá až taneční chůze. Mírná chorea, např. typické drobné pohyby prstů napodobující jakoby hru na klavír, často ujde pozornosti, považují se za obecné projevy psychomotorického neklidu. Chorea bývá i z terapeutického hlediska přeceňována – nebývá obvykle tím nejvíce invalidizujícím hybným projevem, na rozdíl od poruchy volních pohybů a dystonie. Někdy však dosahuje skutečně invalidizující tíže.
Chorea v průběhu nemoci individuálně rychle progreduje, posléze však spontánně snižuje svou intenzitu a přechází v dystonii a později v akinezi.
Ještě významnější poruchou hybnosti, než jsou choreatické dyskineze, je od časných stadií pozvolna progredující ztráta volní hybnosti – především ta je zodpovědná za motorické selhávání v mnoha základních denních aktivitách.
Porucha volních pohybů je v klinické praxi velmi podceňovaný projev, přispívá však zásadním způsobem k invalidizaci pacienta. Nešikovnost, hybné zpomalení a porucha koordinace pohybů, ať již horních končetin při cílené činnosti či celého těla při koordinaci chůzového stereotypu, nejsou důsledky dyskinezí, ale samostatnou poruchou. Na rozdíl od dyskinetických projevů porucha volní hybnosti souvisí s progresí a délkou nemoci a také s kognitivní deteriorací [103]. Mechanizmy poruch volní hybnosti nejsou doposud podrobně prozkoumány.
Dystonie (přetrvávající svalové stahy působící kroucení a opakované pohyby nebo abnormální postavení postižených částí těla) se objevuje obvykle v středně pokročilých stadiích klasické formy HN. Často se např. trupová dystonie stává zdrojem významné poruchy chůze.
Mimo choreu a dystonii lze u některých nemocných také pozorovat myoklonus (mimovolní, rychlý a krátce trvající svalový záškub).
Těžký, generalizovaný parkinsonský syndrom se objevuje až v pozdních stadiích HN (tzv. sekundární Westphalova varianta – tj. imobilita bez dyskinezí). Nemocní jsou pak zcela imobilní a dochází k sekundárním komplikacím (dekubity, infekty). Rigidita však bývá přítomna u mnoha nemocných již ve středních stadiích HN, mimo jiné i v důsledku terapie antipsychotiky.
Poruchy chůze jsou závažné projevy výrazně horšící kvalitu života. Rozvíjejí se obvykle ve středních stadiích nemoci. Objevuje se „rozházená“ chůze o široké bázi, rušená náhlými mimovolními pohyby, ale pády jsou vzácné. V pozdějších stadiích se pády objevují častěji s narůstající dystonií, bradykinezí, rigiditou a posturální instabilitou.
Dysartrie je velmi častým projevem nemoci. Obvykle se porucha řeči rozvíjí ve středních a pozdních stadiích nemoci, může se však objevit i v prvních létech. Postupem nemoci progreduje a řeč se často stává zcela nesrozumitelnou. Charakteristická je explozivní a sakadovaná řeč, tzv. hyperkinetická dysartrie. Občas lze pozorovat i mimovolně vzniklé zvuky typu bručení nebo povzdechů, které přerušují řeč.
Závažným problémem je dysfagie, která zejména pro pacienty v pokročilých stadiích nemoci může mít fatální následky. Je nutno aktivně pátrat po problémech s polykáním tekuté a tuhé stravy, po kašli, teplotách a recidivujících zánětech dýchacích cest (aspirace!). Aspirace jsou často dlouho klinicky němé. Vzácně lze pozorovat i tzv. hyperfagii, tj. polykání nerozkousaných velkých soust, snad pod vlivem nekontrolovatelného pocitu hladu, kdy hrozí udušení pacienta.
Postupná kachektizace většiny pacientů je typickým rysem pokročilých stadií nemoci a nemusí být spojena s nápadným úbytkem chuti k jídlu a problémy s běžným příjmem potravy. Váhový úbytek nelze uspokojivě vysvětlit a neodpovídá tíži dyskinez. Předpokládá se účast degenerace laterálních jader hypothalamu. Časná kachektizace je spojena s horší prognózou nemoci.
Zvláštním fenoménem je také velmi charakteristický výraz obličeje u HN: emoční oploštěnost, prázdnost pohledu spojená s výrazem lehké omrzelosti až znechucení.
Pacient se po zhruba 10–15 letech rozvoje všech výše popsaných projevu nemoci (průběh však bývá individuální) stává závislým na péči okolí a umírá po cca 20 letech rozvoje HN v marantickém stavu, většinou na komplikace základní nemoci: infekce, dekubity atd.
Podrobněji o hybných poruchách u HN v českém písemnictví viz publikace Rotha [89].
Juvenilní forma HN
Tato forma nemoci začíná před 20. rokem věku a vzniká u cca 5% všech případů HN. Asi v 1–2% všech případů dochází dokonce k manifestaci před 10. rokem věku. Velmi časný počátek HN je obvykle spojen s paternálním přenosem – viz Klinická genetika. Jako první se objevují poruchy chování, relativně často jsou přítomny psychotické příznaky a rychle se rozvíjí demence. Choreatické dyskineze obvykle nejsou patrné a dominuje rigidita a bradykineze (tzv. primární Westphalova varianta). Mezi časté projevy patří také dystonie, myoklonus a pyramidové příznaky. Až u poloviny nemocných se objevují epileptické paroxysmy různého typu. V pokročilých stadiích dochází k těžké dysartrii a dysfagii. Progrese obtíží vede rychle k nesoběstačnosti, k závislosti na péči okolí. Doba přežití je kratší než u klasické formy, cca 10 let od prvních projevů [104].
Forma HN s pozdním počátkem
Tato forma nemoci se manifestuje o osob starších 60 let. Jedná se o cca 5% všech případů HN. Počátek po 70. roce věku je výjimečný, lze předpokládat, že drobné symptomy byly již přítomny dlouho předtím, a pouze nebyly rozpoznány. Tato forma nemoci má pomalý průběh a nemocní se mohou dožít průměrného věku zdravé populace. Hlavním příznakem jsou mimovolní pohyby typu chorey, a to především cirkumorálně (tzv. senilní chorea je určitě v části případů zapříčiněna nediagnostikovanou HN s pozdním počátkem), mohu však být i generalizované. Obvykle nepůsobí závažné postižení základních denních aktivit a nemocní jsou po motorické stránce dlouho soběstační. Výraznější demence se obvykle nerozvíjí, izolované kognitivní deficity však jsou přítomny (zejména poruchy pozornosti a volného vybavení krátkodobé paměti, dysexekutivní syndrom). Z behaviorálních poruch se nejčastěji objevují apatie, deprese či iritabilita.
Terapie
Kauzální terapie HN t. č. neexistuje. Také zpomalení progrese nemoci není možné. Některým ze symptomů nemoci však lze účinně farmakologickou a psycho‑sociální intervencí čelit. Farmakologická léčba některých symptomů přináší velkou úlevu a zlepšení kvality života nejen nemocným, ale i pečovatelům a rodinným příslušníkům (např. terapie agresivity, psychotických projevů atd.). Moderní a komplexní terapie HN však vyžaduje multidisciplinární tým, obvykle pod vedením zkušeného neurologa, psychiatra nebo klinického genetika zabývajícího se dlouhodobě HN. V týmu by mimo tyto profese měli být také psycholog, fyzioterapeut, sociální pracovník, ergoterapeut, logoped, nutriční specialista, zkušená zdravotní sestra atd.
Pro reprezentativní přehled všech farmakologických studií, které byly provedeny u HN, odkazujeme na vyčerpávající metaanalýzu Bonelliho a Wenninga [105] a v českém písemnictví na souhrnnou publikaci Rotha, Klempíře a Uhrové [106].
Terapie motorických poruch
a) Dyskinetický syndrom (chorea, dystonie)
Při léčbě chorey nesmíme zapomínat, že stres choreatické dyskineze zvyšuje, a tedy hodnocení v ambulanci lékaře nemusí odpovídat běžné intenzitě dyskinezí. V každém případě je nutné respektovat zásadu, že léčit máme až choreu, která negativně ovlivňuje, invalidizuje svého nositele.
Antipsychotika (neuroleptika) blokádou postsynaptických dopaminových receptorů ve striatu tlumí dyskineze. Typická antipsychotika tlumí choreatické dyskineze účinněji než atypická, nicméně mají i vyšší procento závažných nežádoucích efektů. Jsou to především sedace, apatie, zpomalení psychomotorického tempa, posturální instabilita s pády, dysfagie, dysartrie a event. indukce polékového parkinsonského syndromu či akutních a tardivních dyskinezí. Antipsychotika u HN však mohou příznivě ovlivnit také iritabilitu, agresi a psychotické příznaky, nutno však mít na vědomí, že výrazně zhoršují apatii, častou symptomatiku u HN.
V současné době používáme v našem centru jako antichoreatická léčiva 1. volby tiaprid (pomalu stoupat od 50mg na noc až do maximální celkové dávky 600mg rozděleně ve třech denních dávkách) či risperidon (pomalu stoupat od 0,5mg na noc, do 4–6mg ve dvou denních dávkách). Při neefektivitě těchto dávek či vedlejších účincích zkoušíme dále např. sulpirid, melperon či olanzapin, teprve poté nasazujeme klasická antipsychotika, např. haloperidol (0,5–1mg/den, max. 10mg/den) anebo jiné farmakologické skupiny (viz níže).
Presynapticky působící léky na dopaminových synapsích (tzv. depletory dopaminu – reserpin a tetrabenazin) byly u choreatických dyskinezí také zkoušeny a měly dobrý efekt. U tetrabenazinu v dávkách do 150–200mg/den nebývají přítomny některé komplikace antipsychotik. Jeho použití však na druhou stranu dosti často indukuje závažné deprese a parkinsonský syndrom. V České republice není tetrabenazin dostupný, je nutno jej speciálně dovážet v systému tzv. sirotčích léků a je poměrně drahý.
Některé GABAergní léky tlumí poměrně účinně dyskineze, jejich nevýhodou však je často nutná eskalace dávek v průběhu terapie, vznik závislosti, posturální instabilita a sedace. Nejlepší účinky podle našich zkušeností pozorujeme u klonazepamu. Málokdy stoupáme na více než na 2–4mg/den rozděleně do tří denních dávek.
Pokud se chorea začne měnit v dystonii či dokonce v akinezi, je na místě především postupně antipsychotika snižovat či přímo vysadit (pokud je to ovšem možné z hlediska event. psychotických symptomů), protože antipsychotika mohou jak dystonii, tak akinezi u HN zhoršit.
V indikaci choreodystonie či dystonie u HN v našem centru používáme s dobrým efektem amantadinsulfát, který může zlepšit i posturální instabilitu. Obvykle stoupáme pomalu až do dávky 400–500mg denně, rozděleně do ranní a polední dávky. U osob s těžkým kognitivním deficitem či psychotickými projevy však můžeme amantadinem indukovat delirium či psychotický stav, u mužů s hypertrofií prostaty občas také retenci moči.
b) Akineze, rigidita
Při primární Westphalově variantě HN se objevuje akineze a rigidita, někdy s příměsí dystonie. Zde lze alespoň částečně hybný stav zlepšit pomocí levodopa (pomalu zvyšovat až do maximální dávky cca 1 000mg/den), můžeme však indukovat choreatické dyskineze či psychotický stav. Často opět užitečný bývá i amantadin. S agonisty dopaminu v této indikaci nemáme zkušenosti.
c) Porucha chůze a posturální instabilita
Typická antipsychotika obecně tyto projevy zhoršují. Naše zkušenost ale je, že malé dávky atypických antipsychotik, např. risperidonu, mohou přechodně stabilitu a chůzi zlepšit. Výrazné zlepšení stability chůze pozorujeme občas po nasazení amantadinu.
V posledních letech se objevují publikace, které dokazují, že i přes progresivní a fatální průběh HN mohou nemocní profitovat z nácviku aktivit všedního dne. Doporučuje se začít s nácvikem kompenzačních strategií ve stadiích, kdy je pacient ještě schopen se je dobře naučit tak, aby tyto naučené schopnosti mohl co nejdéle využívat v pokročilých stadiích. Práce se soustředí na poruchy stability, chůze a prevence pádů [107,108]. Naše zkušenosti jsou zatím spíše kazuistického rázu.
d) Porucha kontroly volních pohybů
Porucha koordinace a funkčnosti cílených pohybů je snad nejzávažnějším motorickým projevem HN, i když bývá v lékařském hodnocení velmi často opomíjena – skrývá se za více nápadné dyskinetické poruchy hybnosti, především však ona invalidizuje své nositele. Nejenže neexistují klinické studie, bohužel nemáme k dispozici ani žádné empiricky ověřené úspěšné terapeutické postupy. Teprve v posledních letech se objevují specifické fyzioterapeutické metodiky snažící se oddálit nástup invalidizace a zlepšit stávající schopnosti nemocných [107,108]. Objevují se také první práce mapující možnosti logopedie, tréninku polykání, ergoterapie atd.
e) Epileptické paroxyzmy
Objevují se především u dětí a adolescentů trpících HN. Léčba se nijak neliší od běžných postupů v epileptologii, léky první volby bývají valproát či lamotrigin v běžných terapeutických dávkách.
Terapie psychiatrických poruch
a) Změny osobnosti a poruchy chování
Jejich terapie bývá obtížná a vzhledem k časté velmi špatné compliance nemocných (spolu s obvyklou ztrátou náhledu na své chování) zejména psychoterapeutické snahy selhávají.
Velmi naléhavým problémem je především iritabilita a agresivita. Ve farmakoterapii pro akutní zklidnění využíváme benzodiazepiny a poté především atypická antipsychotika (risperidon, olanzapin, quetiapin) či využíváme efektu vyšší dávky již nasazených základních antipsychotik pro dyskinetický syndrom. Užitečné preparáty v prevenci iritability jsou podle naší zkušenosti také valproát (do 1 000mg/den), sertralin (do 150mg/den) či jiná antidepresiva typu SSRI. V případě závažné hypersexuality či dokonce sexuální agresivity je možné přistoupit k podávání antiadrogenních preparátů (medroxyprogesteron).
Projevy apatie a abulie jsou špatně terapeuticky ovlivnitelné. Máme málo zkušeností v léčbě apatie, nicméně ani s antidepresivy, s metylfenidátem ani s modafinilem jsme neučinili příznivé zkušeností.
U mnoha změn osobnosti a poruch chování však neexistuje účinná farmakoterapie. Hlavní význam tkví v těsné spolupráci odborného týmu s rodinou. Velkou pozornost je nutné věnovat edukaci, zacvičení a samozřejmě i podpoře pečovatelů.
b) Úzkostné projevy
Léčebně lze použít po přechodnou dobu krátkodobě působící benzodiazepiny, na delší, udržovací léčbu jsou vhodná antidepresiva typu SSRI.
c) Afektivní poruchy
V léčbě deprese u HN chybí jakékoliv dvojitě zaslepené kontrolované studie. V časných stadiích nemoci, kdy není ještě přítomen výraznější deficit kognitivních schopností, je vhodná podpůrná psychoterapie a edukace pacientů. V současnosti používáme jako antidepresiva první volby SSRI. Pokud je přítomna insomnie, máme příznivé zkušenosti s mirtazapinem, a protože mnoho nemocných s HN progresivně hubne, lze využít i vedlejší účinky mirtazapinu – zvýšené chutí k jídlu a přibývání na hmotnosti. Při dominující apatii a stavech se sníženou energií a aktivitou lze občas pozorovat příznivý efekt bupropionu. Pokud jsou přítomny u pacienta známky bipolární afektivní poruchy, indikujeme tymoprofylaktickou léčbu. Nedoporučuje se však podávat litium (riziko intoxikace při časté dehydrataci nemocných) a za vhodnější je považováno užití valproátu či lamotriginu.
V situacích, kdy je depresivní porucha doprovázena psychotickými stavy, jsou doporučovány v akutním stadiu kombinace antidepresiv a nízkých dávek atypických antipsychotik (např. olanzapinu, quetiapinu), event. v rezistentních případech lze využít i elektrokonvulzivní terapii.
U nemocných trpících HN můžeme pozorovat výrazný terapeutický efekt, ale také častější výskyt vedlejších příznaků terapie (zejména agitace, akatízie a deliriózní stavy). Jako iniciální dávku antidepresiva je proto vhodné použít polovinu doporučené běžné denní dávky.
d) Psychotická symptomatika
Psychotické stavy jsou indikací k okamžitému zahájení terapie, tedy podávání antipsychotik. Léčbou volby jsou opět atypická antipsychotika (risperidon, quetiapin, olanzapin). Kombinaci více antipsychotik se vyhýbáme.
e) Obsedantně‑kompulzivní porucha
V terapii je dosahováno dobrého efektu klomipraminem či antidepresivy typu SSRI, relativně nejlepší zkušenosti máme se sertralinem či paroxetinem. Lze zkusit i kombinaci s malou dávkou olanzapinu. Těžké obsedantně‑kompulzivní projevy u některých našich pacientů ale vzdorují všem léčebným snahám.
f) Izolované kognitivní deficity a demence
V současné době nejsou k dispozici účinné terapeutické postupy, jež dávají naději zpomalit či zastavit progresivní ztrátu kognitivních schopností. Podpůrná psychoterapie, aktivizace nemocných např. formou ergoterapie, kognitivní trénink a sociální podpora pomáhá udržet déle komunikaci a běžné denní aktivity pacienta. Kognitiva bohužel nepomáhají [109].
Změny celkového stavu
Váhový úbytek u HN
Nemocný s HN, který hubne, vyžaduje cca dvojnásobek běžného kalorického příjmu zdravé osoby (4–5000 kcal/den). Proto je nutné již při prvním kontaktu s pacientem sledovat rizikové faktory malnutrice (tab. 4) [106]. Při poklesu tělesné hmotnosti musíme zjistit její skutečnou příčinu (nechutenství, dysfagie, nevhodný jídelníček a stravovací návyky, neurologické, kognitivní a behaviorální poruchy, jiné komorbidity, nežádoucí účinky medikace, sociální a ekonomický status). V rozpoznání malnutrice a její etiologie mohou napomoci laboratorní vyšetření (např. snížené hodnoty především celkové bílkoviny, albuminu, prealbuminu, cholinesterázy či transferinu).
![Klinicky významné ukazatele rizika rozvoje malnutrice [106].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/430aa9562c9a55ec8986f2c0d28997bb.png)
Pacienti i pečovatelé musí být informováni o zásadách stravování při dysfagii: příprava jídla na malé kousky, správná konzistence (nejlépe se polyká hustota jogurtu, zapíjení soust, event. zahuštění tekutin, např. pomocí přípravků z kukuřičného škrobu /Nutilis/, vzpřímený sed při jídle atd.) a první pomoci při dušení. Velký význam má také kvalitní stomatologická a dentální péče. Na diagnostice a terapii dysfagie by se měl podílet logoped – specialista, který rozhodne o event. dalších vyšetřeních (rtg plic, polykací akt, videofluoroskopie). Kvalitní informace o logopedii a dysfagii u HN jsou dostupné např. na internetové adrese www.huntington.cz.
Při včasném záchytu váhového úbytku může pomoci edukace pacienta a pečovatelů. Pokud to nestačí, je indikována doplňková perorální výživa (tzv. sipping – upíjení vysokoenergetických přípravků). V případě neúspěchu pacient je převeden na plnou enterální výživu. U nemocných se závažnou dysfagií nebo nemožným nedostatečným perorálním příjmem krátkodobě může být zavedena nazogastrická sonda a při dlouhodobých obtížích perkutánní gastrostomie (PEG). Z naší zkušenosti je zřetelné, že správná a včasná indikace nutriční podpory včetně PEG vede ke zlepšení kvality života v pozdních stadiích HN.
Pacient s HN se však dostává do péče klinických nutricionistů (pokud vůbec) příliš pozdě. Ti zajišťují umělou výživu a preskripci (jejich seznam lze najít na www.skvimp.cz). Váhový přírůstek může být také potencován vedlejšími účinky symptomatické terapie HN (zejména mirtazapin, valproát a antipsychotika).
Terminální stavy
Přístup k nemocným v terminálních stadiích HN je definován zásadami humánního přístupu, snahou o důstojnost a zmírňování utrpení. Tlumení bolestí, dostatečná hydratace a výživa, prevence dekubitů a aspirace, umožnění kontaktu s rodinou jsou teoreticky samozřejmostí, obvyklá praxe v ČR je však frustrující. V současnosti se v některých, především anglických centrech klade velký důraz na informovanost nemocných již v časných stadiích o problémech pozdních fází nemoci, aby měli možnost aktivně se rozhodnout o použití např. PEG či pro podávání antibiotik v terminálních stavech atd. [110].
Hledání experimentální a (semi)kauzální léčby
Jak již bylo řečeno, současné možnosti terapie HN jsou čistě symptomatické a neexistuje žádný postup umožňující zpomalit, zastavit či dokonce zvrátit vývoj chorobných změn.
Současný výzkum se soustřeďuje na ovlivnění celé řady faktorů hrajících roli v procesu neurodegenerace, především v procesech tvorby abnormního proteinu, jeho agregace a poruchy eliminace (chaperony, systém kaspáz, ubikvitin‑proteazomový systém, transkripční faktory).
Některé studie jsou zaměřeny na možnost přímého ovlivnění exprese huntingtinu pomocí tzv. antisense nukleotidů či techniky siRNA. Jiné studie zkoumají preparáty ovlivňující agregaci proteinů a funkci chaperonů – např. trehalóza, geldanamycin či rapamycin. Zkouší se také cystamin, který inhibuje transglutaminázy (součást mechanizmů agregace), a látky regulující transkripci, např. mitramycin, jenž inhibuje histon deacetylázu. Naděje se vkládají i do terapie pomocí neurotrofních faktorů, především BDNF – gen pro jejich tvorbu je možné dopravit např. lentivirovým vektorem do mozku. V současnosti je také zkoumán efekt sertralinu, antidepresiva, které zvyšuje expresi BDNF v mozku. Zkoumány jsou i látky s antiapoptotickým efektem, např. minocyklin.
V minulých letech se vkládaly naděje do přípravků ovlivňujících mitochondriální funkce (kreatin, koenzym Q10 a remacemid), v klinických studiích však tyto látky neprokázaly žádný efekt.
Nadějným směrem u HN jsou striatální transplantace, které v současnosti probíhají v Evropě, a výzkum kmenových buněk. Podrobnější diskuze na téma experimentálních terapeutických snah není na tomto místě možná, zdroje informací např. viz přehledné články Rosse a Shoulsona [111], Wrighta a Barkera [112] či Dunnetta a Rosserové [113].
Huntingtonova nemoc je onemocnění celé rodiny
HN znamená vždy ohrožení celé rodiny, která je konfrontována s touto devastující chorobou a genetickým rizikem řady příslušníků. Partner nemocného HN řeší celou řadu problémů: nižší socioekonomický status, ztrátu volného času, ztrátu bezpečného zázemí, roli pečovatele zabírající prakticky veškerý čas atd. Dalšími závažnými problémy jsou riziko přenosu HN na potomky (pocity viny za přenos mutace, neschopnost sdělit dětem jejich ohrožení atd.) a vlastní charakter příznaků nemoci, který obvykle závažným způsobem narušuje psychiku partnera. Nemocní mění své chování a osobnost, někdy se dopouštějí násilí na partnerech (chorobná žárlivost, sexuálně motivované násilnické jednání) či na dětech. Děti v rodinách s HN navíc velmi obtížně chápou vzniklou situaci se všemi následky (proč je rodič agresivní, chová se jinak atd.). Důsledky takových dlouhodobých problémů pro vývoj dětí nelze generalizovat, znamenají však jistě dopad na fungování celé rodiny.
U většiny partnerů v průběhu společného života s nemocnou osobou pod vlivem dlouhodobé stresové situace dochází k rozvoji těžké deprese, úzkostných stavů až panických poruch, negativistickému chování, k výbuchům agresivity vůči nemocnému atd. [114]. Téma HN v rodině je často tabu a nesmí se o něm hovořit na veřejnosti ani uvnitř širší rodiny. Partneři, stejně jako osoby v riziku, popisují svůj stav jako „permanentní smutek“. Často je nutné i u nich léčebně zasáhnout.
Právě z těchto důvodů vznikají svépomocné podpůrné organizace na celém světě (např. Mezinárodní huntingtonská asociace – International Huntington Association). U nás existuje od roku 1991 Společnost pro pomoc při Huntingtonově chorobě. Jako hlavní cíle si klade všestrannou podporu a pomoc pacientům a jejich rodinám, zlepšení informovanosti rodin, odborníků a veřejnosti, zlepšení péče o pacienty a rodiny a vybudování potřebných služeb.
Závěrem je nutné upozornit na existenci mezinárodních výzkumných organizací zabývajících se specificky problematikou HN. V USA to je Huntington Study Group a v Evropě před několika lety vznikla European Huntington’s Disease Network, jejíž součástí je i Česká republika. Mezinárodní, multicentrický výzkum umožní v budoucích letech nepochybně získat významné etiopatogenetické a terapeutické poznatky, které povedou k odnětí „rodinného prokletí“ HN.
Poděkování
MUDr. Janě Židovské, CSc., MUDr. Tereze Uhrové a MUDr. Jiřímu Klempířovi, Ph.D., za inspiraci, kritické připomínky a energii ve společné klinické a výzkumné práci na téma Huntingtonovy nemoci
Podpořeno výzkumným záměrem MŠM 0021620849
Poznámka
Některé části textu jsou převzaty či jsou modifikovány z předchozích publikací autora na téma Huntingtonovy nemoci
Přijato k recenzi: 15. 2. 2010
Přijato do tisku: 26. 3. 2010
doc. MUDr Jan Roth, CSc.
Univerzita Karlova, Neurologická klinika 1. LF UK a VFN Praha
Kateřinská 30
120 00 Praha 2
e-mail: jan1roth2@gmail.com
Recenzenti:
prof. MUDr. Evžen Růžička, DrSc.
MUDr. Jana Židovská, CSc.
MUDr. Jiří Klempíř, Ph.D.
doc. MUDr. Jan Roth, CSc.
Docent Jan Roth se narodil v roce 1961. Studium na Fakultě všeobecného lékařství UK v Praze dokončil v roce 1986. Od té doby pracuje na Hennerově neurologické klinice 1. LF UK v Praze. V roce 1994 obhájil kandidátskou práci „Ně kte ré soudobé směry klinického výzkumu Parkinsonovy nemoci“, v roce 2001 byl po obhájení habilitační práce „Huntingtonova a Parkinsonova nemoc – klinické modely postižení bazálních ganglií“ jmenován docentem neurologie. V minulosti se mimo klinické práce a klinického výzkumu v oblasti extrapyramidových onemocnění věnoval také problematice výpočetní tomografie mozku a míchy. Je spoluzakladatelem Centra extrapyramidových onemocnění na Hennerově neurologické klinice, které v současné době vede. Podílel se na celé řadě výzkumných prací, projektů a grantů, z nichž mnohé získaly oficiální významná ocenění. Je autorem či spoluautorem 6 monografií, 15 kapitol v monografiích, 7 kapitol v učebnicích, dále je autorem či spoluautorem 62 původních článků (z toho 39 s IF) a 60 přehledových článků. V současnosti se intenzivně zabývá především problematikou Huntingtonovy nemoci, a to jak v samostatné klinické práci a výzkumu, tak v rámci evropské výzkumné organizace European Huntington’s Disease Network, kde byl v letech 2006 – 2009 členem jejího výkonného výboru.
Vědomostní test
1. Choreatické dyskineze:
- a) jsou charakteristické nutkáním provést pohyb
- b) jsou mimovolní, nepravidelné rychlé pohyby v náhodné distribuci
- c) se objevují výlučně při polékových syndromech
- d) mají prakticky vždy hereditární podklad
2. Huntingtonova nemoc je charakteristická:
- a) genetickým přenosem vázaným na mužské pohlaví
- b) 50% rizikem přenosu na potomky bez rozdílu pohlaví
- c) obvyklou klinickou manifestací před 20. rokem věku
- d) 25% rizikem přenosu – jedná se o autozomálně dominantní dědičnost
3. Genetický presymptomatický test:
- a) se provádí u všech osob v riziku
- b) se provádí u všech plnoletých osob v riziku
- c) lze provést u plnoletých osob v riziku, které si přejí znát svůj genetický stav
- d) umožňuje přesnou predikci počátku klinických příznaků u osoby v riziku
4. Huntingtonova nemoc:
- a) je nejčastější příčinou choreatických dyskinezí v České republice
- b) její prevalence je cca 1 : 10–15 000 obyvatel
- c) její prevalence je cca 1 : 100–150 000 obyvatel
- d) se v České republice vyskytuje zcela raritně
5. Pro Huntingtonovu nemoc je charakteristická:
- a) přítomnost parkinsonského syndromu při manifestaci ve stáří
- b) kombinace hybného, kognitivního postižení s těžší vegetativní dysfunkcí
- c) přítomnost výrazných choreatických dyskinezí při manifestaci v dětství
- d) kombinace hybného, kognitivního postižení, společně s poruchami chování
6. Počátek Huntingtonovy nemoc v dětském věku:
- a) se častěji objevuje u dětí, kde postiženým rodičem byl otec
- b) se obvykle objevuje u dětí, kde postiženým rodičem byla matka
- c) je vždy způsoben novou mutací v doposud zdravé rodině
- d) je spojen s lepší prognózou než u osob, kde nemoc začala v dospělosti
7. Časnou neuropatologickou změnou u Huntingtonovy nemoci:
- a) jsou změny v prefrontálních kortikálních oblastech
- b) jsou změny středně velkých ostnitých GABAergních neuronů striata
- c) jsou změny v GABAergních neuronech hipokampu
- d) jsou změny v interneuronech striata
8. Mutace Huntingtonovy nemoci je způsobena:
- a) expanzí CCG tripletu v genu IT 15 nad 40 repetic
- b) expanzí huntingtinu nad 40 CAG repetic
- c) expanzí CAG tripletu v genu IT 15 na 40 a více repeticí
- d) expanzí CAG tripletů v molekule huntingtinu
9. Huntingtin:
- a) je protein, jehož polyglutaminová sekvence je prodloužena v přímé úměře ke zmnožení CAG tripletů v mutaci
- b) je protein bez přímé vazby k patogenezi Huntingtonovy nemoci
- c) je pro striatum základním stavebním strukturálním proteinem a v jiných buňkách lidského těla se neobjevuje
- d) je kofaktorem glutamátdehydrogenázy, a proto při jeho změnách dochází v mozku k nedostatku GABA
10. Dystonické dyskineze jsou:
- a) mimovolní, nepravidelné rychlé pohyby v náhodné distribuci
- b) přetrvávající svalové stahy působící kroucení a opakované pohyby nebo abnormální postavení postižených částí těla
- c) prudké a rychlé svalové záškuby
- d) mimovolní pohyby výlučně vázané na pohybovou aktivitu, v klidu se neobjevují
11. Expanze na 40 a více CAG tripletů v genu IT 15 zjištěná molekulárně genetickým testem:
- a) znamená potvrzení diagnózy pouze u osoby s klinickými projevy onemocnění
- b) nepřináší riziko Huntingtonovy nemoci, riziková hranice je nad 45 CAG tripletů
- c) neznamená ohrožení Huntingtonovou nemocí, pokud je osoba starší 65 let
- d) v nepřítomnosti klinických příznaků u testované osoby nepřináší riziko zdědění vlohy pro potomky
12. K tlumení choreatických dyskinezí:
- a) lze použít atypická i typická antipsychotika
- b) jsou benzodiazepiny neúčinné
- c) je velmi účinný valproát
- d) je výhodné použít sertralin
13. Iritabilita:
- a) je častým projevem Huntingtonovy nemoci a lze ji úspěšně tlumit pomocí SSRI či valproátu
- b) se u Huntingtonovy nemoci vyskytuje pouze ojediněle
- c) se vyskytuje pouze v pozdních stadiích Huntingtonovy nemoci
- d) je častým příznakem Huntingtonovy nemoci a bohužel obvykle vzdoruje všem léčebným snahám
14. Epileptické záchvaty:
- a) se u Huntingtonovy nemoci nevyskytují
- b) vyskytují se především u juvenilní formy Huntingtonovy nemoci
- c) mají výlučně myoklonický ráz
- d) vyskytují se jen v pozdních stadiích Huntingtonovy nemoci
15. Nootropika:
- a) mají v terapii Huntingtonovy nemoci své místo, účinkují dobře např. u projevů apatie i u jiných symptomů
- b) nejsou u Huntingtonovy nemoci indikována, na apatii ani na demenci neúčinkují a navíc mohou horšit iritabilitu a agresivitu
- c) mají dobrý efekt v incipientních stadiích demence
- d) mohou zpomalit rozvoj Huntingtonovy nemoci
16. Problémy s výživou u Huntingtonovy nemoci:
- a) jsou bezvýznamnou součástí projevů choroby
- b) jsou častým a závažným problémem, vedou k těžké kachektizaci
- c) vyskytují se pouze u nemocných s těžkou dysfagií
- d) jsou obvykle přítomny jen u osob v pozdních fázích nemoci, kdy nemocní nejsou schopni si připravit pokrmy a sami potravu přijímat
17. Tzv. huntingtonské fenokopie:
- a) jsou choroby, u kterých se při genetickém testu najde zmnožení CAG tripletů, ale nejsou přítomny klasické klinické projevy Huntingtonovy nemoci
- b) jsou všechny tzv. tripletové choroby
- c) jsou ty choroby, které se projevují klasickými klinickými projevy, jako Huntingtonova nemoc, ale mutace podmiňující Huntingtonovu nemoc je u nich nepřítomna
- d) jsou veškeré patologické stavy, u kterých se objevují choreatické dyskineze
18. Protokol pro prediktivní genetický test:
- a) je minimálního rozsahu a slouží především k statistickým účelům
- b) zvýšil počet sebevražd a dalších katastrofických dopadů
- c) skládá se z konzultace genetika, neurologa, psychologa a psychiatra a slouží především k snížení pravděpodobnosti katastrofických dopadů testování na pozitivně testovanou osobu v riziku
- d) se dodržuje pouze ve velkých výzkumných centrech, pro běžnou diagnostiku není ani závazný ani doporučený
19. Těžká akineze a rigidita:
- a) není nikdy projevem Huntingtonovy nemoci
- b) se vyskytuje především u juvenilní formy nemoci
- c) vyskytuje se v pozdních stadiích klasické formy Huntingtonovy nemoci a velmi účinné jsou v těchto případech agonisté dopaminu
- d) u Huntingtonovy nemoci vždy vzniká v souvislosti s množstvím podávaných typických i atypických antipsychotik
20. Atrofie caput nuclei cuadati:
- a) je patrna na zobrazovacích metodách až v pozdních stadiích nemoci
- b) je výrazná a detekovatelná ve výpočetní tomografii mozku již v časných stadiích nemoci
- c) lze detekovat pouze v magnetické rezonanci, výpočetní tomografie není dostatečně citlivá
- d) nepatří k neuropatologickým projevům Huntingtonovy nemoci
Zdroje
1. Huntington G. On chorea. Med Surg Rep 1872; 26 : 317–321.
2. Harper PS. Huntington’s disease: a historical background. In: Bates G, Harper PS, Jones L (eds). Huntington’s Disease. 3rd ed. Oxford: Oxford University Press 2002 : 3–27.
3. Harper PS. The epidemiology of Huntington’s disease. Hum Genet 1992; 89(4): 365–376.
4. Kremer B, Goldberg P, Andrew SE, Theilmann J, Telenius H, Zeisler Jutta et al. A worldwide study of the Huntington’s disease mutation. N Engl J Med 1994; 330(20): 1401–1406.
5. Al‑Jader LN, Harper PS, Krawczak M, Palmer SR. The frequency of inherited disorders database: prevalence of Huntington disease. Community Genet 2001; 4(3): 148–157.
6. Walker DA, Harper PS, Wells CEC, Tyler A, Davies K, Newcombe RG. Huntington’s chorea in South Wales: a genetic and epidemiological study. Clin Genet 1981; 19(4): 213–221.
7. Quarrell OW, Tyler A, Jones MP, Nordin M, Harper PS. Population studies of Huntington disease in Wales. Clin Genet 1988; 33(3): 189–195.
8. Folstein SE, Chase GA, Wahl WE, McDonnell AM, Folstein MF. Huntington’s disease in Maryland: clinical aspects of racial variation. Am J Hum Genet 1987; 41(2): 168–179.
9. Penney JB jr, Young AB, Shoulson I, Starosta‑Rubenstein S, Snodgrass SR, Sanchez‑Ramos J et al. Huntington’s disease in Venezuela: 7 years of follow‑up on symptomatic and asymptomatic individuals. Mov Disord 1990; 5(2): 93–99.
10. Perry TL, Hansen S, Kloster M. Huntington’s chorea. Deficiency of gamma‑aminobutyric acid in brain. New Engl J Med 1973; 288(7): 337–342.
11. Spokes EG. Neurochemical alterations in Huntington’s chorea: a study of post‑mortem brain tissue. Brain 1980; 103(1): 179–210.
12. Vonsattel JP, Myers RH, Stevens TJ, Ferrante RJ, Bird ED, Richardson EP jr. Neuropathological classification of Huntington’s disease. J Neuropathol Exp Neurol 1985; 44(6): 559–577.
13. Roth J, Klempir J, Jech R, Zidovská J, Uhrová T, Doubek P et al. Caudate nucleus atrophy in Huntington’s disease and its relationship with clinical and genetic parameters. Funct Neurol 2005; 20(3): 127–130.
14. Aylward EH, Codori AM, Rosenblatt A, Sherr M, Brandt J, Stine OC et al. Rate of caudate atrophy in presymptomatic and symptomatic stages of Huntington’s disease. Mov Disord 2000; 15(3): 552–560.
15. Jech R, Klempír J, Vymazal J, Zidovská J, Klempírová O, Růzicka E et al. Variation of selective gray and white matter atrophy in Huntington’s disease. Mov Disord 2007; 22(2): 1783–1789.
16. de la Monte SM, Vonsattel JP, Richardson EP jr. Morphometric demonstration of atrophic changes in the cerebral cortex, white matter, and neostriatum in Huntington’s disease. J Neuropathol Exp Neurol 1988; 47(5): 516–525.
17. Myers RH, Vonsattel JP, Stevens TJ, Cupples LA, Richardson EP, Martin JB et al. Clinical and neuropathologic assessment of severity in Huntington’s disease. Neurology 1988; 38(3): 341–347.
18. Rosas HD, Salat DH, Lee SY, Zaleta AK, Pappu V, Fischl B et al. Cerebral cortex and the clinical expression of Huntington’s disease: complexity and heterogeneity. Brain 2008; 131(4): 1057–1068.
19. The Huntington’s Disease Colaborative Research Group. A novel gene containing a trinucleotide repeat that is expanded and unstable on Huntington’s disease chromosomes. Cell 1993; 72(6): 971–983.
20. DiFiglia M, Sapp E, Chase K, Schwarz C, Meloni A,Young C et al. Huntingtin is a cytoplasmic protein associated with vesicles in human and rat brain neurons. Neuron 1995; 14(5): 1075–1081.
21. Sapp E, Schwarz C, Chase K, Bhide PG, Young AB, Penney J et al. Huntingtin localization in brains of normal and Huntington’s disease patients. Ann Neurol 1997; 42(4): 604–612.
22. Borrell‑Pagès M, Zala D, Humbert S, Saudou F. Huntington’s disease: from huntingtin function and dysfunction to therapeutic strategies. Cell Mol Life Sci 2006; 63(22): 2642–2660.
23. Zuccato C, Cattaneo E. Brain‑derived neurotrophic factor in neurodegenerative diseases. Nat Rev Neurol 2009; 5(6): 311–322.
24. Zeitlin S, Liu JP, Chapman DL, Papaioannou VE, Efstratiadis A. Increased apoptosis and early embryonic lethality in mice nullizygous for the Huntington’s disease gene homologue. Nat Genet 1995; 11(2): 155–163.
25. Harjes P, Wanker EE. The hunt for huntingtin function: interaction partners tell many different stories. Trends Biochem Sci 2003; 28(8): 425–433.
26. Roth J. Neurodegenerace: jeden mechanismus pro mnoho chorob? Lékařské listy 2009; 7 : 17–18.
27. Gil JM, Rego AC. Mechanisms of neurodegeneration in Huntington’s disease. Eur J Neurosci 2008; 27(11): 2803–2820.
28. Petrucelli L, Dawson TM. Mechanism of neurodegenerative disease: role of the ubiquitin proteasome system. Ann Med 2004; 36(4): 315–320.
29. Lehman NL. The ubiquitin proteasome system in neuropathology. Acta Neuropathol 2009; 118(3): 329–347.
30. Ravikumar B, Duden R, Rubinsztein DC. Aggregate‑prone proteins with polyglutamine and polyalanine expansions are dehraded by autophagy. Hum Mol Genet 2002; 11(9): 1107–1117.
31. Saudou F, Finkbeiner S, Devys D, Greenberg ME. Huntingtin acts in the nucleus to induce apoptosis but death does not correlate with the formation of intranuclear inclusions. Cell 1998; 95(1): 55–66.
32. Andrew SE, Goldberg YP, Kremer B, Telenius H, Theilmann J, Adam S et al. The relationship between trinucleotide (CAG) repeat length and clinical features of Huntington’s disease. Nat Genet 1993; 4(4): 398–403.
33. Snell RG, MacMillan JC, Cheadle JP, Fenton I, Lazarou LP, Davies P et al. Relationship between trinucleotide repeat expansion and phenotypic variation in Huntington’s disease. Nat Genet 1993; 4(4): 393–397.
34. Rubinsztein DC, Leggo J, Coles R, Almquist E, Biancalana V, Cassiman JJ et al. Phenotypic characterization of individuals with 30–40 CAG repeats in the Huntington’s disease (HD) gene reveals HD cases with 36 repeats and apparently normal elderly individuals with 36–39 repeats. Am J Hum Genet 1996; 59(1): 16–22.
35. Bates GP, Benn C. The polyglutamine diseases. In: Huntington’s Disease. Bates G, Harper PS, Jones L (eds). Oxford: Oxford University Press 2002 : 430–472.
36. Semaka A, Collins JA, Hayden MR. Unstable familial transmissions of Huntington disease alleles with 27–35 CAG repeats (intermediate alleles). Am J Med Genet B Neuropsychiatr Genet 2010; 153B(1): 314–320.
37. Kovtun IV, Welch G, Guthrie HD, Hafner KL, McMurray CT. CAG repeat lengths in X ‑ and Y‑bearing sperm indicate that gender bias during transmission of Huntington’s disease gene is determined in the embryo. J Biol Chem 2004; 279(10): 9389–9391.
38. Telenius H, Kremer B, Goldberg YP, Theilmann J,Andrew SE, Zeisler J et al. Somatic and gonadal mosaicism of the Huntington disease gene CAG repeat in brain and sperm. Nat Genet 1994; 6(4): 409–414.
39. Leeflang EP, Zhang L, Tavaré S, Hubert R, Srinidhi J, MacDonald ME et al. Single sperm analysis of the trinucleotide repeats in the Huntington’s disease gene: quantification of the mutation frequency spectrum. Hum Mol Genet 1995; 4(9): 1519–1526.
40. MacMillan JC, Snell RG, Tyler A, Houlihan GD, Fenton I, Cheadle JP et al. Molecular analysis and clinical correlations of the Huntington’sdisease mutation. Lancet 1993; 342(8877): 954–958.
41. Duyao M, Ambrose C, Myers R, Novelletto A, Persichetti F, Frontali M et al. Trinucleotide repeat length instability and age of onset in Huntington’s disease. Nat Genet 1993; 4(4): 387–392.
42. Wexler NS, Lorimer J, Porter J, Gomez F, Moskowitz C, Shackell E et al. Venezuelan kindreds reveal that genetic and environmental factors modulate Huntington’sdisease age of onset. Proc Natl Acad Sci U S A 2004; 101(10): 3498–3503.
43. Metzger S, Bauer P, Tomiuk J, Laccone F, Didonato S, Gellera C et al. Genetic analysis of candidate genes modifying the age‑at‑onset in Huntington’s disease. Hum Genet 2006; 120(2): 285–292.
44. Wexler NS, Young AB, Tanzi RE, Travers H, Starosta‑Rubinstein S, Penney JB et al. Homozygotes for Huntington’s disease. Nature 1987; 326(6109): 194–197.
45. Squitieri F, Gellera C, Cannella M, Mariotti C, Cislaghi G, Rubinsztein DC et al. Homozygosity for CAG mutation in Huntington disease is associated with a more severe clinical course. Brain 2003; 126(4): 946–955.
46. Trottier Y, Biancalana V, Mandel JL. Instability of CAG repeats in Huntington’sdisease: relation to parental transmission and age of onset. J Med Genet 1994; 31(5): 377–382.
47. Kremer B, Almqvist E, Theilmann J, Spence N, Telenius H, Goldberg YP et al. Sex‑dependent mechanisms for expansions and contractions of the CAG repeat on affected Huntington disease chromosomes. Am J Hum Genet 1995; 57(2): 343–350.
48. Wheeler VC, Persichetti F, McNeil SM, Mysore JS, Mysore SS, MacDonald ME et al. Factors associated with HD CAG repeat instability in Huntington disease. J Med Genet 2007; 44(11): 695–701.
49. Gonitel R, Moffitt H, Sathasivam K, Woodman B, Detloff PJ, Faull RL et al. DNA instability in postmitotic neurons. Proc Natl Acad Sci U S A 2008; 105(9): 3467–3472.
50. Ishiguro H, Yamada K, Sawada H, Nishii K, Ichino N,Sawada M et al. Age‑dependent and tissue‑specific CAG repeat instability occurs in mouse knock‑in for a mutant Huntington’s disease gene. J Neurosci Res 2001; 65(4): 289–297.
51. Shelbourne PF, Keller‑McGandy C, Bi WL, Yoon SR, Dubeau L, Veitch NJ et al. Triplet repeat mutation length gains correlate with cell‑type specific vulnerability in Huntington disease brain. Hum Mol Genet 2007; 16(10): 1133–1142.
52. Alexander GE, DeLong MR, Strick PL. Parallel organization of functionally segregated circuits linking basal ganglia and cortex. Annu Rev Neurosci 1986; 9 : 357–381.
53. Flaherty AW, Graybiel AM. Anatomy of the basal ganglia. In: Marsden CD, Fahn S (eds). Movement Disorders 3. Oxford: Butterworth‑Heinemann 1994 : 3–27.
54. Albin RL, Young AB, Penney JB. The functional anatomy of basal ganglia. Trends Neurosci 1989; 12(10): 366–375.
55. Alexander GE, Crutcher MD. Functional architecture of basal ganglia circuits: neuronal substrates of parallel processing. Trend Neurosci 1990; 13(7): 266–271.
56. Cummings JL. Frontal‑subcortical circuits and human behavior. Arch Neurol 1993; 50(8): 873–880.
57. Bonelli RM, Cummings JL. Frontal‑subcortical dementias. Neurologist 2008; 14(2): 100–107.
58. Tekin S, Cummings JL. Frontal‑subcortical neuronal circuits and clinical neuropsychiatry: an update. J Psychosom Res 2002; 53(2): 647–654.
59. Graybiel AM. Neurotransmitters and neuromodulators in the basal ganglia. Trends Neurosci 1990; 13(7): 244–254.
60. Tibben A. Predictive testing for Huntington’s disease. Brain Res Bull 2007; 72(2–3): 165–171.
61. International Huntington Association (IHA) and the World Federation of Neurology (WFN) Research Group on Huntington’s Chorea. Guidelines for the molecular genetics predictive test in Huntington’s disease. Neurology 1994; 44(8): 1533–1536.
62. Timman R, Roos R, Maat‑Kievit A, Tibben A. Adverse effects of predictive testing for Huntington disease underestimated: long‑term effects 7–10 years after the test. Health Psychol 2004; 23(2): 189–197.
63. Langbehn DR, Hayden MR, Paulsen JS; PREDICT‑HD Investigators of the Huntington Study Group. CAG‑repeat length and the age of onset in Huntington disease (HD): a review and validation study of statistical approaches. Am J Med Genet B Neuropsychiatr Genet 2010; 153B(2): 397–408.
64. Židovská J, Růžičková Š, Vojtíšková M, Havrdová E, Roth J, Kapras J. DNA analýza genu Huntingtonovy choroby v české populaci. Psychiatrie 1998; 2 : 70–73.
65. Židovská J, Klempíř J, Kebrdlová V, Uhrová T, Koblihová J, Anders M et al. Huntingtonova nemoc: zkušenosti s genetickým testováním v letech 1994–2005. Cesk Slov Neurol N 2007; 70/103(1): 72–77.
66. Wild EJ, Tabrizi SJ. Huntington’s disease phenocopy syndromes. Curr Opin Neurol 2007; 20(6): 681–687.
67. Kucharík M, Klempíř J, Roth J. Huntingtonské fenokopie dospělého věku. Neurologie pro praxi 2009; 10(3): 180–183.
68. Tsuji S. Dentatorubral‑pallidoluysian atrophy: clinical features and molecular genetics. Adv Neurol 1999; 79 : 399–409.
69. Burke JR, Ikeuchi T, Koide R, Tsuji S, Yamada M, Pericak‑Vance MA et al. Dentatorubral‑pallidoluysian atrophy and Haw River Syndrome. Lancet 1994; 344(8938): 1711–1712.
70. Mariotti C, Alpini D, Fancellu R, Soliveri P, Grisoli M, Ravaglia S et al. Spinocerebellar ataxia type 17 (SCA17): oculomotor phenotype and clinical characterization of 15 Italian patients. J Neurol 2007; 254(11): 1538–1546.
71. Schneider SA, van de Warrenburg BP, Hughes TD, Davis M, Sweeney M, Wood N, Quinn NP et al. Phenotypic homogeneity of the Huntington disease‑like presentation in a SCA17 family. Neurology 2006; 67(9): 1701–1703.
72. Rubio JP, Danek A, Stone C, Chalmers R, Wood N, Verellen C et al. Chorea‑acanthocytosis: genetic linkage to chromosome 9q21. Am J Hum Genet 1997; 61(4): 899–908.
73. Klempíř J, Mikulenková D, Písačka M, Klempířová O.Diferenciální diagnostika neuroakantocytóz. Cesk Slov Neurol N 2009; 72/105(1): 24–29.
74. Danek A, Rubio JP, Rampoldi L, Ho M, Dobson‑Stone C, Tison F et al. McLeod neuroacanthocytosis: genotype and phenotype. Ann Neurol 2001; 50(6): 755–764.
75. Curtis AR, Fey C, Morris CM, Bindoff LA, Ince PG, Chinnery PF et al. Mutation in the gene encoding ferritin light polypeptide causes dominant adult‑onset basal ganglia disease. Nat Genet 2001; 28(4): 350–354.
76. Crompton DE, Chinnery PF, Fey C, Curtis AR, Morris CM, Kierstan J et al. Neuroferritinopathy: a window on the role of iron in neurodegeneration. Blood Cells Mol Dis 2002; 29(3): 522–531.
77. Filla A, De Michele G, Coppola G, Federico A, Vita G,Toscano A et al. Accuracy of clinical diagnostic criteria for Friedreich’s ataxia. Mov Disord 2000; 15(6): 1255–1258.
78. Hanna MG, Davis MB, Sweeney MG, Noursadeghi M,Ellis CJ, Elliot P et al. Generalized chorea in two patients harboring the Friedreich’s ataxia gene trinucleotide repeat expansion. Mov Disord 1998; 13(2): 339–340.
79. Bhidayasiri R, Perlman SL, Pulst SM, Geschwind DH. Late‑onset Friedreich ataxia: phenotypic analysis, magnetic resonance imaging findings, and review of the literature. Arch Neurol 2005; 62(12): 1865–1869.
80. Lawrence AD, Sahakian BJ, Hodges JR, Rosser AE, Lange KW, Robbins TW. Executive and mnemonic functions in early Huntington’s disease. Brain 1996; 119(5): 1633–1645.
80. Kirkwood SC, Siemers E, Hodes ME, Conneally PM, Christian JC, Foroud T. Subtle c1anges among presymptomatic carriers of the Huntington’s disease gene. J Neurol Neurosurg Psychiatry 2000; 69(6): 773–779.
82. Sprengelmeyer R. Young AW, Calder AJ, Karnat A,Lange H, Hömberg V et al. Loss of disgust. Perception of faces and emotions in Huntington’s disease. Brain 1996; 119(5): 1647–1665.
83. Gray JM, Young AW, Barker WA, Curtis A, Gibson D.Impaired recognition of disgust in Huntington’s disease gene carriers. Brain 1997; 120(11): 2029–2038.
84. Johnson SA, Stout JC, Solomon AC, Langbehn DR, Aylward EH, Cruce CB et al. Beyond disgust: impaired recognition of negative emotions prior to diagnosis in Huntington’s disease. Brain 2007; 130(7): 1732–1744.
85. Julien CL, Thompson JC, Wild S, Yardumian P, Snowden JS, Turner G et al. Psychiatric disorders in preclinical Huntington’s disease. J Neurol Neurosurg Psychiatry 2007; 78(9): 939–943.
86. Marshall J, White K, Weaver M, Flury Wetherill L, Hui S, Stout JC et al. Specific psychiatric manifestations among preclinical Huntington disease mutation carriers. Arch Neurol 2007; 64(1): 116–121.
87. Duff K, Paulsen JS, Beglinger LJ, Langbehn DR, Stout JC; Predict‑HD Investigators of the Huntington Study Group. Psychiatric symptoms in Huntington’s disease before diagnosis: the predict‑HD study. Biol Psychiatry 2007; 62(12): 1341–1346.
88. Zimbelman JL, Paulsen JS, Mikos A, Reynolds NC, Hoffmann RG, Rao SM. fMRI detection of early neural dysfunction in preclinical Huntington’sdisease. J Int Neuropsychol Soc 2007; 13(5): 758–769.
89. Roth J, Židovská J. Chorea. In: Růžička E, Roth J,Kaňovský P (eds). Extrapyramidová onemocnění II. Dyskinetické syndromy. Praha: Galén 2002 : 71–99.
90. Di Maio L, Squitieri F, Napolitano G, Campanella G,Trofatter JA, Conneally PM. Suicide risk in Huntington’s disease. J Med Genet 1993; 30(4): 293–295.
91. Craufurd D, Thompson JC, Snowden JS. Behavioral changes in Huntington’s disease. Neuropsychiatry Neuropsychol Behav Neurol 2001; 14(4): 219–226.
92. Thompson JC, Snowden J, Craufurd D, Neary D. Behavior in Huntington’s disease: dissociating cognition‑based and mood‑based changes. J Neuropsychiatry Clin Neurosci 2002; 14(1): 37–44.
93. Paulsen JS, Ready RE, Hamilton JM, Mega MS, Cummings JL. Neuropsychiatric aspects of Huntington’s disease. J Neurol Neurosurg Psychiatry 2001; 71(3): 310–314.
94. Mendez MF. Huntington’s disease: update and review of neuropsychiatric aspects. Int J Psychiatry Med 1994; 24(3): 189–208.
95. Farrer LA. Suicide and attempted suicide in Huntington’s disease: implications for preclinical testing of persons at risk. Am J Med Genet 1986; 24(2): 305–311.
96. Marder K, Zhao H, Myers RH, Cudkowicz M, Kayson E, Kieburtz K et al. Rate of functional decline in Huntington’s disease. Huntington Study Group. Neurology 2000; 54(2): 452–458.
97. Beglinger LJ, Langbehn DR, Duff K, Stierman L, Black DW, Nehl C et al. Probability of obsessive and compulsive symptoms in Huntington’s disease. Biol Psychiatry 2007; 61(3): 415–418.
98. Jensen P, Fenger K, Bolwig T, Sørensen SA. Crime in Huntington’s disease: a study of registered offences among patients, relatives, and controls. J Neurol Neurosurg Psychiatry 1998; 65(4): 467–471.
99. King M. Alcohol abuse in Huntington’s disease. Psychol Med 1985; 15(4): 815–819.
100. Verny C, Allain P, Prudean A, Malinge MC, Gohier B, Scherer C et al. Cognitive changes in asymptomatic carriers of the Huntington disease mutation gene. Eur J Neurol 2007; 14(12): 1344–1350.
101. Folstein SE, Brandt J, Folstein MF. Huntington’s disease. In: Cummings JL (ed). Subcortical dementia. New York: Oxford University Press 1990 : 87–107.
102. Roth J, Klempíř J, Špačková N. Neuropsychologie Huntingtonovy nemoci. In: Preiss M, Kučerová H(eds). Klinická neuropsychologie. Praha: Grada Publishing 2006 : 271–302.
103. Klempír J, Klempírová 0, Stochl J, Spacková N, Roth J. Relationship between impairment of voluntary movements and cognitive impairment in Huntington’s disease. J Neurol 2009, 256(10): 1629–1633.
104. Ribaï P, Nguyen K, Hahn‑Barma V, Gourfinkel‑An I, Vidailhet M, Legout A et al. Psychiatric and cognitive difficulties as indicators of juvenile huntington disease onset in 29 patients. Arch Neurol 2007; 64(6): 813–819.
105. Bonelli RM, Wenning GK. Pharmacological management of Huntington’s disease: an evidence‑based review. Curr Pharm 2006; 12(21): 2701–2720.
106. Roth J, Klempíř J, Uhrová T. Současné terapeutické možnosti u Huntingtonovy nemoci. Psychiatrie pro praxi 2009; 10(5): 205–208.
107. Bilney B, Morris ME, Perry A. Effectiveness of physiotherapy, occupational therapy, and speech pathology for people with Huntington’s disease: a systematic review. Neurorehabil Neural Repair 2003; 17(1): 12–24.
108. Zinzi P, Salmaso D, De Grandis R, Graziani G, Maceroni S, Bentivoglio A et al. Effects of an intensive rehabilitation programme on patients with Huntington’s disease: a pilot study. Clin Rehabil 2007; 21(7): 603–613.
109. Cubo E, Shannon KM, Tracy D, Jaglin JA, Bernard BA, Wuu J et al. Effect of donepezil on motor and cognitive function in Huntington disease. Neurology 2006; 67(7): 1268–1271.
110. Moskowitz CB, Marder K. Palliative care for people with late‑stage Huntington’s disease. Neurol Clin 2001; 19(4): 849–865.
111. Ross CA, Shoulson I. Huntington disease: pathogenesis, biomarkers, and approaches to experimental therapeutics. Parkinsonism Relat Disord 2009; 15 (Suppl 3): S135–S138.
112. Wright BL, Barker RA. Established and emerging therapies for Huntington’s disease. Curr Mol Med 2007; 7(6): 579–587.
113. Dunnett SB, Rosser AE. Cell transplantation for Huntington’s disease. Should we continue? Brain Res Bull 2007; 72(2–3): 132–147.
114. Roth J, Uhrová T, Doubek P, Preiss M, Židovská J,Havrdová E et al. The impact of Huntington’s disease on caregivers. The Czech Experience. Revista Neuro‑psiquiatría 2002; 65(3–4): 168–173.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2010 Číslo 2
-
Všechny články tohoto čísla
- Huntingtonova nemoc
- Trénink lokomoce v závěsu u pacientů po poranění míchy
- Neurorehabilitace
- Diffusion tensor imaging – současné možnosti MR zobrazení bílé hmoty mozku
- Prospektivní analýza subtypů a rizikových faktorů ischemické cévní mozkové příhody u dospělých do 50 let
- Srovnání české verze Montrealského kognitivního testu s Mini‑Mental State pro stanovení kognitivního deficitu u Parkinsonovy nemoci
- Faktory ovlivňující výsledek chirurgické léčby výhřezu meziobratlové ploténky bederní páteře
- Retrospektivní studie nálezů na magnetické rezonanci míchy a mozku u pacientů s diagnózou neuromyelitis optica
- Intramedulární astrocytom – soubor 15 pacientů a přehled literatury
- Neobvyklé klinické obrazy u migrény – kazuistiky
- Úprava sníženého mozkového krevního průtoku u Wernickeovy encefalopatie po alkoholové abstinenci – kazuistika
- Webové okénko
-
Analýza dat v neurologii XX.
Statistické testy pro četnosti kategorií – test dobré shody - Profesor Bartko – bard slovenskej neurologickej obce 80-ročný
- Průběh a závěry mezioborového setkání „Winter GLIO TRACK Meeting“ 2010
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Huntingtonova nemoc
- Neobvyklé klinické obrazy u migrény – kazuistiky
- Retrospektivní studie nálezů na magnetické rezonanci míchy a mozku u pacientů s diagnózou neuromyelitis optica
- Neurorehabilitace


