Výroční setkání věnované novinkám v léčbě roztroušené sklerózy
Autoři:
J. Piťha
Působiště autorů:
Neurologické oddělení, Krajská zdravotní, a. s. – Nemocnice Teplice o. z.
Vyšlo v časopise:
Cesk Slov Neurol N 2018; 81(4): 491-492
Kategorie:
Zpráva z odborné akce
Dne 3. 3. 2018 se uskutečnilo v německém Mnichově setkání odborníků specializujících se na diagnostiku a léčbu RS. Sympozia se účastnilo kolem 300 neurologů, převážně ze zemí EU.
Úvodní sdělení na téma role T a B lymfocytů v patofyziologii RS přednesl prof. K. Schmierer z Queen Mary University v Londýně. Dle mechanizmu účinku rozdělil léky ovlivňující průběh onemocnění (disease modifying drugs; DMD) do 4 skupin. Interferony, glatiramer acetát a dimetyl fumarát mají pleiotropní efekt ovlivňující aktivaci celé řady genů. Teriflunomid a mitoxantron redukují buněčnou proliferaci. Mezi antimigrační léky patří natalizumab a fingolimod. Cílenou buněčnou depleci způsobují alemtuzumab, ocrelizumab a kladribin. Imunopatogeneze RS je komplexní děj – porucha hematoencefalické bariéry je klíčová pro rozvoj perivaskulárního zánětu a rozvoj akutního axonálního poškození s následnou neurodegenerací. Axonální poškození je spojeno s fokální demyelinizací. CD8+ cytotoxické T lymfocyty aktivují fagocytózu prostřednictvím prozánětlivých cytokinů, např. interferonu gamma (IFN-γ) a tumor nekrotizujícího faktoru alfa (TNF-α), ale mohou přímo poškodit oligodendrocyty prostřednictvím MHC molekul I. třídy a/ nebo interakcí mezi Fas – FasL. CD4+ pomocné T buňky produkují např. IFN-γ, interleukin 17 (IL-17), jež se podílejí na zánětlivé reakci. Funkce B lymfocytů, které se formují v ektopických lymfoidních folikulárních centrech na meningách, spočívá v antigenní prezentaci a produkci cytokinů a autoprotilátek. Efekt deplece B lymfocytů byl ověřen klinickými studiemi s ocrelizumabem, účinek jejich dlouhodobé deplece není znám. Úbytek B lymfocytů u kladribinu na rozdíl od alemtuzumabu není spojen s větším výskytem autoimunit. Některé DMD působí na paměťové T a B buňky, což může ovlivňovat protiinfekční imunitu. Recentní klinické studie prokázaly klíčovou roli deplece B buněk v kontrole aktivity RS. Samotná imunosuprese T buněk v procesech potlačení aktivity RS se zdá méně důležitá. Deplece paměťových B buněk může být sjednocujícím a důležitým faktorem pro účinnou kontrolu RS a měla by být testována v klinické praxi.
Prof. A. Bar-Or z Pensylvánské univerzity věnoval pozornost cílené léčbě na T a B lymfocyty. U DMD byly shrnuty mechanizmy jejich účinku a nejčastější nežádoucí reakce. Nižší adherence k léčbě koreluje s vyšším rizikem relapsů. Terapeutické paradigma musí zohlednit úroveň aktivity onemocnění, protože pacienti s agresivnějším průběhem vyžadují časné nasazení vysoce účinné léčby. Moderní DMD poskytují lékařům stále větší možnosti cílit léčbu na specifické subpopulace lymfocytů, o nichž je známo, že se účastní imunopatogeneze RS. Zavedení nových léků do léčebné praxe poskytuje lékařům nové možnosti léčby. Lze cílit na specifické skupiny lymfocytů, o kterých se ví, že se podílejí u RS na rozvoji a udržování autoimunitního zánětu. Vysoce účinné léky (dimetyl fumarát, fingolimod, natalizumab, ocrelizumab a kladribin) působí jako lymfocytární „depletory“ s různou mírou specificity, nebo induktory sekvestrace buněk.
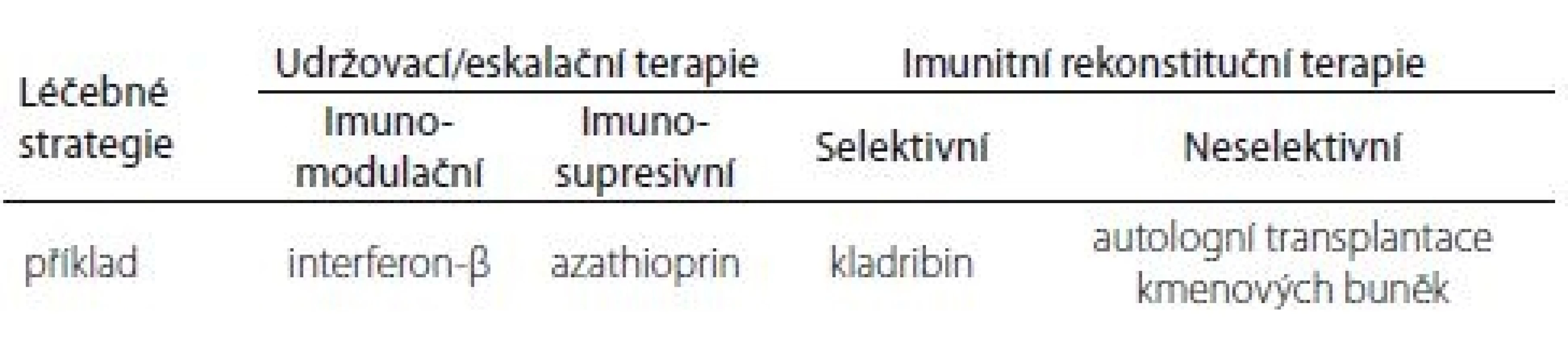
Imunitní mechanizmus účinku DMD u RS s podtitulem „Potřebujeme nový klasifikační systém?“ – takový byl název sdělení, který prezentoval prof. H. Wiendl z univerzity v Münsteru. V posledních dvaceti letech se management léčby RS dramaticky změnil. Většina dostupných léků může být klasifikována jako udržovací terapie, která je závislá na pravidelné aplikaci léku, a trvání účinku je určeno farmakologickým poločasem. Terapeutický efekt je často závislý na terapeutické dávce a je dočasný. Současná klasifikace dělí DMD na imunomodulační a imunosupresivní. U imunomodulancií dochází ke kontinuálnímu podávání farmaka modulujícího imunitní funkce. Kontinuální imunosuprese potlačuje imunitu. Tento typ terapie může indukovat dlouhodobou remisi, při jejím vysazení však hrozí rebound fenomén s nutností léčbu ukončit. Pokud se v případě udržovací terapie vyskytne zánětlivá aktivita, znamená to, že jde o suboptimální léčebnou odpověď. Kontinuální imunosupresivní terapie je spojena s vyšším rizikem nežádoucích účinků. Novou léčebnou strategií je indukční terapie. Tato léčebná strategie má biologický účinek, který nezávisí na poločasu eliminace farmaka, ale má přímý farmakologický účinek (remise bez farmakologické podpory). Může nastat několik situací. Buď jde o jednorázovou terapii, která indukuje dlouhodobý stav „freedom from disease aktivity“ (imunitní rekonstituční terapie; IRT), nebo pravidelné podávání léku, které po každé dávce navodí remisi. Poslední možností je indukční terapie následovaná terapií udržovací. IRT je krátkodobá léčba, která rekonstituuje imunitní systém, v důsledku čehož dochází k dlouhodobým kvalitativním změnám imunitních funkcí. Rekonstituci předchází redukce imunitních funkcí. Tyto mechanizmy jsou dokumentovány počty lymfocytů a jejich subpopulací po podání kladribinu ve dvou léčebných cyklech po dobu 2 let. Rekonstituce pokračuje minimálně další 2 roky. Na základě těchto poznatků navrhuje prof. Wiendl novou klasifikaci léčebných strategií RS (tab. 1).
Prof. G. Giovannoni z Queen Mary University v Londýně zaměřil svoje sdělení na účinnost a bezpečnost IRT u kladribinu. Upozornil na výhodné krátkodobé podání (16–20 dnů během 1. a 2. roku léčby), vysokou účinnost dokumentovanou dosažením 47% stavu NEDA (no evidence of disease activity) po 2leté léčbě a velmi nízkým počtem subjektů, které nedokončily klinické studie z důvodu nežádoucích účinků (3,5 %). Demonstroval výsledky klinické studie CLARITY z hlediska jak poklesu ročního počtu relapsů, tak proporce pacientů bez relapsů ve srovnání s placebem, zpomalení tendence k progresi disability, ale i signifikantní pokles aktivity a nárůstu atrofie na MR během 2letého sledování. Zmínil se i o výsledcích studie CLARITY EXT sledující klinické a MR parametry další 2 roky. Kladribin je inovativní léčba vhodná pro pacienty s vysoce aktivní RS.
Rozvoji cílů léčby u RS se věnoval prof. X. Montalban z univerzity v Barceloně. Podtitul jeho sdělení byl „Léčit cíleně a včas“. Diagnostika se urychlila poslední verzí McDonaldových diagnostických kritérií z r. 2017, kdy diseminaci v čase nahradil průkaz nekorelátů oligoklonálních imunoglobulinů v likvoru. Velmi silným argumentem, proč zahájit léčbu co nejdříve, je fakt, že axonální poškození a mozková atrofie předcházejí klinické manifestací a jsou ireverzibilní. Relabující fáze onemocnění predikuje dlouhodobou disabilitu. Včasné odhalení nonrespondérů umožňuje změnit léčebnou strategii. Nová doporučení ECTRIMS-EAN, z nichž některá byla v přednášce připomenuta, napomáhají v rozhodování o správném vedení léčby (volba iniciální terapie, switch in, switch out, eskalace, deeskalace, léčba ve speciálních situacích, monitorace léčby apod.).
Prof. P. Rieckmann se zabýval problematikou individualizace léčby RS. Upozornil na fakt, že RS je nesmírně heterogenní onemocnění. Dosud nejsou k dispozici jednoznačné prediktivní biologické markery onemocnění. To, co je však nutné zlepšit, je zkvalitnění komunikace mezi pacientem a ošetřujícím lékařem v rámci managementu RS. Hlavními prediktory léčebné odpovědi v rámci rozsáhlé analýzy MSBase se ukázaly věk, trvání choroby a její průběh, předchozí aktivita relapsů, míra disability, predominantní fenotyp relapsů a předchozí léčba.
Ve své další přednášce se prof. Rieckmann věnoval graviditě, pacientům vyššího věku a komorbiditám. Problematika gravidity souvisí s vysazením DMD před otěhotněním v závislosti na riziku teratogenity. Ovlivnění ročního počtu relapsů u pacientů starších 40 let proti mladším se v klinických studiích většinou neliší. Nicméně ve studii AFFIRM byla redukce ročního počtu relapsů u subjektů léčených natalizumabem větší u pacientů mladších. V závislosti na věku jsou pozorovány kvantitativní a funkční změny některých lymfocytárních subpopulací, např. naivních a paměťových buněk. Mezi nejčastěji se vyskytující doprovodné choroby patří deprese a úzkostné poruchy, arteriální hypertenze, hyperlipidemie a chronická plicní onemocnění. Vaskulární komorbidity bývají spojeny s nárůstem progrese disability. Komorbidity oddalují zahájení léčby a mohou komplikovat výběr vhodných DMD.
„Kdy měníme a eskalujme léčbu?“ Toto téma si zvolila pro svou přednášku prof. J. Ohz univerzity v Torontu. Mezi hlavní důvody ukončení či změny léčby patří nežádoucí účinky, produkce neutralizačních protilátek, riziko závažných infekcí (např. PML), vysoká aktivita choroby a těhotenství. Při zvažování změny léčby je nutné znát mechanizmus účinku různých DMD. Jde zejména o rizika rebound fenoménu a perzistující lymfopenie. Studie TONGO byla randomizovaná, placebem kontrolovaná studie, zkoumající trvání vymývacího období při přechodu z natalizumabu na fingolimod. Bylo zjištěno, že optimální doba nasazení fingolimodu po ukončení předchozí léčby k udržení kontroly onemocnění je 8–12 týdnů. U některých DMD (např. ocrelizumab, fingolimod) je nutné počítat s tím, že lymfopenie může přetrvávat měsíce až roky po ukončení léčby. Potenciální aditivní efekt je třeba brát v úvahu i po nasazení imunomodulační či imunosupresivní terapie po ukončení léčby kladribinem.
Sympozium bylo zpestřeno dvěma interaktivními kazuistickými bloky. První se týkal managementu komorbidit a problematiky gravidity, druhý se věnoval eskalaci terapie, změně léčby a volbě léku u nově diagnostikované pacientky středního věku.
Na závěr prof. Rieckamann zdůraznil, že:
- lepší porozumění patofyziologii RS a zlepšení diagnostiky umožnily časnější diagnózu a léčbu RS;
- rostoucí počet léčebných možností s různými mechanizmy účinku dovolují další individualizaci léčby u pacientů s RS;
- zavedení nekontinuální IRT do léčebné praxe může zásadně změnit léčebné možnosti ve prospěch pacientů s RS.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2018 Číslo 4
-
Všechny články tohoto čísla
- Editorial
- Detekce nestabilního karotického plátu v prevenci ischemické cévní mozkové příhody
- Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - ANO
- Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - NE
- Agresívna liečba intracerebrálnej hemoragie so znižovaním krvného tlaku a indikáciou operácie
- Léčba cílená na B lymfocyty – významný pokrok v léčbě roztroušené sklerózy
- Biomarkery progrese onemocnění a prognózy u pacientů s roztroušenou sklerózou
- Možnosti regulace neuroimunitních a neuroendokrinních dějů pomocí fyzioterapie
- Parietální atrofický skór na magnetické rezonanci mozku u normálně stárnoucích osob
- Zobrazení periferních nervů pomocí difuzního tenzoru a MR traktografie
- Rozdíly v klinických, radiologických a léčebných modalitách intramedulárních arachnoidálních cyst a syringomyelie v oblasti krční páteře – 12 případů
- Vzťah medzi intenzitou tinnitu a mierou senzorineurálnej straty sluchu z aspektu prínosu hyperbarickej oxygenoterapie
- Vzťah medzi intenzitou tinnitu a mierou senzorineurálnej straty sluchu z aspektu prínosu hyperbarickej oxygenoterapie
- Antiagregačná a antikoagulačná liečba pri karotickej endarterektómii
- Skoré pooperačné komplikácie po plánovaných operáciách degenerovanej driekovej chrbtice u starších pacientov
- Srovnání účinnosti subkutánně podávaného interferonu β-1a 44 μg, dimetyl fumarátu a fingolimodu v reálné klinické praxi – multicentrická observační studie
- Soubor obrázků s protikladnou náročností pojmenovatelnosti
- Faryngo-cerviko-brachiální varianta Guillain-Barrého syndromu
- Bradykininem indukovaný angioedém po podání tkáňového aktivátoru plazminogenu u akutní cévní mozkové příhody – terapie s nebo bez inhibitoru C1 esterázy
- Oboustranná paréza nervus abducens po úrazu hlavy a krční páteře
- Huntingtonova nemoc se začátkem v seniu – přehlížená diagnóza
- Analýza dat v neurologii - LXX. Kovariance
- Výroční setkání věnované novinkám v léčbě roztroušené sklerózy
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Antiagregačná a antikoagulačná liečba pri karotickej endarterektómii
- Oboustranná paréza nervus abducens po úrazu hlavy a krční páteře
- Zobrazení periferních nervů pomocí difuzního tenzoru a MR traktografie
- Huntingtonova nemoc se začátkem v seniu – přehlížená diagnóza
