Obecné pohyby a neurologický vývoj raného věku u dětí s novorozeneckou hypoglykemií
General movements and neurological development of the early age in children with neonatal hypoglycemia
Aim: To evaluate the relationship between neonatal hypoglycemia and neurodevelopment at toddler stage.
Patients and methods: A prospective cohort study. A cohort of 50 neonates diagnosed with hypoglycemia, with 1380 – 4170 g birth weight and 31 – 41 weeks of gestational age born in the single center during 2015 – 2016. The evaluation of neurological condition by means of video recordings and the General Movements Assessment, and a standard neurological examination was used.
Results: Pathological cranial US findings OR 80; 95% CI 1.6 – 4.024) and abnormal motor pattern of general movements (GMs) were independent predictors of abnormal neurological findings at 9 to 16 weeks post-term (OR 864; 95% CI 2.99 – 250,059). At 24 months, four children (8%) were diagnosed with cerebral palsy; all of them had consistent GMs pathology and an abnormal neurological finding.
Conclusions: The assessment of GMs combined with the standard neurological examination and cranial US is a valuable tool to predict the development of cerebral palsy at an early age. Early diagnosis is crucial to the child’s prognosis and quality of life. After the observation, we did not find a significant relationship between neonatal hypoglycemia and abnormal neurodevelopment at the toddler stage.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
新生儿低血糖患儿早期一般运动及神经发育
目的:
目的探讨婴幼儿期新生儿低血糖与神经发育的关系。
患者和方法:
前瞻性队列研究。一组50名被诊断为低血糖的新生儿,他们的出生体重为1380 - 4170克,孕周为31 - 41周,在2015 - 2016年期间出生在一个中心。采用录像、一般动作评定和标准的神经学检查对神经系统状况进行评价。
结果:
病理头颅超声(US)检查结果或80例;95% CI 1.6 - 4.024)和一般运动异常运动模式(GMs)是术后9 ~ 16周神经功能异常的独立预测因子(或864;95% CI 2.99 - 250,059)。24个月时,4名儿童(8%)被诊断为脑瘫;所有患者均有一致的GMs病理及异常的神经学发现。
结论:
GMs评估结合标准神经学检查和头颅超声检查是预测早期脑瘫发展的重要工具。早期诊断对儿童的预后和生活质量至关重要。通过观察,我们没有发现新生儿低血糖与幼儿期神经发育异常之间存在显著关系。
关键词:
新生儿低血糖-脑瘫-全身运动-神经学检查
Keywords:
neonatal hypoglycemia – Cerebral palsy – general movements – neurological examination
Autoři:
A. Nogolová 1; J. Pavlíček 2
Působiště autorů:
Oddělení dětského lékařství, Městská nemocnice Ostrava, p. o.
1; Klinika dětského lékařství LF OU a FN Ostrava
2
Vyšlo v časopise:
Cesk Slov Neurol N 2019; 82(2): 189-193
Kategorie:
Původní práce
doi:
https://doi.org/10.14735/amcsnn2019189
Souhrn
Cíl: Cílem práce je analýza vztahu mezi novorozeneckou hypoglykemií a neurologickým vývojem v batolecím věku.
Soubor a metody: Prospektivní kohortová studie. Soubor 50 novorozenců s hypoglykemií s porodní hmotností 1 380 – 4 170 g, narozených v jednom zařízení mezi 31. a 41. gestačním týdnem v letech 2015 – 2016. K hodnocení neurologického nálezu byly použity videonahrávky a metoda General Movements Assessment (GMA) a standardní neurologické vyšetření.
Výsledky: U novorozenců s hypoglykemií byly patologický UZ mozku OR 80; 95% CI 1,6 – 4 024) a patologický pohybový vzorec „obecných pohybů“ (general movements; GMs) (OR 864; 95% CI 2,99 – 250 059) nezávislými prediktory abnormálního neurologického nálezu mezi 9. a 16. týdnem postnatálně. Ve 24 měsících čtyři děti (8 %) měly diagnostikovánu dětskou mozkovou obrnu (DMO), všechny tyto děti měly konzistentní patologii GMs a abnormální neurologické nálezy.
Závěr: Vyšetření GMs v kombinaci se standardním neurologickým vyšetřením a UZ mozku jsou rychlé, neinvazivní a levné metody, které lze využít k predikci vývoje DMO v raném věku. Včasná diagnostika je zásadní pro prognózu a kvalitu života dítěte. Po ukončení sledování jsme nenašli signifikantní vztah mezi novorozeneckou hypoglykemií a abnormním neurologickým vývojem v batolecím věku.
Klíčová slova:
novorozenecká hypoglykemie – dětská mozková obrna – obecné pohyby – neurologické vyšetření
Úvod
Hypoglykemie je definována nízkou hladinou glukózy v krvi a její fyziologická hodnota je věkově odlišná. Glukóza je pro rychle rostoucí mozek důležitým zdrojem energie a substrátem pro syntézu membránových lipidů a proteinů nutných k maturaci mozku a myelinizaci. Glukóza vstupuje do mozku facilitovanou difuzí. Rychlost tohoto přestupu závisí na výši glykemie. Pokles difuze glukózy do mozku vede k hypoglykorachii a dochází k energetickému deficitu neuronů. Hypoglykemie může zásadně ovlivnit dlouhodobou morbiditu novorozenců a způsobit ireverzibilní poškození vývoje a růstu mozku a mozkových funkcí, zvláště v kombinaci s dalšími rizikovými faktory (hypoxie, ischemie, intrakraniální krvácení, infekce atd.). Hypoglykemií jsou více ohroženi nedonošení, hypotrofičtí a hypertrofičtí novorozenci, děti diabetických matek, novorozenci s perinatální asfyxií, s kongenitálními syndromy (např. Downův syndrom, Costello syndrom, Beckwithův-Wiedemannův syndrom) [1–3]. Hlavními dlouhodobými následky neonatální hypoglykemie mohou být poruchy motorického vývoje, vizuálních funkcí, behaviorálních projevů [2,4–8], vznik epilepsie okcipitálního laloku nebo závažné epileptické encefalopatie s refrakterními záchvaty [6,9,10]. Opakované epizody hypoglykemie jsou spojeny se signifikantně menším obvodem hlavy v kojeneckém a batolecím věku [4,6,10].
Kromě standardního neurologického vyšetření můžeme ke zhodnocení nezralého nervového systému využít také metodu popsanou Prechtlem – General Movements Assessment (GMA). Pomocí GMA lze vyšetřovat děti od narození do zhruba 20. týdne postnatálně, poté jsou jednotlivé pohyby nahrazeny antigravitačními a úmyslnými pohyby [11,12]. „Centrální generátory vzorů“ (central pattern generators; CPGs) jsou sítě neuronů, které mohou produkovat opakovaně a automaticky rytmické pohybové vzorce, a to nezávisle na senzorické aferentaci a vyšších etážích CNS. CPGs takto popsaným způsobem fungují jen za laboratorních podmínek. U zdravého jedince je naopak činnost CPGs modulována supraspinálními centry, neuromodulátory a senzorickou aferentací [13,14]. Poškozením mozku v raném údobí dochází k redukci těchto vlivů a generované pohyby ztrácejí svou variabilitu, zvyšuje se jejich rytmicita a monotónnost [12,15]. Základem GMA je observace dítěte v jeho spontánním motorickém projevu a vizuální hodnocení pohybových sekvencí. „Obecné pohyby“ (general movements; GMs) zahrnují celé tělo – krk, končetiny, trup. Tyto pohyby jsou plynulé a elegantní, jsou prováděny s různou amplitudou, intenzitou, silou a rychlostí. V průběhu prvních 2 měsíců po narození se GMs označují jako „kroutivé pohyby“ (writhing movements). Abnormální pohybové vzorce jsou klasifikovány jako „špatný repertoár pohybu“ (poor repertoire; PR), „křečová synchronizovaná hybnost“ (cramped synchronised; CS) nebo „chaotické pohyby“ (chaotic movements). Od 6. do 9. týdne věku „kroutivé pohyby“ (writhing movements) postupně mizí a jsou nahrazovány tzv. „neposednými pohyby“ (fidgety movements; FMs). FMs jsou malé a elegantní pohyby na krku, trupu, končetinách. Jsou věkově specifické, můžeme je pozorovat zhruba do 15. až 20. týdne po narození [11,12,16].
Cílem práce bylo studium vztahu mezi novorozeneckou hypoglykemií a neurologickým vývojem v batolecím věku. Součástí studie bylo vyhodnocení UZ nálezů vyšetření mozku, hodnocení kvality motorického repertoáru GMs, neurologických nálezů a určení jejich validity v predikci abnormního neurologického vývoje po proběhlých epizodách novorozenecké hypoglykemie.
Soubor a metodika
Do studie bylo zařazeno 50 novorozenců s diagnostikovanou hypoglykemií narozených v letech 2015–2016 v intermediárním centru Městské nemocnice v Ostravě. Tam byli neurologicky vyšetřeni a dále sledováni.
Rodiče všech dětí vyjádřili svůj písemný souhlas se studií a s pořizováním videonahrávek.
K definici hypoglykemie bylo využito modifikované schéma American Academy of Pediatrics (AAP): hodnota glukózy ≤ 35 mg/ dl (1,94 mmol/ l) ve věku 1–3 h; ≤ 40 mg/ dl (2,2 mmol/ l) mezi 3. a 24. h a ≤ 45 mg/ dl (2,5 mmol/ l) nad 24 h [17]. Současně byly definovány další rizikové faktory:
- perinatalní asfyxie [18] jako pH z pupečníkové krve < 7,0; base excess (BE) ≤ 12 mmol/ l; Apgar skóre 0–3 body po 5. min života;
- hypotrofický novorozenec s porodní hmotností ≤ 10. percentil [19];
- hypertrofický novorozenec s porodní hmotností ≥ 90. percentil [19];
- novorozenci diabetických matek (matky s diabetem mellitem 1. typu nebo s gestačním diabetem dle kritérií American Diabetes Association) [20];
- předčasně narozený novorozenec byl definován porodem před ukončeným 37. gestačním týdnem [21];
- sepse jako systémové onemocnění s prokázanou bakteriémií a s nutností aplikace antibiotik [21];
- syndrom dechové tísně novorozence s typickým radiologickým a klinickým obrazem [21];
- ikterus byl vždy verifikován odběrem hladiny bilirubinu v krvi, novorozenci byli léčeni fototerapií (dle kritérií AAP) [22];
- patologický UZ mozku obsahoval diagnózy periventrikulární/ intraventrikulární hemoragie (PVH/ IVH) I.–IV. stupně [23] a periventrikulární leukomalacie (PVL) I.–IV. stupně [24].
Kapilární vzorky k testování hypoglykemie byly odebírány z paty novorozence. K testování byl použit glukometr Accu-Chek Performa (Accu-Chek, Praha, ČR). Každá patologická hodnota glykemie byla ověřena laboratorně z venózní krve. První krevní vzorky byly odebírány 30–60 min po narození a dále v pravidelných intervalech před krmením (dle hodnot glykemií a klinického stavu).
Ultrazvukové vyšetření mozku přes velkou fontanelu bylo opakovaně realizováno u každého dítěte erudovaným dětským neurologem. K vyšetření byl použit přístroj Acuson Sequoia 512, mikrosektorová sonda 8V5 (Siemens Healthcare, Erlangen, Německo).
Vyšetření GMs bylo provedeno v novorozeneckém období a opětovně mezi 9. a 16. týdnem postnatálně. Novorozenci byli hodnoceni po ukončení adaptačních procesů jednotlivých orgánových systémů a po stabilizaci behaviorálních procesů, nejdříve 5. den života. GMs nebyly vyšetřeny v klinicky němém období mezi 6. a 8. týdnem věku. Video nahrávky trvaly 5–10 min, byly pořízeny v období aktivního odpočinku, v termoneutrálním prostředí. Děti byly nahrávány v poloze na zádech, s omezením stimulace z okolí. Ve věku 9–16 týdnů byl hodnocen motorický projev pomocí Motor Optimality Score (MOS). Tento detailní skórovací systém obsahuje 5 bodovaných subkategorií (1. hodnocení FMs; 2. věku adekvátní motorický projev; 3. kvalita pohybových vzorců; 4. hodnocení postury; 5. celková kvalita motorického projevu). Maximální počet bodů MOS je 28 (nejlepší motorický projev), minimum je 5 bodů [25,26]. MOS < 25 bodů byl v naší studii hodnocen jako redukovaný.
Standardní neurologické vyšetření obsahovalo zhodnocení vybraných vývojových (primitivních) reflexů, posturálního a tonusového zrání, vyšetření provokované i spontánní hybnosti. Vyšetření se zaměřilo na časné odhalení dětské mozkové obrny (DMO). Ve věku 24 měsíců byl neurologický nález hodnocen jako normální (žádné neurologické odchylky), lehce abnormální (lehká motorická dyskoordinace, mírná tonusová odchylka, afektivní labilita, dyslálie, mírné odchylky v behaviorálním projevu atd.) nebo abnormální (DMO). Diagnóza DMO byla postavena na definici dle Baxe et al [27] a Rosenbauma et al [28]. Míra funkčního omezení u dětí s DMO byla posuzována podle systému klasifikace hrubé motoriky (Gross Motor Function Classification System – Expanded and Revised; GMFCS E&R) [29].
U každého vyšetření byl kalendářní věk dítěte korigován podle věku gestačního.
Konečné vyhodnocení neurologického vývoje pro účely této studie bylo provedeno ve 24. měsíci života, indikovaní pacienti jsou sledováni i nadále.
Získaná data byla uložena a zpracována v programu Microsoft Excel (Microsoft Corporation, Redmond, WA, USA). Stejný program byl použit i pro popisnou statistiku a základní grafy. Základní hodnocení je prezentováno tabulkami s uvedením počtu a procentuálního podílu. Pro porovnání byl použit chí-kvadrát test. K posouzení, zda jsou vybrané rizikové faktory nezávislými prediktory neurologického vývoje, byla použita binární logistická regrese. Hladina významnosti α pro pravděpodobnost chyby prvního druhu (p) byla u všech testů zvolena na úrovni 0,05. K testování byl použit GraphPad Prism 6.0h software pro Mac OS X (GraphPad Software, San Diego, CA, USA).
Výsledky
Do studie bylo zařazeno 50 novorozenců s hypoglykemií zjištěnou v prvních 48 h po narození. Mužské pohlaví tvořilo 54 % (27/ 50) dětí. Soubor zahrnoval zralé i předčasně narozené novorozence (90 %), s mediánem porodu ve 33. týdnu (31.–41. týden), s porodní hmotností s mediánem 2 160 g (1 380–4 170 g). Dvojčat bylo 18 % (9/ 50) dětí. Podrobná klinická data studované skupiny jsou uvedena v tab. 1.
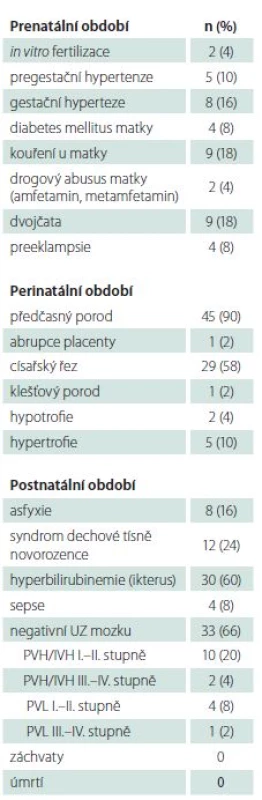
Hodnota glykemie se pohybovala v rozmezí 0,5 až 2,2 mmol/ l (medián 1,6).
Abnormní pohybový vzorec GMs po narození byl zjištěn u 36 (72 %) novorozenců. Nejčastěji byl popsán PR GMs, a to u 34 dětí (68 %); CS GMs byl pozorován u dvou dětí (4 %). „Chaotické pohyby“ (chaotic movements) v našem souboru nebyly zachyceny.
Mezi 9. a 16. týdnem byly hodnoceny FMs, které chyběly u devíti (18 %) dětí. Hodnota MOS byla v rozmezí od 6–28 bodů (medián 26, interquartile range [IQR] 22–26) a byla redukována u 19 (38 %) dětí, detailní výsledky hodnocení v tab. 2–3.
![Motor Optimality Score a jeho subkategorie (n = 50) [42].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image_pdf/83b4b72d6d5a420b9703cfaf6b2edb89.jpeg)
![Vyšetření abnormního motorického repertoáru mezi 9.–16. týdnem (n = 50) [42].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image_pdf/4ea41bc52453a29f20dbfbe1ef086806.jpeg)
Standardní neurologické vyšetření mezi 9. a 16. týdnem postnatálně bylo u 20 (40 %) dětí abnormální, nejčastěji byl popsán centrální hypertonický syndrom (14/ 20 dětí). Incidence GMs abnormalit a neurologických odchylek měla tendenci s věkem klesat.
Abnormity na UZ mozku byly popsány u 17 (34 %) pacientů. Dominovaly intraventrikulární hemoragie (IVH) I.–II. stupně a periventrikulární leukomacie (PVL) I.–II. stupně (14/ 17 dětí). Tři děti měly závažné nálezy typu intracerebrální hemoragie III.–IV. stupně a cystické leukomalacie III.–IV. stupně.
Ve věku 24 měsíců čtyři pacienti (8 %) měli diagnostikovánu DMO: 1× formu hemiparetickou (GMFCS stupeň I), 2× formu diparetickou (GMFCS stupeň II), 1× formu kvadruspastickou (GMFCS stupeň V). Při sledování dětí s hypoglykemií byly signifikantně spojeny abnormní motorické vzorce GMs v novorozeneckém údobí s patologickými nálezy v kojeneckém věku (chybění FMs, redukce MOS) a abnormitami standardního neurologického vyšetření; děti s DMO měly patologická vyšetření v celém průběhu sledování (tab. 4–5). Děti s DMO měly současně závažný nález při UZ vyšetření mozku. Ze studovaných rizikových faktorů uvedených v tab. 1 byly patologický nález na UZ mozku a abnormální pohybový vzorec GMs po narození nezávislými prediktory patologického neurologického nálezu mezi 9. až 16. týdnem postnatálně (UZ CNS: OR 80; 95% CI 1,6–4 024; neurologický nález: OR 864; 95% CI 2,99–250 059). Trvalá přítomnost abnormního pohybového vzorce GMs (PR, CS, absence FMs) byla silným prediktorem nepříznivého neurologického vývoje. Naopak UZ nález na mozku negativní nebo jen s lehkými odchylkami a trvale normální nebo tranzitorně abnormální GMs obecně predikovaly příznivý neurologický vývoj.


Diskuze
V hodnoceném souboru převažovali předčasně narození novorozenci. Tento fakt potvrzuje, že nejsilnějším rizikovým faktorem vzniku hypoglykemie je prematurita. Je uváděna až incidence 50 % u předčasně narozených dětí [3].
U pacientů našeho souboru byla kromě standardního neurologického vyšetření využita metoda dle Prechtla – vyšetření GMs. Abnormní GMs po narození byly zjištěny u 72 % novorozenců, nejčastěji byly pozorovány PR GMs. Tento pohybový vzorec je typický pro nezralé a hypotrofické novorozence, novorozence s nízkým Apgar skóre, často jej vídáme první 2 týdny po narození [30]. Má však bohužel poměrně malou prediktivní hodnotu, což podporuje i naše zjištění. Patologický motorický repertoár charakteru CS GMs jsme pozorovali pouze u 4 % dětí našeho souboru, jeho trvalá přítomnost však ve 100 % predikovala vývoj DMO. Jde o nejčasnější příznak možného vývoje do obrazu spastické formy DMO s vysokou specificitou, která je v různých studiích uváděna od 92,5 až po 100 % [11,12,16].
V kojeneckém období (v období FMs) se všechny děti naší kohorty s normálními FMs v kombinaci s plynulými elegantními pohyby a negativním neurologickým vyšetřením vyvíjely fyziologicky. Tento fakt podporují četné studie, které definují přítomnost FMs jako vysoce prediktivní pro normální vývoj [11,12,16,26]. Výjimkou byly dvě děti s fyziologickým vývojem, které neměly FMs, a dále tři děti s absencí FMs, které měly abnormální a opožděný neurologický vývoj, ale nebyly hodnoceny jako DMO.
Standardní neurologické vyšetření mezi 9. a 16. týdnem postnatálně bylo u 40 % dětí abnormální, nejčastěji byl popsán centrální hypertonický syndrom. Incidence GMs abnormalit a patologií v neurologickém vyšetření měly tendenci klesat s věkem. Tento fenomén si vysvětlujeme možnou spontánní úpravou raných dysfunkcí mozku [11,12]. To odpovídá i zjištěním, že specificita vyšetření GMs je věkově závislá, je nižší v raných obdobích vývoje (zhruba 82 %), ve 3 měsících dosahuje až 100 % [11,12,16]. Naopak senzitivita vyšetření GMs je věkově nezávislá, v průměru v různých studiích udávaná kolem 94 % [11,12,16]. Vyšetření GMs se jeví citlivější metodou než klasické neurologické vyšetření [31].
Trvalá přítomnost abnormních GMs byla silným prediktorem nepříznivého neurologického vývoje do budoucna.
Abnormity na UZ mozku, rozsah a lokalizace lézí zásadně ovlivňují budoucí neurologický status dítěte. Periventrikulární/ intraventrikulární hemoragie a stupeň krvácení koreluje s nezralostí a stupněm asfyxie, u novorozenců narozených pod 28. gestačním týdnem se incidence pohybuje mezi 60–80 %, u zralých novorozenců nepřesahuje 5%. PVH/ IVH I. a II. stupně neurologický nález většinou neovlivní, což podporuje i naše zjištění. Naopak u PVH/ IVH III. st. je riziko neurologických komplikací až 70 % [32]. Další častou diagnózou nedonošených dětí je PVL. Na vzniku PVL se zásadně spolupodílí rizikové faktory v prenatálním, intra a postnatálním období, např. preeklampsie matky, placentární insuficience, diabetes matky, prenatální infekce, asfyxie, syndrom dechové tísně, hypoglykemie atd. Incidence PVL kolísá, ve studii Pierrata et al [33] byla diagnostikována u 2,8 % novorozenců narozených ve 32. gestačním týdnu a méně. V naší studované skupině byla incidence PVL výrazně vyšší (10 %), tento fakt si vysvětlujeme přítomností a kombinací mnoha rizikových faktorů u sledovaných novorozenců. Dle Kinnala et al [34] UZ mozku provedený postnatálně zobrazuje až 4× častěji abnormitu právě u dětí s tranzientní hypoglykemií než u zdravé kontrolní skupiny. Z nálezů jsou popisovány hyperechogenity bílé hmoty frontálních a parieto-okcipitálních laloků [6,9,10]. Typické postižení parieto-okcipitálních laloků nebylo v naší skupině zachyceno, což může být způsobeno malým počtem pacientů ve sledovaném souboru. Všechny děti, které měly diagnostikovánu DMO, měly závažnou patologii na UZ mozku. Výjimkou bylo jedno dítě s negativním UZ mozku, které mělo následně diagnostikovánu lehkou centrální diparézu. U tohoto pacienta byl však trvale abnormní pohybový vzorec GMs, nebyly pozorovány FMs a měl abnormní neurologický nález.
Po ukončení sledování jsme nenalezli signifikantní vztah mezi novorozeneckou hypoglykemií a vznikem DMO v batolecím věku.
Silnou stránkou studie bylo zjištění, že použité metody jsou levné, rychlé, neinvazivní a lze je kombinovat. S jejich pomocí můžeme včasně zachytit poruchu vývoje, určit vývojovou prognózu, hodnotit průběh a úspěšnost stanovené intervence. Nevýhodou byla menší studovaná skupina pacientů a kratší doba sledování. Cíleně ale byla vybrána jedna riziková skupina novorozenců a pro posouzení vlivu hypoglykemie na další vývoj autoři považují sledované období za dostatečné.
Závěr
Neonatální hypoglykemie je u novorozenců vážným problémem. V kombinaci s dalšími rizikovými faktory může nepříznivě ovlivnit neurologický vývoj dítěte. K časné a správné diagnostice může pomoci standardní neurologické vyšetření doplněné o vyhodnocení GMs a strukturálního zobrazení mozku. Cílem je prevence rozvoje závažných poruch vývoje a možnost plánování časných terapeutických opatření k odstranění odchylek ve vývoji.
Standardem je multioborová péče a spolupráce a individualizovaný přístup ke každému dítěti a jeho rodině.
Autoři děkují všem dětem a jejich rodičům za trpělivost při videonahrávání a dále všem zdravotníkům, kteří se o rizikové novorozence starají. Rádi bychom také poděkovali doc. MU Dr. Marianu Kacerovskému, Ph.D., za jeho pomoc se statistickou analýzou. Velmi si ceníme pomoci Mgr. Hany Kokešové s pořizováním videonahrávek.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 5. 11 2018
Přijato do tisku: 30. 1. 2019
MUDr. Alice Nogolová
Oddělení dětského lékařství
Městská nemocnice Ostrava, p. o.
Nemocniční 898/20A
728 80 Ostrava
e-mail: alice.nogolova@mnof.cz
Zdroje
1. Sharma A, Davis A, Shekhawat PS. Hypoglycemia in the preterm neonate: etiopathogenesis, diagnosis, management and long-term outcomes. Transl Pediatr 2017; 6(4): 335–348. doi: 10.21037/tp.2017.10.06.
2. Tam EW, Haeusslein LA, Bonifacio SL et al. Hypoglycemia is associated with increased risk for brain injury and adverse neurodevelopmental outcome in neonates at risk for encephalopathy. J Pediatr 2012; 161(1): 88–93. doi: 10.1016/j.jpeds.2011.12.047.
3. Harris DL, Weston PJ, Harding JE. Incidence of neonatal hypoglycemia in babies identified as at risk. J Pediatr 2012; 161(5): 787–791. doi: 10.1016/j.jpeds.2012.05.022.
4. Duvanel CB, Fawer CL, Cotting J et al. Long-term effects of neonatal hypoglycemia on brain growth and psychomotor development in small-for-gestational-age preterm infants. J Pediatr 1999; 134(4): 492–498.
5. Kerstjens JM, Bocca-Tjeertes IF, de Winter AF et al. Neonatal morbidities and developmental delay in moderately preterm-born children. Pediatrics 2012; 130(2): e265–e272. doi: 10.1542/peds.2012-0079.
6. Filan PM, Inder TE, Cameron FJ et al. Neonatal hypoglycemia and occipital cerebral injury. J Pediatr 2006; 148(4): 552–355.
7. Burns CM, Rutherford MA, Boardman JP et al. Patterns of cerebral injury and neurodevelopmental outcomes after symptomatic neonatal hypoglycemia. Pediatrics 2008; 122(1): 65–74. doi: 10.1542/peds.2007-2822.
8. McKinlay CJ, Alsweiler JM, Ansell JM et al. Neonatal glycemia and neurodevelopmental outcomes at 2 years. N Engl J Med 2015; 373(16): 1507–1518. doi: 10.1056/NEJMoa1504909.
9. Udani V, Munot P, Ursekar M et al. Neonatal hypoglycemic brain injury – a common cause of infantile-onset remote symptomatic epilepsy. Indian Pediatr 2009; 46(2): 127–132.
10. Caraballo RH, Sakr D, Mozzi M et al. Symptomatic occipital lobe epilepsy following neonatal hypoglycemia. Pediatr Neurol 2004; 31(1): 24–29.
11. Einspieler C, Prechtl HF, Ferrari F et al. The qualitative assessment of general movements in preterm, term and young infants-review of the methodology. Early Hum Dev 1997; 50(1): 47–60.
12. Einspieler C, Prechtl HF. Prechtl’s assessment of general movements: a diagnostic tool for the functional assessment of the young nervous system. Ment Retard Dev Disabil Res Rev 2005; 11(1): 61–67.
13. Einspieler C, Marschik PB. Central pattern generators and their significance for the foetal motor function. Klin Neurophysiol 2012; 43 : 16–21. doi: 10.1055/s-0031-1286264.
14. Vařeka I, Bednář M, Vařeková R. Robotická rehabilitace chůze. Cesk Slov Neurol N 2016; 79/112(2): 168–172.
15. Ferrari F, Cioni G, Prechtl HF. Qualitative changes of general movements in preterm infants with brain lesions. Early Hum Dev 1990; 23(3): 193–231.
16. Ferrari F, Cioni G, Einspieler C et al. Cramped synchronized general movements in preterm infants as an early marker for cerebral palsy. Arch Pediatr Adolesc Med 2002; 156(5): 460–467.
17. Adamkin DH. Committee on Fetus and Newborn. Postnatal glucose homeostasis in late-preterm and term infants. Pediatrics 2011; 127(3): 575–579. doi: 10.1542/peds.2010-3851.
18. Gomella TL, Cunningham MD, Eyal FG. Neonatology. 7th ed. McGraw-Hill Education 2013.
19. Fenton TR, Kim JH. A systematic review and meta-analysis to revise the Fenton growth chart for preterm infants. BMC Pediatr 2013; 13 : 59. doi: 10.1186/1471-2431-13-59.
20. American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care 2010; 33(Suppl 1): S62–S69.
21. Janota J, Straňák Z (eds). Neonatologie. 1. vyd. Praha: Mladá fronta 2013.
22. American Academy of Pediatrics Subcommittee on Hyperbilirubinemia. Management of hyperbilirubinemia in the newborn infant 35 or more weeks of gestation. Pediatrics 2004; 114(1): 297–316.
23. Levene MI, Fawer CL, Lamont RF. Risk factors in the development of intraventricular haemorrhage in the preterm neonate. Arch Dis Child 1982; 57(6): 410–417.
24. de Vries LS, Eken P, Dubowitz LM. The spectrum of leukomalacia using cranial ultrasound. Behav Brain Res 1992; 49(1): 1–6.
25. Einspieler C, Prechtl HF, Bos AF et al. Prechtl’s method of the qualitative assessment of general movements in preterm, term and young infants. Early Hum Dev 2011; 87(9): 633–639. doi: 10.1016/j.earlhumdev.2011.04.017.
26. Yuge M, Marschik PB, Nakajima Y et al. Movements and postures of infants aged 3 to 5 months: to what extent is their optimality related to perinatal events and to the neurological outcome? Early Hum Dev 2011; 87(3): 231–237. doi: 10.1016/j.earlhumdev.2010.12.046.
27. Bax M, Goldstein M, Rosenbaum P et al. Proposed definition and classification of cerebral palsy, April 2005. Dev Med Child Neurol 2005; 47(8): 571–576.
28. Rosenbaum P, Paneth N, Leviton A et al. A report: the definition and classification of cerebral palsy, April 2006. Dev Med Child Neurol 2007; 109(Suppl): 8–14.
29. Palisano RJ, Hanna SE, Rosenbaum PL et al. Validation of a model of gross motor function for children with cerebral palsy. Phys Ter 2000; 80(10): 974–985.
30. Beccaria E, Martino M, Briatore E et al. Poor repertoire General Movements predict some aspects of development outcome at 2 years in very preterm infants. Early Hum Dev 2012; 88(6): 393–396. doi: 10.1016/j.earlhumdev.2011.10.002.
31. Cioni G, Ferrari F, Einspieler C et al. Comparison between observation of spontaneous movements and neurologic examination in preterm infants. J Pediatr 1997; 130(5): 704–711.
32. Hadač J. Ultrazvukové vyšetření mozku přes velkou fontanelu. 1. vyd. Praha: Triton 2000 : 82–137.
33. Pierrat V, Duquennoy C, van Haastert IC et al. Ultrasound diagnosis and neurodevelopmental outcome of localised and extensive cystic periventricular leucomalacia. Arch Dis Child Fetal and Neonatal Ed 2001; 84(3): 151–156.
34. Kinnala A, Rikalainen H, Lapinleimu H et al. Cerebral magnetic resonance imaging and ultrasonography findings after neonatal hypoglycemia. Pediatrics 1999; 103(4 Pt 1): 724–729.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2019 Číslo 2
-
Všechny články tohoto čísla
- Intradurálne extramedulárne nádory chrbtice
- Roztroušená skleróza mozkomíšní, úloha střevní mikrobioty v poškozujícím zánětu
- Genetické a neurobiologické aspekty komorbidního výskytu poruch autistického spektra a epilepsie
- Roztroušená skleróza a těhotenství z pohledu gynekologa – možnosti asistované reprodukce
- Roztroušená skleróza mozkomíšní, těhotenství, mateřství a kojení
- Hraje leptin roli v rozvoji intrakraniálních meningeomů?
- Srovnávací studie pacientů s myastenií České a Slovenské republiky
- Moderní mikrochirurgie jako trvalé, bezpečné a šetrné řešení nekrvácejících mozkových výdutí
- Explantace stimulátoru nervus vagus odpovídající protokolu vyšetření magnetickou rezonancí
- Obecné pohyby a neurologický vývoj raného věku u dětí s novorozeneckou hypoglykemií
- Srovnání kosmetického efektu krátkého podélného a příčného kožního řezu při karotické endarterektomii
- Změny v obsahu esenciálních a stopových prvků v lidských degenerujících meziobratlových ploténkách nekorespondují s klinickým stavem pacientů
- Jak náhrada extracelulárního sodíku ovlivňuje distribuci rychlosti vedení periferním nervem u krysy
- Rychlá diagnostika chemokinu CXCL13 v mozkomíšním moku u pacientů s neuroboreliózou
- Aneuryzmatické subarachoidální krvácení v těhotenství – úspěšný kliping po selhání koilingu
- Extra-intrakraniální bypass iniciovaný rehabilitačním lékařem pro kognitivní deterioraci
- Traumatické pseudoaneuryzma arterie temporalis superficialis
- Klíšťová meningitida komplikovaná kardioembolickým intraluminálním trombem v krkavici a mozkovou mrtvicí
- Genetika nervosvalových onemocnění
- Analýza dat v neurologii LXXIV. - Neparametrický Spearmanův koeficient korelace
- Recenze knih
- Doc. Vladimír Škorpil, 100 let od narození zakladatele naší elektromyografie
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Intradurálne extramedulárne nádory chrbtice
- Rychlá diagnostika chemokinu CXCL13 v mozkomíšním moku u pacientů s neuroboreliózou
- Genetika nervosvalových onemocnění
- Roztroušená skleróza a těhotenství z pohledu gynekologa – možnosti asistované reprodukce
