Výběr vhodné operační techniky při léčbě nejčastější kraniosynostózy
Autoři:
J. Táborský 1; J. Táborská 1; M. Vaculík 1; K. Maratová 2; A. Kodýtková 2; V. Beneš 1; P. Libý 1
Vyšlo v časopise:
Cesk Slov Neurol N 2023; 86(5): 310-321
Kategorie:
Přehledný referát
doi:
https://doi.org/10.48095/cccsnn2023310
Souhrn
Sagitální synostóza je nejčastějším typem izolované kraniosynostózy. Vede k abnormálnímu tvaru lebky, který je nutné korigovat operačně. Jednotlivé operační techniky se postupně vyvinuly na základě historického a medicínského vývoje. Cílem naší práce je přiblížit principy, benefity a limitace světově nejčastěji používaných operačních technik. V současné době neexistuje univerzální operační technika vhodná pro všechna věková rozhraní a všechny typy skafocefalií. Estetické a funkční výsledky se liší v rámci operačních technik a jednotlivých pracovišť. Některé otevřené a minimálně invazivní techniky mají srovnatelné estetické výsledky. Volba operační techniky by měla probíhat individuálně u každého pacienta.
Klíčová slova:
endoskopie – kraniosynostóza – skafocefalie – operační techniky
Úvod
Sagitální synostóza je definována předčasným zánikem šípového švu. Lebka je úzká a protažená vlivem kompenzačního růstu v zachovaných švech. Vzniká tak dolichocefalický tvar lbi na podkladě sagitální synostózy, tzv. skafocefalie. Incidence této vrozené vývojové vady se pohybuje okolo 1 : 5 000, a představuje tak nejčastější typ izolované kraniosynostózy [1]. Onemocnění predominantně postihuje chlapce v poměru 4 : 1. Příčina sagitální synostózy není stále objasněna. U malé části pacientů se detekuje genetické pozadí [2].
Historický vývoj
První operace skafocefalie byla provedena Lannelonguem v Paříži v roce 1890 [3]. Operace spočívala ve vytvoření dvou kostních defektů v parietálních kostech rovnoběžných se srostlým sagitálním švem. Naopak Lane ze San Francisca zavedl techniku vytnutí srostlého sagitálního švu, tzv. strip kraniektomii [4]. V té době byla mortalita těchto operací vysoká, až 45 % [5]. V důsledku toho se od operativy na několik dekád upustilo. Až ve 40. letech 20. století došlo ke znovuobjevení strip kraniektomie Townem a Faberem. Mortalita již byla nízká. Důraz byl kladen na časování operace do 3 měsíců věku, protože právě u starších pacientů nebyly výsledky příznivé [6]. S pokroky v anesteziologii a zejména díky možnosti transfuze se v 60. letech 20. století začaly rozvíjet otevřené invazivní techniky. Jejich hlavní výhodou byly lepší estetické výsledky i u starších pacientů a nižší riziko recidivy skafocefalie. Na přelomu milénia se Jimenez et al. vrátili zpět ke strip kraniektomii, nicméně nyní pod hlavičkou minimálně invazivní endoskopicky asistované operativy doplněné o pooperační kraniální ortézu [7]. Totožnou techniku zavedli v česko-slovenské oblasti neurochirurgové z Fakultní nemocnice Ostrava v roce 2008 [8]. V současné době probíhají korekce skafocefalie pomocí různých technik na českých neurochirurgických pracovištích ve Fakultní nemocnici v Motole v Praze, ve Fakultních nemocnicích v Brně, v Ostravě, v Olomouci, v Plzni a Hradci Králové [8,9].
Patogeneze
Předčasný zánik švu vede k restrikci růstu kolmo na šev, jak již popsal Virchow v roce 1851 [10]. Podle místa předčasného srůstu a kompenzačního růstu lebky dělíme skafocefalie na několik typů. U zadní skafocefalie přítomné v 35 % případů zaniká nejprve dorzální část sagitálního švu před zadní fontanelou, to vede k charakteristickému okcipitálnímu vyklenutí. Přední část sagitálního švu zaniká ve 24 % případů a vede ke klenutému čelu. Kompletní forma skafocefalie je přítomná u 29 % pacientů a představuje nejtěžší formu vedoucí ke kombinaci klenutého čela a okcipitálního klenutí a zúžení lbi. Centrální typ přítomný u 13 % případů vede k mírné morfologické variantě [11]. V době diagnózy bývá srůst kompletní v 73 % a částečný ve 27 % případů [12]. U částečného srůstu lze uvažovat o vytnutí pouze srostlé části švu a zachovat funkční oblast [13].
Diagnostika
Zaniklý sagitální šev lze ve vyjádřených případech identifikovat pohmatem jako hranu v místě podezřelé synostózy. Ke stanovení diagnózy je většinou potřeba verifikace zkušeným antropologem. Použitím zobrazovacích metod lze nález objektivně potvrdit ultrasonografií, vyžaduje to však zkušeného ultrasonografistu [14]. Ve studii 102 neurochirurgů ze čtyř kontinentů od Doumita et al. je stále nejpoužívanější metodou vyšetření CT [15]. Sedm procent respondentů využívá CT při podezření na mnohočetné suturální patologie a 71 % využívá CT vždy, i při jasném klinickém nálezu. Radiační dávka z jednoho vyšetření CT mozku u pacientů pod jeden rok zvyšuje životní riziko na nádorové onemocnění o 0,07 % [16]. U vyšetření CT s cílem diagnostiky kraniosynostózy postačí zobrazení čistě kostní tkáně, a měly by proto být použity nízkodávkové protokoly snižující radiační dávku na jeden až dva mSv. U vyšetření CT břicha kojence dosahují dávky 20 mSv, jsou tedy 10–20× vyšší [17]. Nejnovější přístroje CT v nízkodávkovém protokolu dosahují dávek srovnatelných s dvěma až čtyřmi RTG vyšetření lebky v závislosti na množství detektorů v přístroji. Další výhodou vyšetření CT je zhodnocení tíže kompenzačního růstu lebky a plánování operační intervence, navíc u 3–6 % pacientů může být detekována mnohočetná suturální patologie [18,19]. Vyšetření CT je na našem pracovišti do rutinního diagnostického procesu zapojeno od roku 2021. Z 91 vyšetřovaných pacientů jsme u tří detekovali patentní sagitální šev při hyperdolichocefalickém tvaru a současně podezření na skafocefalii. Tato jednotka je označována jako sticky sagittal suture, operace není indikována a postačí kraniální remodelační ortéza [20]. Při použití speciálních sekvencí lze v diagnostice využít také vyšetření MR [21]. Vyšetření single photon emission computed tomografie (SPECT) poskytuje doplňující informace o perfuzi mozku a současně snímek CT zobrazí zaniklý šev. V případě těžkých forem skafocefalie či komplexních kraniosynostóz detekuje SPECT oblasti hypoperfuze mozku. Vyšetření tak může pomoci jak v indikaci k operaci, tak v pooperační kontrole, kdy dle autorů již po 3 měsících dochází k normalizaci [22–24]. Některá pracoviště využívají vyšetření SPECT v rutinní diagnostice.
Indikace
Indikace k operaci skafocefalie zahrnují zlepšení výsledného tvaru hlavy a profylaxi elevace nitrolebního tlaku a poruch učení. Právě z důvodu prevence funkčního postižení by měla být operace naplánována nejlépe před 6. měsícem věku [25–28], nejpozději však do 1. roku věku [29]. U pozdně diagnostikovaných pacientů může dojít k rozvoji nitrolební hypertenze, Chiariho malformace, otoku papil zrakových nervů až ke slepotě [6,30,31]. Renier et al. popsali zvýšený nitrolební tlak u 14 % pacientů se synostózou jednoho lebečního švu [32]. Dalším argumentem pro operaci je prevence psychosociálního znevýhodnění v dětském kolektivu v průběhu dospívání [33].
Časování operace a výběr nejlepší techniky, předoperační doporučení, prevence transfuze
Z hlediska psychomotorického vývoje by měla operace proběhnout časně od stanovení diagnózy [25–29]. Z estetického hlediska mají jednotlivé operační techniky lepší výsledky v přesných věkových intervalech (tab. 1) [19,31,34–45].
Typ operační techniky by měl být zvolen na základě tíže kompenzačních mechanizmů, nikoliv na základě lokalizace srostlého švu [46]. Další faktor úspěchu operace může být polohování pacienta na záhlaví nebo užití předoperační kraniální ortézy zlepšující předoperační cefalický index (CI). Dle studií lze získat polohováním až tři jednotky CI [47] a kraniální ortézou osm jednotek [48].
Podání krevní transfuze představuje komparativní parametr studií a faktor miniinvazivity. V době operace dochází postupně k přeměně fetálního hemoglobinu (Hb) na dospělý typ Hb a v krevním obraze detekujeme anemii. Bylo publikováno mnoho protokolů k prevenci podání krevních transfuzí. Např. subkutánní aplikace erytropoetinu v dávce 600 μm/kg/týden v kombinaci s perorální substitucí železa [49]. Problematikou se také zabývali neurochirurgové z FN Brno. Vytvořili předoperační protokol v roce 2007. Po krevních náběrech doporučují dle výsledků substituci aktiferrinem, pyridoxinem, kyselinou askorbovou, kyselinou listovou a případně erytropoetinem [9].
Chirurgické techniky
Přístup k řešení skafocefalie se mezi pracovištěmi značně liší. Doumit et al. se v průzkumné studii dotazovali chirurgů ze 14 zemí a čtyř kontinentů, jakou operační techniku by volili u pacienta se skafocefalií do 4 měsíců života. Z dotazovaných by 31 % volilo otevřenou operační techniku, 24 % by plánovalo otevřenou operaci na 6. měsíc života, 19 % by preferovalo endoskopicky asistovanou rozšířenou kraniektomii s pomocnými nástřihy, 16 % endoskopicky asistovanou strip kraniektomii a 10 % pružinovou techniku [15].
Otevřené operační techniky
Otevřené operační techniky jsou celosvětově stále více preferované než techniky minimálně invazivní. Celkem 55 %, resp. 81 % dotazovaných chirurgů využívá otevřené techniky [15,50]. Otevřené techniky vyžadují velkou kožní incizi, nejčastěji bikoronální, invazivní anesteziologické zajištění, zvýšenou potřebu krevních derivátů, delší dobu hospitalizace a pooperační podkožní drenáž [51,52]. Většina studií zaměřených na psychomotorický vývoj a nitrolební tlak prokazujících protektivní účinek byla popsána u otevřených technik a někteří chirurgové tento argument používají k ospravedlnění otevřené techniky. V současné době se však objevují studie podporující protektivní vlivy také u minimálně invazivních výkonů [53].
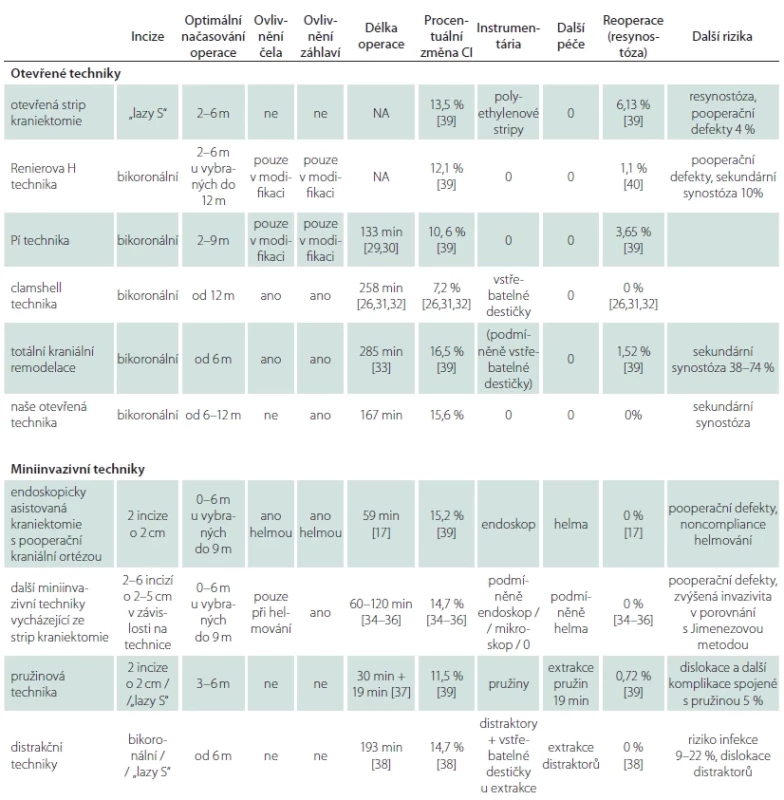
Otevřená strip kraniektomie
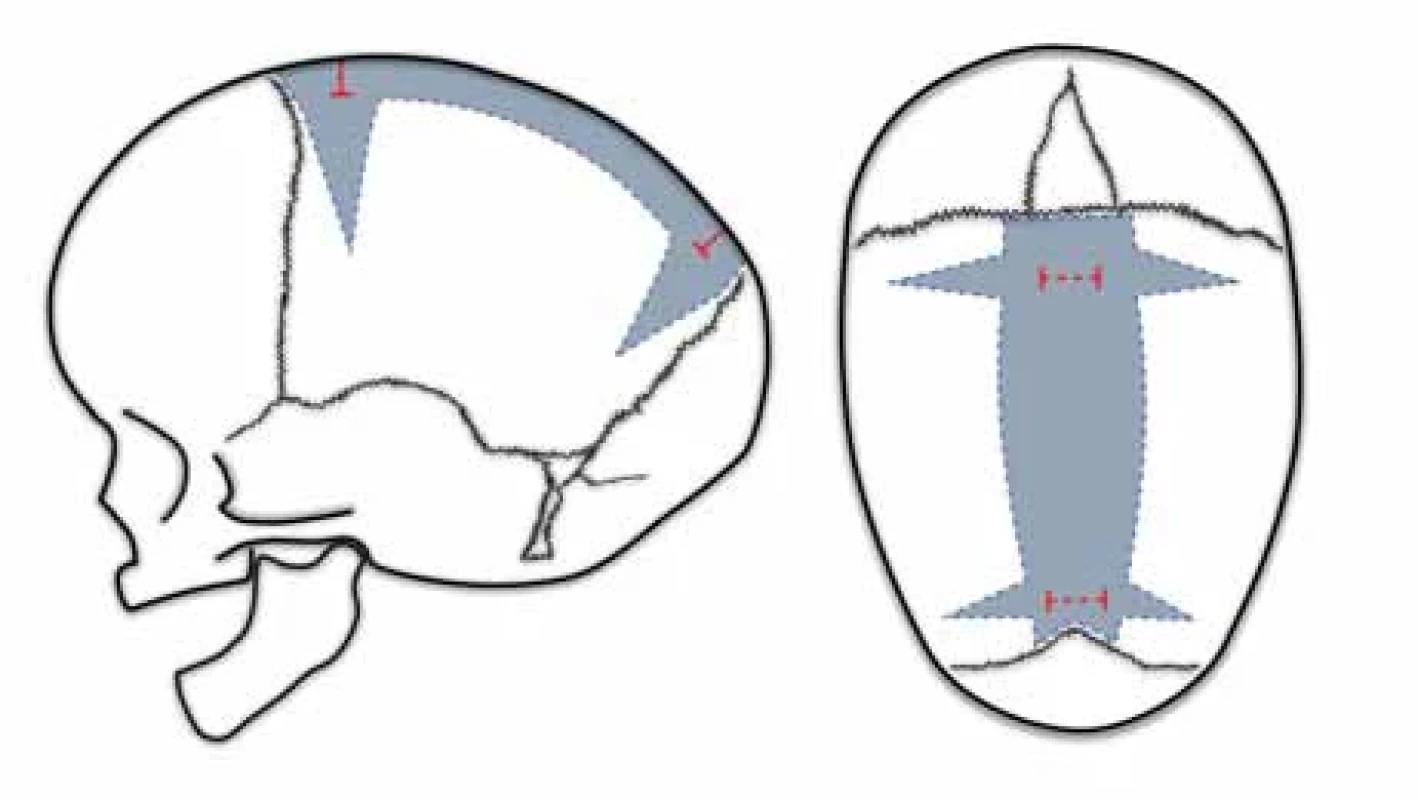
Laneova otevřená strip kraniektomie [4] představuje první korekční techniku skafocefalie. Ve 40. a 50. letech 20. století se stala bezpečnou a nejpoužívanější technikou vzhledem k pokrokům v transfuzní terapii. Vlastní operace se skládá z velkého kožního řezu nad sagitální synostózou a vytnutí kosti vč. srostlého švu o variabilní šíři 1–4 cm (obr. 1). Strip kraniektomie před 8. týdnem života vede k častějším resynostózám s recidivou dolichocefalie, proto se doporučuje operaci odložit na dobu dosažení 3 měsíců života [54,55].
Variantou strip kraniektomie je vytnutí úzkého pruhu kosti a vmezeření polyethylenových destiček s fixací na okraje parietálních kostí k prevenci resynostózy [56].
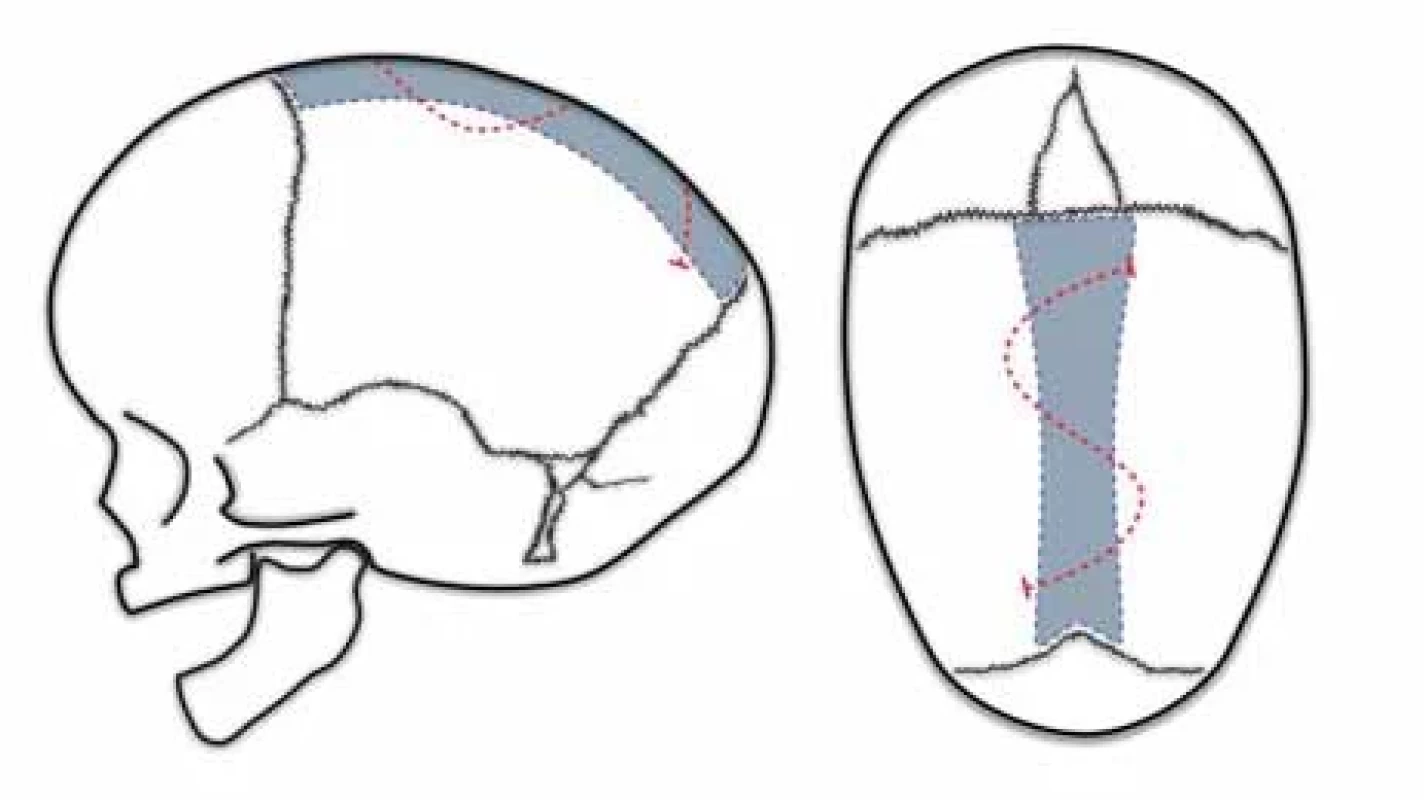
Renierova H technika
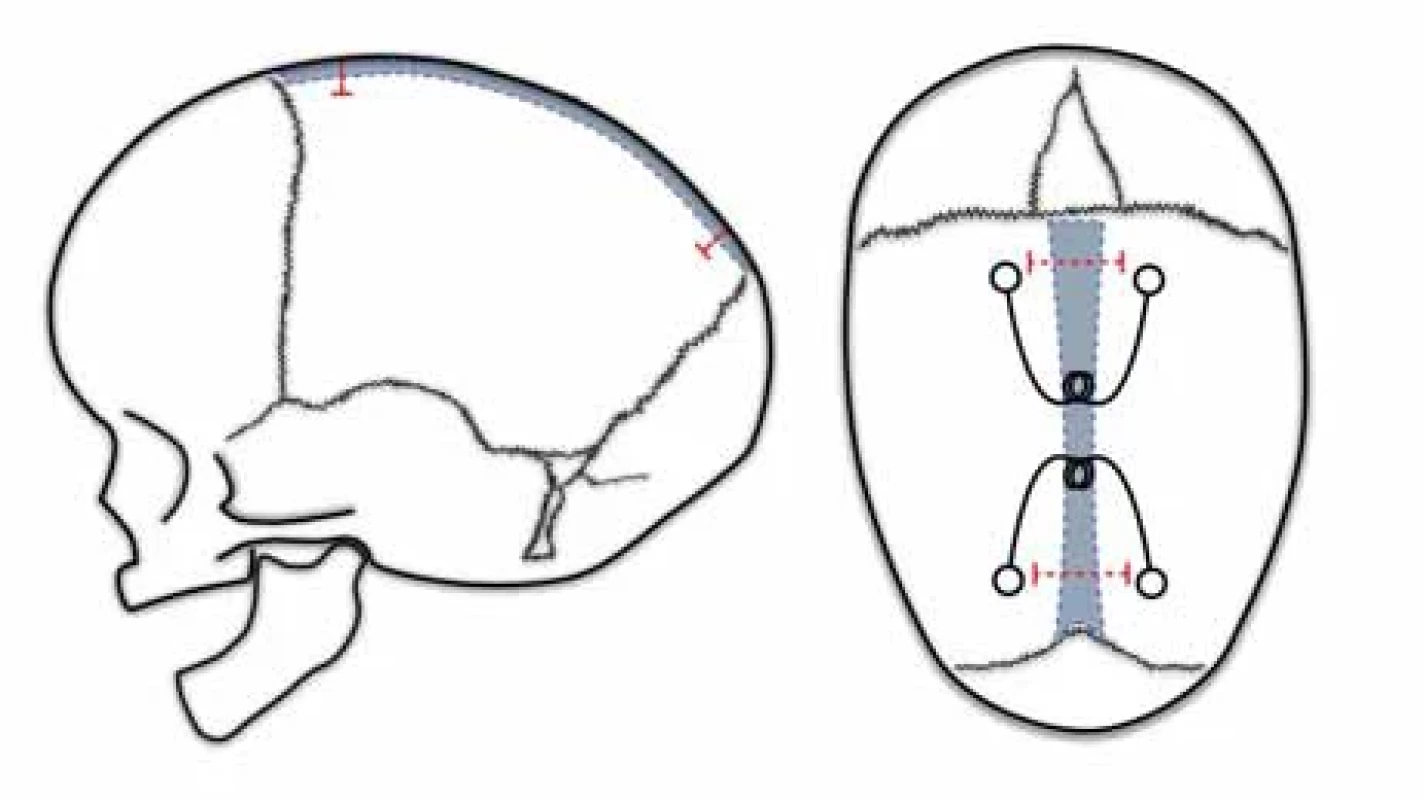
Renierova H technika byla popsána Marchacem a Renierem v Paříži v 80. letech 20. století. Brzy získala na popularitě díky své jednoduchosti a výborným estetickým výsledkům až v 85 % případů [57]. Technika spočívá v bikoronálním kožním řezu a vytnutí kosti nad sagitálním švem spolu s pruhovitým vytnutím parietální kosti za koronálním a před lambdovým švem do výsledného tvaru písmene H (obr. 2). Kostní ploténka ze sagitální kraniektomie se tvarově upraví, zkrátí a následně zafixuje stehem k tvrdé pleně. Autoři uvádí protektivní efekt na neurologický vývoj pacienta. Reoperace je nutná pouze u 1 % pacientů [30,45].
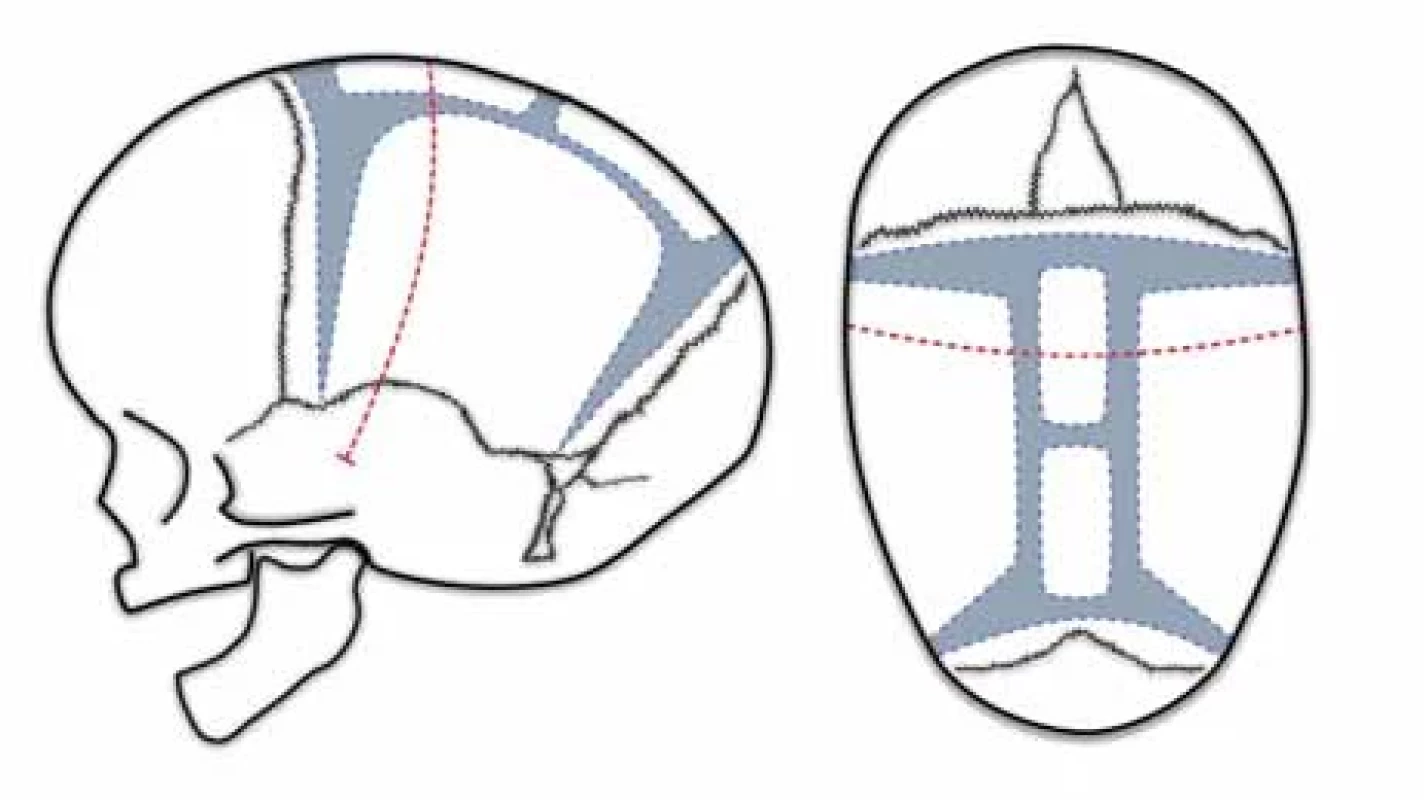
Pí technika
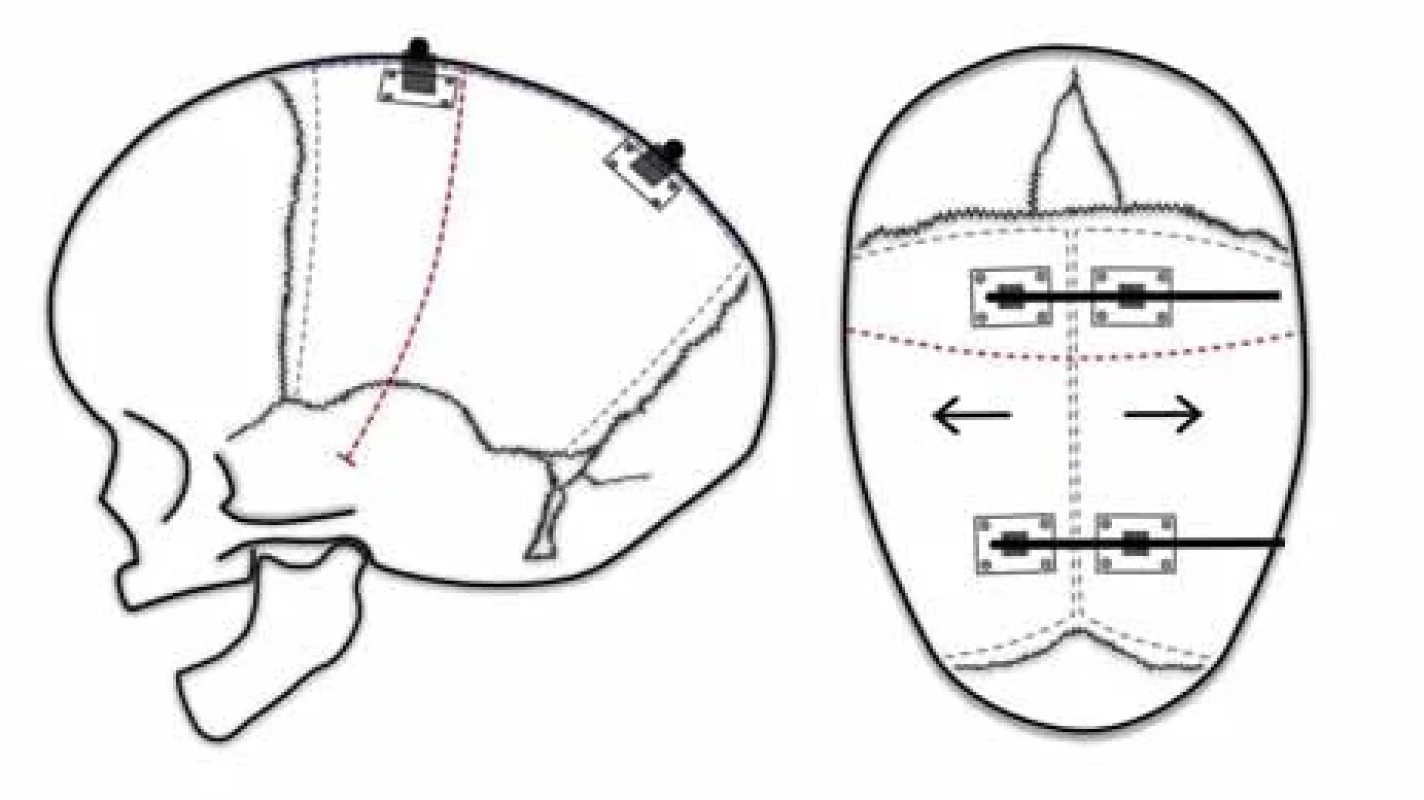
Pí technika byla popsána v roce 1978 [58]. Začíná opět bikoronálním kožním řezem a vytnutím kostní ploténky v obou parietálních kostech v celém průběhu za koronálním švem. Zbylá část sagitálního švu zůstává zachována. Naopak se vytínají dva pruhy kosti paralelně se srostlým sagitálním švem do výsledného řeckého písmene π (obr. 3). Zachovaný sagitální šev je možné přitáhnout stehem k frontální kostní ploténce, a tím lze lebku předozadně zkrátit. V závislosti na aktivním zkrácení Jane et al. techniku označili jako squeeze technique [59]. Tento manévr sekundárně rozšíří biparietální rozměr. Z obav komprese mozku byly provedeny studie s perioperační monitorací intraventrikulárního tlaku. Zkrácení předozadní délky lbi do jednoho centimetru se prokázalo jako bezpečné [60]. Výsledky jsou excelentní u 53 %, dobré u 43 % a slabé u 4 % případů. Slabé výsledky jsou častěji u pacientů mladších 8 týdnů. Ideální doba operace byla stanovena na rozmezí 3–6 měsíců [61,62].
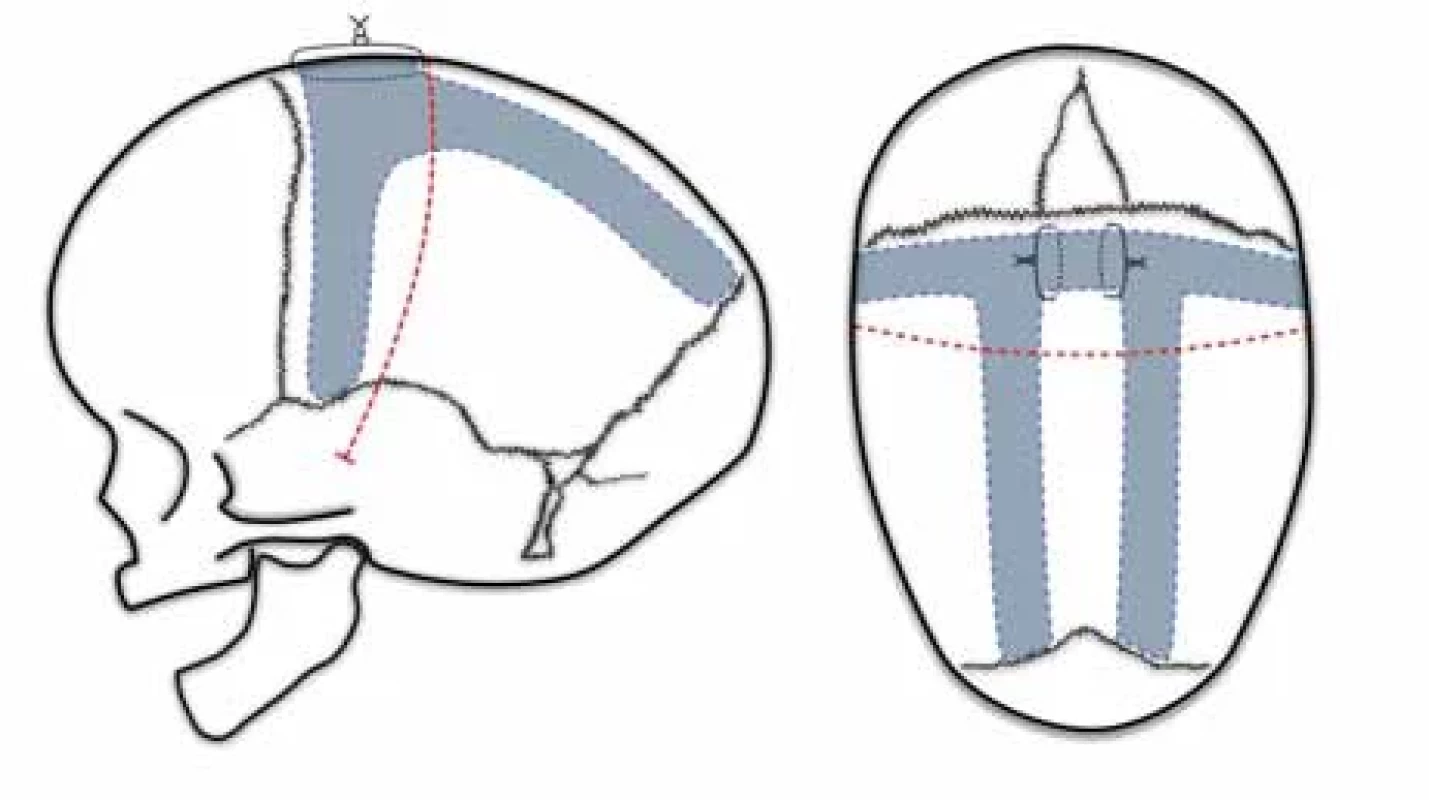
Naše modifikovaná kombinace Pí a H techniky
Prvně byla zavedena v roce 2015 v reakci na četné pooperační kostní defekty předešlé techniky. Po bikoronální kožní incizi, stažení kožních laloků a obnažení kalvy vč. periostu si genciánovou violetí vyznačíme kraniotomie (obr. 4). Podobně jako u Renierovy H techniky vytváříme nástřihy za koronálním a před lambdovým švem. Z Pí techniky zanecháváme synostotický sagitální šev a využíváme aktivní zkrácení předozadního rozměru. Navíc přidáváme paprskovité kraniotomie ve frontální a okcipitální kosti. Kostní ploténky modelujeme za použití Tessierových kleští. Výhodou naší techniky je snížené riziko vzniku kostních defektů. Jednotlivé kostní výběžky mají zachované cévní zásobení kosti alespoň z jedné strany a to podporuje osifikaci defektů. Technika je vhodná pro pacienty od 6 měsíců do 4 let věku. Pacienti starší 1 roku vyžadují fixaci kostí vstřebatelnými destičkami. Nevýhodou jsou nízká možnost ovlivnění klenutého čela a invazivita výkonu. Průměrná doba operace je 167 min. V našem souboru jsme naměřili průměrný CI před operací 68,8 a 79,5 po operaci. Na poslední kontrole, průměrně 3,7 let od operace, činil průměrný CI 77,1. Žádný pacient ze všech 68 operovaných nevyžadoval reoperaci.
Clamshell technika
Operace začíná bikoronální incizí, stažením frontálního a okcipitálního kožního laloku s obnažením lebky. Nejprve se provede bifrontální kraniotomie s přední remodelací frontálních kostí jako při komplexní kraniální remodelaci. Následně kraniotomie nad sagitální synostózou tak, že se část sagitálního hřebínku ponechává střídavě na pravé nebo levé parietální kosti. Tím vznikne vzorec rozevírající se mušle. Po odloučení od tvrdé pleny mozkové se kostní ploténky rozevřou laterálně na pantu skvamózního švu (obr. 5). Fixace stehy nebo vstřebatelnými destičkami je zásadní k prevenci návratu parietálních plotének do původního stavu. Technika je vhodná pro pozdně diagnostikované případy skafocefalie, kde kosti nejsou tak poddajné. Autoři užívající clamshell techniku uvádějí průměrné věky při operaci 1,8 let [31], 4,2 let [37] a 4,9 let [36]. Relativní náročnosti kostní remodelace odpovídá délka operace 2,4–5,4 h [31,36,37]. Operací lze získat 3,7–5,7 kraniálních jednotek [31,37]. Rottgers et al. uvádí pozitivní ovlivnění nitrolebního tlaku u pěti ze šesti pacientů [31].
Totální kraniální remodelace
Totální kraniální remodelace představuje nejinvazivnější operační metodu. Technika spočívá v kompletním obnažení kalvy, vytvoření mnohočetných kraniektomií a přesunech kostních plotének. Na rozdíl od H a Pí techniky cíleněji ovlivňuje tvarové deformity vzniklé kompenzačními růstovými mechanizmy a vzhledem k menším pooperačním kostním defektům je vhodná i pro pacienty starší jednoho roku. Operace mohou být jednodobé nebo dvoudobé. Příkladem jednodobého výkonu je metoda z Melbourne publikovaná Greensmithem et al. v roce 2008. Po obnažení kalvy se provedou mnohočetné kraniektomie. Frontální kostní ploténka s intaktním koronálním švem se mimo tělo pacienta upraví osteotomiemi a modelují tak, aby se zmenšila klenutost čela. Za koronálním švem se vytne pruh kosti o rozměru 3–4 cm a poté je přesunut kaudálně pod odloučenou okcipitální kostní ploténku. Parietální kostní ploténky se otočí o 180° a přesunou na opačnou stranu. Všechny kostní ploténky jsou k sobě fixovány resorbovatelnými destičkami a kostními stehy (obr. 6). Průměrná délka operace činí 4,75 h. Zisk CI je v průměru 12,9 jednotek [38].
Miniinvazivní techniky – úvod
Z výše zmíněné historie jsou to právě miniinvazivní metody, které se snaží překonat historicky zakořeněné otevřené techniky. Základní výhodu představuje menší operační zátěž pacienta. Operační časy jsou kratší, krevní ztráty jsou nižší. Délka hospitalizace a náklady na zdravotní péči klesají [52]. Pro rodinu představuje výhodu časnější řešení, a naopak limitem je věková hranice pro provedení miniivazivní techniky většinou okolo 6. měsíce věku dítěte. Důvodem je faktor poddajnosti kostí krania a využití dynamického období růstu lebky. Nevýhodou některých technik je delší závislost na pooperační helmě nebo potřeba druhé operace s cílem extrakce instrumentária.
Endoskopicky asistovaná kraniektomie s pooperační kraniální ortézou
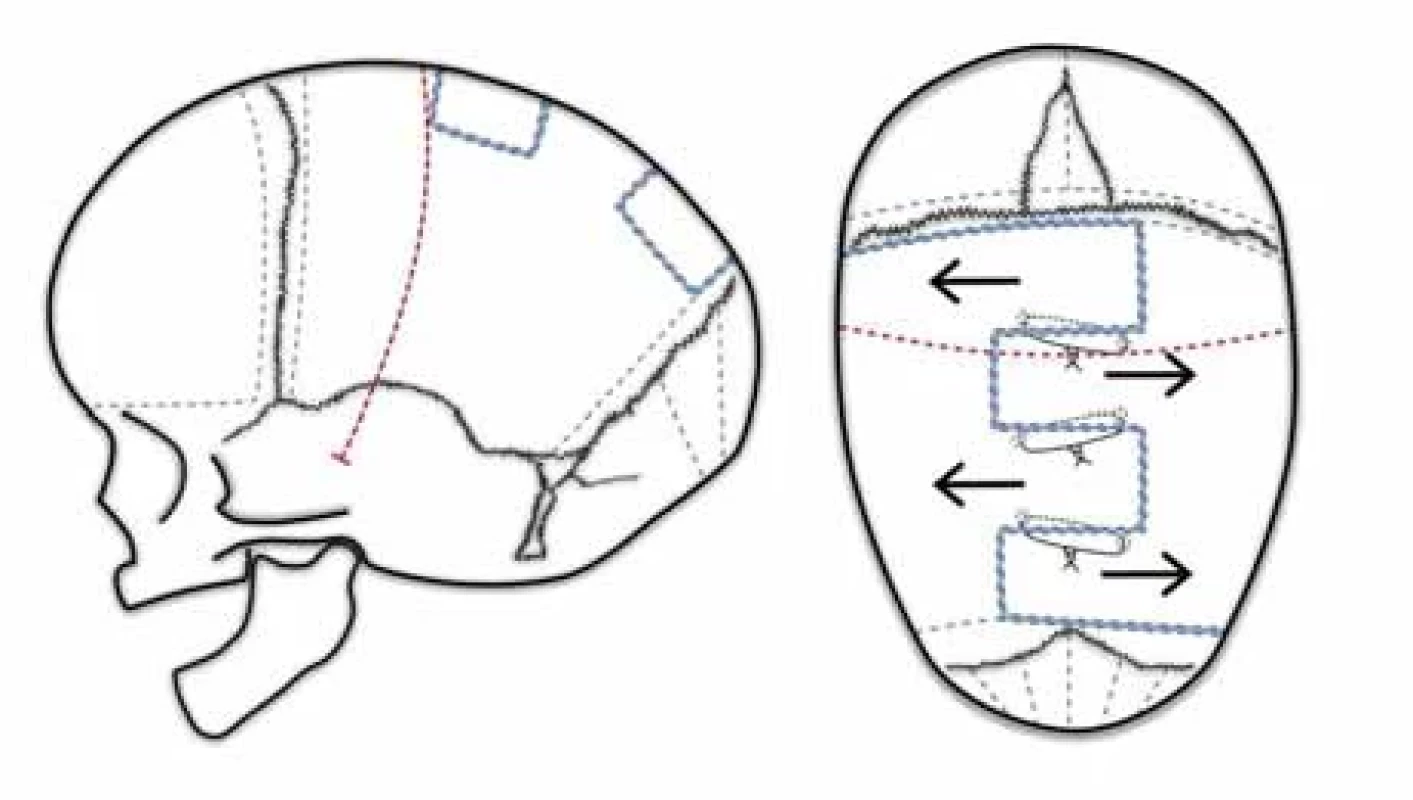
Jimenez a Barone poprvé popsali metodu na čtyřech pacientech v roce 1998 [7]. Následně techniku dále rozvíjeli. V roce 2004 zahrnoval publikovaný soubor již 139 pacientů s průměrným věkem 3,6 měsíce. Výsledky byly u 87 % pacientů excelentní, u 9 % dobré a pouze u 4 % slabé [19,63]. Metoda pak získala popularitu celosvětově. U nás byla metoda poprvé použita v Ostravě [8]. Metoda je určena pro pacienty do 6 měsíců věku, respektive do 9 měsíců věku při absenci těžkých kompenzačních projevů [63]. Operační technika spočívá ve dvou kožních řezech o délce 2 cm. První lokalizovaný za bregmou a druhý před lambdou. Preparace probíhá subgaleálně s návrty v parietálních kostech a uvolněním pleny pod endoskopickou kontrolou. Osteotomie parietálních kostí se provádí speciálními, tzv. kostními nůžkami. Vzniká pruhovitá sagitální kraniektomie o průměrné šíři 5,4 cm [7,19]. Další pomocné nástřihy tvaru písmene „V“ se provádí kolmo na sagitální kraniektomii v parietálních kostech vpředu a vzadu (obr. 7). Krvácení z okrajů kosti autoři zastavují instrumentáriem s integrovanou monopolární koagulací pod endoskopickou kontrolou. Krevní ztráty dosáhly v průměru 27 ml a pouze 7 % pacientů vyžadovalo podání krevní transfuze po dobu hospitalizace [63]. Průměrná délka operace byla 57 min [63]. Výsledný tvar hlavy je podmíněn kraniální remodelační ortézou. Délka nošení kraniální ortézy se pohybuje od 3 do 12 měsíců [7]. Během této doby pacient potřebuje 2–4 nové ortézy z důvodu rychlého růstu hlavy u kojenců [63,64]. Helmování lze rozdělit do tří fází. Během první fáze trvající 1–2 měsíce se normalizuje CI. Druhá fáze trvající 1–3 měsíce je za účelem překorigování. Poslední fáze je udržovací [19].
Další miniinvazivní techniky vycházející ze strip kraniektomie
Další autoři modifikovali miniinvazivní techniku přidáním kožních incizí, rozsahem osteoektomií, nebo dokonce eliminací endoskopické asistence [40,41,57,65]. Bude o nich více zmíněno v diskuzi.
Pružinová technika
Pružinová technika byla prvně popsána Lauritzenem ze Švédska v roce 1998 [66]. Technika spočívá v úzké sagitální synostektomii z řezu nad vertexem. Do návrtů v parietálních kostech se umístí jedna až tři pružiny (obr. 8). Expanze kalvy laterálně trvá v 90 % 2 týdny [47,67]. Technika vyžaduje určitou šíři kosti z hlediska poddajnosti, efektivní změny CI, prevenci dislokace pružiny. Operace je proto plánována na období 3–6 měsíců věku. V předoperačním období signifikantně zlepšuje CI polohování nebo předoperační kraniální ortéza [47,67]. Výsledné CI v průměru dosahují téměř spodní hranice normocefalie (73,7–74,4) [67,68], v dlouhodobém trendu 3 let však index postupně klesá o jednu až dvě jednotky [42] a většina pacientů končí v pásmu dolichocefalie. Z výhod pružinové techniky můžeme vyzvednout právě užívání expanzivních sil, kdy mozek nepodléhá žádné restrikci nebo kontrakci. Komplikací pružin mohou být durální píštěle, trhliny v sagitální splavu, dislokace pružin (ve 3 %), dekubitus nad pružinou (ve 2 %) [69,70]. Celkové riziko komplikací se nakonec pohybuje okolo 5 % [70]. Pružiny se odstraňují za 4,2–7 měsíců [70,71]. Délka operace se pohybuje v 79 % do 1 h [42]. Laurizen et al. publikovali obtížnou extrakci pružin až v 7 % [70]. Metoda neovlivní existující deformity, jako jsou klenuté čelo nebo okcipitální klenutí [42]. Ve srovnávací studii od Skolnicka dosahovala pružinová metoda oproti endoskopicky asistované strip kraniektomii signifikantně slabších pooperačních výsledků CI 74,3 vs. 77,0 [72]. Horší estetické výsledky, nízká distribuce pružin a nutnost sekundární operace jsou nejspíše příčiny nízké popularity pružinové techniky.
Distrakční techniky
První zmínku o použití distraktorů u pacientů s kraniosynostózou jsme nalezli v publikaci od Sugawary et al. z roku 1998. Distraktory použil u dvou pacientů s Crouzonovým syndromem a také u jednoho pacienta se skafocefalií. Operace spočívá ve velké kožní incizi nad vertexem, šetrné kraniotomii bez odloučení dury, přišroubování distraktorů ke kosti a vyvedení skrz kůži ven (obr. 9). Následná distrakce 1 mm za den do požadovaného finálního tvaru hlavy začíná několik dní po výkonu [73]. Další autoři popisují kombinované použití laterální distrakce a předozadní komprese u těžších forem skafocefalie [74,75]. Odstranění distraktorů většinou probíhá 2–3 měsíce od zavedení. Dokumentované zisky kraniálního indexu touto metodou se pohybují ze 68 jednotek do pásma normocefalie se 78 jednotkami se signifikantním zlepšením psychomotorického vývoje [75]. Sakamoto et al. dokonce demonstrovali srovnatelné estetické výsledky při porovnání s totální kraniální remodelací [43]. Tak jako u pružin je i zde potřeba druhé operace k odstranění distraktorů. Zároveň se při extrakci mohou implantovat vstřebatelné destičky zabraňující kolapsu dosaženého tvaru hlavy [76]. Transkutánní distraktory představují riziko pro šíření infekce pohybující se až mezi 9 a 22 %. Potenciálním rizikem jsou podobně jako u pružinových systémů durální trhliny a uvolnění distraktorů, obzvláště při nedostatečné tloušťce kosti [77–79].
Diskuze
Vývoj a popularita jednotlivých technik byla a je formována historickým pozadím. Nejprve pokroky v perioperační péči umožnily rozvoj invazivních operačních technik s předvídatelnějšími a lepšími estetickými výsledky [80]. Od otevřené strip kraniektomie se postupně začalo upouštět. Při srovnání s totální kraniální remodelací dosahuje signifikantně slabších estetických výsledků s rozdílem 3,4 cefalických jednotek [80]. Podobné výsledky také potvrzují Brichtová et al. z brněnské neurochirurgie [9]. Již v 90. letech 20. století nebyla strip kraniektomie doporučována u pacientů starších 18 měsíců [33]. V současné době ustupuje do pozadí, nicméně v průzkumné studii Di Rocca stále 27,5 % chirurgů používalo strip kraniektomii nebo její modifikaci jako hlavní techniku [50,81].
Chirurgické obory inklinují obecně k minimální invazivitě, která by měla přinést nižší operační zátěž pacienta. A tak po ovládnutí invazivních technik a vzestupu technologií převládl na přelomu milénia příklon k minimální invazivitě s rozvojem technicky náročnějších výkonů. Širší zapojení a vývoj endoskopů a instrumentárií, objevení distraktorů a pružin, vývoj materiálů, jako jsou např. vstřebatelné destičky, individuálně zhotovené kraniální ortézy, to vše otevřelo nové možnosti. Obzvláště endoskopicky asistované operace se staly rozšířenými napříč světovými pracovištěmi [7,82].
John A. Jane již v 70. letech 20. století zdůrazňoval důležitost korekce kompenzačních růstů lebky. Je třeba pracovat s faktem, že existuje více forem skafocefalií a není jedna univerzální operace, která vyřeší všechny varianty [83]. Většinou dominuje klenuté čelo nebo klenutí a zúžení lbi parieto-okcipitálně, případně kombinace. Dle dominantní deformity lze cílit na frontální či okcipitální kostní ploténku a tomu přizpůsobit operační techniku. Rozmanitost nálezů vedla k modifikacím jednotlivých technik [84]. Příkladem může být zmíněná reverzní Pí technika při zadní skafocefalii nebo také námi publikovaná modifikace s parieto-okcipitálními osteoektomiemi korigujícími zadní kranium [41]. Endoskopicky asistovaná strip kraniektomie s následnou kraniální ortézou dokáže signifikantně ovlivnit kompenzační růst lebky. Správně vyrobená a funkční kraniální ortéza dokáže ovlivnit všechny kompenzační deformity, převážně díky nízkému věku dítěte, poddajné kostní ploténce a rychlému růstu lebky. Naopak pružinová technika kompenzační růsty zcela neovlivňuje [42].
Věk dítěte má podstatný vliv na volbu operační techniky. Minimálně invazivní techniky jsou vhodné pro pacienty do věku 6–9 měsíců. Později již výsledky nebývají esteticky uspokojivé pro vyzrávání diploe a zpomalení růstu lebky [63]. Věkové minimum není jasně dáno. U endoskopicky asistované strip kraniektomie lze operovat i 2týdenní novorozence [7]. U pružinových a distrakčních technik se doporučuje vyšší věk pro potřebu uchycení instrumentária ke kostní ploténce. Tenká kost by mohla vést k uvolnění instrumentária. U pružinových technik je uvolnění publikováno ve 3 % případů i přes dodržení věkového intervalu [69].
Otevřené operační techniky je lepší provádět ve vyšším věku pro vyšší krevní ztráty a manipulaci s kostními ploténkami. Nejčastěji je preferovaných 6 měsíců věku a váha okolo 6 kg. Na našem pracovišti techniky nejsou vnímány jako konkurenční, ale jednoznačně se doplňují. Od zavedení minimálně invazivní endoskopicky asistované operace v roce 2017 na našem pracovišti nastal dramatický posun v indikačních přístupech a převládla minimálně invazivní operativa. Na druhou stranu stále přichází pacienti se skafocefalií, kteří byli diagnostikováni pozdě, a metodou volby je u nich otevřená remodelace. Vzhledem k pokrokům v operativě, technickému zázemí, neuroanestezii a perioperační péči se otevřená operativa maximálně přibližuje k minimálně invazivní technice, navíc s výhodou okamžité remodelace lbi. Rodičům lze tedy nabídnout pozitivní pohled na situaci i při relativně pozdějším záchytu skafocefalie. Mimořádnou kategorií jsou případy pacientů nad 1, 2 nebo i 4 roky věku, někdy označované jako pozdní skafocefalie. V těchto případech pacient profituje z invazivních operačních technik, jako jsou clamshell technika či totální kraniální remodelace [31, 36–38]. U těchto pozdních záchytů situaci ztěžují nepoddajná kostní ploténka, zpomalený růst lebky a snížená regenerace kostních defektů. V prevenci pooperačních defektů se standardně používají rozdělení kosti v diploe nad dvě kostní ploténky s překrytím defektu, vmezeření kostního prachu a hoblin do místa defektů nebo použití hydroxyapatitových náhrad [31,85].
Minimálně invazivní metody jsou založené na iatrogrenním vytváření kostních defektů. Příliš velké defekty nemusí osifikovat s případnou nutností reoperace. Na druhou stranu úzké osteoektomie mohou vést k resynostóze a recidivě dolichocefalie. V problematice nepanuje jednotný názor. Někteří autoři vytváří defekty o průměrné šíři 5,4 cm a délce 10 cm a o perzistujících defektech se nezmiňují. Z obavy o zhojení defektu někteří autoři vytínají užší pruh kosti o šíři dvou centimetrů [51,86]. Jiní autoři vytínají defekty 4 cm široké, ale vrací centimetrový pruh kostní ploténky nad sagitální splav [87]. Jako příčina defektů u kraniektomií se udává pulzace dury znemožňující osifikaci [85].
Dalším zajímavým tématem jsou pomocné laterální osteoektomie v parietální kosti u Jimenezovy metody. V případě takových částečných nástřihů řada autorů neprokázala efekt, navíc vedly k prodloužení operace [86,88,89]. Naopak jiné studie pomocné nástřihy obhajují a udávají zisk 5 CI [18]. V současné době na našem pracovišti probíhá studie využívající 3D modelování ke stanovení významu rozsahu laterálních nástřihů.
Další autoři se zaměřili na dobu nošení kraniální ortézy. Iyer et al. poukazují na neefektivnost helmování po 8,4 měsíce [90]. Nguyen et al. doporučují 8 měsíců [91], Ridgway et al. 7,5 měsíce, respektive helmu odkládají pacienti, kteří dosáhnou 80 jednotek CI [86]. Někteří autoři poukazují na zajímavý fakt, že estetický výsledek je více závislý na zkušenostech ortotika než na zkušenostech chirurga [91,92]. S tím souhlasí Jimenez et al. a upozorňují na nesprávně zhotovenou helmu, nízkou compliance v nošení kraniální ortézy (až u 17,1 % pacientů) a úzkou sagitální synostektomii jako hlavní příčiny špatných výsledků [19,93].
Zkrácení délky nošení helmy lze docílit rozšířenými technikami. Námi publikovaný článek dokládal snížení potřeby kraniální ortézy na 1,5 měsíce (P25 : 1, P75 : 2 měsíce) při prodloužení parietálních a přidání dvou okcipitálních nástřihů [41]. Někteří autoři vynechávají pooperační kraniální ortézu úplně. Rozšířením endoskopické strip kraniektomie se totiž přibližujeme otevřeným remodelačním technikám z malých kožních řezů. Mutchnick et al. přidali k strip kraniektomii 3–4 parietální nástřihy vedoucí až ke skvamóznímu švu ze tří krátkých kožních řezů. V případě okcipitálního klenutí přidávají další dva nástřihy v okcipitální kosti paralelně se sagitálním splavem. Udávají zisk z 69 na 79 cefalických jednotek [40]. Massimi et al. využívají až šesti malých kožních řezů. Technika se podobá otevřené Renierově H metodě. Sagitální strip vytínají v šíři 3–4 cm a bočné kraniektomie 1–2 cm. Kraniektomie jsou ohraničeny vždy z jedné strany koronálním nebo lambdovým švem. V případě okcipitálního klenutí přidávají zadní nástřihy [39].
V posledních letech se objevují studie na pooperační sekundární synostózy. Důvod zániku předoperačně funkčního švu není znám. Seruya et al. publikovali riziko sekundární synostózy u pacientů po totální kraniální remodelaci 42,6 %, 38,3 %, 74,5 % a 74,5 % pro pravý koronální, levý koronální, pravý lambdový a levý lambdový šev [94]. Arnaud et al. stanovili výskyt sekundární koronální synostózy u 10 % operovaných pacientů Renierovou H technikou, z toho 1 % vyžadovalo další chirurgické řešení [95]. Příčinou sekundární synostózy by mohla být ztráta cévního zásobení způsobená odloučením švu během operace, to vysvětluje vyšší výskyt u invazivních operačních technik. Na druhou stranu při speciální technice, kde autoři odstraňují funkční koronální i lambdový šev, jsou v 56 % přítomné koronální a v 86 % lambdové švy na kontrolním vyšetření CT [96]. Dále umístění švu do mrtvého prostoru při Melbourne technice by vysvětlovalo vyšší riziko zániku lambdového švu. Rottgers et al. popsali kazuistiku sekundární synostózy i u neoperovaného pacienta. To poukazuje na genetické pozadí jako jeden z faktorů [31].
Druhá strana problematiky je formace nového švu po vytnutí srostlého švu. Agrawal et al. vytvářeli u otevřených strip kraniektomií defekty v místě sagitální synostózy o rozměru 1,5–2,5 cm a na kontrolním RTG vyšetření s jedno - až dvouletým odstupem detekovali nový šev v 16,7 % případů, zbylí pacienti měli defekt kompletně zarostlý [97]. Neogeneze švu není objasněna. Sauerhammer et al. pozorovali kompletní formaci nového švu v 17,6 % případů u pacientů po operaci koronální synostózy. Dále v 70,6 % se jednalo o částečnou formaci v kombinaci s drobnými kostními defekty. U zbylých pacientů došlo k resynostóze. To bylo spojeno se slabšími estetickým výsledky operace [98]. V některých případech nový šev vzniká dokonce mimo místo původního uložení [99]. Jako vysvětlení neogenze švu se nabízejí vliv mechanických sil, pulzace dury či genetické pozadí [85]. Další studie k objasnění tohoto fenoménu jsou ale potřeba.
Výsledkům jednotlivých technik a jejich srovnání se věnovala celá řada studií. Při porovnání otevřené kraniální remodelace s otevřenou strip kraniektomií vykazuje kraniální remodelace lepší estetické výsledky [55,100,101], dokonce až dvojnásobně [102], lepší kognitivní výsledky u pacientů pod 6 měsíců věku [25] a nižší riziko zvýšeného nitrolebního tlaku po operaci [103]. Jedinou výhodou otevřené strip kraniektomie je kratší doba operace [101].
Endoskopicky asistovaná strip kraniektomie přináší výhody méně invazivní operační techniky v porovnání s otevřenou kraniální remodelací, jako jsou menší krevní ztráty a potřeba krevních transfuzí, kratší doba hospitalizace a kratší operační časy [52]. Méně jednoznačné jsou kosmetické výsledky [52,104]. Většina autorů uvádí srovnatelné kosmetické výsledky [105,106]. Komplikace se objevují srovnatelně nebo méně u endoskopicky asistovaných operací [52].
Obecně u operací kraniosynostóz by podávání krevních derivátů nemělo být příliš restriktivní, jelikož nejčastější příčinou perioperační mortality je právě hemoragický šok [55,107]. Hranice pro podání transfuze se liší podle pracoviště a pohybuje se od hodnoty Hb 60 do 80 g/l. Celkem 44 % respondentů podává transfuze u 90 % pacientů [50].
Závěr
Operační možnosti korekce skafocefalie jsou rozmanité a mezi specialisty stále diskutované. V současné době neexistuje univerzální operační technika. Volba závisí na více faktorech, jako jsou věk dítěte, přítomnost a tíže kompenzačních deformit lebky, na zkušenostech a vybavenosti pracoviště. Estetické a funkční výsledky se liší v rámci operačních technik, ale také v rámci jednotlivých pracovišť. Jednotlivé techniky nejsou konkurenční, ale komplementární a volba by měla být zvolena individuálně pro každého pacienta.
Konflikt zájmů
Autoři prohlašuji, že nemají konflikt zájmů v souvislosti s tématem práce.
Finanční podpora
Výzkum byl podpořen Grantovou agenturou Univerzity Karlovy (projekt č. 32122).
MUDr. Jakub Táborský
Neurochirurgická klinika
dětí a dospělých
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha
e-mail: jakub.taborsky@fnmotol.cz
Přijato k recenzi: 1. 6. 2023
Přijato do tisku: 3. 10. 2023
Zdroje
1. Lajeunie E, Le Merrer M, Bonaiti-Pellie C et al. Genetic study of scaphocephaly. Am J Med Genet 1996; 62 (3): 282–285. doi: 10.1002/ (SICI) 1096-8628 (19960329) 62 : 3< 282:: AID-AJMG15>3.0.CO; 2-G.
2. Hunter AG, Rudd NL. Craniosynostosis. I. Sagittal synostosis: its genetics and associated clinical findings in 214 patients who lacked involvement of the coronal suture (s). Teratology 1976; 14 (2): 185–193. doi: 10.1002/ tera.1420140209.
3. Lannelongue M. De la craniectomie dans la microcéphalie. Compt Rend Seances Acad Sci. 1890; 50 : 1382–1385.
4. Lane LC. Pioneer craniectomy for relief of mental imbecility due to premature sutural closure and microcephalus. JAMA 1892; 267 : 230.
5. Jacobi A. Non nocere. Med Rec 1894; 45 : 609–618.
6. Faber HK. Lannelongue-lane operation and scaphocephaly. J Pediatr 1962; 60 : 470. doi: 10.1016/s0022-3476 (62) 80076-6.
7. Jimenez DF, Barone CM. Endoscopic craniectomy for early surgical correction of sagittal craniosynostosis. J Neurosurg 1998; 88 (1): 77–81. doi: 10.3171/jns.1998. 88.1.0077.
8. Nowaková M, Kordoš P, Hladík M et al. Endoskopické operační řešení kraniosynostóz z pohledu dětského intenzivisty. Pediatr Praxi 2015; 16 (5): 308–311.
9. Brichtova E, Mackerle Z. Léčba kraniosynostóz remodelační technikou. Cesk Slov Neurol N 2011; 74/107 (2): 168–174.
10. Virchow R. Über Cretinismus, namentlich in Fran - ken, und über pathologische Schädelformen. Verh Phys Med Ges 1851; 2 (15–17): 891–939.
11. David L, Glazier S, Pyle J et al. Classification system for sagittal craniosynostosis. J Craniofac Surg 2009; 20 (2): 279–282.
12. Boyajian MK, Al-Samkari H, Nguyen DC et al. Partial suture fusion in nonsyndromic single-suture craniosynostosis. Cleft Palate Craniofac J 2020; 57 (4): 499–505. doi: 10.1177/1055665620902299.
13. Lobb DC, Patel SK, Pan BS et al. Partial suturectomy for phenotypical craniosynostosis caused by incomplete fusion of cranial sutures: a novel surgical solution. Neurosurg Focus 2021; 50 (4): E6. doi: 10.3171/2021.1. FOCUS201024.
14. Pogliani L, Zuccotti GV, Furlanetto M et al. Cranial ultrasound is a reliable first step imaging in children with suspected craniosynostosis. Childs Nerv Syst 2017; 33 (9): 1545–1552. doi: 10.1007/s00381-017-3449-3.
15. Doumit GD, Papay FA, Moores N et al. Management of sagittal synostosis: a solution to equipoise. J Craniofac Surg 2014; 25 (4): 1260–1265. doi: 10.1097/SCS.0b013 e3182a24635.
16. Brenner D, Elliston C, Hall E et al. Estimated risks of radiation-induced fatal cancer from pediatric CT. AJR Am J Roentgenol 2001; 176 (2): 289–296. doi: 10.2214/ajr.176.2.1760289.
17. Mardini S, Alsubaie S, Cayci C et al. Three-dimensional preoperative virtual planning and template use for surgical correction of craniosynostosis. J Plast Reconstr Aesthet Surg 2014; 67 (3): 336–343. doi: 10.1016/ j.bjps.2013.11.004.
18. Baker CM, Ravindra VM, Gociman B et al. Management of sagittal synostosis in the synostosis research group: baseline data and early outcomes. Neurosurg Focus 2021; 50 (4): E3. doi: 10.3171/2021.1.FOCUS201 029.
19. Jimenez DF, Barone CM, McGee ME et al. Endoscopy-assisted wide-vertex craniectomy, barrel stave osteotomies, and postoperative helmet molding therapy in the management of sagittal suture craniosynostosis. J Neurosurg 2004; 100 (5 Suppl): 407–417. doi: 10.3171/ped.2004.100.5.0407.
20. Baumgartner JE, Seymour-Dempsey K, Teichgraeber JF et al. Nonsynostotic scaphocephaly: the so-called sticky sagittal suture. J Neurosurg 2004; 101 (1 Suppl): 16–-20. doi: 10.3171/ped.2004.101.2.0016.
21. Eley KA, Watt-Smith SR, Sheerin F et al. “Black bone“ MRI: a potential alternative to ct with three-dimensional reconstruction of the craniofacial skeleton in the diagnosis of craniosynostosis. Eur Radiol 2014; 24 (10): 2417–2426. doi: 10.1007/s00330-014-3286-7.
22. Barik M, Bajpai M, Das RR et al. Role of 99mTc-ECD SPECT in the management of children with craniosynostosis. Biomed Res Int 2014; 2014 : 172646. doi: 10.1155/2014/172646.
23. Schaller BJ, Filis A, Merten HA et al. Premature craniosynostosis – the role of skull base surgery in its correction. A surgical and radiological experience of 172 operated infants/children. J Craniomaxillofac Surg 2012; 40 (3): 195–200. doi: 10.1016/j.jcms.2011.04.003.
24. Sen A, Dougal P, Padhy AK et al. Technetium-99m-HMPAO SPECT cerebral blood flow study in children with craniosynostosis. J Nucl Med 1995; 36 (3): 394–398.
25. Hashim PW, Patel A, Yang JF et al. The effects of whole-vault cranioplasty versus strip craniectomy on long-term neuropsychological outcomes in sagittal craniosynostosis. Plast Reconstr Surg 2014; 134 (3): 491–501. doi: 10.1097/PRS.0000000000000420.
26. Patel A, Yang JF, Hashim PW et al. The impact of age at surgery on long-term neuropsychological outcomes in sagittal craniosynostosis. Plast Reconstr Surg 2014; 134 (4): 608e–617e. doi: 10.1097/PRS.0000000000000 511.
27. Vinchon M, Guerreschi P, Karnoub MA et al. Morphological and surgical results in sagittal synostosis: early craniectomy versus later cranioplasty. Childs Nerv Syst 2021; 37 (7): 2335–2341. doi: 10.1007/s00381-021-05178-9.
28. Virtanen R, Korhonen T, Fagerholm J et al. Neurocognitive sequelae of scaphocephaly. Pediatrics 1999; 103 (4 Pt 1): 791–795. doi: 10.1542/peds.103.4.791.
29. Renier D, Arnaud E, Marchac D. Craniosynostosis: functional and morphologic postoperative results. Neurochirurgie 2006; 52 (2–3 Pt 2): 302–310. doi: 10.1016/s0028-3770 (06) 71223-1.
30. Arnaud E, Renier D, Marchac D. Prognosis for mental function in scaphocephaly. J Neurosurg 1995; 83 (3): 476–479. doi: 10.3171/jns.1995.83.3.0476.
31. Rottgers SA, Kim PD, Kumar AR et al. Cranial vault remodeling for sagittal craniosynostosis in older children. Neurosurg Focus 2011; 31 (2): E3. doi: 10.3171/2011.5.FOCUS1196.
32. Renier D, Sainte-Rose C, Marchac D et al. Intracranial pressure in craniostenosis. J Neurosurg 1982; 57 (3): 370–377. doi: 10.3171/jns.1982.57.3.0370.
33. Burstein FD, Hudgins RJ, Cohen SR et al. Surgical correction of severe scaphocephalic deformities. J Craniofac Surg 1994; 5 (4): 228–235. doi: 10.1097/00001665-199409000-00006.
34. Engel M, Freudlsperger C, Hoffmann J et al. Surgical outcome after using a modified technique of the pi-procedure for posterior sagittal suture closure. J Craniomaxillofac Surg 2012; 40 (8): e363–e368. doi: 10.1016/j.jcms.2012.01.024.
35. David LR, Plikaitis CM, Couture D et al. Outcome analysis of our first 75 spring-assisted surgeries for scaphocephaly. J Craniofac Surg 2010; 21 (1): 3–9. doi: 10.1097/SCS.0b013e3181c3469d.
36. Herlin C, Captier G, Bigorre M et al. Partial hybrid cranial vault remodeling in late correction of scaphocephaly and revision surgery. A monocentric retrospective study of nine consecutive cases. Neurochirurgie 2020; 66 (2): 110–115. doi: 10.1016/j.neuchi.2019.10.004.
37. Smyth MD, Tenenbaum MJ, Kaufman CB et al. The „clamshell“ craniotomy technique in treating sagittal craniosynostosis in older children. J Neurosurg 2006; 105 (4 Suppl): 245–251. doi: 10.3171/ped.2006.105.4.245.
38. Greensmith AL, Holmes AD, Lo P et al. Complete correction of severe scaphocephaly: the melbourne method of total vault remodeling. Plast Reconstr Surg 2008; 121 (4): 1300–1310. doi: 10.1097/01.prs.0000304592.56498.6.
39. Massimi L, Di Rocco C. Mini-invasive surgical technique for sagittal craniosynostosis. Childs Nerv Syst 2012; 28 (9): 1341–1345. doi: 10.1007/s00381-012-1799-4.
40. Mutchnick IS, Maugans TA. Nonendoscopic, minimally invasive calvarial vault remodeling without postoperative helmeting for sagittal synostosis. J Neurosurg Pediatr 2012; 9 (3): 222–227. doi: 10.3171/2011.12.PEDS11306.
41. Liby P, Lomachinsky V, Taborsky J et al. Minimally invasive endoscopically assisted remodelation (mear) of sagittal craniosynostosis: an alternative technique to open and endoscopic procedures with cranial orthosis time span reduction. Childs Nerv Syst 2021; 37 (2): 581–586. doi: 10.1007/s00381-020-04836-8.
42. Windh P, Davis C, Sanger C et al. Spring-assisted cranioplasty vs pi-plasty for sagittal synostosis – a long term follow-up study. J Craniofac Surg 2008; 19 (1): 59–64. doi: 10.1097/scs.0b013e31815c94c8.
43. Sakamoto Y, Nakajima H, Tamada I. Outcome analysis of morcellation craniotomy with distraction osteogenesis for scaphocephaly. Pediatr Neurosurg 2013; 49 (4): 248–253. doi: 10.1159/000362690.
44. Bonfield CM, Lee PS, Adamo MA et al. Surgical treatment of sagittal synostosis by extended strip craniectomy: cranial index, nasofrontal angle, reoperation rate, and a review of the literature. J Craniomaxillofac Surg 2014; 42 (7): 1095–1101. doi: 10.1016/j.jcms.2014.01. 036.
45. Arnaud E, Marchac D, Renier D. The treatment of craniosynostosis: indications and techniques. Neurochirurgie 2006; 52 (2–3 Pt 2): 264–291. doi: 10.1016/s0028-3770 (06) 71221-8.
46. Jane JA, Lin KY, Jane JA. Sagittal synostosis. Neurosurg Focus 2000; 9 (3): e3. doi: 10.3171/foc.2000.9.3.4.
47. van Veelen ML, Bredero HH, Dirven CM et al. Effect of presurgical positioning on skull shape in sagittal suture synostosis. J Craniofac Surg 2015; 26 (6): 2012–2014. doi: 10.1097/SCS.0000000000002021.
48. Sood S, Rozzelle A, Shaqiri B et al. Effect of molding helmet on head shape in nonsurgically treated sagittal craniosynostosis. J Neurosurg Pediatr 2011; 7 (6): 627–632. doi: 10.3171/2011.4.PEDS116.
49. Wood RJ, Stewart CN, Liljeberg K et al. Transfusion-free cranial vault remodeling: a novel, multifaceted approach. Plast Reconstr Surg 2020; 145 (1): 167–174. doi: 10.1097/PRS.0000000000006323.
50. Di Rocco F, Ben Gbulie U, Meyer P et al. Current techniques and protocols in the surgical management of scaphocephaly in young infants. J Craniofac Surg 2014; 25 (1): 39–41. doi: 10.1097/SCS.0b013e3182a2f799.
51. Kestle JRW, Lee A, Anderson RCE et al. Variation in the management of isolated craniosynostosis: a survey of the synostosis research group. J Neurosurg Pediatr 2018; 22 (6): 627–631. doi: 10.3171/2018.7.PEDS18132.
52. Yan H, Abel TJ, Alotaibi NM et al. A systematic review and meta-analysis of endoscopic versus open treatment of craniosynostosis. Part 1: the sagittal suture. J Neurosurg Pediatr 2018; 22 (4): 352–360. doi: 10.3171/2018.4.PEDS17729.
53. Chowdhury AM, Patel R, Silva AHD et al. Sagittal synostosis: does choice of intervention and its timing affect the long-term aesthetic and neurodevelopmental outcome? A single-institution study of 167 children. J Neurosurg Pediatr 2022; 31 (2): 169–178. doi: 10.3171/2022.10.PEDS22135.
54. Norwood CW, Alexander E, Davis CH et al. Recurrent and multiple suture closures after craniectomy for craniosynostosis. J Neurosurg 1974; 41 (6): 715–719. doi: 10.3171/jns.1974.41.6.0715.
55. Boop FA, Shewmake K, Chadduck WM. Synostectomy versus complex cranioplasty for the treatment of sagittal synostosis. Childs Nerv Syst 1996; 12 (7): 371–375. doi: 10.1007/BF00395087.
56. Alexander E, Davis CH, Mitchell OC. Treatment of craniosynostosis. Clin Neurosurg 1964; 11 : 32–45. doi: 10.1093/neurosurgery/11.cn_suppl_1.32.
57. Di Rocco F, Knoll BI, Arnaud E et al. Scaphocephaly correction with retrocoronal and prelambdoid craniotomies (Renier‘s „H“ technique). Childs Nerv Syst 2012; 28 (9): 1327–1332. doi: 10.1007/s00381-012-1811-z.
58. Jane JA, Edgerton MT, Futrell JW et al. Immediate correction of sagittal synostosis. J Neurosurg 1978; 49 (5): 705–710. doi: 10.3171/jns.1978.49.5.0705.
59. Jane JA, Lin KYK. Surgical management of scaphocephaly: pi-squeeze technique. Tech Neurosurg 1997; 3 : 179–183.
60. Guimaraes-Ferreira J, Gewalli F, David L et al. Clinical outcome of the modified pi-plasty procedure for sagittal synostosis. J Craniofac Surg 2001; 12 (3): 218–224. doi: 10.1097/00001665-200105000-00003.
61. Boop FA, Chadduck WM, Shewmake K et al. Outcome analysis of 85 patients undergoing the pi procedure for correction of sagittal synostosis. J Neurosurg 1996; 85 (1): 50–55. doi: 10.3171/jns.1996.85.1.0050.
62. Khechoyan D, Schook C, Birgfeld CB et al. Changes in frontal morphology after single-stage open posterior-middle vault expansion for sagittal craniosynostosis. Plast Reconstr Surg 2012; 129 (2): 504–516. doi: 10.1097/PRS.0b013e31823aec1d.
63. Jimenez DF, Barone CM. Endoscopic technique for sagittal synostosis. Childs Nerv Syst 2012; 28 (9): 1333–1339. doi: 10.1007/s00381-012-1768-y.
64. Cartwright CC, Jimenez DF, Barone CM et al. Endoscopic strip craniectomy: a minimally invasive treatment for early correction of craniosynostosis. J Neurosci Nurs 2003; 35 (3): 130–138. doi: 10.1097/01376517-200306000-00002.
65. Di Rocco C. How to decrease the impact of surgical scar in the correction of sagittal synostosis. Childs Nerv Syst 2003; 19 (1): 42–45. doi: 10.1007/s00381-002-0692-y.
66. Lauritzen C, Sugawara Y, Kocabalkan O et al. Spring mediated dynamic craniofacial reshaping. Case report. Scand J Plast Reconstr Surg Hand Surg 1998; 32 (3): 331–338. doi: 10.1080/02844319850158697.
67. Arko L, Swanson JW, Fierst TM et al. Spring-mediated sagittal craniosynostosis treatment at the children‘s hospital of philadelphia: technical notes and literature review. Neurosurg Focus 2015; 38 (5): E7. doi: 10.3171/2015.3.FOCUS153.
68. Rodriguez-Florez N, Borghi A, Yauwan DD et al. Three--dimensional calvarial growth in spring-assisted cranioplasty for correction of sagittal synostosis. J Craniofac Surg 2020; 31 (7): 2084–2087. doi: 10.1097/SCS.0000000 000006863.
69. Lin F, Wong VH, Ekanayake G et al. Delayed sagittal sinus tear: a complication of spring cranioplasty for sagittal craniosynostosis. J Craniofac Surg 2012; 23 (5): 1382–1384. doi: 10.1097/SCS.0b013e31825431a7.
70. Lauritzen CGK, Davis C, Ivarsson A et al. The evolving role of springs in craniofacial surgery: the first 100 clinical cases. Plast Reconstr Surg 2008; 121 (2): 545–554. doi: 10.1097/01.prs.0000297638.76602.de.
71. Rodriguez-Florez N, Ibrahim A, Hutchinson JC et al. Cranial bone structure in children with sagittal craniosynostosis: relationship with surgical outcomes. J Plast Reconstr Aesthet Surg 2017; 70 (11): 1589–1597. doi: 10.1016/j.bjps.2017.06.017.
72. Skolnick GB, Yu JL, Patel KB et al. Comparison of 2 sagittal craniosynostosis repair techniques: spring-assisted surgery versus endoscope-assisted craniectomy with helmet molding therapy. Cleft Palate Craniofac J 2021; 58 (6): 678–686. doi: 10.1177/1055665620966521.
73. Sugawara Y, Hirabayashi S, Sakurai A et al. Gradual cranial vault expansion for the treatment of craniofacial synostosis: a preliminary report. Ann Plast Surg 1998; 40 (5): 554–565. doi: 10.1097/00000637-199805000-00021.
74. Oh TS, Ra YS, Hong SH et al. Cranial compression using distractors in reverse fashion as an alternative method for correcting scaphocephaly in older patients. Pediatr Neurosurg 2013; 49 (1): 1–10. doi: 10.1159/000354258.
75. Lee MC, Shim KW, Park EK et al. Expansion and compression distraction osteogenesis based on volumetric and neurodevelopmental analysis in sagittal craniosynostosis. Childs Nerv Syst 2015; 31 (11): 2081–2089. doi: 10.1007/s00381-015-2843-y.
76. Lee MC, Shim KW, Yun IS et al. Correction of sagittal craniosynostosis using distraction osteogenesis based on strategic categorization. Plast Reconstr Surg 2017; 139 (1): 157–169. doi: 10.1097/PRS.0000000000002899.
77. Yonehara Y, Hirabayashi S, Sugawara Y et al. Complications associated with gradual cranial vault distraction osteogenesis for the treatment of craniofacial synostosis. J Craniofac Surg 2003; 14 (4): 526–528. doi: 10.1097/00001665-200307000-00025.
78. Park DH, Chung J, Yoon SH. Rotating distraction osteogenesis in 23 cases of craniosynostosis: comparison with the classical method of craniotomy and remodeling. Pediatr Neurosurg 2010; 46 (2): 89–100. doi: 10.1159/000319005.
79. Park DH, Yoon SH. The trans-sutural distraction osteogenesis for 22 cases of craniosynostosis: a new, easy, safe, and efficient method in craniosynostosis surgery. Pediatr Neurosurg 2011; 47 (3): 167–175. doi: 10.1159/000330708.
80. Thomas GP, Johnson D, Byren JC et al. Long-term morphological outcomes in nonsyndromic sagittal craniosynostosis: a comparison of 2 techniques. J Craniofac Surg 2015; 26 (1): 19–25. doi: 10.1097/SCS.0000000000001107.
81. Millesi M, Preischer M, Reinprecht A. Do standard surgical techniques lead to satisfying aesthetic results in nonsyndromic sagittal suture synostosis? J Neurosurg Pediatr 2021; 28 (5): 502–507. doi: 10.3171/2021.4.PEDS2166.
82. Berry-Candelario J, Ridgway EB, Grondin RT et al. Endoscope-assisted strip craniectomy and postoperative helmet therapy for treatment of craniosynostosis. Neurosurg Focus 2011; 31 (2): E5. doi: 10.3171/2011.6.FOCUS1198.
83. Albright AL. Operative normalization of skull shape in sagittal synostosis. Neurosurgery 1985; 17 (2): 329–331. doi: 10.1227/00006123-198508000-00016.
84. Wagner W, Wiewrodt D. A simple technique for the correction of frontal bossing in synostotic scaphocephaly. Childs Nerv Syst 2008; 24 (3): 373–377. doi: 10.1007/s00381-007-0548-6.
85. Chao MT, Jiang S, Smith D et al. Demineralized bone matrix and resorbable mesh bilaminate cranioplasty: a novel method for reconstruction of large-scale defects in the pediatric calvaria. Plast Reconstr Surg 2009; 123 (3): 976–982. doi: 10.1097/PRS.0b013e31819ba46f.
86. Ridgway EB, Berry-Candelario J, Grondin RT et al. The management of sagittal synostosis using endoscopic suturectomy and postoperative helmet therapy. J Neurosurg Pediatr 2011; 7 (6): 620–626. doi: 10.3171/2011.3.PEDS 10418.
87. Sakar M, Cevik S, Isik S et al. Modified endoscopic strip craniectomy technique for sagittal craniosynostosis: provides comparable results and avoids bony defects. Childs Nerv Syst 2022; 38 (6): 1173–1180. doi: 10.1007/s00381-021-05429-9.
88. Wood BC, Ahn ES, Wang JY et al. Less is more: does the addition of barrel staves improve results in endoscopic strip craniectomy for sagittal craniosynostosis? J Neurosurg Pediatr 2017; 20 (1): 86–90. doi: 10.3171/2017.1.PEDS16478.
89. Dlouhy BJ, Nguyen DC, Patel KB et al. Endoscope-assisted management of sagittal synostosis: wide vertex suturectomy and barrel stave osteotomies versus narrow vertex suturectomy. J Neurosurg Pediatr 2016; 25 (6): 674–678. doi: 10.3171/2016.6.PEDS1623.
90. Iyer RR, Ye X, Jin Q et al. Optimal duration of postoperative helmet therapy following endoscopic strip craniectomy for sagittal craniosynostosis. J Neurosurg Pediatr 2018; 22 (6): 610–615. doi: 10.3171/2018.5.PEDS 184.
91. Nguyen DC, Farber SJ, Skolnick GB et al. One hundred consecutive endoscopic repairs of sagittal craniosynostosis: an evolution in care. J Neurosurg Pediatr 2017; 20 (5): 410–418. doi: 10.3171/2017.5.PEDS16674.
92. Garland CB, Camison L, Dong SM et al. Variability in minimally invasive surgery for sagittal craniosynostosis. J Craniofac Surg 2018; 29 (1): 14–20. doi: 10.1097/SCS.0000000000003997.
93. Chan JW, Stewart CL, Stalder MW et al. Endoscope-assisted versus open repair of craniosynostosis: a comparison of perioperative cost and risk. J Craniofac Surg 2013; 24 (1): 170–174. doi: 10.1097/SCS.0b013e3182646ab8.
94. Seruya M, Tan SY, Wray AC et al. Total cranial vault remodeling for isolated sagittal synostosis: part I. Postoperative cranial suture patency. Plast Reconstr Surg 2013; 132 (4): 602e–610e. doi: 10.1097/PRS.0b013e31829f4b3d.
95. Arnaud E, Capon-Degardin N, Michienzi J et al. Scaphocephaly part II: secondary coronal synostosis after scaphocephalic surgical correction. J Craniofac Surg 2009; 20 (Suppl 2): 1843–1850. doi: 10.1097/SCS.0b013e 3181b6c4c3.
96. Beuriat PA, Szathmari A, Chauvel-Picard J et al. Coronal and lambdoid suture evolution following total vault remodeling for scaphocephaly. Neurosurg Focus 2021; 50 (4): E4. doi: 10.3171/2021.1.FOCUS201004.
97. Agrawal D, Steinbok P, Cochrane DD. Reformation of the sagittal suture following surgery for isolated sagittal craniosynostosis. J Neurosurg 2006; 105 (2 Suppl): 115–117. doi: 10.3171/ped.2006.105.2.115.
98. Sauerhammer TM, Seruya M, Ropper AE et al. Craniectomy gap patency and neosuture formation following endoscopic suturectomy for unilateral coronal craniosynostosis. Plast Reconstr Surg 2014; 134 (1): 81e–91e. doi: 10.1097/PRS.0000000000000285.
99. Kinsella CR, Cray JJ, Cooper GM et al. Parasagittal suture after strip craniectomy. J Craniofac Surg 2011; 22 (1): 66–67. doi: 10.1097/SCS.0b013e3181f6c488.
100. Gerety PA, Basta MN, Fischer JP et al. Operative management of nonsyndromic sagittal synostosis: a head-to-head meta-analysis of outcomes comparing 3 techniques. J Craniofac Surg 2015; 26 (4): 1251–1257. doi: 10.1097/SCS.0000000000001651.
101. De Praeter M, Nadjmi N, Reith FCM et al. Is there an advantage to minimizing surgery in scaphocephaly? A study on extended strip craniectomy versus extensive cranial vault remodeling. J Craniofac Surg 2019; 30 (6): 1714–1718. doi: 10.1097/SCS.0000000000005516.
102. Maugans TA, McComb JG, Levy ML. Surgical management of sagittal synostosis: a comparative analysis of strip craniectomy and calvarial vault remodeling. Pediatr Neurosurg 1997; 27 (3): 137–148. doi: 10.1159/000121241.
103. Thomas GP, Johnson D, Byren JC et al. The incidence of raised intracranial pressure in nonsyndromic sagittal craniosynostosis following primary surgery. J Neurosurg Pediatr 2015; 15 (4): 350–360. doi: 10.3171/2014.11.PEDS1426.
104. Shah MN, Kane AA, Petersen JD et al. Endoscopically assisted versus open repair of sagittal craniosynostosis: the st. Louis Children‘s Hospital experience. J Neurosurg Pediatr 2011; 8 (2): 165–170. doi: 10.3171/2011.5.PEDS1128.
105. Lepard J, Akbari SHA, Mooney J et al. Comparison of aesthetic outcomes between open and endoscopically treated sagittal craniosynostosis. J Neurosurg Pediatr 2021; 28 (4): 432–438. doi: 10.3171/2021.3.PEDS20 894.
106. Schulz M, Liebe-Puschel L, Seelbach K et al. Quantitative and qualitative comparison of morphometric outcomes after endoscopic and conventional correction of sagittal and metopic craniosynostosis versus control groups. Neurosurg Focus 2021; 50 (4): E2. doi: 10.3171/2021.1.FOCUS20988.
107. Czerwinski M, Hopper RA, Gruss J et al. Major morbidity and mortality rates in craniofacial surgery: an analysis of 8101 major procedures. Plast Reconstr Surg 2010; 126 (1): 181–186. doi: 10.1097/PRS.0b013e3181da87df.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2023 Číslo 5
-
Všechny články tohoto čísla
- Delirium a spánek v intenzivní péči I – epidemiologie, rizikové faktory a důsledky
- Delirium a spánek v intenzivní péči II – možnosti monitorace a diagnostiky
- Výběr vhodné operační techniky při léčbě nejčastější kraniosynostózy
- Kognitivní toxicita indukovaná radioterapií v éře precizní onkologie – od patofyziologie ke strategiím omezení toxicity
- 3D tisk v neurochirurgii – naše zkušenost
- Progrese hemangioblastomů v těhotenství u syndromu von Hippel-Lindau
- Zomrel doc. MUDr. Eugen Eiben, CSc.
- Není čas ztrácet čas – skutečně účinná kontrola fokálních epileptických záchvatů
- Pětiletá data potvrzují dlouhodobý prospěch z užívání cenobamátu
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Výběr vhodné operační techniky při léčbě nejčastější kraniosynostózy
- Delirium a spánek v intenzivní péči I – epidemiologie, rizikové faktory a důsledky
- Delirium a spánek v intenzivní péči II – možnosti monitorace a diagnostiky
- 3D tisk v neurochirurgii – naše zkušenost


