Konkomitantní chemoradioterapie a cílená biologická léčba u glioblastoma multiforme
Concomitant Chemoradiotherapy and Targeted Therapy in Glioblastoma Multiforme
Glioblastoma multiforme (GBM) is among the most aggressive of malignant brain tumors and therapeutic options for it are limited. Standard therapy is maximal surgical resection and adjuvant concurrent chemoradiotherapy and maintenance therapy with temozolomid. This approach improves median and 5-year survival in comparison with postsurgical radiotherapy alone. MGMT (O6-Methylguanine-DNA-methyltransferase) promoter methylation is the first predictive biomarker. Low levels of expression of MGMT protein are correlated with successful treatment. Additional predictive and prognostic biomarkers are required, especially in the light of the development of targeted therapy – antibodies and tyrosine kinase inhibitors. New therapeutic approaches are under intensive investigation. The most promising data currently derive from anti-angiogenic therapies, such as bevacizumab and cediranib. This review presents a summary covering chemotherapy, the significance of promoter methylation MGMT, pseudoprogression and the possible role of targeted therapy in the treatment of glioblastoma multiforme.
Key words:
glioblastoma multiforme – chemotherapy – biomarkers – angiogenesis
Authors:
P. Burkoň 1*; R. Lakomý 2*; D. Burkoňová 1; P. Fadrus 3
Authors‘ workplace:
Oba autoři přispěli k práci stejným dílem
*; Klinika radiační onkologie LF MU a MOÚ, Brno
1; Klinika komplexní onkologické péče, LF MU a MOÚ, Brno
2; Neurochirurgická klinika LF MU a FN Brno
3
Published in:
Cesk Slov Neurol N 2010; 73/106(5): 503-509
Category:
Review Article
Overview
Glioblastoma multiforme (GBM) patří k nejagresivnějším mozkovým nádorům s omezenými léčebnými možnostmi. V současné době je zlatým léčebným standardem kombinace radio - a chemoterapie následující po maximálně možné radikální operaci. Tento postup zlepšuje medián celkového a pětiletého přežití. Metylace promotoru MGMT (O6-metyl-guanin-DNA-metyltransferáza) je prvním prediktivním biomarkerem. Nízká hladina funkčního MGMT koreluje s lepšími léčebnými výsledky. Další výzkum biomarkerů je nezbytný, zvláště v době rozvoje cílené biologické léčby – protilátek a inhibitorů tyrozinkináz. Zatím nejslibnější výsledky jsou dnes u anti-angiogenních látek, jako bevacizumab a cediranib. Práce shrnuje aktuální informace o postavení chemoterapie, významu metylace promotoru MGMT, otázce pseudoprogrese a cílené biologické léčby u glioblastomu.
Klíčová slova:
glioblastoma multiforme – chemoterapie – biomarkery – angiogeneze
Úvod
Glioblastoma multiforme (GBM) tvoří přibližně 75 % všech high-grade gliomů. Incidence se popisuje mezi 3–4 případy na 100 000 obyvatel za rok. Postihuje dospělé mezi 45–75 lety; více než 80 % pacientů je starších 50 let.
Multiformní glioblastomy jsou typické svým infiltrativním růstem a zasahují velké části mozkové tkáně. Z patologického hlediska jsou charakterizovány přítomností jaderných atypií, vaskulárních proliferací, nekrózy a vysokou mitotickou aktivitou. Při vyšetření magnetickou rezonancí nacházíme heterogenní, expanzivně se chovající útvary utlačující komory a přetlačující středočárové struktury. Typické bývá zvýšení denzity na okraji centrálně uložených nekrotických ložisek obklopených perifokálním edémem.
V současné době je zlatým léčebným standardem kombinace radio - a chemoterapie následující po maximálně možné radikální operaci. Tento postup zlepšuje medián celkového a pětiletého přežití. Radikalita a úspěšnost výkonu je rozhodující prognostický faktor. Parciální výkon má vždy horší léčebné výsledky a nejhorší léčebné výsledky jsou uváděny u pacientů s inoperabilními tumory.
Léčebná strategie, zvláště pooperační, musí být určena multidisciplinárním týmem zpravidla ve složení – neurochirurg, radiační a klinický onkolog, diagnostik a neurolog – a řešena s přihlédnutím ke všem rizikovým faktorům včetně celkového stavu pacienta.
Chemoterapie
Úvod
Používání preparátů nitrózomočoviny v adjuvantní léčbě po provedeném chirurgickém zákroku bylo založeno na studiích, které prokázaly krátké prodloužení celkového přežití pacientů léčených chirurgií s následnou radioterapií a chemoterapií oproti pacientům léčeným bez chemoterapie [1,2]. Dvě metaanalýzy dostupných randomizovaných studií týkajících se léčby high-grade gliomů potvrdily mírné zlepšení přežití u pacientů léčených kombinací chirurgie, radioterapie a chemoterapie oproti pacientům léčeným pouze chirurgií a radioterapií [3,4]. Zejména metaanalýza 12 studií (GMT Group, 2002), zahrnující přes 3 000 pacientů léčených pooperačně samotnou radioterapií nebo současným podáním radio - a chemoterapie, zjistila absolutní zvýšení jednoletého přežití ze 40 na 46 % a prodloužení mediánu přežití o dva měsíce v případě, že k léčbě byla přidána chemoterapie. Při léčbě těmito preparáty však docházelo ke zvýšení toxicity.
Pooperační chemoradioterapie
Role chemoterapie v léčbě maligního glioblastomu byla zásadně přehodnocena na základě randomizované studie publikované R. Stuppem v roce 2005 [5]. Tato studie potvrdila efekt temozolomidu, alkylačního cytostatika, v adjuvantní kombinované léčbě high-grade gliomů po neurochirurgické resekci. Pooperační chemoradioterapie s temozolomidem zvyšuje celkové přežití a bezpříznakové období. Nové výsledky pětiletého sledování přežití a analýzu prediktivních faktorů včetně hodnocení významu hladiny metylace promotoru genu reparačního enzymu MGMT – O6-metylguanin-DNA-metyltransferázy – na základě provedené studie publikoval Stupp v březnu roku 2009 [6].
Stuppova studie klinického zkoušení fáze III na souboru 573 pacientů léčených na 85 pracovištích v 15 zemích probíhala v letech 2000–2002. Do souboru byli zařazeni pacienti s nově diagnostikovaným multiformním glioblastomem ve věku 18–70 let v dobrém celkovém stavu (PS 0–2) s adekvátními hodnotami krevního obrazu, funkcí jater a ledvin. U všech byla provedena histologická verifikace (kompletní či parciální resekce nebo biopsie), která byla po randomizaci centrálně ověřována. Kompletní resekce byla provedena celkem u 226 pacientů, parciální resekce u 254 pacientů a u 93 pacientů byla provedena pouze biopsie. Zastoupení v obou ramenech studie bylo přibližně stejné. Metylace MGMT byla stanovena PCR testováním. Kvalita života byla zjišťována mozkovým modulem testu EORTC: QLQ-C30 (BN-20). Léčebné výsledky byly hodnoceny podle běžně uznávaných kritérií (parciální, celková remise atd.) a vedlejší účinky léčby podle kritérií NCIC. Statistická analýza byla provedena podle Kaplan-Meier metodiky.
V prvním rameni studie byli pacienti léčeni kombinací radioterapie a chemoterapie s temozolomidem (konkomitantně a v adjuvantním podání po ukončení radioterapie, zpravidla šest cyklů), u pacientů v druhém rameni byla aplikována samostatná radioterapie. U pacientů léčených kombinovanou chemoradioterapií byl temozolomid aplikován 75 mg/m2, den 1.–42., p.o., po celou dobu radioterapie (i přes víkendy). Radioterapie byla provedena standardní frakcionací (5 × 2,0 Gy/týden, celková dávka 60 Gy za 6 týdnů). Adjuvantní léčba temozolomidem v monoterapii byla v této skupině pacientů indikována po ukončení konkomitantní chemoradioterapie (ve 4. týdnu po ukončení ozařování): temozolomid 150–200 mg/m2, p.o., den 1.–5., interval 28 dní, celkem 4–6 cyklů nebo do progrese onemocnění. Léčebné schéma je graficky znázorněno na schématu 1.
![Schéma 1. Schéma Stuppovy studie [5].](https://pl-master.mdcdn.cz/media/image/44114140d2018fd1d5f82340cca230f9.jpeg?version=1537790292)
Z celkového počtu pacientů v souboru bylo do ramene se samostatnou radioterapií zařazeno 286 nemocných a do ramene, ve kterém byla pacientům aplikována konkomitantní chemoradioterapie, bylo umístěno celkem 287 pacientů. Finální analýza byla nakonec provedena na souboru 532 pacientů (93 %). Výsledky celkového přežití ve vztahu k radikalitě operačního výkonu a charakteru následné léčby zobrazují tab. 1 a graf 1.
![Celkové přežití podle rozsahu operace a následné léčby [6].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/232217bacf418152b3a5856f164df628.jpeg)
![Celkové přežití podle charakteru léčby [6].](https://pl-master.mdcdn.cz/media/image/7f3695110fdda7f2a3376e1695682062.jpeg?version=1537790292)
Nejlepší léčebné výsledky byly popsány ve věkové skupině pacientů mladších 50 let; pět let přežívá v případě kombinované terapie 17 % a u pacientů po samostatné radioterapii 4,9 %. U pacientů nad 50 let pět let přežívá 6,4–6,6 % vs 0–1,1 %. Nicméně podání adjuvantní radioterapie a chemoterapie u starších pacientů v dobrém celkovém stavu může být pro tyto pacienty prospěšné [7].
Medián přežívání po progresi onemocnění je v obou ramenech stejný (6,2 měs.). Odpověď na druhou linii léčby nebyla vyhodnocována, nicméně reoperováno bylo v obou skupinách celkově 127 pacientů, reiradiace byla provedena u 24 pacientů a u 345 nemocných byla nasazena paliativní chemoterapie.
Obdobné výsledky publikovali R. Mirimanoff et al [8]. V randomizované studii na souboru 573 pacientů s glioblastomem léčených v letech 2000–2002 bylo prokázáno zlepšení léčebných výsledků při adjuvantní aplikaci temozolomidu s radioterapií proti skupině pacientů „jen“ adjuvantně ozařovaných: čtyřleté přežívání 12,9 vs 3,8 %; medián přežívání 14,6 vs 12,1 měs.
Součástí Stuppovy analýzy bylo také vyhodnocení léčebných výsledků u pacientů, kteří se nepodrobili resekci tumoru. Výsledky studie ve skupině těchto nemocných odpovídají už dříve předpokládané hypotéze, že využití temozolomidu v léčbě glioblastomů v konkomitantním podání s radioterapií bude mít léčebný efekt i v případě inoperabilních multiformních glioblastomů mozku. U pacientů, kteří podstoupili kombinovanou chemoradioterapii (48 pac.), bylo pozorováno 5,2% pětileté přežívání. Bohužel ve skupině (45 pac.) pouze biopticky ověřených glioblastomů s následnou samostatnou radioterapií ve čtvrtém roce sledování nepřežívá pacient žádný.
Na reprezentativní podskupině 206 pacientů byla vyhodnocena hladina metylované MGMT a retrospektivně analyzovány léčebné výsledky. Ve skupině nemocných léčených radioterapií a temozolomidem bylo pětileté přežití pacientů s metylovanou MGMT pozorováno v 13,8 % a ve skupině s nemetylovanou MGMT pouze 5,2 %. Metylace MGMT byla potvrzena jako prediktivní faktor účinnosti systémové terapie s temozolomidem [9].
Rovněž další práce potvrzují, že inaktivace MGMT genu díky metylaci jeho promotoru vede k prodloužení přežití a zvýšení účinku léčby temozolomidem a BCNU u pacientů s maligními gliomy [10–12].
V normálních tkáních MGMT působí jako supresor mutací a karcinogeneze. Nádory s vysokou aktivitou MGMT jsou nádory chemorezistentní, především vůči cytostatikům s alkylačním účinkem. Metylace MGMT promotoru (ztráta jeho funkce) u gliomů s vysokým stupněm malignity je příznivý prognostický faktor. Nádory s metylovaným MGMT promotorem odpovídají lépe jak na radioterapii samotnou, tak na kombinovanou léčbu temozolomid/radioterapie. Výsledný efekt léčby s temozolomidem tak může záviset na množství aktivní MGMT a na míře inaktivace (metylace) promotorových sekvencí genu pro MGMT. Zvýšená buněčná aktivita MGMT znamená snížení odpovědi buňky na temozolomid, naopak její snížená aktivita zvyšuje účinek temozolomidu. Aktivitu MGMT lze stanovit testem PCR, který určuje stav metylace promotorové sekvence MGMT genu.
Pseudoprogrese
Kombinovaná léčba zvyšuje letální účinek na nádorové, ale i zdravé buňky. V dnešní době se často setkáváme s diskuzí na téma pseudoprogrese. Tato vzniká na základě nekrózy nádoru, postradiačního zánětu v okolí a na podkladě poškození endotelu cév (změna permeability). Výsledkem je enhancement v MR a CT obrazu po ukončené chemoradioterapii [13].
Vyskytuje se ve 20–30 % případů „progredujícího“ onemocnění. Pseudoprogrese se nejčastěji objevuje v období 2–6 měsíců po ukončení adjuvantní chemoradioterapie a je ve většině případů asymptomatická. V klinické praxi není jednoduché na základě MR nálezu odlišit pseudoprogresi od časné progrese. Pro pacienta je to otázka zásadní. Pseudoprogrese je v podstatě obrazem efektivní léčby, která by měla pokračovat. Naopak časná progrese, se kterou se také setkáváme, je jasný signál selhání dosavadní léčby a je nutná změna léčebné strategie.
V diferenciální diagnostice se doporučuje využívat magnetickou rezonanční spektroskopii (MRS), která může odlišit zbytkové nebo rekurentní nádory od čisté nekrózy, ale ne od nekrózy smíšené s nádorovou tkání. Další pomocnou metodou může být technika difuzně váženého zobrazení (DWI) a PET vyšetření se značenými aminokyselinami, např. 11-C-metioninem, které má vyšší senzitivitu než rutinně užívaný PET se značenou glukózou. Dostupnost těchto metod, omezená senzitivita a především specificita jsou zatím určitou limitací. Rozhodujícím faktorem stran dalšího postupu u pacientů s progredující sytící se lézí na časné MR kontrole po konkomitantní chemoradioterapii je klinický stav. Pokud nejsou vyjádřeny klinické známky progrese onemocnění, je na místě pokračovat v adjuvantním podávání temozolomidu do MR kontroly za 2–3 měsíce a další postup je určen dle nálezu. V případě pseudoprogrese by nemělo v průběhu další léčby docházet k zásadnímu klinickému zhoršení a na kontrolní MR lze očekávat zlepšení nálezu. Pokud je progredující léze na časné MR kontrole spojena s horšícím se klinickým stavem, zvažuje se v určitých případech s ohledem na potenciální morbiditu operační výkon s cílem zlepšit stav pacienta a histologicky verifikovat proces.
Dle výsledků recentních studií je nutno pomýšlet na možnost pseudoprogrese zejména u pacientů s metylací MGMT v nádorové tkáni, protože právě tato skupina má větší pravděpodobnost léčebné odpovědi [13].
Praktické doporučení pro podávání temozolomidu
Indikace
Temozolomid je určen k léčbě pacientů s multiformním glioblastomem nově diagnostikovaným souběžně s radioterapií a následně jako adjuvantní monoterapeutická léčba a pacientů s maligními gliomy (včetně glioblastoma multiforme), u nichž se po standardní léčbě projevují recidivy nebo progrese.
Z indikačních kritérií, která mohou podání preparátu ovlivnit, je nejdůležitější celkový stav pacienta a jeho přidružená onemocnění, kdy KPS (Karnofského index) by měl být více než 70 %. Z populační analýzy farmakokinetiky u pacientů ve věku 19–78 let vyplývá, že clearance temozolomidu není ovlivňována věkem. Nicméně se zdá, že starší pacienti (ve věku > 70 let) mají vyšší riziko vzniku neutropenie a trombocytopenie a je nutné k indikaci podávání preparátu u těchto pacientů přistupovat obezřetně.
Dávkování a jeho úpravy v průběhu léčby
Schéma podávání temozolomidu v léčbě multiformního glioblastomu bylo do klinické praxe převzato ze studijního ramene Stuppovy studie [5].
Při kombinované chemoradioterapii je temozolomid podáván v dávce 75 mg/m2, den 1.–42., p.o., po celou dobu radioterapie (i přes víkendy). Radioterapie je aplikována standardní frakcionací (5 × 2,0 Gy/týden, celková dávka 60 Gy za 6 týdnů).
Obr. 1 ukazuje izodózní rozložení dávky pooperační radioterapie glioblastomu parietookcipitální oblasti vpravo.
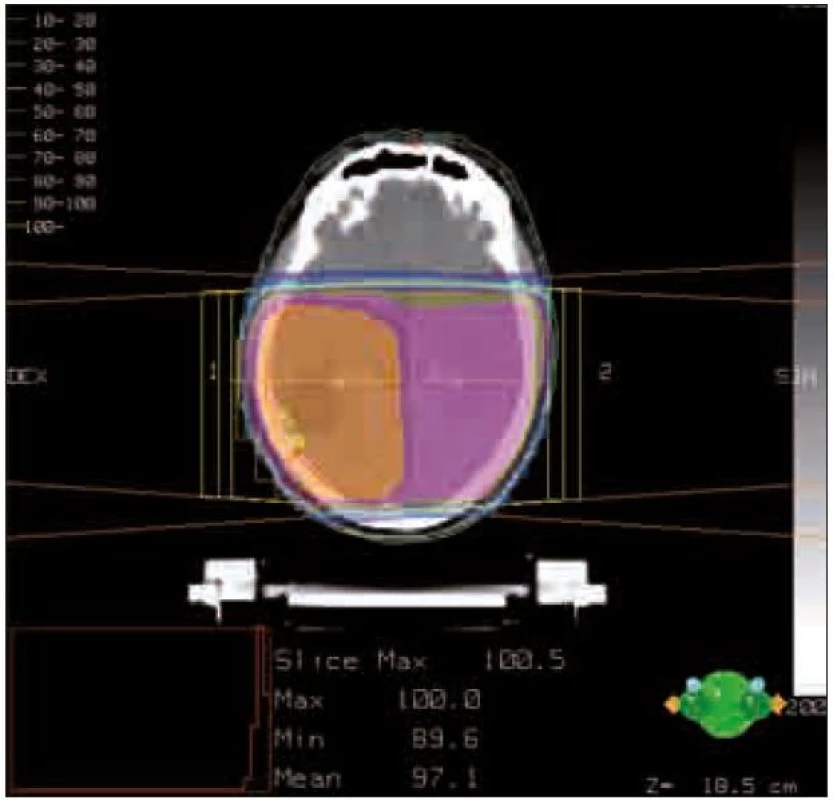
Následná adjuvantní léčba temozolomidem v monoterapii je indikována čtyři týdny po ukončení konkomitantní chemoradioterapie; temozolomid je podáván v dávce 150–200 mg/m2, p.o., den 1. –5., interval 28 dní, celkem šest cyklů nebo do progrese onemocnění.
Doporučená úprava dávkování temozolomidu při kombinované chemoradioterapii a následné adjuvantní léčbě je uvedena v tab. 2–4.
![Přerušení nebo ukončení podávání temozolomidu (TMZ) během souběžné léčby s radioterapií [dle SPC temozolomidu].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/e4a5b2919194b8e1d14af7740e89b66d.jpeg)
![Úrovně dávky přípravku temozolomid (TMZ) pro adjuvantní léčbu [dle SPC temozolomidu].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/10b355f84ad85cbad5d2ec89df863b11.jpeg)
![Snížení dávky nebo ukončení podávání přípravku temozolomid (TMZ) během adjuvantní léčby [dle SPC temozolomidu].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/555e661d7b39df644e44091d2ee1558e.jpeg)
Nežádoucí účinky léčby
Když byly zkombinovány abnormality laboratorních testů a nežádoucí účinky při konkomitantním i adjuvantním podání temozolomidu, byla pozorována neutropenie stupně 3 a 4 u 8 % pacientů a trombocytopenie stupně 3 nebo 4 u 14 % pacientů, kteří dostávali temozolomid.
Nejčastěji se vyskytujícími nehematologickými nežádoucími účinky ve vztahu k léčbě byly v provedených klinických studiích gastrointestinální poruchy, především nauzea (43 %) a zvracení (36 %). Tyto reakce dosahovaly obvykle pouze stupně 1 nebo 2 (0–5 epizod zvracení během 24 hod) a buď spontánně odezněly, nebo byly snadno léčitelné standardní antiemetickou léčbou. Incidence těžké nauzey a zvracení činila 4 %.
Mezi další časté nehematologické nežádoucí účinky podávání temozolomidu patří anorexie, zácpa, bolesti hlavy a únava.
Vzhledem k četnosti nevolnosti a zvracení se doporučuje antiemetická profylaxe před počáteční dávkou chemoradioterapie a také v průběhu následné adjuvantní léčby.
Cílená biologická léčba
Úvod
V současné době probíhá řada klinických studií s „cílenou biologickou léčbou“. Nové metody především pooperační léčby či léčby recidiv jsou dnes založeny na monoklonálních protilátkách a tyrozinkinázových inhibitorech v kombinaci se standardním způsobem léčby.
Nejvíce jsou zkoumány mechanizmy ovlivňující angiogenezi, epidermální růstové faktory, dráhu m-TOR, intergriny, proteinkinázu Cβ2. Zatím nejnadějnější výsledky prokazují inhibitory angiogeneze – bevacizumab a cediranib.
Další rozvoj cílené léčby bude podmíněn důkladnějším poznáním genetických změn v nádorové buňce, objevením nových prognostických a prediktivních faktorů [14]. Centrem zájmu jsou dnes skupiny krátkých nekódujících RNA (20–25 nukleotidů) – mikroRNA, které tvoří rozsáhlou síť regulátorů genové exprese.
Angiogeneze
Tvoření nových krevních cév hraje klíčovou úlohu v rozvoji nádorového bujení. Nádor, který dosáhne určité velikosti, potřebuje systém krevních cév, které mu dodají živiny, kyslík a odstraní toxické látky. V roce 1980 byl izolován vaskulární endoteliální růstový faktor (vascular endothelial growth factor, VEGF) jako silný stimulátor růstu endotelových cév, který aktivuje tyrozinkinázové receptory na povrchu buněk endotelu, a je tak hlavním regulátorem normálního i patologického růstu cév. Neovaskularizace je jedním ze základních znaků multiformního glioblastomu. Podpůrné endotelie glioblastomu (GBM) exprimují VEGF receptory ve velkém množství.
Možnost využití antiangiogenních látek popsali ve své práci Folkman et al před více než třemi desetiletími [15]. Na gliálních modelech bylo dokázáno, že blokáda VEGF se odrazí v poklesu hustoty kapilár a normalizaci již vytvořené cévní sítě vedoucí ke zvýšení oxygenace a snížení intersticiálního tlaku ve tkáni [16]. Klinické výsledky s první generací léků, jako je talidomid, byly nadějí do budoucna [17].
Inhibitory vaskulárního endoteliálního růstového faktoru (VEGF)
Největší pozornost je v současné době věnována bevacizumabu a jeho kombinaci se standardní léčbou. Bevacizumab (Avastin, Roche) je humanizovaná monoklonální protilátka proti VEGF. Svoji vazbou na VEGF zabraňuje interakci mezi VEGF a tyrozinkinázovými receptory VEGFR-1 a VEGFR-2.
V léčbě recidivujícího multiformního glioblastomu byl prokázán efekt kombinace bevacizumabu s irinotecanem, inhibitorem topoizomerázy I, jehož lipofilní metabolity dobře pronikají hematoencefalickou bariérou. Příznivé výsledky publikovali Vredenburgh et al v roce 2007 na souboru 35 pacientů s recidivujícími high-grade gliomy předléčenými radioterapií a temozolomidem. Četnost léčebné odpovědi dosáhla překvapivých 57 % (20 pacientů), šestiměsíční období bez progrese bylo zaznamenáno u 46 % pacientů a po šesti měsících od započetí léčby žilo 77 % pacientů s akceptovatelnými nežádoucími účinky [18].
Pozitivní výsledky při léčbě bevacizumabem zaznamenali také Friedman et al [19]. Cílem této studie fáze II bylo zjistit, jaká je účinnost samotného bevacizumabu. Srovnávacím ramenem byla ověřená kombinace bevacizumabu s irinotecanem. Bevacizumab byl podáván v dávce 10 mg/kg à 2 týdny, irinotecan v dávce 340 mg/m2 nebo 125 mg/m2 à 2 týdny, dle toho, zda pacienti současně užívali antiepileptika ovlivňující metabolizmus cytostatika v játrech (s/bez EIAEDs, enzyme-inducing antiepileptic drugs). Studie se zúčastnilo celkem 167 pacientů. V rameni se samotným bevacizumabem bylo šestiměsíční doby bez progrese dosaženo u 42,6 % pacientů, u kombinace 50,3 %, medián celkového přežití v rameni se samotnou protilátkou byl 9,2 měsíce, u kombinace 8,7 měsíce a četnost léčebných odpovědí 28,2 vs 37,8 % u kombinace. Komplikace bevacizumabu jako krvácení do CNS, trombembolické příhody, proteinurie a hypertenze byly srovnatelné jako při léčbě jiných nádorů a byly přijatelné. Dle aktuálních znalostí lze říci, že bevacizumab je účinný v léčbě relabujícího glioblastomu, a to jak v monoterapii, tak při kombinaci s irinotekanem, s akceptovatelným profilem toxicity.
Pod záštitou Radiation Therapy Oncology Group nyní probíhá pro pacienty s nově diagnostikovaným multiformním glioblastomem studie fáze III (RTOG 0825 Study), jejímž primárním cílem je zjistit, zdali přidání bevacizumabu ke standardní léčbě, tj. ke konkomitantní chemoradioterapii s následným podáním adjuvantního temozolomidu, zlepší léčebné výsledky [20].
Inhibitory tyrozinkinázy receptoru pro vaskulární endoteliální růstový faktor (VEGFR)
Zatím nadějná data jsou dnes u cediranibu (AZD2171) – RecentinTM. Cílovou strukturou jsou tyrozinkinázové receptory, především VEGFR-2, ale též VEGFR-1, VEGFR-3, c-Kit, receptory růstového faktoru odvozeného z trombocytů PDGFRα a PDGFRβ [21].
Aktuálně probíhá randomizovaná klinická studie fáze III u nemocných s relabujícím glioblastomem porovnávající účinnost cediranibu v monoterapii a kombinace cediranib + lomustin oproti lomustinu samotnému.
Cediranib je zkoušen i u nemocných s nově diagnostikovaným glioblastomem, a to v kombinaci s denním temozolomidem a radioterapií, zatím jen rámci klinické studie fáze II.
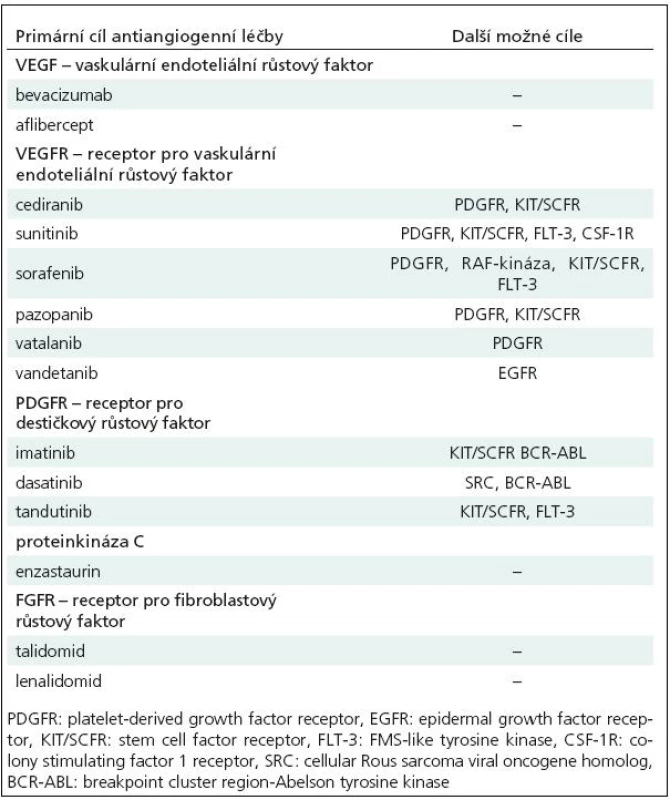
K dalším tyrozinkinázovým inhibitorům, které ovlivňují VEGFR, patří např. sora-fenib (Nexavar), sunitinib (Sutent), pazopanib (GW 786034, Armala), vatalanib (PTK 787), vandetanib (AZD 6474). Jde o preparáty zaměřené i na tyrozinkinázy jiných receptorů (tab. 5). Zatím však nejsou k dispozici přesvědčivá data o jejich účinnosti u glioblastomu, klinické studie fáze I/II probíhají.
Inhibitory receptoru pro epidermální růstový faktor (EGFR)
Receptory pro epidermální růstové faktory (EGFR) zahrnují skupinu receptorů označovaných jako erbB-1 až erbB-4. Receptor EGFR (erbB-1) je zvýšeně exprimován na povrchu buněk řady nádorů. Jeho exprese je nacházena přibližně u 40–50 % pacientů s multiformním glioblastomem. Amplifikace genu EGFR vede k řadě dějů, jejichž důsledkem je zvýšená agresivita nádoru a rezistence k radioterapii a chemoterapii. Cílem léčby může být extracelulární část receptoru (cetuximab) nebo jeho tyrozinkináza intracelulárně (gefitinib, erlotinib). Proběhlé studie fáze I a II s monoklonální protilátkou cetuximabem a s inhibitory tyrozinkinázy EGFR (gefitinib, erlotinib) zatím neprokázaly významný efekt v léčbě recidivujících či progredujících maligních gliomů [22–25].
Inhibitory receptoru pro destičkový růstový faktor (PDGFR)
Nadměrná aktivace PDGFR a jeho signální dráhy může potencovat proces angiogeneze. Bohužel klinické studie fáze II s imatinibem v monoterapii naznačují, že u neselektovaných nemocných má tento lék omezenou účinnost [26,27]. Možná novější inhibitory PDGFR, jako dasatinib a tandutinib, které mají lepší prostupnost přes hematoencefalickou bariéru, budou mít příznivější výsledky.
Inhibitory rapamycinového receptoru (mTOR)
Everolimus a temsirolimus jsou perorálně účinné inhibitory savčího rapamycinového cílového receptoru (mTOR), jedné z komponent intracelulárních signálních cest ovlivňujících buněčný růst, metabolizmus, proliferaci a angiogenezi. Galanis et al podali temsirolimus 65 pacientům s progredujícím GBM po předchozí léčbě nejvíce jednou řadou chemoterapie. U 36 % pacientů léčených temsirolimem zjistili radiologické zlepšení nálezu, což bylo spojeno se signifikantním prodloužením doby do progrese onemocnění. Tyto nálezy však musí být potvrzeny dalšími studiemi [28].
Závěr
Standardní léčebnou metodou v terapii glioblastomu zůstává maximální radikální chirurgický výkon následovaný kombinací radioterapie a chemoterapie s temozolomidem (konkomitantně a v adjuvantním podání po ukončení radioterapie). Tento postup prokázal jednoznačný benefit ve smyslu prodloužení času do progrese i celkového přežití. Větší benefit z léčby lze dle výsledků analýz očekávat u pacientů s metylací MGMT. I přes kombinovanou terapii není prognóza těchto pacientů dobrá.
Ve snaze zlepšit léčebné výsledky proběhla v posledních letech řada klinických studií s cílenou biologickou léčbou. Byla zkoušena řada monoklonálních protilátek a inhibitorů využívajících vysoké frekvence overexprese receptoru epidermálního růstového faktoru (EGFR) a angiogeneze v těchto nádorech. Navzdory velkému množství nových látek nepřinesly prozatím publikované výsledky klinických studií radikální pokrok. Nejdále je výzkum v oblasti inhibice angiogeneze, především s bevacizumabem. Probíhající studie fáze III a jejich výsledky by mohly náhled na standardní terapii změnit.
Léčebná strategie, zvláště pooperační, by měla být určena multidisciplinárním týmem zpravidla ve složení neurochirurg, radiační a klinický onkolog, radiodiagnostik, neurolog a patolog.
MUDr. Radek Lakomý
Klinika komplexní onkologické péče
LF MU a Masarykův onkologický ústav
Žlutý kopec 7
65653 Brno
e-mail: lakomy@mou.cz
Přijato k recenzi: 10. 3. 2010
Přijato do tisku: 11. 5. 2010
Sources
1. Walker MD, Green SB, Byar DP, Alexander E jr, Batzdorf U, Brooks WH et al. Randomized comparisons of radiotherapy and nitrosoureas for the treatment of malignant glioma after surgery. N Engl J Med 1980; 303(23): 1323–1329.
2. Kala M, Cwiertka K, Hajdúch M. Nové trendy v chemoterapii nádorů mozku – léčba dle histologických diagnóz. Klin Onkol 2000; 13(4): 107–111.
3. Fine HA, Dear KB, Loeffler JS, Black PM, Canellos GP. Meta-analysis of radiation therapy with and without adjuvant chemotherapy for malignant gliomas in adults. Cancer 1993; 71(8): 2585–2597.
4. Stewart LA. Chemotherapy in adult high-grade glioma: a systematic review and meta-analysis of individual patient data from 12 randomised trials. Lancet 2002; 359(9311): 1011–1018.
5. Stupp R, Mason WP, van den Bent MJ, Weller M, Fisher B, Taphoorn MJ et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 2005; 352(10): 987–996.
6. Stupp R, Hegi ME, Mason WP, van den Bent MJ, Taphoorn MJ, Janzer RC et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial. Lancet Oncol 2009; 10(5): 459–466.
7. Brandes AA, Vastola F, Basso U, Berti F, Pinna G, Rotilio A et al. A prospective study on glioblastoma in elderly. Cancer 2003; 97(3): 657–662.
8. Mirimanoff R, Mason W, van den Bent M, Kortmann R, Taphoorn M, Brandes A et al. Is long-term survival in glioblastoma possible? Updated results of the EORTC/NCIC phase III randomized trial on radiotherapy (RT) and concomitant and adjuvant temozolomide (TMZ) versus RT alone. Int J Radiat Oncol Biol Phys 2007; 69 (3 Suppl): S2.
9. Hegi ME, Diserens AC, Gorlia T, Hamou MF, de Tribolet N, Weller M et al. MGMT gene silencing and benefit from temozolomide in glioblastoma. N Engl J Med 2005; 352(10): 997–1003.
10. Esteller M, Garcia-Foncillas J, Andion E, Goodman SN, Hidalgo OF, Vanaclocha V et al. Inactivation of the DNA-repair gene MGMT and the clinical response of gliomas to alkylating agents. N Engl J Med 2000; 343(19): 1350–1354.
11. Hegi ME, Diserens AC, Godard S, Dietrich PY, Regil L, Ostermann S et al. Clinical trial substantiates the predictive value of O-6-methylguanine-DNA methyltransferase promoter methylation in glioblastoma patients treated with temozolomide. Clin Cancer Res 2004; 10(6): 1871–1874.
12. Paz MF, Yaya-Tur R, Rojas-Marcos I, Reynes G, Pollan M, Aguirre-Cruz L et al. CpG island hypermethylation of the DNA repair enzyme methyltransferase predicts response to temozolomide in primary gliomas. Clin Cancer Res 2004; 10(15): 4933–4938.
13. Brandsma D, Stalpers L, Taal W, Sminia P, van den Bent MJ. Clinical features, mechanism and management of pseudoprogression in malignant gliomas. Lancet 2008; 9(5): 453–461.
14. Nečesalová E, Kuglík P, Cejpek P, Veselská R, Vranová R, Pešáková M et al. Studium polyzomie chromozomu 7, monozomie chromozomu 10, amplifikace genu EGFR a delece genu p53 u multiformního glioblastomu pomocí metody fluorescenční in situ hybridizace (FISH). Klin Onkol 2006; 19(1): 9–14.
15. Folkman J. Tumor angiogenesis : therapeutic implications. N Engl J Med 1971; 285(21): 1182–1186.
16. Jain RK. Normalizing tumor vasculature with anti-angiogenic therapy: a new paradigm for combination therapy. Nat Med 2001; 7(9): 987–989.
17. Glass J, Gruber LM, Nirenberg A. Phase II trial of the antiangiogenic agen thalidomide in patients with recurrent high-grade gliomas. J Clin Oncol 1999; 18 (Suppl): 144.
18. Vredenburgh JJ, Desjardins A, Herndon JE, Marcello J, Reardon DA, Quinn JA et al. Bevacizumab plus irinotecan in recurrent glioblastoma multiforme. J Clin Oncol 2007; 25(30): 4722–4729.
19. Friedman HS, Prados MD, Wen PY, Mikkelsen T, Schiff D, Abrey LE et al. Bevacizumab alone and in combination with irinotecan in recurrent glioblastoma. J Clin Oncol 2009; 27(28): 4733–4740.
20. Radiation Therapy Oncology Group 0825, American College of Radiology. Phase III double-blind placebo-controlled trial of conventional concurrent chemoradiation and adjuvant temozolomide plus bevacizumab versus conventional concurrent chemoradiation and adjuvant temozolomide in patients with newly diagnosed glioblastoma [online]. September 29, 2009 [cited 2010 Jan 20]. Dostupné z URL: http://www.rtog.org/members/protocols/0825/0825.pdf.
21. Batchelor T, Sorensen AG, Ancukiewicz M, Duda DG, Luis DN, Plotkin SR et al. A phase II trial of AZD2171 (cediranib), an oral pan-VEGF receptor tyrosine kinase inhibitor, in patients with relapsed glioblastoma. J Clin Oncol 2007; 25 (Suppl): abstr. 2001.
22. Neyns B, Sadones J, Joosens E, Bouttens F, Verbeke L, Baurain JF et al. Stratified phase II trial of cetuximab in patients with recurrent high-grade glioma. Ann Oncol 2009; 20(9): 1596–1603.
23. Rich JN, Reardon DA, Peery T, Dowell JM, Quinn JA, Penne KL et al. Phase II trial of gefitinib in recurrent glioblastoma. J Clin Oncol 2004; 22(1): 133–142.
24. Vogelbaum MA, Peereboom D, Stevens GH, Barnett GH, Brewer C. Phase II study of single agent therapy with the EGFR tyrosine kinase inhibitor erlotinib in recurrent glioblastoma multiforme. Ann Oncol 2004; 15 (Suppl 3): iii206.
25. Chakravarti A, Seiferheld W, Tu X, Wang H, Zhang HZ, Ang KK et al. Immunohistochemically determined total epidermal growth factor receptor levels not of prognostic value in newly diagnosed glioblastoma multiforme: report from the Radiation Therapy Oncology Group. Int J Radiat Oncol Biol Phys 2005; 62(2): 318–327.
26. Wen PY, Yung WK, Lamborn KR, Dahia PL, Wang Y, Peng B, et al. Phase I/II study of imatinib mesylate for recurrent malignant gliomas: North American Brain Tumor Consortium Study 99–08. Clin Cancer Res 2006; 12(16): 4899–4907.
27. Van den Bent M, Brandes A, Frenay M, Fumoleau P, Stupp R, Dittrich C et al. Multicentre phase II study of imatinib mesylate (Glivec®) in patients with recurrent anaplastic oligodendroglioma (AOD)/mixed oligoastrocytoma (MOA) and anaplastic astrocytoma (AA)/low grade astrocytoma (LGA): an EORTC New Drug Development Group (NDDG) and Brain Tumor Group (BTG) study. J Clin Oncol 2005; 23 (Suppl): 1517.
28. Galanis E, Buckner JC, Maurer MJ, Kreisberg JI, Ballman K, Boni J et al. Phase II trial of temsirolimus (CCI-779) in recurrent glioblastoma multiforme: a north central cancer treatment group study. J Clin Oncol 2005; 23(23): 5294–5304.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2010 Issue 5
-
All articles in this issue
- Cievna mozgová príhoda a ischemická choroba srdca
- Konkomitantní chemoradioterapie a cílená biologická léčba u glioblastoma multiforme
- Syndrom útlaku ulnárního nervu v oblasti lokte – přehled operačních technik a srovnání jejich výsledků
- Analýza „default mode“ sítě u zdravých dobrovolníků
- Úloha predoperačného časového intervalu pri liečbe diskogenného syndrómu caudae equinae
- Výskyt psychogénnych porúch v neurológii
- Behaviorálne poruchy u pacientov s Parkinsonovou chorobou – anamnestický skríning za pomoci špecializovaného dotazníka
- Přítomnost tzv. typických MR nálezů u multisystémové atrofie a progresivní supranukleární paralýzy – retrospektivní pilotní studie
- Endoskopická transnazální chirurgie hypofýzy – výhody spolupráce otorinolaryngologa a neurochirurga
- Střelná poranění hlavy a mozku
- Hemangioblastom kaudy – kazuistika
- Neuralgie nervus pudendalis – kazuistika
- Bodná poranění míchy a míšních kořenů – kazuistiky
- Morbus Lhermitte-Duclos – kazuistika
- Vývoj Národní sady klinických standardů a ukazatelů zdravotní péče a první výsledky v oboru neurologie
- Standard pro léčbu pacientů s autoimunitními nervosvalovými onemocněními intravenózním lidským imunoglobulinem a plazmaferézou
- Antikoagulační terapie v prevenci a léčbě ischemických iktů
- Vývoj technik PLIF a TLIF
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Neuralgie nervus pudendalis – kazuistika
- Vývoj technik PLIF a TLIF
- Syndrom útlaku ulnárního nervu v oblasti lokte – přehled operačních technik a srovnání jejich výsledků
- Střelná poranění hlavy a mozku
