Kvalita života po hluboké mozkové stimulaci u pacientů s pokročilou Parkinsonovou nemocí
Quality of Life after Deep Brain Stimulation in Patients with Advanced Parkinson’s Disease
Goal:
The object of the study was to describe the effect of deep brain stimulation of the subthalamic nucleus on various aspects of quality of life in patients with Parkinson’s disease.
Patients and methods:
Quality of life was assessed by means of the PDQ-39 questionnaire for 26 patients 12 and 36 months after deep brain stimulation to treat advanced Parkinson’s disease.
Results:
Patient quality of life, according to the PDQ-39 summary index, improved by 46% three years after surgery (p <0.001). UPDRS III scores improved by 39% in the first year, and by 31% in the third year after DBS (p <0.001).
Conclusion:
We observed statistically significant improvements in quality of life for all patients both 12 and 36 months after deep brain stimulation. The improvement was most conspicuous in the motor subscales. However, benefit in the social aspects of Parkinson’s disease (stigma, social support, communication) was also evident. Deep brain stimulation appears to have a long-lasting positive effect on the quality of life in patients with Parkinson’s disease.
Key words:
deep brain stimulation – quality of life – Parkinson’s disease
Authors:
M. Baláž; M. Bočková; M. Bareš; I. Rektorová; V. Dírerová; I. Rektor
Authors‘ workplace:
Centrum pro abnormní pohyby a parkinsonizmus I. neurologická klinika LF MU a FN u sv. Anny v Brně
Published in:
Cesk Slov Neurol N 2011; 74/107(5): 564-568
Category:
Short Communication
Overview
Cíl:
Cílem práce je popsat vliv hluboké mozkové stimulace subthalamického jádra na jednotlivé aspekty kvality života u pacientů s Parkinsonovou nemocí.
Soubor a metodika:
Práce sleduje kvalitu života ve skupině 26 pacientů s Parkinsonovou nemocí před operací, po 12 a 36 měsících od provedení hluboké mozkové stimulace. Kvalita života byla hodnocena pomocí dotazníku PDQ-39.
Výsledky:
Kvalita životů pacientů se zlepšila o 46 % po třech letech od operace (p < 0,001). UPDRS III skóre se zlepšilo o 38 % po jednom roce a o 31 % po třech letech (p < 0,001).
Závěry:
V našem souboru jsme zjistili statisticky signifikantní zlepšení skóre PDQ-39 po 12 i 36 měsících od operace u všech pacientů. Nejvýrazněji se zlepšení odrazilo v motorických příznacích, které jsou DBS STN nejvíce ovlivněny. Lze pozorovat i efekt na sociální důsledky Parkinsonovy nemoci (stigma, sociální podpora, komunikace). Hluboká mozková stimulace má dlouhodobý efekt na kvalitu života.
Klíčová slova:
hluboká mozková stimulace – kvalita života – Parkinsonova nemoc
Úvod
Parkinsonova nemoc je neurodegenerativní onemocnění s motorickými, senzitivními, autonomními i neuropsychiatrickými příznaky. Základem terapie je dopaminergní medikace, která má efekt především na motorické příznaky.
Vlivem dopaminergní terapie a progrese onemocnění se u velké části pacientů objevují pozdní hybné komplikace, například motorické fluktuace a dyskinezy [1]. U části pacientů je vhodnou terapií motorických příznaků v pozdním stadiu PN hluboká mozková stimulace (Deep Brain Stimulation, DBS). Nejčastějším cílem implantace hlubokých elektrod u PN je subthalamické jádro (STN) [2].
DBS STN zlepšuje skóre v Jednotné škále pro hodnocení PN (Unified Parkinson’s Disease Rating Scale, UPDRS) ve stavu bez medikace – OFF – po roce od operace přibližně o 60 %. Výrazný efekt DBS na jednotlivé podškály (UPDRS II a UPDRS III) trvá i více než pět let od implantace systému (zlepšení o cca 43–57 %) [2].
DBS STN však není prevencí dalšího rozvoje onemocnění a obvykle neovlivňuje symptomy PN, které nereagují na podávání L-DOPA (zárazy v chůzi, nemotorické příznaky). Vzhledem k tomu, že PN je chronicky progredující neurodegenerativní onemocnění, je důležitým předpokladem DBS STN, aby přínos této procedury dlouhodobě převažoval nad nežádoucími účinky, a efekt operace se má projevit především zlepšením kvality života pacientů.
Kvalita života pacienta s PN je ovlivňována motorickými i nemotorickými příznaky a dalšími faktory, jako je například délka trvání nemoci a věk pacientů [3]. Není snadné určit, zda mají na kvalitu života významnější efekt symptomy motorické nebo nemotorické. Zajímavým pozorováním je, že mohutnost efektu L-DOPA na motorické symptomy před operací je prediktorem efektu DBS STN nejen na hybnost (reflektovanou především škálou UPDRS), ale i kvalitu života [4]. Na druhou stranu je některými autory považován dopad nemotorických (například neuropsychiatrických) příznaků za rozhodující faktor ovlivňující kvalitu života [3,5–8].
V současnosti se ke sledování kvality života u PN užívají dva hlavní typy dotazníků – generické a specifické [9,10]. Generické dotazníky (například EuroQOL Five Dimensions – EQ5D, Sickness Impact Profile – SIP, Questions on Life Satisfaction – QLS) pokrývají velké množství aspektů kvality života a dají se použít u rozličných nemocí. To poté umožňuje srovnání kvality života mezi jednotlivými onemocněními.
Dotazníky specifické jsou sestaveny podle příznaků jednotlivých nemocí a dovolují hodnocení dopadu konkrétních příznaků onemocnění na stav pacienta (například Parkinson’s Disease Quality of Life Questionnaire – PDQL, Parkinson’s Disease Quality of Life Scale – PDQUALIF). Nejčastěji používaným specifickým dotazníkem u PN je Dotazník kvality života u Parkinsonovy nemoci – Parkinson’s Disease Questionnaire (PDQ-39). Kvalita života pacientů po DBS STN byla sledována několika autory [9,11–13] a ti udávají celkové zlepšení od 14 do 62 %. Podle Volkmanna et al [9] mají nemotorické symptomy PN (změny nálady, bolesti, poruchy spánku) stejný nebo dokonce časem i větší efekt na kvalitu života než příznaky motorické. Zatím nelze jednoznačně určit, které jednotlivé faktory se nejvíce podílejí na zlepšení kvality života.
V naší práci jsme se zaměřili na hodnocení dlouhodobého vlivu hluboké mozkové stimulace pomocí dotazníku PDQ-39 a sledování změn jednotlivých částí dotazníku před operací a po 12 a 36 měsících od DBS STN.
Soubor a metodika
Soubor
Do studie bylo zařazeno 26 pacientů po DBS STN. Všichni byli pacienty indikovanými k DBS STN v Centru pro abnormní pohyby a parkinsonizmus ve FN u sv. Anny v Brně v letech 2003 až 2006, kteří v čase hodnocení studie dosáhli dobu 36 měsíců od operace. Do studie nebyli zahrnuti pouze dva pacienti, kteří zemřeli v kratší době než tři roky po DBS STN (oba z příčin nesouvisejících s DBS STN – náhodné utonutí šest měsíců po operaci, plicní embolie po 34 měsících od operace).
Soubor zahrnuje celkem 11 žen a 15 mu-žů s pokročilou PN. Průměrný věk v době operace byl 59,3 ± 7,4 let. Trvání PN v čase operace dosáhlo 10,3 ± 3,2 let. Průměrné trvání léčby přípravky L-DOPA 8,4 ± 2,9 let, stadium PN dle Hoehnové a Yahra dosáhlo v době operace ve stavu OFF průměrně 3,02 ± 0,5.
Hluboká mozková stimulace
Pacienti byli indikováni k provedení DBS STN podle standardních kritérií již opakovaně popsaných v domácí [8,14,15] i zahraniční literatuře [16]. Hlavními indikacemi k provedení DBS STN byly pozdní motorické komplikace Parkinsonovy nemoci (především ON-OFF fluktuace a dyskineze) neovlivnitelné úpravami medikace.
Při DBS neurochirurg do STN stereotakticky zavedl stimulační elektrodu. Během zavádění elektrod byl proveden perioperační elektrofyziologický monitoring a perioperační mikrostimulace. S odstupem 3–7 dnů od zavedení elektrod byl do podkoží v subklavikulární oblasti implantován stimulátor. Podrobný popis průběhu operace je také dostupný v literatuře [2,17].
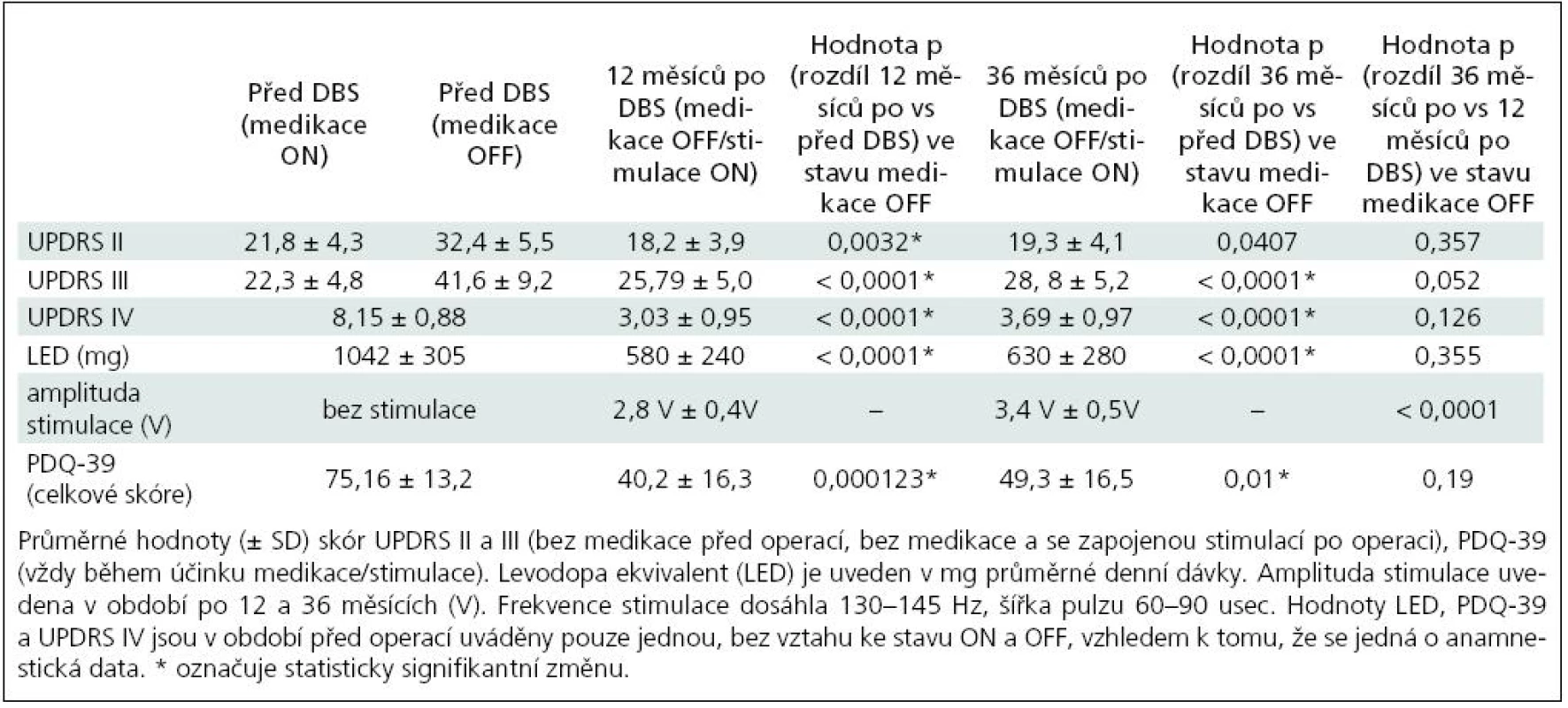
Efekt hluboké mozkové stimulace v našem souboru pacientů považujeme za velmi dobrý, je reflektován změnou skóre jednotlivých položek UPDRS (tab. 1).
Hodnocení kvality života
U pacientů bylo v rámci standardního předoperačního vyšetření provedeno šetření kvality života pomocí dotazníku PDQ-39. PDQ-39 je dotazník vyplňovaný přímo pacientem, obsahuje 39 dotazů na jednotlivé potíže a omezení způsobená Parkinsonovou nemocí pociťovaná v průběhu posledního měsíce [18].
Tento dotazník pacienti vyplnili i 12 a 36 měsíců po DBS STN.
Před operací pacienti vyplnili dotazník kvality života ve stavu ON (během účinku dopaminergní medikace), zatímco po DBS STN ve stavu ON a se zapojenou stimulací (ON/ON).
Ve výsledcích referujeme i změnu v položkách UPDRS II (aktivity denního života), UPDRS III a IV. Škála UPDRS byla hodnocena před operací u pacientů během tzv. definovaného OFF stavu (12 hod bez dopaminergní medikace). V období po operaci bylo hodnocení UPDRS provedeno se zapojenou stimulací, bez medikace (ON stimulace/OFF medikace). Dále jsou v tabulkách uvedeny i průměrné parametry stimulace a dávka dopaminergní medikace, kterou pacienti užívali v konkrétním čase.
Statistické hodnocení
Ke statistické analýze byly použity ANOVA a Tukeyův test (ke srovnání rozdílů mezi jednotlivými podškálami).
Výsledky
Změny v parametrech UPDRS, amplitudě stimulace a dávce levodopa ekvivalentu (LED) jsou shrnuty v tab. 1. Zlepšení hybnosti, které bylo jasně patrné po roce, bylo zachováno i po dalších dvou letech. Délka trvání dyskinez poklesla v průměru o 68,5 %.
Tak jak bylo možné předpokládat, LED byla významně snížena po DBS STN a toto snížení medikace bylo stále významné i po 36 měsících. U dvou pacientů bylo možno po dobu více než 12 měsíců zcela přerušit podávání dopaminergní léčby a po 36 měsících byly u čtyř pacientů podávány pouze agonisté dopaminových receptorů.
Při analýze naší skupiny pacientů jsme nepozorovali vliv věku nebo délky trvání nemoci na míru zlepšení kvality života.
Po 36 měsících byla průměrná amplituda stimulace 3,4 ± 0,5 V. Frekvence nastavení byla u všech pacientů 130 Hz. Šířka pulzu dosáhla 90 µs, s výjimkou dvou pacientů, kde byla nastavena na 60 µs.
Kvalita života se ve škále PDQ-39 významně zlepšila po 12 a 36 měsících ve srovnání se stavem před operací (graf 1). Mírné zvýšení celkového skóre mezi 12 a 36 měsíci nebylo statisticky významné (p = 0,19). Hvězdička (*) označuje statisticky signifikantní změnu.

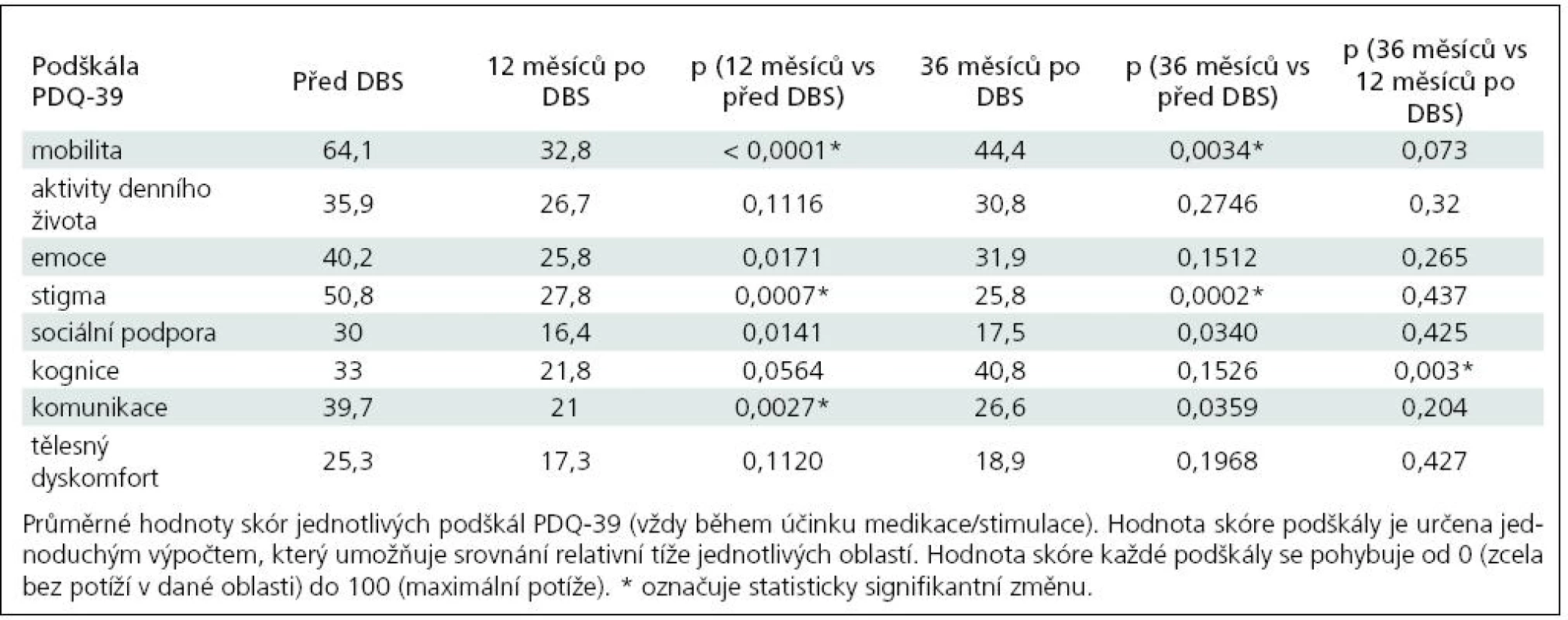
Zajímavé výsledky přineslo hodnocení jednotlivých podškál PDQ-39. DBS mělo významný vliv na většinu podškál, a to na motorické příznaky (mobilita) i sociální důsledky PN (stigma, sociální podpora, komunikace). V oblastech, jako aktivity denního života, emoce, kognice, tělesný dyskomfort se však kvalita života pacientů signifikantně po 36 měsících nezlepšila (emoce sice zlepšeny po 12 měsících, ale zlepšení po 36 měsících od implantace již nebylo patrné). Tab. 2 shrnuje výsledky podškál a příslušné hodnoty p.
Diskuze
Zlepšení kvality života po DBS STN se v různých pracích pohybuje v poměrně širokém rozpětí 14 až 62 % [19,20]. Někteří autoři pozorovali pouze zlepšení motorických, jiní i nemotorických příznaků PN (neuropsychiatrické příznaky).
V našem souboru jsme zjistili statisticky signifikantní zlepšení skóre PDQ-39 po roce i po 36 měsících od operace u všech pacientů. Jak se dá předpokládat, nejvýrazněji se zlepšení odrazilo v motorických příznacích, které jsou prostřednictvím DBS STN nejvíce ovlivněny. Z tohoto pohledu se naše výsledky přibližují závěrům jiných otevřených studií [12,20–22]. Za zajímavé považujeme však i statisticky signifikantní zlepšení v podškálách stigma, komunikace a sociální podpora, které odrážejí sociální důsledky Parkinsonovy nemoci.
Mírné zhoršení kvality života po 36 mě-sících ve srovnání se stavem po roce od DBS je pravděpodobně výsledkem progrese PN a akcentace příznaků, které jsou jen málo ovlivnitelné pomocí DBS, resp. dopaminergní terapie. Nejvýraznější zhoršení, pokud jde o nárůst bodového hodnocení mezi 12 a 36 měsíci, bylo v podškále kognice a emocí. Tento výsledek je v souladu s publikovanými studiemi [24,25]. U části pacientů po DBS STN bylo pozorováno zhoršení kognitivních (především verbální fluence, verbální paměti, asociativní učení, vizuospaciální paměť) a také některých neuropsychiatrických funkcí [6]. Za příčiny tohoto jevu se považují preoperační faktory (předchozí psychiatrické nemoci), vlivy operace (trvání procedury, trajektorie elektrod, chirurgické komplikace), působení stimulace (umístění elektrod, stimulační parametry), psychosociální změny po DBS STN a změny související s PN (neurodegenerativní proces, nedopaminergní symptomy). Porucha kognitivních funkcí v anamnéze je jednou z hlavních kontraindikací hluboké mozkové stimulace. Je vhodné potenciální kandidáty informovat o možném mírném poklesu některých kognitivních schopností po DBS STN [26].
Limitací naší studie může být to, že se jedná o retrospektivní zpracování dat z databáze pacientů. Pacienti indikovaní k DBS jsou však poměrně malá skupina (podle literárních údajů je k DBS indikovaných zatím pouze do 4,5 % s PN [23]) a v jejich případě dochází již k jisté preselekci (věk, stupeň pokročilosti PN, menší výskyt jiných onemocnění, dobrý neuropsychologický a kognitivní stav, nepřítomnost dalších kontraindikací k operačnímu výkonu), a proto srovnání se skupinou jiných pacientů shodující se pouze ve věku a trvání onemocnění nemusí mít dostatečnou výpovědní hodnotu.
Předmětem dalšího studia mohou být externí faktory, které zlepšení kvality podmiňují. Při analýze naší skupiny pacientů jsme nepozorovali vliv věku nebo délky trvání nemoci na míru zlepšení kvality života. Zajímavou otázkou je studium korelace zlepšení mezi kvalitou života a motorickými příznaky (vyjádřenými ve škále UPDRS III). Podle práce autorů Lezcano et al [13] se korelace zlepšení motoriky a kvality života, jež je přítomna po 12 měsících, snižuje po dvou letech. Uvedení autoři předpokládají, že po iniciálním zlepšení motoriky, které se projeví na úpravě kvality života po 12 měsících, mají na kvalitu života po dvou letech větší vliv jiné než motorické příznaky PN (např. komunikace). V našem souboru bylo možno (i vzhledem k nutnosti mírného zvýšení amplitudy stimulace a medikace (LED) mezi 12 a 36 měsíci) pozorovat mírnou progresi onemocnění, která se odrazila i v mírném nárůstu skóre PDQ-39 po 36 měsících ve srovnání se stavem po jednom roce. Tato progrese byla v oblasti motorických příznaků kompenzována úpravami stimulačních parametrů a medikace jen částečně (mírné zhoršení motorického skóre ve stavu OFF v UPDRS, nárůst skóre aktivit denního života a motoriky ve škále PDQ-39).
Hodnocení a sledování kvality života u pacientů indikovaných k DBS STN považujeme za velmi významné, přestože hodnocení kvality života je subjektivní a u PN není zcela jasné, které dotazníky jsou pro tento účel nejvhodnější. Při terapeutické metodě, jež není kurativní a má nezanedbatelné náklady personální a finanční, je nutné indikovat pacienty, kteří mají z této léčby co největší benefit. I proto je kvalita života parametr, který by měl být neurology i neurochirurgy pozorně sledován i při zavádění nových terapeutických metod u PN. Přikláníme se k názoru, že je vhodné upravit kritéria k indikacím DBS STN tak, aby zahrnovala i aspekty související s kvalitou života [20] tak, aby byla metoda nabídnuta pacientům, u kterých můžeme očekávat zlepšení právě v aspektech/doménách nejlépe ovlivnitelných působením stimulace (motorika, aktivity denního života).
MUDr. Marek Baláž, Ph.D.
Centrum
pro abnormní pohyby a parkinsonizmus
I.
neurologická klinika LF
MU a FN u sv. Anny v Brně
Pekařská
53
656
91 Brno
e-mail:
marek.balaz@fnusa.cz
Přijato
k recenzi: 30. 11. 2010
Přijato
do tisku: 6. 4. 2011
Poděkování
Děkujeme prof. MUDr. Z. Novákovi, Ph.D., a MUDr. J. Chrastinovi, Ph.D., za provedení stereotaktických neurochirurgických výkonů a Ing. Z. Novotnému za zpracování statistiky.
Podpořeno výzkumným záměrem MŠMMT 002 162 2404.
Sources
1. Kanovský P, Kubová D, Bares M, Hortová H, Streitová H, Znojil V et al. Levodopa-induced dyskinesias and the continuous subcutaneous infusions of apomorphine: results of two-years, prospective follow-up. Mov Disord 2002; 17(1): 188–191.
2. Chrastina J, Zbořilová E, Smrčka V, Nádvorník P. Renesance stereotaktické léčby parkinsonského třesu. Cesk Slov Neurol N 1996; 59/92(5): 265–268.
3. Schrag A, Hovris A, Morley D, Quinn N, Jahanshahi M. Young versus older-onset Parkinson’s disease: impact of disease and psychosocial consequences. Mov Disord 2003; 18(11): 1250–1256.
4. Smeding HM, Speelman JD, Huizenga HM, Schuurman PR, Schmand B. Predictors of cognitive and psychosocial outcome after STN DBS in Parkinson’s Disease. J Neurol Neurosurg Psychiatry 2011; 82(7): 754–760.
5. Schrag A, Jahanshahi M, Quinn N. What contributes to quality of life in patients with Parkinson’s disease? J Neurol Neurosurg Psychiatry 2000; 69(3): 308–312.
6. Voon V, Kubu C, Krack P, Houeto JL, Tröster AI. Deep brain stimulation: neuropsychological and neuropsychiatric issues. Mov Disord 2006; 21 (Suppl 14): S305–S327.
7. Parsons TD, Rogers SA, Braaten AJ, Woods SP, Tröster AI. Cognitive sequelae of subthalamic nucleus deep brain stimulation in Parkinson’s disease: a meta-analysis. Lancet Neurol 2006; 5(7): 578–588.
8. Baláž M, Rektor I. Neuropsychologické a kognitivní vlivy hluboké mozkové stimulace subtalamického jádra u pacientů s Parkinsonovou nemocí. Neurol Prax 2008; 9(5): 278–282.
9. Volkmann J, Albanese A, Kulisevsky J, Tornqvist AL, Houeto JL, Pidoux B et al. Long-term effects of pallidal or subthalamic deep brain stimulation on quality of life in Parkinson’s disease. Mov Disord 2009; 24(8): 1154–1161.
10. Ferrara J, Diamond A, Hunter C, Davidson A, Almaguer M, Jankovic J. Impact of STN-DBS on life and health satisfaction in patients with Parkinson’s disease. J Neurol Neurosurg Psychiatry 2010; 81(3): 315–319.
11. Deuschl G, Schade-Brittinger C, Krack P, Volkmann J, Schäfer H, Bötzel K et al. A randomized trial of deep-brain stimulation for Parkinson’s disease. N Engl J Med 2006; 355(9): 896–908.
12. Just H, Ostergaard K. Health-related quality of life in patients with advanced Parkinson’s disease treated with deep brain stimulation of the subthalamic nuclei. Mov Disord 2002; 17(3): 539–545.
13. Lezcano E, Gómez-Esteban JC, Zarranz JJ, Lambarri I, Madoz P, Bilbao G et al. Improvement in quality of life in patients with advanced Parkinson’s disease following bilateral deep-brain stimulation in subthalamic nucleus. Eur J Neurol 2004; 11(7): 451–454.
14. Urgošík D,Vladyka V. Neurochirurgická léčba Parkinsonovy nemoci. In: Růžička E, Roth J, Kaňovský P et al (eds). Parkinsonova nemoc a parkinsonské syndromy. Extrapyramidová onemocnění II. Praha: Galén 2000 : 200–209.
15. Urgošík D, Jech R, Růžička E. Hluboká mozková stimulace u nemocných s extrapyramidovými poruchami pohybu stereotaktická procedura a intraoperační nálezy. Cesk Slov Neurol N 2011; 74/107(2): 175–186.
16. Defer GL, Widner H, Marié RM, Rémy P, Levivier M. Core assessment program for surgical interventional therapies in Parkinson’s disease (CAPSIT-PD). Mov Disord 1999; 14(4): 572–584.
17. Peto V, Jenkinson C, Fitzpatrick R, Greenhall R. The development and validation of a short measure of functioning and well being for individuals with Parkinson’s disease. Qual Life Res 1995; 4(3): 241–248.
18. Erola T, Karinen P, Heikkinen E, Tuominen J, Haapaniemi T, Koivukangas J et al. Bilateral subthalamic nucleus stimulation improves health-related quality of life in Parkinsonian patients. Parkinsonism Relat Disord 2005; 11(2): 89–94.
19. Lyons KE, Pahwa R. Long-term benefits in quality of life provided by bilateral subthalamic stimulation in patients with Parkinson disease. J Neurosurg 2005; 103(2): 252–255.
20. Martínez-Martín P, Valldeoriola F, Tolosa E, Pilleri M, Molinuevo JL, Rumià J et al. Bilateral subthalamic nucleus stimulation and quality of life in advanced Parkinson’s disease. Mov Disord 2002; 17(2): 372–377.
21. Lagrange E, Krack P, Moro E, Ardouin C, Van Blercom N, Chabardes S et al. Bilateral subthalamic nucleus stimulation improves health-related quality of life in PD. Neurology 2002; 59(12): 1976–1978.
22. Barone P, Antonini A, Colosimo C, Marconi R, Morgante L, Avarello TP et al. The PRIAMO study: a multicenter assessment of nonmotor symptoms and their impact on quality of life in Parkinson’s disease. Mov Disord 2009; 24(11): 1641–1649.
23. Morgante L, Morgante F, Moro E, Epifanio A, Girlanda P, Ragonese P et al. How many Parkinsonian patients are suitable candidates for deep brain stimulation of subthalamic nucleus? Results of a questionnaire. Parkinsonism Relat Disord 2007; 13(8): 528–531.
24. Emre M. Treatment of dementia associated with Parkinson’s disease. Parkinsonism Relat Disord 2007; 13 (Suppl 3): S457–S461.
25. Burn DJ, Tröster AI. Neuropsychiatric complications of medical and surgical therapies for Parkinson’s disease. J Geriatr Psychiatry Neurol 2004; 17(3): 172–180.
26. Telecká S, Baláž M, Rektorová I, Fanfrdlová Z, Rektor I. Jeden rok po hluboké mozkové stimulaci pacientů s Parkinsonovou nemocí – neuropsychologické výsledky. Cesk Slov Neurol N 2010; 73/106(1): 57–61.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2011 Issue 5
-
All articles in this issue
- Vývojová porucha koordinace – vývojová dyspraxie
- „Awake“ resekcia supratentoriálnych low-grade gliómov lokalizovaných vo vnútri alebo v priamom kontakte s elokventnými oblasťami
- Kognitivní evokované potenciály
- Hereditární časná forma Alzheimerovy nemoci v důsledku zárodečné mutace p.M139V v genu PSEN1 – kazuistika
- Oboustranná ischemická retinopatie a neuropatie optiku jako izolovaný oční projev vysokohorské nemoci – kazuistika
- Progredující spasticita, kognitivní deficit a nevýbavné kortikální motorické evokované potenciály jako klinické příznaky pravděpodobné primární laterální sklerózy – kazuistika
- Kvalita života po hluboké mozkové stimulaci u pacientů s pokročilou Parkinsonovou nemocí
- Prevence žilní trombózy a plicní embolizace v neurochirurgii
- Zkušenosti s evakuací chronického subdurálního hematomu z návrtu kalvy
- Kognitivní dysfunkce u pacientů s klinickým izolovaným syndromem a roztroušenou sklerózou
- Agregometrie v sekundární prevenci cévních mozkových příhod. Aspirinová rezistence
- Vyšetření očních pohybů v neurologické praxi
- Kalcifikující pseudoneoplazma nervového systému – tři kazuistiky
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Vývojová porucha koordinace – vývojová dyspraxie
- Kognitivní evokované potenciály
- Progredující spasticita, kognitivní deficit a nevýbavné kortikální motorické evokované potenciály jako klinické příznaky pravděpodobné primární laterální sklerózy – kazuistika
- Zkušenosti s evakuací chronického subdurálního hematomu z návrtu kalvy