Mnohočetné extraneurální metastázy anaplastického astrocytomu – kazuistika
Multiple Extraneural Metastases of an Anaplastic Astrocytoma – a Case Report
Since metastasizing of intracranial tumours outside the central nervous system is an extremely rare complication, this option tends to be omitted in clinical practice. Most frequently, metastases are formed by high-grade (malignant) gliomas. They occur most commonly in the lungs and/or pleura and, alternatively, in descending order in the kidneys, adrenal glands, pancreas, spleen, heart and skin. Higher incidence of metastases is associated with neurosurgical procedures. In this report, we describe a case of a patient with anaplastic astrocytoma and pulmonary metastases with clinical signs of pulmonary involvement definitely confirmed during autopsy that also revealed further metastases in the liver, adrenal glands and lumbar vertebrae.
Key words:
extraneural metastasis – anaplastic astrocytoma – neurosurgery – chemotherapy – radiotherapy
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
J. Hommerová 1; J. Mraček 2; P. Mukenšnabl 3; L. Holubec 4; J. Polívka 1; V. Přibáň 2
Authors‘ workplace:
LF UK a FN Plzeň
Neurologická klinika
1; LF UK a FN Plzeň
Neurochirurgické oddělení
2; LF UK a FN Plzeň
Šiklův patologicko-anatomický ústav
3; LF UK a FN Plzeň
Onkologické a radioterapeutické oddělení
4
Published in:
Cesk Slov Neurol N 2013; 76/109(6): 745-750
Category:
Case Report
Overview
Metastazování mimo centrální nervový systém je u nitrolebečních tumorů extrémně řídkou komplikací, proto je tato možnost v klinické praxi poměrně často opomíjena. Nejvíce tvoří metastázy gliomy vysokého stupně malignity (high‑grade gliomy). Metastázy se objevují nejčastěji v plicích a/ nebo v pleuře, dále sestupně v lymfatických uzlinách, kostech, játrech, méně pak i v dalších orgánech (ledviny, nadledviny, pankreas, slezina, srdce, kůže). Vyšší výskyt metastáz je dáván do souvislosti s prodělaným neurochirurgickým operačním výkonem. V tomto sdělení prezentujeme případ nemocné s anaplastickým astrocytomem, u které se objevily plicní metastázy s klinickými příznaky postižení plicního parenchymu, definitivně potvrzené pitvou, kdy byly zjištěny také další metastázy v játrech, nadledvině a bederních obratlech.
Klíčová slova:
extraneurální metastázy – anaplastický astrocytom – neurochirurgie – chemoterapie – radioterapie
Podpořeno MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPl, 00669806).
Úvod
Extraneurální metastazování nitrolebečních tumorů je velmi vzácná, avšak popisovaná skutečnost. V současnosti je dokumentováno přibližně 300 případů. První takový případ byl popsán roku 1928 Davisem [1], v českém písemnictví roku 1950 Šiklem [2]. Můžeme najít zmínky o extraneurálním metastazování meningeomů, gliomů, hypofyzárních nádorů, meduloblastomů, papilomů choroidálního plexu, pinealomů a dalších nádorů. Nejvíce případů extraneurálních metastáz bylo popsáno u nemocných s maligními (high‑grade) gliomy, což je částečně dáno i faktem, že glioblastom je vůbec nejčastější intrakraniální tumor. Ze všech metastáz nitrolebečních tumorů se 41,4 % vyskytlo u multiformního glioblastomu, u anaplastického astrocytomu 10,3 % a u anaplastického oligodendrogliomu 5,25 % [3]. Nejčastějším místem metastazování high‑grade gliomů jsou plíce a/ nebo pleura (60 %), následují lymfatické uzliny (51 %) především v krční oblasti, kosti (31 %) s maximem postižení v obratlových tělech, a játra (22 %) [4]. Popsány jsou ale také případy postižení ledvin, nadledvinek, pankreatu, sleziny, srdce a kůže [4 – 6]. Nejhojněji se metastázy vyskytují u nemocných po prodělaném intrakraniálním operačním výkonu [7].
Kazuistika
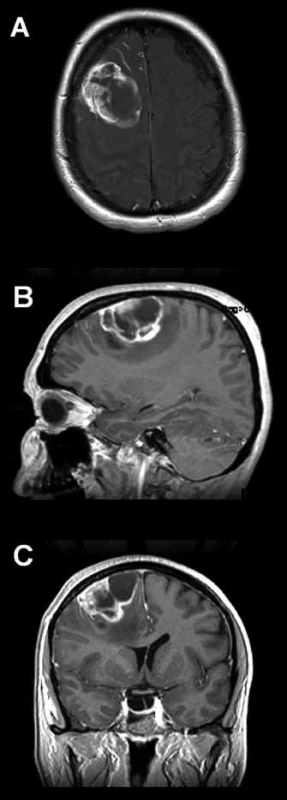
Třiačtyřicetiletá žena dosud vážněji nestonající, pociťovala měsíc bolesti hlavy s maximem v zátylku, s propagací do krku a do pravého ucha. V objektivním neurologickém nálezu byla naznačena centrální paréza nervus facialis vlevo a vyšší reflexy na levostranných končetinách. Magnetická rezonance (MR) mozku zobrazila frontodorzálně vpravo solitárně‑cystické ložisko, široce přisedlé k mozkovým plenám, s kolaterálním edémem, sytící se po podání kontrastní látky, velikosti 49 × 42 × 30 mm (obr. 1). Doplněná funkční MR ukázala centrální krajinu vzdálenou 5 mm od dorzálního okraje kolaterálního edému (obr. 2). Bylo vysloveno podezření na gliový tumor.
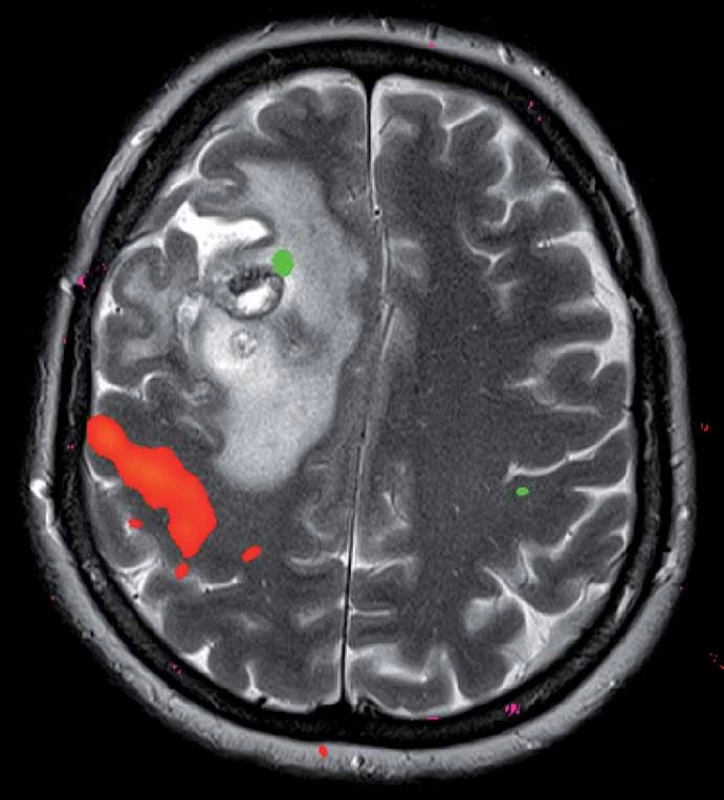
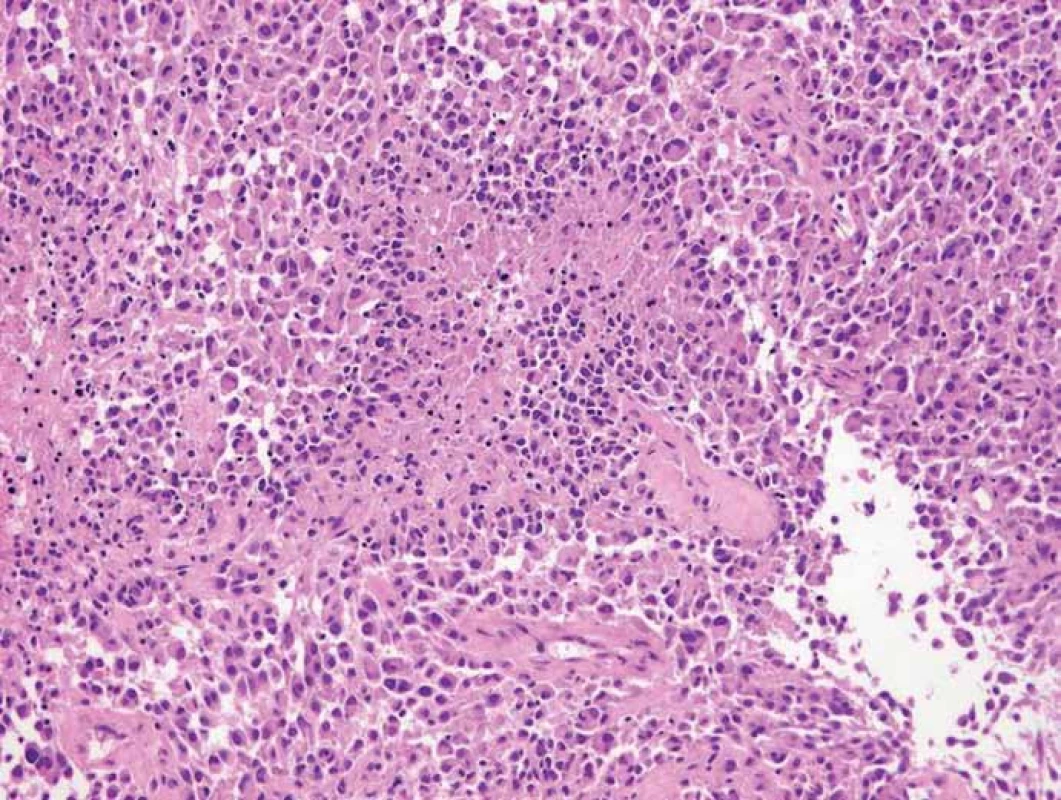
Nemocná podstoupila operační výkon – navigovanou resekci tumoru s peroperačním elektrofyziologickým monitoringem (zvrat fáze, kortikální stimulace). Peroperační biopsie z tumoru prokázala anaplastický astrocytom, který byl potvrzen i definitivními histopatologickými preparáty (obr. 3). Kontrolní magnetická rezonance provedená první den po operaci nezobrazila reziduum tumoru. Z hlediska zobrazovacích metod bylo odstranění tumoru radikální.
Pooperační průběh byl bez komplikací, rána se zhojila per primam intentionem. Nemocná byla propuštěna do domácí péče 12. pooperační den s normálním neurologickým nálezem.
Následovalo zevní radikální ozáření lůžka tumoru na lineárním urychlovači (referenční dávka 60 Gy) a nemocné byla též podána konkomitantně chemoterapie (temozolomid 75 mg/ m2, tj. v dávce 140 mg perorálně denně po celou dobu ozařování).
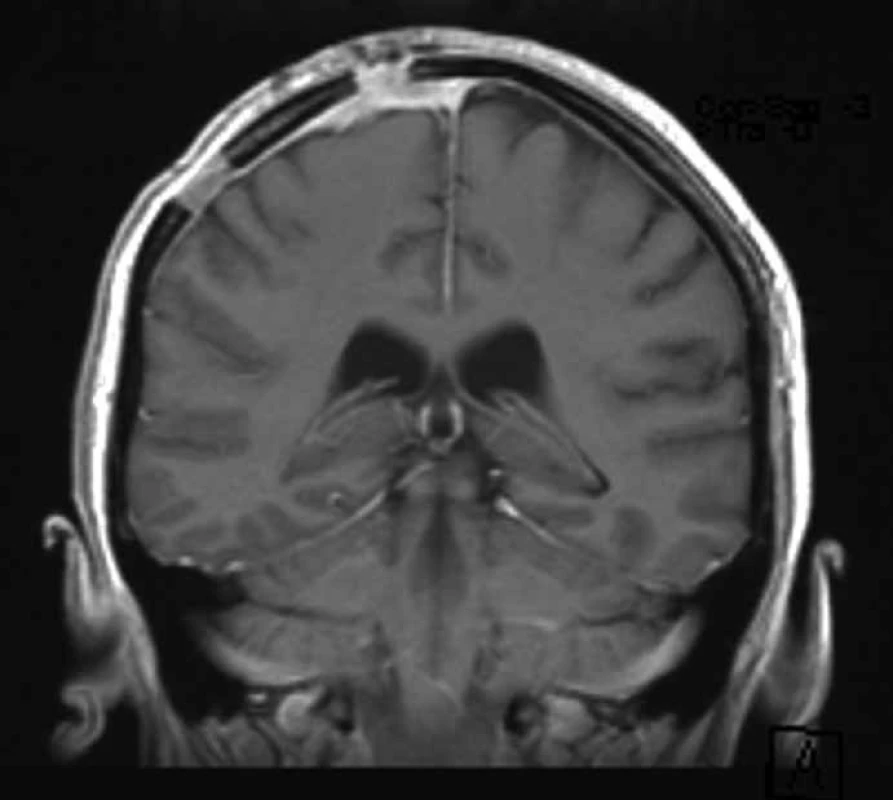
Kontrolní MR mozku po šesti měsících od operace nevykazovala známky recidivy nádoru, ztluštělé a sytící se pleny mozkové byly hodnoceny jako pooperační změny (obr. 4).
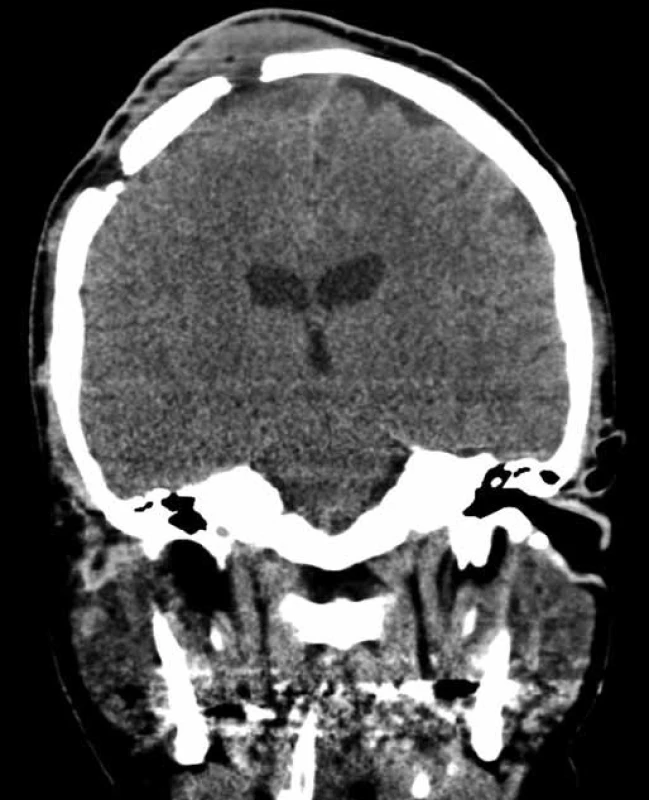
Sedm měsíců po operaci se u nemocné objevily bolesti hlavy při pobytu venku, subfebrilie, dominantním příznakem byl neustupující dráždivý kašel. Byla provedena počítačová tomografie (CT) plic s nálezem pokročilého postižení intersticia. Na základě zobrazení se nedalo jednoznačně rozlišit mezi nespecifickou intersticiální pneumonií, plicní fibrózou a karcinomatózní lymfangiopatií. Funkční vyšetření plic prokázalo těžkou ventilační poruchu restrikčního typu. Nemocná byla přijata k hospitalizaci s plánovaným dovyšetřením. Její stav se však začal velmi rychle horšit až do obrazu respirační insuficience, musela být zahájena umělá plicní ventilace. Bylo doplněno CT mozku s kontrastní látkou, které zobrazilo ložisko v mozkových plenách nad původní resekcí, propagující se přes otvory kraniotomie do měkkých pokrývek lebečních (obr. 5). Nativní CT břicha zjistilo ascites v peritoneální dutině. V dalším průběhu byla provedena plicní biopsie, která prokázala masivní infiltraci plicního parenchymu a pleury buňkami charakteru maligního metastatického tumoru, jež vykazovaly histopatologické znaky metastáz anaplastického astrocytomu. Byla indikována symptomatická terapie a nemocná 12. den od přijetí do nemocnice zemřela.
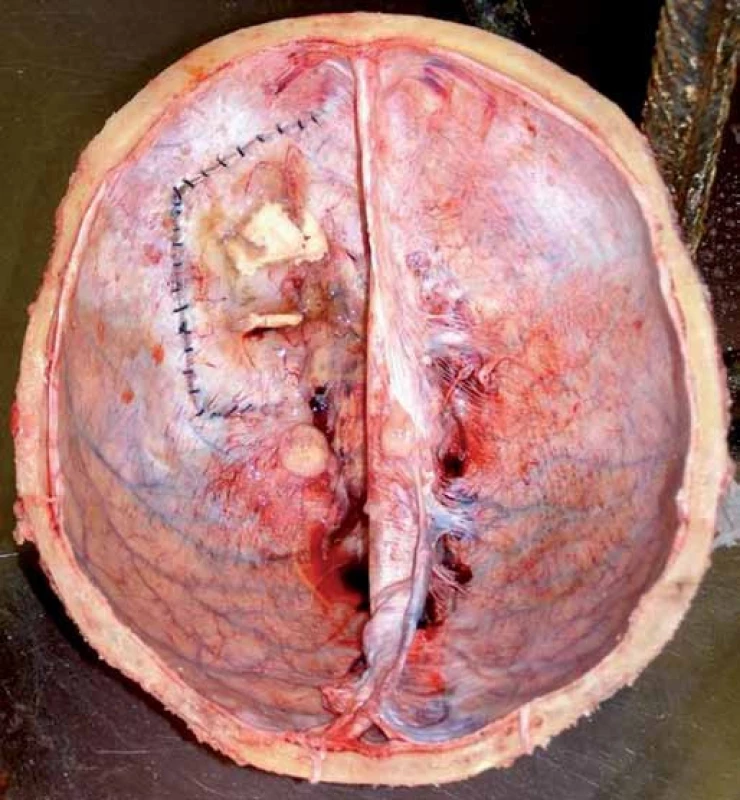
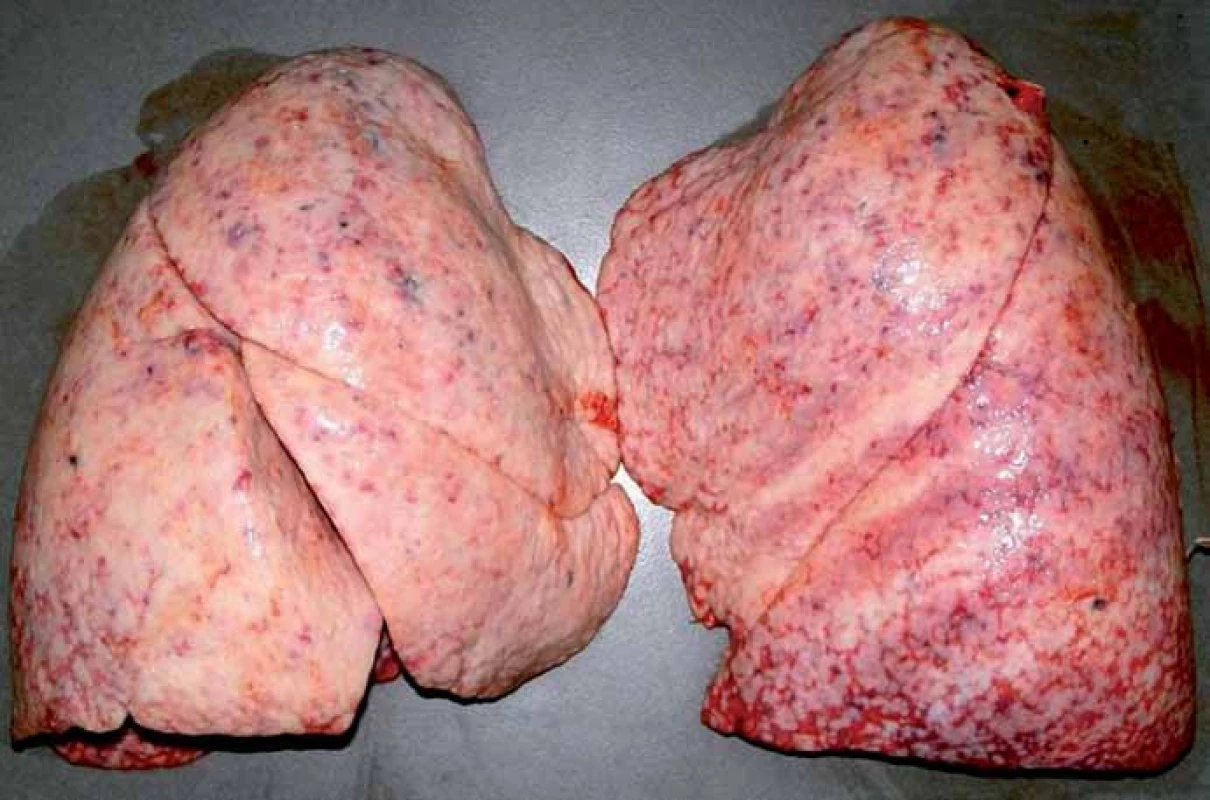
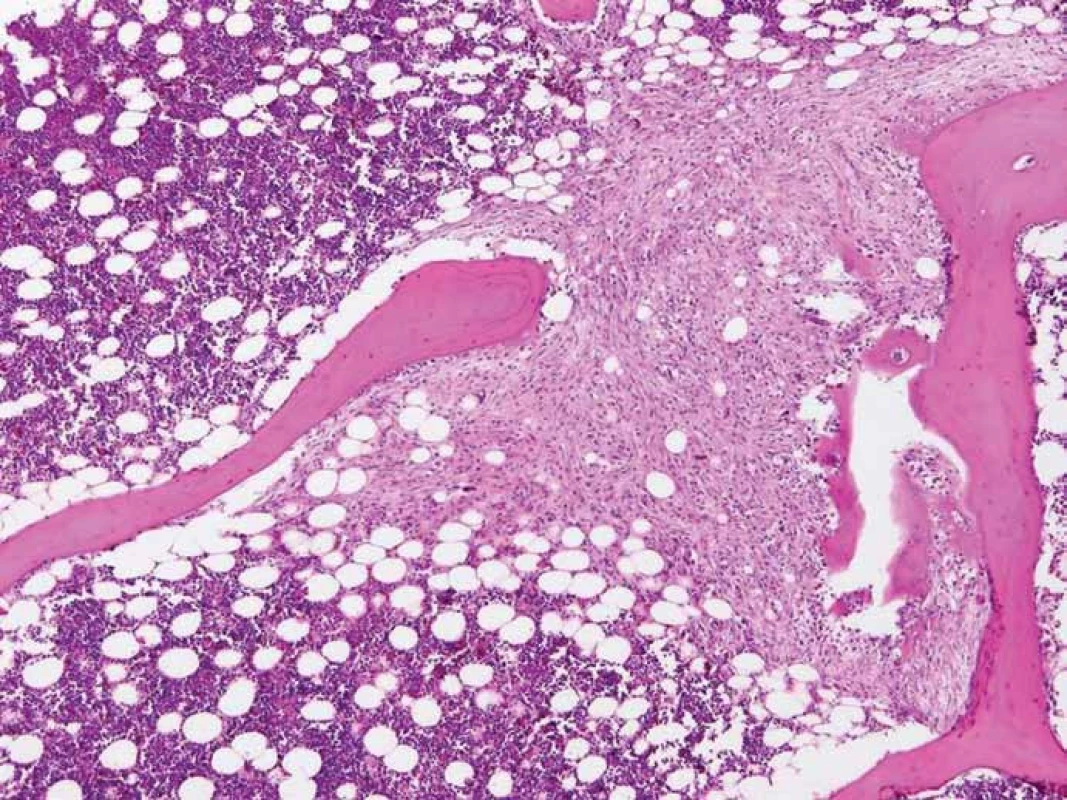
Pitva prokázala recidivu mozkového tumoru v oblasti předchozí operace v mozkových plenách a podkoží (obr. 6), ve vlastní mozkové tkáni se recidiva neprokázala. Dále byly zjištěny metastázy maligního gliomu v obou plicích (obr. 7) včetně nádorové lymfangiopatie, v játrech, v nadledvině a v bederních obratlech (obr. 8).
Diskuze
Zatímco intracerebrální metastázy nejsou u vysokostupňových gliomů ničím neobvyklým, vznik systémových metastáz je extrémně vzácný. Teorií, proč se tyto metastázy vyskytují tak zřídka, existuje několik. Jednou z nich byla dříve uváděná neschopnost gliových buněk přežívat v cizorodém, tj. extrakraniálním prostředí. Tato teorie však byla opakovaně vyvrácena experimenty, kdy byly buňky maligního gliomu implantovány do pleurální a peritoneální dutiny [8] či subkutánně [9,10], kde přežívaly a byly schopny růstu. Za další překážku metastazování se považuje předpokládaná nepřítomnost lymfatických cév v mozku, některé studie však podporují názor, že lymfatické cévy CNS existují [11]. Dalším uváděným důvodem je tenkost a poddajnost stěny intracerebrálních žil, které nedovolí penetraci tumoru, a konečně i krátká doba přežívání nemocných s high‑grade gliomem. Průměrná doba přežití je 8 – 15 měsíců u nemocných s nově diagnostikovaným glioblastomem, 24 – 36 měsíců u nemocných s anaplastickým astrocytomem a 60 měsíců u nemocných s anaplastickým oligodendrogliomem [12].
Výskyt extraneurálních metastáz je odhadován na pouhých 0,44 – 2 % všech pacientů s vysokostupňovým gliomem [5]. Ne všechna v literatuře zaznamenaná pozorování jsou však spolehlivá a dokonale dokumentovaná. Většina autorů při popisu extraneurálního rozsevu mozkového nádoru respektuje Weissova kritéria [13]:
- Musí jít o histologicky prokázaný primární nádor centrální nervové soustavy.
- Klinický průběh musí dokazovat, že počáteční příznaky byly způsobeny tímto nádorem.
- Musí být provedena úplná pitva, aby poskytla jistotu, že není nikde jiný primární tumor.
- Morfologie primárního nádoru centrální nervové soustavy a metastázy musí být identická.
V námi popisovaném případě byla splněna všechna tato kritéria.
Ley et al [14] dělí metastázy maligních gliomů na blízké a vzdálené. Podle tohoto dělení je do blízkých počítána lebka, pericranium a měkké tkáně hlavy a krku, do vzdálených pak plíce, kosti, lymfatické uzliny mediastina a hilu plic, játra, ledviny, pankreas, nadledviny, slezina, kůže a srdce. U naší nemocné se vyskytly metastázy jak blízké (mozkové pleny, podkoží hlavy), tak vzdálené (plíce, lymfatické uzliny, játra, nadledviny, bederní obratle).
Postižení plic se ukazuje jako prognostický faktor pro mimořádně špatný výsledný klinický stav [8]. V našem případě se rovněž jednalo o metastatické postižení plic, které bylo navíc symptomatické a klinicky dominantní. V porovnání s histopatologickými nálezy při pitvách je výskyt symptomatických metastáz sporadický [15].
Z dostupných pozorování vyplývá, že metastázy jsou častější u mladších pacientů (průměrný věk 45 let). Jsou též dokumentovány případy vzniku těchto metastáz v souvislosti s mutací genu p53 a amplifikací epidermálního růstového faktoru (EGFR). U naší nemocné genetické vyšetření provedeno nebylo.
Základní léčebný přístup u nemocných s high‑grade gliomem by měl být neurochirurgický zákrok – maximálně radikální resekce tumoru. Radikalita výkonu je rozhodující prognostický faktor [16]. Radikalitu resekce zvyšuje použití fluorescenčního zobrazení nádorové tkáně 5 - aminolevulovou kyselinou (5 - ALA resekce) [17].
Bezpečnost operace nádorů uložených v blízkosti elokventních oblastí umožňuje použít technologie, jako jsou funkční magnetická rezonance, traktografie, fluorescenční zobrazení nádorové tkáně, navigace a peroperační elektrofyziologický monitoring. V našem případě vzhledem k lokalizaci nádoru v blízkosti motorické krajiny byl využit peroperační elektrofyziologický monitoring. U nádorů lokalizovaných v řečové oblasti lze také použít techniku awake surgery – probuzení nemocného během operace se sledováním řeči. Tato technika u naší nemocné vzhledem k lokalizaci tumoru v nedominantní hemisféře využita nebyla. Pro volbu další léčebné strategie je rozhodující histologické ověření nádoru. Tato strategie by měla být ideálně řešena multidisciplinárním týmem ve složení neurochirurg, onkolog, neurolog. Současný léčebný standard je maximálně možná resekce tumoru následovaná konkomitantní chemoterapií (temozolomid) a radioterapií (obvyklá totální referenční dávka 60 Gy). I v případě neradikálně odstraněných nebo inoperabilních tumorů je možná konkomitantní radiochemoterapie v potenciaci s temozolomidem následovaná monoterapií temozolomidem až do progrese onemocnění. V našem případě pacientka prodělala radikální resekci tumoru s následující konkomitantní radiochemoterapií v potenciaci s temozolomidem, tedy standardní léčebný postup.
Třebaže operační výkon prodlužuje dobu přežití nemocných, je také spojen s vyšším rizikem výskytu metastáz – chirurgický zákrok totiž pravděpodobně poruší „biologickou bariéru“, a umožní tak šíření nádoru [18]. Inkompletní uzávěr dura mater či kostní defekty mohou umožnit přímou komunikaci mezi maligními buňkami tumoru a extrameningeálními cévami a lymfatickými cestami. Dle Pasquiera et al [6] negativní tlak v cévách otevřených během operace může způsobit aspiraci nádorových buněk s následným šířením hematogenní cestou. Gyepes et al [19] tvrdí, že nádorové buňky mohou poměrně snadno proniknout křehkou cévní stěnou během pooperačního hojení. Opakovaný operační výkon riziko vzniku metastáz dále zvyšuje. Známá je též souvislost metastazování se zavedením ventrikuloperitoneálního shuntu [4,6], tento zákrok je proto u nemocných s maligním nitrolebečním tumorem kontraindikován.
Spontánně vzniklé metastázy (bez předchozího operačního výkonu) jsou podstatně méně časté a jejich vznik je vysvětlován třemi možnými situacemi:
- infiltrací tumorózní tkáně skrz perivaskulární a durální prostor,
- drenáží mozkomíšního moku do extrakraniální tkáně podél durální membrány kraniálních a spinálních nervů [20],
- prorůstáním tumoru skrz meningeální žíly, lymfatické kanálky nebo přímo defektem v dura mater [20], tumory uložené v temporálním laloku jsou dokonce schopny destruovat kost [21].
Závěr
Každý zaznamenaný případ výskytu extrakraniálních, potažmo extraneurálních metastáz těchto tumorů je nejen atraktivní z hlediska kazuistického, ale může nás posunout dál v pochopení principů tohoto vzácného a zatím ne zcela objasněného jevu. Námi prezentovaný případ byl zajímavý jak četností systémů zasažených metastázami, tak také tím, že se nejednalo o gliový nádor nejvyššího stupně malignity, ale o grade III – anaplastický astrocytom, který zapříčinil takto rozsáhlé metastatické postižení.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Jolana Hommerová
Neurologická klinika
LF UK a FN Plzeň
Alej Svobody 80
304 60 Plzeň
e-mail: hommerovaj@fnplzen.cz
Přijato k recenzi: 4. 6. 2013
Přijato do tisku: 18. 7. 2013
Sources
1. Davis L. Spongioblastoma multiforme of the brain. Ann Surg 1928; 87(1): 8 – 14.
2. Šikl H. Glioma of the brain with metastasis into the lung. Acta Un Int Cancer 1950; 6 : 986 – 988.
3. Piccirilli M, Brunetto GM, Rocchi G, Giangaspero F,Salvati M. Extra central nervous system metastases from cerebral glioblastoma multiforme in elderly patiens. Clinico – pathological remarks on our series of seven cases and critical review of the literature. Tumori 2008; 94(1): 40 – 51.
4. Schweitzer T, Vince GH, Herbold C, Roosen K, Tonn JC. Extraneural metastases of primary brain tumors. J Neurooncol 2001; 53(2): 107 – 114.
5. Didelot A, Taillandier L, Grignon Y, Vespignani H,Beauchesne P. Concomitant bone marrow metastasis of a glioblastoma multiforme revealed at the diagnosis. Acta Neurochir (Wien) 2006; 148(9): 997 – 1000.
6. Pasquier B, Pasquier D, N‘Golet A, Meng Hong P, Couderc P. Extraneural metastases of astrocytomas and glioblastomas: clinicopathological study of two cases and review of literature. Cancer 1980; 45(1): 112 – 125.
7. Huang P, Allam A, Taghian A, Freeman J, Duffy M, Suit HD. Growth and metastatic behavior of five human glioblastomas compared with nine other histological types of human tumor xenografts in SCID mice. J Neurosurg 1995; 83(2): 308 – 315.
8. Zimmermann HM. The natural history of intracranial neoplasms with special reference to gliomas. Am J Surg 1957; 93(6): 913 – 924.
9. Battista AF, Bloom W, Loffman M, Feigin I. Autotransplantation of anaplastic astrocytoma into the subcutaneous tissue of man. Neurol (Minneap) 1961; 11 : 977 – 981.
10. Grace JT, Perese DM, Metzgar RS, Sasabe T, Holdridge B. Tumor autograft responses in patients with glioblastoma multiforme. J Neurosurg 1961; 18 : 159 – 167.
11. McComb JG. Recent research into the nature of cerebrospinal fluid formation and absorption. J Neurosurg 1983; 59(3): 369 – 383.
12. DeAngelis LM. Brain tumors. N Engl J Med 2001; 344(2): 114 – 123.
13. Weiss L. A metastasing ependymoma of the cauda equina. Cancer 1955; 8(1): 161 – 171.
14. Ley A, Campillo D, Oliveras C. Extracranial metastasis of glioblastoma multiforme. J Neurosurg 1961; 18 : 313 – 330.
15. Stark AM, Nabavi A, Mehdorn HM, Blomer U. Glioblastoma multiforme – report of 267 cases treated at a single institution. Surg Neurol 2005; 63(2): 162 – 169.
16. Hentschel SJ, Sawaya R. Optimizing outcomes with maximal surgical resection of malignant gliomas. Cancer Control 2003; 10(2): 109 – 114.
17. Lakomý R, Burkoň P, Burkoňová D, Jančálek R. Nové možnosti léčby glioblastoma multiforme. Klin Onkol 2010; 23(6): 381 – 387.
18. Mraček Z, Janda J. Glioblastoma multiforme s extrakraniálními metastázami. Cesk Neurol Neurochir 1975; 38(1): 19 – 24.
19. Gyepes MT, D‘Angio GJ. Extracranial metastases from central nervous system tumors in children and adolescents. Radiology 1966; 87(1): 55 – 63.
20. Dolman CL. Lymph node metastasis as first manifestation of glioblastoma. J Neurosurg 1974; 41(5): 607 – 609.
21. Nager GT. Gliomas involving the temporal bone clinical and pathological aspects. Laryngoscope 1967; 77(4): 454 – 488.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2013 Issue 6
-
All articles in this issue
- Komorbidita migrény a deprese – metaanalytická studie
- Okulofaryngeální muskulární dystrofie v populaci České republiky
- Telemetrický monitoring intrakraniálního tlaku v diagnostice hydrocefalu a nitrolební hypertenze
- Zlomeniny kondylu okciputu
- Distální fuziformní aneuryzma arteria temporalis anterior – kazuistika
- Magnetická rezonance v diagnostice kraniotraumat – kazuistika
- Idiopatická herniace míchy – kazuistika
- Mnohočetné extraneurální metastázy anaplastického astrocytomu – kazuistika
- Maligní tumor z pochvy periferního nervu v oblasti cervikálního plexu – kazuistika
- Neurologické diagnózy v diferencované hospicové péči – dvě kazuistiky
- Idiopatická superficiální sideróza – kazuistika
- Tuberózní skleróza u dětí sledovaných od novorozeneckého věku pro prenatální nález rhabdomyomů srdce – dvě kazuistiky
- Spondylodiscitida s abscesy v paravertebrálních svalech způsobená Streptococcus suis – kazuistika
- Selhání peroperační videoangiografie s využitím indocyaninové zeleně při detekci uzávěru mozkového aneuryzmatu klipem – kazuistika
- Expanze pineální krajiny
- Frontotemporálna lobárna degenerácia z pohľadu nových klinicko‑patologických korelácií
- Postižení kognitivních funkcí v časných fázích roztroušené sklerózy
- Předoperační psychosociální proměnné jako prediktory výsledku operace zad
- Vplyv prostredia virtuálnej reality počas roboticky asistovaného lokomočného tréningu na motorické funkcie pacientov s detskou mozgovou obrnou
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Frontotemporálna lobárna degenerácia z pohľadu nových klinicko‑patologických korelácií
- Tuberózní skleróza u dětí sledovaných od novorozeneckého věku pro prenatální nález rhabdomyomů srdce – dvě kazuistiky
- Expanze pineální krajiny
- Zlomeniny kondylu okciputu
