Chronický subdurální hematom
Chronic subdural haematoma
Chronic subdural haematoma represents one of the most frequent diseases which we deal with in common neurosurgical practice. Diagnosis of chronic subdural haematoma is usually determined by a neurologist, but patients with this diagnosis are commonly seen even by other specialists. The aim of this article is to provide a complete overview of etiology, pathophysiology, clinical presentation, diagnostics and treatment of this disease with regard to up to date knowledge and authors‘ experience.
Key words:
chronic subdural haematoma – subdural effusion – hyperfibrinolysis – brain CT – burr-hole craniostomy
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
P. Stejskal; M. Vaverka; L. Hrabálek; M. Hampl
Authors‘ workplace:
Neurochirurgická klinika LF UP a FN Olomouc
Published in:
Cesk Slov Neurol N 2019; 82(1): 25-29
Category:
Review Article
doi:
https://doi.org/10.14735/amcsnn201925
Overview
Chronický subdurální hematom představuje jedno z nejčastějších onemocnění, se kterým se setkáváme v běžné neurochirurgické praxi. Diagnózu chronického subdurálního hematomu obvykle stanoví neurologové, ale s pacienty s danou diagnózou se běžně setkávají i lékaři jiných odborností. Cílem sdělení je poskytnout ucelený přehled o etiologii, patogenezi, klinických projevech, diagnostice a léčbě tohoto onemocnění s ohledem na nejnovější poznatky a zkušenosti autorů.
Klíčová slova:
chronický subdurální hematom – subdurální kolekce – hyperfibrinolýza – CT mozku – trepanace
Úvod
Chronický subdurální hematom (CHSDH) je časté neurochirurgické onemocnění. Může se rozvinout v jakémkoli věku, ale typickou skupinu tvoří starší pacienti. Incidence CHSDH v evropských zemích je 2 – 3/ 100 000 obyvatel [1], zajímavé je, že v Japonsku až 20/ 100 000 [2]. Se stárnutím populace incidence očekávaně narůstá [3]. V ČR podstoupí operaci CHSDH přibližně 1 000 pacientů ročně. CHSDH představuje chronickou opouzdřenou kolekci tekutiny tvořenou krví a jejími rozpadovými produkty v subdurálním prostoru, tj. mezi vnitřní vrstvou tvrdé pleny a arachnoideou. CHSDH se typicky rozvíjí několik týdnů s pozdním nástupem klinických projevů. Iniciálním momentem rozvoje CHSDH je krvácení z přemosťujících žil mozku do subdurálního prostoru s následným patologickým rozvojem zvětšující se opouzdřené kolekce [4 – 6]. CHSDH je považován zdánlivě za benigní onemocnění s velkou hojivou tendencí, ale pokud by nebylo správně diagnostikováno a adekvátně léčeno, mohlo by být až smrtelné z důvodu komprese mozku a rozvoje temporálního konu. V dnešní době je díky diagnostickým možnostem, snadné dostupnosti CT vyšetření a kvalitní neurochirurgické péči daná situace vzácná.
Etiologie a patogeneze
S CHSDH se můžeme setkat u pacientů jakéhokoli věku, nicméně u dětí jde o samostatnou problematiku, která není předmětem daného sdělení. V naprosté většině případů se jedná o problematiku starších pacientů [3]. Tento fakt si vysvětlujeme atrofií mozku jako jedním z hlavních predisponujících faktorů. V důsledku toho dochází k napínání přemosťujících žil na konvexitě mozku, kdy i mírný náraz hlavy může způsobit pohyb hemisféry a natržení napjaté žíly [4 – 6]. Dalšími predisponujícími faktory logicky budou nejrůznější koagulopatie, ať už iatrogenní, v případě pacientů užívajících antikoagulancia, nebo primární či sekundární v důsledku jiných chorob. Antiagregační léčba taktéž predisponuje k rozvoji CHSDH [7 – 9]. Chronický etylizmus je dalším rizikovým faktorem vedoucím k rozvoji atrofie mozku, zhoršení koagulačních parametrů, zvýšení fragility cév a především k opakovaným pádům. V etiologii subdurálního hematomu se může uplatnit i nitrolební hypotenze, a to např. v důsledku dehydratace či drenážní operace [10].
Nejčastějším vyvolávajícím momentem rozvoje CHSDH je kraniotrauma [11,12], byť jen minimální, při kterém může u predisponovaných pacientů dojít k natržení přemostujících žil mozku a krvácení do subdurálního prostoru. Čerstvá krevní kolekce v subdurálním prostoru se časně zcela fyziologicky mění v krevní koagulum. Záhy dojde ke zmnožení fibroblastů v oblasti tvrdé pleny, které postupně začnou migrovat do vlastního hematomu. Následně začnou z vnitřní vrstvy tvrdé pleny do hematomu prorůstat neokapiláry, zvané sinusoidy. Tento obraz je patrný již po 1 týdnu od vzniku krvácení. V případě CHSDH dochází v následujících týdnech k rozpadu krevních elementů a spolu s fibrinolytickými procesy dojde ke kompletnímu zkapalnění hematomu. Tím je znemožněno další prorůstání granulační tkáně do krevního koagula. V této fázi hovoříme o vlastním CHSDH, tedy opouzdřené kolekci tekutiny ohraničené vnější silnější vaskularizovanou membránou a vnitřní tenkou avaskulární blankou [4 – 6]. Vytvořené pouzdro CHSDH je možné detekovat na MR již za 14 dní. Progresi velikosti CHSDH si vysvětlujeme opakovaným krvácením do dutiny hematomu z novotvořených kapilár vnějšího pouzdra hematomu. Tyto kapiláry jsou tenké, bez souvislé endoteliální výstelky, fragilní, a tedy snadno prostupné pro krevní elementy [4,13]. Vzhledem k tomu, že zkapalněný hematom již neobsahuje žádný fibrinogen při aktivovaném fibrinolytickém procesu, má tekutý obsah CHSDH v podstatě protisrážlivý účinek, čímž je potencováno opakované krvácení do dutiny hematomu [13,14]. V neposlední řadě k progresi objemu subdurální kolekce přispěje i zvýšená permeabilita méněcenných neokapilár vnějšího pouzdra hematomu [15,16]. Osmotická teorie, léta vysvětlující nárůst hematomu, byla opakovaně vyvrácena [4,17].
Klinické projevy
Klinické projevy CHSDH jsou dány nárůstem nitrolební hypertenze, přímou kompresí mozku zvětšujícím se hematomem a především lokální poruchou perfuze vedoucí k ischemizaci mozkové tkáně pod místem komprese [18]. CHSDH je zpočátku asymptomatický, klinicky se projeví za týdny až měsíce od svého vzniku, po vyčerpání rezervy intrakraniálního prostoru. Rezervy jsou o to větší v případě atrofie mozku. Klinické projevy mohou být zpočátku zcela nespecifické, jako je bolest hlavy, často lokalizovaná na jedné polovině, dále psychické poruchy, nesoustředěnost, únava, apatie, změna osobnosti. Vyjádření daných příznaků může být velmi variabilní. Již o něco typičtější je, při další progresi velikosti hematomu, rozvoj fokální neurologické symptomatiky, jako jsou hemiparéza, fatická porucha. Pokud není ani v daném stadiu hematom adekvátně léčen, může vést až k rozvoji mozkového konu se všemi příznaky a důsledky. Relativně méně častým projevem může být i epileptický záchvat. Závažnost klinických projevů lze hodnotit dle známé Markwalderovy klasifikace z roku 1981 [19].
Diagnostika
Suverénní metodou ke stanovení diagnózy CHSDH je v dnešní době CT vyšetření mozku. Zobrazuje se jako různě denzní lem, v typickém případě srpkovitého tvaru, mezi povrchem mozku a vnitřní laminou kalvy. V naprosté většině případů je lokalizován nad konvexitami hemisfér (obr. 1). Poměrně často (v 20 – 25 % případů) diagnostikujeme hematom oboustranně [20]. Denzita hematomu se mění dle stáří hematomu a přítomnosti čerstvé krve. Akutní hematom je vůči mozkové tkáni hyperdenzní. Řádově za 2 – 3 týdny se v důsledku rozkladu mění v izodenzní, což může vést k diagnostickému pochybení u oboustranné kolekce. Starší hematomy jsou již obvykle hypodenzní. Denzita hematomu může být smíšená, daná přítomností čerstvé krve, krevním sedimentem či přítomností sept v dutině hematomu. Nakaguchi et al vytvořili klasifikaci CHSDH dle CT obrazu s možnou predikcí úspěšnosti operační léčby. Popisují 4 typy hematomů – homogenní, laminární, separovaný a trabekulární. Prokázali, že recidivy jsou méně časté u homogenního a trabekulárního typu [21,22]. Dle míry komprese mozku jsou patrny vyhlazení gyrifikace, defigurace postranní komory, přesun středočárových struktur kontralaterálně a nakonec deformace cisteren kolem mozkového kmene. CT mozku s kontrastní látkou může být přínosná právě u izodenzních CHSDH, kdy dojde ke zvýraznění hranice mezi mozkem a hematomem.
Fig. 1. CT scan of the brain with a typical
fi nding of a chronic subdural haematoma
in the right fronto-temporo-parieto-occipital
area.
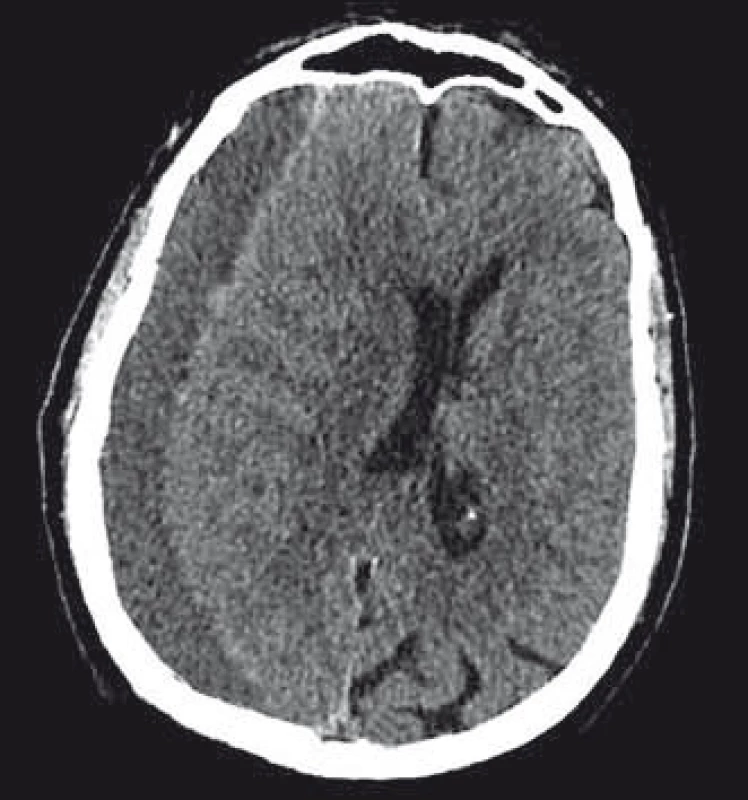
Tak jako je MR mozku v dnešní době zcela zásadní v diagnostice celé řady intrakraniálních patologií, prostá CT mozku je převážně dostatečná pro stanovení diagnózy CHSDH. MR může být přínosná při zobrazení izodenzního a především bilaterálního izodenzního hematomu, kdy poskytne lepší informaci o lokalitě a tlakovém působení na okolní struktury. CHSDH je hypersignální v T1 i T2 vážených sekvencích. Také lépe zobrazí vytvořené vazivové pouzdro hematomu [23].
Léčba
Léčba symptomatického CHSDH je v zásadě chirurgická. Stále se diskutuje o různých variantách operačních postupů, nicméně podstatou všech je vypuštění expanzivně se chovající subdurální kolekce. Následně může dojít k reexpanzi mozku, redukci dutiny hematomu, a tím spojení vnějšího a vnitřního pouzdra, jejich zjizvení a zhojení hematomu. Standardní operační výkon u CHSDH spočívá v provedení trepanace, obvykle nad maximem kolekce, následné durotomii s protnutím vnějšího pouzdra hematomu a evakuaci tekuté porce. Charakter tekutiny může být různý: od tmavé husté připomínající „vyjetý motorový olej“ po xantochromní čirou tekutinu již odbarveného hematomu. Může být patrna i příměs čerstvé krve. Do dutiny CHSDH je obvykle zaveden drén, vyveden mimo ránu a následně napojen na uzavřený drenážní systém ponechaný se spádovým gradientem 50 – 80 cm pod úrovní hlavy [24]. Založení drenáže je prokazatelně spojeno s nižším počtem recidiv onemocnění [25]. Po operaci je drenáž ponechána obvykle 1 – 3 dny do ústupu sekrece, ponechání drenáže 4 dny a více již není prospěšné [26]. Výkon je možné při dobré spolupráci pacienta provést v lokální anestezii. Na našem pracovišti je naprostá většina pacientů operována v lokální anestezii, výkon je dobře tolerován.
Existuje mnoho variant daného postupu. Jsou popisovány operace s prováděním dvou trepanačních návrtů s možností výplachu subdurálního prostoru mezi návrty a následným zavedením drénů. Dle metaanalýzy Belkhaira et al ale nebyl prokázán přínos provedení dvou návrtů ve srovnání s jedním [27]. Tradičně byl součástí trepanace a drenáže i peroperační výplach subdurálního hematomu, nicméně nedávno publikovaná metaanalýza Yuana et al srovnávající výsledky operačních postupů s výplachem subdurálního hematomu a bez něj neshledala statisticky významný rozdíl ve výsledcích obou operací [28]. Na našem pracovišti již máme 4letou zkušenost s prováděním výhradně trepanace a drenáže, bez výplachu subdurálního hematomu, při primární léčbě CHSDH. Naše dosavadní výsledky nejsou taktéž statisticky významně rozdílné ve srovnání s dříve u nás prováděným postupem s výplachem. Použití metody bez výplachu jako méně invazivního a rychlejšího postupu se tedy jeví vhodnější. Byla publikována celá řada dalších operačních postupů léčby CHSDH, které ale většinou zůstávají na úrovni malých retrospektivních studií či kazuistik. Jde o použití endoskopu při evakuaci hematomu [29], aplikaci kyslíku [30] či oxidu uhličitého [31] do subdurálního prostoru na místo evakuovaného hematomu či peroperační aplikaci tkáňového aktivátoru plazminogenou do dutiny hematomu [32]. Srovnávání efektivity jednotlivých postupů je stále předmětem mnoha studií.
Po operaci je nález reziduální subdurální kolekce běžný, kompletní regrese není nezbytná pro odeznění klinických potíží. Markwalder et al ve svých studiích prokázali, že 10. pooperační den je reziduální subdurální kolekce na zobrazení mozku CT stále patrna u 78 % pacientů, 40 dní po operaci již jen u 15 %, kompletní regrese může trvat až 6 měsíců [19].
Bohužel u 5 – 33 % pacientů dochází po primární operaci k recidivě subdurální kolekce s opětovným zhoršením klinického stavu, jenž vyžaduje opakovanou intervenci [33 – 36]. Je možné se pokusit o jednorázovou punkci a evakuaci subdurální kolekce přes původní návrt nebo provést nový ve výhodnější lokalizaci. Nicméně i přes maximální snahu o vyřešení CHSDH zmíněnými „méně invazivními“ postupy dojde u 9 % pacientů dle našich zkušeností k vytvoření tlustého vazivového pouzdra, které brání reexpanzi mozku a je příčinou klinických příznaků. V tomto případě jsme nuceni již přistoupit ke kraniotomii s exstirpací pouzdra hematomu a koagul [3,4]. Jedná se již o náročnější operační výkon prováděný v celkové anestezii, spojený s vyšší mortalitou a morbiditou. Vzhledem k velkému riziku recidivy subdurální kolekce kvůli nízké tendenci mozku k reexpanzi je dle našich zkušeností vhodnější provedení kraniektomie, tedy nevracet kostní ploténku a minimalizovat tím velikost subdurálního prostoru. Kranioplastiku provádíme s odstupem několika měsíců po zhojení a zlepšení klinického stavu. Nicméně statisticky podložené doporučení o provedení kraniektomie po exstirpaci pouzdra CHSDH nyní nelze pro nedostatek studií vyslovit. U pacientů s rozvojem epileptických záchvatů, kromě léčby vlastního CHSDH, podáváme antiepileptika [4].
Konzervativní, eventuálně podpůrná pooperační medikamentózní léčba, je stále ve stadiu výzkumů. Příslibem jsou inhibitory angiotenzin konvertujícího enzymu [37], tranexamová kyselina [38 – 40], kortikoidy [41]. Nicméně jsou třeba ještě další větší studie k definitivnímu potvrzení příznivého účinku a eventuálnímu zařazení do léčebného algoritmu.
Antikoagulační a antiagregační léčba u pacientů s CHSDH
U pacientů s CHSDH se velmi často setkáváme s antikoagulační či antiagregační léčbou. Tito pacienti proto mají nejen vyšší riziko vzniku CHSDH [7 – 9], ale i samotná jeho léčba je komplikovanější.
Stále nejčastěji používaným lékem ze skupiny antikoagulancií je warfarin, méně často se setkáváme s užíváním direktních perorálních antikoagulancií (DOAK: dabigatran, apixaban, rivaroxaban). U warfarinizovaných pacientů je nutné před chirurgickým výkonem normalizovat koagulační parametry snížením international normalised ratio alespoň pod 1,5 [42]. Pokud klinický stav nevyžaduje akutní úpravu, je možné podat vitamin K s postupnou úpravou koagulopatie [43], v akutním případě pak transfuzi čerstvé mražené plazmy či lépe přímo koncentrát protrombinového komplexu [44]. U pacientů užívajících DOAK je dostačující operační léčbu CHSDH odložit (pokud to klinický stav dovoluje) o cca 24 h, kdy dojde k odeznění účinku daných léků. V případě užívání dabigatranu a nutnosti provedení výkonu akutně je možné podat specifické antidotum – idarucizumab.
Otázka opětovného zahájení užívání perorálního antikoagulancia po operaci CHSDH je složitější. Stále nemáme dostatek studií s větším počtem pacientů, na základě kterých bychom mohli tuto otázku jednoznačně zodpovědět. Některé studie sice prokazují, že zahájení podávání perorálních antikoagulancií již 3 dny po operaci je bezpečné a nezvyšuje riziko recidivy CHSDH [45,46], jiné ale ukázaly, že časné pooperační podávání nízkomolekulárního heparinu či perorálních antikoagulancií ovlivní počet reoperací a vede k horším výsledkům [47]. Praxe je tedy obvykle taková, že pooperačně je pacientům aplikován nízkomolekulární heparin a převod na perorální antikoagulancia je proveden nejdříve po zhojení operační rány, tj. cca 10. pooperační den, s individuálním posouzením každého pacienta.
Mezi nejčastěji používaná antiagregancia patří kyselina acetylsalicylová (ASA) a klopidogrel. Funkce trombocytů je plně obnovena po 7 dnech od posledního užití ASA či klopidogrelu [48]. V případě mírnějších klinických projevů a nevýrazného CT nálezu CHSDH je možné chirurgický výkon odložit, při urgenci je výkon obvykle prováděn bez zvláštní přípravy. Otázka načasování opětovného zahájení pooperačního užívání antiagregancií je také nejasná. Zatím nemáme doporučení založené na důkazech. V praxi je doporučováno zahájení rovněž po zhojení operační rány.
Komplikace léčby
Nejčastější komplikace chirurgické léčby CHSDH je jeho recidiva, dle literatury nastává v 5 – 33 % [29 – 32]. Rozvíjí se obvykle pozvolna, řádově týdny, projeví se návratem klinických příznaků. Hlavním rizikovým faktorem je snížená tendence atrofického mozku k reexpanzi. Pravděpodobnost recidivy zvyšuje i pooperační pneumocefalus. Čtyři pětiny objemu pneumocefalu jsou tvořeny pomalu se vstřebávajícím dusíkem, který brání slepení subdurálního prostoru [49]. Mezi méně častou závažnou komplikaci, se kterou se setkáváme řádově v jednotkách procent, patří rozvoj akutního krvácení, a to do dutiny CHSDH, vzácně epidurálně v místě trepanace či intracerebrálně v důsledku hyperperfuzního syndromu po rychlé dekompresi [20]. S infekcí operační rány a rozvojem subdurálního empyému se setkáváme taktéž v jednotkách procent [29], častěji u pacientů s vynucenými následnými výkony při recidivě. Vzhledem ke zvýšené polymorbiditě nemocných s CHSDH evidujeme zvýšenou tendenci k běžným chirurgickým komplikacím (tromboembolizmus, infekce dýchacích a močových cest) [50].
Závěr
Chronický subdurální hematom představuje časté neurochirurgické onemocnění typické pro starší pacienty. Jde o zdánlivě benigní onemocnění s velkou hojivou tendencí, které ale bez korektní léčby může vést až ke smrti pacienta. Diagnostika je v době moderních zobrazovacích metod snadná. Jednoduchý chirurgický výkon spočívající v návrtu lebky, vypuštění hematomu a dočasné drenáži je u většiny pacientů dostatečný ke kompletnímu vyléčení. Nicméně i přes svoji zdánlivou jednoduchost je léčba u části pacientů velmi komplikovaná. Kompletní pochopení patofyziologických mechanizmů s následnou možností pozitivního ovlivnění výsledků léčby CHSDH bude jistě předmětem mnoha dalších studií.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Přemysl Stejskal
Neurochirurgická klinika LF UP
a FN Olomouc
I.P. Pavlova 185/6
779 00 Olomouc
e-mail: premysl.stejskal@fnol.cz
Přijato k recenzi: 11. 8. 2018
Přijato do tisku: 10. 12. 2018
Sources
1. Krupa M. Chronic subdural hematoma: a review of the literature. Part 1. Ann Acad Med Stetin 2009; 55(2): 47 – 52.
2. Karibe H, Kameyama M, Kawase M et al. Epidemiology of chronic subdural hematomas. No Shinkei Geka 2011; 39(12): 1149 – 1153.
3. Santarius T, Kirkpatrick PJ, Kolias AG et al. Working toward rational and evidence-based treatment of chronic subdural hematoma. Clin Neurosurg 2010; 57 : 112 – 122.
4. Ducruet AF, Grobelny BT, Zacharia BE et al. The surgical management of chronic subdural hematoma. Neurosurg Rev 2012; 35(2): 155 – 169. doi: 10.1007/ s10143-011-0349-y.
5. Drapkin AJ. Chronic subdural hematoma: pathophysiological basis for treatment. Br J Neurosurg 1991; 5(5): 467 – 473.
6. Sajanti J, Majamaa K. High concentrations of procollagen propeptides in chronic subdural haematoma and effusion. J Neurol Neurosurg Psychiatry 2003; 74(4): 522 – 524.
7. Baechli H, Nordmann A, Bucher HC et al. Demographics and prevalent risk factors of chronic subdural haematoma: results of a large single-center cohort study. Neurosurg Rev 2004; 27(4): 263 – 266.
8. Rust T, Kiemer N, Erasmus A. Chronic subdural haematomas and anticoagulation or antithrombotic therapy. J Clin Neurosci 2006; 13(8): 823 – 827. doi: 10.1016/ j.jocn.2004.12.013.
9. Lindvall P, Koskinen LO. Anticoagulants and antiplatelet agents and the risk of development and recurrence of chronic subdural haematomas. J Clin Neurosci 2009; 16(10): 1287 – 1290. doi: 10.1016/ j.jocn.2009.01.001.
10. Markwalder TM. Chronic subdural hematomas: a review. J Neurosurg 1981; 54(5): 637 – 645. doi: 10.3171/ jns. 1981.54.5.0637.
11. Chen JC, Levy ML. Causes, epidemiology, and risk factors of chronic subdural hematoma. Neurosurg Clin N Am 2000; 11(3): 399 – 406.
12. Sambavian M. An overview of chronic subdural hematoma: experience with 2300 surgical cases. Surg Neurol 1997; 47(5): 418 – 422.
13. Murakami H, Hirose Y, Sagoh M et al. Why do chronic subdural hematomas continue to grow slowly and not coagulate? Role of trombomodulin in the mechanism. J Neurosurg 2002; 96(5): 877 – 884. doi: 10.3171/ jns. 2002.96.5.0877.
14. Kawamaki Y, Chikama M, Tamiya T et al. Coagulation and fibrinolysis in chronic subdural hematoma. Neurosurgery 1989; 25(1): 25 – 29.
15. Suzuki K, Takano S, Nose T et al. Increased concentration of vascular endothelial growth factor (VEGF) in chronic subdural hematoma. J Trauma 1999; 46(3): 532 – 533.
16. Weigel R, Schilling L, Schmiedek P. Specific pattern of growth factor distribution in chronic subdural hematoma (CSH): evidence for an angiogenic disease. Acta Neurochir (Wien) 2001; 143(8): 811 – 818.
17. Weir B. Oncotic pressure of subdural fluids. J Neurosurg 1980; 53(4): 512 – 515. doi: 10.3171/ jns.1980.53.4.0512.
18. Ischikawa T, Kawamura S, Hadeishi H et al. Cerebral blood flow and oxygen metabolism in hemiparetic patiens with chronic subdural hematoma. Quantitative evaluation using positron emission tomography. Surg Neurol 1995; 43(2): 130 – 137.
19. Markwalder TM, Steinsiepe KF, Rohner M et al. The course of chronic subdural hematomas after burr-hole craniostomy and closed-system drainage. J Neurosurg 1981; 55(3): 390 – 396.
20. Greenberg MS. Chronic subdural hematoma. Handbook of Neurosurgery. 7th ed. New York: Thieme 2010 : 899 – 902.
21. Nakaguchi H, Tanishima T, Yoshimasu N. Factors in the natural history of chronic subdural hematomas that influence their postoperative recurrence. J Neurosurg 2001; 95(2): 256 – 262. doi: 10.3171/ jns.2001.95.2.0256.
22. Chon KH, Lee JM, Koh EJ et al. Independent predictors for recurrence of chronic subdural hematoma. Acta Neurochir 2012; 154(9): 1541 – 1548. doi: 10.1007/ s00701-012-1399-9.
23. Senturk S, Guzel A, Bilici A et al. CT and MR imaging of chronic subdural hematomas: a comparative study. Swiss Med Wkly 2010; 140(23 – 24): 335 – 340. doi: smw-12867.
24. Vaverka M, Kala M. Zkušenosti s léčbou chronického subdurálního hematomu dospělých. Cesk Slov Neurol N 1993; 56/ 89(4): 155 – 159.
25. Santarius T, Kirkpatrick PJ, Ganesan D et al. Use of drains versus no drains after burr-hole evacuation of chronic subdural haematoma: a randomised controlled trial. Lancet 2009; 374(9695): 1067 – 1073. doi: 10.1016/ S0140-6736(09)61115-6.
26. Sindou M, Ibrahim I, Maarrawi J. Chronic subdural hematomas: twist drill craniostomy with a closed system of drainage, for 48 hours only, is a valuable surgical treatment. Acta Neurochir 2010; 152(3): 545 – 546. doi: 10.1007/ s00701-009-0489-9.
27. Belkhair S, Pickett G. One versus double burr holes for treating chronic subdural hematoma meta-analysis. Can J Neurol Sci 2013; 40(1): 56 – 60.
28. Yuan Y, Wang QP, Cao YL et al. Burr hole drainage and burr hole drainage with irrigation to treat chronic subdural hematoma: a systematic review and meta-analysis. Medicine (Baltimore) 2018; 97(33): e11827. doi: 10.1097/ MD.0000000000011827.
29. Rodziewicz GS, Chuang WC. Endoscopic removal of organized chronic subdural hematoma. Surg Neurol 1995; 43(6): 569 – 572.
30. Takeda N, Sasaki K, Oikawa A et al. A new simple therapeutic method for chronic subdural hematoma without irrigation and drainage. Acta Neurochir (Wien) 2006; 148(5): 541 – 546. doi: 10.1007/ s00701-005-0689-x.
31. Kubo S, Takimoto H, Nakata H et al. Carbon dioxide insufflation for chronic subdural haematoma: a simple addition to burr-hole irrigation and closed-system drainage. Br J Neurosurg 2003; 17(6): 547 – 550.
32. Neils DM, Singanallur PS, Wang H et al. Recurrence-free chronic subdural hematomas: a retrospective analysis of the instillation of tissue plasminogen activator in addition to twist drill or burr hole drainage in the treatment of chronic subdural hematomas. World Neurosurg 2012; 78(1 – 2): 145 – 149. doi: 10.1016/ j.wneu.2011.08.032.
33. Gelabert GM, Iglesias PM, Garcia AA et al. Chronicsubdural haematoma: surgical treatment and outcome in 1000 cases. Clin Neurol Neurosurg 2005; 107(3): 223 – 229. doi: 10.1016/ j.clineuro.2004.09.015.
34. Santarius T, Qureshi HU, Sivakumaran R et al. The role of external drains and peritoneal conduits in the treatment of recurrent chronic subdural hematoma. World Neurosurg 2010; 73(6): 747 – 750. doi: 10.1016/ j.wneu.2010.03.031.
35. Sikahall ME, Salazar PN, Sandoval BB. Chronic subduralhematoma. Surgical management in 100 patients. Cir Cir 2008; 76(3): 199 – 203.
36. Chon KH, Lee JM, Koh EJ et al. Independent predictors for recurrence of chronic subdural hematoma. Acta Neurochir (Wien) 2012; 154(9): 1541 – 1548. doi: 10.1007/ s00701-012-1399-9.
37. Berghauser Pont LM, Dirven CM, Dippel DW et al. The role of corticosteroids in the management of chronic subdural hematoma: a systematic review. Eur J Neurol 2012; 19(11): 1397 – 1403. doi: 10.1111/ j.1468-1331.2012.03768.x.
38. Tanweer O, Frisoli FA, Bravate C ett. al. Tranexamic acid for treatment of residual subdural hematoma after bedside twist-drill evacuation. World Neurosurg 2016; 91 : 29 – 33. doi: 10.1016/ j.wneu.2016.03.062.
39. Kageyama H, Toyooka T, Tsuzuki N et al. Nonsurgical treatment of chronic subdural hematoma with tranexamic acid. Neurosurg 2013; 119(2): 332 – 337. doi: 10.3171/ 2013.3.JNS122162.
40. Iorio MC, Blanchard J, Richer M et al. Tranexamic acid in chronic subdural hematomas (TRACS): study protocol for a randomized controlled trial. Trials 2016; 17(1): 235. doi: 10.1186/ s13063-016-1358-5.
41. Weigel R, Hohenstein A, Schlickum L et al. Angiotensin converting enzyme inhibition for arterial hypertension reduces the risk of recurrence in patiens with chronic subdural hematoma possibly by an antiangiogenic mechanism. Neurosurgery 2007; 61(4): 788 – 792. doi: 10.1227/ 01.NEU.0000298907.56012.E8.
42. Tuka V, Janotam T. Warfarin – starý známý a přece stále neznámý. Interní Med 2011; 13(6): 244 – 246.
43. Hanley JP. Warfarin reversal. J Clin Pathol 2004; 57(11): 1132 – 1139. doi: 10.1136/ jcp.2003.008904.
44. Lankiewicz MW, Hays J, Friedman KD et al. Urgent reversal of warfarin with prothrombin complex concentrate. J Thromb Haemost 2006; 4(5): 967 – 970. doi: 10.1111/ j.1538-7836.2006.01815.x.
45. Kawamata T, Takeshita M, Kubo O et al. Management of intracranial hemorrhage associated with anticoagulant therapy. Surg Neurol 1995; 44(5): 438 – 442.
46. Yeon JY, Kong DS, Hong SC. Safety of early warfarin resumption following burr hole drainage for warfarin-associated subacute or chronic subdural hemorrhage. J Neurotrauma 2012; 29(7): 1334 – 1341. doi: 10.1089/ neu.2011.2074.
47. Forster MT, Mathe AK, Senft C et al. The influence of preoperative anticoaglation on outcome and quality of life after surgical treatment of chronic subdural hematoma. J Clin Neurosci 2010; 17(8): 975 – 979. doi: 10.1016/ j.jocn.2009.11.023.
48. Mascarenhas L. Illustration of the impact of antiplatelet drugs on the genesis and management of chronic subdural hematoma. Neurochirurgie 2012; 58(1): 47 – 51. doi: 10.1016/ j.neuchi.2011.09.005.
49. Ohba S, Kinoshita Y, Nakagawa T et al. The risk factors for recurrence of chronic subdural hematoma. Neurosurg Rev 2013; 36(1): 145 – 149. doi: 10.1007/ s10143-012-0396-z.
50. Blažek M, Havel E, Bělobrádková E. Předoperační vyšetření a příprava chirurgického pacienta. Interní Med 2012; 14(11): 422 – 428.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2019 Issue 1
-
All articles in this issue
- Ketogenní dieta – účinná nefarmakologická léčba dětské a adolescentní epilepsie
- Vieme dobre diagnostikovať dyskinetickú formu DMO? ÁNO
- Sub signum coma – súčasný pohľad na chronické poruchy vedomia
- Chronický subdurální hematom
- Iatrogenizácia pacientov so psychogénnymi neepileptickými záchvatmi – možné východiská
- Genetika neurodegenerativních demencí v deseti bodech – co může neurolog očekávat od molekulárního genetika?
- Lehká mozková poranění – konsenzuální odborné stanovisko České neurologické společnosti ČLS JEP
- Evokované potenciály vyvolané kontaktním teplem – vliv fyziologických proměnných
- Laboratorní účinnost kyseliny acetylsalicylové v sekundární prevenci ischemických cévních mozkových příhod
- Parietální atrofie na magnetické rezonanci mozku u Alzheimerovy nemoci s pozdním začátkem
- Transkraniální magnetická stimulace u hraniční poruchy osobnosti – série kazuistik
- Změny v expresi TNFα a microRNA-15b u experimentálního modelu subarachnoidálního krvácení
- Raschova analýza dotazníku Q-LES-Q-SF na podkladě odpovědí pacientů s neuropatickou bolestí
- Oligoklonální IgG a volné lehké řetězce – srovnání izoelektrické fokusace v agarózovém a polyakrylamidovém gelu
- Nové možnosti ultrazvuku v predikci výskytu bolesti dolní části zad u dospívajících mužů – pilotní studie
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Lehká mozková poranění – konsenzuální odborné stanovisko České neurologické společnosti ČLS JEP
- Chronický subdurální hematom
- Oligoklonální IgG a volné lehké řetězce – srovnání izoelektrické fokusace v agarózovém a polyakrylamidovém gelu
- Ketogenní dieta – účinná nefarmakologická léčba dětské a adolescentní epilepsie
