Validace dotazníku pro hodnocení dopadu cévní mozkové příhody – česká verze Stroke Impact Scale 3.0
Validation of questionnaire for evaluation of ischemic stroke sequels – the Czech version of Stroke Impact Scale 3.0
Introduction: Assessment of the quality of life in patients after ischemic stroke (IS) is essential to objectively assess the consequences in everyday life and to better identify all aspects of disability and limitations. However, there is no validated specific tool for quality-of-life assessment in patients after IS in the Czech Republic. Aim: To validate the Czech version of the Stroke Impact Scale (SIS) 3.0 – the most used tool worldwide in stroke survivors, which will allow its standardized use in the Czech population. Patients and methods: Consecutive patients with IS without cognitive deficit aged 18–80 years were included in the validation study. Internal consistency was examined using the Cronbach’s alpha coefficient. The following scales were used to determine the construct and criterion validity of the Czech version of SIS 3.0: WHOQOL-BREF, the National Institutes of Health Stroke Scale, modified Rankin Scale, Barthel Index, and Hospital Anxiety and Beck Depression Inventory. Results: A total of 150 patients (58.4% men, mean age 57.6 ± 13.7 years) were enrolled in the study at a mean follow-up of 3.8 ± 0.4 months after the onset of stroke, with 96.7% achieving good functional independence (mRS 0–2). Cronbach’s alpha coefficient of particular domains ranged from 0.750 to 0.934. Significant correlations were found between SIS 3.0 domains, WHOQOL-BREF and other used tools of the neuropsychological battery. Conclusion: In the presented study, the psychometric properties were verified and adequate criteria and construct validity of the Czech version of SIS 3.0 were confirmed.
Keywords:
ischemic stroke – Reliability – health related quality of life – Stroke Impact Scale 3.0 – validity
Authors:
E. Gurková 1; D. Šaňák 2; L. Šáteková 1; Š. Šaňáková 1; J. Zapletalová 3
Authors‘ workplace:
Ústav ošetřovatelství, Fakulta zdravotnických věd, UP Olomouc
1; Komplexní Cerebrovaskulární centrum, Neurologická klinika, LF UP a FN Olomouc
2; Ústav lékařské biofyziky a statistiky, LF UP Olomouc
3
Published in:
Cesk Slov Neurol N 2022; 85(4): 287-295
Category:
Original Paper
doi:
https://doi.org/10.48095/cccsnn2022287
Overview
Úvod: Hodnocení kvality života u pacientů po prodělané ischemické CMP (iCMP) je nezbytné pro objektivní posouzení následků v běžném životě a umožňuje lépe identifikovat všechny aspekty postižení a omezení. V ČR však validovaný specifický nástroj pro hodnocení kvality života u pacientů po iCMP chybí. Cíl: Validace české verze nejčastěji používaného nástroje na světě – Stroke Impact Scale verze 3.0 (SIS 3.0), která umožní její standardizované použití v české populaci. Soubor a metodika: Do validační studie byli zařazeni konsekutivní pacienti s iCMP bez kognitivního deficitu ve věku 18–80 let. Vnitřní konzistence byla zjišťována pomocí Cronbachova koeficientu alfa. Na hodnocení konstrukční a kriteriální validity SIS byly použity škály SIS 3.0, WHOQOL-BREF, National Institutes of Health Stroke Scale, modifikovaná Rankinova škála, index Barthelové a škála hodnocení úzkosti a deprese při hospitalizaci (Hospital Anxiety and Beck Depression Inventory). Výsledky: Do studie bylo zařazeno celkem 150 pacientů (58,4 % mužů, průměrný věk 57,6 ± 13,7 let) průměrně 3,8 ± 0,4 měsíce po vzniku iktu, přičemž 96,7 % z nich dosáhlo dobrého klinického výsledku (mRS 0–2). Cronbachův koeficient alfa jednotlivých domén se pohyboval v rozmezí domén od 0,750 do 0,934. Signifikantní korelace byly zjištěny mezi doménami SIS 3.0, WHOQOL-BREF a ostatními testy námi použité neuropsychologické baterie. Závěr: V prezentované studii byly ověřeny psychometrické vlastnosti a potvrzena dostatečná kriteriální a konstrukční validita české verze SIS 3.0.
Klíčová slova:
reliabilita – ischemická cévní mozková příhoda – kvalita života související se zdravím – Škála k posouzení dopadu cévní mozkové příhody verze 3.0 – validita
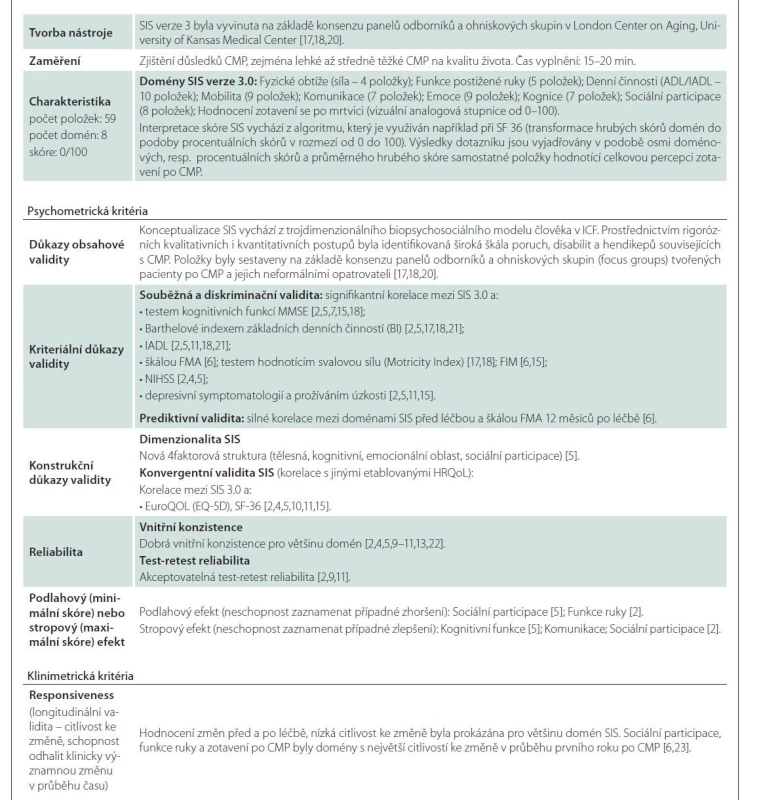
Úvod
Kvalita života související se zdravím (health related quality of life; HRQoL) u pacientů po CMP reflektuje dopad ischemické CMP (iCMP) na vnímání úrovně fungování ve fyzické, kognitivní a sociální oblasti života, na psychickou pohodu a rovněž na schopnost prožívat plnohodnotný život [1]. Koncept HRQoL se stal jedním z nejpoužívanějších nástrojů pro pacientem hodnocené následky postižení či nemoci (patient reported outcomes; PROMs) v neurologii nejen v oblasti klinického výzkumu, ale i v rámci hodnocení kvality zdravotní péče nebo kvality léčby z perspektivy pacienta. V současnosti je HRQoL využívána především v multidisciplinární následné péči o pacienty po CMP s cílem lépe identifikovat všechny aspekty následků nebo postižení, omezení aktivit a sociální participace u pacientů [2,3]. Hodnocení HRQoL po iCMP a pochopení fyzických, funkčních a psychosociálních následků, které po CMP pacienti prožívají, je zdůrazněno v prioritách výzkumu a vývoje zahrnutých do Evropského akčního plánu pro cévní mozkovou příhodu (European Stroke Action Plan; ESAP) na léta 2018–2030. Kontinuálně roste zájem o shromažďování údajů týkajících se PROMs vč. HRQoL, které by nejlépe odrážely CMP z perspektivy pacienta a poskytovaly další informace nad rámec tradičních klinických ukazatelů (hodnocení funkčního stavu, kognitivních funkcí apod.).
Ačkoli byla v poslední době u pacientů po iCMP implementována celá řada různých, jak obecných (např. Short-Form 36, Nottingham Health Profile, EuroQOL, WHOQOL-BREF 26), tak specifických nástrojů HRQoL (Stroke Impact Scale, Burden of Stroke Scale, Stroke Specific Quality of Life Scale, Stroke Patient-Reported Outcome Measure, Newcastle Stroke-Specific Quality of Life Measure, Change in Quality of Life scale, Stroke and Aphasia Quality of Life Scale, Neuro-QOL survey), dosud neexistuje jednoznačný konsenzus v tom, který z nástrojů je nejvhodnější [4]. Navíc chybí dostatečné srovnání používaných nástrojů v kontextu psychometrické a klinimetrické kvality měření (validita, reliabilita, citlivost ke změně způsobené specifickými intervencemi v péči po iCMP). V klinických studiích [5] jsou ze specifických nástrojů nejčastěji používané tyto dva sebe-posuzující (self-reported) nástroje – Stroke Impact Scale (SIS) a Stroke-Specific Quality of Life Scale (SS-QOL). Při komparaci klinimetrických a psychometrických kritérií SIS a SS-QOL [6] dosahoval SIS lepší vlastnosti (citlivost ke změně a kriteriální validitu) u pacientů podstupujících rehabilitaci po iCMP. Proto se zdá být vhodnější pro hodnocení změn po rehabilitačních intervencích nebo v dlouhodobé následné péči [7]. V posledních letech narůstá počet validačních studií zkoumajících psychometrické a klinimetrické parametry různých jazykových verzí SIS [2,4,8–16]. Nástroj se vyvíjí již více než dvě desetiletí a prošel několika modifikacemi. V současné době se používá třetí verze (verze SIS 3.0) a alternativní formy [4,17,18] (modifikovaná zkrácená forma SIS [SF-SIS] a 16 položková verze zahrnující jen fyzické dimenze HRQoL [SIS-16]). SIS je doporučen při longitudinálním sledování změn po iCMP ve výzkumu nebo klinické praxi [19]. Jednotlivé verze SIS mají excelentní psychomterické i klinimetrické vlastnosti (tab. 1) [2,4–7,9–11,13,15,17,18,20–23], představují standardizované nástroje HRQoL využitelné při efektivním plánovaní péče o pacienty po iCMP v klinické praxi nebo při podpoře metodologické kvality a zobecňování výsledků klinických studií zahrnujících sledování HRQoL. Psychometrické vlastnosti jednotlivých jazykových verzí byly extenzivně ověřované, souhrnný přehled výsledků validačních studií uvádí tab. 1. Česká verze SIS dosud nebyla testována. Validovaný specifický nástroj pro hodnocení specifické HRQoL u pacientů po iCMP v českém jazykovém prostředí chybí a je potřebný. Ischemické CMP představují třetí nejčastější příčinu úmrtí v ČR [24] a ČR se také zařazuje mezi země s nejvyšší odhadovanou incidencí, prevalencí a mortalitou iCMP v Evropě [25,26]. Vysoká incidence iCMP v populaci je sdružená se zvyšujícím se počtem pacientů žijících s následky po iktu, což vyžaduje objektivní a spolehlivé posouzení těchto následků. Jejich důkladný popis vycházející z validních a spolehlivých nástrojů HRQoL, jakým je i SIS, umožňuje také specifičtěji zaměřit následnou péči o pacienty po iktu.
Cílem naší studie bylo otestovat psychometrické vlastnosti (konstruktové a kriteriální důkazy validity) české verze SIS 3.0, a umožnit tak její standardizované použití pro potřeby české populace.
Soubor a metodika
Prezentovaná validační studie byla provedena v rámci prospektivní studie FRAILTY (Factors Affecting the Quality of Life After Ischemic Stroke in Young Adults); reg. č. NCT04839887. První fází validační studie byla transkulturální validace české jazykové verze SIS 3.0 dle publikovaných doporučení Mapi Research Trust [27] a společnosti International Society for Pharmacoeconomics and Outcomes (ISPO) [28]. Celý proces transkulturální validace byl rozdělen do následujících kroků s cílem vytvořit finální českou verzi:
a) získání souhlasu Mapi Research Trust s překladem;
b) vytvoření panelu odborníků (neurolog, profesionální překladatelé, rodilý mluvčí, odborníci se zkušeností s lingvistickou validací) pro jednotlivé fáze překladu;
c) provedení dvou nezávislých překladů z anglického do českého jazyka (forward translation) a jejich sjednocení;
d) provedení dvou nezávislých překladů z českého do anglického jazyka (backward translations) a jejich sjednocení;
e) harmonizace verzí; revize návrhu finálního překladu zkušeným neurologem (DŠ);
f) testování verze v pilotní skupině 5 pacientů po iCMP různého věku a s různým reziduálním neurologickým deficitem po iktu;
g) finalizace české verze.
Popis vývoje, obsahu a psychometrických vlastností nástroje je detailně popsán v tab. 1.
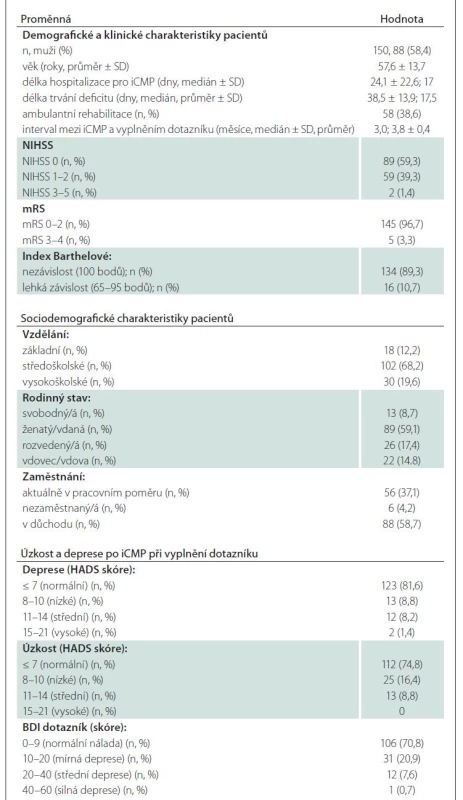
Do testování psychometrických vlastností české verze SIS 3.0 byli v průběhu 12 měsíců konsekutivně zařazeni pacienti dispenzarizovaní v Komplexním cerebrovaskulárním centru Neurologické kliniky FN Olomouc, kteří splnili následující vstupní kritéria: iCMP, věk 18–80 let (vč.) a podpis informovaného souhlasu s účastí ve studii. Vylučujícími kritérii pro účast ve studii byly: těžké postižení zraku nebo sluchu neumožňující vyplnění dotazníků, afázie a alexie, kognitivní deficit, aktivní onkologické onemocnění a jiné choroby významně ovlivňující denní aktivity.
Neurologický deficit po iktu byl hodnocen pomocí škály National Institutes of Health Stroke Scale (NIHSS) [29], následky po iktu pomocí modifikované Rankinovy škály (modified Rankin Scale; mRS) [30] a dotazníku Barthelové (Barthel Index; BI) (tab. 2) [31]. Po vyšetření pacienti vyplnili dotazníkový set, který obsahoval tyto části: 1) Kvalita života; hodnocena českou verzí SIS 3.0 (tab. 1) a generickým nástrojem WHOQOL-BREF [32,33], který hodnotí čtyři domény – fyzické zdraví, prožívání, sociální vztahy a prostředí; 2) Úzkost a deprese po CMP; hodnoceny dvěma sebeposuzujícími screeningovými škálami – Hospital Anxiety and Depression Scale (HADS) [34] a Beckova sebeposuzovací škála depresivity pro dospělé (BDI-I) [35]. Po ukončení dotazníku pacienti hodnotili jeho srozumitelnost.
Statistická analýza
Získaná data byla statisticky zpracována pomocí programu SPSS; verze 25 (IBM, Armonk, NY, USA). Pro popis rozložení hodnot byla použita deskriptivní statistika (hrubé skóre jednotlivých domén WHOQoL-BREF a SIS 3.0, průměr, směrodatná odchylka (standard deviation; SD), medián, rozsah, interkvartilové rozpětí, absolutní a relativní početnost). Pro vyhodnocení jednotlivých domén SIS 3.0 a WHOQoL-BREF byla provedena transformace vypočítaných hrubých skóre na škále o rozpětí od 0 do 100 (vyšší skóre označuje vyšší kvalitu života). Normalita kvantitativních dat byla ověřena pomocí Shapiro-Wilkových testů normality. Pro non-normální distribuci hodnot dotazníku SIS 3.0 byly k testování rozdílů v kvalitě života z hlediska sledovaných proměnných (funkční stav, reziduální neurologický deficit, míra deprese a úzkosti) používány primárně neparametrické testy (Kruskal-Wallisův test, Mann-Whitneyho U test) s post-hoc testy s Bonferroniho korekcí signifikance. Kriteriální důkazy validity a konvergentní validita SIS 3.0 byly hodnoceny pomocí Spearmanovy korelace (korelace mezi skóre domén SIS 3.0 a funkčním neurologickým deficitem, mírou deprese, úzkostí a doménami WHOQoL-BREF). Vnitřní konzistence dotazníku byla testována pomocí Cronbachova koeficientu alfa. Pro zpracování dat byla zvolena hladina významnosti p = 0,05.
Pro zjištění konstrukční validity (faktorové struktury/dimenzionality) byly v prvním kroku ověřeny předpoklady pro použití faktorové analýzy (FA). Byly zhodnoceny matice korelačních koeficientů pro položky SIS 3.0. Rovněž byl vytvořen sutinový graf pro grafické ověření počtu sledovaných faktorů, byly vypočítány Kaiser-Meyer-Olkinova míra (KMO) a Bartlettův test homogenity. Pro potvrzení faktorové struktury byla použita konfirmační (CFA) a explorační faktorová analýza (EFA). V rámci CFA/EFA byly vypočítány indexy dobré shody: Comparative fit index (CFI), Root mean square error of approximation (RMSEA), Normed fit index (NFI) a Tucker-Lewis index (TLI).
Odhad velikosti souboru pro dotazník SIS se spolehlivostí 95 % byl stanoven na 150 (přesnost D = 5,2; σ = 32,51; získaný průměr z norem pro standardní odchylku [36]) [37]. V datovém souboru byla frekvence výskytu chybějících dat 4,6 %.
Výsledky
Do studie bylo zařazeno celkem 150 pacientů (58,4 % mužů) s iCMP (průměrný věk 57,6 ± 13,7 let, jejichž vybrané relevantní deskriptivní charakteristiky jsou uvedeny v tab. 2). Pacienti vyplnili dotazník průměrně 3,8 ± 0,4 měsíce po vzniku iktu, přičemž 96,7 % z nich dosáhlo dobrého klinického výsledku (mRS 0–2), 59,3 % nemělo žádný reziduální neurologický deficit a 89,3 % bylo nezávislých (BI: 100 bodů) (tab. 2).
Velká většina (74,8 %) pacientů nevykazovala symptomy úzkosti (HADS ≤ 7) nebo deprese (81,6 %) po iktu (tab. 2). Nejnižší skóre ve škále SIS 3.0 bylo zjištěno v oblasti emocí a nejvyšší v oblasti komunikace (tab. 3). Fyzické zdraví byla jediná doména v dotazníku WHOQoL-BREF (průměr: 15,06), která byla nižší, než je norma pro českou populaci (průměr: 15,55) [33].
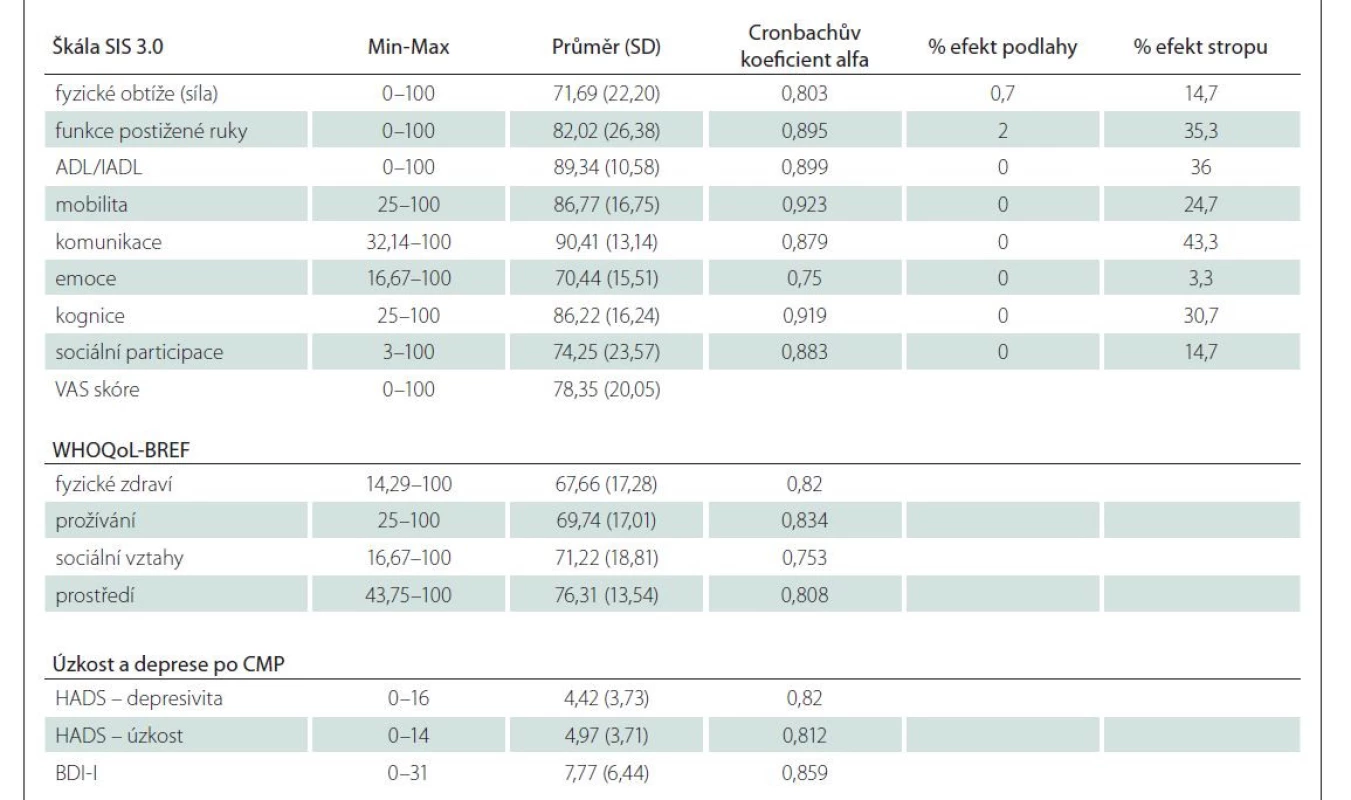
Efekt stropu (podíl pacientů, kteří dosáhli maximálního skóre) byl prominentní u sedmi domén SIS (tab. 3). Kritéria konfirmační analýzy české verze SIS nebyla splněna pro indexy NFI, TLI a CFI (hodnoty < 0,9), předpoklad „goodness of fit“ modelu splňoval pouze index RMSEA. Výsledek chí-kvadrát testu (hodnota testové statistiky chi-square = 2 421; p < 0,0001) nepotvrdil strukturu modelu s osmi faktory. V dalším kroku bylo proto přistoupeno k hledání optimální faktorové struktury prostřednictvím EFA. V rámci uvedených předpokladů pro FA nebyl splněn první předpoklad o korelaci jednotlivých položek, v korelační matici bylo vysoké procento korelačních koeficientů s nižší než požadovanou hodnotou (s hodnotami pod 0,2 bylo v korelační matici více než 30 % korelačních koeficientů). Hodnota celkové KMO přesahovala doporučenou hodnotu 0,7 a hodnota Bartlettova testu byla signifikantní (p < 0,0001). KMO vypočítaná pro jednotlivé položky (measures of sampling adequacy; MSA) v diagonále anti-image matice byla u třech položek v doméně „Emoce“ nižší než 0,5 a tyto položky proto byly z FA vyloučeny. Při určení počtu faktorů (podle suťového grafu, Kaiserova pravidla a stanovení faktorových zátěží) bylo jako nejlepší faktorové řešení zvoleno řešení s čtyřmi faktory, vysvětlující 54,6 % variance, přičemž v případě našeho souboru (n = 150) by faktorové zátěže měly být vyšší než 0,5. Po vyřazení sporných položek s nízkou zátěží bylo faktorové řešení lepší po šikmé rotaci metodou Oblimin než v případě ortogonální rotace metodou Varimax; stále se však vyskytovalo deset položek bez jednoznačného faktorového zařazení. Po jejich vyloučení vedla EFA k řešení 4faktorového modelu s 46 položkami (matice CFA a EFA nejsou z hlediska rozsahu grafické přílohy součástí článku), nicméně parametry modelu nepotvrdily vhodnost daného modelu a kritéria CFA nebyla splněna ani pro žádný z indexů (RMSEA, chi-square, NFI, TLI a CFI). Na základě těchto výsledků a z důvodu srovnatelnosti výsledků se zahraničními studiemi pokračovala analýza s původní strukturou nástroje.
Vnitřní konzistence SIS 3.0 byla dostatečná, Cronbachův koeficient alfa jednotlivých domén se pohyboval v rozmezí domén od 0,750 do 0,923 (tab. 3), přičemž hodnoty některých domén (mobilita, funkce postižené ruky) přesáhly horní mez intervalu párových korelačních koeficientů při odhadu reliability (> 0,3 a < 0,8). Jejich vyloučení však nevedlo k žádné změně hodnoty Cronbachova koeficientu alfa.
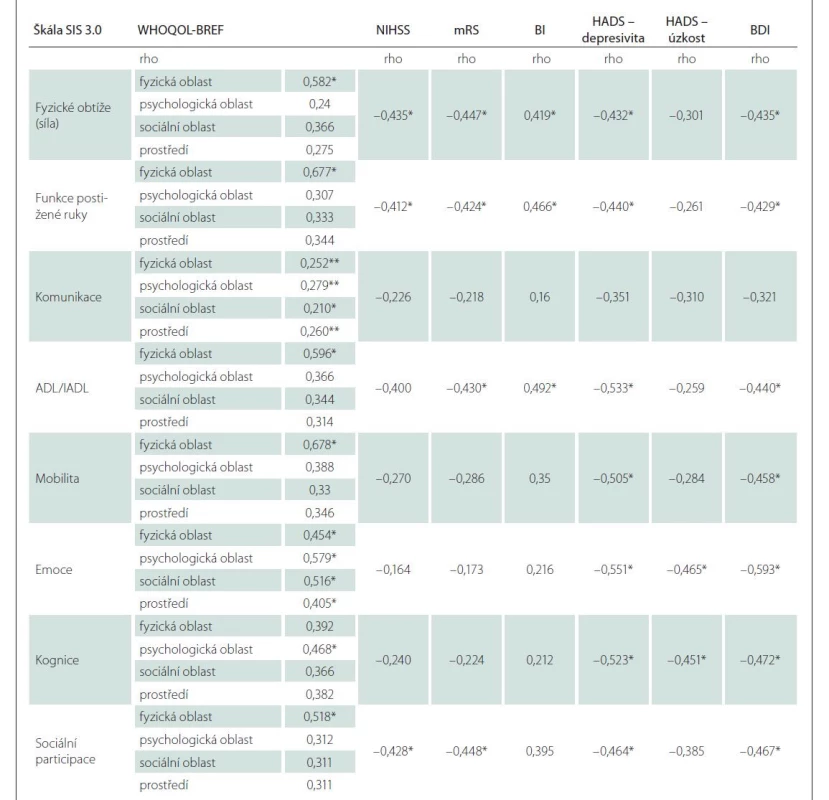
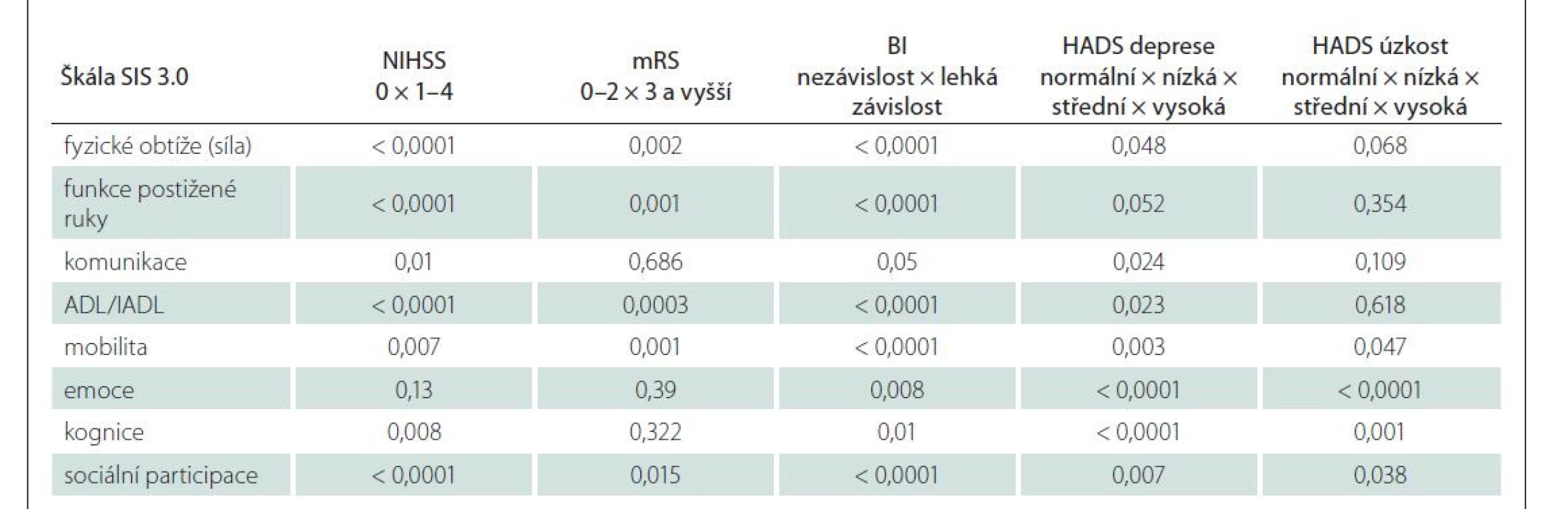
Byly zjištěny signifikantní korelace mezi doménami SIS 3.0 a WHOQOL-BREF, které dokládají konvergentní validitu české verze SIS 3.0 (tab. 4). Souběžná validita SIS 3.0 byla ověřena na celém výzkumném souboru pomocí korelace dosažených skóre jednotlivých domén SIS s ostatními testy použité neuropsychologické baterie (NIHSS, mRS, BI, HADS, BDI). Byla prokázána signifikantní negativní korelace mezi skóre domén SIS a skóre NIHSS, mRS a BI. Konkrétní hodnoty korelačních koeficientů uvádí tab. 4, přičemž nejvyšší konvergentní validitu s reziduálním neurologickým deficitem a následky iktu (NIHSS, mRS, BI) měly domény: fyzické obtíže; funkce postižené ruky, ADL/IADL a sociální participace. Nejsilnější korelaci se škálami deprese měly domény: emoce, kognice, sociální participace, mobilita a ADL/IADL.
ADL/IADL – základní/instrumentální denní aktivity; BDI – Beckova sebeposuzovací škála depresivity (Beck Depression Inventory Scale); BI – index
Barthelové denních aktivit; HADS – Hospital Anxiety and Depression Scale; mRS – modifikovaná Rankinova škála (modified Rankin Scale); NIHSS
– National Institutes of Health Stroke Scale; Rho – Spearmanovo rho; SIS 3.0 – Stroke Impact Scale, verze 3.0, WHOQoL-BREF – dotazník kvality života
WHOQOL-BREF
Většina domén SIS se lišila mezi jednotlivými pacienty podle jejich stupně reziduálního neurologického deficitu a přítomnosti depresivní symptomatologie (tab. 5). Nejvyšší diskriminační validita byla zjištěna při hodnocení rozdílů v doménách SIS a stupněm nezávislosti v denních aktivitách (BI) a deprese (HADS).
Diskuze
V prezentované studii jsme ověřili psychometrické vlastnosti a potvrdili dostatečnou kriteriální a konstrukční validitu české verze SIS 3.0. Jedná se o první validační studii specifického nástroje HRQoL pro pacienty po iktu v ČR.
Konstrukční důkazy validity mohou být podpořeny množstvím odlišných postupů. Nejužitečnějším způsobem je faktorová analýza, zejména u multidimenzionálních konstruktů, jakým je i HRQoL. Protože položky české verze nesplňovaly předpoklady pro testování faktorové struktury, použité techniky CFA/EFA jsou diskutabilní. Při exploračních technikách jsme vycházeli z posledně publikované studie zkoumající faktorovou strukturu SIS 3.0 [5]. V dané studii byla zjištěna čtyřfaktorová struktura (fyzická oblast, kognice, emoce a sociální participace), která prokázala lepší výsledky položkové fit statistiky než původní verze s osmi faktory. V naší studii jsme vhodnost modelu s čtyřmi faktory nepotvrdili.
Multidimenzionální nástroje specifické pro CMP poskytují komplexnější a přesnější hodnocení následků CMP a jsou citlivější na krátkodobé změny zdravotního stavu pacientů po CMP oproti generickým nástrojům [5]. Hodnocení jednotlivých oblastí HRQoL umožňuje lépe pochopit, jak se onemocnění a jeho léčba reálně promítají do každodenního života pacienta. Pomáhá také lépe porozumět jeho preferencím, očekáváním a požadavkům v souvislosti s onemocněním. Tato zjištění mohou být v klinické praxi použita pro zajištění adekvátní následné nebo podpůrné rehabilitační péče, zlepšení adherence a sebepéče pacienta v kontextu požadavků komplexního terapeutického režimu [7]. Pro měření HRQoL pacientů po CMP dominují v českých studiích [38,39] převážně generické nástroje (např. EuroQOL). Používání SIS 3.0 pro klinické i výzkumné účely u pacientů se subakutní a chronickou CMP je doporučováno experty Neurologické sekce Americké asociace pro fyzikální terapii (American Physical Therapy Association; APTA) [19]. SIS byl posuzován na základě kritérií APTA, známé pod akronymem EDGE (Evidence Database to Guide Effectiveness), hodnotící psychometrické, klinimetrické parametry a klinickou využitelnost hodnotících škál a nástrojů u pacientů po CMP [19]. Dostupné jazykové verze SIS 3.0 byly vytvořené rigorózním procesem transkulturální validace. Jednotlivé kroky testování české verze SIS 3.0 směřovaly k vytvoření nástroje, který je konceptuálně ekvivalentní s původní verzí s porovnatelnými psychometrickými vlastnostmi.
Vnitřní konzistence SIS 3.0 byla dostatečná, porovnatelná s předcházejícími validačními studiemi [2,4,5,9–11,13,22]. Při testování konvergentních důkazů validity jsme sledovali korelace mezi skóre jednotlivých domén SIS a doménami etablovaného a již v českém prostředí validovaného nástroje na měření identického konstruktu – HRQoL. Při testování tohoto druhu validity byly v předcházejících studiích použity nástroje EQ-5D [4,10] nebo SF-36 [2,5,11,15]. V předkládané studii byl použit WHOQOL-BREF, který je široce využívaný v rámci české populace při sledování HRQoL. Signifikantní korelace zjištěné mezi doménami SIS 3.0 a WHOQOL-BREF jsou významnými důkazy konvergentní validity české verze SIS 3.0 (tab. 4). Kritériové důkazy validity představují hodnocení stupně, do jakého je možné adekvátně použít skóre nástroje k vyvozování nejpravděpodobnější pozice osoby na měřené proměnné – kritériu. Kritérium je proměnná, která je ve významném vztahu s testem a kterou je možné na základě výsledků testu predikovat. Je to standard, vůči kterému jsou test anebo testové skóre hodnoceny. V našem případě jsme na základě předcházejících studií [2,5,11,15,21] jako kritérium zvolili skóre z testů neuropsychologické baterie (NIHSS, mRS, BI, HADS, BDI). Výsledky studie naznačují, že SIS může rozlišovat mezi pacienty s různým stupněm neurologického deficitu a následků po iktu, nezávislosti v denních aktivitách nebo deprese. Výsledky validace české verze SIS 3.0 jsou porovnatelné s některými zahraničními studiemi [5], které potvrzují využitelnost nástroje v monitorování progrese následků iCMP nebo výsledků rehabilitace.
Hlavním omezením studie byly výběr pacientů a rozsah souboru. Rozsah výběrového souboru odpovídal požadavkům na velikost souboru pro kriteriální a konvergentní validitu ve vztahu k počtu položek nástroje (minimálně 10 respondentů na jednu položku v sledované doméně). Pro testování faktorové struktury je rozsah souboru limitující. Pro průřezový design studie nebylo možné sledovat longitudinální validitu. V dalším výzkumu se zaměříme na testování citlivosti SIS 3.0 ke změně – to znamená schopnost nástroje odhalit klinicky významnou změnu v průběhu času. Zároveň budeme na větším počtu pacientů testovat vhodnost čtyřfaktorového řešení. Dalším omezením byl monocentrický charakter studie. Třetím omezením byla selekce pacientů, resp. potencionální selekční bias. Do studie byli zařazeni pouze pacienti bez kognitivního deficitu. Do studie nebyli zařazeni pacienti, kteří byli nedávno hospitalizováni pro jiné závažné onemocnění, pacienti s psychiatrickým onemocněním, těžkou zrakovou nebo sluchovou poruchou či postižením a pacienti v terminálním stádiu onemocnění.
Závěr
Standardizované hodnocení HRQoL je nezbytné pro objektivní a spolehlivé posouzení následků po ischemické CMP. Získané informace umožňují hodnocení kvality poskytované multidisciplinární péče a identifikaci všech aspektů následků a postižení po iktu. Díky provedené validační studii je nyní dostupná také česká verze škály SIS 3.0. Česká verze SIS 3.0 vykazuje srovnatelnou validitu a vnitřní konzistenci jako originální verze a jeho následně validované další jazykové mutace.
Etické aspekty
Studie byla provedena ve shodě s Helsinskou deklarací z roku 1975 (a jejími revizemi z let 2004 a 2008). Studie byla schválena lokální etickou komisí FN Olomouc a LF UP (6/2021, č. NU22-09-00021). Všichni pacienti podepsali informovaný souhlas s účastí ve studii. Prezentovaná validační studie byla provedena v rámci prospektivní studie FRAILTY (Factors Affecting the Quality of Life After Ischemic Stroke in Young Adults); reg. č. NCT04839887 (ClinicalTrials.gov).
Finanční podpora
Studie byla podpořena z programového projektu Agentury pro zdravotnický výzkum Ministerstva zdravotnictví ČR s reg. č. NU22-09-00021 a grantem IGA LF UP_2022_013.
Konflikt zájmů
Všichni autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
prof. MUDr. Daniel Šaňák, Ph.D., FESO
Komplexní cerebrovaskulární
centrum,
Neurologická klinika
LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: daniel.sanak@fnol.cz
Přijato k recenzi: 31. 5. 2022
Přijato do tisku: 21. 7. 2022
Sources
1. van Mierlo ML, Schröder C, van Heugten CM et al. The influence of psychological factors on health-related quality of life after stroke: a systematic review. Int J Stroke 2014; 9 (3): 341–348. doi: 10.1111/ijs.12149.
2. Carod-Artal FJ, Coral LF, Trizotto DS et al. The stroke impact scale 3.0: evaluation of acceptability, reliability, and validity of the Brazilian version. Stroke 2008; 39 (9): 2477–2484. doi: 10.1161/STROKEAHA.107.513671.
3. Hunger M, Sabariego C, Stollenwerk B et al. Validity, reliability and responsiveness of the EQ-5D in German stroke patients undergoing rehabilitation. Qual Life Res 2012; 21 (7): 1205–1216. doi: 10.1007/s11136-011-00 24-3.
4. MacIsaac R, Ali M, Peters M et al. Derivation and validation of a modified short form of the stroke impact scale. J Am Heart Assoc 2016; 5 (5): e003108. doi: 10.1161/JAHA.115.003108.
5. Vellone E, Savini S, Fida R et al. Psychometric evaluation of the Stroke Impact Scale 3.0. J Cardiovasc Nurs 2015; 30 (3): 229–241. doi: 10.1097/JCN.0000000000000 145.
6. Lin KC, Fu T, Wu CY et al. Psychometric comparisons of the Stroke Impact Scale 3.0 and Stroke-Specific Quality of Life Scale. Qual Life Res 2010; 19 (3): 435–443. doi: 10.1007/s11136-010-9597-5.
7. Sullivan JE. Measurement characteristics and clinical utility of the stroke impact scale. Arch Phys Med Rehabil 2014; 95 (9): 1799–1800. doi: 10.1016/j.apmr.2014.02. 011.
8. Caël S, Decavel P, Binquet C et al. Stroke impact scale version 2: validation of the French version. Phys Ther 2015; 95 (5): 778–790. doi: 10.2522/ptj.20130012.
9. Ochi M, Ohashi H, Hachisuka K et al. The reliability and validity of the Japanese version of the Stroke Impact Scale Version 3.0. J UOEH 2017; 39 (3): 215–221. doi: 10.7888/juoeh.39.215.
10. Jenkinson C, Fitzpatrick R, Crocker H et al. The Stroke Impact Scale: validation in a UK setting and development of a SIS short form and SIS index. Stroke 2013; 44 (9): 2532–2535. doi: 10.1161/STROKEAHA.113.001 847.
11. Choi SU, Lee HS, Shin JH et al. Stroke Impact Scale 3.0: reliability and validity evaluation of the Korean version. Ann Rehabil Med 2017; 41 (3): 387–393. doi: 10.5535/arm.2017.41.3.387.
12. Coppers A, Möller JC, Marks D. Psychometric proper - ties of the short form of the Stroke Impact Scale in German-speaking stroke survivors. Health Qual Life Outcomes 2021; 19 (1): 190. doi: 10.1186/s12955-021-01 826-5.
13. Mohammad AH, Al-Sadat N, Siew Yim L et al. Reliability and validity of the Nigerian (Hausa) version of the Stroke Impact Scale (SIS) 3.0 index. Biomed Res Int 2014; 2014 : 302097. doi: 10.1155/2014/302097.
14. Gonçalves RS, Gil JN, Cavalheiro LM et al. Reliability and validity of the Portuguese version of the Stroke Impact Scale 2.0 (SIS 2.0). Qual Life Res 2012; 21 (4): 691–696. doi: 10.1007/s11136-011-9977-5.
15. Hantal AO, Dogu B, Buyukavci R et al. Stroke impact scale version 3.0: study of reliability and validity in stroke patients in the Turkish population. Turk J Phys Med Rehabil 2014; 60 (2): 106–116. doi: 10.5152/tftrd.2014.70 487.
16. Kamwesiga JT, von Koch L, Kottorp A et al. Cultural adaptation and validation of Stroke Impact Scale 3.0 version in Uganda: a small-scale study. SAGE Open Med 2016; 4 : 2050312116671859. doi: 10.1177/2050312116671 859.
17. Duncan PW, Lai SM, Bode RK et al. Stroke Impact Scale-16: a brief assessment of physical function. Neurology 2003; 60 (2): 291–296. doi: 10.1212/01.wnl.0000041493.656 65.d6.
18. Duncan PW, Bode RK, Lai SM et al. Rasch analysis of a new stroke-specific outcome scale: The Stroke Impact Scale. Arch Phys Med Rehabil 2003; 84 (7): 950–963. doi: 10.1016/s0003-9993 (03) 00035-2.
19. Sullivan JE, Crowner BE, Kluding PM et al. Outcome measures for individuals with stroke: process and recommendations from the American Physical Therapy Association neurology section task force. Phys Ther 2013; 93 (10): 1383–1396. doi: 10.2522/ptj.20120492.
20. Duncan PW, Wallace D, Studenski S et al. Conceptualization of a new stroke-specific outcome measure: the stroke impact scale. Top Stroke Rehabil 2001; 8 (2): 19–33. doi: 10.1310/BRHX-PKTA-0TUJ-UYWT.
21. Lai SM, Perera S, Duncan PW et al. Physical and social functioning after stroke: comparison of the stroke impact scale and short form-36. Stroke 2003; 34 (2): 488–493. doi: 10.1161/01.STR.0000054162.94998.C0.
22. Richardson M, Campbell N, Allen L et al. The stroke impact scale: performance as a quality of life measure in a community-based stroke rehabilitation setting. Disabil Rehabil 2016; 38 (14): 1425–1430. doi: 10.310/09638288.2015.1102337.
23. Guidetti S, Ytterberg C, Ekstam L et al. Changes in the impact of stroke between 3 and 12 months post-stroke, assessed with the Stroke Impact Scale. J Rehabil Med 2014; 46 (10): 963–968. doi: 10.2340/16501977 - 1865.
24. Bednařík J, Tomek A, Bar M et al. Ischemická cévní mozková příhoda nebo tranzitorní ischemická ataka nekardioembolické etiologie a jejich sekundární prevence. Adaptovaný klinický doporučený postup. [online]. Dostupné z: https: //kdp.uzis.cz/res/guideline/11-aterotromboticka-ischemicka-cmp-nebo-tia-jejich-sekundarni-prevence-final.pdf.
25. Bryndziár T, Šedová P, Mikulík R. Incidence cévní mozkové příhody v Evropě – systematická review. Cesk Slov Neurol N 2017; 80/113 (2): 180–189.
26. Sedova P, Brown RD, Zvolsky M et al. Validation of stroke diagnosis in the National Registry of Hospitalized Patients in the Czech Republic. J Stroke Cerebrovasc Dis 2015; 24 (9): 2032–2038. doi: 10.1016/j.jstrokecerebrovasdis.2015.04.019.
27. Acquadro C, Conway K, Giroudet C et al. Linguistic validation manual for health outcomes assessments. Lyon, France: MAPI Institute 2012.
28. Wild D, Grove A, Martin M et al. Principles of good practice for the translation and cultural adaptation process for patient-reported outcomes (PRO) measures: report of the ISPOR task force for translation and cultural adaptation. Value Health 2005; 8 (2): 94–104. doi: 10.1111/j.1524-4733.2005.04054.x.
29. Brott T, Adams HP, Olinger CP et al. Measurements of acute cerebral infarction: a clinical examination scale. Stroke 1989; 20 (7): 864–870. doi: 10.1161/01.str.20.7.864.
30. Dromerick AW, Edwards DF, Diringer MN. Sensitivity to changes in disability after stroke: a comparison of four scales useful in clinical trials. J Rehabil Res Dev 2003; 40 (1): 1–8. doi: 10.1682/jrrd.2003.01.0001.
31. Mahoney FI, Barthel DW. Functional evaluation: the Barthel index. Md State Med J J 1965; 14 : 61–65.
32. Development of the World Health Organization WHOQOL-BREF quality of life assessment. The WHOQOL Group. Psychol Med 1998; 28 (3): 551–558. doi: 10.1017/ s0033291798006667.
33. Dragomirecká E, Bartoňová J. Dotazník kvality života Světové zdravotnické organizace WHOQOL-BREF. Psychometrické vlastnosti a první zkušenosti s českou verzí. Psychiatrie 2006; 10 (3): 144–149.
34. Zigmond AS, Snaith RP. The hospital anxiety and depression scale. Acta Psychiatr Scand 1983; 67 (6): 361–370. doi: 10.1111/j.1600-0447.1983.tb09716.x.
35. Beck AT, Ward C, Mendelson M et al. An inventory for measuring depression. Arch Gen Psychiatry 1961; 4 (6): 561–571. doi: 10.1001/archpsyc.1961.01710120031 004.
36. Dimunová L, Sováriová Soósová M, Kardosová K et al. Quality of life in post-stroke patients. Kontakt 2021; 23 (3): 157–161. doi: 10.32725/kont.2020.036.
37. Hendl J. Přehled statistických metod zpracování dat. Analýza a metaanalýza dat. Praha: Portál 2004.
38. Fadrná T, Školoudík D. Quality of life in self-sufficient patients after stroke. Cesk Slov Neurol N 2017; 80/113 (3): 323–327. doi: 10.14735/amcsnn2017csnn. eu1.
39. Fadrná T, Mikšová Z, Herzig R et al. Factors influencing quality of life in patients followed in the neurosonology laboratory for carotid stenosis. Health Qual Life Outcomes 2018; 16 (79): 1–10. doi: 10.1186/s12955-018-09 02-2.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2022 Issue 4
-
All articles in this issue
- Editorial
- Dabigatran pharmacogenetics and secondary prevention of ischemic stroke
- Validation of questionnaire for evaluation of ischemic stroke sequels – the Czech version of Stroke Impact Scale 3.0
- Telemedical assessments by remote versions of ALBA, POBAV and ACE-III tests
- Heart rate variability analysis during head-up tilt testing in diagnostics of reflex syncope – review of problems and our experiences
- Delirium management in neurointensive care in the Czech Republic – a survey
- Pathological magnetic resonance imaging findings in myelin oligodendrocyte glycoprotein antibody-associated disease
- Zemřel profesor Zdeněk Mraček
- Effects of Ditan Tongmai Decoction in combination with acupuncture on post-stroke recovery based on electroencephalogram
- Rituximab treatment of post-COVID-19 development of acute-onset chronic inflammatory demyelinating polyneuropathy
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Validation of questionnaire for evaluation of ischemic stroke sequels – the Czech version of Stroke Impact Scale 3.0
- Telemedical assessments by remote versions of ALBA, POBAV and ACE-III tests
- Pathological magnetic resonance imaging findings in myelin oligodendrocyte glycoprotein antibody-associated disease
- Delirium management in neurointensive care in the Czech Republic – a survey
