Alzheimerova nemoc probíhající pod obrazem kortikobazální degenerace – kazuistika
Alzheimer’s Disease Manifesting as Corticobasal Degeneration – Case Report
Corticobasal degeneration is a rare neurodegenerative disease that belongs to the group of tauopathies is clinically manifested as a combination of extrapyramidal symptoms and cortical dysfunction affecting mainly the parietal areas. The definite diagnosis of corticobasal degeneration is based on neuropathological findings. For this reason, the term corticobasal syndrome tends to be used in surviving patients. The objective of our paper is to present a case of a patient with corticobasal syndrome as a peculiar manifestation of neuropathologically confirmed Alzheimer’s disease. Our patient showed significant cognitive impairment in visuospatial functions, apparent apraxia, frontal signs as well as early episodic memory impairment. Asymmetrical extrapyramidal features with left-sided prevalent akinesia and rigidity, apraxia on the left upper extremity and occasional myoclonus were also present. The pattern of neuropathological changes met the criteria of a fully developed neocortical stage of an early Alzheimer’s disease without any evidence of corticobasal degeneration. The main features evoking Alzheimer’s disease-associated corticobasal syndrome and enabling its differentiation from corticobasal degeneration were lower age at onset and myoclonus. In contrast to previously published data, our patient presented with an early episodic memory impairment suggesting a predominant involvement of the hippocampal and entorhinal cortices.
Key words:
corticobasal syndrome – corticobasal degeneration – Alzheimer’s disease – tauopathies
Autoři:
S. Johanidesová 1; R. Rusina 1; P. Houška 2; J. Kellerihash2 3,4 3,5
Působiště autorů:
Neurologická klinika IPVZ a Thomayerova nemocnice, Praha
1; Neurologické oddělení, Nemocnice Strakonice, a. s.
2; 3. LF UK v Praze
3; Radiodiagnostické oddělení, Nemocnice na Homolce, Praha
4; Oddělení patologie a molekulární medicíny, Thomayerova nemocnice, Praha
5
Vyšlo v časopise:
Cesk Slov Neurol N 2012; 75/108(3): 373-377
Kategorie:
Kazuistika
Souhrn
Kortikobazální degenerace je vzácné neurodegenerativní onemocnění patřící do skupiny tauopatií, které se klinicky projevuje kombinací extrapyramidových symptomů a korové dysfunkce s postižením hlavně v parietální oblasti. Definitivní diagnóza kortikobazální degenerace je možná až neuropatologicky. Proto se u žijících pacientů užívá spíše termín kortikobazální syndrom. Cílem sdělení je demonstrovat kazuistiku pacienta s klinickým obrazem evokujícím kortikobazální degeneraci, ale neuropatologickou diagnózou definitivní Alzheimerovy nemoci. Náš pacient měl výraznou kognitivní alteraci s převahou zrakově-prostorových funkcí s nápadnou apraxií, frontálními rysy, ale i časnou poruchou paměti. Přidružen byl asymetrický extrapyramidový syndrom akineto-rigidní s levostrannou převahou, myoklonie a apraxie levé horní končetiny s občasnou dystonií. Neuropatologický nález odpovídal kritériím plně vyvinutého neokortikálního stadia časné formy Alzheimerovy nemoci bez známek postižení kortikobazální degenerací. Hlavním rysem, který umožnil rozpoznání kortikobazálního syndromu v rámci Alzheimerovy nemoci a odlišení od kortikobazální degenerace, byl výskyt myoklonií a nižší věk pacienta. Na rozdíl od předchozích studií se u našeho pacienta projevila časná porucha epizodické paměti odkazující na predominující lézi hipokampální a entorinální kůry.
Klíčová slova:
kortikobazální syndrom – kortikobazální degenerace – Alzheimerova nemoc – tauopatie
Úvod
Kortikobazální degenerace (CBD) je progresivní neurodegenerativní onemocnění ze skupiny tauopatií s převahou 4R izoformy (biochemický podtyp tau proteinu s převládajícími čtyřmi opakujícími se úseky vazby na mikrotubuly) hyperfosforylované formy tau proteinu s průkazem taupozitivních neuronálních a gliálních lézí zejména astrocytárních plak a „threads“ v bílé i šedé hmotě kortikálních struktur a striata a fokální numerickou atrofií neuronů kůry, bazálních ganglií a substantia nigra. Klinicky se onemocnění v typických případech vyznačuje asymetrickým parkinsonizmem, dystonií, končetinovou apraxií, syndromem cizí ruky, myoklonem a kognitivní dysfunkcí. V popředí je postižení zrakově-prostorových funkcí a apraxie [1], alterace pracovní paměti a exekutivní dysfunkce, často bývá přidružena deprese a iritabilita [2]. CBD se vyskytuje nejčastěji v šestém deceniu a tvoří zřejmě 4–6 % onemocnění parkinsonského typu [3].
CBD je velmi heterogenní onemocnění. Neuropatologicky potvrzená CBD může totiž vypadat jako frontotemporální demence, progresivní nonfluentní afázie nebo progresivní posteriorní kortikální atrofie [3]. Na druhou stranu klinické projevy „typické“ CBD byly popsány u jiných neurodegenerací (např. u Alzheimerovy nemoci, demence s Lewyho tělísky, Creutzfeldtovy-Jakobovy nemoci, frontotemporální lobární degenerace nebo Parkinsonovy nemoci) [3]. Při analýze neuropatologicky ověřených CBD za uplynulých 20 let činnosti londýnské Brainbank se ukázalo, že klinická diagnóza v případě CBD za života pacientů byla stanovena správně v pouhých 26,3 % [3]. Proto se klinický obraz CBD bez znalosti neuropatologického podkladu doporučuje označovat termínem „kortiko-bazální syndrom“ (CBS) [4].
Alzheimerova nemoc (AN) je charakterizována ukládáním beta amyloidu extracelulárně ve formě senilních plak a intraneuronálními depozity hyperfosforylovaného tau proteinu do podoby neurofibrilárních klubek (tangles), což v konečném důsledku vede k numerické atrofii neuronů. Neuopatologické změny jsou nejvýraznější v entorinální a anterotemporální krajině včetně hipokampů, což vede k obrazu progredující amnestické demence s převahou postižení epizodické paměti, postupně se přidává postižení dalších kognitivních domén. Vedle této typické formy AN existují i vzácnější fokální varianty, kdy neuropatologické markery onemocnění jsou výraznější v jiných lokalizacích (např. frontální varianta AN, probíhající pod obrazem demence frontálního typu nebo okcipitální varianta AN s převahou postižení zrakově-prostorových funkcí v rámci syndromu tzv. zadní kortikální atrofie – posterior cortical atrophy) [5].
Přinášíme kazuistiku pacienta s klinickým obrazem kortikobazálního syndromu (CBS), u něhož byla post mortem definitivně diagnostikována Alzheimerova nemoc (AN), přičemž pro AN typická depozita beta amyloidu a tau proteinu byla nadprahově i v lokalizacích obvyklých u postižení v rámci CBD.
Kazuistika
Šestašedesátiletý muž, řidič z povolání, bez neurologické rodinné zátěže, s anamnézou hypertenze a ischemické choroby srdeční, byl vyšetřen v roce 2007 pro poruchu paměti a zhoršenou soběstačnost. První příznaky manželka uváděla do souvislosti s kardiochirurgickým zákrokem (bypass), který prodělal o šest let dříve.
Pacient byl dezorientován, bradypsychický a emočně oploštělý, měl zjevnou anozognozii, stěžoval si pouze na bolest nohou a neobratnost prstů, MMSE bylo 10/30 bodů. Měl mírnou levostrannou hemiparézu, lehký parkinsonský syndrom, normální okulomotoriku a CT vyšetření prokázalo kortiko-subkortikální atrofii. Stav byl hodnocen jako rozvinutá Alzheimerova nemoc a byl nasazen donepezil.
Postupně se projevy nemoci zhoršily, v roce 2009 se objevil myoklonus, zpočátku na LHK, později multifokální. Rozvinul se extrapyramidový syndrom akineto-rigidní více vlevo, bez klidového tremoru. LHK se stala apraktickou s občasným dystonickým postavením a myokloniemi. Levodopa ve stoupající dávce do 600 mg neměla významnější účinek na hybnost; MMSE klesl na 8/10 a vzhledem k absenci ovlivnění kognitivních funkcí i průběhu onemocnění byl donepezil nahrazen memantinem.
MR mozku ukázala pokročilou symetrickou atrofii s převahou frontálně a parietálně, dále byla patrná atrofie hipokampů (obr. 1a) bez výraznější atrofie okcipitálního laloku (obr. 1b). SPECT prokázalo hypoperfuzi bilaterálně temporoparietálně a okcipitálně s nápadnou pravostrannou převahou (obr. 2).
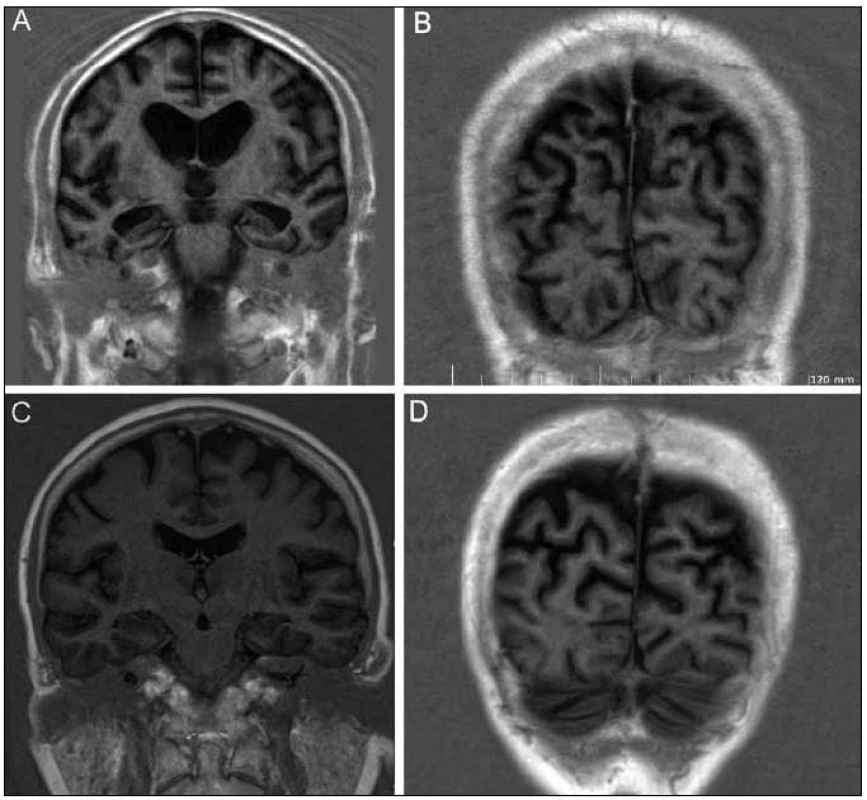
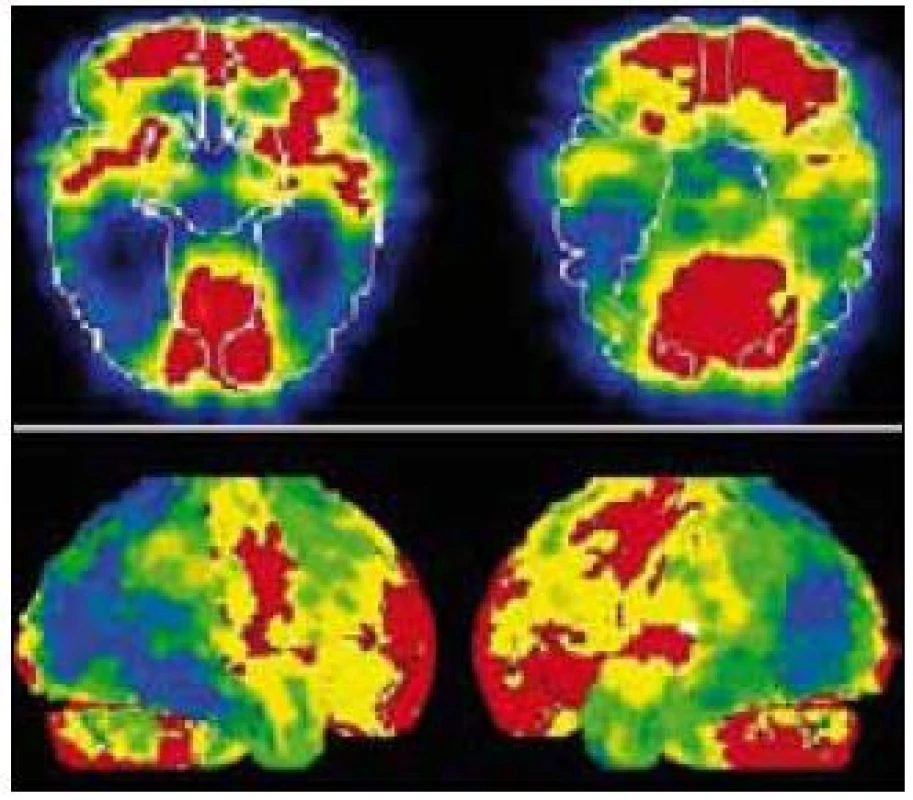
Vyšetření mozkomíšního moku bylo normální, tau protein a beta amyloid byly v normě, což v diferenciálně diagnostické rozvaze nepřineslo výraznější prospěch, genotyp Apo E byl E3/E3.
Pacient byl neuropsychologicky vyšetřen v zimě 2009 (tab. 1), vzhledem k výrazně pokročilému stavu onemocnění byl na hranici vyšetřitelnosti (MMSE bylo již pouze 5/30). Přes těžký kognitivní deficit byla patrná převaha postižení zrakově--prostorových funkcí včetně konstrukční apraxie, apraxie při oblékání a nápadné frontální rysy (perseverační tendence, stereotypie, snížená slovní produkce) s behaviorálními projevy (apatie, iritabilita a mírná dezinhibice).
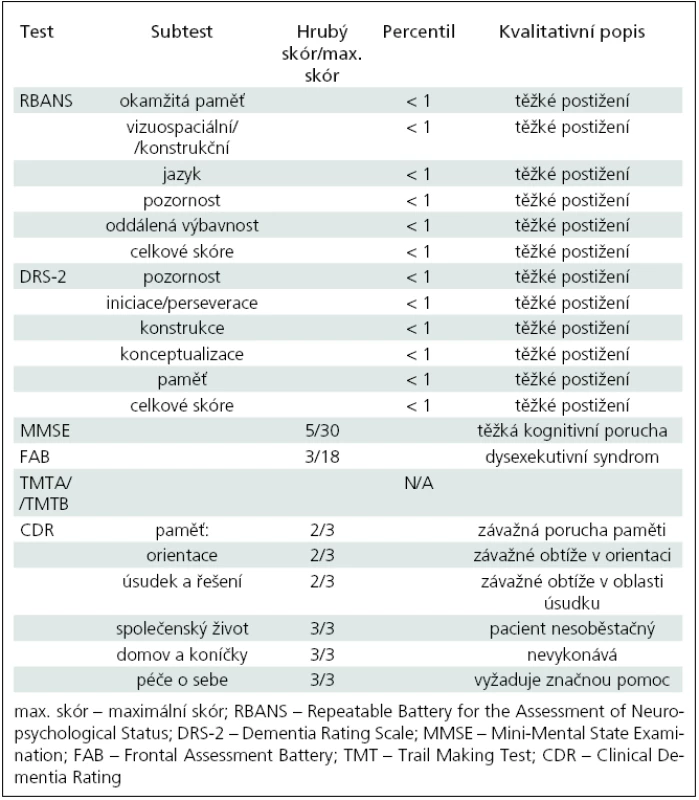
Škála pro klinické hodnocení demence CDR [6] potvrdila výrazné omezení soběstačnosti, často se objevovala agitovanost, neklid a negativizmus. Řeč byla těžkopádná, obsahově chudá.
Pacientovi byl administrován test RBANS (Repeatable Battery for the Assessment of Neuropsychological Status) [6]. Výsledky prokázaly alteraci mnestických funkcí výrazně pod hranicí normy, přičemž vzhledem k výrazné progresi onemocnění byla kromě výbavnosti narušena i vštípivost. Intruze nebyly zachyceny, křivka učení měla kolísavý charakter a omezenou kapacitu. Sémantická paměť byla také alterována.
Kresbu figury nebylo vzhledem k těžké konstrukční apraxii vůbec možné administrovat. Z deseti obrázků byl pacient schopen správně pojmenovat pouze dva, nepomohla ani nápověda dle sémantického klíče. Subnormních výsledků dosáhl také v DRS-2 (Dementia Rating Scale) [6]. V testu FAB (Frontal Assessment Battery) [6], který je zaměřen na exekutivní funkce, získal pouze tři body z 18, což svědčí pro výrazný dysexekutivní syndrom.
V roce 2010 se prohlubovala demence i poruchy hybnosti, memantin byl pro neúčinnost vysazen, objevily se delirantní stavy, pacient byl hospitalizován na gerontopsychiatrii a tam v létě téhož roku zemřel.
Neuropatologický nález
V hipokampu a přilehlé temporální kůře byl vysoký počet senilních plak, převážně „zralého“ typu, s imunohistochemickou pozitivitou protilátky proti amyloid-ß peptidu (obr. 3b). Výskyt plak v parietální, okcipitální a frontální kůře levé hemisféry byl rovněž vysoce nadprahový s velmi výrazným postižením senzomotorické kůry, premotorické kůry, plaky však byly nalezeny i v mozečku.
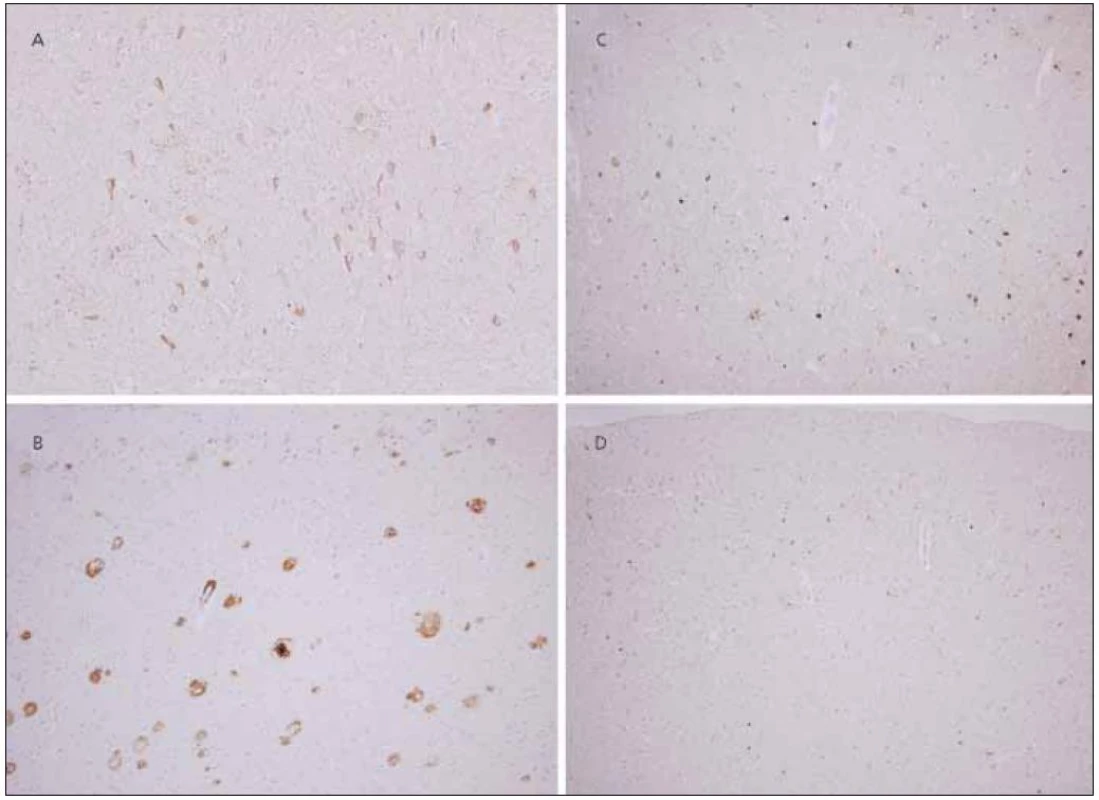
V početných neuronech hipokampu byla neurofibrilární klubka pozitivní v imunohistochemické reakci s protilátkou proti hyperfosforylované formě tau proteinu (obr. 3a). V kůře i subkortikální šedé hmotě zejména v bazálních gangliích a mezencefalu byly zastiženy četné „pretangles“, „threads“, jednotlivé globoidní tangles, ojedinělé „tufted astrocytes“, ale astrocytární plaky nebyly patrné v žádné z vyšetřených oblastí. Ojediněle byly zjevné i gliální inkluze v subkortikální bílé hmotě. Značná část inkluzí byla pozitivních v reakci s protilátkou proti 4R (obr. 3c), avšak místy je zřetelná převaha 3R pozitivit (biochemický podtyp tau proteinu s převládajícími třemi opakujícími se úseky vazby na mikrotubuly) (obr. 3d), a to i v primární motorické kůře a kůře premotorické.
V substantia nigra a locus coeruleus byla jen nevýrazná numerická atrofie pigmentovaných neuronů, Lewyho tělíska či neurity neprokázala ani imunohistochemická reakce s alfa-synukleinem. Inkluze pozitivní v ubikvitinu, proteinu P62 či proteinu TDP-43 nalezeny nebyly. Ani užitím protilátky proti alfa-B krystalinu jsme nenacházeli dystrofické balónové neurony v motorických oblastech mozkového kortexu.
Diagnostický závěr tedy odpovídal kritériím plně vyvinutého neokortikálního stadia časné formy Alzheimerovy nemoci (Braak VI, CERAD frequent); změny kompatibilní s obrazem CBD nalezeny nebyly.
Diskuze
Přinášíme kazuistiku pacienta s klinickým obrazem kortikobazální degenerace, u něhož byla post mortem nečekaně prokázána Alzheimerova nemoc v neokortikálním stadiu s typickým neuropatologickým nálezem (neuritické plaky a neurofibrilární klubka). Distribuce neuropatologických změn sice odpovídala obvyklému nálezu u Alzheimerovy nemoci (predilekce v meziotemporální a anterotemporální krajině a parahipokampálních gyrech), ale změny byly velmi výrazné rovněž v parietální kůře (tedy v oblastech, kde je maximum taupozitivních depozit u CBD).
Demence s časnou apraxií a frontální symptomatikou byla provázena výrazně asymetrickým extrapyramidovým syndromem nereagujícím na dopaterapii. Intermitentní dystonické projevy s myokloniemi na LHK evokující syndrom cizí ruky (alien hand) byly v korelaci s hypoperfuzí parietálně více vpravo na SPECTu a parietální atrofií na MR. V souhrnu tedy tento obraz sugestivně evokoval klinickou diagnózu CBD.
V dalším textu budeme diskutovat o dvou hlavních rysech, které u našeho pacienta při zpětném hodnocení mohly vést k podezření na kortikobazální syndrom v rámci Alzheimerovy nemoci (CBS-AN): 1. poruchy paměti, 2. MR obraz atrofie nejen biparietálně, ale i v hipokampální krajině. Navíc negativní likvorové vyšetření rovněž částečně svědčilo proti diagnóze Alzheimerovy nemoci, samozřejmě při vědomí limitů interpretace výsledků tohoto vyšetření [7,8].
U pacientů s CBD se v rámci kognitivní alterace objevuje časné postižení zrakově-prostorových funkcí a deficity exekutivních funkcí, praxie a řeči s poměrně zachovalou epizodickou pamětí [9]. Onemocnění postupně progreduje do obrazu frontálního typu demence. Naproti tomu časný deficit epizodické paměti s poruchou výbavnosti i vštípivosti bývá v korelaci s atrofií hipokampů a přilehlé temporální kůry typicky v rámci Alzheimerovy nemoci [10]. U pacientů CBD i u pacientů CBS-AN je epizodická paměť relativně zachována. Pracovní paměť, která je funkcí exekutivy, je častěji narušena u pacientů s kortikobazální degenerací [11]. Sémantická paměť může být, avšak nemusí být narušena jak u CBD, tak u AN. Předchozí výzkum ukazuje, že nebyly shledány signifikantní rozdíly v oblasti sémantické paměti mezi pacienty trpícími AN a pacienty s kortikobazálním syndromem [12].
Zrakově prostorové postižení s těžkou konstrukční, ideomotorickou a oblékací apraxií může být projevem pokročilé Alzheimerovy nemoci, ale obdobně výrazné postižení v časné fázi průběhu neurodegenerativního onemocnění (jako u našeho pacienta) svědčí spíše pro CBD [2].
Pacient také trpěl neplynulou (nonfluentní) afázií s dysartrií, která je častá u CBD. Pro AN je naopak typická zpočátku anomická afázie, později obraz fluentní transkortikální senzorické afázie s fonemickými parafáziemi. Snížené slovní produkci u našeho pacienta odpovídalo i nápadné postižení frontobazálně a periinzulárně vlevo (predilekční postižení Brodmannovy arey 10 u CBD bylo již v literatuře popsáno [13]).
Z přidružených behaviorálních symptomů v rámci demence u našeho pacienta převažovala deprese, apatie a negativizmus, což je u CBD časté [2], podobné obtíže se však mohou vyskytnout i u jiných demencí, včetně AN.
U našeho pacienta vyjádřený MR obraz symetrické atrofie s převahou frontálně a parietálně s mírným postižením hipokampů není typický pro AN v tomto věku, u Alzheimerovy nemoci nacházíme predominantní hipokampální a anterotemporální atrofii. Obraz však také není typický pro CBD, u níž je uváděna asymetrie atrofických změn parasagitálně [14]. Z hlediska zobrazovacího nebyla diagnóza zcela typická, avšak biparietální atrofie nasvědčovala spíše pro CBS-AN (kde je typický nález fronto-parietální atrofie, typicky asymetrické) než CBD nebo čistou AN. Recentně však byla popsána i symetrická varianta CBD, což by vysvětlovalo asymetrii změn na SPECT, která se ještě morfologicky neodrazila v atrofii.
Dvě recentní studie srovnávají neuropsychologický profil, demografická data a fokální atrofii (MR voxel-based morfometrie) CBS způsobený „klasickou“ CBD (tedy 4R-tauopatie – CBS-CBD) a fokální variantu Alzheimerovy nemoci (tedy CBS-AN). Ukázalo se, že pacienti s CBS-AN jsou mladší, častěji se projevují myokloniemi a méně často tremorem. Wadia et al doporučují tři kritéria, která jsou užitečná k vyloučení CBD v rámci klinického obrazu CBS: dobrá počáteční odezva na levodopu po dobu víc než dvou let, časné postižení okulomotoriky do dvou let od prvních symptomů a trvání onemocnění déle než deset let [15].
U CBS-AN byla nalezena atrofie zadních frontálních a horních parietálních oblastí, avšak důležitou odlišností byla celkově pokročilejší atrofie i dalších oblastí [4,16].
Neuropsychologické vyšetření je důležité pro zhodnocení CBS syndromu. Nedokáže však rozlišit AN prezentující se jako CBS od CBD, protože změny jsou podmíněny anatomickou lokalizací léze, nikoliv biochemickou podstatou neurodegenerativního onemocnění. Předchozí studie ukazují, že neuropsychologické vyšetření u pacientů s CBD a pacientů s CBS-AN má podobný charakter míry postižení paměti a exekutivních funkcí [16]. Ačkoliv dosud publikované studie [12] neprokazují výraznější poruchy epizodické paměti u pacientů CBS-AN ve srovnání s pacienty s kortikobazální degenerací, v našem případě jsme u pacienta zjistili časnou poruchu epizodické paměti (anamnestický údaj).
Závěr
Diferenciální diagnostika CBS je složitý problém, i přes užití všech dostupných vyšetřovacích modalit nelze mnohdy dospět ke správné diagnóze. Pouze retrospektivní analýzy důkladně vyšetřených a neuropatologicky verifikovaných případů pomohou najít diskriminující změny, které odliší CBD od ostatních příčin CBS, zvláště případů CBS-AN.
Autoři děkují rodině pacienta za souhlas s publikací této kazuistiky. Autoři rovněž děkují prim. MUDr. Petru Lhotákovi (Radiologické oddělení, Nemocnice České Budějovice, a.s.) a prim. MUDr. Marii Buncové, CSc. (Radioizotopové pracoviště IKEM), za zapůjčení části obrazové dokumentace a souhlas s publikací.
Podpořeno výzkumným záměrem MŠM 0021620816 a grantem IGA MZ NT 12094-5.
Mgr. Silvie Johanidesová
Neurologická klinika
IPVZ a Thomayerova nemocnice
Vídeňská 800
140 59 Praha 4
e-mail: silvie.johanidesova@ftn.cz
Přijato k recenzi: 11. 7. 2011
Přijato do tisku: 13. 12. 2011
Zdroje
1. Bak TH, Caine D, Hearn VC, Hodges JR. Visuospatial functions in atypical parkinsonian syndromes. J Neurol Neurosurg Psychiatry 2006; 77(4): 454–456.
2. Litvan I, Cummings J, Mega M. Neuropsychiatric features of corticobasal Degeneration. J Neurol Neurosurg Psychiatry 1998; 65(5): 717–721.
3. Ling H, Sullivan SS, Holton JL, Revesz T, Massey LK, Williams DR et al. Does corticobasal degeneration exist? A clinicopathological re-evaluation. Brain 2010; 133(7): 2045–2057.
4. Josephs KA, Whitwell JL, Boeve BF, Knopman DS, Petersen RC, Hu WT et al. Anatomical differences between CBS-corticobasal degeneration and CBS-Alzheimer’s disease. Mov Disord 2010; 25(9): 1246–1252.
5. Alladi S, Xuereb J, Bak T, Nestor P, Knibb J, Patterson K, Hodges JR. Focal cortical presentations of Alzheimer’s disease. Brain 2007; 130 (10): 2636–2645.
6. Lezak MD, Howieson DB, Loring DW. Neuropsychological assessment. Oxford: Oxford University Press 2004.
7. Vranová H, Kaňovský P, Mareš J, Nevrlý M, Stejskal D, Nestrašil I et al. Laboratorní ukazatele neurodegenerace v likvoru a míra motorického postižení u Parkinsonovy nemoci: korelační studie. Cesk Slov Neurol N 2008; 71/104(3): 324–328.
8. Vališ M, Taláb R, Andrýs C, Štourač P, Masopust J, Kalnická D et al. Tau-protein, fosforylovaný tau-protein a beta-amyloidu42 v likvoru u demencí a roztroušené sklerózy. Cesk Slov Neurol N 2008; 71/104(3): 329–335.
9. Kim SK, Park KW, Kang DY, Cha JK, Kim SH, Kim JW. Severe episodic memory impairment in a patient with clinical features compatible with corticobasal degeneration. J Clin Neurol 2008; 4(2): 94–98.
10. Shelley BP, Hodges JR, Kipps CM, Xuereb JH, Bak TH.Is the pathology of corticobasal syndrome predictable in life? Mov Disord 2009; 24(11): 1593–1599.
11. Mathuranath PS, Xuereb JH, Bak T, Hodges JR. Corticobasal ganglionic degeneration and/or frontotemporal dementia? A report of two overlap cases and review of literature. J Neurol Neurosurg Psychiatry 2000; 68(3): 304–312.
12. Xie S, Libon DJ, Wang X, Massimo L, Moore P, Vesely L et al. Longitudinal Patterns of Semantic and Episodic Memory in Frontotemporal Lobar Degeneration and Alzheimer’s Disease. Int Neuropsychol Soc 2010; 16(2): 278–286.
13. Hillis EA. Naming and language production. In: Grossman M (ed). Behavioural/cognitive Neurology. AAN Continuum: Lifelong Learning in Neurology. Philadelphia: Lippincott Williams & Wilkins 2010; 16(4): 29–44.
14. Barkhof F, Fox NC, Bastos-Leite A, Scheltens P. Neuroimaging in Dementia. 1st ed. Berlin Heidelberg: Springer-Verlag 2011.
15. Wadia PM, Lang AE. The many faces of corticobasal degeneration. Parkinsonism Relat Disord 2007; 13 (Suppl 3): S336–S340.
16. Hu WT, Rippon GW, Boeve BF, Knopman DS, Petersen RC, Parisi JE et al. Alzheimer’s disease and corticobasal degeneration presenting as corticobasal syndrome. Mov Disord 2009; 24(9): 1375–1379.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2012 Číslo 3
-
Všechny články tohoto čísla
- Chirurgická léčba revmatického postižení kraniocervikálního přechodu
- Konformačně specifické protilátky a diagnostika prionových chorob
- Low back pain a deprese – vzájemný vztah
- Neurosyfilis
- Diagnostika a možnosti léčby Niemann-Pickovy choroby typ C
- Tau protein a anti-tau protilátky u pacientů s roztroušenou sklerózou
- Asociace polymorfizmů v genu pro matrix metalloproteinázu-2 a tkáňový inhibitor metalloproteinázy-2 s roztroušenou sklerózou
- Neurofyziologická diagnostika poškození loketního nervu v oblasti lokte
- Rozšířený transnazální endoskopický přístup k nádorům lebeční spodiny a očnice
- Stanovení mozečkové dominance podle asymetrie svalového tonu končetin
- Vzorec posturálnych zmien v súvislosti so symetrickou vibráciou krčných svalov
- Operační léčba syndromu tarzálního tunelu
- Zadní interhemisférický prekuneální/transspleniální přístup k intrinsickým mozkovým lézím
- Atypický paraneoplastický neurologický syndrom – kazuistika
- Neurenterická cysta kraniocervikální junkce – kazuistika
- Oboustranná léze n. phrenicus manifestující se jako ortopnoe – kazuistiky tří případů
- Alzheimerova nemoc probíhající pod obrazem kortikobazální degenerace – kazuistika
- Rozsáhlý epidurální absces cervikotorakální páteře řešený kombinovaným přístupem – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XXXIII. Bayesovská statistika v klinických a neurovědních aplikacích - Stanislav Kratochvíl – Experimentální hypnóza. 3. aktualizované a rozšířené vydání. Praha: Grada 2011, 363 stran.
- Adherence k léčbě u pacientů se schizofrenií
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Neurosyfilis
- Operační léčba syndromu tarzálního tunelu
- Diagnostika a možnosti léčby Niemann-Pickovy choroby typ C
- Oboustranná léze n. phrenicus manifestující se jako ortopnoe – kazuistiky tří případů
