Míšní šok – od patofyziologie ke klinickým projevům
Spinal Shock – from Pathophysiology to Clinical Manifestation
Spinal shock occurs as a consequence of an abrupt interruption of descending supraspinal pathways. The term spinal shock describes a phenomenon when a trauma, ischemia, hemorrhage or inflammation results in sudden loss of neurological functions below the level of the injury. Clinically, transient loss or decrease of reflex activity below the level of the injury, hypotonia and disturbance of motor, sensory and autonomic functions predominate. In order to clarify the mechanism behind the spinal shock and subsequent return of reflex activity or even hyperreflexia, we need to understand the changes taking place in motor neurons below the level of the injury. These changes consist of three main phases. Reduction of reflex activity results from decreased excitability of spinal motor neurons. Resumption of reflex activity or voluntary movement is attributed to denervation hypersensitivity and hyperreflexia occurs due to new synaptic growth. Consequently, the motor neuron below the level of injury is predominantly under either voluntary or reflex control. As a result, various levels of spasticity develop or, in case of an incomplete lesion, voluntary movement might be recovered, depending on the extent of spinal cord injury.
Key words:
spinal shock – spinal cord injury – tetraplegia – paraplegia – synapse – spasticity
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
R. Háková 1; J. Kříž 1,2
Působiště autorů:
Spinální jednotka při Klinice RHB a TVL 2. LF UK a FN v Motole, Praha
1; Ortopedicko-traumatologická klinika 3. LF UK a FN Královské Vinohrady, Praha
2
Vyšlo v časopise:
Cesk Slov Neurol N 2015; 78/111(3): 263-267
Kategorie:
Přehledný referát
doi:
https://doi.org/10.14735/amcsnn2015263
Souhrn
Míšní šok nastává náhlým přerušením descendentních supraspinálních drah. Termín míšní šok tedy popisuje stav, kdy dojde většinou v důsledku traumatu, ischemie, hemoragie či zánětu k náhlému výpadku nervových funkcí pod úrovní akutní míšní léze. Klinicky dominuje dočasná ztráta nebo pokles míšní reflexní aktivity pod úrovní léze, hypotonie a porucha motorických, senzitivních a autonomních funkcí. Pro objasnění mechanizmu vzniku míšního šoku a následného návratu reflexů až rozvoje hyperreflexie je zásadní pochopení změn, ke kterým dochází v oblasti motoneuronu pod úrovní míšní léze. Tyto změny probíhají ve třech hlavních fázích. Ke snížení reflexní aktivity dochází v důsledku poklesu excitability míšních motoneuronů. Obnovení reflexní aktivity a případně volního pohybu je ve fázi návratu reflexů připisováno denervační hypersenzitivitě, ve fázi hyperreflexie pak růstu nových synapsí. Motoneuron pod úrovní míšní léze se v důsledku popsaných změn dostává dominantně buď pod volní, nebo reflexní kontrolu. Výsledkem je rozvoj různě závažné formy spasticity a u nekompletních míšních lézí návrat volní hybnosti v závislosti na rozsahu míšního poškození.
Klíčová slova:
míšní šok – poranění míchy – tetraplegie – paraplegie – synapse – spasticita
Úvod
Míšní šok se může rozvinout po částečném nebo úplném přerušení míchy. Objevuje se zejména při akutním míšním poranění, ale byl popsán i u několik hodin trvajícího mechanizmu vzniku míšní léze. Přítomnost míšního šoku svědčí pro rychlejší vznik a horší prognózu poškození míchy [1]. Syndrom míšního šoku je definován výpadkem motorických, senzitivních a autonomních funkcí s areflexií nebo hyporeflexií a hypotonií pod úrovní míšní léze. Postupně dochází k obnově reflexů až k hyperreflexii jako jednomu z pozitivních příznaků léze centrálního (horního) motoneuronu [2]. Případný návrat motorických, senzitivních a autonomních funkcí po odeznění míšního šoku závisí na rozsahu míšní léze. Ve fázi míšního šoku je obtížné předvídat závažnost poškození míchy, nicméně některé příznaky mohou být již v tomto období prognosticky významné. Míšní šok může trvat několik dní, ale i týdnů. Neexistuje konsenzus ohledně klinické symptomatologie definující trvání míšního šoku. Někdy je za jeho ukončení označován návrat polysynaptických kožních reflexů, jindy až návrat šlachookosticových reflexů, podle některých autorů končí míšní šok návratem reflexní aktivity detruzoru, podle jiných pak nástupem spasticity [3]. Míšní šok může prodloužit např. septická komplikace, jako uroinfekce nebo dekubit [1]. Patofyziologická podstata míšního šoku budí zájem vědců a lékařů již po mnoho desítek let, a byť mnohé bylo objasněno, stále zůstává řada otázek nezodpovězených.
Vývoj pohledu na fenomén míšního šoku
Fenomén míšního šoku poprvé popsal Robert Whytt v roce 1750 jako ztrátu citlivosti provázenou motorickým výpadkem s postupnou úpravou reflexů. Termín šok však poprvé použil až v roce 1841 Marshall Hall pro krátkodobé vymizení reflexů na končetinách žáby po přerušení míchy za okciputem [4]. Sir Charles Scott Sherrington v roce 1898 označil za hlavní faktor míšního šoku nedostatek facilitace ze suprasegmentálních oblastí [5]. Sir Ludwig Guttmann v roce 1964 popsal, že míšní šok může být důsledkem přetrvávání inhibice reflexní aktivity pod úrovní léze [6].
Little et al prezentovali v roce 1999 teorii dvou základních neuronálních mechanizmů vysvětlujících zlepšení motorických funkcí a rozvoj hyperreflexie na příkladu inkompletního míšního poranění. Little et al předpokládali časné postsynaptické změny zvyšující efektivitu synapsí, na které navazují presynaptické změny, respektive růst nových synapsí [7]. Tuto teorii ve své práci z roku 2004 dále rozvinuli Ditunno et al. Ti potvrdili zásadní roli synaptických změn při odeznívání míšního šoku na příkladu kompletního míšního poranění a navrhli dnes často citovaný nový, čtyřfázový model míšního šoku, kdy každá fáze je definována patofyziologicky i klinicky [4]. Obecně jsou pro porozumění mechanizmům podílejícím se na rozvoji a odeznění míšního šoku důležité tři fáze, které uvádíme v dalším přehledu (tab. 1).
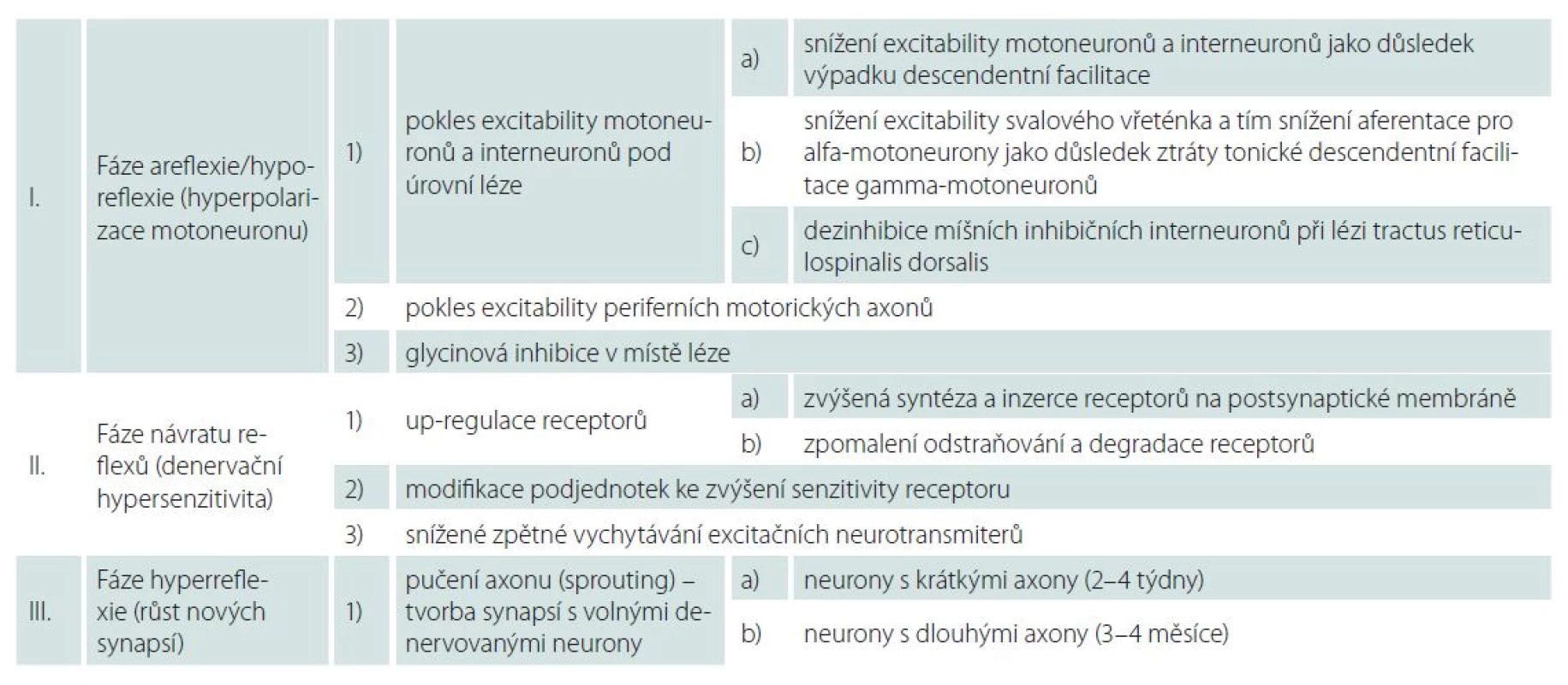
Fáze areflexie/ hyporeflexie (hyperpolarizace neuronů): 0.– 1. den
Patofyziologie
Míšní motoneurony i interneurony mají za normálních okolností bazální úroveň excitačních stimulů, které kontinuálně přicházejí ze supraspinálních axonů, většinou z jader pontu. Volní pohyb pak za fyziologických podmínek nasedá na toto excitační pozadí [4]. Po akutně vzniklé míšní lézi jsou míšní neurony kaudálně od místa poranění izolovány od descendentních podnětů. Výpadek descendentní facilitace vede k hyperpolarizaci neuronů a ke snížení jejich excitability [1,7 – 9]. Pokles excitability motoneuronů a interneuronů pod úrovní léze je pokládán za primární příčinu hypo ‑ či areflexie v této fázi míšního šoku [4].
Na rozvoji míšního šoku se pravděpodobně dále podílí i ztráta tonické descendentní facilitace gamma ‑ motoneuronů, jež způsobí snížení excitability svalového vřeténka, a tím snížení aferentace pro alfa‑motoneurony [1,4].
Jako třetí příčina poklesu excitability neuronů pod míšní lézí je uváděna dezinhibice míšních inhibičních interneuronů při lézi tractus reticulospinalis dorsalis [1,4,7].
Poruchy motoriky po míšním poranění jsou tradičně vysvětlovány poškozením descendentních drah s malým podílem změn v periferním nervovém systému. Boland et al však ve své studii s 11 pacienty po poranění krční nebo hrudní míchy zachytili po přechodnou dobu od vzniku akutní míšní léze signifikantní pokles excitability periferních motorických axonů zejména na dolních končetinách. Obnovení excitability souviselo klinicky s rozvojem hyperreflexie, nekorelovalo však se zlepšením svalové síly [10].
Za rozvoj míšního šoku může být částečně odpovědná i glycinová inhibice. Hypotézu, že inhibiční neurotransmiter glycin je jedním z mediátorů míšního šoku, potvrdili ve své práci Simpson et al [11].
Elektrofyziologický korelát
Elektrofyziologickým korelátem změn ve fázi hypo‑/ areflexie je chybějící tibiální H ‑ reflex a nevýbavnost F ‑ vlny [9,12].
Klinický pohled
Pod úrovní míšní léze jsou výrazně redukované až vymizelé míšní reflexy. Při důsledném neurologickém vyšetření pacienta bezprostředně po úraze je úplná absence všech reflexů spíše vzácností [13]. Dále je patrná chabá paréza či plegie kosterních svalů. Současně dochází i k poruše senzitivních a autonomních drah. Motorický a senzitivní deficit je objektivizován vyšetřením dle ISNCSCI (Mezinárodní standardy pro neurologickou klasifikaci míšního poranění) [14].
V důsledku poškození sympatické inervace při zachované funkci parasympatiku se v této fázi míšního šoku rozvíjí neurogenní šok. Neurogenní šok je klinicky vyjádřen zejména závažnou arteriální hypotenzí, bradykardií a poikilotermií. Jedná se o život ohrožující stav, který – pokud není včas rozpoznán a léčen – může vést k selhání orgánů [15]. Udržení krevního tlaku je rovněž zásadní pro eliminaci sekundárního míšního poranění [8]. Studie autorů Guly et al se zabývala incidencí neurogenního šoku v souboru pacientů po míšním monotraumatu. Jeho relativně nízkou incidenci (19,3 % u krčních a 7 % u hrudních lézí) autoři vysvětlili tím, že symptomy míšního šoku vč. šoku neurogenního se mohou objevit i s odstupem a že někteří pacienti mohli být ošetřeni ještě před jeho manifestací [16].
Fáze návratu reflexů (denervační hypersenzitivita): 1.– 3. den
U kompletního míšního poranění není návrat reflexní aktivity provázen obnovením motorických funkcí. Při nekompletní lézi se s reflexní aktivitou postupně navrací i volní pohyb. Po nekompletním míšním poranění jsou reflexy méně sníženy a k jejich návratu dochází rychleji, neboť míšní neurony jsou méně hyperpolarizovány. Návrat reflexů po míšním poranění je součtem řady adaptačních procesů v míše, které umožňují aktivitu míšních motoneuronů s větší nezávislostí na supraspinální kontrole, což je příklad plasticity zralého CNS [8].
Patofyziologie
Současný návrat reflexů a zlepšení motorických funkcí v odstupu hodin až dnů (4 – 72 hod) po nekompletním míšním poranění ukazuje na společný postsynaptický mechanizmus v míšních neuronech pod úrovní léze [7]. Důsledkem postsynaptických změn je zvýrazněná synaptická efektivita. Hovoříme o tzv. denervační hypersenzitivitě. V CNS může dojít ke zvýšení senzitivity k neurotransmiterům několika způsoby.
Za hlavní mechanizmus je považována tzv. up ‑ regulace. Jedná se o zvýšenou syntézu a inzerci receptorů na postsynaptické membráně a zpomalení odstraňování receptorů. Je popisován zejména na inaktivitě závislý vzestup syntézy excitačních NMDA (N ‑ metyl ‑ D ‑ aspartát) glutamátových receptorů v motoneuronech. Stoupá i množství jiných receptorů, např. serotoninu 2A. Up ‑ regulace receptorů může vysvětlovat časné obnovení reflexní aktivity.
Další možností zvýšení senzitivity receptoru k neurotransmiterům je modifikace podjednotek receptoru [4,7,8]. V této fázi míšního šoku stoupá množství neurotrofinů a jiných růstových faktorů a jejich receptorů. Signálem pro tento vzestup mohou být např. lipopolysacharidy z degenerujících axonů, cytokiny uvolněné gliovými buňkami či inaktivita míšních neuronů. Některé neurotrofiny a růstové faktory zvyšují synaptickou efektivitu. Např. fosforylací podjednotek glutamátového NMDA receptoru dochází ke zvýšení jeho excitability. Jiné neurotrofiny a růstové faktory snižují GABA (kyselina g ‑ aminomáselná) inhibici a přispívají tak k odeznění míšního šoku [4].
Mezi uváděné mechanizmy denervační hypersenzitivity patří rovněž snížené zpětné vychytávání excitačních neurotransmiterů.
Elektrofyziologický korelát
Elektrofyziologickým korelátem změn v časné fázi je návrat tibiálního H ‑ reflexu asi 24 hod po kompletním míšním poranění, kdy jsou však šlachookosticové reflexy ještě stále nevýbavné. Ztráta reflexů a tonu je dále provázena nízkou perzistencí F ‑ vlny [9,12].
Klinický pohled
První reflex, který lze vyvolat obvykle již v prvních hodinách po poranění, je patologický reflex DPR (Delayed Plantar Response; opožděná plantární odpověď). Je vybavitelný neobvykle silným tupým stimulem planty od paty k palci podél laterální strany plosky a poté mediálně přes hlavičky metatarzů k palci. Odpovědí je opožděná flexe a následná relaxace palce [17]. Z fyziologických reflexů dochází nejprve k obnovení některých kožních polysynaptických reflexů: bulbokavernózního, análního a kremasterového reflexu. Přítomnost bulbokavernózního reflexu bývá uváděna jako klinický příznak odeznění míšního šoku. Při obnovení nebo zesílení kožních reflexů nejsou většinou šlachookosticové reflexy ještě přítomny.
Postup návratu reflexů v průběhu míšního šoku studovali ve své práci z roku 1999 Ko et al. Zaměřili se na patologickou DPR, vybrané polysynaptické kožní reflexy, reflex patelární, reflex Achillovy šlachy a Babinskiho příznak. DPR byla prvním reflexem, který se objevoval, a u kompletních poranění přetrvávala minimálně týden. DPR byla výbavná u všech pacientů s kompletním a senzitivně nekompletním poraněním. Pouze v 10 % DPR přetrvávala déle než jeden měsíc. Nejčastěji pak následoval bulbokavernózní (za 1 – 2 dny) a kremasterový reflex (1. – 3. den u dvou třetin kompletních lézí, u zbývající třetiny do dvou týdnů). Babinskiho příznak se nikdy neobjevil před DPR. V den úrazu byla úplná areflexie u méně než 8 % pacientů, šlachookosticové reflexy však chyběly u všech pacientů s motoricky kompletním poraněním [13]. Vývoj reflexů v prvních několika dnech po vzniku poranění se zdá být pro určování prognózy důležitější než pouhá přítomnost nebo nepřítomnost reflexů v den poranění. Vybavitelnost DPR déle než 48 hod od vzniku poranění je špatné prognostické znamení. Přetrvávání DPR tedy může být spolu s kompletním neurologickým vyšetřením a vyšetřením dle ISNCSCI využito pro odhad prognózy u pacientů po akutním míšním poranění [17].
Fáze hyperreflexie (růst nových synapsí)
Synaptická zakončení přerušeného axonu s míšními motoneurony a interneurony degenerují v průběhu několika dní. S odstupem dvou týdnů až měsíců dochází k pozdním dlouhotrvajícím změnám, které jsou charakteristické pro přirozený vývoj míšního poranění a prolínají se se změnami provázejícími odeznívání míšního šoku.
Patofyziologie
Změny výbavnosti reflexů a návrat motorických funkcí probíhají v této pozdní fázi postupně a různým tempem, což svědčí spíše pro pomalu se rozvíjející presynaptický mechanizmus. Axony zachovaných descendentních motorických drah, axony reflexních oblouků a interneurony vytvářejí nové synapse. K růstu synapsí dochází pučením (sprouting) nepoškozených axonů s tvorbou synapsí na novém cílovém neobsazeném motoneuronu [4].
Důležitou roli v této fázi hrají neurotrofiny uvolňované hypoaktivními spinálními neurony. Jejich množství vrcholí několik dní po poranění a působí jako retrográdní signál indukující růst nových synapsí [4,8]. Růst nových synapsí probíhá v tomto období pravděpodobně ve dvou fázích, které korelují se dvěma periodami vzestupu H ‑ reflexu – přechodný vzestup během 2. – 4. týdne a odložený vzestup během čtvrtého měsíce. Synaptický růst vyžaduje vzestup proteosyntézy, ke kterému dochází jednak lokálně v oblasti terminálního zakončení axonu a jednak s časovým odstupem v těle axonu v závislosti na jeho délce [4]. Neurony s dlouhými axony (např. aferentní neurony typu Ia) jsou díky zmíněné lokální proteosyntéze v oblasti terminálního zakončení axonu schopny v soutěži o tvorbu synapsí s volnými denervovanými motoneurony konkurovat interneuronům. Interneurony by totiž jinak byly díky kratšímu axonu zvýhodněny, neboť jak retrográdní signál neurotrofinů, tak pomalý anterográdní transport proteinů z těla neuronů u nich probíhají rychleji. S časovou prodlevou přímo úměrnou délce axonu pak dochází k posílení, resp. dozrávání vzniklých synapsí právě díky pomalému anterográdnímu transportu proteinů z axonálního těla do oblasti terminálního zakončení axonu. Rychlost synaptického růstu je tedy závislá na délce axonu. Zatímco interneurony tvoří plně funkční synapse s odstupem 2 – 4 týdnů od vzniku poranění, senzitivní aferentní neurony typu Ia potřebují 3 – 4 měsíce [4].
Zlepšení motorických funkcí je často přisuzováno obnovení vedení v místě poranění [4,6], kde dochází k resorpci edému nebo hematomu. Obnovení vedení však nemůže, stejně tak jako remyelinizace axonů, vysvětlit zlepšení motorických funkcí v případech, kdy dochází k axonální degeneraci. Zmíněný růst nových synapsí umožňuje zachovaným descendentním motorickým axonům zaujmout nové funkce kaudálně od inkompletního poranění. Předpokládaný růst synapsí lze pravděpodobně posílit zvýšením aktivity v příslušné dráze [7].
Elektrofyziologický korelát
Elektrofyziologickým korelátem změn ve fázi hyperreflexie jsou změny H ‑ reflexu. Byly pozorovány dvě periody vzestupu H ‑ reflexu – přechodný vzestup během 2. – 4. týdne a odložený vzestup během čtvrtého měsíce. Současně dochází k zotavení F ‑ vlny s normální perzistencí odpovědi [12]. Po 2 – 6 měsících, kdy je spasticita zcela rozvinutá, ukazují elektrofyziologická měření již málo změn [12].
Klinický pohled
K návratu reflexů šlachookosticových dochází obvykle 4. – 30. den po vzniku poranění.
Návrat reflexů je samozřejmě individuální a variabilní, a to dokonce i u kompletních poranění, kde bychom očekávali uniformní odpověď. Část variability je pravděpodobně důsledkem rozdílu ve výbavnosti reflexů u zdravých jedinců [18].
Autonomní funkce rovněž pokračují ve vývoji se zmírněním vagové bradykardie a hypotenze. U pacientů s míšní lézí nad šestým hrudním míšním segmentem se může objevit syndrom autonomní dysreflexie (AD) [19]. Některé kazuistiky uvádějí i výskyt časné AD po kompletním poranění [20]. Rozšiřující se povědomí o kardiovaskulárních dysfunkcích, jež jsou hlavní příčinou úmrtí spinálních pacientů, vede k začlenění autonomní dysfunkce do hodnocení stavu pacienta [21].
Růst nových synapsí může vést k žádoucímu i nežádoucímu klinickému vývoji. Příkladem synaptického růstu, který vede ke zlepšení neurologických funkcí, je klinický vývoj u Brown ‑ Séquardova syndromu. Ten je charakterizován asymetrickou svalovou slabostí spojenou s poruchou taktilního čití a propriocepce na straně léze a poruchou algického a termického čití kontralaterálně. Za zlepšení motorických funkcí je odpovědná právě reorganizace neporušených motorických drah navzdory nulové regeneraci ipsilaterálních motorických axonů. V časné fázi do 72 hod se upraví motorická funkce lehce paretické kontralaterální dolní končetiny a v pozdní fázi s odstupem dvou týdnů až měsíců se navrací motorická funkce těžce paretické ipsilaterální dolní končetiny. Kontrolu nad těžce paretickou končetinou tedy přebírají zachované kontralaterální motorické axony [7,22].
Během této fáze se vývoj reflexů a zlepšování motorických funkcí mohou měnit inverzně, kdy s narůstající silou v extenzorech kolene klesá amplituda patelárního reflexu. Alternativně může zlepšování motorických funkcí stagnovat nebo klesat, když se rozvine hyperreflexie. Tento inverzní vztah napovídá, že mezi zachovanými descendentními motorickými dráhami a reflexními dráhami dochází ke kompetici. Zmíněná kompetice je limitujícím faktorem zlepšení motorických funkcí [7]. V případě dostatečného množství neporušených sestupných motorických drah může cestou synaptického růstu zachovaných descendentních motorických axonů s „volnými, denervovanými“ motoneurony dojít ke zlepšení motorických funkcí. V opačném případě mohou nové synapse míšních aferentních neuronů s „volnými“ motoneurony přispět ke spasticitě. Motorické neurony jsou tedy buď pod volní, nebo reflexní kontrolou, přičemž jedna z nich se stává pro daný motoneuron dominantní [4].
Neuronální aktivita v zachovaných descendentních motorických drahách je podpůrným faktorem pro motorické zotavení. Rozvíjející se hyperreflexie po míšním poranění je potencována aktivitou v reflexních drahách a brání motorickému zotavení, které často stagnuje nebo regreduje, když se stává hyperreflexie dominantní. RHB léčba by proto měla mít za cíl zvýšení aktivity v zachovaných descendentních motorických drahách za pomoci reflexní facilitace nebo CNS stimulace a redukci excesivních reflexních podnětů.
Závěr
Míšní šok začíná několik minut po vzniku poranění a bývá plně vyjádřen až po několika hodinách. Může odeznít v průběhu 24 hod, ale může trvat i týdny, vzácně měsíce. I přes prezentovaná patofyziologická vysvětlení podkladu klinicky pozorovaných změn v období míšního šoku a při jeho odeznívání zůstává řada nabízejících se otázek nezodpovězena. Změny provázející odeznívání míšního šoku plynule přecházejí ve změny charakteristické pro přirozený vývoj míšního poranění a není možné mezi nimi stanovit jasnou hranici. Míšní šok bude nepochybně i nadále v popředí zájmu zúčastněných odborníků, neboť je jasné, že reflektuje v pozadí stojící neuroplasticitu po míšním poranění.
V období míšního šoku je těžké stanovit rozsah a závažnost poranění. Zdá se, že větší výpovědní hodnotu stran prognózy má, spíše než přítomnost či nepřítomnost reflexů v době vstupního vyšetření, vývoj reflexů v prvních dnech po poranění. Přetrvávání DPR déle než 48 hod po vzniku poranění je špatný prognostický faktor. Pochopení neuronálních mechanizmů podílejících se na zlepšení motorických funkcí a hyperreflexii je zásadní i pro jejich využití v rehabilitaci.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 3. 7. 2014
Přijato do tisku: 3. 4. 2015
MUDr. Jiří Kříž, Ph.D.
Spinální jednotka při Klinice RHB a TVL
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: jiri.kriz@fnmotol.cz
Zdroje
1. Atkinson PP, Atkinson JL. Spinal shock. Mayo Clin Proc 1996; 71(4): 384 – 389.
2. Štětkářová I. Mechanizmy spasticity a její hodnocení. Cesk Slov Neurol N 2013; 76/ 109(3): 267 – 280.
3. Grigorean VT, Sandu AM, Popescu M, Iacobini MA, Stoian R, Neascu C et al. Cardiac dysfunctions following spinal cord injury. J Med Life 2009; 2(2): 133 – 145.
4. Ditunno JF, Little JW, Tessler A, Burns AS. Spinal shock revisited: a four ‑ phase model. Spinal Cord 2004; 42 : 383 – 395.
5. Nacimiento W, Noth J. What, if Anything, is Spinal Shock. Arch Neurol 1999; 56(8): 1033 – 1035.
6. Guttmann L. The Stoke Mandeville National Spinal Injuries Centre. In: Guttmann L (ed). Spinal Cord Injuries, Comprehensive Management and Research. Oxford, England: Blackwell Scientific Publication 1976.
7. Little JW, Ditunno JF jr, Stiens SA, Harris RM. Incomplete spinal cord injury: neuronal mechanisms of motor recovery and hyperreflexia. Arch Phys Med Rehabil 1999; 80(5): 587 – 599.
8. Smith PM, Jeffery ND. Spinal shock – comparative aspects and clinical relevance. J Vet Intern Med 2005; 19(6): 788 – 793.
9. Leis AA, Kronenberg MF, Štětkářová I, Paske WC, Stokić DS. Spinal motoneuron excitability after acute spinal cord injury in humans. Neurology 1996; 47 : 231 – 237.
10. Boland RA, Lin CS, Engel S, Kiernan MC. Adaptation of motor function after spinal cord injury: novel insights into spinal shock. Brain 2011; 134(2): 495 – 505. doi: 10.1093/ brain/ awq289.
11. Simpson RK jr, Robertson CS, Goodman JC. The role of glycine in spinal shock. J Spinal Cord Med 1996; 19(4): 215 – 224.
12. Hiersemenzel LP1, Curt A, Dietz V. From spinal shock to spasticity: neuronal adaptations to a spinal cord injury. Neurology 2000; 54(8): 1574 – 1582.
13. Ko HY, Ditunno JF jr, Graziani V, Little JW. The pattern of reflex recovery during spinal shock. Spinal Cord 1999; 37(6): 402 – 409.
14. Kříž J, Háková R, Hyšperská V, Hlinková Z, Lukáš R, Andel R. Mezinárodní standardy pro neurologickou klasifikaci míšního poranění – revize 2013. Cesk Slov Neurol N 2014; 77/ 110(1): 77 – 81.
15. Krassioukov AV, Karlsson AK, Wecht JM, Wuermser LA,Mathias CJ, Mathias CJ et al. Assessment of autonomic dysfunction following spinal cord injury: rationale for additions to International Standards for Neurological Assessment. J Rehabil Res 2007; 44(1): 103 – 112.
16. Guly HR, Bouamra O, Lecky FE. The incidence of neurogenic shock in patients with isolated spinal cord injury in the emergency department. Resuscitation 2008; 76(1): 57 – 62.
17. Weinstein DE, Ko HY, Graziani V, Ditunno JF jr. Prognostic significance of the delayed plantar reflex following spinal cord injury. J Spinal Cord Med 1997; 20(2): 207 – 211.
18. Nielsen J, Crone C, Hultborn H. H ‑ reflexes are smaller in dancers from The Royal Danish Ballet than in welltrained athletes. Eur J Appl Physiol Occup Physiol 1993; 66(2): 116 – 121.
19. Kříž J, Rejchrt M. Autonomní dysreflexie – závažná komplikace u pacientů po poranění míchy. Cesk Slov Neurol N 2014; 77/ 110(2): 168 – 173.
20. Silver JR. Early autonomic dysreflexia. Spinal Cord 2000; 38 : 229 – 233.
21. Weaver LC, Fleming JC, Mathias CJ, Krassioukov AV. Disordered cardiovascular control after spinal cord injury. Handb Clin Neurol 2012; 109 : 213 – 233. doi: 10.1016/ B978 ‑ 0 ‑ 444 ‑ 52137 ‑ 8.00013 ‑ 9.
22. Little JW, Halar E. Temporal Course of Motor Recovery after Brown ‑ Sequard Spinal Cord Injuries. Paraplegie 1985; 23(1): 39 – 46.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2015 Číslo 3
-
Všechny články tohoto čísla
- Diagnostika epileptických záchvatů
- Míšní šok – od patofyziologie ke klinickým projevům
- Biomarkery roztroušené sklerózy – současné možnosti a perspektivy
- Vplyv rýchlosti rastu supratentoriálnych grade II gliómov na ich prognózu
- Příčiny vzniku Parkinsonovy nemoci – nové představy a nové výzvy
- Testy verbální fluence, česká normativní studie pro osoby vyššího věku
- Addenbrookský kognitivní test – orientační normy pro českou populaci
- Komise pro funkční odbornost v EEG upozorňuje
- Současný stav léčby anaplastických gliomů v České republice
- Využití škály QUALID k hodnocení kvality života u pacientů v pozdní fázi demence v České republice
- Výsledky chirurgické léčby pacientů s „čistým“ úrazovým epidurálním krvácením
- Neuropsychologický výkon u pacientů s první epizodou schizofrenie
- Kennedyho choroba v materiáli Centra pre neuromuskulárne ochorenia Bratislava
- Absces zadní jámy lební s obstrukčním hydrocefalem u dítěte s dermoidální cystou s dermálním sinusem – kazuistika
- Projekt ncRNAPain
- Výskyt periferního primitivního neuroektodermálního nádoru v průběhu spinálního kořene – kazuistika
- Erratum
- Absces mozku jako první klinická manifestace hereditární hemoragické teleangiektázie – tři kazuistiky
- Ovlivnění výsledku traktografie pyramidové dráhy volbou oblasti zájmu trasování – kazuistika
- Vzduchová embolie mozku – kazuistika
- Životní jubileum profesorky Soni Nevšímalové
- Zvečnená spomienka na profesora Cigánka
- Prof. MUDr. Peter Kukumberg, PhD., 70- ročný
- Webové okénko
- Analýza dat v neurologii
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Addenbrookský kognitivní test – orientační normy pro českou populaci
- Míšní šok – od patofyziologie ke klinickým projevům
- Diagnostika epileptických záchvatů
- Testy verbální fluence, česká normativní studie pro osoby vyššího věku
