Individualizovaný přístup k léčbě roztroušené sklerózy
Individualized Approach to Treating Multiple Sclerosis
This review is concerned with individualized treatment of relapsing-remitting multiple sclerosis. It is important to continuously monitor the clinical course and MRI in order to further predict prognosis and to select the optimal therapy. Pharmacogenetics focus on determining biomarkers so that early non-responders as well as possible adverse effects can be detected. The principles of pharmacovigilance are essential for good clinical practice. Personalized approach to treatment may enable identification of the most suitable treatments that improve health-related quality of life and pharmacoeconomic impact indicators.
Key words:
multiple sclerosis – personalized medicine – pharmacogenetics
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
J. Piťha
Působiště autorů:
MS Centrum, Neurologické oddělení, Krajská zdravotní, a. s. – Nemocnice Teplice o. z.
Vyšlo v časopise:
Cesk Slov Neurol N 2016; 79/112(5): 528-533
Kategorie:
Přehledný referát
Souhrn
Přehledný článek se zabývá individualizovanou léčbou relaps remitující roztroušené sklerózy. Pro predikci další prognózy onemocnění a zvolení optimální léčby je důležitý monitoring pomocí průběžného hodnocení klinického průběhu a magnetické rezonance. Farmakogenetika využívá stanovení biomarkerů, které nejen mohou včas odhalit nonrespondéry, ale mohou též upozornit na možnost nežádoucích účinků. Dodržování zásad farmakovigilance je nezbytnou podmínkou správné léčebné praxe. Personalizovaný přístup k léčbě může stanovit nejvýhodnější léčebné postupy se zlepšením kvality života a s dopadem na farmakoekonomické ukazatele.
Klíčová slova:
roztroušená skleróza – personalizovaná medicína – farmakogenetika
Úvod
Pojem „personalizovaná medicína“ (PM), jejíž komponety jsou stratifikovaná, precizní medicína a medicína 4P – Predictive, Preventive, Personalized, Participatory – byl poprvé použit v roce 1971. W. M. Gibson popisuje své zkušenosti před druhou světovou válkou, kdy sice medicína zdaleka neposkytovala nemocným tak velké možnosti jako dnes, nicméně tento nedostatek vyvažovala tím, co nám dnes připadá čím dál tím důležitější – orientací na jednotlivce. Svůj článek nazval: „Má personalizovaná medicína šanci přežít?“ [1]. Podle České společnosti pro personalizovanou medicínu a lékařské algoritmy [2] je PM multidisciplinární vědní obor, který se, na různých úrovních, zabývá optimalizací léčebných a diagnostických postupů u konkrétního pacienta s využitím moderních informatických metod. Jde o tzv. léčbu šitou na míru, což je správná léčba pro konkrétního pacienta, navíc aplikovaná ve správný čas. Každý člověk je jedinečný z pohledu genetické predispozice, a proto se také tolik liší jeho reakce na daný léčebný postup [3].
Evidence-Based Medicine (EBM) vychází z velkých, obvykle dvojitě zaslepených, studií splňujících i ty nejnáročnější statistické požadavky založených na analýze klinických dat u probandů a následně zpracovaných metaanalýzami. Zdánlivý rozpor mezi EBM a PM vzniká tím, že novější medicínské pokroky umožňují daleko přesněji identifikovat zdravotní stav jedince, a to dokonce s možností predikce jak jeho zdravotních rizik, tak odhadu rozvoje případné choroby a jeho individuální reakci na potřebnou léčbu a její výběr. Tyto poznatky přinesla především genomika, farmakogenomika, proteomika, metabolomika a další, které podrobněji objasňují procesy v organizmu daného jedince. Právě rozvoj těchto technik vedl k rozvoji PM a její širší aplikaci [4]. PM může:
- posunout důraz na prevenci;
- výběrem optimální léčby se vyhnout chybné preskripci omezením nežádoucích účinků, zvýšením lékové adherence a zlepšením kvality života;
- odhalit další využití léčiv s levnějším využitím lékařské péče.
Webové stránky Food and Drugs Administration (FDA) uvádějí více než 100 přípravků, u nichž je upozornění na zvýšené riziko nežádoucích účinků ve spojitosti s genetickými mutacemi enzymů podílejících se na metabolizmu léčiv [5]. V praxi se však uplatňují i další aspekty, které je třeba brát v úvahu při zhodnocení účinnosti a bezpečnosti léčby, např. klinická kritéria a zejména magnetická rezonance (MR). Narůstá počet publikací zabývajících se PM, zejména v onkologii, revmatologii a dalších oborech.
Farmakogenetika a farmakogenomika
Farmakogenetika/farmakogenomika bývá definována jako obor studující dědičné faktory ve vztahu k inter - a intraindividuální variabilitě lékové odpovědi. Jde tedy o specifický podobor spadající do oblasti PM. Farmakogenomika hledá souvislosti mezi variabilitou lékové odpovědi v širším kontextu celého genomu, resp. přepisu informace kódované v genech, zatímco farmakogenetika sleduje jen omezené množství genetických biomarkerů na úrovni DNA. Do praxe však prozatím pronikly jen některé farmakogenetické postupy, kdežto farmakogenomika je v současnosti spíše záležitostí intenzivního klinického výzkumu [6]. Příkladem využití farmakogenetiky je v neurologii vyšetření enzymu thiometyltransferázy před zahájením léčby azathioprinem. Zhruba 10 % pacientů je nositelem jedné nebo více mutací v genu TPMT, které snižují nebo úplně potlačují enzymovou aktivitu. V důsledku akumulace toxických tipurinových metabolitů pak může dojít k život ohrožující myelosupresi. Klinické projevy deficitu TPMT mohou být závažné pro pacienty, kteří jsou homozygoty nebo heterozygoty pro funkčně variantní alely.
Farmakogenetika přináší zatím jen omezené informace s využitím v klinické praxi. Její perspektivy však směřují k vyhledávání jedinců s predikcí farmakologické odpovědi či manifestací závažných nežádoucích účinků.
Současné možnosti využití personalizované medicíny v léčbě roztroušené sklerózy
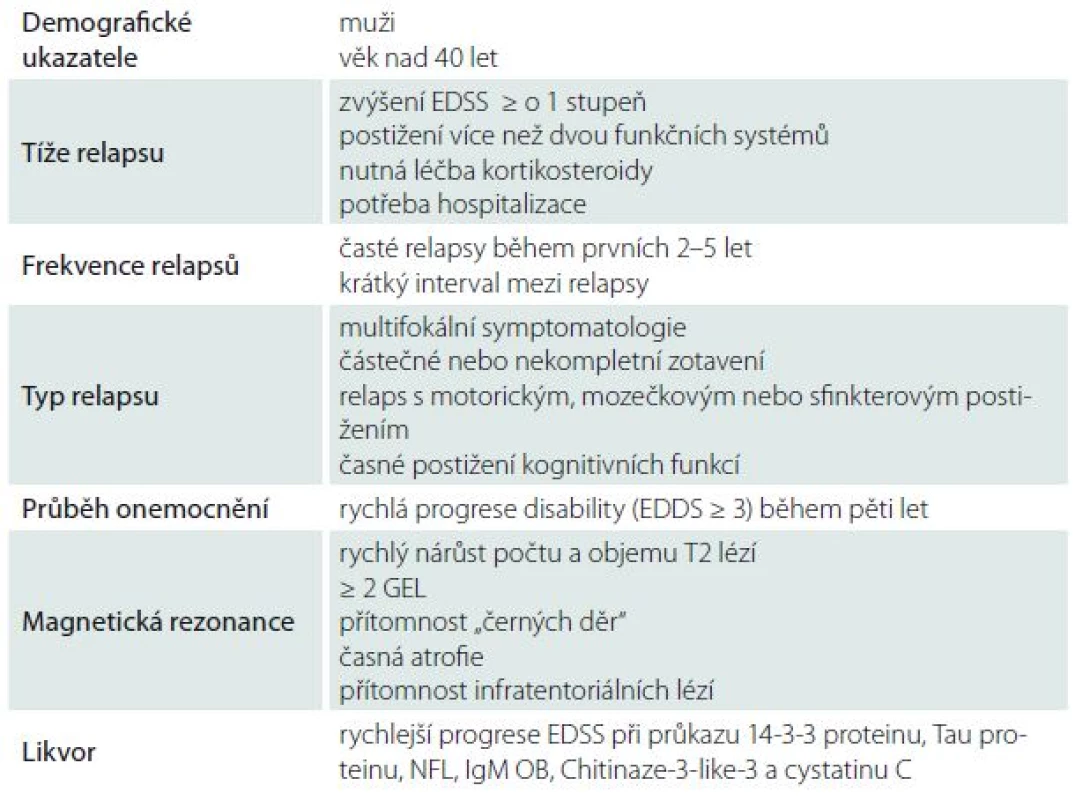
Roztroušená skleróza (RS) je heterogenní zánětlivé onemocnění centrálního nervového systému s nepředvídatelnou prognózou a individuální odpovědí na léčbu. Obrovský rozvoj poznání imunopatogeneze RS přinesl v posledních letech na trh celou řadu nových léků indikovaných u relaps remitující RS (RR RS), které se liší v účinnosti, ale i bezpečnosti. Kromě interferonu-β (IFNβ) a glatirameracetátu (GA) jsou k dispozici perorální léky (teriflunomid, fingolimod, dimetyl fumarát) a monoklonální protilátky (natalizumab a alemtuzumab). Nezpochybnitelným faktem je, že včasné zahájení léčby zásadním způsobem ovlivní prognózu onemocnění. Existuje celá řada klinických studií, které poskytují velké množství dat použitelných v klinické praxi. Tyto studie sledují účinnost a bezpečnost jednotlivých preparátů buď vůči placebu, či jinému léčivu v určité populaci. Jaká je však prognóza konkrétního pacienta? Jakou léčbu zvolit? Jak neztrácet čas léčbou „nonrespondérů“? Jak se vyhnout závažným nežádoucím účinkům? Na řadu z těchto otázek může odpovědět PM, která řeší optimální terapeutické algoritmy, bezpečnost léčby a některé farmakoekonomické aspekty [7].
Farmakovigilance
Z požadavku primum nocere plyne, že léčba musí být nejen efektivní, ale i bezpečná. Při volbě léčebného preparátu je nutné zvážit riziko nežádoucích účinků u konkrétního jedince, např. některé komorbidity (třeba přidružená autoimunitní onemocnění, malignity), toleranci injekčních preparátů apod. Samostatnou kapitolou je strategie léčby při plánovaném těhotenství, riziko poškození plodu při léčbě během gravidity a opětovné nasazení terapie po porodu.
Prognostické markery
Mnohem sofistikovanější je práce, která analyzovala riziko rozvoje klinicky definitivní RS (CD RS) u pacientů s klinicky izolovaným syndromem (Clinically Isolated Syndrome; CIS) [9]. Do studie bylo zahrnuto 1 058 pacientů. Bylo hodnoceno riziko rozvoje CD RS a akumulace disability dle Expanded Disability Status Scale (EDSS) na základě monovariantního (poměr rizika s 95% intervalem spolehlivosti) a multivariantního (upravený poměr rizika s 95% intervalem spolehlivosti) Cox regresního modelu. Mladší věk byl spojen s větším rizikem konverze do CD RS. Pacienti s retrobulbární neuritidou měli nižší riziko přechodu do CD RS (poměr rizika 0,6 (0,5–0,8)) a progresi disability (poměr rizika 0,5 (0,3–0,8)). Přítomnost oligoklonálních pásů v likvoru zvyšovala riziko rozvoje CD RS (upravený poměr rizika 11,3 (6,7–19,3)) a disability (upravený poměr rizika 2,9 (1,4–6,0)). Přítomnost více než 10 lézí na MR zvyšovala riziko CD RS (modifikovaný poměr rizika 11,3 (6,7–19,3)) a disability (modifikovaný poměr rizika 2,9 (1,4–6,0)). Léčba modifikující onemocnění (Drugs Modifying Disease; DMD) před druhou atakou redukovala upravený poměr rizika RS dle McDonaldových kritérií (modifikovaný poměr rizika 0,6 (0,4–0,9)) a akumulaci disability (modifikovaný poměr rizika 0,5 (0,3–0,9)). Největší prognostický význam má počet lézí na MR [10]. V roce 2015 byl prezentován program MAGNIMS (Magnetic Resonance Imaging In MS), který má za cíl sjednotit doporučení pro využití MR v diagnostice, ale zejména monitoraci léčby RS [11].
Narůstající počet prací pokoušejících se o stanovení prognostických markerů přináší řadu metodologických problémů stran validizace sledovaných parametrů, se kterými bude třeba se vypořádat. Názorným příkladem uplatnění PM v praxi je strategie léčby IFNβ a natalizumabem.
Interferon-β
IFNβ je první účinná léčba u RR RS. Zároveň je při této léčbě nejvíce využíváno poznatků PM. Jedná se o imunogenní molekulu, která může během léčby vyvolat tvorbu neutralizačních protilátek (NAbs). Jejich výskyt může predikovat sníženou účinnost IFNβ. Dle doporučení Evropské federace neurologických společností (EFNS) z let 2005 a 2010 je touto metodou vhodné vyšetřovat všechny pacienty léčené IFNβ v průběhu prvních dvou let léčby pravidelně v šestiměsíčních intervalech [12]. Pro testování přetrvávající biologické účinnosti IFNβ při pozitivních NAbs je nutné vyšetřit Myxovirus resistence protein A (MxA), jehož syntéza je indukována výlučně IFNβ. Někteří autoři dokonce doporučují vyšetření MxA před nasazením léčby jako predikující faktor terapeutického efektu [13]. MxA protein byl označen jako nejspolehlivější marker, který nejlépe reflektuje skutečnou biologickou aktivitu IFNβ. Jeho hodnota stoupá za 4 hod po aplikaci IFNβ, po 12 hod začne klesat a za 24 hod od aplikace klesne pod cut-off hodnotu. Nedostatečná produkce MxA v návaznosti na podání IFNβ indikuje snížení jeho biologické aktivity. Při opakovaně vysokých titrech NAbs a/nebo opakovaně nízké hladině MxA je účinnost léčby IFNβ rovna účinnosti placeba [14]. Pokud je prokázána pozitivita NAbs a současně i nízká hodnota MxA, je vhodné, zejména u klinicky a MR stabilizovaného pacienta, doplnit ještě MxA indukční test. Během tohoto vyšetření srovnáváme hodnoty MxA před aplikací IFNβ a za 4 hod po ní. Pokud hodnota za 4 hod po aplikaci dosáhne alespoň trojnásobku hodnoty výchozí, biologická účinnost IFNβ je dostatečná. V opačném případě je doporučeno léčbu IFNβ ukončit [15].
MR se ukázalo jako t.č. nejpřínosnější vyšetření ke stanovení účinnosti IFNβ. Jedna z mnohých studií prokázala, že nonrespondéři se v 2.–6. roce léčby rekrutují z pacientů, kteří mají více než jednu novou T2 lézi na MR a roční počet relapsů (Annualized Relaps Rate; ARR) vyšší než dva (odds ratio ≥ 5,7), nebo z pacientů s více než třemi novými T2 lézemi bez ohledu na počet relapsů [16]. Uher et al prokázali, že větší objem T2 lézí, přítomnost enhancujících lézí, snížení objemu corpus callosum a zvýšení objemu postranních komor během šesti měsíců po první atace RS zvyšují pravděpodobnost další ataky a progresi disability při léčbě intramuskulárním IFNβ-1a [17].
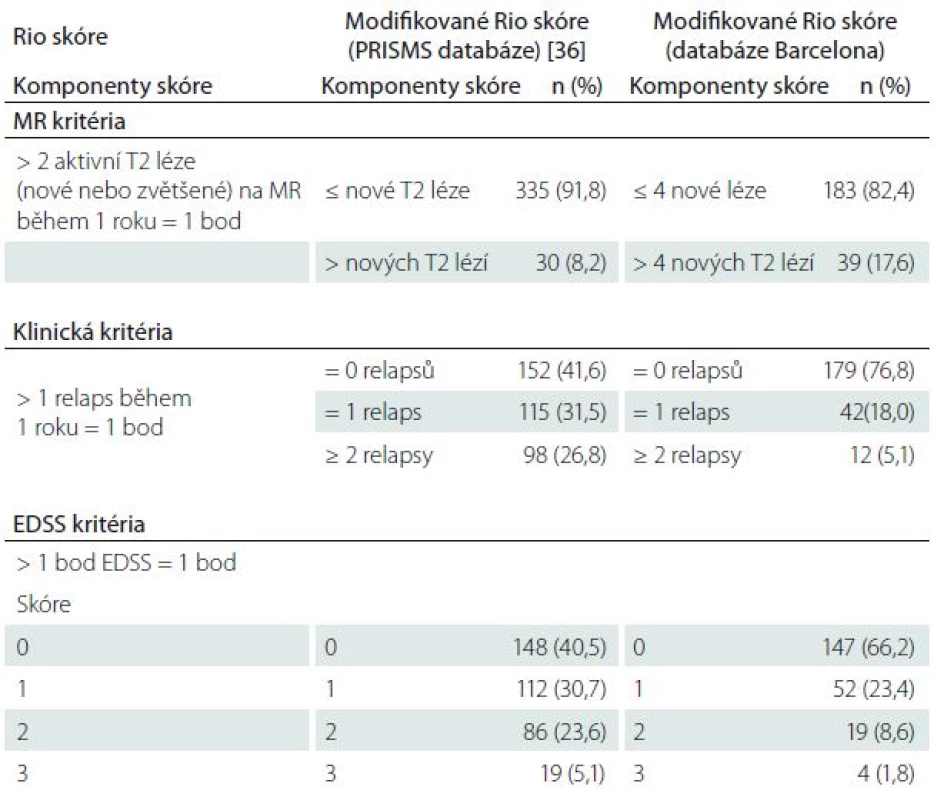
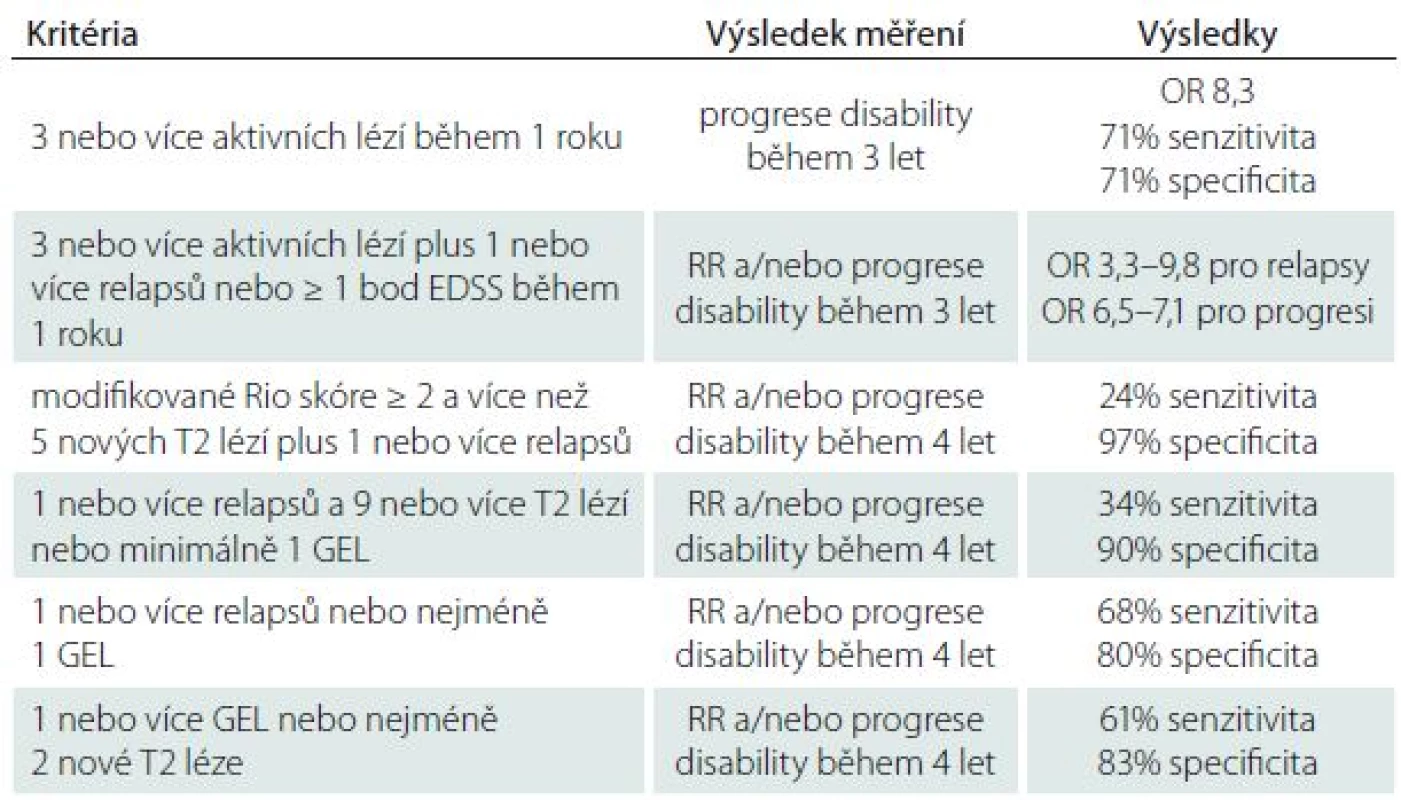
Rio skóre je založeno na vyhodnocení klinických a MR parametrů k posouzení suboptimální léčebné odpovědi po nasazení IFNβ během prvního roku léčby [18]. Modifikované Rio skóre (MRS) je zjednodušená verze, která zohledňuje i EDSS a upřesňuje položky relapsů a MR aktivity s cílem identifikovat pacienty, u kterých bude i nadále přetrvávat aktivita onemocnění a kteří se v následujících letech stávají suboptimálními respondenty (tab. 2) [19]. Ze schéma 1 je patrný monitorovací algoritmus pro vyhodnocení terapeutické odpovědi na IFNβ [20]. V tab. 3 jsou uvedena kritéria pro predikci léčebné odpovědi IFNβ na základě konsenzu skupiny MAGNIMS [11].

Které biologické markery jsou perspektivní pro monitoraci léčby IFNβ? Výchozí hladina IL-17A v séru je užitečným biomarkerem dobré léčebné odpovědi na IFNβ [21]. U tzv. respondérů byla prokázána signifikantně zvýšená exprese NLRP3 inflammazomu a IL-1B oproti nonrespondérům po jednom roce léčby [22]. Exprese microRNA může predikovat individuální aktivitu onemocnění a její progresi během léčby [23]. Ve studii IMPROVE se ukázalo, že vyšetření tripletu CASP2/IRF4/IRF6 vykazuje poměrně výraznou prediktivní přesnost (0,68) a specificitu (0,88), ale nízkou senzitivitu (0,22) pro průkaz léčebné odpovědi [24]. Celogenomový asociační skríning odhalil vysoké zastoupení specifických genů, které modifikují terapeutickou odpověď na IFNβ. Např. glypican 5 byl nedávno replikován v souvislosti s odpovídavostí na IFNβ. RNA transkriptomické studie prokázaly již předem determinovanou sníženou expresi genů indukovaných IFN [25]. Farmakogenomické ukazatele jsou v naprosté většině na úrovni experimentálních dat a nejsou zatím použitelné v klinické praxi.
Léčba IFNβ kromě lokálních a celkových příznaků (flu-like syndrom) nepřináší závažnější komplikace, i když byly hlášeny případy trombotické mikroangiopatie. Ta se projevuje jako trombotická trombocytopenická purpura nebo hemolyticko-uremický syndrom [26].
Natalizumab
Natalizumab je první monoklonální protilátka v indikaci RR RS. Je léčbou 2. volby nebo je využíván při vysoce aktivní formě onemocnění. NAbs se nacházejí u 4,5–14,1 % léčených pacientů a jejich perzistence souvisí s manifestací nežádoucích účinků, zejména alergických reakcí [27]. Perzistence vyšších hladin NAbs je užitečná pro predikci snížené účinnosti léčby [27].
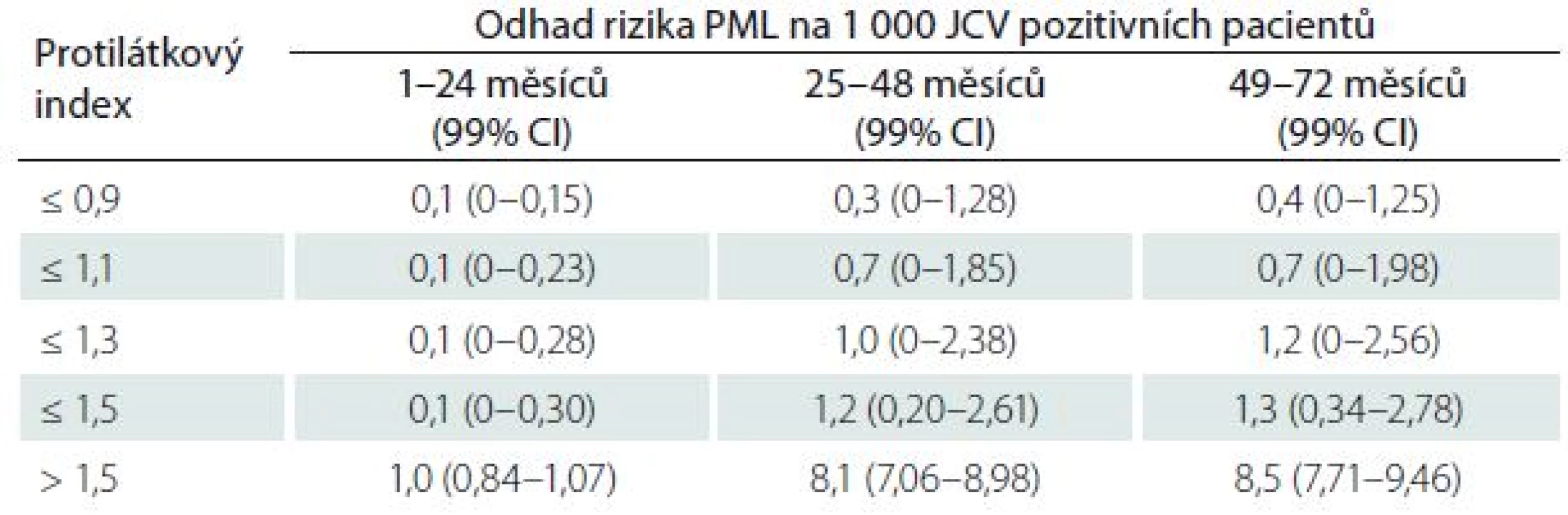
Nejzávažnější komplikací léčby je progresivní multifokální leukoencefalopatie (PML). Riziko PML narůstá s délkou léčby, přítomností protilátek proti JC viru (JCV) a event. předchozí imunosupresivní léčbou. U léčených pacientů může dojít k sérokonverzi původně JCV negativních pacientů. Proto je doporučeno vyšetření protilátek opakovat vždy po půl roce. Riziko PML dle délky léčby a protilátkového indexu je patrné z tab. 4 [28]. U nemocných léčených více než dva roky je bezpodmínečně nutné provádět kontroly MR mozku ve zkráceném observačním protokolu po třech měsících [29]. Mezinárodní expertní skupina jednoznačně stanovila, jakým způsobem stratifikovat riziko PML [30].
Ukázalo se, že snížená hladina L-selectinu exprimovaného CD4 T buňkami může predikovat vyšší riziko PML u séropozitivních pacientů [31]. Hladina L-selektinu (CDD2L) v jiné studii úzce korelovala s JCV sérostatusem stejně jako protilátkový JCV index. Nízká hladina CD62L zvyšovala relativní riziko PML 55násobně (p < 0,0001). Validizace ukázala 86% senzitivitu a 91% specificitu pro CD62L a 100% senzitivitu a 59% specificitu pro JCV index jako prediktory PML [32]. Kombinace vyšetření NAbs a průkazu některých membránových buněčných znaků (např. CD49d, CD11a, and CD62L) může zvýšit predikci rizika PML [33].
Typizace HLA antigenů může být užitečná pro odlišení pacientů s manifestací alergických reakcí. HLA-DRB1*13 a HLA-DRB1*14 alely byly signifikantně zvýšeny u pacientů s rozvojem anafylaktické reakce po aplikaci natalizumabu [34].
Závěr
Individualizovaný způsob léčby klade velké nároky na terapeutické zkušenosti ošetřujícího lékaře, vč. znalostí farmakovigilance, lékových interakcí, ale i perfektní spolupráci s pacientem. Zásadním a osudovým rozhodnutím je volba preparátu v iniciálním stadiu onemocnění. Je třeba zdůraznit, že v odůvodněných případech je nutné nasadit razantnější léčbu jako první volbu. Jedná se o případy, kdy se manifestují více než dvě středně těžké či těžké ataky za rok a současně lze detekovat jednu nebo více gadoliniem zvýrazněné léze na MR mozku nebo významné zvýšení počtu a objemu T2 lézí ve srovnání s předchozí MR před 3–6 měsíci. Může se ovšem stát, že se nepříznivé prediktivní ukazatele objeví již po první klinické epizodě (např. trvající aktivita na MR, nález v likvoru, těžký reziduální nález po prodělaném relapsu a další), což bude důvod pro zahájení co neúčinnější léčby již v této fázi choroby.
Při setrvání na původní terapii je nutné se ujistit, že zvolená léčba je efektivní, bezpečná a splňuje zásady NEDA (No Evidence of Disease Activity) nebo se jim maximálně blíží. I při klinické stabilizaci je nutné monitorovat průběh onemocnění pomocí MR, a to nejlépe s aplikací kontrastní látky.
Pokud je patrná klinická aktivita, aktivita na MR, event. i nárůst progrese onemocnění, je nutné léčbu co nejdříve eskalovat a volit preparát s optimálním poměrem účinnosti a bezpečnosti. Samotná aktivita na MR není pro plátce zdravotní péče důvod k léčebné eskalaci, i když klinické důkazy mluví i v tomto případě ve prospěch změny léčebné strategie [35].
Perspektivy PM jsou v dalším rozvoji farmakogenetických prediktivních ukazatelů a jejich provázání s dalšími markery onemocnění tak, aby byla zvolena optimální léčba pro konkrétního pacienta s cílem zlepšení kvality života, s dopadem i na farmakoekonomické ukazatele.
MUDr. Jiří Piťha, Ph.D.
MS Centrum
Neurologické oddělení
Krajská zdravotní, a.s. – Nemocnice Teplice o.z.
Duchcovská 53
415 29 Teplice
e-mail: pithaj@seznam.cz
Přijato k recenzi: 24. 11. 2015
Přijato do tisku: 21. 3. 2016
Zdroje
1. Gibson, W. Can personalized medicine survive? Can Farm Physician 1971; 17 (8): 29–34.
2. Česká společnost pro personalizovanou medicínu a lékařské algoritmy. [online]. Dostupné z URL: http://www.cspmla.cz.
3. Steele FR. Personalized medicine: something old, something new. Person Med 2009; 6 (1): 1–5.
4. Palička V. Personalizovaná medicína a její (možné) postavení v kardiologii. Interv Akut Kardiol 2012; 11 (1): 6–8.
5. Presicision Medicine. U.S. Food and Drug Administration. [online]. Available from URL: http://www.fda.gov/scienceresearch/specialtopics/personalizedmedicine/default.htm.
6. Annibali V, Ristori G, Cannoni S, et al. Multiple sclerosis: pharmacogenomics and personalised drug treatment. Neurol Sci 2006; 5 (Suppl): S347–9.
7. Derfuss T. Personalized medicine in multiple sclerosis: hope or reality? BMC Med 2012; 10 : 116. doi: 10.1186/1741-7015-10-116.
8. Gajofatto A, Calabrese M, Benedetti MD, et al. Clinical, MRI, and CSF markers of disability progression in multiple sclerosis. Dis Markers 2013; 35 (6): 687–99. doi: 10.1155/2013/484959.
9. Polman CH, Reingold SC, Banwell B, et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann Neurol 2011; 69 (2): 292–302. doi: 10.1002/ana.22366.
10. Tintore M, Rovira À, Río J, et al. Defining high, medium and low impact prognostic factors for developing multiple sclerosis. Brain 2015; 138 (7): 1863–74. doi: 10.1093/brain/awv105.
11. Wattjes MP, Rovira À, Miller D et al. Evidence-based guidelines: MAGNIMS consensus guidelines on the use of MRI in multiple sclerosis-establishing disease prognosis and monitoring patients. Nat Rev Neurol 2015; 11 (10): 597–606. doi: 10.1038/nrneurol.2015.157.
12. Polman CH, Bertolotto A, Deisenhammer F, et al. Recommendations for clinical use of data on neutralising antibodies to interferon-beta therapy in multiple sclerosis. Lancet Neurol 2010; 9 (7): 740–50. doi: 10.1016/S1474-4422 (10) 70103-4.
13. Matas E, Bau L, Martínez-Iniesta M, et al. Baseline MxA mRNA expression predicts interferon beta response in multiple sclerosis patients. PLoS One 2014; 9 (11): 366–72. doi: 10.1371/journal.pone.0112758.
14. Bertolotto A, Sala A, Malucchi S, et al. Biological activity of interferon betas in patients with multiple sclerosis is affected by treatment regimen and neutralising antibodies. J Neurol Neurosurg Psychiatry 2004; 75 (9): 1294–9.
15. Hesse D, Sellebjerg F, Sorensen PS. Absence of MxA induction by interferon beta in patients with MS reflects complete loss of bioactivity. Neurology 2009; 73 (5): 372–7. doi: 10.1212/WNL.0b013e3181b04c98.
16. Horakova D, Kalincik T, Dolezal O, et al. Early predictors of non-response to interferon in multiple sclerosis. Acta Neurol Scand 2012; 126 (6): 390–7. doi: 10.1111/j.1600-0404.2012.01662.x.
17. Uher T, Horakova D, Kalincik T, et al. Early magnetic resonance imaging predictors of clinical progression after 48 months in clinically isolated syndrome patients treated with intramuscular interferon β-1a. Eur J Neurol 2015; 22 (7): 1113–23. doi: 10.1111/ene.12716.
18. Rio J, Castillo J, Rovira A, et al. Measures in the first year of therapy predict the response to interferon beta in MS. Mult Scler 2009; 15 (7): 848–53. doi: 10.1177/1352458509104591.
19. Sormani MP, Rio J, Tintore M, et al. Scoring treatment response in patients with relapsing multiple sclerosis. Mult Scler 2013; 19 : 605–12. doi: 10.1177/1352458512460605.
20. Sormani M, Signori A, Stromillo M, et al. Refining response to treatment as defined by the Modified Rio Score. Mult Scler 2013; 19 (9): 1246–7. doi: 10.1177/13524585134 83892.
21. Dimisianos N, Rodi M, Kalavrizioti D, et al. Cytokines as Biomarkers of Treatment Response to IFN β in Relapsing-Remitting Multiple Sclerosis. Mult Scler Int 2014; 14 (6): 436764. doi: 10.1155/2014/436764.
22. Malhotra S, Río J, Urcelay E, et al. NLRP3 inflammasome is associated with the response to IFN-β in patients with multiple sclerosis. Brain 2015; 138 (3): 644–52. doi: 10.1093/brain/awu388.
23. Hecker M, Thamilarasan M, Koczan D, et al. MicroRNA expression changes during interferon-beta treatment in the peripheral blood of multiple sclerosis patients. Int J Mol Sci 2013; 14 (8): 16087–110. doi: 10.3390/ijms140816087.
24. Baranzini SE, Madireddy LR, Cromer A, et al. Prognostic biomarkers of IFNb therapy in multiple sclerosis patients. Mult Scler 2015; 21 (7): 894–904. doi: 10.1177/1352458514555786.
25. Vandenbroeck K, Urcelay E, Comabella M. IFN-beta pharmacogenomics in multiple sclerosis. Pharmacogenomics 2010; 11 (8): 1137–48. doi: 10.2217/pgs.10.108.
26. Hunt D, Kavanagh D, Drummond I, et al Thrombotic microangiopathy associated with interferon beta. N Engl J Med 2014; 370 (13): 1270–1. doi: 10.1056/NEJMc1316118.
27. Vennegoor A, Rispens T, Strijbis EM, et al. Clinical relevance of serum natalizumab concentration and anti-natalizumab antibodies in multiple sclerosis. Mult Scler 2013; 19 (5): 593–600. doi: 10.1177/1352458512460604.
28. Plavina T, Subramanyam M, Bloomgren G, et al. Anti-JC virus antibody levels in serum or plasma further define risk of natalizumab-associated progressive multifocal leukoencephalopathy. Ann Neurol 2014; 76 (6): 802–12. doi: 10.1002/ana.24286.
29. Wattjes MP, Wijburg MT, Vennegoor A, et al. Diag - nostic performance of brain MRI in pharmacovigilance of natalizumab-treated MS patients. Mult Scler 2016; 22 (9): 1174–83. doi: 10.1177/1352458515615225.
30. McGuigan C, Craner M, Guadagno J, et al. Stratification and monitoring of natalizumab-associated progressive multifocal leukoencephalopathy risk: recommendations from an expert group. J Neurol Neurosurg Psychiatry 2016; 87 (2): 117–25. doi: 10.1136/jnnp-2015-311100.
31. Schwab N, Schneider-Hohendorf T, Posevitz V, et al. L-selectin is a possible biomarker for individual PML risk in natalizumab-treated MS patients. Neurology 2013; 81 (10): 865–71. doi: 10.1212/WNL.0b013e3182a 351fb.
32. Schwab N, Schneider-Hohendorf T, Pignolet B, et al. PML risk stratification using anti-JCV antibody index and L-selectin. Mult Scler 2016; 22 (8): 1048–60. doi: 10.1177/1352458515607651.
33. Antoniol C, Stankoff B. Immunological Markers for PML Prediction in MS Patients Treated with Natalizumab. Front Immunol 2015; 5 : 668. doi: 10.3389/fimmu.2014.00668.
34. de la Hera B, Urcelay E, Brassat D et al. Natalizu - mab-related anaphylactoid reactions in MS patients are associated with HLA class II alleles. Neurol Neuroimmunol Neuroinflamm 2014; 1 (4): 87–94. doi: 10.1212/NXI. 0000000000000047.
35. Traboulsee A, Simon JH, Stone L, et al. Revised Recommendations of the Consortium of MS Centers Task Force for a Standardized MRI Protocol and Clinical Guidelines for the Diagnosis and Follow-Up of Multiple Sclerosis. AJNR Am J Neuroradiol 2016; 37 (3): 394–401. doi: 10.3174/ajnr.A4539.
36. Study Group. Randomized double-blind placebo-controlled study of interferon beta-1a in relapsing/remitting multiple sclerosis. PRISMS (Prevention of Relapses and Disability by Interferon beta-1a Subcutaneously in Multiple Sclerosis). Lancet 1998; 352 (9139): 1498–504.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2016 Číslo 5
-
Všechny články tohoto čísla
- Rasmussenova encefalitída
- Jsou nemotorické projevy Parkinsonovy nemoci indikací k léčbě pomocí hluboké mozkové stimulace subthalamických jader?
- Jsou nemotorické projevy Parkinsonovy nemoci indikací k léčbě pomocí hluboké mozkové stimulace subthalamických jader?
-
Komentář ke kontroverzím
Hluboká mozková stimulace u Parkinsonovy nemoci – revize indikačních kritérií? - Léky navozená spánková endoskopie – cesta k lepším chirurgickým výsledkům při léčbě syndromu obstrukční spánkové apnoe
- Současná kortikoterapie u nádorů mozku
- Individualizovaný přístup k léčbě roztroušené sklerózy
- Aktuální pohled na management nízkostupňových gliových nádorů centrálního nervového systému
- Detekce pravolevých zkratů u mladých pacientů po ischemické cévní mozkové příhodě – pilotní studie
- Myxovirus resistance protein A v terapii interferony-β u pacientů s roztroušenou sklerózou a algoritmus sledování účinnosti léčby
- Myasténia gravis asociovaná s tymómom – súbor pacientov v Slovenskej republike (1978–2015)
- Bezpečnost karotického stentingu – srovnání protekčních systémů
-
Komentář k článku Pavlík et al
Bezpečnost karotického stentingu – srovnání protekčních systémů - Průkaz boreliové DNA u pacientů s neuroboreliózou
- Vztah likvorových hladin IL-6 ke změnám parciálního tlaku kyslíku v mozku a k rozvoji vazospazmů u pacientů po subarachnoidálním krvácení z ruptury aneuryzmatu mozkové tepny
- Stereotaktické biopsie mozkových patologií systémem Varioguide – zkušenosti ze 101 výkonů
- Myasthenia Gravis Composite – validace české verze
- Pilotní studie využití tenzometrické plošiny v domácí terapii poruch rovnováhy
- Neurofyziologická vyšetření u traumatických lézí brachiálního plexu
-
Komentář k článku Vaško et al
Neurofyziologická vyšetření u traumatických lézí brachiálního plexu - Paroxyzmálna kinezigénna dystónia ako primomanifestácia roztrúsenej sklerózy – kazuistika
- Idiopatická hypertrofická kraniální pachymeningitida – dvě kazuistiky
- Metodika stanovení smrti mozku pomocí transkraniální sonografie vypracovaná Neurosonologickou komisí a Cerebrovaskulární sekcí České neurologické společnosti ČLS JEP
- Webové okénko
-
Analýza dat v neurologii
LIX. Koncept atributivního rizika v analýze populačních studií – VI. Kauzalita vztahů
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Současná kortikoterapie u nádorů mozku
- Rasmussenova encefalitída
- Neurofyziologická vyšetření u traumatických lézí brachiálního plexu
- Průkaz boreliové DNA u pacientů s neuroboreliózou
