Transkraniální magnetická stimulace ve výzkumu kortikální inhibice u depresivní poruchy a schizofrenie, efekt antipsychotik
Transcranial Magnetic Stimulation in the Research of Cortical Inhibition in Depressive Disorder and Schizophrenia, the Effect of Antipsychotics
Transcranial magnetic stimulation enables exploration of cortical inhibition in various neuropsychiatric disorders, including depressive disorder and schizophrenia. Cortical inhibition can be defined as a neurophysiological mechanism (not pathological) through which GABAergic interneurons influence the activity of other neurons. The most frequently studied cortical inhibition parameters include cortical silent period, short-interval cortical inhibition, long-interval cortical inhibition, amplitude of motor-evoked potential, resting motor threshold, and intracortical facilitation. Published cross-sectional studies suggest impairment of cortical inhibition in both above mentioned mental disorders. Some inconsistent results in these cross-sectional studies can be explained by their design and by heterogeneous samples of patients. It might be difficult to differentiate the effect of the disorder and the effect of the treatment. This problem can be resolved with recent prospective longitudinal studies aimed at the effect of selected antipsychotics on cortical inhibition in schizophrenia. They confirmed impairment of cortical inhibition and they identified the potential antipsychotics have to change this impairment. Some researchers believe that this potential is a newly discovered mechanism of action. Some researchers also suppose that the new data on pathophysiology and treatment of (not only) depressive disorder and schizophrenia discovered using the transcranial magnetic stimulation help (partially) to rebuild psychiatry on new grounds, sometimes called Circuit-based Psychiatry.
Key words:
cortical inhibition – transcranial magnetic stimulation – depressive disorder – schizophrenia – antipsychotics
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
L. Ustohal
Působiště autorů:
CEITEC – Středoevropský technologický institut, MU, Brno
; Psychiatrická klinika LF MU a FN Brno
Vyšlo v časopise:
Cesk Slov Neurol N 2017; 80/113(2): 157-162
Kategorie:
Přehledný referát
doi:
https://doi.org/10.14735/amcsnn2017157
Tato práce byla finančně podpořena projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 65269705 (FN Brno).
Souhrn
Transkraniální magnetická stimulace umožňuje zkoumat kortikální inhibici u různých neuropsychiatrických poruch, vč. depresivní poruchy a schizofrenie. Kortikální inhibici lze definovat jako neurofyziologický mechanizmus (nikoli patologický), jímž GABAergní interneurony ovlivňují činnost ostatních neuronů. Nejčastěji zkoumanými paradigmaty kortikální inhibice jsou kortikální tichá perioda, kortikální inhibice s krátkým intervalem, kortikální inhibice s dlouhým intervalem, amplituda motorického evokovaného potenciálu, klidový motorický práh a intrakortikální facilitace. Průřezové studie ukazují, že u obou výše zmíněných poruch je kortikální inhibice narušena. Jistou inkonzistenci těchto průřezových studií lze vysvětlit jejich designem a také příliš heterogenními soubory, takže je někdy obtížné rozlišit vlastní efekt nemoci a její léčby. K tomu slouží recentní prospektivní longitudinální studie zaměřené na vliv antipsychotik na kortikální inhibici u pacientů se schizofrenií. Ty konzistentně ukazují nejen na její narušení u tohoto onemocnění, ale i na schopnost antipsychotik kortikální inhibici měnit, což je některými považováno za nově zjištěný mechanizmus účinku těchto léků. Dle některých názorů poznatky získané pomocí transkraniální magnetické stimulace o patofyziologii (nejen) depresivní poruchy a schizofrenie a mechanizmech účinku používané léčby pomohou postavit psychiatrii (alespoň částečně) na nových základech, kterou pak někteří navrhují nazývat psychiatrií založenou na (neuronálních) okruzích.
Klíčová slova:
kortikální inhibice – transkraniální magnetická stimulace – depresivní porucha – schizofrenie – antipsychotika
Úvod
Transkraniální magnetická stimulace (TMS) je neinvazivní neuromodulační technika, která využívá proměnného magnetického pole aplikovaného skrze měkké tkáně hlavy a lebku k vyvolání elektrických proudů v mozku. Jedná se o bezpečnou a v neurovědách častou metodu, která má vedle použití v preklinickém výzkumu i široké uplatnění v klinice – a to jak v diagnostice, tak i v terapii. V diagnostice se používá ve spojení s elektromyografií (EMG) k hodnocení patologických stavů motorického systému a nově ve spojení s neuronavigací též k mapování kortexu před neurochirurgickými výkony [1]. V terapii se osvědčila zejména v léčbě depresivní poruchy [2,3].
TMS od svého představení v roce 1985 umožňuje zkoumat fenomény jako kortikální excitabilita, inhibiční a excitační mechanizmy, rychlost neuronálního vedení, konektivita a neuroplasticita. Tím zvláště ve spojení se zobrazovacími metodami, jako je elektroencefalografie, magnetická rezonance a pozitronová emisní tomografie, umožňuje studovat afektivní, behaviorální a kognitivní neuronální okruhy, čímž (alespoň částečně) pomáhá budovat psychiatrii na nových základech, kterou proto Camprodon a Pascual-Leone nazývají psychiatrií založenou na (neuronálních) okruzích (Circuit-based Psychiatry) [1].
Kortikální inhibice a způsoby jejího měření
Kyselina gama-aminomáselná (GABA) je hlavní inhibiční neurotransmiter v mozku, který je spolu s glutamátem zásadně důležitý pro modulaci kortikální excitability a neuroplasticity [4 – 6]. Samotnou kortikální inhibici (Cortical Inhibition; CI) lze definovat jako neurofyziologický mechanizmus (nikoli patologický), kterým GABAergní interneurony ovlivňují činnost ostatních neuronů, resp. kterým regulují působení kortexu na ostatní části mozku a nervové soustavy [6 – 8].
K měření CI a jejího narušení se používá právě TMS, a to konkrétně jednopulzová (single-pulse) nebo párová (paired-pulse) stimulace (repetitivní TMS; rTMS – slouží zejména k výše uvedeným terapeutickým účelům, především tedy k léčbě depresivní poruchy). Existuje řada paradigmat využívaných k měření CI, která lze dělit na inhibiční nebo excitační či dle použité stimulace na paradigmata měřená jednopulzovou TMS nebo párovou TMS [6,9].
Mezi inhibiční paradigmata měřená jednopulzovou stimulací patří kortikální tichá perioda (Cortical Silent Period; CSP), k inhibičním paradigmatům měřeným párovou stimulací náleží kortikální inhibice s krátkým intervalem (Short-Interval Cortical Inhibition; SICI) a s dlouhým intervalem (Long-Interval Cortical Inhibition; LICI) [6,9].
K excitačním paradigmatům měřeným jednopulzovou stimulací patří amplituda motorického evokovaného potenciálu (MEP) a klidový motorický práh (Resting Motor Threshold; RMT), k excitačním paradigmatům zjišťovaným párovou stimulací pak intrakortikální facilitace (Intracortical Facilitation; ICF) [6,9].
Měření CSP je prováděno aplikací nadprahového TMS pulzu nad oblastí motorického kortexu za současné volní svalové aktivity, kterou měřený subjekt vykonává. To způsobuje potlačení tonické svalové aktivity. Délka tohoto potlačení svalové aktivity, měřená od začátku MEP do návratu bazální EMG aktivity, je mírou CI. Řádově trvá asi do 300 ms. Předpokládá se, že CSP je vyjádřením inhibiční aktivity mediované GABAB receptory [6,8 – 16].
Měření SICI je prováděno aplikací podprahového podmiňovacího (conditioning) TMS pulzu předcházejícího o několik milisekund (1 – 5 ms) nadprahový testovací pulz. Poté je měřena amplituda vyvolaného MEP, která by měla být redukována o 50 – 90 %. Předpokládá se, že SICI měří inhibiční aktivitu mediovanou GABAA receptory [6,8 – 17].
Měření LICI je obdobné jako v případě SICI, pouze místo podprahového podmiňovacího pulzu se používá nadprahový, následovaný rovněž nadprahovým testovacím stimulem v delším časovém intervalu (např. 100 ms), což způsobuje snížení amplitudy MEP. Podobně jako v případě CSP se předpokládá, že LICI je vyjádřením inhibiční aktivity mediované GABAB receptory [6,18 – 21].
MEP je definován jako celková reakce periferního svalu vyvolaná pomocí TMS pulzu nad oblastí kontralaterálního motorického kortexu měřená pomocí EMG [9,22]. RMT je definován jako minimální intenzita TMS, která je potřebná k indukci MEP o amplitudě vyšší než 50 μV v pěti z 10 pokusů. RMT reflektuje aktivitu neuronálních membrán a excitabilitu kortikokortikálních axonů, synapsí a sodíkových kanálů, zatímco NMDA-asociovaná neurotransmise a GABAergní mechanizmy se zdají být méně zapojeny [6,9,23,24].
Měření ICF je prováděno podobně jako v případě SICI čili podprahový podmiňovací pulz je následován nadprahovým testovacím pulzem, ovšem v delším časovém intervalu 10 – 15 ms, popřípadě ještě delším. To na rozdíl od SICI rezultuje ve zvýšení excitability projevující se vyšší amplitudou MEP. Předpokládá se, že ICF je způsobena především glutamátergní neurotransmisí [6,9,24,25].
Kortikální inhibice u depresivní poruchy a schizofrenie
Kortikální inhibice a její narušení je v poslední době intenzivně studováno (nejen) u depresivní poruchy a schizofrenie. Předpokládá se totiž, že hraje významnou roli v patofyziologii těchto onemocnění, a tak by nám lepší znalosti o ní mohly pomoci k přesnější diagnostice a také účinnější terapii těchto poruch.
Kortikální inhibice u depresivní poruchy
Radhuová et al zjistili ve své metaanalýze z roku 2013, že v případě depresivní poruchy je signifikantně zkrácena CSP (na základě analýzy čtyř studií zahrnujících celkem 131 pacientů ve srovnání se 149 zdravými kontrolami) (tab. 1) [6,26 – 29]. Signifikantně snížena je dle jejich zjištění u této skupiny pacientů i SICI (na základě analýzy tří studií zahrnujících celkem 115 depresivních pacientů ve srovnání se 130 zdravými kontrolami) [6,26 – 28]. Naproti tomu Radhuová et al zjistili, že u pacientů s depresivní poruchou není signifikantně změněna amplituda MEP (na základě analýzy tří studií zahrnujících celkem 34 nemocných a 37 zdravých kontrol) [6,30 – 32]. Rovněž ani RMT není dle jejich metaanalýzy signifikantně odlišný (na základě analýzy osmi studií zahrnujících celkem 176 depresivních pacientů ve srovnání se 188 zdravými kontrolami) [6,26 – 28,30,31,33 – 35]. Stejně jako v případě amplitudy MEP a RMT nebyla v jejich metaanalýze zjištěna signifikantní změna ani u ICF (na základě analýzy tří studií zahrnujících celkem 115 pacientů s depresivní poruchou ve srovnání se 130 zdravými kontrolami) [6,26 – 28].
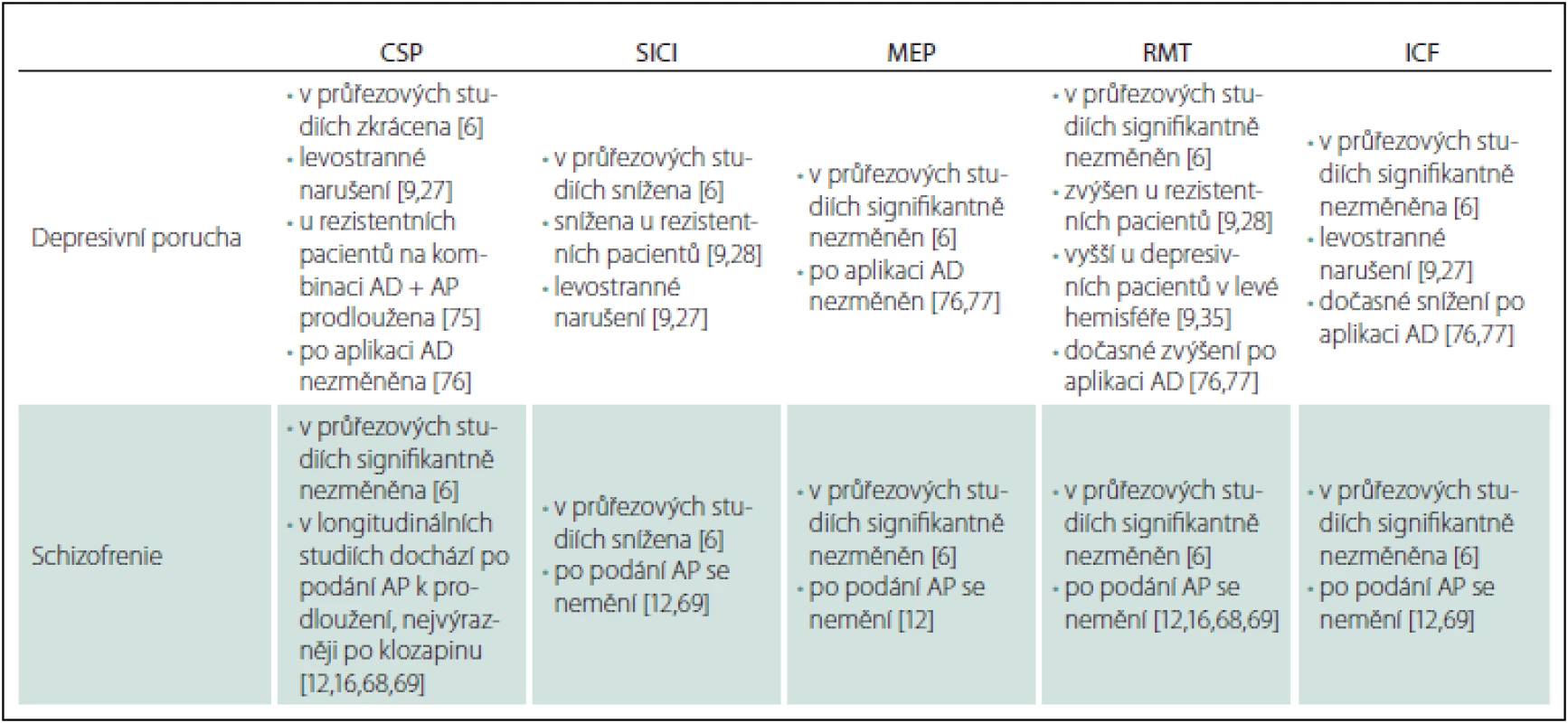
Z obdobných studií vycházel i přehled Bunseho et al z roku 2014. Bunse se spolupracovníky upozorňují na určitou inkonzistenci studií danou heterogenitou zkoumaných souborů, kdy první studie s medikovanými depresivními pacienty ukázala prodlouženou CSP [9,29]. Naproti tomu pozdější studie ukázala u nemedikovaných pacientů s depresivní poruchou zkrácenou CSP i SICI jako důkaz kortikální dezinhibice [9,26]. Studie Levinsona et al z roku 2010 zařazená do metaanalýzy Radhuové i Bunseho přehledu srovnávala zdravé kontroly, euthymní (bezpříznakové) medikované pacienty s prodělanou depresivní epizodou/ epizodami, nemedikované pacienty s depresivní poruchou a na léčbu rezistentní pacienty s depresivní poruchou. Všechny tyto podskupiny pacientů měly ve srovnání se zdravými kontrolami zkrácenou CSP. Pouze na léčbu rezistentní pacienti měli ve srovnání se zdravými kontrolami sníženou SICI a zvýšený RMT. Navíc rezistentní pacienti měli zvýšený RMT i ve srovnání s ostatními podskupinami pacientů, což dle autorů ukazuje na sníženou excitabilitu frontálního kortexu [9,28]. Ve studii Maedy et al byl zjištěn rozdíl v RMT mezi mozkovými hemisférami u pacientů s depresivní poruchou (vyšší RMT byl zjištěn pro levou hemisféru), pomocí párové stimulace byla shledána nižší excitabilita levé hemisféry (u zdravých kontrol rozdíly mezi hemisférami nebyly) [9,35]. Rozdíl mezi hemisférami u pacientů s depresivní poruchou byl zjištěn i ve studii Lefaucheura et al, kteří zaznamenali narušení inhibičních (CSP, SICI) i excitačních (RMT, ICF) procesů v levé hemisféře ve srovnání s pravou hemisférou i ve srovnání se zdravými kontrolami [9,27]. Kromě toho vyšlo najevo, že změny CI mohou následovat u depresivních pacientů i po aplikaci neinvazivních neuromodulačních technik. Aplikace elektrokonvulzivní terapie spojená s rTMS o frekvenci 3 Hz nebo rTMS o frekvenci 10 Hz cílená na levý prefrontální kortex vedla u pacientů s depresivní poruchou ke klinickému zlepšení a také k posílení excitability v levém motorickém kortexu, což indikovalo zvýšení poměru MEP k M vlně, snížený motorický práh, zkrácená CSP a redukovaná SICI [9,36,37].
Kortikální inhibice u schizofrenie
U schizofrenie Radhuová et al nezjistili ve zmiňované metaanalýze (na rozdíl od depresivní poruchy) signifikantní rozdíl mezi CSP u pacientů a zdravých kontrol (na základě analýzy 11 studií zahrnujících celkem 334 nemocných a 457 zdravých kontrol) (tab. 1) [6,8,10,38 – 46]. Naopak SICI byla dle jejich zjištění snížená (podobně jako v případě depresivní poruchy; zjištěno na základě analýzy 12 studií zahrnujících 335 pacientů ve srovnání se 440 zdravými kontrolami) [6,8,10,39 – 43,46 – 50]. Amplituda MEP u pacientů se schizofrenií nebyla dle metaanalýzy Radhuové et al signifikantně odlišná od zdravých kontrol (opět podobně jako u depresivní poruchy; zjištěno na základě analýzy čtyř studií zahrnujících 91 pacientů a 93 zdravých kontrol) [6,30,31,45,51]. Totéž co pro MEP platilo i pro RMT – ani ten nebyl obdobně jako v případě depresivní poruchy signifikantně odlišný u pacientů se schizofrenií a zdravých kontrol (na základě analýzy 21 studií zahrnujících celkem 500 pacientů a 617 zdravých kontrol [6,8,10,30,31,33,38 – 42,44 – 50,52 – 55]. Konečně ani u ICF nebyl zjištěn v metaanalýze Radhuové et al signifikantní rozdíl mezi pacienty se schizofrenií a zdravými kontrolami (na základě analýzy 11 studií s 323 pacienty a 428 zdravými kontrolami) [6,8,10,39 – 43,46,47,49,50].
Také v případě schizofrenie upozorňují Bunse et al na určitou inkonzistenci ve výsledcích jednotlivých studií, které jsou v případě tohoto onemocnění ještě výraznější než u depresivní poruchy. Vcelku jednoznačným výsledkem je signifikantní snížení SICI, které potvrzuje teorii o narušené GABAergní transmisi u schizofrenie, kdy v neuropatologických studiích je nalézáno narušení GABAergních interneuronů; v postmortem studiích bylo zjištěno narušení dekarboxylázy kyseliny glutamové 67 (GAD67) čili enzymu syntetizujícího GABA a také snížení počtu GABAergních interneuronů v různých částech kortexu vč. motorického [9,56–63]. V případě rozdílných výsledků při měření CSP upozorňují Bunse et al na značnou heterogennost studovaných souborů, co se týče fáze nemoci (pacienti s prvními epizodami vs. pacienti chronicky nemocní) a také co se týče léčby (pacienti tzv. drug-naive čili dosud nikdy neužívající psychofarmaka, nemedikovaní pacienti a pacienti medikovaní různými antipsychotiky) [9]. To do značné míry platí i pro největší průřezovou studii Strubeho et al, která už v metaanalýze Radhuové et al ani v přehledu Bunseho et al být nemohla a která měří různé parametry CI u pacientů s krátkým trváním schizofrenie (do 2 let, nikoli tedy vyloženě u pacientů s prvními epizodami), chronickým průběhem schizofrenie a zdravých dobrovolníků. Autoři zjistili rozdíl v délce CSP, která byla prodloužena u pacientů s krátkým trváním onemocnění ve srovnání se zdravými kontrolami i nemocnými s chronickým průběhem schizofrenie. Pokud byli srovnáni všichni pacienti se zdravými kontrolami, bylo u nich zjištěno snížení SICI, a naopak prodloužení CSP [64].
Podobně jako v případě depresivní poruchy mohou i u schizofrenie vyvolat změny CI nejen psychofarmaka, ale i neinvazivní neuromodulační techniky, jako je elektrokonvulzivní terapie, soudě podle pilotní studie Přikryla et al z roku 2011 [65].
Efekt antipsychotik na kortikální inhibici
Již bylo konstatováno, že jisté inkonzistence ve výsledcích studií zkoumajících CI a její narušení u depresivní poruchy, a ještě výrazněji u schizofrenie, mohou způsobovat různé fáze onemocnění a mnohem více medikace psychofarmaky, mezi nimiž zaujímají zásadní místo antipsychotika (AP). Jedná se zejména o ta novější, označovaná jako atypická nebo také AP II. generace. Nepoužívají se jen v léčbě schizofrenie, ale čím dál častěji i u afektivních poruch, jako jsou bipolární afektivní porucha a depresivní porucha, a dokonce i u poruch tradičně řazených mezi neurotické, např. obsedantně-kompulzivní porucha nebo úzkostné poruchy; zapomenout nelze ani na jejich používání u organických duševních poruch, kde jsou předepisována nejen psychiatry. Toto široké užívání bylo jedním ze zásadních důvodů, proč v posledních letech čelní představitelé neuropsychofarmakologických společností přišli s novou nomenklaturou psychofarmak opouštějící tradiční rozdělení těchto léčiv dle indikací, tedy na antipsychotika, antidepresiva, anxiolytika, hypnotika atd. Nová nomenklatura je prezentována pod označením nomenklatura založená na neurovědách (Neuroscience-based Nomenclature; NbN; více o ní viz [66]; v češtině pak viz [67]).
Nejvíce prací zkoumajících efekt AP na CI bylo zaměřeno na výzkum CSP u schizofrenie, což bylo dáno nejspíše tím, že první průřezové studie ukazovaly nejméně konzistentní výsledky. V jedné z těchto průřezových studií zahrnujících 78 pacientů a 38 zdravých kontrol však Liu et al zjistili, že nemedikovaní pacienti měli nejkratší CSP. Naopak pacienti užívající klozapin (atypické AP považované za nejúčinnější, vyhrazené pro rezistentní případy jako AP třetí volby) měli CSP nejdelší – ve srovnání s pacienty užívajícími jiná AP i zdravými kontrolami. Kromě toho byla také zjištěna negativní korelace mezi délkou CSP a tzv. negativními příznaky schizofrenie (k nimž patří emoční oploštělost, ochuzení řeči a myšlení, sociální stažení, anhedonie a další) [8].
Určitou nevýhodou všech výše zmíněných studií zahrnutých do metaanalýzy Radhuové et al i přehledu Bunseho et al a také studie Strubeho et al z roku 2014 bylo, že se jednalo o studie průřezové, takže nebyly ideální k určení podílu vlastní nemoci a též její léčby na změnách CI. K tomu mohou lépe posloužit prospektivní longitudinální studie, do nichž budou zařazeni pacienti s první epizodou schizofrenie, kteří dosud neužívali psychofarmaka a kterým budou parametry CI změřeny před zahájením vybrané farmakologické léčby. V takto designované pilotní práci z roku 2009 zjistili Přikryl et al, že byl-li léčen pacient s první epizodou schizofrenie dosud neužívající psychofarmaka paliperidonem, atypickým AP z podskupiny antagonistů serotoninových a dopaminových receptorů (SDA), došlo k významnému prodloužení CSP doprovázenému také zlepšením jeho klinického stavu; RMT se významně nezměnil [68].
První rozsáhlejší studie byla publikována o 5 let později Frankem et al, kteří do ní zařadili celkem 24 psychofarmaky dosud neléčených pacientů s první epizodou psychotické poruchy (byla předpokládána schizofrenie). Před zahájením antipsychotické léčby a po 3 týdnech jejího podávání změřili parametry CI. K léčbě vybrali atypické AP quetiapin náležející mezi tzv. multireceptorové antagonisty (MARTA). Zjistili, že po léčbě quetiapinem došlo k signifikantnímu prodloužení CSP, ostatní parametry CI zůstaly nezměněny. V důsledku léčby došlo i k signifikantnímu zmírnění závažnosti psychotických příznaků, avšak jejich změna nekorelovala se změnou CSP. Autoři práci uzavírají s tím, že je třeba dalších studií s dalšími AP, aby se potvrdilo, že změna CI je vlastní i působení dalších AP [69].
Druhá studie s velmi podobným designem, avšak jiným AP, byla publikována recentně Ustohalem et al [16]. Autoři do ní zařadili celkem 13 drug-naive pacientů s první epizodou schizofrenie, u kterých před léčbou a po 4 týdnech antipsychotické terapie změřili parametry CI (po 4 týdnech byly získány výsledky od 12 z nich), konkrétně CSP a RMT. K léčbě zvolili atypické AP risperidon náležející do podskupiny SDA. Podobně jako Frank zjistili, že po léčbě došlo k signifikantnímu prodloužení CSP, kdežto RMT se nezměnila. V důsledku podávání risperidonu došlo rovněž k signifikantnímu snížení závažnosti psychopatologie, korelace mezi změnou CSP a psychopatologie však také nebyla nalezena [16].
Třetí podobnou longitudinální studii publikovali Kaster et al v roce 2015. Nezkoumali v ní psychofarmaky dosud neléčené pacienty s první epizodou schizofrenie, ale pacienty se schizofrenií, kteří měli být převáděni z nějakého důvodu (především pro neúčinnost dosavadní léčby) na klozapin. Zařazeno bylo celkem 16 pacientů, z nichž všichni až na jednoho užívali nějaké psychofarmakum (14 z nich AP, zbývající pacient z psychofarmak užíval jen tymostabilizéry valproát a lithium). Před zahájením převodu na klozapin jim byly změřeny parametry CI a pak po 6 týdnech jeho užívání (výsledky byly získány od 11 pacientů) a opět ještě po 6 měsících jeho užívání (výsledky byly získány od šesti pacientů). Po 6 týdnech léčby klozapinem bylo zjištěno signifikantní prodloužení délky CSP. V rozmezí 6 týdnů a 6 měsíců léčby klozapinem se už délka CSP nezměnila. Autoři studii uzavřeli s tím, že jejich prospektivní longitudinální studie ukázala souvislost mezi léčbou klozapinem a GABAB mediovanou inhibiční neurotransmisí. Navrhují dokonce, že potenciace této GABAB mediované neurotransmise může být nově zjištěným neurotransmiterovým mechanizmem, který je součástí patofyziologie a také léčby schizofrenie AP [12].
A dosavadní výzkumy jim alespoň prozatím dávají za pravdu. Navíc by se takto případně dala vysvětlit i superiorita účinnosti klozapinu oproti jiným AP, kterou zatím jednoznačně vysvětlit nedokážeme – v léčbě účinná AP (minimálně quetiapin a risperidon) prodlužují délku CSP, a tudíž ovlivňují GABAB mediovanou inhibiční neurotransmisi, avšak klozapin takto působí výrazněji než ostatní. Přesný farmakologický mechanizmus, jakým AP působí změny CI, však prozatím není znám. Možné vysvětlení lze hledat v genetických, a zvláště epigenetických studiích, to však musí být ještě předmětem dalšího výzkumu [70 – 74].
Podobné prospektivní longitudinální studie, které by zkoumaly efekt AP u pacientů s depresivní poruchou, nejsou k dispozici. Na vliv AP u depresivní poruchy je možné tedy usuzovat jen nepřímo. Například ve studii z roku 2013 srovnávající pacienty s rezistentní depresivní poruchou, vaskulární depresí a zdravými kontrolami bylo zjištěno, že pacienti s rezistentní depresivní poruchou měli oproti dvěma zbývajícím skupinám prolongovanou CSP, což je v kontrastu s nálezy jiných studií u depresivních nemocných, kteří měli oproti zdravým kontrolám CSP zkrácenou (viz výše). Všichni tito pacienti ale užívali dvojkombinaci antidepresiv (AD) a AP (quetiapin nebo olanzapin). Pacienti s vaskulární depresí byli bez medikace psychofarmaky a zdravé kontroly samozřejmě také [75]. Studie rovněž ukazují, že i AD mohou ovlivnit CI, avšak patrně jiným způsobem než AP. Například po intravenózním podání klomipraminu bylo zjištěno dočasné zvýšení motorického prahu a intrakortikální inhibice a snížení ICF, kdežto amplituda MEP a CSP se nezměnily [76]. Stejného výsledku bylo dosaženo i v další studii s klomipraminem a citalopramem pro obě tato AD [77].
Závěr
Studium CI a jejího narušení pomocí TMS prováděné u depresivní poruchy a schizofrenie přináší nové poznatky k patofyziologii těchto závažných duševních onemocnění a také lépe umožňuje pochopit jejich ovlivnění psychofarmaky. Tím pomáhá poskytnout základy moderního pojetí psychiatrie jako aplikované neurovědní disciplíny, již zmíněné psychiatrie založené na (neuronálních) okruzích a rovněž potřebné poznatky pro novou nomenklaturu psychofarmak známou jako nomenklatura založená na neurovědách. Do budoucna lze při studiu CI a dalších neuronálních fenoménů očekávat větší zapojení zobrazovacích metod, jak už ukazují pilotní práce Suna et al v případě depresivní poruchy a Radhuové et al v případě schizofrenie, v nichž se zaměřili na specifické narušení funkce prefrontálního kortexu u zmíněných duševních poruch [14,78]. Měření CI může mít i praktické důsledky pro diagnostiku, jak ukazuje recentní práce popisující různé narušení CI u pacientů s atypickou, melancholickou a nediferencovanou depresivní poruchou. V této studii měli všichni depresivní pacienti zkrácenou CSP oproti zdravým kontrolám; pacienti s atypickou depresí ale měli ve srovnání s ostatními depresivními nemocnými zkrácenou i SICI a prodlouženou ICF [79]. Navíc měření CI by mohlo být využitelné i jako nástroj predikce response na léčbu, jak ukazuje studie, v níž bylo zjištěno, že nonrespondéři na terapii fluoxetinem měli před léčbou výraznější deficit LICI než budoucí respondéři [80]. Podobně dokázalo měření CI pomocí TMS odhalit pacienty s rezistentní depresivní poruchou, u nichž dojde k remisi suicidálních ideací po magnetické konvulzivní terapii [78].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Bc. Libor Ustohal, Ph.D.
Psychiatrická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: Ustohal.Libor@fnbrno.cz
Přijato k recenzi: 20. 9. 2016
Přijato do tisku: 1. 11. 2016
Zdroje
1. Camprodon JA, Pascual-Leone A. Multimodal applications of transcranial magnetic stimulation for circuit-based psychiatry. JAMA Psychiatry 2016;73(4):407 – 8.
2. Lefaucheur J-P, André-Obadia N, Antal A, et al. Evidence-based guidelines on the therapeutic use of repetitive transcranial magnetic stimulation (rTMS). Clin Neurophysiol 2014;125(11):2150 – 206.
3. Ustohal L, Přikrylová Kučerová H, Přikryl R, et al. Repetitivní transkraniální magnetická stimulace v léčbě depresivní poruchy – randomizovaná, jednoduše slepá, antidepresivy kontrolovaná studie. Cesk Slov Neurol N 2014;77/ 110(5):602 – 7.
4. DeFelipe J, Conley M, Jones EG. Long-range focal collateralization of axons arising from corticocortical cells in monkey sensory-motor cortex. J Neurosci 1986;6(12):3749 – 66.
5. Schieber MH, Hibbard LS. How somatotopic is the motor cortex hand area? Science 1993;261(5120):489 – 92.
6. Radhu N, de Jesus DR, Ravindran LN, et al. A meta-analysis of cortical inhibition and excitability using transcranial magnetic stimulation in psychiatric disorders. Clin Neurophysiol 2013;124(7):1309 – 20.
7. Daskalakis ZJ, Fitzgerald PB, Christensen BK. The role of cortical inhibition in the pathophysiology and treatment of schizophrenia. Brain Res Rev 2007;56(2):427 – 42.
8. Liu SK, Fitzgerald PB, Daigle M, et al. The relationship between cortical inhibition, antipsychotic treatment, and the symptoms of schizophrenia. Biol Psychiatry 2009;65(6):503 – 9.
9. Bunse T, Wobrock T, Strube W, et al. Motor cortex excitability assessed by transcranial magnetic stimulation in psychiatric disorders: a systematic review. Brain Stimul 2014;7(2):158 – 69. doi: 10.1016/ j.brs.2013.08.009.
10. Daskalakis ZJ, Christensen BK, Fitzgerald PB, et al. Increased cortical inhibition in persons with schizophrenia treated with clozapine. J Psychopharmacol 2008;22(2):203 – 9. doi: 10.1177/ 0269881107084002.
11. Fuhr P, Agostino R, Hallett M. Spinal motor neuron excitability during the silent period after cortical stimulation. Electroencephalograf Clin Neurophysiol 1991;81(4):257 – 62.
12. Kaster TS, de Jesus D, Radhu N, et al. Clozapine potentiation of GABA mediated cortical inhibition in treatment resistant schizophrenia. Schizophr Res 2015;165(2 – 3):157 – 62. doi: 10.1016/ j.schres.2015.04.015.
13. Kujirai T, Caramia MD, Rothwell JC, et al. Corticocortical inhibition in human motor cortex. J Physiol 1993;471 : 501 – 19.
14. Radhu N, Garcia Dominguez L, Farzan F, et al. Evidence for inhibitory deficits in the prefrontal cortex in schizophrenia. Brain 2015;138(2):483 – 97. doi: 10.1093/ brain/ awu 360.
15. Rogasch NC, Daskalakis ZJ, Fitzgerald PB. Cortical inhibition, excitation, and connectivity in schizophrenia: a review of insights from transcranial magnetic stimulation. Schizophr Bull 2014;40(3):685 – 96.
16. Ustohal L, Mayerova M, Hublova V, et al. Risperidone increases the cortical silent period in drug-naive patients with first-episode schizophrenia: a transcranial magnetic stimulation study. J Psychopharmacol 2016 Aug 15 pii: 0269881116662650. [Epub ahead of print].
17. Cantello R, Gianelli M, Civardi C, et al. Magnetic brain stimulation: the silent period after the motor evoked potential. Neurology 1992;42(10):1951 – 9.
18. McCormick DA. GABA as an inhibitory neurotransmitter in human cerebral cortex. J Neurophysiol 1989;62(5):1018 – 27.
19. Siebner HR, Dressnandt J, Auer C, et al. Continuous intrathecal baclofen infusions induced a marked increase of the transcranially evoked silent period in a patient with generalized dystonia. Muscle Nerve 1998;21(9):1209 – 12.
20. Valls-Sole J, Pascual-Leone A, Wassermann EM, et al. Human motor evoked responses to paired transcranial magnetic stimuli. Electroencephalogr Clin Neurophysiol 1992;85(6):355 – 64.
21. Werhahn KJ, Kunesch E, Noachtar S, et al. Differential effects on motorcortical inhibition induced by blockade of GABA uptake in humans. J Physiol 1999;517(2):591 – 7.
22. Rothwell JC, Hallett M, Berardelli A, et al. Magnetic stimulation: motor evoked potentials. The International Federation of Clinical Neurophysiology. Electroencephalogr Clin Neurophysiol Suppl 1999;52 : 97 – 103.
23. Rossini PM, Barker AT, Berardelli A, et al. Non-invasive electrical and magnetic stimulation of the brain, spinal cord and roots: basic principles and procedures for routine clinical application. Report of an IFCN committee. Electroencephalogr Clin Neurophysiol 1994;91(2):79 – 92.
24. Ziemann U. TMS and drugs. Clin Neurophysiol 2004;115(8):1717 – 29.
25. Nakamura H, Kitagawa H, Kawaguchi Y, et al. Intracortical facilitation and inhibition after transcranial magnetic stimulation in conscious humans. J Physiol 1997;498(3):817 – 23.
26. Bajbouj M, Lisanby SH, Lang UE, et al. Evidence for impaired cortical inhibition in patients with unipolar major depression. Biol Psychiatry 2006;59(5):395 – 400.
27. Lefaucheur JP, Lucas B, Andraud F, et al. Inter-hemispheric asymmetry of motor corticospinal excitability in major depression studied by transcranial magnetic stimulation. J Psychiatr Res 2008;42(5):389 – 98.
28. Levinson AJ, Fitzgerald PB, Favalli G, et al. Evidence of cortical inhibitory deficits in major depressive disorder. Biol Psychiatry 2010;67(5):458 – 64. doi: 10.1016/ j.biopsych.2009.09.025.
29. Steele JD, Glabus MF, Shajahan PM, et al. Increased cortical inhibition in depression: a prolonged silent period with transcranial magnetic stimulation (TMS). Psychol Med 2000;30(3):565 – 70.
30. Chroni E, Lekka NP, Tsoussis I, et al. Effect of exercise on motor evoked potentials elicited by transcranial magnetic stimulation in psychiatric patients. J Clin Neurophysiol 2002;19(3):240 – 4.
31. Reid PD, Daniels B, Rybak M, et al. Cortical excitability of psychiatric disorders: reduced post-exercise facilitation in depression compared to schizophrenia and controls. Aust N Z J Psychiatry 2002;36(5):669 – 73.
32. Shajahan PM, Glabus MF, Gooding PA, et al. Reduced cortical excitability in depression. Impaired post-exercise motor facilitation with transcranial magnetic stimulation. Br J Psychiatry 1999;174 : 449 – 54.
33. Abarbanel JM, Lemberg T, Yaroslavski U, et al. Electrophysiological response to transcranial magnetic stimulation in depression and schizophrenia. Biol Psychiatry 1996;40(2):148 – 50.
34. Grunhaus L, Polak D, Amiaz R, et al. Motor-evoked potential amplitudes elicited by transcranial magnetic stimulation do not differentiate between patients and normal controls. Int J Neuropsychopharmacol 2003;6(4):371 – 8.
35. Maeda F, Keenan JP, Pascual-Leone A. Interhemispheric asymmetry of motor cortical excitability in major depression as measured by transcranial magnetic stimulation. Br J Psychiatry 2000;177 : 169 – 73.
36. Chistyakov AV, Kaplan B, Rubichek O, et al. Effect of electroconvulsive therapy on cortical excitability in patients with major depression: a transcranial magnetic stimulation study. Clin Neurophysiol 2005;116(2):386 – 92.
37. Chistyakov AV, Kaplan B, Rubichek O, et al. Antidepressant effects of different schedules of repetitive transcranial magnetic stimulation vs. clomipramine in patients with major depression: a relationship to changes in cortical excitability. Int J Neuropsychopharmacol 2005;8(2):223 – 33.
38. Bajbouj M, Gallinat J, Niehaus L, et al. Abnormalities of inhibitory neuronal mechanisms in the motor cortex of patients with schizophrenia. Pharmacopsychiatry 2004;37(2):74 – 80.
39. Daskalakis ZJ, Christensen BK, Chen R, et al. Evidence for impaired cortical inhibition in schizophrenia using transcranial magnetic stimulation. Arch Gen Psychiatry 2002;59(4):347 – 54.
40. Fitzgerald PB, Brown TL, Daskalakis ZJ, et al. A transcranial magnetic stimulation study of inhibitory deficits in the motor cortex in patients with schizophrenia. Psychiatry Res 2002;114(1):11 – 22.
41. Fitzgerald PB, Brown TL, Daskalakis ZJ, et al. A transcranial magnetic stimulation study of the effects of olanzapine and risperidone on motor cortical excitability in patients with schizophrenia. Psychopharmacology (Berl) 2002;162(1):74 – 81.
42. Fitzgerald PB, Brown TL, Marston NA, et al. Reduced plastic brain responses in schizophrenia: a transcranial magnetic stimulation study. Schizophr Res 2004;71(1):17 – 26.
43. Hasan A, Wobrock T, Grefkes C, et al. Deficient inhibitory cortical networks in antipsychotic-naive subjects at risk of developing first-episode psychosis and first-episode schizophrenia patients: a cross-sectional study. Biol Psychiatry 2012;72(9):744 – 51. doi: 10.1016/ j.biopsych.2012.03.005.
44. Herbsman T, Forster L, Molnar C, et al. Motor threshold in transcranial magnetic stimulation: the impact of white matter fiber orientation and skull-to-cortex distance. Hum Brain Mapp 2009;30(7):2044 – 55. doi: 10.1002/ hbm.20649.
45. Soubasi E, Chroni E, Gourzis P, et al. Cortical motor neurophysiology of patients with schizophrenia: a study using transcranial magnetic stimulation. Psychiatry Res 2010;176(2 – 3):132 – 6. doi: 10.1016/ j.psychres.2009.04.003.
46. Wobrock T, Schneider-Axmann T, Retz W, et al. Motor circuit abnormalities in first-episode schizophrenia assessed with transcranial magnetic stimulation. Pharmacopsychiatry 2009;42(5):194 – 201. doi: 10.1055/ s-0029-1224137.
47. Eichhammer P, Wiegand R, Kharraz A, et al. Cortical excitability in neuroleptic-naive first-episode schizophrenic patients. Schizophr Res 2004;67(2 – 3):253 – 9.
48. Oxley T, Fitzgerald PB, Brown TL, et al. Repetitive transcranial magnetic stimulation reveals abnormal plastic response to premotor cortex stimulation in schizophrenia. Biol Psychiatry 2004;56(9):628 – 33.
49. Wobrock T, Schneider M, Kadovic D, et al. Reduced cortical inhibition in first-episode schizophrenia. Schizophr Res 2008;105(1 – 3):252 – 61. doi: 10.1016/ j.schres.2008.06.001.
50. Pascual-Leone A, Manoach DS, Birnbaum R, et al. Motor cortical excitability in schizophrenia. Biol Psychiatry 2002;52(1):24 – 31.
51. Enticott PG, Hoy KE, Herring SE, et al. Reduced motor facilitation during action observation in schizophrenia: a mirror neuron deficit? Schizophr Res 2008;102(1 – 3):116 – 21. doi: 10.1016/ j.schres.2008.04.001.
52. Boroojerdi B, Topper R, Foltys H, et al. Transcallosal inhibition and motor conduction studies in patients with schizophrenia using transcranial magnetic stimulation. Br J Psychiatry 1999;175 : 375 – 9.
53. Fitzgerald PB, Brown TL, Daskalakis ZJ, et al. A study of transcallosal inhibition in schizophrenia using transcranial magnetic stimulation. Schizophr Res 2002;56(3):199 – 209.
54. Fitzgerald PB, Brown TL, Marston NA, et al. A transcranial magnetic stimulation study of abnormal cortical inhibition in schizophrenia. Psychiatry Res 2003;118(3):197 – 207.
55. Hoy KE, Georgiou-Karistianis N, Laycock R, et al. Using transcranial magnetic stimulation to investigate the cortical origins of motor overflow: a study in schizophrenia and healthy controls. Psychol Med 2007;37(4):583 – 94.
56. Lewis DA, Hashimoto T, Volk DW. Cortical inhibitory neurons and schizophrenia. Nat Rev Neurosci 2005;6(4):312 – 24.
57. Hashimoto T, Bazmi HH, Mirnics K, et al. Conserved regional patterns of GABA-related transcript expression in the neocortex of subjects with schizophrenia. Am J Psychiatry 2008;165(4):479 – 89.
58. Benes FM, Lim B, Matzilevich D, et al. Regulation of the GABA cell phenotype in hippocampus of schizophrenics and bipolars. Proc Natl Acad Sci U S A 2007; 104(24):10164 – 9.
59. Benes FM. Model generation and testing to probe neural circuitry in the cingulate cortex of postmortem schizophrenic brain. Schizophr Bull 1998;24(2):219 – 30.
60. Benes FM. Regulation of cell cycle and DNA repair in post-mitotic GABA neurons in psychotic disorders. Neuropharmacology 2011;60(7 – 8):1232 – 42. doi: 10.1016/ j.neuropharm.2010.12.011.
61. Benes FM, McSparren J, Bird ED, et al. Deficits in small interneurons in prefrontal and cingulate cortices of schizophrenic and schizoaffective patients. Arch Gen Psychiatry 1991;48(11):996 – 1001.
62. Cohen SM, Tsien RW, Goff DC, et al. The impact of NMDA receptor hypofunction on GABAergic neurons in the pathophysiology of schizophrenia. Schizophr Res 2015;167(1 – 3):98 – 107. doi: 10.1016/ j.schres.2014.12.026.
63. Taylor SF, Tso IF. GABA abnormalities in schizophrenia: a methodological review of in vivo studies. Schizophr Res 2015;167(1 – 3):84 – 90. doi: 10.1016/ j.schres.2014.10.011.
64. Strube W, Wobrock T, Bunse T, et al. Impairments in motor-cortical inhibitory network across recent-onset and chronic schizophrenia: a cross-sectional TMS study. Behav Brain Res 2014;264 : 17 – 25. doi: 10.1016/ j.bbr.2014.01.041.
65. Přikryl R, Ustohal L, Kucerová HP, et al. Effect of electroconvulsive therapy on cortical excitability in a patient with long-term remission of schizophrenia: a transcranial magnetic stimulation study. J ECT 2011;27(1):e9 – 11. doi: 10.1097/ YCT.0b013e3181dbf785.
66. Zohar J, Stahl S, Moller HJ, et al. A review of the current nomenclature for psychotropic agents and an introduction to the Neuroscience-based Nomenclature. Eur Neuropsychopharmacol 2015;25(12):2318 – 25. doi: 10.1016/ j.euroneuro.2015.08.019.
67. Ustohal L. Nová nomenklatura psychofarmak. Psychiatr Praxi 2016;17(3):98 – 102.
68. Prikryl R, Ustohal L, Kucerova HP, et al. Paliperidon mediated modification of cortical inhibition. Neuroendocrinol Lett 2009;30(3):396 – 9.
69. Frank E, Landgrebe M, Poeppl TB, et al. Antipsychotic treatment with quetiapine increases the cortical silent period. Schizophr Res 2014;156(1):128 – 32. doi: 10.1016/ j.schres.2014.03.028.
70. Cha DS, Kudlow PA, Baskaran A, et al. Implications of epigenetic modulation for novel treatment approaches in patients with schizophrenia. Neuropharmacology 2014;77 : 481 – 6. doi: 10.1016/ j.neuropharm.2013.08.038.
71. Hasan A, Mitchell A, Schneider A, et al. Epigenetic dysregulation in schizophrenia: molecular and clinical aspects of histone deacetylase inhibitors. Eur Arch Psychiat Clin Neurosci 2013;263(4):273 – 84. doi: 10.1007/ s00406-013-0395-2.
72. Ota VK, Noto C, Gadelha A, et al. Evaluation of neurotransmitter receptor gene expression identifies GABA receptor changes: a follow-up study in antipsychotic-naive patients with first-episode psychosis. J Psychiatr Res 2014;56 : 130 – 6. doi: 10.1016/ j.jpsychires.2014.05.012.
73. Ota VK, Noto C, Gadelha A, et al. Changes in gene expression and methylation in the blood of patients with first-episode psychosis. Schizophr Res 2014;159(2 – 3): 358 – 64. doi: 10.1016/ j.schres.2014.09.008.
74. Hosák L, Kovařík A, Ustohal L, et al. Duševní poruchy – epigenetické mechanizmy jejich vzniku a farmakologické léčby. Psychiatr Praxi 2015;16(2):45 – 8.
75. Concerto C, Lanza G, Cantone M, et al. Different patterns of cortical excitability in major depression and vascular depression: a transcranial magnetic stimulation study. BMC Psychiatry 2013;13 : 300. doi: 10.1186/ 1471-244X-13-300.
76. Manganotti P, Bortolomasi M, Zanette G, et al. Intravenous clomipramine decreases excitability of human cortex. A study with paired magnetic stimulation. J Neurol Sci 2001;184(1):27 – 32.
77. Minelli A, Bortolomasi M, Scassellati C, et al. Effects of intravenous antidepressant drugs on the excitability of human motor cortex: a study with paired magnetic stimulation on depressed patients. Brain Stimul 2010;3(1):15 – 21. doi: 10.1016/ j.brs.2009.04.003.
78. Sun Y, Farzan F, Mulsant BH, et al. Indicators for remission of suicidal ideation following magnetic seizure therapy in patients with treatment-resistant depression. JAMA Psychiatry 2016;73(4):337 – 45. doi: 10.1001/ jamapsychiatry.2015.3097.
79. Veronezi BP, Moffa AH, Carvalho AF, et al. Evidence for increased motor cortical facilitation and decreased inhibition in atypical depression. Acta Psychiatr Scand 2016;134(2):172 – 8. doi: 10.1111/ acps.12565.
80. Croarkin PE, Nakonezny PA, Husain MM, et al. Evidence for pretreatment LICI deficits among depressed children and adolescents with nonresponse to fluoxetine. Brain Stimul 2014;7(2):243 – 51. doi: 10.1016/ j.brs.2013.11.006.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2017 Číslo 2
-
Všechny články tohoto čísla
- Loketní nerv
- Antitrombotická terapia u pacientov so spontánnou krčnou disekciou
- Disekce karotid neantikoagulujeme
-
Komentář ke kontroverzím
Kontroverze volby antikoagulační léčby u disekce karotid? - Nastupující tonus u předčasně narozených dětí jako projev vývoje nervové soustavy a možnosti jeho hodnocení
- Možnosti aktivování plastických a adaptačních procesů v centrálním nervovém systému pomocí fyzioterapie u nemocných s roztroušenou sklerózou mozkomíšní
- Transkraniální magnetická stimulace ve výzkumu kortikální inhibice u depresivní poruchy a schizofrenie, efekt antipsychotik
- Toxické účinky pesticidů
- Role specifické buněčné imunity v patogenezi roztroušené sklerózy se zaměřením na Th17 a Treg lymfocyty
- Dopis redakci
- Incidence cévní mozkové příhody v Evropě – systematická review
- Okulárna myasténia gravis v Slovenskej republike
- Emoční uvědomění u adolescentů – pilotní studie ověřující základní psychometrické vlastnosti české verze Škály úrovně emočního uvědomění pro děti LEAS-C
- Přesnost uložení elektrod pro hlubokou mozkovou stimulaci pomocí bezrámového systému NexFrame©
- Fingolimod v reálné klinické praxi
- „Awake“ resekce gliomu v poloze pacienta v polosedě – kazuistika
- Anti-NMDAR encefalitida v dětském věku – kazuistika
- Febrilní křeče – doporučený postup pro vyšetření dítěte s nekomplikovanými febrilními křečemi, adaptovaný doporučený postup American Academy of Pediatrics
- Doporučení pro diagnostiku a léčbu symptomů dolních močových cest u pacientů s roztroušenou sklerózou v České republice – mezioborový konsenzus expertů dle metodiky DELPHI
- Komentář k článku Krhut et al
-
Analýza dat v neurologii
LXII. Pozor na interpretaci ekologických (korelačních) studií – I. - K 80. narozeninám prof. MU Dr. Eduarda Zvěřiny, DrSc., FCMA, (plk. v. v.)
- Recenze knihy
- Dopis redakci k problematice meningitid
- 7. mezinárodní neurochirurgický zimní kongres (INWC) společně s kongresem Centrální Evropské neurochirurgické společnosti (CENS) v Innsbrucku-Seefeldu 11.– 14. 1. 2017
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Loketní nerv
- Incidence cévní mozkové příhody v Evropě – systematická review
- Anti-NMDAR encefalitida v dětském věku – kazuistika
- Febrilní křeče – doporučený postup pro vyšetření dítěte s nekomplikovanými febrilními křečemi, adaptovaný doporučený postup American Academy of Pediatrics
