Normotenzní hydrocefalus
Normal pressure hydrocephalus
The mini-monograph presents a comprehensive view on normal pressure hydrocephalus (NPH). NPH is a clinical diagnosis developed due to altered behavior of CSF within the intracranial space. The clinical manifestation of NPH includes the typical Adams-Hakim triad – gait disorder, cognitive deficit, urinary incontinence – with about half of the patients not having the complete triad. MRI shows ventriculomegaly, often with disproportion in the size of subarachnoid spaces (dilated Sylvian fissures, high convexity tightness) without an obstruction in CSF flow. From the point of therapy, mild cortical atrophy or the occurrence of chronic ischemic changes is to some extent accepted. The basic attribute of NPH is the presence of normal CSF pressure during lumbar puncture, but with the help of special invasive tests the alteration of CSF behavior within the intracranial space can be measured with a significant estimated accuracy (lumbar infusion test, intracranial pressure monitoring). Selection of surgical candidates is in most cases performed on the basis of predictive CSF diversion tests (tap test, extended lumbar drainage). The pathophysiology of the most common idiopathic form of NPH is only partially explained despite more than 50 years from the first findings. Idiopathic form of NPH typically arises at an advanced age, and thus it is an important differential diagnosis of neurodegenerative diseases. The importance of the diagnosis increases with the fact that the natural course of the disease could be to a large extent modified by surgical treatment in the form of implantation of a CSF shunt system a ventriculo-peritoneal shunt (in most cases).
Keywords:
dementia – normal pressure hydrocephalus – Hakim- -Adams triad – DESH – neurodegenerative disease
Autoři:
P. Skalický 1,2
; A. Mládek- 1 3; O. Bradáč 1,2
Působiště autorů:
Neurochirurgická klinika dětí a dospělých 2. LF UK a FN Motol, Praha
1; Neurochirurgická a neuroonkologická klinika 1. LF UK a ÚVN – VFN, Praha
2; ČVUT, Praha
3
Vyšlo v časopise:
Cesk Slov Neurol N 2021; 84(6): 512-533
Kategorie:
Minimonografie
doi:
https://doi.org/10.48095/cccsnn2021512
Souhrn
Minimonografie se zabývá komplexním pohledem na normotenzní hydrocefalus (normal pressure hydrocephalus; NPH). NPH je klinickou jednotkou vznikající na podkladě alterace chování mozkomíšního moku uvnitř intrakraniálního prostoru. Klinická manifestace NPH zahrnuje typickou Adams-Hakimovu trias (porucha chůze, kognitivní deficit, močová inkontinence), přičemž zhruba polovina pacientů nemá tuto trias kompletní. Na MR je zobrazena ventrikulomegalie často s disproporcí velikosti subarachnoidálních prostor (zvětšené incisurae Sylvii, úzké prostory mezi sulky na konvexitách) bez známek obstrukce toku mozkomíšního moku. Z pohledu terapie jsou do jisté míry akceptovány i lehká kortikální atrofie či výskyt chronických ischemických změn. Základní součástí NPH je přítomnost normální velikosti tlaku mozkomíšního moku při lumbální punkci. S pomocí speciálních invazivních testů však lze alteraci chování moku uvnitř intrakraniálního prostoru s významnou přesností odhadovat (lumbální infuzní test, monitorování intrakraniálního tlaku). Výběr chirurgických kandidátů je ve většině případů prováděn na základě prediktivních testů (tap test, prodloužená lumbální drenáž). Patofyziologie nejčastější idiopatické formy NPH není po více než 50 letech od prvních poznatků dostatečně objasněna. Idiopatická forma NPH vzniká nejčastěji v pokročilém věku, a je tak významnou diferenciální diagnózou neurodegenerativních onemocnění. Tato diagnóza nabývá na důležitosti faktem, že je do značné míry ovlivnitelná chirurgickou léčbou v podobě implantace zkratu, který zajišťuje odtok mozkomíšního moku (ve většině případů ventrikulo-peritoneální zkrat).
Klíčová slova:
demence – normotenzní hydrocefalus – Hakim-Adamsova trias – DESH – neurodegenerativní onemocnění
Úvod
Normotenzní hydrocefalus (normal pressure hydrocephalus; NPH) je důležitou součástí diferenciální diagnostiky demence již více než 50 let. Hakim a Adams popsali v roce 1965 tři pacienty, kteří měli ventrikulomegalii na pneumoencefalografii, ale neměli zvýšený intrakraniální tlak (intracranial pressure; ICP) [1]. Definovali klinický syndrom – triádu příznaků: močovou inkontinenci, demenci a poruchu chůze – provázející tuto diagnózu [1]. Kompletní trias se vyskytuje zhruba u 50 % pacientů [2]. NPH dělíme na primární nebo také idiopatický (iNPH) a sekundární (sNPH). Idiopatický NPH postihuje obvykle osoby nad 65 let a příčina jeho vzniku je neznámá. Sekundární NPH se může vyskytnout v jakémkoli věku v návaznosti na předchozí inzult (subarachnoidální krvácení, meningitida apod.) [3]. Na světě v současné době žije zhruba 50 milionů lidí s demencí a očekává se, že se tento počet do roku 2050 vzhledem ke stárnutí populace ztrojnásobí [4]. Průběh iNPH lze do jisté míry implantací zkratu zvrátit, a proto by tuto diagnózu měl znát každý, kdo se věnuje pacientům s demencí [5]. Ačkoli je udávaná prevalence iNPH z důvodu poddiagnostikování nepřesná, počítá se s 1,3% prevalencí iNPH pro osoby ve věku 65 a více [6]. Roční incidence stanovená v roce 2016 v Německu byla 1,36/100 000 obyvatel [7]. Nejčastěji užívaná léčba spočívá v implantaci ventrikuloperitoneálního (VP) zkratu – systému odvádějícího mozkomíšní mok z postranních komor mozku do břišní dutiny [8]. Implantace zkratu vede ke zlepšení klinických symptomů u 75 % pacientů [9]. Míra komplikací VP zkratu se pohybuje mezi 13–38 %, přičemž 26–38 % jsou případy s fixním ventilem a 9–16 % případů s nastavitelným ventilem vyžaduje revizi [9]. Dobré výsledky lze u některých pacientů v závislosti na výskytu komorbidit udržet mnoho let [10]. Diagnostika iNPH je založena na klinických příznacích v kombinaci se zobrazovacími metodami (MR, CT) a funkčními testy. V praxi se používají doporučené postupy, které podle pravděpodobnosti onemocnění stratifikují iNPH na možný (possible) iNPH, pravděpodobný (probable) iNPH a definitivní (definite) iNPH [5,11]. Výzkum je zaměřen na objasnění patofyziologických mechanizmů, identifikaci pacientů odpovídajících na zkratovou terapii, identifikaci a léčbu komorbidit, zkvalitnění zkratových systémů a využití neinvazivních vyšetření [12]. Minimonografie předkládá přehled aktuálních poznatků týkajících se této diagnózy.
Historické okénko
Přestože byl hydrocefalus již dlouhou dobu znám, jednotka NPH (nejprve označovaná jako symptomatický okultní hydrocefalus) je známa teprve od poloviny minulého století. Případ komunikujícího hydrocefalu s normálním tlakem po subarachnoidálním krvácení představili Foltz a Ward v roce 1956 [13]. Případ byl však pouze popsán bez dalšího zkoumání příčin a důsledků. Více se této problematice věnoval až Salomón Hakim. Ten si poprvé povšiml projevů NPH u pacientů v roce 1957 v nemocnici San Juan de Dios v Bogotě v Kolumbii. Své poznatky a první kazuistiky představil světu poprvé v roce 1964 [14]. Na to navázal společně s Raymondem Adamsem v nejslavnějších pracích publikovaných v The New England Journal of Medicine [15] a The Journal of the Neurological Sciences [1] v roce 1965. Hakim své patofyziologické úvahy založil na Pascalově zákoně. Síla (vyvinutá na stěny komorového systému) se rovná tlaku vynásobenému velikostí plochy. Teorii demonstroval na nafukujícím se balónku. V první fázi při nafukování stoupají tlak i síla působící na gumu balónku, po dosažení maxima však tlak klesá na určitou, později stabilní, úroveň, zatímco síla při rostoucí ploše komor stále roste. To znamená, že tlak v malých i velkých komorách je víceméně stejný, ale síla je ve velkých komorách vyšší – proporčně ke zvětšené ploše stěn [15].
Definice pojmu a základní rozdělení
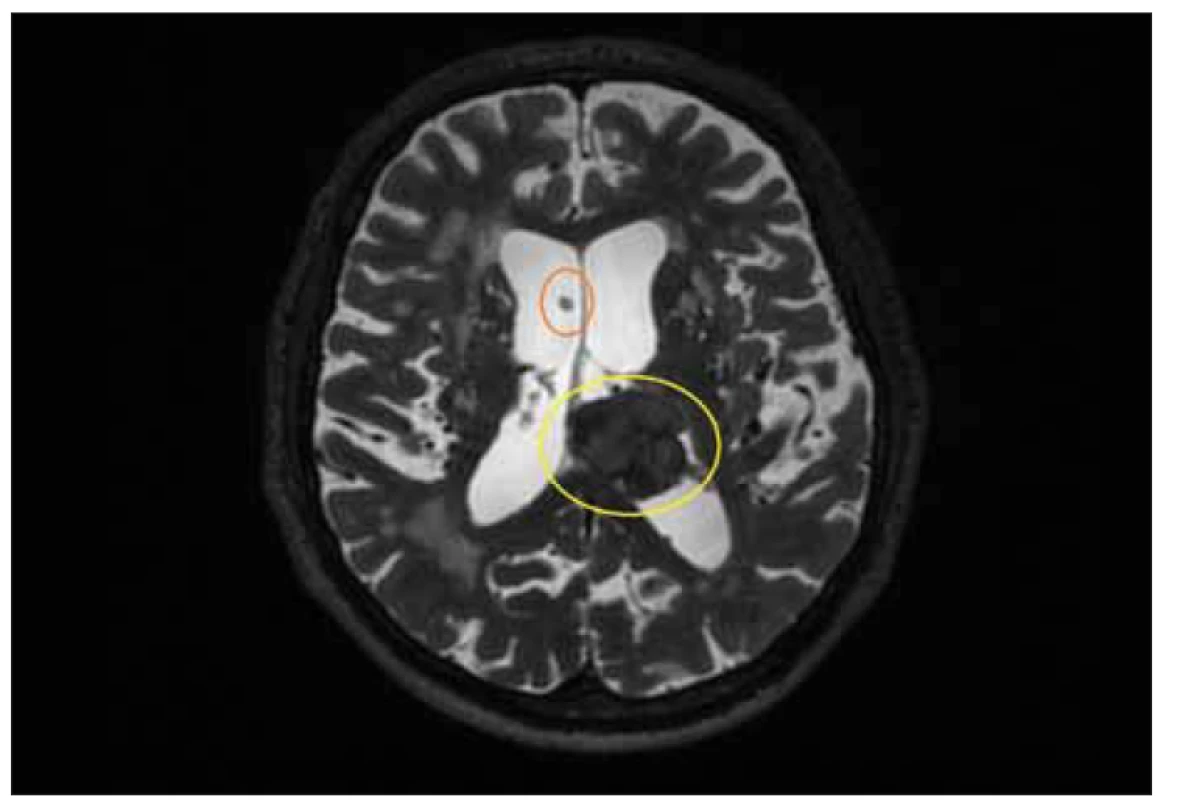
Z pohledu etiologie je zásadní dělení NPH na iNPH, kde příčina není známa, a sNPH, který může vznikat na podkladě různých patologií ovlivňujících dynamiku mozkomíšního moku, jako jsou subarachnoidální nebo intracerebrální krvácení, meningitida, malignita nebo trauma [16]. Sekundární NPH může vzniknout v jakémkoli věku, zatímco iNPH se vyskytuje nejčastěji u populace nad 65 let [16]. Preklinická fáze sNPH eskaluje v průběhu týdnů nebo měsíců [17], a je tak obvykle mnohem kratší než preklinický vývoj iNPH, který probíhá léta. U sNPH jsou časté neurologické deficity způsobené primárním onemocněním, které tak mohou maskovat typické příznaky NPH [18]. Byly popsány signifikantně lepší výsledky zkratové operace u pacientů trpících sNPH než u pacientů s iNPH při kratší době trvání symptomů [19]. Proto je dělení na sNPH a iNPH zásadní [20]. Sekundární NPH rezultuje z adhezí a fibrózy v subarachnoidálních prostorách a arachnoidálních granulací, nebo ze změn ve složení mozkomíšního moku na podkladě meningitidy, subarachnoidálního krvácení či produktů nitrolebních nádorů (obr. 1) [21]. Tyto mechanizmy pravděpodobně vedou k iniciálnímu zvýšení tlaku v komorách a jejich zvětšení a následné progresi v rámci klasické teorie spolu se změnami v tvorbě a resorpci moku [16].
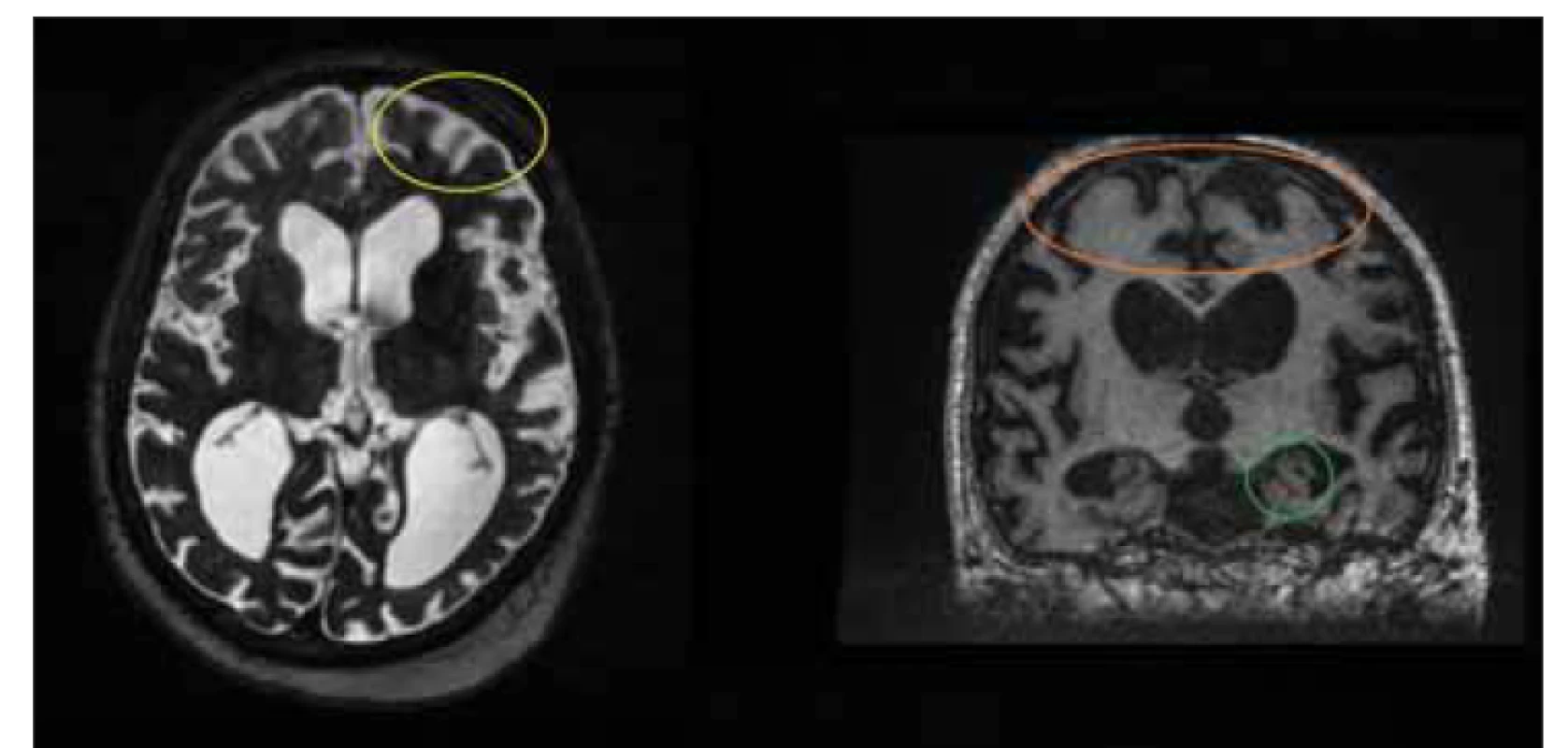
Fig. 1. MRI, T2-weighted image, axial plane. Patient with secondary normal pressure
hydrocephalus. Note the intraventricular meningioma in the left lateral ventricle (yellow
circle) and tip of the ventricular cathetheter (orange circle).
Patofyziologie idiopatického normotenzního hydrocefalu
Původní teorie přepokládala, že expanze komor je zprvu způsobena tlakem přesahujícím elastické napětí okolní mozkové tkáně, komory se zvětší a tlak klesne na normální hodnoty [1]. Přes normální tlak v komorách pak působí větší síla na stěny komorového systému při zvětšující se ploše jeho povrchu, což vede k další expanzi [22]. Po Hakimově výzkumu NPH byly poznatky týkající se univerzální patofyziologie hydrocefalu dále rozebrány autory Bering a Pappenheimer v průběhu šedesátých let minulého století [23–25]. Zmíněné výzkumy popisovaly hydrodynamické změny jak v produkci, tak v absorpci mozkomíšního moku u hydrocefalu animálních modelů. Již v této době byly popírány mechanizmy produkce moku, limitované pouze skrze filtraci krevní plazmy choroidními plexy, a předpokládalo se, že je likvor produkován i v dalších oblastech. S alteracemi cirkulace a dynamiky likvoru u NPH souvisí i změny pulzibility likvoru samotného, přičemž se hovoří o asociaci mezi zvýšenou hodnotou pulzibility mozkomíšního moku a redukcí poddajnosti intracerebrální tkáně se sníženou arteriální pulzací [26–28]. I proto je v současné době klasický model jednocestné cirkulace moku vyvracen výzkumy, jež naopak potvrzují fenomén tzv. třetí a čtvrté cirkulace [29,30], kdy se na celkové podobě komunikace likvoru mezi ventrikulárním systémem a subarachnoidálními prostory podílí několik faktorů najednou, vč. vlivu arteriální pulzní vlny, intercelulární metabolické výměny či bidirekcionálního pohybu moku. Změny hemodynamických faktorů byly u NPH zkoumány v několika recentních výzkumech, přičemž se na vzniku onemocnění předpokládá spoluúčast tzv. windkessel mechanizmu – centrální tepny, primárně aorta, fungují jako jakýsi rezervoár krve vyslané ze srdce během systoly, která je pak v průběhu diastoly transportována do cév na periferiích. V průběhu stárnutí je arteriální pulzibilita snížena, což má za následek kompenzující mechanizmus ve smyslu abnormálně zvýšené pulzibility Sylviova akvaduktu [31,32]. Opodstatňuje se tak účast změn v elasticitě cév s následnou změnou přenosu pulzní vlny při změně arteriálního tlaku v průběhu srdečních cyklů v intrakraniálním prostoru [33,34]. Problematiku alterací pulzových vln ICP zkoumali mimo jiné Eide a Stanisic u pacientů s NPH [35]. Dle jejich výsledků monitorace 40 pacientů s definitivním iNPH byla amplituda ICP pulzní vlny faktorem odlišujícím pacienty na ty, kteří na chirurgickou implantaci zkratu reagují příznivě, a na ty, kteří nikoli. Jejich studie nastiňuje asociaci mezi ICP (zároveň tak i tlakem likvoru) a odpovídající poddajností mozkové tkáně, což se dále odráží i na neurofyziologických změnách a rozvoji kognitivních deficitů [36,37].
V posledních letech získává z pohledu patofyziologie iNPH pozornost tzv. glymfatický sytém (glial-lymphatic/glymphatic) [38]. Předpokládá se, že se na homeostáze mozkomíšního moku tento systém z části podílí. Ve výběžcích astrocytů v perivaskulárních oblastech jsou aquaporinové kanály (aquaporin 4; AQP4). Přes tyto kanály probíhá transport mozkomíšního moku do intersticia [39]. Odtud pravděpodobně klasickou cestou odtéká k arachnoidálním granulacím a meningeálním lymfatickým cévám [38]. Hlavní hnací silou jsou nejspíše arteriální pulzace, ale předpokládá se i účast respirace a změn vaskulární rezistence v mozkových cévách [40]. První studie ukazují rozdíly mezi pacienty s iNPH a kontrolami v akumulaci gadobutrolu při zobrazování glymfatického systému pomocí MR. U iNPH je zvýšená stagnace gadobutrolu v mozkové tkáni [41,42]. Význam z pohledu diferenciální diagnostiky či výběru chirurgických kandidátů je nejasný. Navíc dysfunkce glymfatického systému doprovází také Alzheimerovu nemoc (Alzheimer disease; AD) [43,44] a pravděpodobně i další neurologická onemocnění [45]. Je možné, že v případě AD jde o dysfunkci na podkladě zvýšené akumulace Ab [44,46] a naopak u iNPH se jedná o dysfunkci primární způsobenou sníženou denzitou AQP4 kanálů s možným imunitním podkladem [39]. Není však dostatek dat ani na to, aby bylo možné říct, že se nejedná o průvodní jev normálního stárnutí [47]. U animálních modelů byly popsány změny dynamiky mozkomíšního moku a intersticiální tekutiny s ohledem na cyklus spánek-bdění [48]. V tomto ohledu je zajímavý výzkum Romána et al [49], neboť popisovali častou asociaci iNPH s obstrukční spánkovou apnoí (OSA). Zatím ale tento mechanizmus není dostatečně probádán [39]. Stejně tak poznatky o glymfatickém systému vycházející z animálních modelů musí být ještě potvrzeny u lidí [45].
Z pohledu efektu terapie je však v dnešní době více přijímána teorie, že iNPH je jakýsi bludný kruh různých patofyziologický mechanizmů, kdy jeden mechanizmus určuje druhý, zatímco tento bludný kruh lze přes veškeré úsilí prozatím pouze zpomalit [50,51]. Vychází z různých objevů u pacientů s NPH. Zvětšení komorového systému je doprovázeno pomalým tokem do konvexitárních subarachnoidálních prostor. Dilatace, resp. tenze vůči periventrikulární bílé hmotě, vede k hypoxii a ischemii [52]. Ependym postupně ztrácí plasticitu, periventrikulární hmota je méně poddajná, což bývá označováno termínem „ztuhlé komory“ („stiff ventricles“) [50]. Tenze vede ke kompresi a okluzi malých cév způsobující ischemii, tkáň ztrácí integritu, compliance mozkové tkáně se snižuje, přičemž se kontinuálně snižuje i přenos pulzní vlny [53]. Vzniká oxidační stres, gliové jizvy a blok v diferenciaci oligodendrocytů. Intersticiální tekutina se hromadí a vzniká stav označovaný jako „transependymální přestup“, jenž se významně podílí na osmotické dysbalanci v periventrikulární bílé hmotě i na intracelulárních alteracích vyúsťujících v progresi onemocnění [32,54]. Mozkomíšní mok je produkován stejnou rychlostí, ale odtok je zpomalen; výsledné léze v okolní mozkové tkáni dále tento tok zpomalují [50]. V poslední době bylo publikováno několik studií zaměřujících se na dynamiku a cirkulaci likvoru v phase-contrast zobrazeních MR a jejich 3D rekonstrukcích [55,56]. Jelikož je samotný NPH limitován na komorový systém, spinální subarachnoidální prostory (primárně v místě foramen magnum) analogicky vytvářejí kompenzující mechanizmus pro stabilizaci alterací hyperdynamického chování mozkomíšního moku [57].
Ačkoli první zmínky o genetických predispozicích rozvoje NPH jsou datovány do 80. let 20. století, až v poslední době jsou studovány podrobněji [58,59]. V roce 2016 [60] byla hodnocena rizika u pacientů pozitivně reagujících na zkratovou léčbu společně s definitivními iNPH pomocí zkoumání ztráty počtu kopií v intronu 2 genu SFMBT1. Dle získaných výsledků vykazovalo intronickou ztrátu až 26 % ze zmíněných pacientů, přičemž byli porovnáni s kontrolami, z nichž pouze 4,2 % vykazovalo tuto genetickou abnormalitu. Podobné výsledky potvrdila studie [61], jež genotypizovala skupiny norského a finského obyvatelstva. Nedávno byl publikován objev v japonské rodině s více jedinci s NPH, kteří byli heterozygotní pro gen CFAP43, s následnou ztrátou produktu tohoto genu [62]. Jiná studie ukázala heterozygotní stav pro gen CWH43 s dvěma typy delecí v jednom z genů a výslednou ztrátou funkce u 15 % z 53 pacientů s iNPH [63]. V současné době lze proto v souladu s patofyziologickými poznatky a různorodostí nálezů u těchto pacientů chápat iNPH spíše jako syndrom [2,50], jehož doménou je profit z dlouhodobé diverze mozkomíšního moku nežli jako jediné etiopatogeneticky definované onemocnění.
Klinický obraz
Hlavní symptomy
Porucha chůze
Porucha chůze je často dominujícím příznakem NPH a obvykle nejlépe odpovídá na implantaci zkratu (video 1) [10]. Na rozdíl od ostatních symptomů z klinické trias, u kterých obvykle po iniciálním zlepšení následuje postupná progrese symptomů, je zlepšení v chůzi lépe udržitelné [64]. Korelátem je frontální dysfunkce spojená s poruchou na úrovni periventrikulárních drah. Ta bohužel může vznikat i na podkladě jiných onemocnění a nelze tak pouze na základě posouzení chůze určit předpokládanou diagnózu [65]. Míra postižení chůze může být různá. U některých pacientů je postižení chůze zjištěno až při bližších vyšetřeních a někteří pacienti jsou chůze již neschopni [66]. Typická porucha chůze však má u pacientů s NPH určité specifické charakteristiky. Kroky jsou krátké, často nedosahují ani délky chodidla, jsou se širokou bází, se sníženou rychlostí, výška kroků je nižší, otočky vyžadují vysoký počet jednotlivých kroků [67]. Takto apraktická chůze bývá popisována jako „magnetická“ [68]. Imbalance je přítomna nejen při chůzi, ale i při stoji [69]. U některých pacientů je tandemová chůze prakticky nemožná. U těchto pacientů se také vyskytují projevy parkinsonismu, jako jsou festinace, hezitace a freezing [70], nicméně jsou zastoupeny méně [69] a do jisté míry mohou reprezentovat projevy komorbidit [71], které ovlivňují stupeň zlepšení po tap testu, což je jeden z funkčních testů, který „simuluje“ krátkodobě funkci zkratu [72]. Míra změny projevů komorbidit je po tap testu logicky nejnižší [67]. Právě analýzy různých kvantitativně hodnotitelných projevů chůze u pacientů s NPH (čas/počet kroků nutný k překonání určité vzdálenosti [73], bodové škály [74]) ve vztahu k provedení tap testu jsou nejdůležitějšími součástmi hodnocení tohoto testu a upřesňující indikační kritéria k zavedení zkratu [67,69,75]. Pacienti s kratším průběhem [76] a pacienti s apatií [77] se obvykle po tap testu v chůzi zlepší více. K analýze lze použít video k optimálnímu hodnocení jednotlivých charakteristik chůze a zároveň ke srovnání při kontrolách [78]. V naší recentní sestavě se osvědčilo použití Dutch Gait Scale s hranicí 15% zlepšení po prodloužené lumbální drenáži (external lumbar drainage; ELD) k indikaci VP zkratu [79]. Je totiž možné, že se do zlepšení chůze během hospitalizace promítají i efekt ošetřovatelské péče, důslednost v medikaci, režimu, zapojení rehabilitace apod. [79]. Pacienti, kteří byli ve studii Ravdina et al označeni jako nerespondující na implantaci VP zkratu [75], se v rámci tap testu také lehce zlepšili, ale zlepšení bylo průměrně pouze o 4,85 % oproti 29% zlepšení u respondentů. Dle japonských doporučených postupů je typická porucha chůze pro iNPH se známkami hydrocefalus s disproporčně zvětšenými subarachnoidálními prostory (disproportionately enlarged subarachnoid space hydrocefalus; DESH) hodnocena jako pravděpodobné iNPH, a lze tak na tomto podkladě indikovat implantaci zkratu [11].
Video 1. Porucha chůze u pacienta s iNPH, u tohoto pacienta byla obtížná zejména otáčka a subjektivně pociťoval nejistotu.
Video 1. Gait disturbance in a patient with iNPH, in this patient the turn was especially difficult and he subjectively felt uncertainty.
Video 2. Zlepšení chůze u pacienta s iNPH po 5 dnech ELD (Srovnejte s video 1). Pacient byl indikován k implantaci VP zkratu.
Video 2. Improvement of gait in a patient with iNPH after 5 days of ELD (Compare with video 1). The patient was indicated for implantation of a VP shunt.
Video 3. Pacient s iNPH na kontrole 3 měsíce po implantaci VP zkratu. Povšimněte si dalšího zlepšení v chůzi. Jedná se o stejného pacienta jako na předešlých videích.
Video 3. Patient with iNPH at follow-up 3 months after VP shunt implantation. Notice the further improvement in walking. This is the same patient as in the previous videos.
Kognitivní deficit
Další součástí Hakim-Adamsovy trias je kognitivní deficit. Ten se projevuje exekutivní dysfunkcí, zpomalením psychomotorického tempa a poruchami afektivity, zejména apatií [80] a poruchou pozornosti [81]. Dle Iddona et al (1999) [82] existují dva kognitivní profily reprezentující časné a pokročilé stádium onemocnění. První je spjaté s izolovanou frontální subkortikální dysfunkcí, druhé s těžkou globální poruchou. Burgalho et al (2014) [83] však tvrdí, že časné stádium je spojené spíše s poruchou vizuospaciálních dovedností. Oba tyto projevy jsou však nápadnější u NPH ve srovnání s AD, u které se více projevuje porucha paměti a orientace [84]. Porucha paměti u pacientů s iNPH je spojena zejména s opožděnou výbavností a rozpomínáním [85]. Navíc u pacientů s AD dominuje kognitivní deficit, kdežto u iNPH obvykle převládá porucha chůze. U pacientů s iNPH komorbidní AD je kognitivní deficit taktéž mnohdy předcházen rozvojem poruchy chůze [86]. Oproti AD je u pacientů s iNPH více vyjádřena exekutivní dysfunkce [87].
Bohužel nepanuje obecná shoda v použitých nástrojích v rámci neuropsychologických evaluací [88]. Jednotlivé testy a dotazníky však bývají obvykle spojeny do neuropsychologické baterie vyšetření. Vhodnými screeningovými testy jsou Mini Mental State Examination (MMSE) či Montreal Cognitive Assessment (MoCA), část pacientů totiž administraci dalších testů, které hodnotí jednotlivé kognitivní domény, nezvládne. Testy vhodné pro administraci v rámci baterie jsou např. Test Rey-Osterriethovy komplexní figury (ROCFT), Auditory Verbal Learning Test (AVLT), Trail Making Test (TMT A+B), testy fonémické a sémantické verbální fluence, Geriatric Depression Scale (GDS) či kostky – subtest Wechslerovy inteligenční škály pro dospělé (WAIS III) [89]. Někteří autoři využívají i škály původně určené pro jiná neurodegenerativní onemocnění (např. Alzheimer Disease Assessment Scale [ADAS]) [84,90]. Jiní autoři hodnocení kombinují s dalšími symptomy (např. v iNPH Scale) [91]. Nejvyšší tendenci ke zlepšení po zkratové operaci mají exekutivní funkce [90]. Testy, které tuto doménu sledují, však nelze jednoznačně využít k výběru kandidátů operace. Také změna ve skóre screeningových testů ve vztahu k funkčním vyšetřením ukazuje rozdíly mezi pacienty, kteří z následné operace profitují [92]. Nicméně stále není k dispozici dostatek dat, ze kterých by bylo možné vytvořit jednoznačná doporučení k indikaci VP zkratu ani k bližšímu odlišení diagnóz [89].
Močová inkontinence
Korelátem vzniku močové inkontinence u NPH je léze nad pontinním mikčním centrem, což způsobuje nedostatečnou inhibiční kontrolu močového měchýře a vede k nadměrné aktivitě detruzoru a výsledné urgenci s nebo bez inkontinence [93]. Často je inkontinence nesprávně přiřazena věku nebo jiným souvisejícím chorobám, proto je třeba znát důkladnou anamnézu [94]. Příznaky dolních močových cest (lower urinary tract symptoms; LUTS) jsou u populace starší 60 let velmi časté. Epidemiologická studie EPIC [95] zjistila v populaci ve věku 60 a více let žijící v ČR prevalenci jakéhokoli LUTS u 94 % mužů a 89 % žen a prevalenci hyperaktivního močového měchýře (overactive bladder; OAB) u 28 % mužů a 34 % žen. OAB je definován jako naléhavost k močení s nebo bez urgentní inkontinence a je obvykle spojen se zvýšenou frekvencí a nykturií [96]. V rámci diagnostiky se využívají subjektivní informace poskytované prostřednictvím ověřených dotazníků (např. International Consultation of Incontinence questionnaire [ICIq]) ke standardizaci hodnocení močových symptomů a měření výsledků [97]. Invazivní urodynamická vyšetření nebývají častá. Z měření maximálního průtoku, rezidua, kapacity močového měchýře, náplně a aktivity detruzoru či aktivity uretrálního svěrače měřené pomocí EMG [96,97] lze očekávat u iNPH nadměrnou aktivitu detruzoru, zodpovědnou za močovou urgenci, o které se předpokládá, že předchází urgentní inkontinenci v progresi iNPH [93]. Jak nemoc postupuje, může docházet dokonce i k inkontinenci stolice [98]. Zkratová operace vede ke zmírnění inkontinence a urgence u zhruba 55 % pacientů [9]. Časté jsou reziduální příznaky související s průběhem onemocnění či komorbiditami [99]. Z pohledu reziduálních symptomů OAB lze terapii doplnit o farmakologickou léčbu OAB, např. Solifenacin [100].
Vedlejší klinické projevy
U pacientů s NPH jsou poměrně časté psychiatrické příznaky [28]. Mohou být součástí samostatného onemocnění, nebo, u některých případů, samotného NPH [101]. Bylo zjištěno, že deprese je častější u pacientů s NPH než v obecné populaci, stejně jako u jiných neurodegenerativních onemocnění [102]. Další příznaky, jako jsou změny osobnosti, úzkosti, poruchy nálad a psychotické stavy, mohou znesnadňovat diagnostiku [28,103]. U pacientů s iNPH byl popsán dokonce zvýšený výskyt schizofrenie než v obecné populaci ve stejném věku [104,105], zatímco výsledek léčby nebyl touto komorbiditou ovlivněn [105]. Psychiatrické příznaky mohou být refrakterní vůči konvenční farmakologické léčbě, a naopak mohou příznivě reagovat na zkratovou operaci [5]. Sexuální dysfunkce je běžným nálezem u starších pacientů, může však být součástí klinického pozadí NPH [106].
Přirozený průběh onemocnění
Idiopatický NPH je celoživotní onemocnění. Zkratová operace může dlouhodobě zmírnit příznaky, ale nemůže odstranit řetězec příčin nemoci [107]. U neléčených pravděpodobných pacientů s iNPH byla popsána 87,5% 5letá mortalita. V této studii zároveň u 13 z 29 sledovaných pacientů (průměrně po dobu 11,5 let) se suspekcí na iNPH či bez příznaků došlo k progresi symptomů k označení pravděpodobného iNPH dle mezinárodních doporučení a konsenzu [108]. Rychlost progrese se může lišit, ale většina hlášených případů pacientů s iNPH (neoperovaných nebo operovaných s odkladem) se zhoršila během prvních několika měsíců po stanovení diagnózy [109].
Zobrazovací techniky
Pro vizualizaci komorového systému se v dnešní době využívá zejména CT a MR. Velikost komor bohužel nekoreluje s odporem průtoku, otevíracím tlakem a indexem tlaku a objemu [110]. V klinické praxi se nicméně k hodnocení ventrikulomegalie používají různé indexy. Evansův index, který byl představen Williamem A. Evansem v roce 1942 [111], je standardem. Obvykle je k diagnóze jakéhokoli hydrocefalu vyžadována hodnota vyšší než 0,3 [11]. Vyjadřuje poměr největší vzdálenosti mezi zevními stěnami frontálních rohů postranních komor a vzdáleností mezi tabulae internae ve stejné úrovni (obr. 2). Je třeba mít na paměti, že se hodnoty Evansova indexu mohou významně lišit v závislosti na úrovni a orientaci řezu vyšetření CT mozku [112]. Další indexy, jako jsou poměr frontálního a okcipitálního rohu (FOR) nebo bifrontální index (BFI) [113], jsou používány zřídka. CT – cisternografie měla falešně pozitivní výsledky u téměř 60 % pacientů a je obsolentní [114]. Nativní vyšetření CT mozku jsou důležitá zejména v pooperačním období a jsou obvykle prvním zobrazovacím vyšetřením mozku pacienta. MR je důležitá v diagnostice. Poskytuje lepší detekci specifických patologických nálezů (stenóza aqueductu – obr. 3) a radiologických příznaků NPH [11]. Konvenční rentgenové nebo radionuklidové studie průchodnosti ventilu jsou někdy využity pro vyhodnocení jeho funkce či nastavení [115].
Fig. 2. Non-contrast CT, axial plane. Evans‘ index. The line a shows the greatest distance between
the frontal horns of the lateral ventricles. Line b shows the widest distance between
the inner laminae measured at the same level. Evans‘ index is the ratio of the distances a/b.
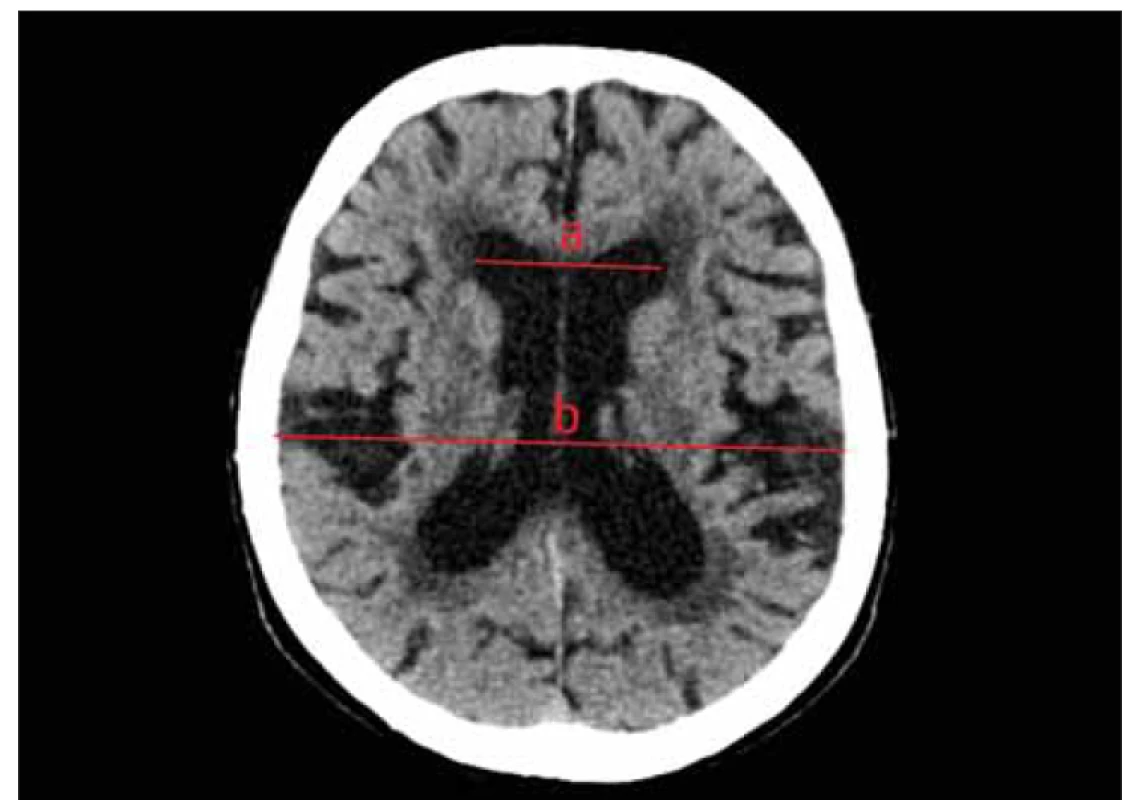
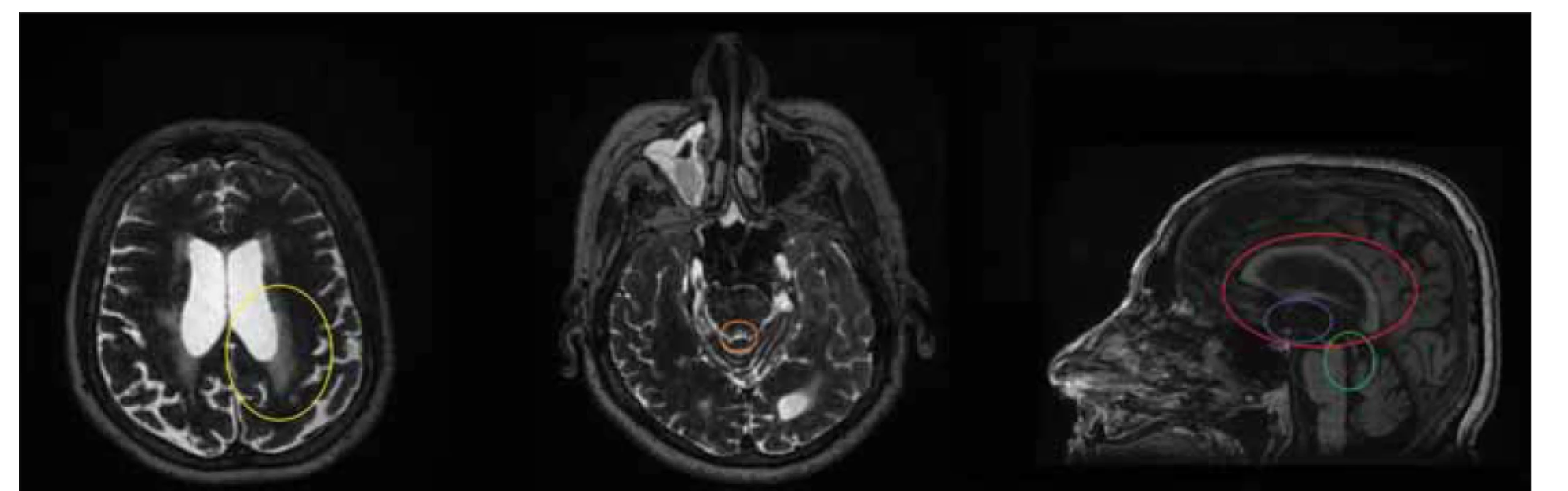
Fig. 3. MRI, T2-weighted image, axial plane, T1-weighted image, sagittal plane. Patient (male, 63 years) with aqueduct stenosis presenting
with normal pressure hydrocephalus symptoms. Note the transependymal flow (yellow circle), decreased cross-section of the
aqudueduct mesencephali (orange circle), funnel-shaped dilation in front of the stenosis (green circle), absence of corpus callosum
bowing (red circle), and third ventricular bowing (blue circle).
Výpočetní tomografie
Nativní vyšetření CT mozku jsou obvykle prvním zobrazovacím vyšetřením pacienta. Z tohoto vyšetření lze popsat nejen přítomnost hydrocefalu, ale i případné patologie k němu vedoucí, zhodnotit atrofii, ischemická ložiska a základní známky různých typů hydrocefalu. Každý pacient s klinickými příznaky NPH by měl v rámci neurologické dispenzarizace vyšetření CT mozku absolvovat.
Dalším důležitým aspektem je využití vyšetření CT v pooperačním období. CT mozku v rámci hospitalizace po výkonu je důležitá pro kontrolu pozice komorového katetru a k vyloučení potenciální komplikace při inzerci katetru. Obvykle se provádí v den výkonu nebo den po operaci. Další provedení CT je obvyklé za jeden měsíc po implantaci zkratu [116]. Doporučení pro další rutinní provádění vyšetření CT při sledování pacienta po operaci nejsou jednoznačná. Mnoho autorů však uvádí, že provádět opakovaná vyšetření CT po 1 roce sledování není nezbytné, pokud se klinické příznaky výrazně nemění [117]. Navíc změna velikosti komor nekoreluje s klinickými výsledky terapie [118]. Proto by se měla indikace k provedení CT řídit již po první ambulantní kontrole pacienta klinickým vývojem. Při podezření na výskyt komplikace nebo ke sledování jejího vývoje je provedení CT nezbytné. Na závěr je nutné zmínit, že z hlediska grafického korelátu předrénování je při absenci klinických příznaků určitý stupeň subdurálních efuzí přípustný [119].
Magnetická rezonance
Vyšetření MR základními sekvencemi nabízí oproti CT více detailní zobrazení mozku a prostor mozkomíšního moku. V rámci diagnostického procesu by MR mozku měla být provedena, a to zvláště při úvaze o jiné etiologii hydrocefalu. Základní morfologické parametry a výsledky vyšetření různými experimentálními metodami jsou zkoumány pro možnost bližší identifikace respondentů na zkratovou terapii nebo k získání poznatků o patofyziologii iNPH.
U pacientů s iNPH se na T2-vážených obrazech MR vyskytují periventrikulární hyperintenzity v bílé hmotě, které však mohou být cévní či kombinované etiologie [120]. V rámci předpokládané patofyziologie u iNPH jsou pravděpodobně na podkladě sníženého průtoku krve v periventrikulární bílé hmotě [121]. Kromě zobrazení samotné mozkové tkáně byla v souvislosti s iNPH studována volumetrie.
Nedávná volumetrická analýza ukázala spojitost neuropsychologických symptomů s velikostí striata [122]. Jiná studie však neprokázala význam využití volumetrie pro výběr kandidátů zkratové operace [123]. Výzkum se zaměřil na morfologické známky z pohledu jejich výskytu u zkratovaných pacientů a s ohledem na odpověď po zkratové operaci. Jedná se zejména o DESH [2,124], Callosal Angle (CA) [125] či Z-Evans‘ index [126]. Největší pozornost v poslední době získal DESH (obr. 4). DESH se skládá ze tří komponent: ventrikulomegalie, zvětšených incisurae Sylvii a úzkých prostor mezi sulky na konvexitách [127]. Morfologické známky disproporcionality subarachnoidálních prostor pravděpodobně souvisí s patogenezí iNPH [128] a pravděpodobnost iNPH zvyšují [129]. Ve studii sledující cestu radionuklidu při cisternografii bylo ukázáno, že u pacientů se známkami DESH dochází k vyšší stagnaci nuklidu v komorovém systému [130]. Nelze však využít absence vyjádření známek DESH či pouze jejich lehkého stupně pro kontraindikaci zkratové operace [79,131]. Někteří pacienti, kteří mají vyjádření DESH nízké, z implantace zkratu profitují a naopak [79]. Japonské doporučené postupy na základě přítomnosti DESH spolu s přítomností typické poruchy chůze umožňují indikaci VP zkratu [11]. Důsledky tohoto postupu však nejsou ještě plně objasněny, souvislost DESH a zlepšení po ELD nebyla pozorována [79,131]. Přítomnost DESH bez klinických příznaků se označuje jako asymptomatická ventrikulomegalie se znaky NPH na MR, přičemž některými autory je to vnímáno jako preklinický stav iNPH [132].
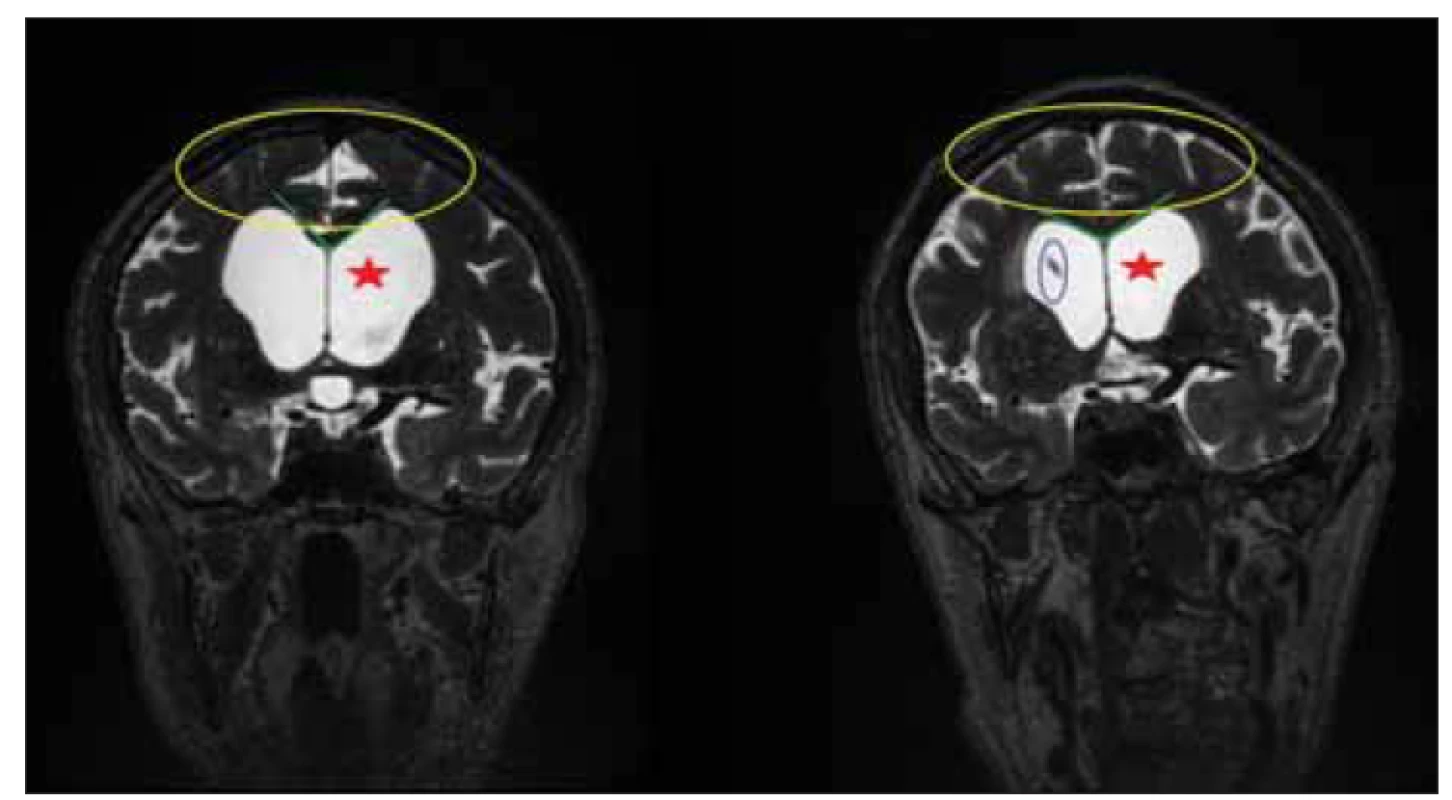
Fig. 4. MRI, T2-weighted image, coronal plane. Patient with idiopathic normal pressure
hydrocephalus before implantation and 3 months after implantation of a ventriculoperitoneal
shunt. Note the changes in disproportionately enlarged subarachnoid space hydrocephalus
morphology. Reduction of ventriculomegaly (red star), relaxation of subarachnoid
spaces on convexities (yellow circle), and increase of callosal angle (green
lines). The tip of the ventricular catheter is marked in a blue circle.
Význam dalších metod MR a experimentálních protokolů je v současné době předmětem pozornosti mnoha autorů, nicméně výsledky prozatím nejsou přínosné. Měření průtoku krve mozkem (cerebral blood flow; CBF) pomocí arterial spin labeling nebylo prokázáno jako použitelné k predikci zkratové odpovědi. CBF se nezvýšil v žádném ze sledovaných oblastí [133]. Změna v parametrech získaných pomocí MR elastografie (MRE) ukázala signifikantní změny u pacientů zlepšujících se na lumbální drenáži oproti pacientům, kteří se nezlepšují, ale rozdíl není signifikantní z pohledu dat získaných před drenáží [134]. Jiná analýza MRE dat ukázala takřka 100% odlišení NPH od AD a zdravých kontrol. Studováno však bylo pouze 8 pacientů s AD a pacienti, kteří se nezlepšili po tap testu, nebyli analyzováni [135]. V jiné studii poukazující na význam MRE bylo hodnoceno pouze 10 pacientů s iNPH [136]. Flow void je často přítomen (obr. 5). Hodnoty parametrů získaných analýzou fázového kontrastu na MR (PC-CINE MR) v aqueductu a jiných prostorách s mozkomíšním mokem jsou z pohledu výběru chirurgických kandidátů nekonkluzivní [137]. Ani analýza průtoků aqueductem před a po lumbální drenáži neukázala klinický přínos této metody [138]. V rámci vyšetření diffusion tensor imaging (DTI) byly prezentovány rozdíly v průměrné difuzivitě v periventrikulárních oblastech mezi pacienty s iNPH a kontrolami [139]. Změny ve frontální bílé hmotě by mohly vysvětlovat dysfunkci komunikace mezi frontální kůrou a bazálními ganglii [140] a vyšší frakční anizotropie v kortikospinálním traktu capsuly interny by mohla objasnit poruchu chůze [141]. Bylo zjištěno, že změny kvantitativních hodnot po zkratové operaci korelovaly s úrovní zlepšení klinických příznaků [142,143]. V poslední době se objevily studie zabývající se dalšími pokročilými metodami MR, využívajícími např. difuzní zobrazování pomocí kurtosy [144], zobrazení v q prostoru [145] či disperze orientované na neurity a zobrazování hustoty [146,147]. MR spektroskopie ukázala signifikantní snížení poměru N-acetylaspartát/kreatin (NAA/Cr) v bílé hmotě frontálního laloku a talamu u pacientů s iNPH [148]. Diagnostická hodnota všech těchto metod zatím bohužel není stanovena.
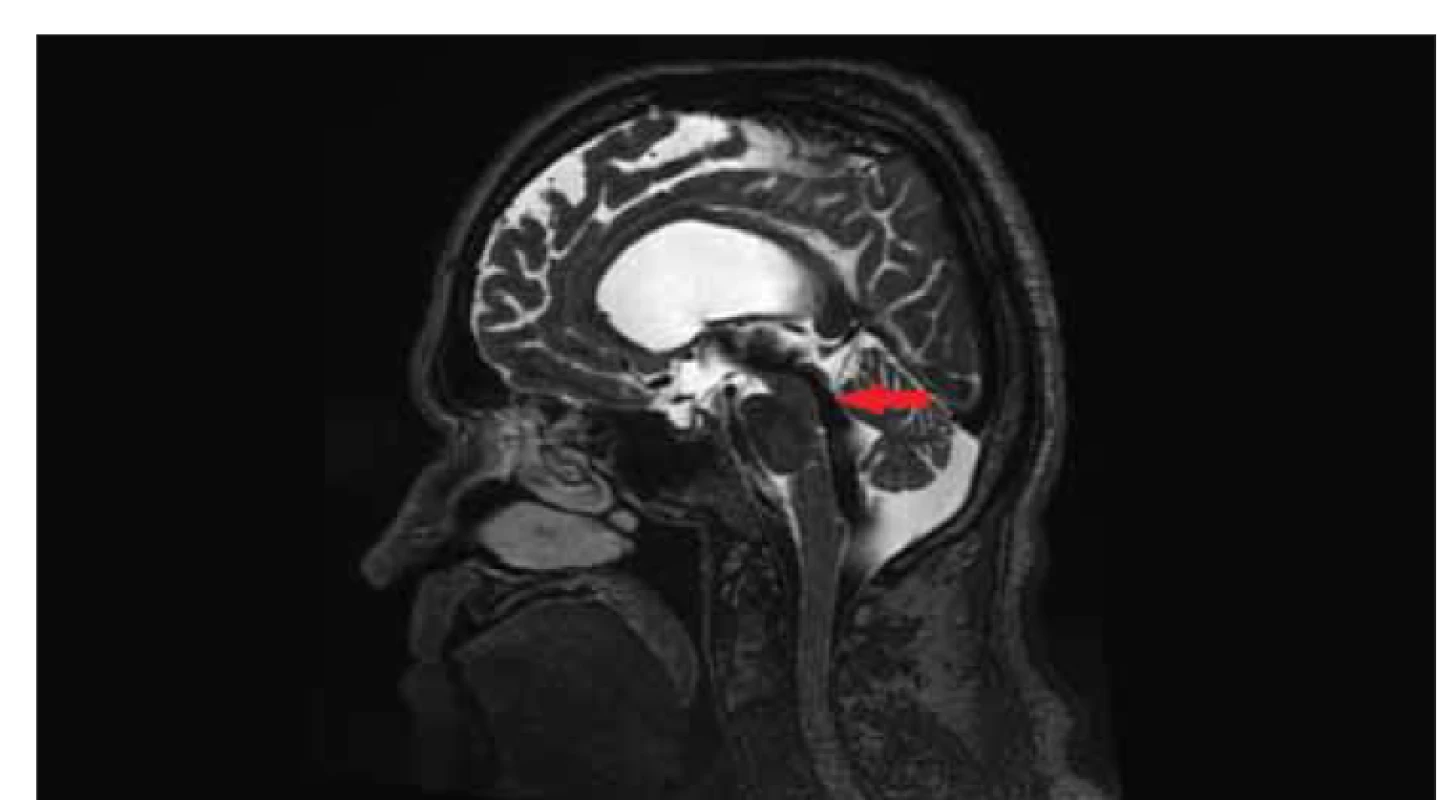
Fig. 5. MRI, T2-weighted image, sagittal plane. Flow void sign (red arrow) in a patient
with idiopathic normal pressure hydrocephalus indicating increased flow through the
mesencephalic aqueduct.
Také radiologické známky z pohledu diferenciální diagnózy či výskytu komorbidit nejsou dostatečně probádány. U pacientů s iNPH nejsou chronické ischemické změny či přítomnost lehké kortikální atrofie kontraindikací k implantaci zkratu při pozitivních funkčních testech [5]. Chybí však dostatek dat sledujících grafický vývoj korelující s klinickým vývojem a srovnáním jednotlivých skupin pacientů. Dle studie Savolainena et al (2000) [149] by menší velikost hipokampů na MR mohla reprezentovat komorbiditu AD, avšak jasné nebo alespoň částečné hranice nebyly definovány. Navíc může být zjištěná atrofie před implantací zkratu přeceněna [128].
Další vyšetření
Data EEG získaná s použitím elektromagnetické mozkové tomografie s nízkým rozlišením (eLORETA) u 34 pacientů s iNPH měla přesnost predikce odpovědi na zkrat 67,6 % [150]. Tím by tato analýza z pohledu neinvazivních testů mohla být v budoucnu zajímavá. Vyšetření pomocí jednofotonové emisní výpočetní tomografie (single photon emission computed tomography; SPECT), která hodnotí presynaptickou dopaminergní aktivitu, bylo nepřesné a ukázalo se být nevhodné k odhalení neurodegenerativní komorbidity [151]. Další vyšetření SPECT s acetazolamidem se v klinické praxi neujalo [152]. Amyloidové a vyšetření PET s fluordeoxyglukózou (FDG-PET) se také nepoužívá [153,154].
Invazivní vyšetření
Základem pro stanovení diagnózy je stanovení ICP, který je obvykle odvozen od hodnoty otevíracího tlaku během lumbální punkce provedené vleže. Nedávno byly stanoveny referenční meze ICP vestoje na 5,9–8,3 mmHg a 0,9–16,3 mmHg vleže [155]. Jediná hodnota ICP je z pohledu diagnózy NPH omezená, proto je k hodnocení vhodnější použít dynamické studie a funkční testy (tab. 1) [156–158]. Hodnota ICP pro diagnózu NPH ale nesmí přesahovat 200 mmHg [11]. Cytologický, biochemický a kultivační nález v moku musí být normální [5].
![Shrnutí statistických hodnot nejčastěji používaných dynamických studií
a funkčních testů [156–158]. Převzato a přeloženo ze Skalický et al (2019) [89].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image_pdf/15247efbe7fb6ecbf31aba4fd7e5f9c6.png)
Lumbální infuzní test
Důležitou dynamickou studií je lumbální infuzní test (LIT). Původní technika popsaná Katzmanem a Husseyem v roce 1970 byla modifikována [159]. Během LIT se ICP nepřetržitě měří během infuze náhrady mozkomíšního moku (obvykle Ringerova roztoku) do bederního subarachnoidálního prostoru pomocí lumbální jehly. Infuze je aplikována do subarachnoidálních prostor obvykle rychlostí 1,5 ml/min. Změna tlakové křivky a hodnot tlaku během testu může určit parametry dynamiky mozkomíšního moku, např. odpor k odtoku mozkomíšního moku (Rout), který je ve světě nejčastěji hodnoceným parametrem v rámci LIT [160]. Existuje nelineární korelace mezi nárůstem ICP s rostoucím Rout, která je definovaná jako rozdíl tlaku v ustáleném stavu na konci infuze a počátečního tlaku děleného rychlostí infuze [161]. Pozitivní je obvykle test s hodnotou Rout vyšší než 12 mmHg/ml/min [162]. Potvrzují to také naměřené hodnoty u zdravých dobrovolníků, které většinou nepřesahují 10 mmHg/ml/min [163]. Proto může výsledek LIT poskytnout cenné informace v nejasných situacích [164]. Stanovení Rout pro predikci odpovědi na zkrat má oporu i v USA [165]. Alternativou je možnost hodnocení v modifikaci dle Nelsona a Goodmana z roku 1971, které je v rámci českých pracovišť více rozšířeno [166].
Vyšetření LIT musí splňovat určité technické požadavky. Pacient musí ležet na boku v horizontále tak, aby byly hodnoty tlaku přesné. Ze stejných důvodů musí být stanoven odpor systému. Obtíže mohou nastat při snížené spolupráci pacienta [167]. Nicméně z vlastních zkušeností můžeme říct, že LIT lze provést bez problémů v lokální anestezii bez použití sedace u většiny pacientů. Doporučujeme měření přes Tuohyho 14G jehlu pro nižší odpor jehly při hodnocení výsledku a možnost zavedení lumbální drenáže [89]. Při nejistém zlepšení po drenáži lze výsledek LIT použít při zvažování indikace zkratu.
Tap test
Již první tři literárně popsaní diagnostikovaní pacienti podstoupili před zavedením zkratu lumbální punkci s odvedením 15 ml mozkomíšního moku a následným zlepšením příznaků u všech těchto pacientů [1]. Od té doby se tap test (TT) používá k identifikaci potenciálních kandidátů zkratové terapie. Odstranění mozkomíšního moku ze subarachnoidálních prostor pravděpodobně snižuje jeho vstřebávání s částečnou normalizací jeho hydrodynamiky [168]. Hranice významného zlepšení a objem odebraného moku však dosud nebyly standardizovány [156]. Jsou doporučeny určité hrubě definované postupy [11]. Výzkum je z pohledu TT zaměřen na klinicky použitelné metody hodnocení chůze, rovnováhy a poznávání, které by mohly identifikovat pacienty odpovídající na zkratovou terapii [69].
V současné době se doporučuje vypustit cca 30–50 ml likvoru s následným hodnocením symptomů s dvouhodinovým odstupem. Jelikož může být zlepšení u některých pacientů zpožděné, je důležité provést hodnocení i podruhé po 24 h [69]. Hodnotí se zlepšení v základních symptomech. Pacienti se zlepšením jsou indikováni k implantaci zkratu. Negativní výsledek TT však nelze použít ke kontraindikaci implantace zkratu [169].
Tap test krátkodobě „simuluje“ funkci zkratu. Provádí se v pozici vleže na boku pacienta pomocí jednorázové punkce lumbálního subarachnoidálního prostoru. Změří se otevírací tlak a odpustí se mozkomíšní mok, který je odeslán k laboratornímu vyšetření. V rámci hodnocení se pro analýzu chůze používají různé testy (např. Timed Up and Go Test) nebo škály (Tinneti Scale, Dutch Gait Scale) [75,170]. U pacientů obvykle již po dvou hodinách od odpuštění mozkomíšního moku dojde ke zlepšení praxe, vstávání ze židle, otáčení i rychlosti chůze [171]. Pro analýzu kognice se obvykle využívá screeningových testů (MoCA, MMSE) [172].
Vnější (prodloužená) lumbální drenáž
Pro finální rozhodnutí o indikaci zkratové operace má použití ELD lepší senzitivitu a specificitu než TT [85]. Podobně jako TT, tak i toto vyšetření „simuluje“ funkci zkratu. Analýza dat z transkraniální magnetické stimulace u pacientů s NPH s lumbální drenáží ukazuje zvýšení kortikální excitability [173]. V průběhu ELD se v mozku zlepšuje metabolizmus [35]. Rychlost odvodu by se měla pohybovat mezi 5 a 10 ml/h, když je pacient ve vodorovné poloze, a s uzavřenou drenáží, když je pacient vertikalizován. Drenáž je udržována po dobu 3–5 dnů [156]. Hodnotí se zlepšení symptomů [156]. Míra významných komplikací (meningitida, subdurální kolekce, subrachnoidální krvácení a uvíznutý drén) byla ve studii zabývající se komplikacemi ELD 3 % [174].
Jediný prediktivní funkční test či dynamická studie pravděpodobně nedokáže plně předpovědět výsledky terapie. To může být způsobeno komplexní patogenezí iNPH [175] spolu se složitostí ICP a hydrodynamiky mozkomíšního moku [176]. Zdá se, že ELD je nejlepší a nejrozumnější prognostický funkční test v diagnostice iNPH [177]. Vzhledem ke statistickým hodnotám a opoře v literatuře [175,177] je ELD v současné době pravděpodobně nejpřesnějším vyšetřením [156], ale světově je vzhledem k dostupnosti a jednoduchosti za cenu nižší přesnosti preferován TT [11]. Dobré zkušenosti jsou již popsány i s kratším, 24h testováním [178]. V souladu s rychlostí odpovědi na drenáž u některých pacientů lze drenáž po dosažení signifikantního zlepšení odstranit, ale standardně doporučujeme testovat 3–5 dní a drenáž při neuspokojivém klinickém vývoji neodstraňovat předčasně. Dokonce i v rámci jednorázové punkce bylo pozorováno zlepšení až po 2–3 dnech [179].
Další invazivní vyšetření
Někteří autoři využívají v diagnostice kontinuální 12–48h ICP monitoring [180,181]. ICP se měří buď lumbálně [182], v mozkové tkáni [183], intraventrikulárně [180], nebo epidurálně [184]. Nejsledovanějšími parametry jsou charakter pulzní křivky, její amplituda, výskyt vyšších výkyvů či výskyt B-vln v průběhu monitorování [180]. ICP je u pacientů s iNPH normální. Stejně tomu je u pacientů s takovým stupněm stenózy aqueductu, která vyvolá příznaky až v dospělosti, přičemž u této skupiny je tlak o něco vyšší. Naopak pacienti s iNPH mají vyšší amplitudu ve frekvenční i časové doméně [185]. Zejména hodnocení střední amplitudy mělo nejlepší výsledky pro identifikaci pacientů zlepšujících se po implantaci zkratu [183]. Výsledky však byly doposud kontroverzní [180,186]. Diagnostické využití ICP monitoringu tak nebylo stanoveno [11]. Navíc se ukázala také nízká korelace mezi výsledkem ICP monitoringu a LIT [187].
Analýza mozkomíšního moku
Přes veškeré snahy nejsou výsledky analýz mozkomíšního moku konkluzivní a momentálně není možné na jejich základě indikovat či kontraindikovat implantaci zkratu. Snížený Ab42 v mozkomíšním moku se vyskytuje u AD i iNPH. Dle autorů však není důvodem sníženého Ab42 v mozkomíšním moku před implantací VP zkratu u iNPH depozice Ab v mozku, ale jeho omezená clearance [188]. Nedávné publikace ukázaly jiné potenciální kandidáty pro analýzu [189–192]. Podle Lia et al (2006) [190] je a-2-glykoprotein bohatý na leucin (LRG) specifický pro iNPH. Také další biomarkery subkortikálního poškození, jmenovitě neurofilamentové lehké řetězce (neurofilament light chain; NFL) a myelinový bazický protein (MPB), jsou zvýšeny v mozkomíšním moku pacientů s iNPH, ale specificita všech těchto markerů je nízká [191]. Zánětlivé biomarkery (TGF-b1, IL-1b, IL-6, IL-10) mohou být zvýšené, ale v současné době není dostatek důkazů pro jejich použití v diagnostice iNPH [191]. Neurosteroidy (pregnenolon [PREG], dehydroepiandrosteron [DHEA], jejich sulfáty a metabolity) by též mohly být zajímavými kandidáty pro analýzu [193,195]. Hodnocení koncentrací většího počtu markerů současně, a to zejména p-tau, t-tau a Ab42, ukazuje zatím nejlepší výsledky pro odlišení iNPH od diferenciálních diagnóz [195–197], avšak v praxi se zatím nevyužívá. Žádný ze známých biomarkerů také nemůže být v současné době využíván k predikci nastavení ventilu [198].
Diferenciální diagnóza a komorbidity
Diferenciální diagnostika NPH – zejména iNPH – je vzhledem k věku, výskytu a symptomům poměrně široká a detailní popis jednotlivých diagnóz přesahuje rámec této publikace (tab. 2). Většinou lze vycházet z dostupných doporučených postupů a dalších doporučení [5,11]. Za zmínku stojí zejména doporučení Mezinárodní společnosti pro hydrocefalus a poruchy mozkomíšního moku (International Society for Hydrocephalus and Cerebrospinal Fluid Disorders; ISHCSF) z roku 2013 pro posouzení komorbidit [200].
![Diferenciální diagnóza normotenzního hydrocefalu spolu s nejčastějšími komorbiditami
a možnými etiologiemi sekundárního normotenzního hydrocefalu. Podle
Relkina et al (2005) [5] a Rigamontiho et al (2014) [199]. Převzato a přeloženo ze
Skalický et al (2019) [89].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image_pdf/e845a1d037d926296c17e8a5a6d60ebe.png)
Kromě různých diagnóz zvažovaných v diferenciálně diagnostické rozvaze (tab. 2) může NPH s některým z těchto onemocnění probíhat souběžně. Vliv těchto nemocí na výsledek zkratové operace může být velký, takže je důležité jejich projevy identifikovat a v rámci možností léčit (obr. 6) [200]. Z pohledu kognitivního deficitu jsou nejčastější AD (obr. 7) a vaskulární demence [201]. Ve studii Pomeraniece et al (2016) [202] se vyskytovala komorbidita AD u 19 % ze 142 pacientů indikovaných k implantaci VP zkratu. Celkem 80 % těchto pacientů se po operaci zlepšilo podobně jako ve skupině bez AD, nicméně odpověď na zkratovou terapii byla signifikantně nižší. U dalších 13 % pacientů z celkově 36 opakovaných biopsií došlo v průběhu sledování (průměr 34,7 měsíců) k rozvoji AD. Podobně Luikku et al (2019) [203] popsali rozvoj AD u 19 % zkratovaných pacientů s iNPH během 5,3letého sledování. Leinonen et al (2012) [204] u 468 možných pacientů s iNPH objevili přítomnost Ab u 42 % pacientů společně s patologií tau proteinu u 9 %. Výsledek biopsie mozku však neovlivnil délku přežití. Oproti tomu vstupují do hry výsledky jiných autorů, u kterých je komorbidita AD spojena s nižším zlepšením po zkratové operaci [128,153,202,203]. Je proto možné, že provedení biopsie kortexu při implantaci zkratu bude mít své opodstatnění [202]. Vzhledem k vyššímu výskytu AD v kohortě pacientů s iNPH oproti obecné populaci [203] však existují i teorie o průmětu patogeneze iNPH s AD [204]. Je možné, že podobně jako vaskulární vlivy [31] by AD mohla objasňovat vznik iNPH alespoň u části pacientů [205]. Jiná studie však spojitost patogeneze iNPH a AD vyvrací [206].
Fig. 6. MRI, T1-weighted image, sagittal plane. Hummingbird sign (mesencephalon in
a yellow circle) in a female patient after shunt implantation at a 3-month follow-up. After
a brief initial improvement of idiopathic normal pressure hydrocephalus symptoms, the
patient developed progressive supranuclear palsy and rapid clinical deterioration.
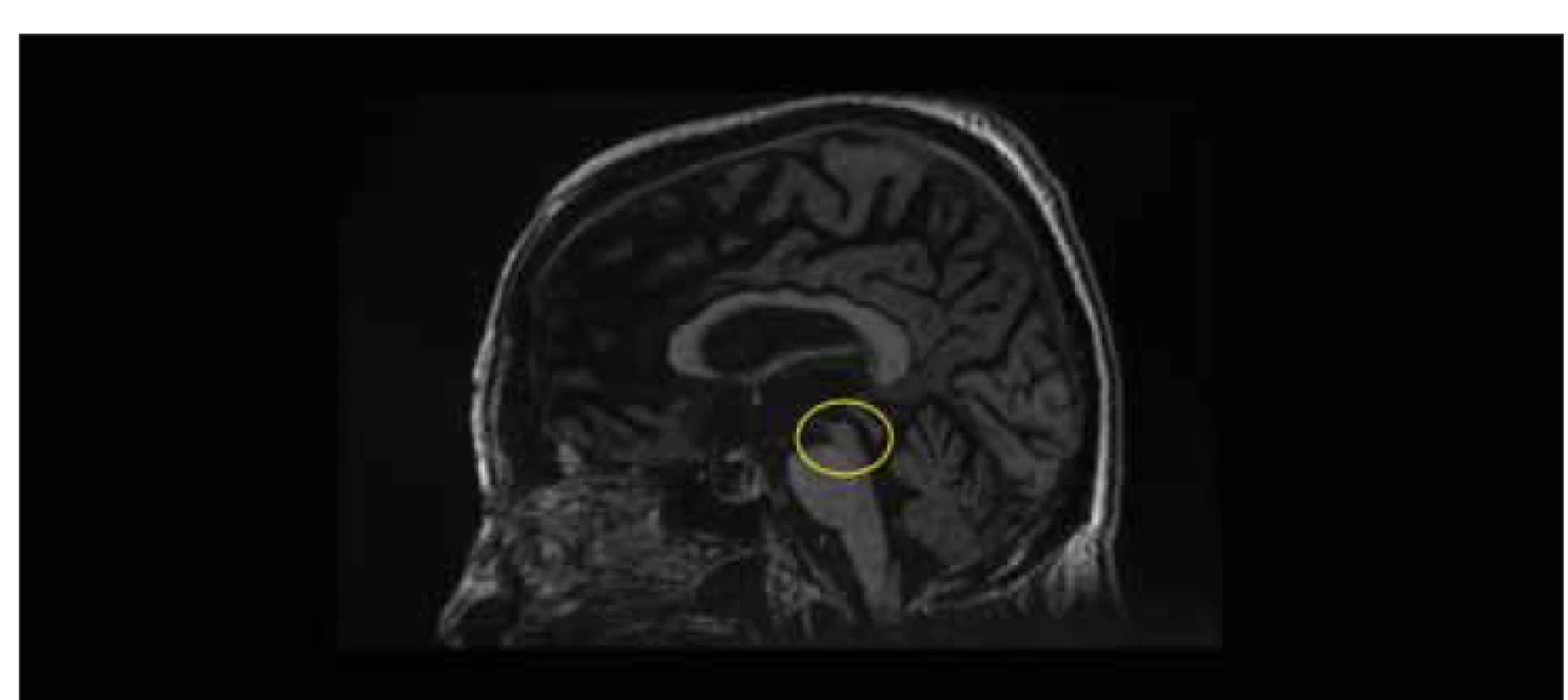
Fig. 7. MRI, T2-weighted image, axial plane, T1-weighted image, coronal plane. Patient
under testing for suspected idiopathic normal pressure hydrocephalus. Clinical symptoms
were more indicative of Alzheimer‘s disease. Functional testing was negative. The
patient was subsequently diagnosed with Alzheimer‘s disease. Note the cortical atrophy
(yellow circle), hippocampal atrophy (green circle), and free subarachnoid spaces on
convexities (orange circle).
Závěrem je nutné říci, že pokud je diagnóza pravděpodobného iNPH potvrzena, neměly by AD či léze cévní etiologie být kontraindikací k zavedení zkratu [201]. Při indikaci zkratové operace by mělo být individuálně přihlédnuto k rizikům spojeným s komorbiditami [207]. Jelikož je diferenciální diagnostika široká a výskyt komorbidit je častý, je nezbytné, aby neurochirurg využil spolupráce s neurology a event. s dalšími specialisty během sledování pacientů po operaci a aby neindikované pacienty referoval k další observaci [208]. Při progresi symptomů směrem k iNPH je nutné zvážit opakování diagnostického procesu.
Výběr chirurgických kandidátů
V současné době se výběr chirurgických kandidátů opírá o různé doporučené postupy, jelikož je potvrzením diagnózy NPH odpověď na zkratovou operaci při splnění již předoperačně stanovených diagnostických kritérií, což má samo o sobě svá omezení. V roce 2021 byla publikována vyšla aktualizovaná verze hojně používaných japonských iNPH guidelines. V rámci diagnostického procesu je diagnóza stratifikována do několika skupin dle splnění určitých kritérií. V prvé řadě jsou základem klinické symptomy se základními grafickými charakteristikami NPH. Dále do hry vstupují již specifické morfologické a klinické projevy onemocnění. Následují invazivní testy – často TT (obr. 8) [11].
ICP – nitrolební tlak; iNPH – idiopatický normotenzní hydrocefalus
Fig. 8. Diagram of the iNPH diagnostic process from Japanese guidelines [11].
ICP – intracerebral pressure; iNPH – idiopathic normal pressure hydrocephalus
![Schéma diagnostického procesu iNPH z japonských doporučených postupů [11].<br>
ICP – nitrolební tlak; iNPH – idiopatický normotenzní hydrocefalus<br>
Fig. 8. Diagram of the iNPH diagnostic process from Japanese guidelines [11].<br>
ICP – intracerebral pressure; iNPH – idiopathic normal pressure hydrocephalus](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image_pdf/9820c604bc5eaa8f73508a860d1ce3b6.png)
Západní svět se více opírá o diagnostické postupy od Relkina et al (2005) [5]. Jejich nevýhodou je absence zohlednění výsledků studií, které byly dostupné až po jejich publikaci. Jedná se především o závěry japonských studií [209,210] týkajících se DESH a mimo jiné studií o moderních zkratových systémech [211,212]. Jejich výhodou je naopak přesnější popis klinických symptomů pacientů s NPH. Více se také klade důraz na výsledky funkčního testování diverze mozkomíšního moku v podobě LIT a ELD [156]. V souladu s literární rešerší doporučujeme v průběhu testování provést LIT s následnou 120h ELD [89]. Výsledky multicentrické iNPH studie z tohoto pohledu byly sice nejednoznačné [167], nicméně při rozhodnutí o indikaci zkratové operace může LIT přesto přinést cenné informace [163]. V rámci naší poslední studie pacienti indikovaní k implantaci VP zkratu s ohledem na výsledek ELD dosahovali vyšší úrovně zlepšení po operaci, než je obvyklé [79]. Jestli tím bylo od indikace operace upuštěno u pacientů, kteří by z implantace těžili nějaký užitek, není jisté.
Nedávná studie ukázala, že pacienti dosahují v průměru největšího zlepšení po operaci při trvání symptomů asi 9,5 měsíce před operací [213]. Není však jisté, zda by (s ohledem na současné poznatky o patofyziologii iNPH) dřívější implantace zkratového systému nebyla pro pacienty výhodou. Proto doba trvání příznaků při indikaci operace nehraje roli. Dále bylo pozorováno, že je periventrikulární bílá hmota v průběhu onemocnění hypoperfundována a dochází k její ischemii [214]. Proto není jasné, zda je hypotéza zlepšení symptomů po provedení dočasné diverze mozkomíšního moku dostatečná k výběru chirurgických kandidátů. Jisté však je, že pacienti, kteří nejsou k operaci indikováni, nebo se po operaci nezlepší, musí být dále sledováni a případně musí být přehodnocena diagnóza dle výsledků provedených testů. Přes všechny nejasnosti ve výběru chirurgických kandidátů je efekt zkratové operace v souvislosti s kvalitou života pacientů s iNPH nesrovnatelně vyšší, než je efekt farmakoterapie na kvalitu života při AD [215].
Terapie
Procedury
Základní léčba NPH je chirurgická. Chirurgické procedury používané při léčbě NPH jsou až na výjimky stejné jako u jiných typů komunikujícího hydrocefalu. Patří mezi ně zejména VP, ventrikuloatriální (VA) a lumboperitoneální (LP) zkrat [216]. Implantace zkratového systému je jedinou důkazy podloženou léčbou NPH. Implantace VP zkratu je v současné době upřednostňována před jinými postupy [217] a vede ke klinickému zlepšení v 70–90 % případů [218].
Ventrikuloperitoneální zkrat
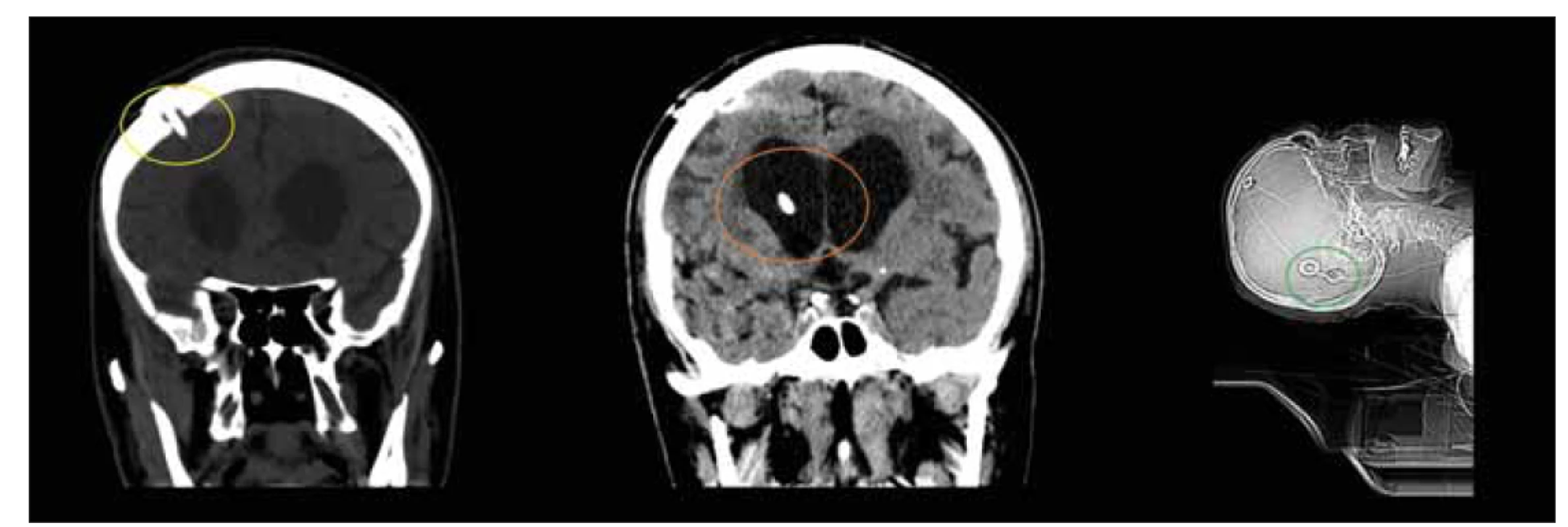
Implantace VP zkratu je nejčastější léčbou NPH v Severní Americe a Evropě – její spolehlivost je podporována většinou publikací [11,219,220] a výsledné zlepšení lze po implantaci zkratu udržet i mnoho let [64,221]. Principem operace je implantace systému, který odvádí mozkomíšní mok z komorového systému – nejčastěji z laterální komory – do břišní dutiny, kde se přes peritoneum vstřebává (obr. 9). Součástí systému je regulující prvek, ventil, který kontroluje průtok moku systémem [216]. Detailní popisy výkonů jsou nad rámec této publikace.
Fig. 9. CT, coronal and sagittal plane. Patient on the day after the implantation of ventriculoperitoneal shunt. Note the positions of the
burrhole (yellow circle) and ventricular catheter (orange circle) when implanting the ventricular catheter from the Kocher point. It is
important to achieve a position parallel to the longitudinal axis of the body when implanting gravity valves (green circle).
Ventrikuloatriální zkrat
Ventrikuloatriální zkrat je systém odvádějící mozkomíšní mok z mozkové komory do pravé srdeční síně. VA zkrat je spojen se specifickými komplikacemi vč. endokarditidy, zkratové nefritidy, sepse, plicní embolie a plicní hypertenze [222,223]. Nedávno publikované studie však uvádějí nízkou prevalenci těchto komplikací u pacientů s iNPH [223,224]. Pro technicky obtížnější zavedení distálního katetru, prevalenci kardiovaskulárních onemocnění u starších pacientů a potenciál závažných komplikací VA zkratu je upřednostňován VP zkrat. Ovšem u pacientů s patologiemi v břišní dutině (ascites, břišní adheze, morbidní obezita, stavy po rozsáhlých chirurgických výkonech v dřívějším období a jiné) může být VA zkrat lepší volbou [224–226].
Lumboperitoneální zkrat
Lumboperitoneální zkrat odvádí mozkomíšní mok z lumbálního prostoru do břišní dutiny. Implantace LP zkratu se v posledních letech stále častěji stává léčbou první volby pro iNPH v Japonsku. V roce 2011 bylo v Japonsku dokonce léčeno více pacientů LP zkratem než VP zkratem [227,228]. Nedávno publikované studie právě z Japonska ukázaly, že klinické zlepšení po implantaci LP zkratu je srovnatelné s tím po VP zkratu [209,227, 229–232]. Specifickou komplikací je zejména radikulopatie, která může vzniknout po špatné implantaci, ale i posunutím proximálního katetru v lumbálním subarachnoidálním prostoru. Zároveň je vyšší riziko předrénování, které může mít za následek dokonce i tonzilární herniaci, a u pacientů s degenerativním onemocněním bederní páteře může být správná funkce systému nejistá a implantace obtížná [209,230,233]. Při diagnostické přesnosti invazivních testů diverze mozkomíšního moku z lumbálního subarachnoidálního prostoru (TT, ELD) je však LP zkrat logickou alternativou [233] zvláště u pacientů, kteří by nepřijali kraniální operaci [209]. Programovatelné ventily pro LP zkraty již byly představeny, a tak lze funkci těchto systémů lépe regulovat [234].
Další metody
Endoskopická třetí ventrikulostomie (ETV) by mohla umožnit vyšší systolický průtok mozkomíšního moku ze třetí komory do interpedunkulární a prepontinní cisterny, a tak teoreticky snížit pulzní napětí na stěnách komorového systému [235]. Principem je vytvoření otvoru vespod III. komory, a tedy vytvoření zkratu mezi komorovým systémem a bazálními cisternami. Vzhledem k současným patofyziologickým poznatkům je role ETV v léčbě iNPH více než kontroverzní [236]. V literatuře je velmi slabá podpora, a proto v současné době nelze tuto metodu doporučit [236]. ETV však musí být zvážena u pacientů s klinickými příznaky NPH s funkční stenózou aqueductu mesencephali [237].
Existují další, zřídka využívané metody spojené zejména s výběrem místa inserce distálního katetru – ventrikulopleurální [238], lumbopleurální [239], či ventrikulosternální zkrat [240] – které mohou být použity jako alternativa v podmínkách, kde jsou běžně užívané výkony kontraindikovány. Modifikace VP zkratu – ventrikuloepiploický zkrat – by mohla snížit míru možných břišních komplikací [241]. Literatura je však omezena na kazuistiky či drobné soubory, a proto nelze žádnou z těchto metod doporučit k preferenci před klasickými metodami.
Zkratové systémy
Zkratové systémy slouží k diverzi toku mozkomíšního moku. Součástí naprosté většiny těchto systémů je ventil, což je prvek, který reguluje tok mozkomíšního moku procházející systémem, event. i se změnami v závislosti na poloze pacienta. Existují dvě skupiny ventilů: ventily diferenčního tlaku (DP) a hydrostatické ventily (HV). Ty jsou buď fixní nebo nastavitelné. Fixní DP ventily jsou buď silikonové-štěrbinové, membránové nebo, nejčastěji, na podkladě kuličky uvnitř kužele. HV ventily regulují průtok pomocí gravitačního, nebo antisifonového zařízení (anti siphon device; ASD), nebo jsou to zařízení, která přímo snižují průtok (FR). Gravitační mechanizmus HV ventilů byl vyvinut už i v nastavitelné verzi [242]. Většina ventilů je k dispozici pro všechny techniky operace (tab. 3) [243]. Neurochirurg musí k minimalizaci možných chyb znát jejich vlastnosti, tlakové poměry u různých technik a specifické vlastnosti různých systémů [244].
![Typy dostupných zkratových zařízení a vybraní zástupci z celkem více než 280 různých ventilů [243].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image_pdf/33bb5f47103bc8e9ca73ffe94f0b0fbc.png)
Je nutno říci, že prospektivní randomizované klinické studie nenašly významné rozdíly ve zlepšení pacientů s NPH po implantaci různých typů ventilů [74,245]. Nedávno se však ukázaly rozdíly zejména ve výskytu komplikací. Lemcke et al [212] v roce 2013 ukázali, že implantace proGAV (programovatelný DP ventil s ASD zařízením) byla spojena se sníženou mírou výskytu předrénování a vyšším skóre mentálních komponent (MCS-12) ve srovnání se skupinou pouze s programovatelným DP ventilem během jednoho roku sledování. Japonské iNPH guidelines (2021) [11] upřednostňují programovatelné ventily s nebo bez přídavného HV jako ventil první linie. Giordan et al [9] v metaanalýze pro tato doporučení předložili argumenty (nižší počet komplikací z předrénování u programovatelných ventilů ve srovnání s fixními ventily – 12 vs. 32 % revizí; 9 vs. 22 % subdurálních kolekcí). Porovnání bezpečnosti a účinnosti nastavitelných ventilů a fixních ASD je v současné době v procesu [246]. Recentní retrospektivní studie Schefflera et al [247] ukázala možný benefit FR ventilů v porovnání s gravitačními ventily, nicméně jejich preferenci na podkladě těchto poznatků nelze doporučit. V práci je navíc významně delší průměrná doba pooperačního sledování ve skupině s gravitačními ventily oproti FR skupině.
Pooperační péče
Po implantaci zkratu je pacient obvykle umístěn na JIP. V rámci hospitalizace je provedena CT mozku k vyloučení chirurgické komplikace a k ověření pozice komorového katetru. První den po operaci je zahájena rehabilitace a pacient je schopen dimise či překladu k další péči většinou 3.–4. den po operaci. Po implantaci zkratu by měl být pacient sledován doživotně v ambulanci neurochirurga. Doporučené intervaly kontrol v prvním roce po zavedení zkratu se v literatuře liší, ale většina autorů doporučuje vyšetření po 1 nebo 3, 6 a 12 měsících po zavedení zkratu a poté jednou ročně s možností dalších úprav podle změn klinických příznaků [116,248]. První kontrola by měla identifikovat komplikace spojené s chirurgickým zákrokem (stav ran) a zhodnotit vývoj klinických příznaků. Mělo by se provést vyšetření CT, aby se zkontrolovala velikost komorového systému a vyloučil případný rozvoj subdurálních kolekcí. V případě implantace programovatelných ventilů se pak může provést úprava nastavení. Dále by měl neurochirurg pacienta sledovat klinicky a podle potřeby provést vyšetření CT a upravit nastavitelný ventil podle vývoje. Důležitou součástí pooperační péče je další sledování neurologem, zejména z hlediska neurodegenerativních komorbidit. Jedině spolupráce může přinést optimální klinický výsledek. Pacientům, kteří nebyli indikováni k chirurgickému zákroku na základě prediktivních testů, je doporučena další neurologická dispenzarizace k upřesnění výsledné klinické diagnózy a zajištění adekvátní terapie.
Výsledky
Klinické výsledky léčby pacientů s NPH se v literatuře liší. To se stává z důvodu různých indikačních kritérií, jiného pooperačního sledování, míry komorbidit, různé doby trvání nebo míry klinických příznaků a dalších faktorů [249–252]. Giordan et al (2019) [9] ukázali, že se po operaci zlepšuje v průměru 75 % pacientů bez ohledu na indikační kritéria vybraných studií. Do roku 2002 neexistovala žádná studie, která by porovnávala výsledky zkratové operace s randomizovanou kontrolní skupinou [253]. V posledních letech však bylo několik takových studií provedeno. Např. Kazui et al (2015) [209] ukázali signifikantně vyšší klinické zlepšení ve 3 měsících po LP zkratu definovaném jako zlepšení o 1 nebo více bodů na modifikované Rankinově škále (modified Rankin scale; mRS) u pacientů operovaných ihned po stanovení diagnózy (65 %) než u pacientů, kteří byli indikováni, ale teprve budou operováni (5 %). Také Nakajima et al (2018) [232] zveřejnili výsledky celostátního nemocničního průzkumu v Japonsku, ve kterém porovnávali výsledky pacientů, kteří podstoupili zkratovou operaci s neoperovanými kontrolami (pomocí mRS), a operovaní pacienti dosáhli významného zlepšení v ročním sledování bez ohledu na typ zkratové operace. Navíc se v Japonsku zjistilo, že VP a LP zkrat je nejen klinicky, ale také ekonomicky efektivní, s návratností investic do 2 let [254]. Prospektivní evropská multicentrická iNPH studie ukázala 69 % zlepšených pacientů při použití mRS (zlepšení o jeden bod) a dokonce 84 % pomocí věkově normované iNPH škály (zlepšení o pět bodů). Indikace operace byla založena na různých klinických a radiologických kritériích a probíhala bez randomizované kontrolní skupiny [255]. Většího procenta zlepšení lze dosáhnout pomocí přísných diagnostických a léčebných protokolů [184]. Např. Poca et al (2012) [256] představili klinické zlepšení u téměř 90 % pacientů (při zlepšení o minimálně jeden bod v iNPH škále). Zlepšení lze navíc udržet několik let [221] i přes případné revize zkratu [10].
Při současných znalostech o patofyziologii onemocnění a častém výskytu neurodegenerativních a jiných komorbidit je způsob výběru chirurgických kandidátů zaměřen k očekávanému zlepšení klinických symptomů po operaci. Potvrzením diagnózy NPH je výsledek zkratové operace. Indikace jsou obvykle vedeny s použitím doporučení a analýzy funkčních vyšetření [11,156]. Není jisté, zda má smysl operovat i pacienty, kteří se nezlepší po ELD na základě klinických příznaků a nálezu na MR. Porucha chůze je příznakem, který má největší pravděpodobnost zlepšení po operaci [10,221,252]. Nicméně Peterson et al (2016) [257] v metaanalýze 23 studií zaměřených na kognitivní výkonnost po zkratu ukázali zlepšení i ve verbálním učení, paměti a zrychlení psychomotorického tempa, přičemž kognitivní zlepšení z terapie u iNPH je výraznější než u farmakologické léčby AD [258]. Idiopatický NPH postihuje staré pacienty. Mnoho z nich má další komorbidity a po operaci se zlepší pouze v jednom nebo dvou příznacích z trias. Pokud k tomu dojde, měl by být tento příznak dále vyšetřen a může být nutné, aby byl pacient odeslán k jinému specialistovi, např. urologovi k vyhodnocení močových příznaků [217]. Hlášené rozdíly ve výsledcích lze proto částečně vysvětlit prevalencí komorbidit a jejich řádná identifikace by měla být ústřední součástí diagnostiky iNPH [200]. Je však třeba připomenout, že při dlouhodobém sledování možných pacientů s NPH (possible iNPH – dle Japonských doporučení) [11] neměly patologické změny spojené s AD u kortikální biopsie vliv na přežití [204].
Komplikace
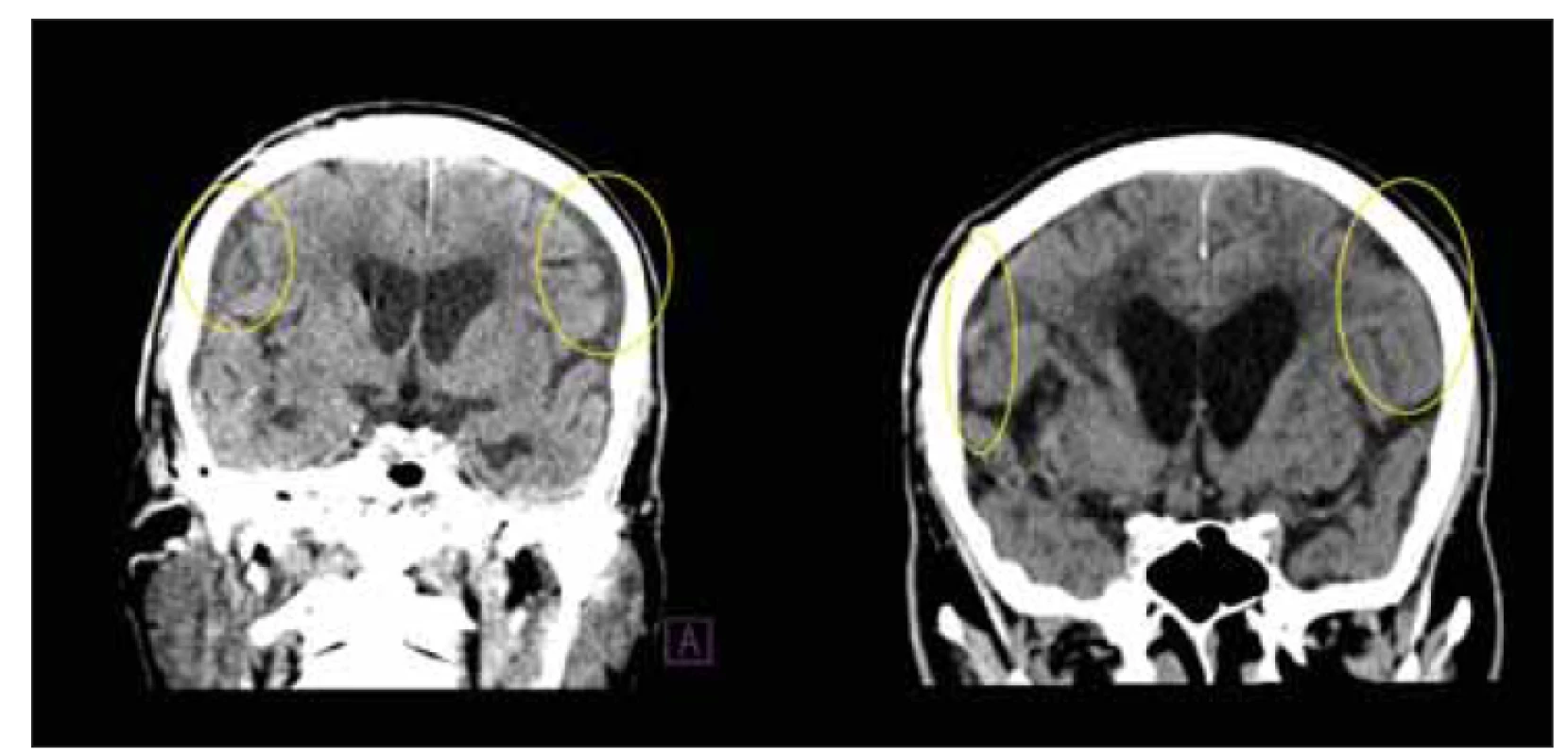
Hebb et al (2001) [157] provedli metaanalýzu 44 článků. Celkem 59 (24–100) % pacientů se po zavedení zkratu zlepšilo s průměrnou mírou komplikací zkratu ve 38 (5–100) % případů, 22 (0–47) % pacientů potřebovalo další chirurgický zákrok a u 6 (0–35) % pacientů vedla implantace zkratu k trvalému neurologickému deficitu nebo smrti. Od vydání této metaanalýzy však byly vyvinuty nové technologie ventilů a pozdější studie uvádějí nižší míru komplikací [20,259,260]. Giordan et al (2019) [9] v metaanalýze zjistili nižší počet komplikací z předrénování u programovatelných ventilů ve srovnání s fixními ventily (12 vs. 32 % revizí; 9 vs. 22 % subdurálních kolekcí). Nejčastější komplikací zkratové léčby jsou malpozice, akutní subdurální nebo intracerebrální hematom, infekce zkratu nebo jeho obstrukce. Nejčastější klinické příznaky z předrénování jsou posturální bolesti hlavy, diplopie, hypakuze nebo příznaky spojené s vývojem subdurální kolekce (obr. 10) či chronického subdurálního hematomu. Naopak poddrénování, které by mohlo být způsobeno špatným nastavením nebo obstrukcí ventilu, se projevuje jako omezené klinické zlepšení či progrese symptomů [94,184,219,260,261]. Předrénování je většinou spojeno se sifonovým mechanizmem [262]. Když pacient za normálních okolností změní polohu z polohy na zádech do polohy vsedě nebo vstane, ICP se může snížit dokonce až na subatmosférické hodnoty [263]. Když je však pacient s implantovaným VP zkratem ve vzpřímené poloze, hydrostatický tlak z rozdílu mezi špičkou komorového katetru a peritoneálního katetru udržuje průtok systémem, i když se ICP stává negativním [264]. HV ventily zabraňují nadměrnému odtoku [212,260] a v kombinaci s nízkým nastavením DP ventilu by v případě programovatelnosti jednotky s komplexním chirurgickým protokolem mohly vést k lepšímu klinickému výsledku [74,212]. Programovatelný ventil je obvykle nastaven zprvu na vyšší hodnotu tlaku s postupnou titrací na nižší hodnoty. S vyšším nastavením je však spojeno možné oddálení nebo znemožnění klinického zlepšení [265]. I když jsou programovatelné ventily cenově více nákladné, může být rozdíl vyvážen, pokud se vezmou v úvahu náklady na pravděpodobnou léčbu komplikací – nemluvě o etických důsledcích [266]. Obstrukce zkratu u iNPH je obvykle spojena s postupným návratem příznaků vznikajícím dny až týdny před tím, než příznaky zpozoruje pacient nebo jeho okolí. Před revizí ji lze rozpoznat radionuklidovou studií průchodnosti systému či infuzní studií ventilem [267] a většinou nastává ve ventilu nebo distálním katetru. V případech, kdy byla zjištěna a léčena, se 75 % pacientů znovu zlepšilo [261].
Fig. 10. CT, coronal plane. Subdural collections in a patient after ventriculoperitoneal
shunt implantation. The valve opening pressure has been increased. After 14 days, the
collections were absorbed on the control CT (yellow circles).
Míra infekcí zkratů může být snížena zavedením komplexních chirurgických protokolů, dezinfekcí pokožky chlorhexidin-alkoholem, výměnou rukavic, v ČR samozřejmou perioperační aplikací intravenózních antibiotik [268] a implantací zkratového systému impregnovaného antibiotiky [268–270]. Předoperační sprchování kožními antiseptiky obecně nemá žádnou výhodu oproti jiným mycím prostředkům [271]. Vliv antikoagulační terapie na komplikace zkratové operace byl hodnocen Goodwinem et al (2007) [272] a bylo zjištěno, že antikoagulační léčba není kontraindikací pro přítomnost zkratu.
Na závěr je nutné dodat, že ve staré populaci pacientů (obvykle v průměru nad 70 let věku) je při delším sledování potřeba vhodně rozlišovat komplikace spojené se zkratem s komplikacemi jiných onemocnění [157,273].
Farmakoterapie
Význam farmakoterapie je v léčbě NPH takřka minimální. Farmakoterapie by měla být zvažována pouze u pacientů, kteří by byli indikováni k chirurgickému zákroku, ale z interního či jiného hlediska operaci podstoupit nemohou [88]. I když léčba acetazolamidem může snížit periventrikulární hyperintenzity bílé hmoty, není vhodná pro dlouhodobé použití [274]. Přechodné zvýšení ICP [275] nebo oploštělé zvýšení CBF [152] u pacientů s NPH po dávce acetazolamidu bylo shledáno jako užitečné při indikaci zkratové operace. Avšak výsledky takového testu jsou omezeny stavem cerebrovaskulárního systému a v současné době tento test není klinicky používán [275].
Předpokládalo se, že enzymatické rozpouštění krevní sraženiny po subarachnoidálním krvácení tkáňovým aktivátorem plazminogenu (tPA), urokinázou nebo streptokinázou má potenciální přínos v prevenci sekundárního zánětu a fibrózy v cestách mozkomíšního moku [276]. Ačkoli neexistují studie zahrnující pouze pacienty se sNPH, intratekální ani intraventrikulární podávání těchto látek nemělo žádný vliv na závislost pacientů na zkratu (vyjadřuje stav, při kterém přirozené cesty toku mozkomíšního moku pacienta s hydrocefalem nedostačují své funkci, a je tak nadále nutná diverze mozkomíšního moku zkratem) a funkční výsledek po aneuryzmatickém subarachnoidálním krvácení [276,277]. Tkáňový aktivátor plazminogenu měl spíše prozánětlivý účinek než naopak [278]. Podobně pro další protizánětlivé látky, jako např. glukokortikoidy, nebyly předloženy žádné důkazy o prevenci rozvoje hydrocefalu a interference s cestou TGF-1 vyžaduje ještě další preklinické testování [276].
Porucha regionálního průtoku krve je u pacientů s NPH dobře zdokumentována [279,280], ale není zcela jasné, zda je to pouze mechanický jev, nebo zda má potenciální roli v patogenezi iNPH [280]. Nicméně hypoperfuze periventrikulární bílé hmoty přispívá k patogenezi poškození axonů [281]. Hyperlipidemie, diabetes mellitus, obezita, arteriální hypertenze a další vaskulární rizikové faktory jsou nadměrně zastoupeny u pacientů s iNPH [31]. Změny vaskulárních pulzací s možným spojením s těmito rizikovými faktory mohou být přispívajícím faktorem v patofyziologii iNPH [282–284]. Proto se předpokládalo, že by vazoaktivní léky mohly mít potenciál při léčbě hydrocefalu. Jediná studie týkající se NPH používající nimodipin v léčbě osmi pacientů efekt neprokázala [285]. Nakonec jedna kazuistika ukázala u pacientky s NPH zlepšení kognitivních funkcí a snížení apatie při administraci methylfenidátu, ale obecný přínos této terapie pro NPH je nejasný [286]. Závěrem lze říct, že za posledních 50 let výzkumu nebyla objevena natolik účinná nechirurgická terapie pro jakékoli dospělé pacienty s hydrocefalem, kterou by bylo možné srovnat se zkratovou operací. Stále však existují cíle pro další výzkum, proto se v tomto ohledu ještě očekává další vývoj [276].
Prospektivní výzkum
Prospektivní výzkum je veden ke zvýšení přesnosti diagnostických nástrojů, predikci nastavení ventilů a obecně ke zdokonalení zkratových technologií [12]. Výběr chirurgických kandidátů je stálou výzvou pro management NPH [5]. Biomarkery by mohly v budoucnu pomoci při vhodnějším výběru pacientů pro zkratovou operaci. Neurosteroidy (PREG, DHEA, jejich sulfáty a metabolity) se zdají být slibnými analytiky při hledání biomarkerů NPH. Ve studii Sosvorové et al (2015) [193] navrhovaný model OPLS radikálně rozlišoval NPH a zdravé kontroly na základě steroidů v mozkomíšním moku s potenciálem předpovědět progresi nemoci [194] a výsledek implantace VP zkratu [287]. Zatímco nižší 7-hydroxy-DHEA je poměrně příznačná pro AD [288], snížené hladiny všech 7-hydroxy DHEA metabolitů byly nalezeny u NPH [193]. Kromě toho byly u NPH hlášeny také významné změny vybraných cytokinů před a po implantaci VP zkratu [289]. Další markery byly zmíněny v příslušné kapitole.
Moderní metody MR, jako je DTI, by mohly být cenné v diferenciální diagnostice NPH, ale je třeba zlepšit jejich klinickou použitelnost [290,291]. Multimodalita dat získaných MR poskytuje dobrý základ pro moderní přístupy, vč. 3D-deep learningu při automatické segmentaci bílé hmoty, šedé hmoty a mozkomíšního moku, a to dokonce i v případě větších deformací nebo patologií [292]. Proto by prognostické specifikace na MR u pacientů s NPH mohly být v budoucnu hodnoceny pomocí přístupů 3D-deep learningu. Podobně by mohla kombinace různých předoperačních diagnostických a hodnotících metod sloužit jako komplexní klinimetrická baterie k identifikaci pacientů, pro které by zkrat byl přínosem [69]. Nedávná studie ukázala 90% přesnost deep learningové metody v identifikaci iNPH, AD pacientů a kontrol [293]. Telemetrické zjištění ICP by s případnou změnou nastavení ventilu mohlo být využíváno i u pacientů s NPH [294]. Vytvořit zkratovou technologii s cílem dosáhnout co nejlepšího fyziologického stavu intrakraniální distribuce mozkomíšního moku je stálým předmětem zájmu [243]. Výběr kandidátů na zkrat, hodnocení komorbidit a pooperační sledování však vždy budou vyžadovat multidisciplinární přístup [295].
Závěr
Normotenzní hydrocefalus je možnou sekundární příčinou demence. Onemocnění je nezbytné znát, neboť lze jeho průběh do jisté míry zvrátit. Základní dělení je na sekundární a idiopatický hydrocefalus. Sekundární může vzniknout v jakémkoli věku na podkladě základního mechanizmu (meningitidy, subarachnoidálního krvácení apod.) a jeho průběh bývá rychlejší. Idiopatický je základní diferenciální diagnózou neurodegenerativních onemocnění, neboť vzniká pozvolna a obvykle po 65. roku. Příčiny této formy nejsou dostatečně objasněny. Diagnostika vyžaduje znalost klinických projevů – poruchy chůze, kognitivní deficit, močová inkontinence – spolu s detaily těchto symptomů i v rámci diferenciálních diagnóz. Zobrazovací vyšetření – zejména MR a CT – jsou pro diagnózu nezbytné. Hodnota Evansova indexu větší než 0,3 při hodnocení ventrikulomegalie je k diagnóze nezbytná. Další charakteristiky, jako např. DESH, jsou pouze pomocné. Invazivní funkční vyšetření (LIT, TT, ELD) jsou základem výběru chirurgických kandidátů a jsou určeny k predikci výsledků následné implantace zkratu. Diagnostický proces a výběr kandidátů k operaci je veden s ohledem na západní a japonská doporučení. Zlepšení po operaci je dosahováno u 75 % pacientů, proto je výzkum směřován k vytvoření přesnějších a nejlépe neinvazivních vyšetření k identifikaci chirurgických kandidátů. Výsledky jsou však zatím mnohdy kontroverzní a prozatím žádná z těchto metod klinické užití nemá. Léčba normotenzního hydrocefalu je výhradně chirurgická. Spočívá v implantaci zkratu, systému odvádějícího mozkomíšní mok z komorového systému, nebo lumbálního subarachnoidálního prostoru nejčastěji do peritoneální dutiny. Průběh onemocnění lze léčbou do značné míry zvrátit a nechodící pacient může být opět schopen chůze. Zkratová zařízení jsou modifikována tak, aby dokázala zajistit co nejlepší fyziologickou dynamiku mozkomíšního moku. Výsledky s použitím moderních programovatelných zařízení účelnost úprav potvrzují. Další výzkum je směřován nejen na zlepšení funkce těchto systémů, ale i na zlepšení identifikace chirurgických kandidátů. Bude nutné dále upřesnit patofyziologické mechanizmy vedoucí k vývoji tohoto onemocnění.
Seznam zkratek
Ab – amyloid b
AD – Alzheimerova nemoc
ADAS – Alzheimer Diseases Assessment Scale
AQP4 – aquaporin 4
ASD – antisifonová zařízení
AVLT – auditorně-verbální test učení
BFI – bifrontální index
CA – úhel corpus callosum
CBF – průtok krve mozkem
DESH –hydrocefalus s disproporčně zvětšenými subarachnoidálními prostory
DHEA – dehydroepiandrosteron
DP ventily – ventily diferenčního tlaku
ELD – prodloužená lumbální drenáž
eLORETA – elektromagnetická mozková tomografie s nízkým rozlišením
ETV – endoskopická ventrikulostomie třetí komory
FOR – poměr frontálního k okcipitálnímu rohu
FR – průtok regulující zařízení
GDS – Geriatric Depresion Scale
HV – hydrostatické ventily
ICIq – International Consultation of Incontinence questionnaire
ICP – intracranial pressure – nitrolební tlak
iNPH – idiopatický normotenzní hydrocefalus
LIT – lumbální infuzní test
LRG – a-2-glykoprotein bohatý na leucin
LUTS – lower urinary tract symptoms – symptomy dolní části močového traktu
LP – lumboperitoneální
MCS-12 – skóre mentálních komponent (součást SF 12 Health Survey®)
MOCA – Montrealský kognitivní test
MMSE – Mini-Mental State Examination
MRE – MR elastografie
mRS – modifikovaná Rankinova škála
NPH – normotenzní hydrocefalus
OAB – hyperaktivní močový měchýř
OSA – obstrukční spánková apnoe
PD – Parkinsonova nemoc
PREG – pregnenolon
ROCFT – test Reyovy-Osterriethovy komplexní figury
Rout – odpor k odtoku mozkomíšního moku
sNPH – sekundární normotenzní hydrocefalus
TMT A+B – Trail Making test A+B
tPA – tkáňová aktivátor plazminogenu
TT – tap test
VA – ventrikuloatriální
VP – ventrikuloperitoneální
WAIS-III – subtest Wechslerovy inteligenční škály dospělých III
Finanční podpora
Podpořeno grantem GAUK č. 1068120 a Studentským grantem ČVUT SGS21/162/OHK4/3T/13. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Konfliktu zájmů
Autoři nemají v souvislosti s touto minimonografií žádný konflikt zájmů.
doc. MUDr. RNDr. Ondřej Bradáč, Ph.D.
Ondřej Bradáč absolvoval 1. LF UK a MFF UK (obor biofyzika a chemická fyzika) v roce 2006. Již během studií se připojil k týmu profesora Vladimíra Beneše v ÚVN, kde po promoci nastoupil jako neurochirurg a zároveň započal svá postgraduální studia neurověd na 1. LF UK. Hlavním tématem postgraduálního studia byla cévní problematika v neurochirurgii a toto studium ukončil obhajobou disertační práce „Treatment for brain arteriovenous malformations“ v roce 2015. Během své předatestační přípravy absolvoval kurzy European Association of Neurosurgical Societies a v letech 2009–2010 zahraniční stáž na Neurochirurgickém oddělení Royal Hallamshire Hospital, Sheffield, Velká Británie, kde se věnoval především cévní a stereotaktickou neurochirurgii. Problematice stereotaxe se věnoval i ve své habilitační práci „Využití bezrámových stereotaktických metod v léčbě intrinsických nádorů mozku“, která byla obhájena na 1. LF UK v roce 2018. Vzhledem ke svému matematicko-fyzikálnímu vzdělání se ve své vědecké činnosti nadále věnuje oblastem na pomezí medicíny a přírodních věd – se svými studenty publikoval práce týkající se počítačového zpracování biosignálu a využití metod strojového učení v diagnostice a léčbě normotenzního hydrocefalu. Od 1. 1. 2021 pracuje na Neurochirurgické klinice dětí a dospělých 2. LF UK a FN Motol jako zástupce přednosty. Ondřej Bradáč publikoval 77 impaktovaných prací s celkovým počtem 683 citací a jeho H-index je 17. Též je s prof. Vladimírem Benešem spolueditorem 2 monografií vydaných nakladatelstvím Springer: „Brain Arteriovenous Malformation. Pathogenesis, Epidemiology, Diagnosis, Treatment and Outcome“ z roku 2017 a „Cavernomas of the CNS: Basic Science to Clinical Practice“ z roku 2020.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
doc. MUDr. RNDr. Ondřej Bradáč, Ph.D.
Neurochirurgická klinika dětí a dospělých
2. LF UK a FN Motol
V Úvalu 84
Praha
150 06
e-mail: ondrej.bradac2@fnmotol.cz
Přijato k recenzi: 16. 7. 2021
Přijato do tisku: 9. 12 2021
Zdroje
1. Hakim S, Adams RD. The special clinical problem of symptomatic hydrocephalus with normal cerebrospinal fluid pressure. Observations on cerebrospinal fluid hydrodynamics. J Neurol Sci 1965; 2 (4): 307–327. doi: 10.1016/0022-510x (65) 90016-x.
2. Hashimoto M, Ishikawa M, Mori E et al. Diagnosis of idiopathic normal pressure hydrocephalus is supported by MRI-based scheme: a prospective cohort study. Cerebrospinal Fluid Res 2010; 7 : 18. doi: 10.1186/1743-8454-7-18.
3. Marmarou A, Bergsneider M, Relkin N et al. Development of guidelines for idiopathic normal-pressure hydrocephalus: introduction. Neurosurgery 2005; 57 (3 Suppl): S1–3. doi: 10.1227/01.NEU.0000168188.25559.0E.
4. Patterson C. World Alzheimer report 2018. Alzheimer’s Disease International 2018.
5. Relkin N, Marmarou A, Klinge P et al. Diagnosing idiopathic normal-pressure hydrocephalus. Neurosurgery 2005; 57 (3 Suppl): S4–16. doi: 10.1227/01.NEU.0000168185.29659.C5.
6. Martín-Láez R, Caballero-Arzapalo H, López-Menéndez LÁ et al. Epidemiology of idiopathic normal pressure hydrocephalus: a systematic review of the literature. World Neurosurg 2015; 84 (6): 2002–2009. doi: 10.1016/j.wneu.2015.07.005.
7. Lemcke J, Stengel D, Stockhammer F et al. Nationwide incidence of normal pressure hydrocephalus (NPH) assessed by insurance claim data in Germany. Open Neurol J 2016; 10 : 15–24. doi: 10.2174/1874205X01610010015.
8. Reddy GK, Bollam P, Caldito G. Long-term outcomes of ventriculoperitoneal shunt surgery in patients with hydrocephalus. World Neurosurg 2014; 81 (2): 404–410. doi: 10.1016/j.wneu.2013.01.096.
9. Giordan E, Palandri G, Lanzino G et al. Outcomes and complications of different surgical treatments for idiopathic normal pressure hydrocephalus: a systematic review and meta-analysis. J Neurosurg 2018; 1–13. doi: 10.3171/2018.5.JNS1875.
10. Pujari S, Kharkar S, Metellus P et al. Normal pressure hydrocephalus: long-term outcome after shunt surgery. J Neurol Neurosurg Psychiatry 2008; 79 (11): 1282–1286. doi: 10.1136/jnnp.2007.123620.
11. Nakajima M, Yamada S, Miyajima M et al. Guidelines for management of idiopathic normal pressure hydrocephalus (third edition): endorsed by the Japanese Society of Normal Pressure Hydrocephalus. Neurol Med Chir (Tokyo) 2021; 61 (2): 63–97. doi: 10.2176/nmc.st.2020-0292.
12. Fasano A, Espay AJ, Tang-Wai DF et al. Gaps, controversies, and proposed roadmap for research in normal pressure hydrocephalus. Mov Disord 2020; 35 (11): 1945–1954. doi: 10.1002/mds.28251.
13. Foltz EL, Ward AA. Communicating hydrocephalus from subarachnoid bleeding. J Neurosurg 1956; 13 (6): 546–566. doi: 10.3171/jns.1956.13.6.0546.
14. Wallenstein MB, McKhann GM. Salomón Hakim and the discovery of normal-pressure hydrocephalus. Neurosurgery 2010; 67 (1): 155–159. doi: 10.1227/01.NEU. 0000370058.12120.0E.
15. Adams RD, Fisher CM, Hakim S et al. Symptomatic occult hydrocephalus with normal cerebrospinal-fluid pressure. New Eng J Med 1965; 273 (3): 117–126. doi: 10.1056/NEJM196507152730301.
16. Daou B, Klinge P, Tjoumakaris S et al. Revisiting secondary normal pressure hydrocephalus: does it exist? A review. Neurosurg Focus 2016; 41 (3): E6. doi: 10.3171/2016.6.FOCUS16189.
17. Marmarou A, Foda MA, Bandoh K et al. Posttraumatic ventriculomegaly: hydrocephalus or atrophy? A new approach for diagnosis using CSF dynamics. J Neurosurg 1996; 85 (6): 1026–1035. doi: 10.3171/jns.1996.85.6.1026.
18. Wang C, Du H, Yin L et al. Analysis of related factors affecting prognosis of shunt surgery in patients with secondary normal pressure hydrocephalus. Chin J Traumatol 2013; 16 (4): 221–224.
19. Thomsen AM, Børgesen SE, Bruhn P et al. Prognosis of dementia in normal-pressure hydrocephalus after a shunt operation: prognosis of dementia NPH. Ann Neurol 1986; 20 (3): 304–310. doi: 10.1002/ana.410200 306.
20. Marmarou A, Young HF, Aygok GA et al. Diagnosis and management of idiopathic normal-pressure hydrocephalus: a prospective study in 151 patients. J Neurosurg 2005; 102 (6): 987–997. doi: 10.3171/jns.2005.102.6.0987.
21. Pirouzmand F, Tator CH, Rutka J. Management of hydrocephalus associated with vestibular schwannoma and other cerebellopontine angle tumors. Neurosurgery 2001; 48 (6): 1246–1253. doi: 10.1097/00006123-200106000-00010.
22. Keong NCH, Pena A, Price SJ et al. Imaging normal pressure hydrocephalus: theories, techniques, and challenges. Neurosurg Focus 2016; 41 (3): E11. doi: 10.3171/2016.7.FOCUS16194.
23. Pappenheimer JR, Heisey SR, Jordan EF et al. Perfusion of the cerebral ventricular system in unanesthetized goats. Am J Physiol 1962; 203 (5): 763–774. doi: 10.1152/ajplegacy.1962.203.5.763.
24. Pappenheimer JR, Miller TB, Goodrich CA. Sleep-promoting effects of cerebrospinal fluid from sleep-deprived goats. Proc Natl Acad Sci U S A 1967; 58 (2): 513–517. doi: 10.1073/pnas.58.2.513.
25. Bering EA, Sato O. Hydrocephalus: changes in formation and absorption of cerebrospinal fluid within the cerebral ventricles. J Neurosurg 1963; 20 (12): 1050–1063. doi: 10.3171/jns.1963.20.12.1050.
26. Qvarlander S, Ambarki K, Wåhlin A et al. Cerebrospinal fluid and blood flow patterns in idiopathic normal pressure hydrocephalus. Acta Neurol Scand 2017; 135 (5): 576–584. doi: 10.1111/ane.12636.
27. Oliveira LM, Nitrini R, Román GC. Normal-pressure hydrocephalus: a critical review. Dementia Neuropsychol 2019; 13 (2): 133–143. doi: 10.1590/1980-57642018dn13-020001.
28. Oliveira MF, Oliveira JRM, Rotta JM et al. Psychiatric symptoms are present in most of the patients with idiopathic normal pressure hydrocephalus. Arq Neuropsiquiatr 2014; 72 (6): 435–438. doi: 10.1590/0004-282x20140047.
29. Wang Z, Zhang Y, Hu F et al. Pathogenesis and pathophysiology of idiopathic normal pressure hydrocephalus. CNS Neurosci Ther 2020; 26 (12): 1230–1240. doi: 10.1111/cns.13526.
30. Buishas J, Gould IG, Linninger AA. A computational model of cerebrospinal fluid production and reabsorption driven by Starling forces. Croat Med J 2014; 55 (5): 481–497. doi: 10.3325/cmj.2014.55.481.
31. Israelsson H, Carlberg B, Wikkelsö C et al. Vascular risk factors in INPH: a prospective case-control study (the INPH-CRasH study). Neurology 2017; 88 (6): 577–585. doi: 10.1212/WNL.0000000000003583.
32. Chrysikopoulos H. Idiopathic normal pressure hydrocephalus: thoughts on etiology and pathophysiology. Med Hypotheses 2009; 73 (5): 718–724. doi: 10.1016/ j.mehy.2009.04.044.
33. Hamilton RB, Scalzo F, Baldwin K et al. Opposing CSF hydrodynamic trends found in the cerebral aqueduct and prepontine cistern following shunt treatment in patients with normal pressure hydrocephalus. Fluids Barriers CNS 2019; 16 (1): 2. doi: 10.1186/s12987-019-0122-0.
34. Yatsushiro S, Sunohara S, Hayashi N et al. Cardiac-driven pulsatile motion of intracranial cerebrospinal fluid visualized based on a correlation mapping technique. Magn Reson Med Sci 2018; 17 (2): 151–160. doi: 10.2463/mrms.mp.2017-0014.
35. Eide PK, Stanisic M. Cerebral microdialysis and intracranial pressure monitoring in patients with idiopathic normal-pressure hydrocephalus: association with clinical response to extended lumbar drainage and shunt surgery. J Neurosurg 2010; 112 (2): 414–424. doi: 10.3171/2009.5.JNS09122.
36. Marmarou A, Shulman K, Rosende RM. A nonlinear analysis of the cerebrospinal fluid system and intracranial pressure dynamics. J Neurosurg 1978; 48 (3): 332–344. doi: 10.3171/jns.1978.48.3.0332.
37. Kayis C, Aygok GA. Cerebrospinal fluid dynamics and infusion techniques. In: Adult hydrocephalus. Cambridge: Cambridge University Press 2014 : 139–149.
38. Ahn JH, Cho H, Kim J-H et al. Meningeal lymphatic vessels at the skull base drain cerebrospinal fluid. Nature 2019; 572 (7767): 62–66. doi: 10.1038/s41586-019 - 1419-5.
39. Reeves BC, Karimy JK, Kundishora AJ et al. Glymphatic system impairment in Alzheimer‘s disease and idiopathic normal pressure hydrocephalus. Trends Mol Med 2020; 26 (3): 285–295. doi: 10.1016/j.molmed.2019.11.008.
40. Kiviniemi V, Wang X, Korhonen V et al. Ultra-fast magnetic resonance encephalography of physiological brain activity – glymphatic pulsation mechanisms? J Cereb Blood Flow Metab 2016; 36 (6): 1033–1045. doi: 10.1177/0271678X15622047.
41. Ringstad G, Valnes LM, Dale AM et al. Brain-wide glymphatic enhancement and clearance in humans assessed with MRI. JCI Insight 2018; 3 (13): e121537. doi: 10.1172/jci.insight.121537.
42. Ringstad G, Vatnehol SAS, Eide PK. Glymphatic MRI in idiopathic normal pressure hydrocephalus. Brain 2017; 140 (10): 2691–2705. doi: 10.1093/brain/awx191.
43. Eide PK, Ringstad G. Delayed clearance of cerebrospinal fluid tracer from entorhinal cortex in idiopathic normal pressure hydrocephalus: a glymphatic magnetic resonance imaging study. J Cereb Blood Flow Metab 2019; 39 (7): 1355–1368. doi: 10.1177/0271678X18760974.
44. Eide PK, Valnes LM, Pripp AH et al. Delayed clearance of cerebrospinal fluid tracer from choroid plexus in idiopathic normal pressure hydrocephalus. J Cereb Blood Flow Metab 2020; 40 (9): 1849–1858. doi: 10.1177/0271678X19874790.
45. Rasmussen MK, Mestre H, Nedergaard M. The glymphatic pathway in neurological disorders. Lancet Neurol 2018; 17 (11): 1016–1024. doi: 10.1016/s1474-4422 (18) 30 318-1.
46. Eide PK, Valnes LM, Pripp AH et al. Delayed clearance of cerebrospinal fluid tracer from choroid plexus in idiopathic normal pressure hydrocephalus. J Cereb Blood Flow Metab 2020; 40 (9): 1849–1858. doi: https: //doi.org/10.1177/0271678x19874790.
47. Hasan-Olive MM, Enger R, Hansson H-A et al. Loss of perivascular aquaporin-4 in idiopathic normal pressure hydrocephalus. Glia 2019; 67 (1): 91–100. doi: 10.1002/glia.23528.
48. Xie L, Kang H, Xu Q et al. Sleep drives metabolite clearance from the adult brain. Science 2013; 342 (6156): 373–377. doi: 10.1126/science.1241224.
49. Román GC, Jackson RE, Fung SH et al. Sleep-disordered breathing and idiopathic normal-pressure hydrocephalus: recent pathophysiological advances. Curr Neurol Neurosci Rep 2019; 19 (7): 39. doi: 10.1007/s11910-019-0952-9.
50. Ammar A, Abbas F, Al Issawi W et al. Idiopathic normal-pressure hydrocephalus syndrome: is it understood? The comprehensive idiopathic normal-pressure hydrocephalus theory (CiNPHT). In: Hydrocephalus: what do we know? And what do we still not know? New York, USA: Springer 2017 : 67–82.
51. Bräutigam K, Vakis A, Tsitsipanis C. Pathogenesis of idiopathic normal pressure hydrocephalus: a review of knowledge. J Clin Neurosci 2019; 61 : 10–13. doi: 10.1016/ j.jocn.2018.10.147.
52. Akai K, Uchigasaki S, Tanaka U et al. Normal pressure hydrocephalus. Neuropathological Study. Acta Pathol Jpn 1987; 37 (1): 97–110.
53. Preuss M, Hoffmann KT, Reiss-Zimmermann M et al. Updated physiology and pathophysiology of CSF circulation – the pulsatile vector theory. Childs Nerv Syst 2013; 29 (10): 1811–1825. doi: 10.1007/s00381-013-2219-0.
54. Mascalchi M, Arnetoli G, Inzitari D et al. Cine-MR imaging of aqueductal CSF flow in normal pressure hydrocephalus syndrome before and after CSF shunt. Acta Radiol 1993; 34 (6): 586–592.
55. Battal B, Kocaoglu M, Bulakbasi N et al. Cerebrospinal fluid flow imaging by using phase-contrast MR technique. Br J Radiol 2011; 84 (1004): 758–765. doi: 10.1259/bjr/66206791.
56. Sass LR, Khani M, Natividad GC et al. A 3D subject-specific model of the spinal subarachnoid space with anatomically realistic ventral and dorsal spinal cord nerve rootlets. Fluids Barriers CNS 2017; 14 (1): 36. doi: 10.1186/s12987-017-0085-y.
57. Hentschel S, Mardal K-A, Løvgren AE et al. Characterization of cyclic CSF flow in the foramen magnum and upper cervical spinal canal with MR flow imaging and computational fluid dynamics. AJNR Am J Neuroradiol 2010; 31 (6): 997–1002. doi: 10.3174/ajnr.A1995.
58. Lee L. Riding the wave of ependymal cilia: genetic susceptibility to hydrocephalus in primary ciliary dyskinesia. J Neurosci Res 2013; 91 (9): 1117–1132. doi: 10.1002/jnr.23238.
59. Portenoy RK, Berger A, Gross E. Familial occurrence of idiopathic normal-pressure hydrocephalus. Arch Neurol 1984; 41 (3): 335–337. doi: 10.1001/archneur.1984.04050150117029.
60. Sato H, Takahashi Y, Kimihira L et al. A segmental copy number loss of the SFMBT1 gene is a genetic risk for shunt-responsive, idiopathic normal pressure hydrocephalus (iNPH): a case-control study. PLoS One 2016; 11 (11): e0166615. doi: 10.1371/journal.pone.0166615.
61. Korhonen VE, Helisalmi S, Jokinen A et al. Copy number loss in SFMBT1 is common among Finnish and Norwegian patients with iNPH. Neurol Genet 2018; 4 (6): e291. doi: 10.1212/NXG.0000000000000291.
62. Morimoto Y, Yoshida S, Kinoshita A et al. Nonsense mutation in CFAP43 causes normal-pressure hydrocephalus with ciliary abnormalities. Neurology 2019; 92 (20): e2364–e2374. doi: 10.1212/WNL.0000000000007505.
63. Yang HW, Lee S, Yang D et al. Deletions in CWH43 cause idiopathic normal pressure hydrocephalus. EMBO Mol Med 2021; 13 (3): e13249. doi: 10.15252/emmm.202013249.
64. Grasso G, Torregrossa F, Leone L et al. Long-term efficacy of shunt therapy in idiopathic normal pressure hydrocephalus. World Neurosurg 2019; 129: e458–e463. doi: 10.1016/j.wneu.2019.05.183.
65. Morel E, Armand S, Assal F et al. Is frontal gait a myth in normal pressure hydrocephalus? J Neurol Sci 2019; 402 : 175–179. doi: 10.1016/j.jns.2019.05.029.
66. Morel E, Armand S, Assal F et al. Deconstructing or reestablishing frontal gait in normal pressure hydrocephalus? J Neurol Sci 2019; 404 : 66–67. doi: 10.1016/j.jns.2019.07.006.
67. de Souza RKM, da Rocha SFB, Martins RT et al. Gait in normal pressure hydrocephalus: characteristics and effects of the CSF tap test. Arq Neuropsiquiatr 2018; 76 (5): 324–331. doi: 10.1590/0004-282X20180037.
68. Stolze H, Kuhtz-Buschbeck JP, Drücke H et al. Comparative analysis of the gait disorder of normal pressure hydrocephalus and Parkinson‘s disease. J Neurol Neurosurg Psychiatry 2001; 70 (3): 289–297. doi: 10.1136/jnnp.70.3.289.
69. Gallagher R, Marquez J, Osmotherly P. Clinimetric properties and minimal clinically important differences for a battery of gait, balance, and cognitive examinations for the tap test in idiopathic normal pressure hydrocephalus. Neurosurgery 2019; 84 (6): E378–E384. doi: 10.1093/neuros/nyy286.
70. Ishii M, Kawamata T, Akiguchi I et al. Parkinsonian symptomatology may correlate with CT findings before and after shunting in idiopathic normal pressure hydrocephalus. Parkinsons Dis 2010; 2010 : 201089. doi: 10.4061/2010/201089.
71. Bugalho P, Guimarães J. Gait disturbance in normal pressure hydrocephalus: a clinical study. Parkinsonism Relat Disord 2007; 13 (7): 434–437. doi: 10.1016/j.parkreldis.2006.08.007.
72. Allali G, Laidet M, Armand S et al. Brain comorbidities in normal pressure hydrocephalus. Eur J Neurol 2018; 25 (3): 542–548. doi: 10.1111/ene.13543.
73. Yamada S, Ishikawa M, Miyajima M et al. Timed up and go test at tap test and shunt surgery in idiopathic normal pressure hydrocephalus. Neurol Clin Pract 2017; 7 (2): 98–108. doi: 10.1212/CPJ.0000000000000334.
74. Boon AJW, Tans JT, Delwel EJ et al. Dutch normal-pressure hydrocephalus study: randomized comparison of low - and medium-pressure shunts. J Neurosurg 1998; 88 (3): 490–495. doi: 10.3171/jns.1998.88.3.0490.
75. Ravdin LD, Katzen HL, Jackson AE et al. Features of gait most responsive to tap test in normal pressure hydrocephalus. Clin Neurol Neurosurg 2008; 110 (5): 455–461. doi: 10.1016/j.clineuro.2008.02.003.
76. Yamada S, Ishikawa M, Miyajima M et al. Disease duration: the key to accurate CSF tap test in iNPH. Acta Neurol Scand 2017; 135 (2): 189–196. doi: 10.1111/ane.12580.
77. Allali G, Laidet M, Armand S et al. Apathy in idiopathic normal pressure hydrocephalus: a marker of reversible gait disorders. Int J Geriatr Psychiatry 2018; 33 (5): 735–742. doi: 10.1002/gps.4847.
78. Ishikawa M, Yamada S, Yamamoto K. Agreement study on gait assessment using a video-assisted rating method in patients with idiopathic normal-pressure hydrocephalus. PLoS One 2019; 14 (10): e0224202. doi: 10.1371/journal.pone.0224202.
79. Skalický P, Vlasák A, Mládek A et al. Role of DESH, callosal angle and cingulate sulcus sign in prediction of gait responsiveness after shunting in iNPH patients. J Clin Neurosci 2021; 83 : 99–107. doi: 10.1016/j.jocn.2020.11.020.
80. Mega MS, Cummings JL. Frontal-subcortical circuits and neuropsychiatric disorders. J Neuropsychiatry Clin Neurosci 1994; 6 (4): 358–370. doi: 10.1176/jnp.6.4.358.
81. Boon AJ, Tans JT, Delwel EJ et al. Dutch normal-pressure hydrocephalus study: prediction of outcome after shunting by resistance to outflow of cerebrospinal fluid. J Neurosurg 1997; 87 (5): 687–693. doi: 10.3171/jns.1997.87.5.0687.
82. Iddon JL, Pickard JD, Cross JJ et al. Specific patterns of cognitive impairment in patients with idiopathic normal pressure hydrocephalus and Alzheimer‘s disease: a pilot study. J Neurol Neurosurg Psychiatry 1999; 67 (6): 723–732. doi: 10.1136/jnnp.67.6.723.
83. Bugalho P, Alves L, Miguel R et al. Profile of cognitive dysfunction and relation with gait disturbance in normal pressure hydrocephalus. Clin Neurol Neurosurg 2014; 118 : 83–88. doi: 10.1016/j.clineuro.2014.01.006.
84. Ogino A, Kazui H, Miyoshi N et al. Cognitive impairment in patients with idiopathic normal pressure hydrocephalus. Dement Geriatr Cogn Disord 2006; 21 (2): 113–119. doi: 10.1159/000090510.
85. Walchenbach R, Geiger E, Thomeer RTWM et al. The value of temporary external lumbar CSF drainage in predicting the outcome of shunting on normal pressure hydrocephalus. J Neurol Neurosurg Psychiatry 2002; 72 (4): 503–506. doi: 10.1136/jnnp.72.4.503.
86. Luikku AJ, Hall A, Nerg O et al. Multimodal analysis to predict shunt surgery outcome of 284 patients with suspected idiopathic normal pressure hydrocephalus. Acta Neurochir (Wien) 2016; 158 (12): 2311–2319. doi: 10.1007/s00701-016-2980-4.
87. Picascia M, Pozzi NG, Todisco M et al. Cognitive disorders in normal pressure hydrocephalus with initial parkinsonism in comparison with de novo Parkinson‘s disease. Eur J Neurol 2019; 26 (1): 74–79. doi: 10.1111/ene.13766.
88. Devito EE, Pickard JD, Salmond CH et al. The neuropsychology of normal pressure hydrocephalus (NPH). Br J Neurosurg 2005; 19 (3): 217–224. doi: 10.1080/02688690500201838.
89. Skalický P, Mládek A, Vlasák A et al. Normal pressure hydrocephalus – an overview of pathophysiological mechanisms and diagnostic procedures. Neurosurg Rev 2020; 43 (6): 1451–1464. doi: 10.1007/s10143-019-01201-5.
90. Saito M, Nishio Y, Kanno S et al. Cognitive profile of idiopathic normal pressure hydrocephalus. Dement Geriatr Cogn Dis Extra 2011; 1 (1): 202–211. doi: 10.1159/000328924.
91. Hellström P, Klinge P, Tans J et al. A new scale for assessment of severity and outcome in iNPH. Acta Neurol Scand 2012; 126 (4): 229–237. doi: 10.1111/j.1600-0404.2012.01677.x.
92. Matsuoka T, Kawano S, Fujimoto K et al. Characteristics of cognitive function evaluation using the Montreal cognitive assessment in a cerebrospinal fluid tap test in patients with idiopathic normal pressure hydrocephalus. Clin Neurol Neurosurg 2019; 186 : 105524. doi: 10.1016/j.clineuro.2019.105524.
93. Sakakibara R, Kanda T, Sekido T et al. Mechanism of bladder dysfunction in idiopathic normal pressure hydrocephalus. Neurourol Urodyn 2008; 27 (6): 507–510. doi: 10.1002/nau.20547.
94. Paranathala MP, Sitsapesan H, Green AL et al. Idiopathic normal pressure hydrocephalus: an important differential diagnosis. Br J Hosp Med 2013; 74 (10): 564–570. doi: 10.12968/hmed.2013.74.10.564.
95. Kogan MI, Zachoval R, Ozyurt C et al. Epidemiology and impact of urinary incontinence, overactive bladder, and other lower urinary tract symptoms: results of the EPIC survey in Russia, Czech Republic, and Turkey. Curr Med Res Opin 2014; 30 (10): 2119–2130. doi: 10.1185/03007995.2014.934794.
96. Klausner AP, Steers WD. The neurogenic bladder: an update with management strategies for primary care physicians. Med Clin North Am 2011; 95 (1): 111–120. doi: 10.1016/j.mcna.2010.08.027.
97. Krzastek SC, Bruch WM, Robinson SP et al. Characterization of lower urinary tract symptoms in patients with idiopathic normal pressure hydrocephalus. Neurourol Urodyn 2017; 36 (4): 1167–1173. doi: 10.1002/nau.23084.
98. Gallia GL, Rigamonti D, Williams MA. The diagnosis and treatment of idiopathic normal pressure hydrocephalus. Nat Clin Pract Neurol 2006; 2 (7): 375–381. doi: 10.1038/ncpneuro0237.
99. Krzastek SC, Robinson SP, Young HF et al. Improvement in lower urinary tract symptoms across multiple domains following ventriculoperitoneal shunting for idiopathic normal pressure hydrocephalus. Neurourol Urodyn 2017; 36 (8): 2056–2063. doi: 10.1002/nau.23235.
100. Chung JH, Lee JY, Kang DH et al. Efficacy and safety of solifenacin to treat overactive bladder symptoms in patients with idiopathic normal pressure hydrocephalus: an open-label, multicenter, prospective study. Neurourol Urodyn 2012; 31 (7): 1175–1180. doi: 10.1002/nau.22234.
101. Pinner G, Johnson H, Bouman P et al. Psychiatric manifestations of normal-pressure hydrocephalus: a short review and unusual case. Int Psychogeriatr 1997; 9 (4): 465–470. doi: 10.1017/s1041610297004602.
102. Israelsson H, Allard P, Eklund A et al. Symptoms of depression are common in patients with idiopathic normal pressure hydrocephalus: the INPH-CRasH study. Neurosurgery 2016; 78 (2): 161–168. doi: 10.1227/NEU.0000000000001093.
103. Dewan MJ, Bick PA. Normal pressure hydrocephalus and psychiatric patients. Biol Psychiatry 1985; 20 (10): 1127–1131. doi: 10.1016/0006-3223 (85) 90012-5.
104. Yoshino Y, Yoshida T, Mori T et al. Risk of idiopathic normal pressure hydrocephalus in older inpatients with schizophrenia. Int Psychogeriatr 2016; 28 (5): 863–868. doi: 10.1017/S1041610215001763.
105. Vanhala V, Junkari A, Korhonen VE et al. Prevalence of schizophrenia in idiopathic normal pressure hydrocephalus. Neurosurgery 2019; 84 (4): 883–889. doi: 10.1093/neuros/nyy147.
106. Missori P, Scollato A, Formisano R et al. Restoration of sexual activity in patients with chronic hydrocephalus after shunt placement. Acta Neurochir (Wien) 2009; 151 (10): 1241–1244. doi: 10.1007/s00701-009-0331-4.
107. Lemcke J, Meier U. Idiopathic normal pressure hydrocephalus (iNPH) and co-morbidity: an outcome analysis of 134 patients. Acta Neurochir Suppl 2012; 114 : 255–259. doi: 10.1007/978-3-7091-0956-4_50.
108. Jaraj D, Wikkelsö C, Rabiei K et al. Mortality and risk of dementia in normal-pressure hydrocephalus: a population study. Alzheimers Dement 2017; 13 (8): 850–857. doi: 10.1016/j.jalz.2017.01.013.
109. Toma AK, Stapleton S, Papadopoulos MC et al. Natural history of idiopathic normal-pressure hydrocephalus. Neurosurg Rev 2011; 34 (4): 433–438. doi: 10.1007/s10143-011-0316-7.
110. Børgesen SE, Gjerris F, Sørensen SC. Cerebrospinal fluid conductance and compliance of the craniospinal space in normal-pressure hydrocephalus. J Neurosurg 1979; 51 (4): 521–525. doi: 10.3171/jns.1979.51.4.0521.
111. Evans WA. An encephalographic ratio for estimating ventricular enlargment and cerebral atrophy. Arch Neurol Psychiatry 1942; 47 (6): 931–937. doi: 10.1001/archneurpsyc.1942.02290060069004.
112. Toma AK, Holl E, Kitchen ND et al. Evans‘ index revisited: the need for an alternative in normal pressure hydrocephalus. Neurosurgery 2011; 68 (4): 939–944. doi: 10.1227/NEU.0b013e318208f5e0.
113. Bateman GA, Brown KM. The measurement of CSF flow through the aqueduct in normal and hydrocephalic children: from where does it come, to where does it go? Childs Nerv Syst 2012; 28 (1): 55–63. doi: 10.1007/s00381-011-1617-4.
114. Børgesen SE, Gyldensted C, Gjerris F et al. Computed tomography and pneumoencephalography compared to conductance to outflow of CSF in normal pressure hydrocephalus. Neuroradiology 1980; 20 (1): 17–22. doi: 10.1007/bf00346856.
115. Lehnert BE, Rahbar H, Relyea-Chew A et al. Detection of ventricular shunt malfunction in the ED: relative utility of radiography, CT, and nuclear imaging. Emerg Radiol 2011; 18 (4): 299–305. doi: 10.1007/s10140-011-0955-6.
116. Lemcke J, Meier U. Improved outcome in shunted iNPH with a combination of a codman hakim programmable valve and an aesculap-miethke shuntassistant. Cent Eur Neurosurg 2010; 71 (3): 113–116. doi: 10.1055/s-0029-1241179.
117. Klinge P, Marmarou A, Bergsneider M et al. Outcome of shunting in idiopathic normal-pressure hydrocephalus and the value of outcome assessment in shunted patients. Neurosurgery 2005; 57 (3 Suppl): S40–52. doi: 10.1227/01.NEU.0000168187.01077.2F.
118. Meier U, Mutze S. Correlation between decreased ventricular size and positive clinical outcome following shunt placement in patients with normal-pressure hydrocephalus. J Neurosurg 2004; 100 (6): 1036–1040. doi: 10.3171/jns.2004.100.6.1036.
119. Pachatouridis D, Alexiou GA, Mihos E et al. The value of programmable shunt valves for the management of subdural collections in patients with hydrocephalus. ScientificWorldJournal 2013; 2013 : 461896. doi: 10.1155/2013/461896.
120. Krauss JK, Regel JP, Vach W et al. White matter lesions in patients with idiopathic normal pressure hydrocephalus and in an age-matched control group: a comparative study. Neurosurgery 1997; 40 (3): 491–495. doi: 10.1097/00006123-199703000-00011.
121. Momjian S, Owler BK, Czosnyka Z et al. Pattern of white matter regional cerebral blood flow and autoregulation in normal pressure hydrocephalus. Brain 2004; 127 (Pt 5): 965–972. doi: 10.1093/brain/awh131.
122. Peterson KA, Mole TB, Keong NCH et al. Structural correlates of cognitive impairment in normal pressure hydrocephalus. Acta Neurol Scand 2019; 139 (3): 305–312. doi: 10.1111/ane.13052.
123. Vlasák A, Skalický P, Mládek A et al. Structural volumetry in NPH diagnostics and treatment-future or dead end? Neurosurg Rev 2021; 44 (1): 503–514. doi: 10.1007/s10143-020-01245-y.
124. Garcia-Armengol R, Domenech S, Botella-Campos C et al. Comparison of elevated intracranial pressure pulse amplitude and disproportionately enlarged subarachnoid space (DESH) for prediction of surgical results in suspected idiopathic normal pressure hydrocephalus. Acta Neurochir (Wien) 2016; 158 (11): 2207–2213. doi: 10.1007/s00701-016-2858-5.
125. Virhammar J, Laurell K, Cesarini KG et al. The callosal angle measured on MRI as a predictor of outcome in idiopathic normal-pressure hydrocephalus. J Neurosurg 2014; 120 (1): 178–184. doi: 10.3171/2013.8.JNS13575.
126. Yamada S, Ishikawa M, Yamamoto K. Optimal diagnostic indices for idiopathic normal pressure hydrocephalus based on the 3D quantitative volumetric analysis for the cerebral ventricle and subarachnoid space. AJNR Am J Neuroradiol 2015; 36 (12): 2262–2269. doi: 10.3174/ajnr.A4440.
127. Ishikawa M, Oowaki H, Takezawa M et al. Disproportionately enlarged subarachnoid space hydrocephalus in idiopathic normal-pressure hydrocephalus and its implication in pathogenesis. Acta Neurochir Suppl 2016; 122 : 287–290. doi: 10.1007/978-3-319-22533-3_57.
128. Kojoukhova M, Vanha K-I, Timonen M et al. Associations of intracranial pressure with brain biopsy, radiological findings, and shunt surgery outcome in patients with suspected idiopathic normal pressure hydrocephalus. Acta Neurochir (Wien) 2017; 159 (1): 51–61. doi: 10.1007/s00701-016-3025-8.
129. Kojoukhova M, Koivisto AM, Korhonen R et al. Feasibility of radiological markers in idiopathic normal pressure hydrocephalus. Acta Neurochir (Wien) 2015; 157 (10): 1709–1718. doi: 10.1007/s00701-015-2503-8.
130. Cogswell PM, Graff-Radford J, Wurtz LI et al. CSF dynamics disorders: association of brain MRI and nuclear medicine cisternogram findings. Neuroimage Clin 2020; 28 : 102481. doi: 10.1016/j.nicl.2020.102481.
131. Craven CL, Toma AK, Mostafa T et al. The predictive value of DESH for shunt responsiveness in idiopathic normal pressure hydrocephalus. J Clin Neurosci 2016; 34 : 294–298. doi: 10.1016/j.jocn.2016.09.004.
132. Iseki C, Kawanami T, Nagasawa H et al. Asymptomatic ventriculomegaly with features of idiopathic normal pressure hydrocephalus on MRI (AVIM) in the elderly: a prospective study in a Japanese population. J Neurol Sci 2009; 277 (1–2): 54–57. doi: 10.1016/j.jns.2008.10.004.
133. Virhammar J, Ahlgren A, Cesarini KG et al. Cerebral perfusion does not increase after shunt surgery for normal pressure hydrocephalus. J Neuroimaging 2020; 30 (3): 303–307. doi: 10.1111/jon.12702.
134. Solamen LM, McGarry MDJ, Fried J et al. Poroelastic mechanical properties of the brain tissue of normal pressure hydrocephalus patients during lumbar drain treatment using intrinsic actuation MR elastography. Acad Radiol 2021; 28 (4): 457–466. doi: 10.1016/j.acra.2020.03.009.
135. Murphy MC, Cogswell PM, Trzasko JD et al. Identification of normal pressure hydrocephalus by disease-specific patterns of brain stiffness and damping ratio. Invest Radiol 2020; 55 (4): 200–208. doi: 10.1097/RLI.0000000000000630.
136. Perry A, Graffeo CS, Fattahi N et al. Clinical correlation of abnormal findings on magnetic resonance Eelastography in idiopathic normal pressure hydrocephalus. World Neurosurg 2017; 99 : 695–700.e1. doi: 10.1016/j.wneu.2016.12.121.
137. Algin O, Hakyemez B, Parlak M. The efficiency of PC-MRI in diagnosis of normal pressure hydrocephalus and prediction of shunt response. Acad Radiol 2010; 17 (2): 181–187. doi: 10.1016/j.acra.2009.08.011.
138. Sharma AK, Gaikwad S, Gupta V et al. Measurement of peak CSF flow velocity at cerebral aqueduct, before and after lumbar CSF drainage, by use of phase-contrast MRI: utility in the management of idiopathic normal pressure hydrocephalus. Clin Neurol Neurosurg 2008; 110 (4): 363–368. doi: 10.1016/j.clineuro.2007.12.021.
139. Hattingen E, Jurcoane A, Melber J et al. Diffusion tensor imaging in patients with adult chronic idiopathic hydrocephalus. Neurosurgery 2010; 66 (5): 917–924. doi: 10.1227/01.NEU.0000367801.35654.EC.
140. Lenfeldt N, Larsson A, Nyberg L et al. Diffusion tensor imaging reveals supplementary lesions to frontal white matter in idiopathic normal pressure hydrocephalus. Neurosurgery 2011; 68 (6): 1586–1593. doi: 10.1227/NEU.0b013e31820f3401.
141. Kim MJ, Seo SW, Lee KM et al. Differential diagnosis of idiopathic normal pressure hydrocephalus from other dementias using diffusion tensor imaging. AJNR Am J Neuroradiol 2011; 32 (8): 1496–1503. doi: 10.3174/ajnr.A2531.
142. Siasios I, Kapsalaki EZ, Fountas KN et al. The role of diffusion tensor imaging and fractional anisotropy in the evaluation of patients with idiopathic normal pressure hydrocephalus: a literature review. Neurosurg Focus 2016; 41 (3): E12. doi: 10.3171/2016.6.FOCUS16192.
143. Jurcoane A, Keil F, Szelenyi A et al. Directional diffusion of corticospinal tract supports therapy decisions in idiopathic normal-pressure hydrocephalus. Neuroradiology 2014; 56 (1): 5–13. doi: 10.1007/s00234-013 - 1289-8.
144. Nakanishi A, Fukunaga I, Hori M et al. Microstructural changes of the corticospinal tract in idiopathic normal pressure hydrocephalus: a comparison of diffusion tensor and diffusional kurtosis imaging. Neuroradiology 2013; 55 (8): 971–976. doi: 10.1007/s00234-013-1201-6.
145. Hori M, Kamiya K, Nakanishi A et al. Prospective estimation of mean axon diameter and extra-axonal space of the posterior limb of the internal capsule in patients with idiopathic normal pressure hydrocephalus before and after a lumboperitoneal shunt by using q-space diffusion MRI. Eur Radiol 2016; 26 (9): 2992–2998. doi: 10.1007/s00330-015-4162-9.
146. Kamiya K, Kamagata K, Miyajima M et al. Diffusional kurtosis imaging in idiopathic normal pressure hydrocephalus: correlation with severity of cognitive impairment. Magn Reson Med Sci 2016; 15 (3): 316–323. doi: 10.2463/mrms.mp.2015-0093.
147. Irie R, Tsuruta K, Hori M et al. Neurite orientation dispersion and density imaging for evaluation of corticospinal tract in idiopathic normal pressure hydrocephalus. Jpn J Radiol 2017; 35 (1): 25-30. doi: 10.1007/s11604-016-0594-7.
148. Lenfeldt N, Hauksson J, Birgander R et al. Improvement after cerebrospinal fluid drainage is related to levels of N-acetyl-aspartate in idiopathic normal pressure hydrocephalus. Neurosurgery 2008; 62 (1): 135–141. doi: 10.1227/01.NEU.0000311070.25992.05.
149. Savolainen S, Laakso MP, Paljärvi L et al. MR imaging of the hippocampus in normal pressure hydrocephalus: correlations with cortical Alzheimer‘s disease confirmed by pathologic analysis. Am J Neuroradiol 2000; 21 (2): 409–414.
150. Aoki Y, Kazui H, Bruña R et al. Normalized power variance of eLORETA at high-convexity area predicts shunt response in idiopathic normal pressure hydrocephalus. Sci Rep 2020; 10 (1): 13054. doi: 10.1038/s41598-020-70035-9.
151. Del Gamba C, Bruno A, Frosini D et al. Is DAT imaging abnormality in normal pressure hydrocephalus always suggestive of degeneration? Neurol Sci 2021; 42 (2): 723–726. doi: 10.1007/s10072-020-04743-5.
152. Chang C-C, Asada H, Mimura T et al. A prospective study of cerebral blood flow and cerebrovascular reactivity to acetazolamide in 162 patients with idiopathic normal-pressure hydrocephalus. J Neurosurg 2009; 111 (3): 610–617. doi: 10.3171/2008.10.17676.
153. Hiraoka K, Narita W, Kikuchi H et al. Amyloid deposits and response to shunt surgery in idiopathic normal-pressure hydrocephalus. J Neurol Sci 2015; 356 (1–2): 124–128. doi: 10.1016/j.jns.2015.06.029.
154. Leinonen V, Rinne JO, Wong DF et al. Diagnostic effectiveness of quantitative [18F]flutemetamol PET imaging for detection of fibrillar amyloid b using cortical biopsy histopathology as the standard of truth in subjects with idiopathic normal pressure hydrocephalus. Acta Neuropathol Commun 2014; 2 (1): 46. doi: 10.1186/2051-5960-2-46.
155. Norager NH, Olsen MH, Pedersen SH et al. Reference values for intracranial pressure and lumbar cerebrospinal fluid pressure: a systematic review. Fluids Barriers CNS 2021; 18 (1): 19. doi: 10.1186/s12987-021-00253-4.
156. Marmarou A, Bergsneider M, Klinge P et al. The value of supplemental prognostic tests for the preoperative assessment of idiopathic normal-pressure hydrocephalus. Neurosurgery 2005; 57 (3 Suppl): S17–28. doi: 10.1227/01.neu.0000168184.01002.60.
157. Hebb AO, Cusimano MD. Idiopathic normal pressure hydrocephalus: a systematic review of diagnosis and outcome. Neurosurgery 2001; 49 (5): 1166–1186. doi: 10.1097/00006123-200111000-00028.
158. Kahlon B, Sundbärg G, Rehncrona S. Comparison between the lumbar infusion and CSF tap tests to predict outcome after shunt surgery in suspected normal pressure hydrocephalus. J Neurol Neurosurg Psychiatr 2002; 73 (6): 721–726. doi: 10.1136/jnnp.73.6.721.
159. Brean A, Eide PK. Assessment of idiopathic normal pressure patients in neurological practice: the role of lumbar infusion testing for referral of patients to neurosurgery. Eur J Neurol 2008; 15 (6): 605–612. doi: 10.1111/j.1468-1331.2008.02134.x.
160. Meier U, Bartels P. The importance of the intrathecal infusion test in the diagnostic of normal-pressure hydrocephalus. Eur Neurology 2001; 46 (4): 178–186. doi: 10.1159/000050801.
161. Børgesen SE, Gjerris F. Relationships between intracranial pressure, ventricular size, and resistance to CSF outflow. J Neurosurg 1987; 67 (4): 535–539. doi: 10.3171/jns.1987.67.4.0535.
162. Kim D-J, Kim H, Kim Y-T et al. Thresholds of resistance to CSF outflow in predicting shunt responsiveness. Neurol Res 2015; 37 (4): 332–340. doi: 10.1179/1743132814Y.0000000454.
163. Albeck MJ, Børgesen SE, Gjerris F et al. Intracranial pressure and cerebrospinal fluid outflow conductance in healthy subjects. J Neurosurg 1991; 74 (4): 597–600. doi: 10.3171/jns.1991.74.4.0597.
164. Lalou AD, Czosnyka M, Placek MM et al. CSF dynamics for shunt prognostication and revision in normal pressure hydrocephalus. J Clin Med 2021; 10 (8): 1711. doi: 10.3390/jcm10081711.
165. Halperin JJ, Kurlan R, Schwalb JM et al. Practice guideline: idiopathic normal pressure hydrocephalus: response to shunting and predictors of response: report of the guideline development, issemination, and implementation subcommittee of the American Academy of Neurology. Neurology 2015; 85 (23): 2063–2071. doi: 10.1212/WNL.0000000000002193.
166. Nelson JR, Goodman SJ. An evaluation of the cerebrospinal fluid infusion test for hydrocephalus. Neurology 1971; 21 (10): 1037–1053. doi: 10.1212/wnl.21.10.1037.
167. Kahlon B, Sundbärg G, Rehncrona S. Lumbar infusion test in normal pressure hydrocephalus. Acta Neurol Scand 2005; 111 (6): 379–384. doi: 10.1111/j.1600-0404. 2005.00417.x
168. Wikkelsö C, Andersson H, Blomstrand C et al. Predictive value of the cerebrospinal fluid tap-test. Acta Neurol Scand 1986; 73 (6): 566–573. doi: 10.1111/j.1600-0404. 1986.tb04601.x.
169. Wikkelsø C, Hellström P, Klinge PM et al. The European iNPH multicentre study on the predictive values of resistance to CSF outflow and the CSF tap test in patients with idiopathic normal pressure hydrocephalus. J Neurol Neurosurg Psychiatry 2013; 84 (5): 562–568. doi: 10.1136/jnnp-2012-303314.
170. Gallagher R, Marquez J, Osmotherly P. Gait and balance measures can identify change from a cerebrospinal fluid tap test in idiopathic normal pressure hydrocephalus. Arch Phys Med Rehabil 2018; 99 (11): 2244–2250. doi: 10.1016/j.apmr.2018.03.018.
171. Bovonsunthonchai S, Witthiwej T, Ngamsombat C et al. Effect of spinal tap test on the performance of sit-to-stand, walking, and turning in patients with idiopathic normal pressure hydrocephalus. Nagoya J Med Sci 2018; 80 (1): 53–60. doi: 10.18999/nagjms.80.1.53.
172. Gallagher RM, Marquez J, Osmotherly P. Cognitive and upper limb symptom changes from a tap test in idiopathic normal pressure hydrocephalus. Clin Neurol Neurosurg 2018; 174 : 92–96. doi: 10.1016/j.clineuro.2018.09.015.
173. Agrawal A, Bhattacharya A, Kamble N et al. Effect of lumbar drainage on cortical excitability in normal pressure hydrocephalus. Can J Neurol Sci 2021; 48 (2): 253–258. doi: 10.1017/cjn.2020.169.
174. Governale LS, Fein N, Logsdon J et al. Techniques and complications of external lumbar drainage for normal pressure hydrocephalus. Neurosurgery 2008; 63 (4 Suppl): 379–384. doi: 10.1227/01.NEU.0000327023.18220.88.
175. Mahr CV, Dengl M, Nestler U et al. Idiopathic normal pressure hydrocephalus: diagnostic and predictive value of clinical testing, lumbar drainage, and CSF dynamics. J Neurosurg 2016; 125 (3): 591–597. doi: 10.3171/2015.8.JNS151112.
176. Czosnyka Z, Czosnyka M. Long-term monitoring of intracranial pressure in normal pressure hydrocephalus and other CSF disorders. Acta Neurochir (Wien) 2017; 159 (10): 1979–1980. doi: 10.1007/s00701-017-3282-1.
177. Chotai S, Medel R, Herial NA et al. External lumbar drain: a pragmatic test for prediction of shunt outcomes in idiopathic normal pressure hydrocephalus. Surg Neurol Int 2014; 5 (1): 12. doi: 10.4103/2152-7806.125860.
178. Gallina P, Lastrucci G, Caini S et al. Accuracy and safety of 1-day external lumbar drainage of CSF for shunt selection in patients with idiopathic normal pressure hydrocephalus. J Neurosurg 2018; 1–7. doi: 10.3171/2018.6.JNS18400.
179. Schniepp R, Trabold R, Romagna A et al. Walking assessment after lumbar puncture in normal-pressure hydrocephalus: a delayed improvement over 3 days. J Neurosurg 2017; 126 (1): 148–157. doi: 10.3171/2015.12.JNS151663.
180. Raftopoulos C, Deleval J, Chaskis C et al. Cognitive recovery in idiopathic normal pressure hydrocephalus: a prospective study. Neurosurgery 1994; 35 (3): 397–404. doi: 10.1227/00006123-199409000-00006.
181. Weerakkody RA, Czosnyka M, Schuhmann MU et al. Clinical assessment of cerebrospinal fluid dynamics in hydrocephalus. Guide to interpretation based on observational study. Acta Neurol Scand 2011; 124 (2): 85–98. doi: 10.1111/j.1600-0404.2010.01467.x.
182. Pisani R, Mazzone P, Cocito L. Continuous lumbar cerebrospinal fluid pressure monitoring in idiopathic normal-pressure hydrocephalus: predictive value in the selection for shunt surgery. Clin Neurol Neurosurg 1998; 100 (2): 160–162. doi: 10.1016/s0303-8467 (98) 00008-0.
183. Eide PK, Sorteberg W. Diagnostic intracranial pressure monitoring and surgical management in idiopathic normal pressure hydrocephalus: a 6-year review of 214 patients. Neurosurgery 2010; 66 (1): 80–90. doi: 10.1227/01.NEU.0000363408.69856.B8.
184. Poca MA, Mataró M, Matarín MDM et al. Is the placement of shunts in patients with idiopathic normal pressure hydrocephalus worth the risk? Results of a study based on continuous monitoring of intracranial pressure. J Neurosurg 2004; 100 (5): 855–866. doi: 10.3171/jns.2004.100.5.0855.
185. Green LM, Wallis T, Schuhmann MU et al. Intracranial pressure waveform characteristics in idiopathic normal pressure hydrocephalus and late-onset idiopathic aqueductal stenosis. Fluids Barriers CNS 2021; 18 (1): 25. doi: 10.1186/s12987-021-00259-y.
186. Sahuquillo J, Rubio E, Codina A et al. Reappraisal of the intracranial pressure and cerebrospinal fluid dynamics in patients with the so-called „normal pressure hydrocephalus“ syndrome. Acta Neurochir 1991; 112 (1–2): 50–61. doi: 10.1007/BF01402454.
187. Speil A, Sosa JC, Will BE et al. Lack of correlation of overnight monitoring data and lumbar infusion data in iNPH patients. Acta Neurochir Suppl 2012; 114 : 213–216. doi: 10.1007/978-3-7091-0956-4_41.
188. Graff-Radford NR. Alzheimer CSF biomarkers may be misleading in normal-pressure hydrocephalus. Neurology 2014; 83 (17): 1573–1575. doi: 10.1212/WNL.000 0000000000916.
189. Jeppsson A, Zetterberg H, Blennow K et al. Idiopathic normal-pressure hydrocephalus: pathophysiology and diagnosis by CSF biomarkers. Neurology 2013; 80 (15): 1385–1392. doi: 10.1212/WNL.0b013e31828c2fda.
190. Li X, Miyajima M, Mineki R et al. Analysis of potential diagnostic biomarkers in cerebrospinal fluid of idiopathic normal pressure hydrocephalus by proteomics. Acta Neurochir (Wien) 2006; 148 (8): 859–864. doi: 10.1007/s00701-006-0787-4.
191. Schirinzi T, Sancesario GM, Lazzaro GD et al. Cerebrospinal fluid biomarkers profile of idiopathic normal pressure hydrocephalus. J Neural Transm (Vienna) 2018; 125 (4): 673–679. doi: 10.1007/s00702-018-1842-z.
192. Schirinzi T, Sancesario GM, Ialongo C et al. A clinical and biochemical analysis in the differential diagnosis of idiopathic normal pressure hydrocephalus. Front Neurol 2015; 6 : 86. doi: 10.3389/fneur.2015.00086.
193. Sosvorova L, Hill M, Mohapl M et al. Steroid hormones in prediction of normal pressure hydrocephalus. J Steroid Biochem Mol Biol 2015; 152 : 124–132. doi: 10.1016/j.jsbmb.2015.05.004.
194. Sosvorová L, Bičíková M, Mohapl M et al. Steroids and their metabolites in CSF from shunt as potential predictors of further disease progression in patients with hydrocephalus and the importance of 11b-hydroxysteroid dehydrogenase. Horm Mol Biol Clin Investig 2012; 10 (3): 287–292. doi: 10.1515/hmbci-2012-0002.
195. Chen Z, Liu C, Zhang J et al. Cerebrospinal fluid Ab42, t-tau, and p-tau levels in the differential diagnosis of idiopathic normal-pressure hydrocephalus: a systematic review and meta-analysis. Fluids Barriers CNS 2017; 14 (1): 13. doi: 10.1186/s12987-017-0062-5.
196. Jeppsson A, Wikkelsö C, Blennow K et al. CSF biomarkers distinguish idiopathic normal pressure hydrocephalus from its mimics. J Neurol Neurosurg Psychiatr 2019; 90 (10): 1117–1123. doi: 10.1136/jnnp-2019-320826.
197. Manniche C, Hejl A-M, Hasselbalch SG et al. Cerebrospinal fluid biomarkers in idiopathic normal pressure hydrocephalus versus Alzheimer‘s disease and subcortical ischemic vascular disease: a systematic review. J Alzheimers Dis 2019; 68 (1): 267–279. doi: 10.3233/JAD-180816.
198. Pfanner T, Henri-Bhargava A, Borchert S. Cerebrospinal fluid biomarkers as predictors of shunt response in idiopathic normal pressure hydrocephalus: a systematic review. Can J Neurol Sci 2018; 45 (1): 3–10. doi: 10.1017/cjn.2017.251.
199. Rigamonti D. Adult hydrocephalus. Cambridge: Cambridge University Press 2014.
200. Malm J, Graff-Radford NR, Ishikawa M et al. Influence of comorbidities in idiopathic normal pressure hydrocephalus – research and clinical care. A report of the ISHCSF task force on comorbidities in INPH. Fluids Barriers CNS 2013; 10 (1): 22. doi: 10.1186/2045-8118-10-22.
201. Bech-Azeddine R, Høgh P, Juhler M et al. Idiopathic normal-pressure hydrocephalus: clinical comorbidity correlated with cerebral biopsy findings and outcome of cerebrospinal fluid shunting. J Neurol Neurosurg Psychiatry 2007; 78 (2): 157–161. doi: 10.1136/jnnp.2006.095117.
202. Pomeraniec IJ, Bond AE, Lopes MB et al. Concurrent Alzheimer’s pathology in patients with clinical normal pressure hydrocephalus: correlation of high-volume lumbar puncture results, cortical brain biopsies, and outcomes. J Neurosurg 2016; 124 (2): 382–388. doi: 10.3171/2015.2.JNS142318.
203. Luikku AJ, Hall A, Nerg O et al. Predicting development of Alzheimer‘s disease in patients with shunted idiopathic normal pressure hydrocephalus. J Alzheimers Dis 2019; 71 (4): 1233–1243. doi: 10.3233/JAD-190334.
204. Leinonen V, Koivisto AM, Alafuzoff I et al. Cortical brain biopsy in long-term prognostication of 468 patients with possible normal pressure hydrocephalus. Neurodegener Dis 2012; 10 (1–4): 166–169. doi: 10.1159/000335155.
205. Silverberg GD, Mayo M, Saul T et al. Alzheimer‘s disease, normal-pressure hydrocephalus, and senescent changes in CSF circulatory physiology: a hypothesis. Lancet Neurol 2003; 2 (8): 506–511. doi: 10.1016/s1474-4422 (03) 00487-3.
206. Huovinen J, Helisalmi S, Paananen J et al. Alzheimer‘s disease-related polymorphisms in shunt-responsive idiopathic normal pressure hydrocephalus. J Alzheimers Dis 2017; 60 (3): 1077–1085. doi: 10.3233/JAD-170 583.
207. Nakajima M, Kuriyama N, Miyajima M et al. Background risk factors associated with shunt intervention for possible idiopathic normal pressure hydrocephalus: a nationwide hospital-based survey in Japan. J Alzheimers Dis 2019; 68 (2): 735–744. doi: 10.3233/JAD-180955.
208. Wilson RK, Williams MA. The role of the neurologist in the longitudinal management of normal pressure hydrocephalus. Neurologist 2010; 16 (4): 238–248. doi: 10.1097/NRL.0b013e3181de4907.
209. Kazui H, Miyajima M, Mori E et al. Lumboperitoneal shunt surgery for idiopathic normal pressure hydrocephalus (SINPHONI-2): an open-label randomised trial. Lancet Neurol 2015; 14 (6): 585–594. doi: 10.1016/S1474-4422 (15) 00046-0.
210. Ishikawa M, Oowaki H, Takezawa M et al. Disproportionately enlarged subarachnoid space hydrocephalus in idiopathic normal-pressure hydrocephalus and its implication in pathogenesis. Acta Neurochir Suppl 2016; 122 : 287–290. doi: 10.1007/978-3-319-22533-3_57.
211. Kehler U, Kiefer M, Eymann R et al. PROSAIKA: a prospective multicenter registry with the first programmable gravitational device for hydrocephalus shunting. Clin Neurol Neurosurg 2015; 137 : 132–136. doi: 10.1016/j.clineuro.2015.07.002.
212. Lemcke J, Meier U, Müller C et al. Safety and efficacy of gravitational shunt valves in patients with idiopathic normal pressure hydrocephalus: a pragmatic, randomised, open label, multicentre trial (SVASONA). J Neurol Neurosurg Psychiatry 2013; 84 (8): 850–857. doi: 10.1136/jnnp-2012-303936.
213. Krahulik D, Vaverka M, Hrabalek L et al. Ventriculoperitoneal shunt in treating of idiopathic normal pressure hydrocephalus-single-center study. Acta Neurochir 2020; 162 (1): 1–7. doi: 10.1007/s00701-019-04135-5.
214. Kondziella D, Sonnewald U, Tullberg M et al. Brain metabolism in adult chronic hydrocephalus. J Neurochem 2008; 106 (4): 1515–1524. doi: 10.1111/j.1471-4159.2008.05422.x.
215. Tullberg M, Persson J, Petersen J et al. Shunt surgery in idiopathic normal pressure hydrocephalus is cost-effective – a cost utility analysis. Acta Neurochir 2018; 160 (3): 509–518. doi: 10.1007/s00701-017-3394-7.
216. Bergsneider M, Black PM, Klinge P et al. Surgical management of idiopathic normal-pressure hydrocephalus. Neurosurgery 2005; 57 (3 Suppl): S29–39. doi: 10.1227/01.NEU.0000168186.45363.4D.
217. Williams MA, Malm J. Diagnosis and treatment of idiopathic normal pressure hydrocephalus. Continuum (Minneap Minn) 2016; 22 (2 Dementia): 579–599. doi: 10.1212/CON.0000000000000305.
218. Kiefer M, Unterberg A. The differential diagnosis and treatment of normal-pressure hydrocephalus. Dtsch Arztebl Int 2012; 109 (1–2): 15–25. doi: 10.3238/arztebl.2012.0015.
219. Feletti A, d‘Avella D, Wikkelsø C et al. Ventriculoperitoneal shunt complications in the European idiopathic normal pressure hydrocephalus multicenter study. Oper Neurosurg 2019; 17 (1): 97–102. doi: 10.1093/ons/opy232.
220. Schenker P, Stieglitz LH, Sick B et al. Patients with a normal pressure hydrocephalus shunt have fewer complications than do patients with other shunts. World Neurosurg 2018; 110: e249–e257. doi: 10.1016/j.wneu.2017.10.151.
221. McGirt MJ, Woodworth G, Coon AL et al. Diagnosis, treatment, and analysis of long-term outcomes in idiopathic normal-pressure hydrocephalus. Neurosurgery 2005; 57 (4): 699–705. doi: 10.1093/neurosurgery/57.4.699.
222. Vernet O, Rilliet B. Late complications of ventriculoatrial or ventriculoperitoneal shunts. Lancet 2001; 358 (9293): 1569–1570. doi: 10.1016/s0140-6736 (01) 06 670-3.
223. Hung AL, Vivas-Buitrago T, Adam A et al. Ventriculoatrial versus ventriculoperitoneal shunt complications in idiopathic normal pressure hydrocephalus. Clin Neurol Neurosurg 2017; 157 : 1–6. doi: 10.1016/j.clineuro.2017.03.014.
224. McGovern RA, Kelly KM, Chan AK et al. Should ventriculoatrial shunting be the procedure of choice for normal-pressure hydrocephalus? J Neurosurg 2014; 120 (6): 1458–1464. doi: 10.3171/2014.1.JNS131808.
225. Liu A, Sankey EW, Jusué-Torres I et al. Clinical outcomes after ventriculoatrial shunting for idiopathic normal pressure hydrocephalus. Clin Neurol Neurosurg 2016; 143 : 34–38. doi: 10.1016/j.clineuro.2016.02.013.
226. Chung JJ, Yu J-S, Kim JH et al. Intraabdominal complications secondary to ventriculoperitoneal shunts: CT findings and review of the literature. AJR Am J Roentgenol 2009; 193 (5): 1311–1317. doi: 10.2214/AJR.09.2463.
227. Nakajima M, Miyajima M, Ogino I et al. Use of external lumbar cerebrospinal fluid drainage and lumboperitoneal shunts with strata NSC valves in idiopathic normal pressure hydrocephalus: a single-center experience. World Neurosurg 2015; 83 (3): 387–393. doi: 10.1016/j.wneu.2014.08.004.
228. Kanazawa R, Ishihara S, Sato S et al. Familiarization with lumboperitoneal shunt using some technical resources. World Neurosurg 2011; 76 (3–4): 347–351. doi: 10.1016/j.wneu.2011.02.024.
229. Miyajima M, Kazui H, Mori E et al. One-year outcome in patients with idiopathic normal-pressure hydrocephalus: comparison of lumboperitoneal shunt to ventriculoperitoneal shunt. J Neurosurg 2016; 125 (6): 1483–1492. doi: 10.3171/2015.10.Jns151894.
230. Bayar MA, Tekiner A, Celik H et al. Efficacy of lumboperitoneal shunting in patients with normal pressure hydrocephalus. Turk Neurosurg 2018; 28 (1): 62–66. doi: 10.5137/1019-5149.JTN.18702-16.1.
231. Bloch O, McDermott MW. Lumboperitoneal shunts for the treatment of normal pressure hydrocephalus. J Clin Neurosci 2012; 19 (8): 1107–1111. doi: 10.1016/j.jocn.2011.11.019.
232. Nakajima M, Miyajima M, Ogino I et al. Shunt intervention for possible idiopathic normal pressure hydrocephalus improves patient outcomes: a nationwide hospital-based survey in Japan. Front Neurol 2018; 9 : 421. doi: 10.3389/fneur.2018.00421.
233. Wang VY, Barbaro NM, Lawton MT et al. Complications of lumboperitoneal shunts. Neurosurgery 2007; 60 (6): 1045–1048. doi: 10.1227/01.NEU.0000255469.68129.81.
234. Yang T-H, Chang C-S, Sung W-W et al. Lumboperitoneal shunt: a new modified surgical technique and a comparison of the complications with ventriculoperitoneal shunt in a single center. Medicina (Kaunas) 2019; 55 (10): 643. doi: 10.3390/medicina55100643.
235. Gangemi M, Maiuri F, Naddeo M et al. Endoscopic third ventriculostomy in idiopathic normal pressure hydrocephalus: an Italian multicenter study. Neurosurgery 2008; 63 (1): 62–67. doi: 10.1227/01.NEU.0000335071.37943.40.
236. Tudor IK, Tudor M, McCleery J et al. Endoscopic third ventriculostomy (ETV) for idiopathic normal pressure hydrocephalus (iNPH). Cochrane Database Syst Rev 2015; 7: CD010033. doi: 10.1002/14651858.CD010033.pub2.
237. Tasiou A, Brotis AG, Esposito F et al. Endoscopic third ventriculostomy in the treatment of idiopathic normal pressure hydrocephalus: a review study. Neurosurg Rev 2016; 39 (4): 557–563. doi: 10.1007/s10143-015-0685-4.
238. Craven C, Asif H, Farrukh A et al. Case series of ventriculopleural shunts in adults: a single-center experience. J Neurosurg 2017; 126 (6): 2010–2016. doi: 10.3171/2016.4.JNS16641.
239. Elder BD, Sankey EW, Goodwin CR et al. Outcomes and experience with lumbopleural shunts in the management of idiopathic intracranial hypertension. World Neurosurg 2015; 84 (2): 314–319. doi: 10.1016/j.wneu.2015.03.021.
240. Woo PYM, Pang PKH, Chan KY et al. Ventriculosternal shunting for the management of hydrocephalus: case report of a novel technique. Neurosurgery 2015; 11 (3 Suppl): 371–375. doi: 10.1227/NEU.0000000000000861.
241. Grigorean VT, Sandu AM, Popescu M et al. Our initial experience with ventriculo-epiplooic shunt in treatment of hydrocephalus in two centers. Neurol Neurochir Pol 2017; 51 (4): 290–298. doi: 10.1016/j.pjnns.2017.04.007.
242. Miyake H. Shunt devices for the treatment of adult hydrocephalus: recent progress and characteristics. Neurol Med Chir (Tokyo) 2016; 56 (5): 274–283. doi: 10.2176/nmc.ra.2015-0282.
243. Furlanetti LL, Ballestero MFM, de Oliveira RS. Shunt technology in pediatric neurosurgery: current options and scientific evidence. Arch Pediatr Neurosurg 2020; 2 (2): e342020. doi: 10.46900/apn.v2i2 (May-August).34.
244. Czosnyka Z, Czosnyka M, Richards HK et al. Posture-related overdrainage: comparison of the performance of 10 hydrocephalus shunts in vitro. Neurosurgery 1998; 42 (2): 327–333. doi: 10.1097/00006123-199802000-00069.
245. Ziebell M, Wetterslev J, Tisell M et al. Flow-regulated versus differential pressure-regulated shunt valves for adult patients with normal pressure hydrocephalus. Cochrane Database Syst Rev 2013; 5: CD009706. doi: 10.1002/14651858.CD009706.pub2.
246. Scholz R, Lemcke J, Meier U et al. Efficacy and safety of programmable compared with fixed anti-siphon devices for treating idiopathic normal-pressure hydrocephalus (iNPH) in adults – SYGRAVA: study protocol for a randomized trial. Trials 2018; 19 (1): 566. doi: 10.1186/s13063-018-2951-6.
247. Scheffler P, Oertel MF, Stieglitz LH. Comparison between flow-regulated and gravitational shunt valves in the treatment of normal pressure hydrocephalus: flow-grav study. Neurosurgery 2021; 89 (3): 413–419. doi: 10.1093/neuros/nyab176.
248. Lemcke J, Meier U. Clinical course of disease of patients with normal pressure hydrocephalus: three years after shunt surgery. Aktuelle Neurol 2005; 32 (7): 394–401. doi: 10.1055/s-2005-866882.
249. Toma AK, Papadopoulos MC, Stapleton S et al. Systematic review of the outcome of shunt surgery in idiopathic normal-pressure hydrocephalus. Acta Neurochir (Wien) 2013; 155 (10): 1977–1980. doi: 10.1007/s00701-013-1835-5.
250. Klinge P, Marmarou A, Bergsneider M et al. Outcome of shunting in idiopathic normal-pressure hydrocephalus and the value of outcome assessment in shunted patients. Neurosurgery 2005; 57 (3 Suppl): S40–52. doi: 10.1227/01.NEU.0000168187.01077.2F.
251. Poca MA, Mataró M, Matarín M et al. Good outcome in patients with normal-pressure hydrocephalus and factors indicating poor prognosis. J Neurosurg 2005; 103 (3): 455–463. doi: 10.3171/jns.2005.103.3.0455.
252. Shaw R, Everingham E, Mahant N et al. Clinical outcomes in the surgical treatment of idiopathic normal pressure hydrocephalus. J Clin Neurosci 2016; 29 : 81–86. doi: 10.1016/j.jocn.2015.10.044.
253. Esmonde T, Cooke S. Shunting for normal pressure hydrocephalus (NPH). Cochrane Database Syst Rev 2002; 3: CD003157. doi: 10.1002/14651858.CD003157.
254. Kameda M, Yamada S, Atsuchi M et al. Cost-effectiveness analysis of shunt surgery for idiopathic normal pressure hydrocephalus based on the SINPHONI and SINPHONI-2 trials. Acta Neurochir (Wien) 2017; 159 (6): 995–1003. doi: 10.1007/s00701-017-3115-2.
255. Klinge P, Hellström P, Tans J et al. One-year outcome in the European multicentre study on iNPH. Acta Neurol Scand 2012; 126 (3): 145–153. doi: 10.1111/j.1600-04 04.2012.01676.x.
256. Poca MA, Solana E, Martínez-Ricarte FR et al. Idiopathic normal pressure hydrocephalus: results of a prospective cohort of 236 shunted patients. Acta Neurochir Suppl 2012; 114 : 247–253. doi: 10.1007/978-3-7091-0956-4_49.
257. Peterson KA, Savulich G, Jackson D et al. The effect of shunt surgery on neuropsychological performance in normal pressure hydrocephalus: a systematic review and meta-analysis. J Neurol 2016; 263 (8): 1669–1677. doi: 10.1007/s00415-016-8097-0.
258. Thomas G, McGirt MJ, Woodworth G et al. Baseline neuropsychological profile and cognitive response to cerebrospinal fluid shunting for idiopathic normal pressure hydrocephalus. Dement Geriatr Cogn Disord 2005; 20 (2–3): 163–168. doi: 10.1159/000087092.
259. Gölz L, Ruppert F-H, Meier U et al. Outcome of modern shunt therapy in patients with idiopathic normal pressure hydrocephalus 6 years postoperatively. J Neurosurg 2014; 121 (4): 771–775. doi: 10.3171/2014.6.JNS131211.
260. Bozhkov Y, Roessler K, Hore N et al. Neurological outcome and frequency of overdrainage in normal pressure hydrocephalus directly correlates with implanted ventriculo-peritoneal shunt valve type. Neurol Res 2017; 39 (7): 601–605. doi: 10.1080/01616412.2017.1321300.
261. Kharkar S, Shuck J, Kapoor S et al. Radionuclide shunt patency study for evaluation of suspected ventriculoperitoneal shunt malfunction in adults with normal pressure hydrocephalus. Neurosurgery 2009; 64 (5): 909–916. doi: 10.1227/01.NEU.0000343545.93153.EB.
262. Portnoy HD, Schulte RR, Fox JL et al. Anti-siphon and reversible occlusion valves for shunting in hydrocephalus and preventing post-shunt subdural hematomas. J Neurosurg 1973; 38 (6): 729–738. doi: 10.3171/jns.1973.38.6.0729.
263. Loman J. Effects of alterations in posture on the cerebrospinal fluid pressure. AMA Arch Neurol Psychiatry 1935; 33 (6): 1279. doi: 10.1001/archneurpsyc.1935.02250180138007.
264. Poca MA, Sahuquillo J, Topczewski T et al. Posture-induced changes in intracranial pressure: a comparative study in patients with and without a cerebrospinal fluid block at the craniovertebral junction. Neurosurgery 2006; 58 (5): 899–906. doi: 10.1227/01.NEU.0000209915.16235.6D.
265. Delwel EJ, de Jong DA, Dammers R et al. A randomised trial of high and low pressure level settings on an adjustable ventriculoperitoneal shunt valve for idiopathic normal pressure hydrocephalus: results of the Dutch evaluation programme Strata shunt (DEPSS) trial. J Neurol Neurosurg Psychiatry 2013; 84 (7): 813–817. doi: 10.1136/jnnp-2012-302935.
266. Serarslan Y, Yilmaz A, Cakir M et al. Use of programmable versus nonprogrammable shunts in the management of normal pressure hydrocephalus: a multicenter retrospective study with cost-benefit analysis in Turkey. Medicine 2017; 96 (39): e8185. doi: 10.1097/MD.0000000000008185.
267. Lalou A-D, Czosnyka M, Garnett MR et al. Shunt infusion studies: impact on patient outcome, including health economics. Acta Neurochir 2020; 162 (5): 1019–1031. doi: 10.1007/s00701-020-04212-0.
268. Sarmey N, Kshettry VR, Shriver MF et al. Evidence-based interventions to reduce shunt infections: a systematic review. Childs Nerv Syst 2015; 31 (4): 541–549. doi: 10.1007/s00381-015-2637-2.
269. Pattavilakom A, Xenos C, Bradfield O et al. Reduction in shunt infection using antibiotic impregnated CSF shunt catheters: an Australian prospective study. J Clin Neurosci 2007; 14 (6): 526–531. doi: 10.1016/j.jocn.2006.11.003.
270. Farber SH, Parker SL, Adogwa O et al. Effect of antibiotic-impregnated shunts on infection rate in adult hydrocephalus: a single institution’s experience. Neurosurgery 2011; 69 (3): 625–629. doi: 10.1227/NEU.0b013e31821bc435.
271. Webster J, Osborne S. Preoperative bathing or showering with skin antiseptics to prevent surgical site infection. Cochrane Database Syst Rev 2015; 2: CD004985. doi: 10.1002/14651858.CD004985.pub5.
272. Goodwin CR, Kharkar S, Wang P et al. Evaluation and treatment of patients with suspected normal pressure hydrocephalus on long-term warfarin anticoagulation therapy. Neurosurgery 2007; 60 (3): 497–501. doi: 10.1227/01.NEU.0000255349.71700.E1.
273. Malm J, Kristensen B, Stegmayr B et al. Three-year survival and functional outcome of patients with idiopathic adult hydrocephalus syndrome. Neurology 2000; 55 (4): 576–578. doi: 10.1212/WNL.55.4.576.
274. Alperin N, Oliu CJ, Bagci AM et al. Low-dose acetazolamide reverses periventricular white matter hyperintensities in iNPH. Neurology 2014; 82 (15): 1347–1351. doi: 10.1212/WNL.0000000000000313.
275. Miyake H, Ohta T, Kajimoto Y et al. Diamox® challenge test to decide indications for cerebrospinal fluid shunting in normal pressure hydrocephalus. Acta Neurochir (Wien) 1999; 141 (11): 1187–1193. doi: 10.1007/s007010050417.
276. Del Bigio MR, Di Curzio DL. Nonsurgical therapy for hydrocephalus: a comprehensive and critical review. Fluids Barriers CNS 2015; 13 (1): 3. doi: 10.1186/s12987-016-0025-2.
277. Gerner ST, Kuramatsu JB, Abel H et al. Intraventricular fibrinolysis has no effects on shunt dependency and functional outcome in endovascular-treated aneurysmal SAH. Neurocrit Care 2014; 21 (3): 435–443. doi: 10.1007/s12028-014-9961-3.
278. Kramer AH, Jenne CN, Zygun DA et al. Intraventricular fibrinolysis with tissue plasminogen activator is associated with transient cerebrospinal fluid inflammation: a randomized controlled trial. J Cereb Blood Flow Metab 2015; 35 (8): 1241–1248. doi: 10.1038/jcbfm. 2015.47.
279. Yeom KW, Lober RM, Alexander A et al. Hydrocephalus decreases arterial spin-labeled cerebral perfusion. Am J Neuroradiol 2014; 35 (7): 1433–1439. doi: 10.3174/ajnr.A3891.
280. Owler BK, Pickard JD. Normal pressure hydrocephalus and cerebral blood flow: a review. Acta Neurol Scand 2001; 104 (6): 325–342. doi: 10.1034/j.1600-0404.2001.00092.x.
281. Del Bigio MR. Neuropathology and structural changes in hydrocephalus. Dev Disabil Res Rev 2010; 16 (1): 16–22. doi: 10.1002/ddrr.94.
282. Park E-H, Dombrowski S, Luciano M et al. Alterations of pulsation absorber characteristics in experimental hydrocephalus. J Neurosurg Pediatr 2010; 6 (2): 159–170. doi: 10.3171/2010.5.PEDS09142.
283. Wagshul ME, Eide PK, Madsen JR. The pulsating brain: a review of experimental and clinical studies of intracranial pulsatility. Fluids Barriers CNS 2011; 8 (1): 5. doi: 10.1186/2045-8118-8-5.
284. Hamlat A, Adn M, Sid-Ahmed S et al. Theoretical considerations on the pathophysiology of normal pressure hydrocephalus (NPH) and NPH-related dementia. Med Hypotheses 2006; 67 (1): 115–123. doi: 10.1016/j.mehy.2006.01.029.
285. Schmidt JF, Albeck M, Gjerris F. The effect of nimodipine on ICP and CBF in patients with normal-pressure hydrocephalus. Acta Neurochir 1990; 102 (1–2): 11–13. doi: 10.1007/BF01402178.
286. Keenan S, Mavaddat N, Iddon J et al. Effects of methylphenidate on cognition and apathy in normal pressure hydrocephalus: a case study and review. Br J Neurosurg 2005; 19 (1): 46–50. doi: 10.1080/02688690500080 893.
287. Sosvorova L, Mohapl M, Hill M et al. Steroid hormones and homocysteine in the outcome of patients with normal pressure hydrocephalus. Physiol Res 2015; 64 (Suppl 2): S227–S236. doi: 10.33549/physiolres.933072.
288. Bičíková M, Rípová D, Hill M et al. Plasma levels of 7-hydroxylated dehydroepiandrosterone (DHEA) metabolites and selected amino-thiols as discriminatory tools of Alzheimer‘s disease and vascular dementia. Clin Chem Lab Med 2004; 42 (5): 518–524. doi: 10.1515/CCLM.2004.088.
289. Sosvorova L, Mohapl M, Vcelak J et al. The impact of selected cytokines in the follow-up of normal pressure hydrocephalus. Physiol Res 2015; 64 (Suppl 2): S283–S290. doi: 10.33549/physiolres.933069.
290. Hořínek D, Štěpán-Buksakowska I, Szabó N et al. Difference in white matter microstructure in differential diagnosis of normal pressure hydrocephalus and Alzheimer‘s disease. Clin Neurol Neurosurg 2016; 140 : 52–59. doi: 10.1016/j.clineuro.2015.11.010.
291. Tan K, Meiri A, Mowrey WB et al. Diffusion tensor imaging and ventricle volume quantification in patients with chronic shunt-treated hydrocephalus: a matched case-control study. J Neurosurg 2018; 129 (6): 1611–1622. doi: 10.3171/2017.6.JNS162784.
292. Chen H, Dou Q, Yu L et al. VoxResNet: deep voxelwise residual networks for brain segmentation from 3D MR images. Neuroimage 2018; 170 : 446–455. doi: 10.1016/j.neuroimage.2017.04.041.
293. Irie R, Otsuka Y, Hagiwara A et al. A novel deep learning approach with a 3D convolutional ladder network for differential diagnosis of idiopathic normal pressure hydrocephalus and Alzheimer‘s disease. Magn Reson Med Sci 2020; 19 (4): 351–358. doi: 10.2463/mrms.mp.2019-0106.
294. Antes S, Stadie A, Müller S et al. Intracranial pressure-guided shunt valve adjustments with the Miethke sensor reservoir. World Neurosurg 2018; 109: e642–e650. doi: 10.1016/j.wneu.2017.10.044.
295. Malm J. Improving research and care for patients with idiopathic NPH. Lancet Neurol 2015; 14 (6): 561–563. doi: 10.1016/s1474-4422 (15) 00055-1.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2021 Číslo 6
-
Všechny články tohoto čísla
- Normotenzní hydrocefalus
- Synukleinopatie a jejich laboratorní biomarkery
- Diferenciální diagnostika glioblastomu a solitárních metastáz mozku – úspěch modelů umělé inteligence vytvořených na základě radiomických dat získaných automatickou segmentací z konvenčních MR sekvencí
- Klinicko-radiologický paradox u roztroušené sklerózy – význam vyšetření míchy
- Perorální kladribin v léčbě roztroušené sklerózy – data z celostátního registru ReMuS®
- Protein S 100B a jeho prognostické možnosti u kraniocerebrálních traumat
- Nodo-paranodopatie s protilátkami IgG4 proti neurofascinu-155
- Zobrazení průtoku mozkomíšního moku jednou sekvencí – variable flip angle turbo spin echo
- Aseptická meningitida při akutní hepatitidě E – zkušenosti z jednoho centra
- Rozsáhlé mnohočetné intraneurální gangliony peroneálního nervu
- Syndrom spinální sulkální arterie po stentem asistované embolizaci neprasklého aneuryzmatu vertebrální tepny embolizačním koilem
- Trombóza horní orbitální žíly
- Stiff -person syndrom
- Testy ALBA a POBAV použité k současnému vyšetření dvou pacientů s demencí a jejich dospělých dětí
- Bilaterální paréza hlasivek v rámci recidivujících ischemických cévních mozkových příhod
- Guillain-Barrého syndrom u pacienta s COVID-19
- Obstrukční spánková apnoe u revmatoidního postižení subaxiální krční páteře
- Interpretace plazmatických hladin fenytoinu a valproátu při enterálním podávání u hypoalbuminemické pacientky
- Informace vedoucího redaktora
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Stiff -person syndrom
- Normotenzní hydrocefalus
- Synukleinopatie a jejich laboratorní biomarkery
- Perorální kladribin v léčbě roztroušené sklerózy – data z celostátního registru ReMuS®

