Škála tíže narkolepsie a její psychometrické vlastnosti u pacientů s narkolepsií typu 1 v ČR
Autoři:
J. Bušková 1,2; T. Dvořáková 1,2; R. Kralova 1,2; S. Nevšímalová 3; M. Milata 3; K. Galušková 3; S. Dostálová 3; K. Šonka 3
Působiště autorů:
Oddělení spánkové medicíny, Národní ústav duševního zdraví, Klecany
1; 3. LF UK, Praha
2; Neurologická klinika a Centrum klinických neurověd, 1. LF UK a VFN v Praze
3
Vyšlo v časopise:
Cesk Slov Neurol N 2023; 86(1): 63-68
Kategorie:
Původní práce
doi:
https://doi.org/10.48095/cccsnn202363
Souhrn
Cíl: Studie si kladla za cíl ověřit vhodnost použití Škály tíže narkolepsie (Narcolepsy Severity Scale; NSS) jako základního klinického nástroje pro stanovení subjektivní tíže onemocnění u pacientů s narkolepsií typu 1 (NT1) v ČR. Soubor a metodika: Celkem 78 pacientů ze 2 spánkových center s diagnózou NT1 (29 mužů, 49 žen, průměrný věk 36,1 ± 11,7 let, rozmezí 18–71 let, z toho léčených n = 51) vyplnilo škálu NSS sestávající z 15 otázek zaměřených na výskyt, frekvenci a dopad na denní aktivity všech hlavních narkoleptických příznaků. Současně byli instruováni vyplnit Epworthskou škálu spavosti (Epworth Sleepiness Scale; ESS), Škálu tíže únavy (Fatigue Severity Scale; FSS), Škálu hodnocení úzkosti a deprese při hospitalizaci (Hospital Anxiety and Depression Rating Scale; HADS) a zkrácenou verzi Dotazníku kvality života (Quality of Life Questionnaire; SF-36). Výsledky: Škála NSS vykazuje dobrou vnitřní konzistenci dotazníku pomocí koeficientu Cronbachova a, která je pro celou kohortu pacientů s NT1 0,80, pro skupinu léčených pacientů 0,79 a pro skupinu neléčených pacientů 0,82. Keiser-Meyer-Olkinův index pro celou kohortu je 0,73, což potvrzuje dostatečnou strukturální validitu dotazníku. Nebyl zjištěn signifikantní rozdíl ve skóre NSS léčených a neléčených pacientů, nicméně byla potvrzena korelace celkového skóre NSS s ESS (ρ = 0,61; p < 0,0001) a FSS (ρ = 0,4438; p < 0,0001). Závěr: NSS představuje vhodný a snadno aplikovatelný klinický nástroj ke stanovení subjektivní tíže onemocnění, dobře vystihuje hlavní narkoleptické příznaky a hodnotí jejich vliv na denní aktivity.
Klíčová slova:
ČR – Škála tíže narkolepsie –narkolepsie typu 1 – dospělá populace
Úvod
Narkolepsie typu 1 (NT1), dříve označovaná jako narkolepsie s kataplexií, představuje vzácné neurologické onemocnění s odhadovanou prevalencí v obecné populaci mezi 0,03–0,05 % [1,2]. Jejím patofyziologickým podkladem je imunitně zprostředkovaná ztráta/dysfunkce hypokretinových neuronů v oblasti posterolaterálního hypotalamu u osob, které jsou k rozvoji onemocnění geneticky predisponovány [3].
Mezi hlavní klinické příznaky patří nadměrná denní spavost (excessive daytime sleepiness; EDS) s typickými nepřekonatelnými atakami denního spánku, kataplexie, hypnagogické halucinace, spánková obrna a nekvalitní noční spánek [4]. Nicméně tyto příznaky nebývají vždy plně vyjádřeny u všech pacientů [5,6]. V klinické praxi se setkáváme s vysokou variabilitou nejen jejich samotného výskytu, ale i intenzity obtíží a mírou ovlivnění každodenních aktivit. Ne vždy jsou příznaky zcela typické – je obtížné je kvantifikovat, a tedy konzistentně posoudit tíži narkolepsie. V některých případech mohou tyto nejasnosti dokonce vést k mnohaleté prodlevě mezi nástupem příznaků a stanovením správné diagnózy [6], což významně snižuje kvalitu života pacientů s narkolepsií [7].
Je tedy potřeba zavést do praxe jednoduchý klinický screeningový nástroj, který by umožnil hodnotit frekvenci/závažnost jednotlivých symptomů a jejich celkový dopad na denní aktivity a který by byl současně vhodným nástrojem pro hodnocení efektu léčby. V porovnání s dosud používanými staršími dotazníky, jako jsou např. Epworthská škála spavosti (Epworth Sleepiness Scale; ESS), Ullanlinnská škála narkolepsie, Stanfordský spánkový inventář či Švýcarská škála narkolepsie [8–10], tyto předpoklady lépe splňuje Škála tíže narkolepsie (Narcolepsy Severity Scale; NSS) francouzských autorů z roku 2017 [11]. Naším cílem bylo ověřit její psychometrické vlastnosti v kohortě pacientů s NT1 v ČR a stanovit, zda v plném rozsahu reflektuje potíže, s kterými pacienti přicházejí, s ohledem na jejich denní aktivity.
Metodika
Participanti
Soubor tvořilo 78 dospělých pacientů s NT1 ze 2 spánkových center (65 pacientů Centra pro poruchy spánku a bdění 1. LF UK a VFN, 13 pacientů Oddělení spánkové medicíny NÚDZ, Klecany a 3. LF UK), kteří byli pozváni k diagnostice do spánkové laboratoře pro podezření na narkolepsii, nebo se jednalo o pacienty s již dříve stanovenou diagnózou, kteří byli pozváni k pravidelnému kontrolnímu vyšetření v rámci klinického sledování. U všech pacientů byla diagnóza stanovena na základě aktuálně platných kritérií Mezinárodní klasifikace poruch spánku (International Classification of Sleep Disorders; ICSD-3): nepřekonatelné ataky denního spánku > 3 měsíce, jednoznačná kataplexie, průměrná latence usnutí při testu mnohočetné latence usnutí (Multiple Sleep Latency Test; MSLT) ≤ 8 min s nálezem ≥ 2 period REM spánku (nález REM spánku v prvních 15 min po usnutí v průběhu noci může nahradit 1 periodu REM spánku při MSLT), ev. hladina hypokretinu v mozkomíšním moku ≤ 110 pg/ml [4]. U všech pacientů byla prokázána přítomnost alely DQB1*0602 systému HLA.
Sběr dat
Anglickou verzi výzkumníkům poskytl pro účely studie MAPI Research Institute, Lyon, Francie (No 218774). Nejprve byl proveden dvojitý zpětný překlad NSS z angličtiny do češtiny bilingvním rodilým mluvčím a specialisty na spánkovou medicínu z obou center (JB, KŠ, SN). Překlad byl sloučen a diskutován, dokud nebylo dosaženo konsenzu. Následně bylo vybráno 5 pacientů, kteří byli požádáni o vyjádření, zda jsou otázky jasné a srozumitelné, což shodně potvrdili.
Škála tíže narkolepsie sestává z 15 otázek na 5 hlavních narkoleptických příznaků: ataky spánku a spavost (7 otázek), kataplexie (3 otázky), hypnagogické halucinace (2 otázky), spánková obrna (2 otázky) a nekvalitní noční spánek (1 otázka). Všechny otázky se vztahují k poslednímu měsíci trvání onemocnění [12]. Na otázky hodnotící frekvenci příznaků bylo možné odpovídat za pomocí 6bodové Likertovy škály od 0 do 5, na ostatní otázky hodnotící dopad příznaků na denní fungování pomocí 4bodové Likertovy škály od 0 do 3. Celkové skóre představovalo součet bodů všech otázek, s rozmezím 0–57 bodů, kdy vyšší skóre znamenalo větší závažnost onemocnění. V roce 2020 bylo na základě celkového skóre NSS navrženo rozdělení narkoleptických příznaků na 0–14 mírné, 15–28 střední, 29–42 těžké a ≥ 43 velmi těžké [12,13].
Jako irelevantní se jevila pouze otázka č. 7: „Do jaké míry ovlivňují tato náhlá denní usnutí Vaši schopnost řídit automobil?“, neboť v ČR není nedostatečně kompenzovaná narkolepsie slučitelná s řízením motorových vozidel. Pacienti bez řidičského oprávnění stejně jako ti, kteří toto omezení nepociťují, shodně odpovídali: „Vůbec neovlivňují/neřídím z jiných důvodů“ (= 0 bodů), což může zkreslit informaci stran skutečného dopadu denní spavosti na řízení motorových vozidel. Dotazník byl pacientům předkládán během diagnostického pobytu ve spánkové laboratoři nebo během ambulantního vyšetření v rámci dlouhodobého sledování. Žádný pacient nevyplnil dotazník opakovaně.
Kromě NSS pacienti vyplnili tyto dotazníky: ESS [14], Škála tíže únavy (Fatigue Severity Scale; FSS) [15], Dotazník kvality života: zkrácená verze – 36 (Quality of Life Questionnaire; SF-36) [16] a Škála hodnocení úzkosti a deprese při hospitalizaci (Hospital Anxiety and Depression Rating Scale; HADS) [17].
Statistické metody
K porovnání celkových hodnot dotazníku NSS mezi vybranými skupinami pacientů byl použit dvouvýběrový t-test. Délka onemocnění mezi léčenými a neléčenými pacienty byla porovnána pomocí neparametrického Mann-Whitneyho U testu. Pro vyjádření korelací veličin byl použit neparametrický Spearmanův korelační koeficient. Konzistence dotazníku NSS byla hodnocena koeficientem Cronbachova a a Keiser-Meyer-Olkinovým indexem. Za statisticky signifikantní byly považovány hodnoty p menší než 5 %. Analýza byla zpracována ve statistickém softwaru R, verze 4.2.1 (R Core Team, Auckland, Nový Zéland).
Výsledky
Demografické údaje a deskriptivní data
Do studie bylo zahrnuto 78 pacientů s diagnózou NT1 (29 mužů, 49 žen, průměrný věk 36,1 ± 11,7 let, rozmezí 18–71 let), body mass index (BMI) 23,9 ± 5,6 (rozmezí 19,1–37,2). Průměrný věk při začátku onemocnění byl 20 let, u 38 pacientů (49 %) se první příznaky onemocnění objevily před 18. rokem věku, onemocnění průměrně trvalo 16 let. Hypnagogické halucinace udávalo 35 pacientů (45 %), spánkovou obrnu 32 pacientů (42 %). Z celkového počtu participantů bylo aktuálně léčených 51 pacientů, z toho 28 pacientů bylo léčeno modafinilem, 8 pacientů užívalo metylfenydát, 13 pacientů oxybát sodný, 2 pacienti pitolisant, 13 pacientů tricyklická antidepresiva (11× klomipramin, 1× melipramin, 1× tianepin), 8 pacientů bylo léčeno pomocí selektivních inhibitorů zpětného vychytávání serotoninu (SSRI) (escitalopram, citalopram, fluoxetin, sertralin), 5 venlafaxinem, 3 pacienti užívali ad hoc klonazepam na noc a 1 pacient trazodon na noc.
Průměrné skóre NSS u studované kohorty pacientů s NT1 činilo 26,94 ± 9,86 bodů (rozmezí 7–50 bodů). Z celkového počtu pacientů vykazovalo 11 (14 %) mírné příznaky (0–14 bodů), 35 (45 %) střední (15–28 bodů), 27 (35 %) těžké (29–42) a 5 pacientů (6 %) velmi těžké (≥ 43 bodů). Průměrná skóre ± směrodatná odchylka (standard deviation; SD) jednotlivých otázek u všech pacientů a zvlášť u léčených (n = 51) a neléčených (n = 27) pacientů jsou uvedena v tab. 1. Léčení pacienti se od neléčených signifikantně nelišili z hlediska věku, pohlaví, BMI ani věkem při začátku onemocnění. U léčených pacientů trvalo onemocnění průměrně o 6 let déle (p = 0,0379). Ve výskytu hypnagogických halucinací či spánkové obrny nebyl mezi skupinami léčených a neléčených pacientů s NT1 zjištěn signifikantní rozdíl.
Průměrné skóre ESS činilo 17,1 ± 4,4 body (rozmezí 7–24 bodů), průměrné skóre FSS 41,5 ± 11,6 bodů (rozmezí 10–63), HADS-A: 6,1 ± 4,1 (0–17), HADS-D: 4,9 ± 4,2 (0–18), SF-16 fyzické zdraví: 72,1 ± 15,2 (35–96), SF-36 psychické zdraví: 58,7 ± 15,9 (9–89).
Psychometrické vlastnosti dotazníku
Byla potvrzena vnitřní konzistence dotazníku pomocí koeficientu Cronbachova a, která je pro celou kohortu pacientů s NT1 0,80, pro skupinu léčených pacientů 0,79 a pro skupinu neléčených pacientů 0,82. Keiser-Meyer-Olkinův index pro celou kohortu je 0,73, což potvrzuje dostatečnou strukturální validitu dotazníku.
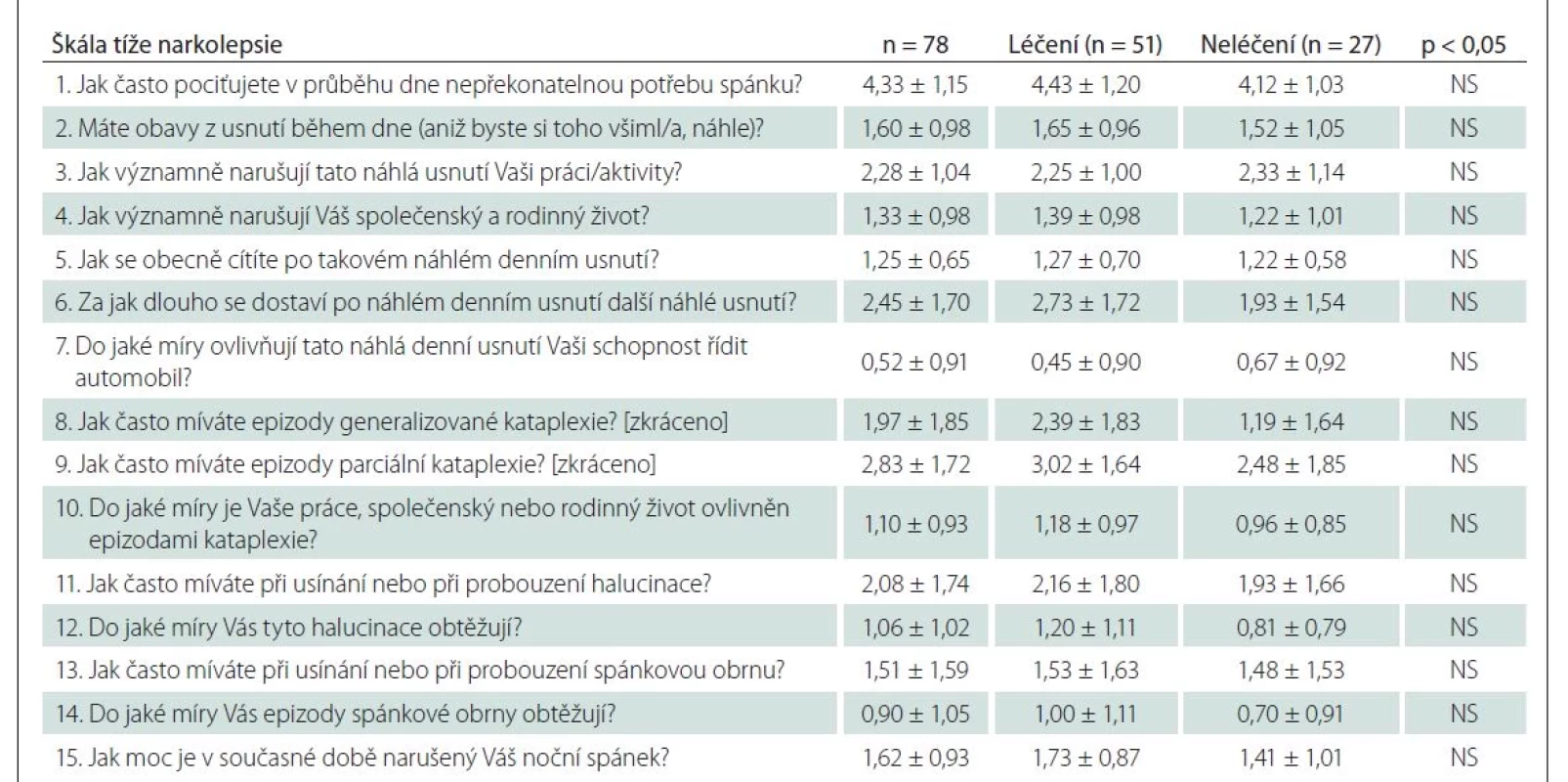
Celkové skóre NSS signifikantně koreluje s otázkami, které se přímo vztahují ke spavosti (otázky 1–4 + 6; obr. 1) – NSS vs. NSS1 (p = 0,0004), NSS2 (p < 0,0001), NSS3 (p = 0,0328), NSS4 (p < 0,0001), NSS6 (p < 0,0001) – i k dalším narkoleptickým příznakům (pro otázky 5 + 8–15 je ve všech případech p < 0,0001), pouze otázka 7 nevykazuje signifikantní korelaci s celkovým skóre NSS (p = 0,2312).
NSS – Škála tíže narkolepsie (Narcolepsy Severity Scale)
Fig. 1. Correlation of NSS total score and questions targeting excessive daytime sleepiness by NSS (ρ = 0.9340; P < 0.0001).
NSS – Narcolepsy Severity Scale
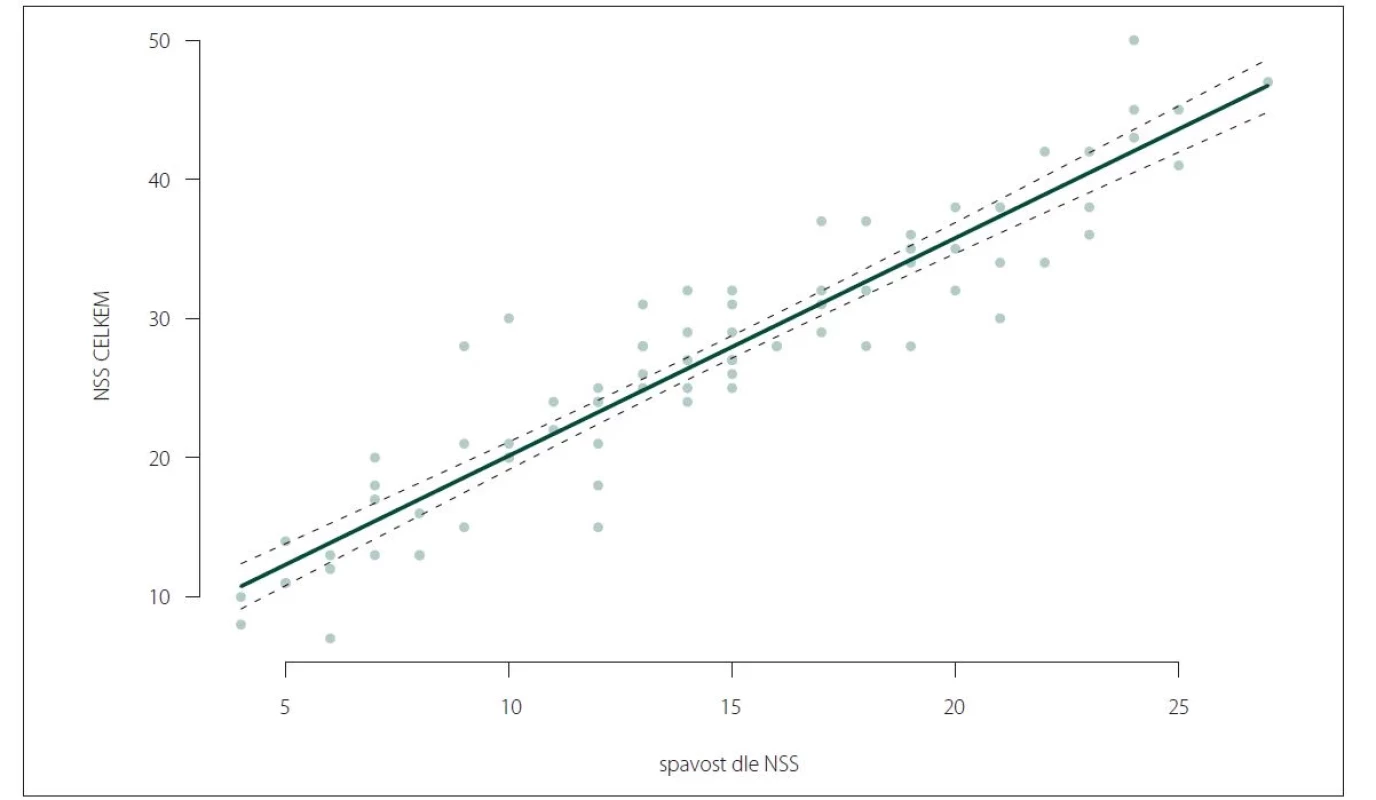
Výsledky dále potvrdily vyšší celkové skóre NSS u pacientů s aktuálním výskytem kataplexie (obr. 2).
NSS – Škála tíže narkolepsie (Narcolepsy
Severity Scale)
Fig. 2. NSS total score in the groups
of patients with and without current
occurrence of cataplexy (P < 0.0001).
NSS – Narcolepsy Severity Scale
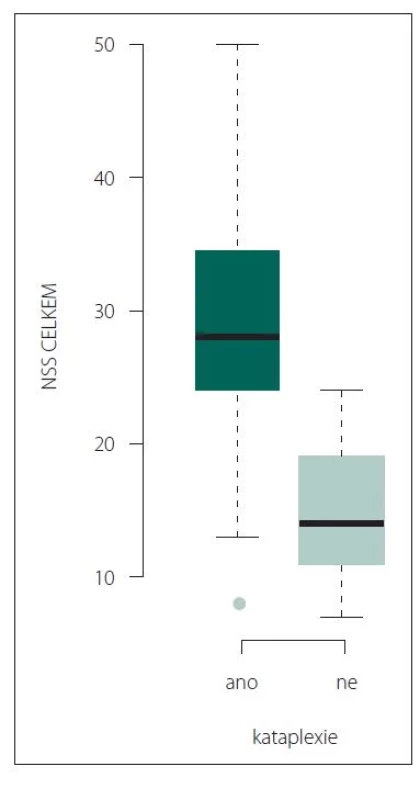
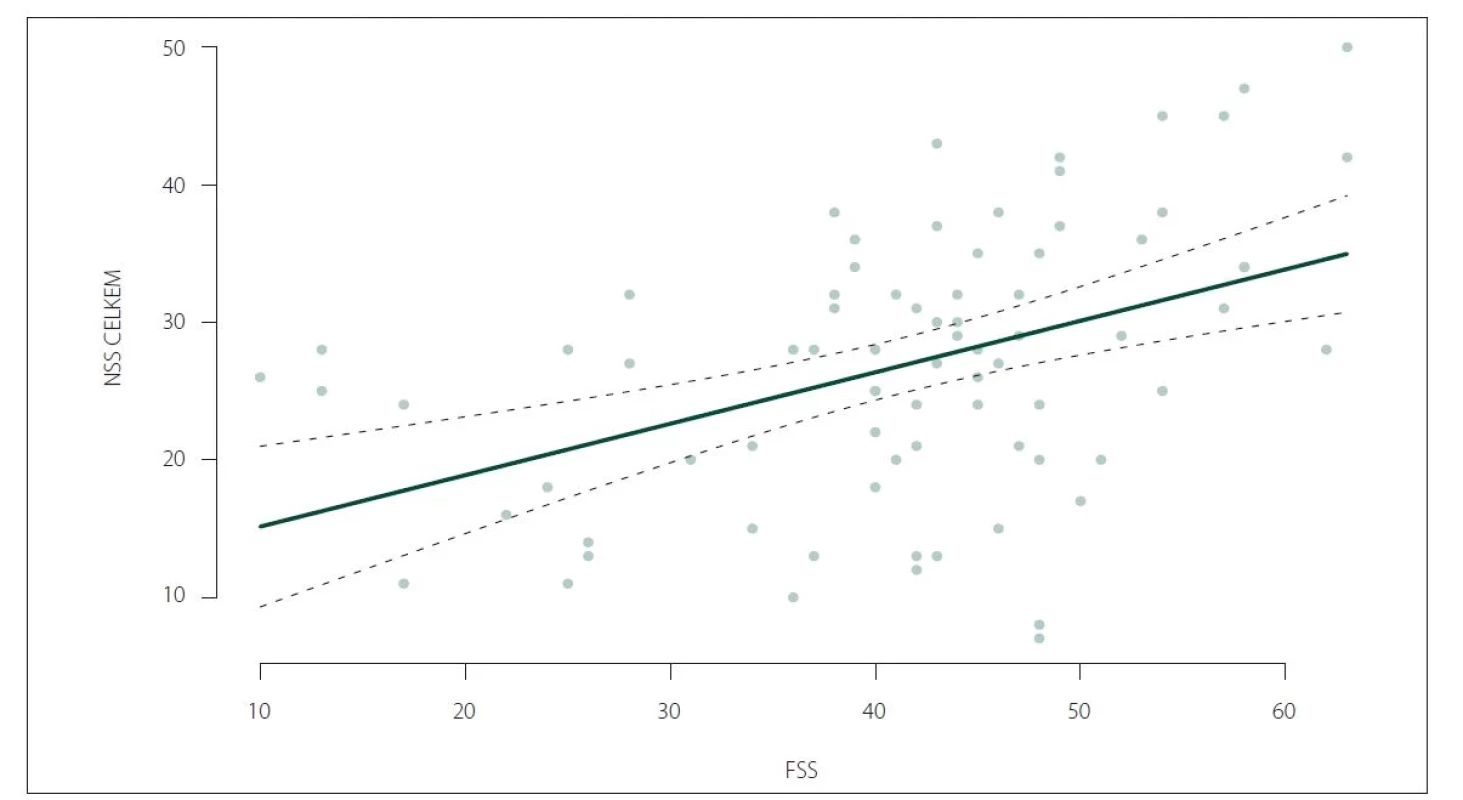
Nebyl zjištěn signifikantní rozdíl ve skóre NSS u léčených a neléčených pacientů (28,37 ± 9,65 vs. 24,22 ± 9,86; p = 0,0806). Nebyla zjištěna signifikantně významná korelace celkového skóre NSS s věkem v době začátku onemocnění ani s délkou trvání onemocnění. Nicméně byla potvrzena korelace celkového skóre NSS a škály ESS (ρ = 0,61; p < 0,0001) a rovněž celkového skóre NSS a škály FSS (ρ = 0,4438; p < 0,0001) (obr. 3, 4).
ESS – Epwothská škála spavosti (Epworth Sleepiness Scale); NSS – Škála tíže narkolepsie (Narcolepsy Severity Scale)
Fig. 3. Correlation of NSS total score and ESS score (ρ = 0.61; P < 0.0001).
ESS – Epworth Sleepiness Scale; NSS – Narcolepsy Severity Scale
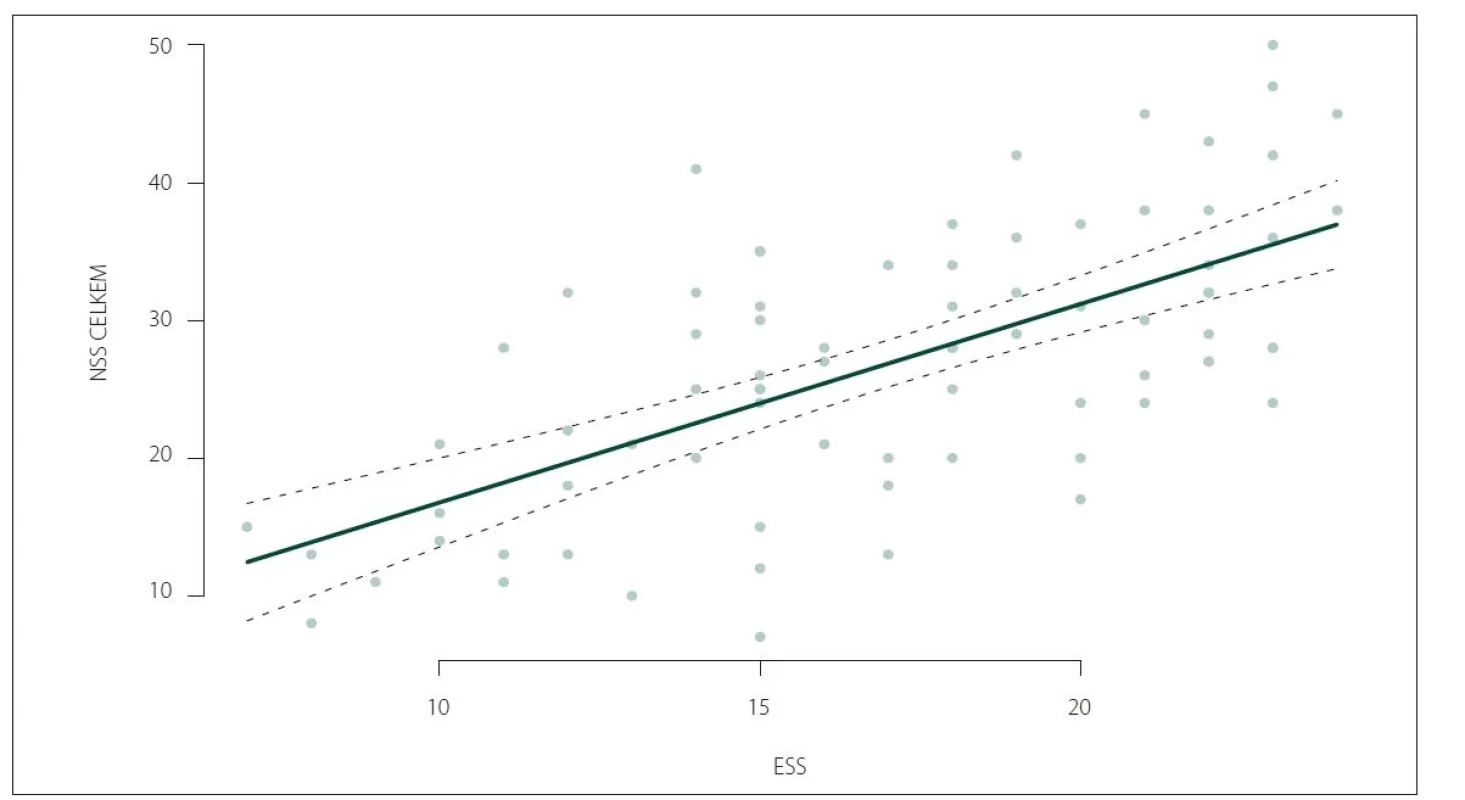
FSS – Škála tíže únavy (Fatigue Severity Scale); NSS – Škála tíže narkolepsie (Narcolepsy Severity Scale)
Fig. 4. Correlation of NSS total score and FSS score (ρ = 0.4438; P < 0.0001).
FSS – Fatigue Severity Scale; NSS – Narcolepsy Severity Scale
ESS signifikantně koreluje s FSS (p = 0,0025), ale nekoreluje s výsledky HADS ani SF-36.
Diskuze
Tato studie prokázala dobré psychometrické vlastnosti české varianty NSS u sledované kohorty pacientů s NT1. Byly zjištěny signifikantně významné korelace jednotlivých položek a celkového skóre, Crombachova a potvrdila vysokou míru vnitřní konzistence dotazníku a jeho dobrou reliabilitu. Z hlediska konvergentní validity je patrná významná korelace mezi celkovým skóre NSS a ESS a FSS.
Průměrné skóre NSS u našich pacientů s NT1 činilo 26,94 ± 9,86, což odpovídá původní francouzské studii 21,57 ± 8,54 [11] a čínské validační studii na dospělých pacientech s NT1 25,44 ± 11,21 [18]. Tato průměrná skóre odpovídají středně závažným příznakům ve škále NSS. Poslední studie, která dosud hodnotila psychometrické vlastnosti NSS, je verze přeložená do brazilské portugalštiny, jejíž celkové skóre je vyšší (33,94 ± 11,23) a spadá do kategorie těžkých příznaků narkolepsie [19]. Sami autoři tento rozdíl vysvětlují horší dostupností léčby narkolepsie v Brazílii [19].
Nadměrná denní spavost je zpravidla iniciálním příznakem NT1 bez ohledu na věk v době začátku onemocnění a je i hlavním perzistujícím a invalidizujícím příznakem, s kterým se setkáváme v rámci dlouhodobého sledování [20]. Základním, široce používaným dotazníkem pro hodnocení nadměrné denní spavosti bez ohledu na její etiologii je ESS [14]. V literatuře je konzistentně uváděno průměrné skóre ESS u pacientů s NT1 mezi 17 a 20 body [12,21], což odpovídá našim zjištěním. Tato škála se však zaměřuje výhradně na spavost a opomíjí další narkoleptické příznaky, tj. nevypovídá o závažnosti onemocnění v plné šíři. Jak ukazuje obr. 2, při subjektivním posuzování tíže narkolepsie hraje významnou roli i výskyt kataplexií. Nevýhodami ESS jsou i její nízká korelace s výsledky MSLT a střední korelace s výsledky testu udržení bdělosti (Maintenance of Wakefulness Test; MWT). Rovněž chybí evidence spolehlivosti při opakovaném použití (test-retest reliabilita) [22]. Námi prokázanou korelaci skóre ESS a celkového skóre NSS potvrzují původní práce [11] i dvě dosud publikované validační studie, čínská [18] a brazilská [19]. V naší skupině pacientů byla současně patrná korelace jednotlivých otázek vztahujících se ke spavosti s celkovým skóre NSS, stejně jako korelace s tíží denní únavy.
Jako screeningová metoda narkoleptických příznaků a jejich rozlišení od příznaků jiných onemocnění, která mohou narkolepsii napodobovat, je dosud používaná Ullanlinnská škála narkolepsie (UNS). Její nevýhodou je ale nekonzistentní specificita v různých studiích [23–25]. Další nástroj pro hodnocení narkoleptických příznaků představuje Stanfordský spánkový inventář (SSI), který pro svůj rozsah 146 otázek není použitelný v běžné klinické praxi [26]. Poslední z používaných škál je Švýcarská škála narkolepsie s 5 otázkami (3 otázky se týkají spavosti a 2 otázky se vztahují ke kataplexii) [8], která je považována za vhodnou screeningovou metodu, ale nepokrývá celé spektrum příznaků a není vhodná pro monitorování efektu léčby. Celkově se tedy NSS v porovnání s dosud rozšířenými škálami ESS, UNS a Švýcarská škála narkolepsie (SNS) jeví jako výhodný a užitečný nástroj.
NSS byla vyvinuta rovněž za účelem sledování efektu léčby a její optimalizace. Původní francouzská studie i dvě následné validační studie potvrzují vhodnost použití škály NSS za tímto účelem [12,18,19]. Součástí těchto sledovaných souborů byli pacienti s NT1, kteří vyplnili dotazník 2×, jednou jako neléčení a s odstupem několika měsíců jako léčení, přičemž ve všech zmíněných studiích byl pozorován pokles celkového skóre NSS. Takovou možnost párového testování naše kohorta neposkytovala. Vzhledem k nízké incidenci NT1 nelze v ČR vytvořit v přiměřeném čase dostatečně početný soubor nových pacientů, které by bylo možné testovat opakovaně. Námi sledovaní léčení i neléčení pacienti převážně zůstávali v pásmu středně těžkých příznaků. Srovnatelná hodnota NSS u obou skupin má několik důvodů. Neléčení pacienti se většinou nenacházeli na začátku svého onemocnění ani jim nebyla recentně stanovena diagnóza – byli to nemocní, kteří se již dříve rozhodli nebrat léky, většinou pro mírnou závažnost příznaků. Většina z nich měla navíc možnost optimálního denního režimu s plánovaným denním spánkem a minimem emočních podnětů, což je další důvod, proč dlouhodobě nepotřebují farmakoterapii a hodnotí svůj klinický stav jako spíše lehký. Svou roli může hrát i skutečnost, že spavost – jako hlavní příznak NT1 – i její další klinické projevy byly v době pandemie COVID-19 ovlivněny možností volnějšího plánování denních zdřímnutí a prodloužením nočního spánku. Zejména pacienti pracující na dálku v této době udávali celkově nižší intenzitu spavosti i menší počet kataplexií [27]. Některé narkoleptické příznaky se rovněž mohou zlepšit v důsledku změny životního stylu, identifikací a vyvarováním se zhoršujících/vyvolávajících faktorů i v důsledku přirozeného vývoje onemocnění [28–30]. Tato práce nesledovala vliv pandemie na subjektivní vnímání tíže narkolepsie, nelze ale vyloučit, že psychosociální a ekonomické faktory s ní spojené mohly ovlivnit výsledky korelací NSS s úzkostným/depresivním prožíváním a vlastní kvalitou života. Přetrvávající vyšší skóre NSS u léčených pacientů rovněž mohlo být ovlivněno skutečností, že někteří pacienti spadající do pásma těžkých/velmi těžkých příznaků nebyli dostatečně farmakoresponzivní.
Závěrem lze konstatovat, že NSS představuje krátký, vnitřně konzistentní a snadno aplikovatelný klinický nástroj ke stanovení závažnosti klinických příznaků narkolepsie typu 1 a jejich důsledků. Předchozí studie prokázaly i vhodnost jejího použití pro sledování efektu léčby.
Etické aspekty
Práce byla provedena ve shodě s Helsinskou deklarací z roku 1975 a jejími revizemi v letech 2004 a 2008. Provedení studie bylo schváleno etickými komisemi obou pracovišť (VFN v Praze: č.j. 16/19 Grant AZV VES 2020 VFN, datum schválení 23. 5. 2019 a Národní ústav duševního zdraví, Klecany: c.j. 141/19, datum schválení 19. 6. 2019). Všichni pacienti podepsali informovaný souhlas s účastí ve studii.
Finanční podpora
Práce byla podpořena z programového projektu Ministerstva zdravotnictví ČR s reg. č. NU20-04-00088 a programem Cooperatio Neuroscience Charles University. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
MUDr. Jitka Bušková, Ph.D.
Oddělení spánkové medicíny
Národní ústav duševního zdraví
Topolová 748
250 67 Klecany
e-mail: jitka.buskova@nudz.cz
Přijato k recenzi: 18. 8. 2023
Přijato do tisku: 17. 1. 2023
Zdroje
1. Luca G, Haba-Rubio J, Dauvilliers Y et al. Clinical, polysomnographic and genome-wide association analyses of narcolepsy with cataplexy: a European Narcolepsy Network study. J Sleep Res 2013; 22 (5): 482–495. doi: 10.1111/jsr.12044.
2. Longstreth WT Jr, Koepsell TD, Ton TG et al. The epidemiology of narcolepsy. Sleep 2007; 30 (1): 13–26. doi: 10.1093/sleep/30.1.13.
3. Liblau RS, Vassalli A, Seifinejad A et al. Hypocretin (orexin) biology and the pathophysiology of narcolepsy with cataplexy. Lancet Neurol 2015; 14 (3): 318–328. doi: 10.1016/S1474-4422 (14) 70218-2.
4. American Academy of Sleep Medicine. International classification of sleep disorders – third edition (ICSD-3). Darien, IL: American Academy of Sleep Medicine 2014.
5. Bassetti CLA, Adamantidis A, Burdakov D et al. Narcolepsy – clinical spectrum, aetiopathophysiology, diagnosis and treatment. Nat Rev Neurol 2019; 15 (9): 519–539. doi: 10.1038/s41582-019-0226-9.
6. Zhang Z, Dauvilliers Y, Plazzi G et al. Idling for decades: a European study on risk factors associated with the delay before a narcolepsy diagnosis. Nat Sci Sleep 2022; 14 : 1031–1047. doi: 10.2147/NSS.S359980.
7. Ohayon MM. Narcolepsy is complicated by high medical and psychiatric comorbidities: a comparison with the general population. Sleep Med 2013; 14 (6): 488–492. doi: 10.1016/j.sleep.2013.03.002.
8. Kallweit U, Schmidt M, Bassetti CL. Patient-reported measures of narcolepsy: the need for better assessment. J Clin Sleep Med 2017; 13 (5): 737–744. doi: 10.5664/jcsm.6596.
9. Akerstedt T, Gillberg M. Subjective and objective sleepiness in the active individual. Int J Neurosci 1990; 52 (1–2): 29–37. doi: 10.3109/00207459008994241.
10. MacLean AW, Fekken GC, Saskin P et al. Psychometric evaluation of the Stanford Sleepiness Scale. J Sleep Res 1992; 1 (1): 35–39. doi: 10.1111/j.1365-2869.1992.tb00006.x.
11. Dauvilliers Y, Beziat S, Pesenti C et al. Measurement of narcolepsy symptoms: the Narcolepsy Severity Scale. Neurology 2017; 88 (14): 1358–1365. doi: 10.1212/WNL.000 0000000003787.
12. Dauvilliers Y, Barateau L, Lopez R et al. Narcolepsy Severity Scale: a reliable tool assessing symptom severity and consequences. Sleep 2020; 43 (6): zsaa009. doi: 10.1093/sleep/zsaa009.
13. Pimentel Filho LH, Frange C, Coelho FMS. Narcolepsy Severity Scale: experience of a Brazilian Sleep Center. Sleep 2020; 43 (9): zsaa113. doi: 10.1093/sleep/zsaa113.
14. Johns MW. A new method for measuring daytime sleepiness: the Epworth sleepiness scale. Sleep 1991; 14 (6): 540–545. doi: 10.1093/sleep/14.6.540.
15. Hjollund NH, Andersen JH, Bech P. Assessment of fatigue in chronic disease: a bibliographic study of fatigue measurement scales. Health Qual Life Outcomes 2007; 5 : 12. doi: 10.1186/1477-7525-5-12.
16. Ware JE Jr, Gandek B. Overview of the SF-36 health survey and the International Quality of Life Assessment (IQOLA) project. J Clin Epidemiol 1998; 51 (11): 903–912. doi: 10.1016/s0895-4356 (98) 00081-x.
17. Zigmond AS, Snaith RP. The hospital anxiety and depression scale. Acta Psychiatr Scand 1983; 67 (6): 361–370. doi: 10.1111/j.1600-0447.1983.tb09716.x.
18. Li C, Spruyt K, Zhang C et al. Reliability and validity of the Chinese version of Narcolepsy Severity Scale in adult patients with narcolepsy type 1. Sleep Med 2021; 81 : 86–92. doi: 10.1016/j.sleep.2021.02.008.
19. Pimentel Filho LH, Gomes ACD, Frange C et al. Validation of the Brazilian Portuguese version of the narcolepsy severity scale. Sleep Med 2020; 76 : 134–139. doi: 10.1016/j.sleep.2020.10.016.
20. Ohayon MM, Ferini-Strambi L, Plazzi G et al. Frequency of narcolepsy symptoms and other sleep disorders in narcoleptic patients and their first-degree relatives. J Sleep Res 2005; 14 (4): 437–445. doi: 10.1111/j.1365-2869.2005.00476.x.
21. Frauscher B, Ehrmann L, Mitterling T et al. Delayed diagnosis, range of severity, and multiple sleep comorbidities: a clinical and polysomnographic analysis of 100 patients of the innsbruck narcolepsy cohort. J Clin Sleep Med 2013; 9 (8): 805–812. doi: 10.5664/jcsm.2926.
22. Kendzerska TB, Smith PM, Brignardello-Petersen R et al. Evaluation of the measurement properties of the Epworth sleepiness scale: a systematic review. Sleep Med Rev 2014; 18 (4): 321–331. doi: 10.1016/j.smrv.2013.08.002.
23. Sturzenegger C, Bassetti CL. The clinical spectrum of narcolepsy with cataplexy: a reappraisal. J Sleep Res 2004; 13 (4): 395–406. doi: 10.1111/j.1365-2869.2004.00422.x.
24. Wing YK, Li RH, Ho CK et al. A validity study of Ullanlinna Narcolepsy Scale in Hong Kong Chinese. J Psychosom Res 2000; 49 (5): 355–361. doi: 10.1016/s0022-3999 (00) 00179-3.
25. Hublin C, Kaprio J, Partinen M et al. The Ullanlinna Narcolepsy Scale: validation of a measure of symptoms in the narcoleptic syndrome. J Sleep Res 1994; 3 (1): 52–59. doi: 10.1111/j.1365-2869.1994.tb00104.x.
26. Anic-Labat S, Guilleminault C, Kraemer HC et al. Validation of a cataplexy questionnaire in 983 sleep--disorders patients. Sleep 1999; 22 (1): 77–87. doi: 10.1093/sleep/22.1.77.
27. Nigam M, Hippolyte A, Dodet P et al. Sleeping through a pandemic: impact of COVID-19-related restrictions on narcolepsy and idiopathic hypersomnia. J Clin Sleep Med 2022; 18 (1): 255–263. doi: 10.5664/jcsm.9556.
28. Zhang J, Han F. Sleepiness in narcolepsy. Sleep Med Clin 2017; 12 (3): 323–330. doi: 10.1016/j.jsmc. 2017.03.008.
29. Pizza F, Franceschini C, Peltola H et al. Clinical and polysomnographic course of childhood narcolepsy with cataplexy. Brain 2013; 136 (Pt 12): 3787–3795. doi: 10.1093/brain/awt277.
30. Kovalská P, Kemlink D, Topinková E et al. Higher body mass index in narcolepsy with cataplexy: life - -long experience. Sleep Med 2017; 32 : 277. doi: 10.1016/ j.sleep.2016.11.010.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2023 Číslo 1
-
Všechny články tohoto čísla
- Progresivní roztroušená skleróza ve světle nejnovějších poznatků
- Doporučení pro strukturální zobrazení MR mozku v diagnostice epilepsie
- Dietní přístupy specifické pro pacienty s roztroušenou sklerózou
- Editorial
- Specifické nástroje pro hodnocení kvality života související se zdravím u mladých pacientů po ischemické cévní mozkové příhodě
- Úloha dynamické MR krční páteře a dynamických evokovaných potenciálů v diagnóze degenerativní cervikální myelopatie
- Validizace elektronického testu paměti ALBAV
- Psychopatologické súvislosti alexitýmie u pacientov s vertebrogénnym algickým syndrómom
- Poděkování recenzentům
- Škála tíže narkolepsie a její psychometrické vlastnosti u pacientů s narkolepsií typu 1 v ČR
- Dekompresivní kraniektomie s duroplastikou a bez provedené duroplastiky – výhody a nevýhody
- Souvislost mezi hladinou volného trijodtyroninu v séru a skóre Mini-Mental State Examination po prodělané akutní ischemické CMP
- První český pacient s deficitem aminoacylázy 1
- Komentář k článku autorů Kövári et al Ovlivnění spasticity pomocí elektrické stimulace podle Jantsche – pilotní studie
- Komentář k článku autorů Ehler et al Onemocnění bederní páteře – nová neurologická nemoc z povolání
- Doc. MUDr Zbyněk Kalita, CSc. dovršil 80 let zdařilého života
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Progresivní roztroušená skleróza ve světle nejnovějších poznatků
- Doporučení pro strukturální zobrazení MR mozku v diagnostice epilepsie
- Dietní přístupy specifické pro pacienty s roztroušenou sklerózou
- Úloha dynamické MR krční páteře a dynamických evokovaných potenciálů v diagnóze degenerativní cervikální myelopatie
