Současný pohled na imunopatogenezi myasthenia gravis
The Current View of Immunopathogenesis of Myasthenia Gravis
Myasthenia gravis (MG) is an autoimmune disease that results in failure of neuromuscular transmission. Earlier theories of the dominant role of pathologic autoantibodies against target antigens (nicotinic acetylcholine receptor, muscle-specific tyrosine kinase and low-density lipoprotein receptor) were corrected following discovery of immune dysregulation at the level of T cells – between Th1 and Th2 and/or between T regulatory cells and Th17 cells, proliferation of CD8+ lymphocytes, chemokines, cytokines and other molecules. The immune system dysfunction can occur at different levels of the immune response: helper CD4+ T cells, cytotoxic CD8+ T cells, regulatory CD4+CD25+ T lymphocytes, Th17 lymphocytes, B lymphocytes and plasma cells. Thymus plays a dominant immunopathogenetic role in younger patients with MG, while extrathymic mechanisms are applied in older patients. Different immunologic mechanisms play a role in MG associated with a thymoma.
Key words:
myasthenia gravis – thymus – autoantibodies – T lymphocytes – B lymphocytes – cytokines
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
M. Jakubíková 1; J. Piťha 1,2
Authors‘ workplace:
Neurologická klinika a Centrum klinických neurověd, 1. LF UK a VFN v Praze
1; MS Centrum Teplice, Neurologické oddělení, Krajská zdravotní, a. s. – Nemocnice Teplice o. z.
2
Published in:
Cesk Slov Neurol N 2015; 78/111(6): 649-654
Category:
Review Article
Overview
Myasthenia gravis (MG) je autoimunitní onemocnění, v jehož důsledku dochází k poruše nervosvalového přenosu. Dřívější představy o dominující roli patologických autoprotilátek namířených proti cílovým antigenům (nikotinovému acetylcholinovému receptoru, svalově specifické tyrozinkináze a nízkodenzitnímu lipoproteinovému receptoru) byly korigovány nálezem imunitní dysregulace na úrovni T lymfocytů – mezi Th1 a Th2 a/ nebo mezi T regulačními lymfocyty a Th17 buňkami, proliferací CD8+ lymfocytů, chemokinů, cytokinů a dalších molekul. K dysfunkci imunitního systému může dojít na různých úrovních imunitní odpovědi: pomocné CD4+ T lymfocyty, cytotoxické CD8+ T lymfocyty, regulační CD4+CD25+ T lymfocyty, Th17 lymfocyty, B lymfocyty i plazmatické buňky. Dominující roli v imunopatologických dějích má u mladších pacientů thymus, u nemocných starších se uplatňují extrathymické mechanizmy. Odlišné imunopatologické mechanizmy působí u myasthenie asociované s thymomem.
Klíčová slova:
myasthenia gravis – thymus – autoprotilátky – T lymfocyty – B lymfocyty – cytokiny
Úvod
Myasthenia gravis (MG) je onemocnění nervosvalového přenosu charakterizované kolísavou slabostí a unavitelností příčně pruhovaných svalů. MG je autoimunitní onemocnění, kde několik typů autoprotilátek pod vlivem buněčných imunitních mechanizmů interferuje se strukturami nervosvalového spojení, které mohou vést k poruše jeho funkce [1].
Imunopatogeneze MG
Imunopatogeneze onemocnění je komplexní. Autoimunitní nemoci mají některé společné vlastnosti, z čehož vyplývá, že k jejich rozvoji vedou společné patogenní mechanizmy. Predisponující jsou faktory genetické, epigenetické, hormonální, nedostatek vitaminu D a možné spouštěcí faktory (infekce, chronický stres), které interagují s imunitním systémem. MG je autoprotilátkami zprostředkovaná nemoc, kde kromě patologie thymu hraje, dle poznatků z poslední doby, podstatnou roli i dysregulace pomocných a regulačních T lymfocytů [1].
Thymus a MG
Thymus je lymfoepiteliální orgán, jehož hlavní úlohou je maturace T lymfocytů (tzv. thymopoeza), tj. selekce buněk, které vytvoří repertoár zralých T buněk, a zároveň delece lymfocytů, jež reagují s autoantigeny [2]. Zásadní je rozlišovat mezi nethymomatózní (bez přítomnosti nádoru thymu – thymomu) a thymomatózní (paraneoplastickou) formou MG. U nethymomatózní formy MG se jedná z histopatologického hlediska buď o folikulární hyperplazii, nebo atrofii thymu.
Nethymomatózní autoimunitní forma MG
U mladších pacientů s protilátkami proti acetylcholinovému receptoru (AChR) dochází v thymu k indukci exprese AChR, která následuje po jeho uvolnění z thymických myoidních buněk. Myoidní buňky jsou u MG zdrojem antigenních epitopů, které jsou v kontextu s molekulami MHC II. třídy rozpoznávány T buněčnými receptory autoreaktivních CD4+ T lymfocytů jako cizorodé. V součinnosti se zánětlivými cytokiny dochází k aktivaci dalších autoreaktivních T lymfocytů, ale i B lymfocytů, které se vymknou kontrole T regulujících lymfocytů. To způsobí jak v thymu, tak i na periferii stimulaci specifických B lymfocytů, které produkují protilátky proti AChR. Dochází k novotvorbě drobných arteriol, jež napomáhají zvýšené atrakci lymfocytů do lymfoidních orgánů. Morfologickým důsledkem je tvorba germinativních center na rozhraní dřeně a kůry brzlíku s tzv. folikulární hyperplazií [2]. V nich jsou nahromaděny autoreaktivní T a B lymfocyty, hlavně fenotypy CD4+/ CD8 – a CD4 – / CD8+. Dřeňové epiteliální struktury obsahují nezralé formy svalových buněk (myoidní buňky), na kterých jsou lokalizovány AChR [3]. Předpokládá se, že autoagresivní reakce proti AChR může být iniciována přímo v thymu a že germinální centra jsou evidentně místo, kde dochází k protilátkové odpovědi B lymfocytů proti AChR [4]. Celá řada studií prokázala v hyperplastickém thymu navíc další důležité procesy, které odrážejí intenzivní aktivaci imunitního systému. V hyperplastickém thymu jsou na rozdíl od kontrolních thymů přítomny buňky produkující zánětlivé cytokiny jako IL‑12, IFN-gama, IL‑1 a IL‑6 [5]. Tento nález folikulární hyperplazie je patrný zejména u nemocných mladšího věku (do 45 – 50 let) s tzv. séropozitivní formou AChR + MG. Až u 50 % séronegativních pacientů, kteří nemají autoprotilátky proti AChR, se v thymu nalézají změny popisované jako „thymitis like“ infiltráty, což jsou podobné změny jako u folikulární hyperplazie thymu séropozitivních pacientů s MG, jen počet germinativních center je výrazně nižší [6]. U starších pacientů je zřetelná atrofie (involuce) thymu, v imunopatogenezi se účastní extrathymické mechanizmy.
Thymomatózní paraneoplastická forma MG
Asi 10 – 15 % pacientů má MG asociovanou s thymomem (MGAT) [7], 1/ 3 z nich tvoří maligní thymomy s invazivním růstem. Imunopatogeneze MGAT je heterogenní, uplatňují se jak centrální imunitní mechanizmy (thymus, thymom), tak periferní extrathymické mechanizmy. Paraneoplastická MGAT začíná v thymomu vývojem abnormálních netolerogenních T lymfocytů vůči AChR, které se následně exportují do periferních imunitních orgánů (lymfatické uzliny, slezina, kostní dřen a často i normální thymus mimo thymomu). Tady dochází k aktivaci T lymfocytů, k interakcím s B lymfocyty a nakonec k produkci autoprotilátek proti AChR [8]. To také vysvětluje fakt, proč po odstranění thymomu i s reziduální tkání thymu nedochází k poklesu titru protilátek proti AChR [9]. Všechny thymomy u pacientů s MG také vyplavují zralé naivní T lymfocyty do periferie a zejména autoreaktivním CD4+ T lymfocytům se přičítá významná role v patogenezi MGAT [10]. Proto při léčbě MGAT má kromě thymektomie rozhodující význam imunosupresivní léčba. Autoimunitní regulátor (AIRE) je transkripční faktor, který je produkován subpopulací medulárních epiteliálních buněk thymu a je nevyhnutný pro expresi tkáňově specifických antigenů, takže se považuje za klíčový faktor v centrální toleranci thymu. U většiny MGAT byly nalezeny hrubé defekty v expresi AIRE [11], nicméně byly také pozorovány u thymomů, které nebyly spojeny s MG, což naznačuje, že samotný nedostatek AIRE nevede k rozvoji MG.
Autoprotilátky
Patologické autoprotilátky jsou v cca 80 % případů namířeny proti nikotinovému AChR na postsynaptické membráně nervosvalové ploténky (AChR + MG) nebo v 5 – 10 % proti svalově specifické tyrozinkináze (MuSK, MuSK + MG). V roce 2011 byly u japonských myasteniků objeveny nové autoprotilátky proti receptoru, který je spojen s nízkodenzitním lipoproteinem (Low ‑ density lipoprotein 4; Lrp4), následně byly referovány i v Německu a USA [12]. Existují i tzv. séronegativní formy onemocnění, kde běžně dostupnými metodami neprokážeme v séru žádné známé protilátky asociované s MG. U této formy se velmi pravděpodobně jedná o velmi nízké titry výše uvedených cirkulujících autoprotilátek (tzv. nízkoafinitní protilátky), které nejsou detekovatelné dostupnými metodami.
V důsledku aktivace autoreaktivních B lymfocytů dochází k produkci protilátek proti AChR, které se zpočátku vážou na dva sousední receptory a následně blokují a destruují AChR tzv. membrány atakujícím komplexem. Aktivuje se komplement, oxid dusíku a zánětlivé cytokiny. Dochází k internalizaci AChR, vyhlazení junkčních záhybů, redukci AChR a následné blokádě nervosvalového přenosu. Pokud není zničení AChR kompenzováno jeho zvýšenou syntézou, důsledkem je snížení funkčních AChR na postsynaptické membráně, což vede k manifestaci myastenických příznaků [13]. Autoprotilátky proti AChR jsou polyklonální a hlavně z podskupin IgG1 a IgG3 (komplement aktivující). Z klinického hlediska titry protilátek jsou mezi pacienty značně variabilní a jejich hodnoty nekorelují s klinickou závažností MG. U pacientů léčených imunosupresivy mohou být protilátky proti AChR falešně negativní nebo se jejich hladina může snížit. Po plazmaferéze rovněž dochází k snížení hladiny protilátek spolu s klinickým zlepšením [14]. Protilátky proti AChR jsou často nalezeny i u pacientů s dlouhodobou klinickou remisí [15].
Pacienti s thymomem mají ve většině případů pozitivní protilátky proti AChR [16]. Naopak falešně pozitivní protilátky proti AChR můžeme nalézt u pacientů s thymomem bez MG, přičemž jejich nález nijak nepredikuje vznik MG [17]. Je popisován výskyt protilátek proti AChR i u jiných autoimunitních chorob.
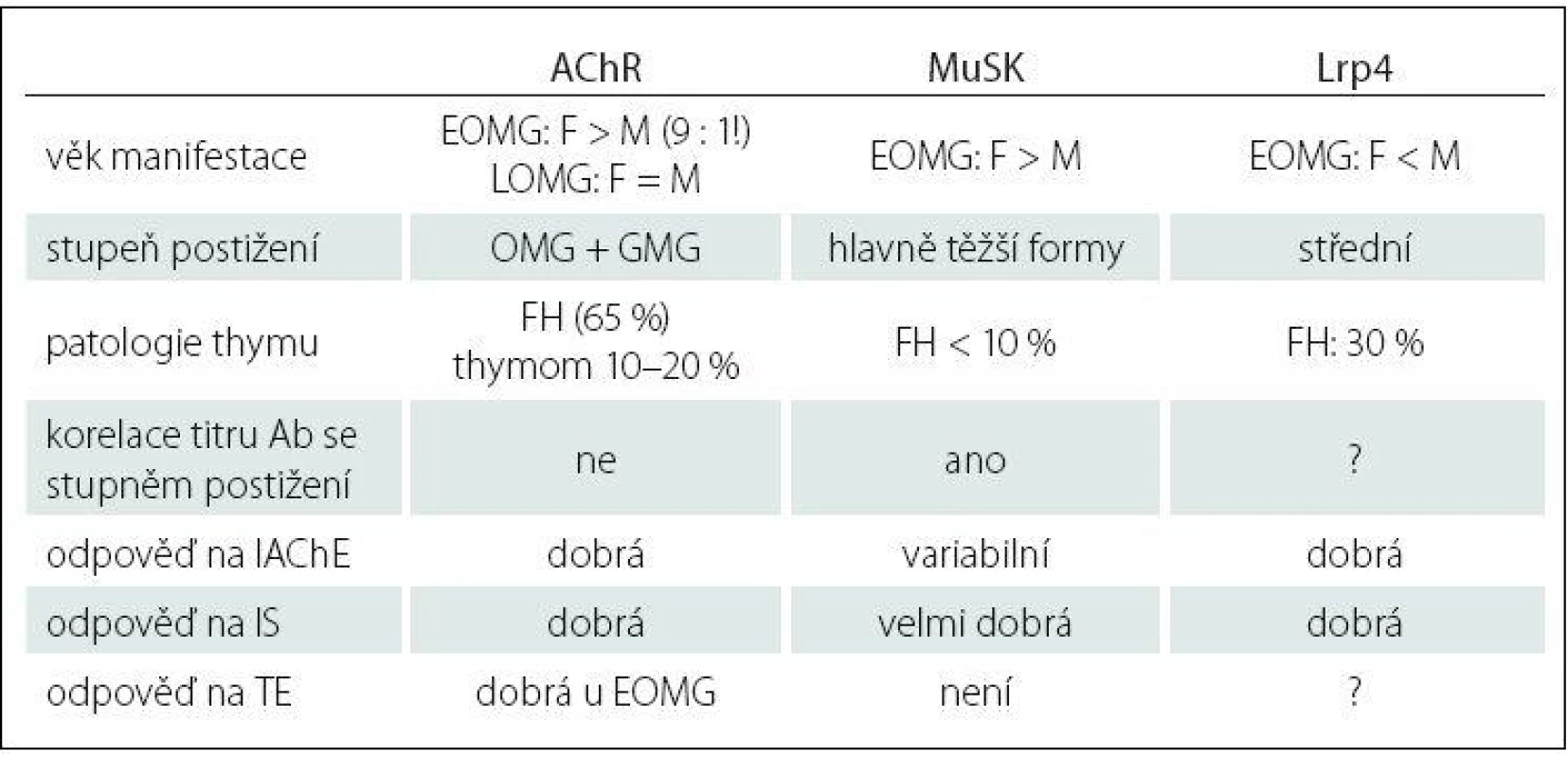
Imunopatologický vliv autoprotilátek je zřejmý u 80 – 85 % nemocných. Tato forma choroby se označuje jako séropozitivní AChR + MG. U 40 % tzv. séronegativních pacientů byly nalezeny protilátky proti MuSK, což je povrchový transmembránový receptorický protein, který je součástí membrány svalového vlákna a má podstatnou roli pro zabudování AChR do postsynaptické membrány nervosvalové ploténky, tzv. clustering (shlukování) AChR [18]. Hoch et al v roce 2001 zjistili, že část pacientů se séronegativní formou MG má autoprotilátky proti MuSK, hlavně třídy IgG4 [19]. Autoprotilátky jsou namířeny proti extracelulární části MuSK a způsobují inhibici aktivace MuSK indukované agrinem, tzn. poruchu agregace, clusteringu AChR a následně postsynaptické selhání neuromuskulární transmise. U pacientů s protilátkami proti MuSK je thymus většinou atrofický. Nejnovějším objevem na poli výzkumu autoprotilátek u MG jsou již zmiňované anti‑Lrp4 protilátky, které patří hlavně do podtříd IgG1 a IgG2. Lrp4 je člen rodiny strukturně příbuzných transmembránových proteinů, které vykonávají různé funkce ve vývoji nervosvalového spojení, vč. signální transdukce a receptorem zprostředkované endocytózy. Lrp4 je specificky exprimován v dobře diferencovaných myotubulech a je soustředěn na nervosvalové ploténce [20]. Extracelulární doména molekuly Lrp4, která slouží jako funkční receptor, je v interakci s agrinem a tato vazba aktivuje MuSK, což vede k tvorbě většiny agregátů obsahujících AChR v junkční oblasti plazmatické membrány [21]. Lrp4 a MuSK mohou tvořit komplex i v nepřítomnosti ligandu agrinu, nicméně agrin prostřednictvím vazby na Lrp4 zvyšuje interakci mezi Lrp4 a MuSK [22,23]. Velká mezinárodní studie [24] odhalila, že podíl těchto autoprotilátek u tzv. dvojitě séronegativních pacientů (anti‑AChR negat., anti‑MuSK negat.) tvoří až 19 % z celkového počtu. U většiny pacientů s nálezem thymomu se nacházejí protilátky antistriatální (ScMAb), které způsobují postižení svalových vláken s mikroskopickým nálezem lymforhagií. Tyto protilátky reagují s epitopy na svalových bílkovinách titinu, ryanodinového receptoru, kortaktinu a dalších, a dle některých autorů můžou korelovat se závažností MG [25]. Klasifikace MG zahrnuje jednak povahu protilátek, věk nástupu onemocnění a zapojení thymu (tab. 1). MG je prototyp autoimunitního onemocnění s přítomností receptorově specifických protilátek.
Účast jednotlivých subpopulací lymfocytů na imunopatogenezi MG
T lymfocyty – buněčná odpověď specifické imunity
AChR ‑ reaktivní CD4+ T buněčné klony, které se nacházejí v thymu a periferní krvi, hrají důležitou roli v patogenezi MG tím, že pomáhají B lymfocytům produkovat anti‑AChR protilátky [26,27]. AChR ‑ specifické CD4+ T buňky jsou přítomny v krvi pacientů s MG, ale jsou obzvláště bohaté na brzlíku, což podporuje myšlenku, že k autosenzibilizaci T buněk dochází v thymu [28]. Studie, které využívají model buněčného přenosu u experimentální autoimunitní MG (EAMG) ukazují stěžejní roli AChR specifických CD4+ T buněk na rozvoj EAMG. Thymektomie a specifická terapie monoklonálními protilátkami proti CD4+ T lymfocytům zlepšuje klinické příznaky u tohoto modelu, což dokazuje, že CD4+ T buňky mohou být zapojeny v iniciaci humorální autoimunitní odpovědi u MG [29]. Po transplantaci fragmentů thymu nebo směsi lymfocytů od pacientů s MG produkují SCID myši protilátky proti lidským AChR a manifestuje se u nich myastenická slabost. Tyto nálezy prokazují, že autoreaktivní CD4+ T buňky jsou nezbytně nutné pro produkci patogenních protilátek proti AChR [30].
Z hlediska periferních mechanizmů autotolerance je velmi důležitou skupinou CD4+ T lymfocytů subpopulace regulačních buněk, které jsou charakterizovány molekulami CD4, CD25 a Foxp3 (transkripční faktor). CD4+CD25+ (T-regulační lymfocyty) mají nejdůležitější roli v udržování autotolerance a potlačení rozvoje autoimunity [31]. Snížení buněčné aktivity Treg je popisováno u pacientů s různými autoimunitními onemocněními [32]. Tak např. funkční aktivita cirkulujících CD4+CD25+ T buněk byla u pacientů s RS nižší ve srovnání se zdravými kontrolami [33]. Jejich mechanizmus účinku ochrany organizmu před T lymfocyty zprostředkovanými autoimunitními nemocemi je buď přímý inhibiční účinek na B lymfocyty nebo nepřímo přes inhibici diferenciace T pomocných lymfocytů [34,35].
Vzhledem k faktu, že CD4+CD25+ regulační T buňky jsou thymického původu a hrají důležitou roli při rozvoji autoimunitních onemocnění, je zajímavé zkoumat jejich role v patogenezi MG. Aricha at al pozorovali, že se v periferní krvi u myastenických potkanů nachází významně nižší počet Treg v porovnání se zdravými kontrolami a že Treg buňky od zdravých dárců mohou suprimovat EAMG u hlodavců [36]. Rovněž Treg buňky od myastenických potkanů jsou méně účinné než Treg buňky od zdravých kontrol [37]. Pacienti s MG mají funkční deficit thymických Treg buněk [38]. Množství Treg buněk dle některých autorů dramaticky narůstá po thymektomii a koreluje se zlepšením klinických příznaků [39]. Také kortikoidy vedou k zlepšení funkční aktivity Treg buněk.
T lymfocyty, které exprimují na svém povrchu molekulu CD8 a antigen rozpoznávají v kontextu molekul MHC I. třídy, představují tzv. cytotoxické CD8+ T lymfocyty. Jejich role v imunopatogenezi MG není zcela jasná. Mají spíše regulující funkci. CD8+ T lymfocyty jsou zapojeny do zastavení destruktivního účinku zánětlivé odpovědi a udržení vlastní imunotolerance; CD8+ T buněčná deplece zvyšuje vnímavost myší k EAMG [40]. Lisak et al ukázali, že deplece CD8+ T buněk z krevních mononukleárních buněk u pacientů s MG vedla ke zvýšené produkci autoprotilátek, což znamená, že autologní CD8+ T buňky vykazují určitou regulační kontrolu nad anti‑AChR CD4+ T buňkami u MG [41].
B lymfocyty a plazmatické buňky – humorální odpověď specifické imunity
Zvýšený počet B buněk se nalézá v thymu u folikulární hyperplazie při SPMG s časným začátkem, a to hlavně u žen [42]. Poměrně typický nález, který svědčí pro účast humorálních mechanizmů v imunopatogenezi MG, je výskyt germinálních center v thymu. Zvýšené hladiny estrogenu nebo prolaktinu pravděpodobně umožňují autoreaktivním B buňkám vyhnout se mechanizmům tolerance, hromadit se a v dostatečném počtu způsobit autoimunitní onemocnění. Senzibilizované autoreaktivní B lymfocyty produkují protilátky zejména proti AChR. Wang et al zjistili, že u pokusných hlodavců s EAMG se buňky secernující autoprotilátky nacházejí v lymfatických uzlinách, slezině a thymu a přednostně jsou produkovány proti nativnímu AChR, a to hlavně alfa‑podjednotce [43]. Kromě toho, u pacientů s MG se objevily důkazy o klonální expanzi B lymfocytů ve srovnání s kontrolami [44]. Aktivační faktory B lymfocytů (APRIL (proliferaci indukující ligand B lymfocytů) a aktivační faktor B lymfocytů (B ‑ cell Activating Factor; BAFF))jsou TNF‑like chemokiny, které podporují přežití a diferenciaci B buněk. Zvýšené sérové hladiny BAFF a APRIL můžeme najít u několika typů autoimunitních onemocnění – systémový lupus erythematodes (SLE), diabetes mellitus 1. typu, roztroušená skleróza, ale i u MG [45]. Inhibitory BAFF nebo BAFF/ APRIL byly již úspěšně použity u myšího modelu několika autoimunitních nemocí [46].
Bylo prokázáno, že belimumab, monoklonální protilátka, která neutralizuje BAFF, je účinná v léčbě SLE a rovněž již byla za tímto účelem schválena [47]. Fáze II klinické studie ověřující bezpečnost a klinický efekt u MG v současné době probíhá.
Cytokiny IL‑17, IFN‑ γ, TNF‑α a IL‑6
Interleukin 17 je tvořen paměťovými aktivovanými CD4+ T lymfocyty a pravděpodobně patří k časným iniciátorům zánětlivých reakcí závislých na T buňkách. Ukazuje se, že rovnováha mezi T-pomocnými buňkami (Th1, Th2, Th17 a Treg) je při rozvoji EAMG narušena tím, že dochází ke kolísání hladiny IL‑17, která při progresi onemocnění stoupá. Z toho vyplývá, že nerovnováha jednotlivých subpopulací pomocných T lymfocytů hraje u EAMG významnou roli a že patogenetické mechanizmy související s produkcí IL‑17 mohou představovat potenciální terapeutické cíle [48].
U pacientů s MG byly prokázány zvýšené hladiny IL‑17 [49] a rovněž u paraneoplastické formy MG byla popsána zvýšená frekvence výskytu IL‑17 produkujících CD4+ T lymfocytů, která dokonce korelovala s hladinami protilátek proti AChR [50]. Zvýšená produkce IL‑17 byla také popsána u folikulární hyperplazie při SPMG [51]. Podle nejnovějších poznatků IL‑17 produkující CD4+ T lymfocyty přispívají ke ztrátě tolerance B lymfocytů u experimentální autoimunitní MG [52].
Chronický zánět přítomný v thymech pacientů MG, který zahrnuje řadu cytokinů, jako je TNF‑α, IL‑17 a IFN ‑ γ, zřetelně přispívá ke snížení počtu Treg buněk a dysregulaci jejich imunosupresivní aktivity. V mechanizmu této chronické imunitní aktivace hrají výše popisované cytokiny ústřední roli [53].
TNF‑α hraje klíčovou úlohu u imunoregulačních poruch pozorovaných u MG. Argumenty podporující tento závěr jsou: Hladina TNF‑α je významně zvýšená nejen v celém thymu, ale i v séru pacientů s MG a že i pacienti s lehčími formami onemocnění mají vysoké hladiny TNF‑α. To naznačuje, že u pacientů s MG je chronický nadbytek TNF‑α [54]. TNF‑α snižuje funkci Treg buněk. Anti‑TNF‑α léčba je úspěšná u mnoha experimentálních modelů autoimunitních chorob vč. EAMG a současně obnovuje supresivní funkce Treg [55].
Sekrece IL‑6 je odpověď na sekreci TNF‑α a IL‑1. Je produktem aktivovaných T lymfocytů, pro B lymfocyty je hlavním růstovým faktorem v závěrečných fázích jejich diferenciace. Podporuje tak tvorbu protilátek (je také růstovým faktorem pro plazmocyty). Některé studie ukázaly, že IL‑6 se podílí na rozvoji MG [56,57], což je v souladu s jeho činností jako promotoru B-buněčné diferenciace a proliferace, a následné indukci tvorby plazmatických buněk a protilátek [58]. Již dříve bylo prokázáno, že léčba protilátkou anti‑IL‑6 potlačuje probíhající MG u krys [59]. Je zajímavé, že IL6 – / IL6 – myši jsou rezistentní k indukci EAMG [60]. Uznání role IL‑6 v imunopatogenezi některých autoimunitních onemocnění vedlo k použití monoklonální protilátky proti lidskému IL‑6 receptoru (tocilizumabu) pro léčbu revmatoidní artritidy, juvenilní idiopatické artritidy a Castlemanovy nemoci. Klinické účinky této léčby u pacientů s MG nejsou známy, zatím nebyl použit v klinických studiích. Jeden experimentální model prokázal, že léčba anti‑IL‑6 protilátkou potlačuje probíhající EAMG prostřednictvím mechanizmů, které zahrnují inhibici Th1, Th17 buněk a posléze i B buněk (schéma 1) [59].

Závěr
V posledních letech jsme svědky velkého pokroku v poznání imunopatologických dějů u autoimunitních chorob. U řady z nich nacházíme společné imunopatogenetické mechanizmy, které vedou k poruše funkce či k destrukci cílové tkáně. Zánětlivé prostředí v cílovém orgánu mění funkci a plasticitu CD4+ buněk, což vede k poškození funkce Treg lymfocytů. Tento mechanizmus je typický pro celou řadu autoimunitních onemocnění. Nové možnosti biologické terapie zaměřené na konkrétní cílový antigen dávají nové naděje pacientům s refrakterními formami jednotlivých autoimunitních onemocnění.
Tato práce vznikla za podpory Grantové agentury Univerzity Karlovy v rámci projektu č. 351011/ 2011 s názvem „Klinická, laboratorní a socioekonomická analýza u pacientů s myasthenia gravis v České republice“. Dále byla podpořena výzkumným programem PRVOUK ‑ P26/ LF1/ 4 a Specifickým vysokoškolským výzkumem č. 254260020.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 11. 9. 2015
Přijato do tisku: 27. 10. 2015
MUDr. Michala Jakubíková
Neurologická klinika a Centrum klinických neurověd
1. LF UK a VFN v Praze
Kateřinská 30
120 00 Praha 2
e-mail: michala.jakubikova@vfn.cz
Sources
1. Berrih ‑ Aknin S, Le Panse R. Myasthenia gravis: a comprehensive review of immune dysregulation and etiological mechanisms. J Autoimmun 2014; 52 : 90 – 100. doi: 10.1016/ j.jaut.2013.12.011.
2. Marx A, Wilisch A, Schultz A, Gattenlöhner S, Nenninger R, Müller ‑ Hermelink HK. Pathogenesis of myasthenia gravis. Virchows Arch 1997; 430(5): 355 – 364.
3. Kaminski HJ, Ruff RL. Structure and kinetic properties of the acetylcholine receptor. In: Engel AG (ed.) Myasthenia gravis and myasthenic disorders. Oxford: University Press 1999 : 40 – 64.
4. Kuks JBM. The thymus and myasthenia gravis. Doctoral thesis. Groningen: University of Groningen 1992.
5. Emilie D, Crevon MC, Cohen ‑ Kaminski S, Peuchmaur M, Devergne O, Berrih ‑ Aknin S et al. In situ production of interleukins in hyperplastic thymus from myasthenia gravis patients. Hum Pathol 1991; 22(5): 461 – 468.
6. Lauriola L, Ranelletti F, Maggiano N, Guerriero M, Punzi C, Marsili F et al. Thymus changes in anti‑MUSK ‑ positive and - negative myasthenia gravis. Neurology 2005; 64(3): 536 – 538.
7. Špalek P. Myastenia gravis – autoimunitné spektrum a imunopatogenetická klasifikácia. Neurologia 2009; 4 : 25 – 30.
8. Ströbel P, Chuang WY, Marx A. Thymoma‑associated paraneoplastic myasthenia gravis. In: Kaminski HJ (ed.). Myasthenia gravis and related disorders. New York: Humana Press 2009 : 105 – 117.
9. Špalek P, Schnorrer M, Krajč T. Imunopatogenéza paraneoplastickej myastenie gravis asociovanej s tymómom. Neurologia 2010; 5 : 7 – 11.
10. Ströbel P, Helmreich M, Menioudakis G, Lewin SR, Rüdiger T, Bauer A et al. Paraneoplastic myasthenia gravis correlates with generation of mature naive CD4(+) T cells in thymomas. Blood 2002; 100(1): 159 – 166.
11. Marx A, Hohenberger P, Pfannschmidt J, Wiebe K, Willcox N, Stro P. The autoimmune regulator AIRE in thy-moma biology: autoimmunity and beyond. J ThoracOncol 2010; 5 (Suppl 4): S266 – S272. doi: 10.1097/ JTO.0b013e3181f1f63f.
12. Motomura M, Narita Masuda T. Autoantibodies in myasthenia gravis. Brain Nerve 2013; 65(4): 433 – 439.
13. Engel AG, Fumagalli G. Mechanisms of acetylcholine receptor loss from the neuromuscular junction. Ciba Found Symp 1982; 90 : 197 – 224.
14. Dau PC. Plasmapheresis therapy in myasthenia gravis. Muscle Nerve 1980; 3(6): 468 – 482.
15. Limburg PC, The TH, Hummel ‑ Tappel E, Oosterhuis HJ. Anti‑acetylcholine receptor antibodies in myasthenia gravis. Part 1. Relation to clinical parameters in 250 patients. J Neurol Sci 1983; 58(3): 357 – 370.
16. Špalek P. Tymómy a paraneoplastická autoimunita. Cesk Slov Neurol N 2002; 65/ 98(3): 367 – 373.
17. Seybold ME, Lindstrom JM. Patterns of acetylcholine receptor antibody in myasthenia gravis. Ann N Y Acad Sci 1981; 377 : 292 – 306.
18. Conti‑Fine BM, Diethelm ‑ Okita B, Ostlie N. Imunopathogenesis of myasthenia gravis. In: Kaminski HJ (ed.). Myasthenia gravis and related disorders. New York, Humana Press 2009 : 43 – 70.
19. Hoch W, McConville J, Helms S, Newsom ‑ Davis J, Melms A, Vincent A. Autoantibodies to the receptor tyrosine kinase MuSK in patients with myasthenia gravis without acetylcholine receptor antibodies. Nat Med 2001; 7(3): 365 – 368.
20. Weatherbee SD, Anderson KV, Niswander LA. LDL‑receptor‑related protein 4 is crucial for formation of the neuromuscular junction. Development 2006; 133(24): 4993 – 5000.
21. Pevzner A, Schoser B, Peters K, Cosma NC, Karakatsani A, Schalke B et al. Anti‑LRP4 autoantibodies in AChR ‑ and MuSK ‑ antibody ‑ negative myasthenia gravis. J Neurol 2012; 259(3): 427 – 435. doi: 10.1007/ s00415 ‑ 011 ‑ 6194 ‑ 7.
22. Gomez AM, Burden SJ. The extracellular region of Lrp4 is sufficient to mediate neuromuscular synapse formation. Dev Dyn 2011; 240(12): 2626 – 2633. doi: 10.1002/ dvdy.22772.
23. Zhang B, Luo S, Wang Q, Suzuki T, Xiong WC, Mei L. LRP4 Serves as a coreceptor of agrin. Neuron 2008; 60(2): 285 – 297. doi: 10.1016/ j.neuron.2008.10.006.
24. Zisimopoulou P, Evangelakou P, Tzartos J, Lazaridis K, Zouvelou V, Mantegazza R et al. A comprehensive analysis of the epidemiology and clinical characteristics of anti‑LRP4 in myasthenia gravis. J Autoimmun 2014; 52 : 139 – 145. doi: 10.1016/ j.jaut.2013.12.004.
25. Romi F, Skeie GO, Gilhus NE, Aarli JA. Striational antibodies in myasthenia gravis: reactivity and possible clinical significance. Arch Neurol 2005; 62(3): 442 – 446.
26. Lindstrom J, Shelton D, Fujii Y. Myasthenia gravis. Adv Immunol 1988; 42 : 233 – 284.
27. Harcourt GC, Sommer N, Rothbard J, Willcox HN, Newsom ‑ Davis J. A juxta ‑ membrane epitope on the human acetylcholine receptor recognized by T cells in myasthenia gravis. J Clin Invest 1988; 82(4): 1295 – 1300.
28. Melms A, Schalke BCG, Kirchner T, Müller ‑ Hermelink HK, Albert E, Wekerle H. Thymus in myasthenia gravis: isolation of T‑lymphocyte lines specific for the nicotinic acetylcholine receptor from thymuses of myasthenic patients. J Clin Invest 1988; 81 : 902 – 908.
29. Ahlberg R, Yi Q, Pirskanen R, Matell G, Swe-rup C, Rieber EP et al. Treatment of myasthenia gravis with anti‑CD4 antibody: improvement correlates to decreased T cell autoreactivity. Neurology 1994; 44(9): 1732 – 1737.
30. Wang ZY. Myasthenia in SCID mice grafted with myasthenic patient lymphocytes: role of CD4+ and CD8+ cells. Neurology 1999; 52(3): 484 – 497.
31. Beissert S, Schwarz A, Schwarz T. Regulatory T cells. J Invest Dermatol 2006; 126(1): 15 – 24.
32. Sakaguchi S, Yamaguchi T, Nomura T, Ono M. Regulatory T cells and immune tolerance. Cell 2008; 133(5): 775 – 787. doi: 10.1016/ j.cell.2008.05.009.
33. Viglietta V, Baecher ‑ Allan C, Weiner HL, Hafler DA. Loss of functional suppression by CD4+CD25+ regulatory T cells in patients with multiple sclerosis. J Exp Med 2004; 199(7): 971 – 979.
34. Bystry RS, Aluvihare V, Welch KA, Kallikourdis M, Betz AG. B cells and professional APCs recruit regulatory T cells via CCL4. Nat Immunol 2001; 2(12): 1126 – 1132.
35. Shevach EM. CD4+CD25+ suppressor T cells: more questions than answers. Nat Rev Immunol 2002; 2(6): 389 – 400.
36. Aricha R, Feferman T, Fuchs S, Souroijon MC. Ex vivo regulatory T cells modelate experimental myasthenia gravis. J Immunol 2005; 175(12): 7898 – 7904.
37. Gertel ‑ Lapter S, Mizrachi K, Berrih ‑ Aknin S, Fuchs S, Souroujon MC. Impairment of regulatory T cells in myasthenia gravis: studies in an experimental model. Autoimmun Rev 2013; 12(9): 894 – 903. doi: 10.1016/ j.autrev.2013.03.009.
38. Balandina A, Lécart S, Dartevelle P, Saoudi A, Berrih ‑ Aknin S. Functional defect of regulatory CD4(+)CD25+ T cells in the thymus of patients with autoimmune myasthenia gravis. Blood 2005; 105(2): 735 – 741.
39. Sun Y, Qiao J, Lu CZ, Zhao CB, Zhu XM, Xiao BG. Increase of circulating CD4+CD25+ T cells in myasthenia gravis patients with stability and thymectomy. Clin Immunol 2004; 112(3): 284 – 289.
40. Zhang GX, Xiao BG, Bakhiet M, van der Meide P, Wigzell H, Link H et al. Both CD4+ and CD8+ T cells are essential to induce experimental autoimmune myasthenia gravis. J Exp Med 1996; 184(2): 349 – 356.
41. Lisak RP, Laramore C, Zweiman B, Moskovitz A. In vitro synthesis of antibodies to acetylcholine receptor by peripheral blood mononuclear cells of patients with myasthenia gravis. Neurology 1983; 33(5): 604 – 608.
42. Berrih ‑ Aknin S, Ragheb S, Le Panse R, Lisak RP. Ectopic germinal centers, BAFf and anti‑B ‑ cell therapy in myasthenia gravis. Autoimmun Rev 2013; 12(9): 885 – 893. doi: 10.1016/ j.autrev.2013.03.011.
43. Wang ZY, Link H, Qiao J, Olsson T, Huang WX. Cell autoimmunity to acetylcholine receptor and its subunits in Lewis rats over the course of experimental autoimmune myasthenia gravis. J Neuroimmunol 1993; 45 : 103 – 112.
44. Vrolix K, Fraussen J, Losen M, Stevens J, Lazaridis K, Molenaar PC et al. Clonal heterogeneity of thymic B cells from early ‑ onset myasthenia gravis patients with antibodies against the acetylcholine receptor. J Autoimmun 2014; 52 : 101 – 112. doi: 10.1016/ j.jaut.2013.12.008.
45. Kim JY, Yang Y, Moon JS, Lee EY, So SH, Lee HS et al. Serum BAFf expression in patients with myasthenia gravis. J Neuroimmunol 2008; 199(1 – 2): 151 – 154. doi: 10.1016/ j.jneuroim.2008.05.010.
46. Davidson A. Targeting BAFf in autoimmunity. Curr Opin Immunol 2010; 22(6): 732 – 739. doi: 10.1016/ j.coi.2010.09.010.
47. Berrih ‑ Aknin S, Ragheb S, Le Panse R, Lisak RP. Ectopic germinal centers, BAFf and anti‑B ‑ cell therapy in myasthenia gravis. Autoimmun Rev 2013; 12 : 885 – 893. doi: 10.1016/ j.autrev.2013.03.011.
48. Mu L, Sun B, Kong Q, Wang J, Wang G, Zhang S et al. Disequilibrium of T helper type 1,2 and 17 cells and regulatory T cells during the development of experimental autoimmune myasthenia gravis. Immunology 2009; 128 (Suppl 1): 826 – 836. doi: 10.1111/ j.1365 ‑ 2567.2009.03089.x.
49. Roche JC, Capablo JL, Larrad L, Gervas ‑ Arruga J, Ara JR, Sanchez A et al. Increased serum interleukin‑17 levels in patients with myasthenia gravis. Muscle Nerve 2011; 44(2): 278 – 280. doi: 10.1002/ mus.22070.
50. Wang Z, Wang W, Chen Y, Wei D. T helper type 17 cellsexpand in patients with myasthenia‑associated thymoma. Scand J Immunol 2012; 76 : 54 – 61. doi: 10.1111/ j.1365 ‑ 3083.2012.02703.x.
51. Cordiglieri C, Marolda R, Franzi S, Cappelletti C, Giardina C, Motta T et al. Innate immunity in myasthenia gravis thymus: pathogenic effects of Toll‑like receptor 4signaling on autoimmunity. J Autoimmun 2014; 52 : 74 – 89. doi: 10.1016/ j.jaut.2013.12.013.
52. Schaffert H, Pelz A, Saxena A, Losen M, Meisel A, Thiel A et al. IL‑17 – producing CD4+ T cells contribute to the loss of B cell tolerance in experimental autoimmune myasthenia gravis. Eur J Immunol 2015; 45(5): 1339 – 1347. doi: 10.1002/ eji.201445064.
53. Berrih ‑ Aknin S, Le Panse R. Myasthenia gravis: a comprehensive review of immune dysregulation and etiological mechanisms. J Autoimmun 2014; 52 : 90 – 100. doi: 10.1016/ j.jaut.2013.12.011.
54. Gradolatto A, Nazzal D, Truffault F, Bismuth J, Fa-del E, Foti M et al. Both Treg cells and Tconv cells aredefective in the myasthenia gravis thymus: roles of IL‑17 and TNF‑α. J Autoimmun 2014; 52 : 53 – 63. doi: 10.1016/ j.jaut.2013.12.015.
55. Valencia X, Stephens G, Goldbach ‑ Mansky R, Wilson M, Shevach EM, Lipsky PE. TNF downmodulates the function of human CD4+CD25 T ‑ regulatory cells. Blood 2006; 108(1): 253 – 261.
56. Cohen ‑ Kaminski S, Delattre RM, Devergne O, Klingel ‑ Schmitt I, Emilie D, Galanaud P et al. High IL‑6 gene expression and production by cultured human thymic epithelial cells from patients with myasthenia gravis. Ann N Y Acad Sci 1993; 681 : 97 – 99.
57. Endo S, Hasegawa T, Sato Y. Inhibition of IL‑6 overproduction by steroid treatment before transsternal thymectomy for myasthenia gravis: does it help stabilize perioperative condition? Eur J Neurol 2005; 12(10): 768 – 773.
58. Takatsu K. Cytokines involved in B cell differentiation and their sites of action. Proc Soc Exp Biol Med 1997; 215(2): 121 – 133.
59. Aricha R, Mizrachi K, Fuchs S, Souroujon MC. Blocking of IL‑6 suppresses experimental autoimmune myasthenia gravis. J Autoimmun 2011; 36(2): 135 – 141. doi: 10.1016/ j.jaut.2010.12.001.
60. Deng C, Goluczko E, Tuzun E, Yang H, Christa-doss P. Resistance to experimental autoimmune myasthenia gravis in IL‑6 - deficient mice is associated with reduced germinal center formation and reduced C3 production. J Immunol 2002; 169(2): 1077 – 1083.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2015 Issue 6
-
All articles in this issue
- Nádory očnice
- Překrývání neurodegenerativních demencí
- Současný pohled na imunopatogenezi myasthenia gravis
- Roztroušená skleróza, neplodnost a její léčba
- Delirium u kriticky nemocných – prospektivní studie
- Poruchy srdečního rytmu u mladých pacientů s kryptogenní ischemickou cévní mozkovou příhodou
- Novinky ze světa NOAK – „Dienerovo pravidlo 1- 3- 6- 12“ a první antidotum s potvrzeným účinkem
- Mobilita medianu před dekompresí karpálního tunelu a po ní
- Měření úrovně emočního uvědomění – pilotní studie ověřující základní psychometrické vlastnosti české verze Škály úrovně emočního uvědomění LEAS
- Psychometrické vlastnosti české verze Epworthské škály spavosti
- Naše zkušenosti s chirurgickou léčbou tumorů periferních nervů
- Kraniocervikální pneumatizace provázená neurologickou symptomatikou – kazuistika
- Familiární amyloidová polyneuropatie – kazuistika
- Časná rotace intratékální baklofenové pumpy – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Nádory očnice
- Novinky ze světa NOAK – „Dienerovo pravidlo 1- 3- 6- 12“ a první antidotum s potvrzeným účinkem
- Psychometrické vlastnosti české verze Epworthské škály spavosti
- Familiární amyloidová polyneuropatie – kazuistika
