Dietní přístupy specifické pro pacienty s roztroušenou sklerózou
Authors:
K. Vodehnalová; E. Kubala; Havrdová; D. Horáková
Authors‘ workplace:
Neurologická klinika a Centrum klinických neurověd 1. LF UK a VFN v Praze
Published in:
Cesk Slov Neurol N 2023; 86(1): 25-30
Category:
Review Article
doi:
https://doi.org/10.48095/cccsnn202325
Overview
Zájem o nefarmakologickou léčbu RS je značný mezi lékaři i pacienty. Dietní intervence se ve světle nových vědeckých poznatků zdá jako slibná podpůrná léčba k zavedené farmakoterapii. Dieta může u pacientů s RS vést k potlačení autoimunitního zánětu a neurodegenerace i k podpoře remyelinizace. V odborných i laických kruzích se nyní diskutuje o více možných specifických výživových směrech, je proto třeba se zaměřit na evidenci, která za nimi stojí, aby lékař mohl pacientovi referovat možné přínosy i rizika s nimi spojená. Na první pohled rozdílné dietní přístupy v podobě nízkotukové nebo vysokotukové stravy mohou mít obdobné benefity na průběh RS. V celkovém přístupu ke stravě u pacientů s RS bychom se ale nadále měli držet pravidel racionální stravy s důrazem na vysoký příjem zeleniny, ovoce a zdravých tuků.
Klíčová slova:
roztroušená skleróza – dieta – Swank – Wahls – ketogenní
Úvod
Roztroušená skleróza je zánětlivé a neurodegenerativní demyelinizační onemocnění CNS způsobené autoimunitní reakcí. Původ onemocnění je multifaktoriální, dochází ke spojení genetických predispozic jedince s vlivem environmentálního prostředí. Pojem environmentální prostředí zde zahrnuje zejména vliv předchozích infekcí, hladiny vitaminu D, čistoty životního prostředí a našeho životního stylu.
Průkopníkem ve zkoumání vlivu přijímané potravy na RS byl kanadský lékař Roy L. Swank, který roku 1948 představil svou teorii o škodlivosti západní diety na průběh onemocnění. Téhož roku začal nabírat pacienty do studie na potvrzení této myšlenky. Pozornost věnovaná vlivu dietních přístupů na RS stoupá od roku 2000, kdy počet vydaných odborných studií začíná překračovat desítku článků za rok. Postupná akcelerace zájmu o téma prozatím kulminovala v roce 2021, kdy dle databáze PubMed po zadání klíčových slov „multiple sclerosis“ a „diet“ ke dni 10. 7. 2022 bylo publikováno 1 119 odborných vědeckých prací. Vědeckým analýzám jsou podrobovány komplexní dietní styly, ale i vlivy jednotlivých potravin či složek potravin na průběh RS. V reálném životě je velmi obtížné metodologicky správně provést studii, která by jednoznačně mohla vést k závěrům, že změna stavu pacienta byla zapříčiněna pouze stravou, neboť vždy zde jsou také další environmentální faktory (kouření, cvičení, přísun vitaminu D apod.) nebo farmakoterapie, které nepochybně ovlivňují průběh onemocnění. S vědomím tohoto výzkumného úskalí nás nepřekvapí, že téměř ke každému doporučení lze nalézt protichůdné vyjádření. Mnoho výživových a nutričních dotazníků nerozlišuje podstatné rozdíly v kvalitě přijímaných potravin. Pokud tedy vědci sbírají pouze informace o poměru jednotlivých živin (tuků, sacharidů, bílkovin), ale nezkoumají blíže kvalitu a postup úpravy potravin, můžeme se např. dozvědět, že dieta založená na tucích může být prospěšná, ale i škodlivá. Důležitost kvality stravy u pacientů s RS zkoumaly dosud dvě velké studie (Health Outcomes and Lifestyle In a Sample of people with Multiple sclerosis [HOLISM], The North American Research Committee on Multiple Sclerosis [NARCOMS]), které při vyhodnocení došly ke shodnému závěru, že pacienti s nejvyšší kvalitou stravy měli o 20–30 % nižší šanci nepříznivého průběhu onemocnění [1,2]. Cílem tohoto souhrnného článku je zaměřit se na možné mechanizmy ovlivnění průběhu onemocnění pomocí stravy a výčet nejběžnějších speciálních dietních přístupů dodržovaných pacienty. Pro jasnější sdělení se budeme zaměřovat pouze na doporučení, která mohou příznivě ovlivnit průběh RS, a jejich biochemické opodstatnění. Zájem o nefarmakologický přístup mezi pacienty je veliký, dle dotazníkového šetření takový přístup vyzkoušelo téměř 65 % pacientů [3].
Mechanizmy působení diety
Patogeneze RS spočívá v autoimunitním zánětlivém procesu CNS, který působí urychlení neurodegenerace. Ovlivnění zánětu a neurodegenerace jsou hlavní farmakologické terapeutické cíle. Dalším léčebným cílem by mohla být i remyelinizace poškozených drah [4]. Dle známých faktů lze dosledovat efekt stravy na všechny tři modality. Nejvíce zkoumanou složkou patogeneze RS, zejména ve vztahu k vývoji nových léků, je ale právě zánět. To je nejspíše způsobeno tím, že zvířecí model RS (Experimental Autoimmune Encephalomyelitis; EAE) je model zejména autoimunitně zánětlivý, méně schopný simulovat u pacientů přirozeně doprovázející neurodegeneraci [5]. Z vědeckých studií ale můžeme dosledovat výživová doporučení k ovlivnění všech tří terapeutických cílů.
Ovlivnění zánětu
Za patogenezí zánětlivé komponenty RS stojí odpověď periferního imunitního systému i samotný zánět v CNS. Sekundárně má na průběh choroby vliv i složení střevního mikrobiomu. Ovlivnění všech tří složek lze dosáhnout pomocí stravy [6].
Na periferní imunitní systém, zejména na diferenciaci T-lymfocytů, má vliv strava skrze potlačení hlavních prozánětlivých transkripčních faktorů (NK-kB a AP-1). K tomuto potlačení může přispět strava bohatá na polyfenoly (např. brokolice, černý rybíz, švestky), síru (např. cibule, česnek), omega-3 mastné kyseliny (např. rybí olej), butyrát (produkován střevním mikrobiomem po konzumaci potravin bohatých na vlákninu), lykopen (např. rajčata), karotenoidy (např. mrkev), kyselinu lipoovou (např. červené maso, vnitřnosti, špenát), isothiokyanáty (brukvovitá zelenina), tokoferol (např. mléko, ořechy) [7].
Na zánětu v CNS mají velký podíl oxidativní stres a tvorba reaktivních kyslíkových radikálů (reactive oxygen species; ROS), které jsou generovány makrofágy a mikrogliemi. ROS poškozují buněčnou membránu neuronů a mohou vést k jejich zániku cestou nekrózy nebo apoptózy [8]. Mezi slibné antioxidanty u RS patří vitamin C, vitamin E, kyselina lipoová nebo ketolátky. Zatímco vitaminová substituce měla významnější vliv na průběh RS pouze na zvířecích modelech, u pravidelné substituce kyselinou lipoovou během 2 let došlo u pacientů se sekundárně progresivní RS k redukci mozkové atrofie, zvýšení rychlosti chůze a subjektivnímu poklesu únavy a deprese [9–11]. Ketolátky nejenže samy působí jako antioxidanty, ale také zvyšují hladinu dalšího antioxidantu, glutathionu [12].
V poslední době stoupá zájem odborné veřejnosti o vliv střevního mikrobiomu na samotný vznik i průběh RS. U pacientů s RS byl zjištěn zvýšený podíl nepříznivých bakterií, dysbióza (např. Archae, E. coli, Clostridium), jež nepřímo prozánětlivě přes své metabolity ovlivňuje imunitní rovnováhu mezi Treg a Th17 lymfocyty, a tím může spustit nebo potencuje autoimunitní reakci [13,14]. Strava má zcela klíčový vliv na kvalitu mikrobiomu. Jako nejškodlivější byla vyhodnocena tzv. západní dieta, hyperkalorická, s vysokým příjmem cukrů i tuků zároveň, s průmyslově vyrobenými aditivy a konzervanty, přičemž na ovlivnění střevní mikrobioty stačí i jediný den na této dietě [15]. Pozitivní ovlivnění složení střevní mikrobioty skrze stravu spočívá např. v pravidelném příjmu vlákniny, omega-3 mastných kyselin a vitaminu D3 [16]. Některé střevní bakterie fermentují vlákninu na mastné kyseliny s krátkým řetězcem (short chain fatty acids; SCFA), které podporují integritu střevní stěny a podporují diferenciaci protizánětlivých Treg lymfocytů [17]. Metodou přerušovaného půstu bylo u EAE dosaženo obohacení střevní mikrobioty o příznivé bakterie (z rodů Bacteroidaceae, Lactobacillaceae, Prevotelaceae), jejichž vzestup koreloval se snížením hladiny prozánětlivého leptinu v krvi. Dále skrze dietou indukované ketolátky a posílený metabolizmus glutathionu došlo k navýšení antioxidační reakce organizmu. Byly pozorovány i redukce prozánětlivého cytokinu IL-17 a nárůst Treg ve střevní stěně [18].
Ovlivnění neurodegenerace
Za rychlejší neurodegenerací u pacientů s RS dle současného poznání stojí zánět v CNS. Pomocí MR můžeme měřit roční úbytek objemu mozku, který se u zdravých dospělých pohybuje okolo 0,2–0,5 % ročně [19], zatímco u pacientů s RS je rozpětí úbytku mezi 0,22–2,1 % ročně [20]. Při zánětu působením oxidativního stresu dochází k poškození mitochondrií, což vede k redistribuci iontových kanálů, jejich nedostatečné funkci a následně k zániku oligodendrocytů či neuronů, tedy neurodegeneraci [21]. Ke snížení vlivu oxidativního stresu by mohl přispět i vyšší příjem antioxidantů. Jeden z mechanizmů působení antioxidantů, např. flavonoidů či fytopigmentů z ovoce a zeleniny, by mohl být skrze aktivaci AhR (aryl hydrocarbon receptoru), který inhibuje aktivaci monocytů a mikroglií, jež taktéž stojí za neurodegenerací [22,23]. Zlepšení příznaků jiných neurodegenerativních chorob a EAE bylo prokázáno při pravidelném příjmu borůvek, jahod či špenátu [24,25].
Oligodendrocyty odpovědné za myelinizaci axonů jsou vysoce citlivé na energetickou deprivaci [26]. Při zajištění dostatečného energetického přísunu mitochondriím dojde ke zlepšení funkce, ale i k přežití jak oligodendrocytů, tak neuronů. Za nedostatečnou dodávkou energie neuronům při neurodegeneraci může stát i glukózový hypometabolizmus, kdy dochází k progresivnímu snížení využití dostupné glukózy neuronem, jež vede k mitochondriální dysfunkci a následné apoptóze. Tyto změny byly v neuronech pozorovány ještě před klinickými projevy neurodegenerace [10]. Řešením pro tuto paradoxní situaci, kdy se tělo snaží neuronům nabízet dostatek paliva k výrobě energie skrze glukózu v krevním řečišti, kterou ale neurony neumí využít, a tudíž dochází ke strádání, by mohlo být zavedení ketogenní diety. Ketolátky jsou známy jako alternativní, ale zcela dostatečný energetický substrát nejen pro neurony. Ketogenní hypometabolizmus dosud nebyl popsán [27]. V jedné studii bylo prokázáno, že u pacientů s RS docházelo ve 40 % mozkové tkáně k nižšímu využití glukózy než u zdravých kontrol [28].
Ovlivnění remyelinizace
Remyelinizace jako přirozený proces opravy axonů je u pacientů s RS klíčovou pro vymizení symptomů ataky. Za remyelinizací stojí prekurzorové buňky oligodendrocytů (oligomeric proanthocyanidins; OPC), které jsou v CNS u chronické formy RS zastoupeny výrazně méně než u relaps-remitentní formy [29]. K navýšení počtu OPC dochází při dietní intervenci v podobě fasting-mimicking diet (FDM). Dále při této dietě dochází k nárůstu remyelinizaci podporujícího brain-derived neurotrophic factor (BDNF) [30].
Specifické diety při RS
Vliv na průběh choroby byl zkoumán u jednotlivých potravin, nutričních suplementů i diet. Níže se zaměříme na nejvíce zkoumané výživové směry při RS.
Středomořská dieta
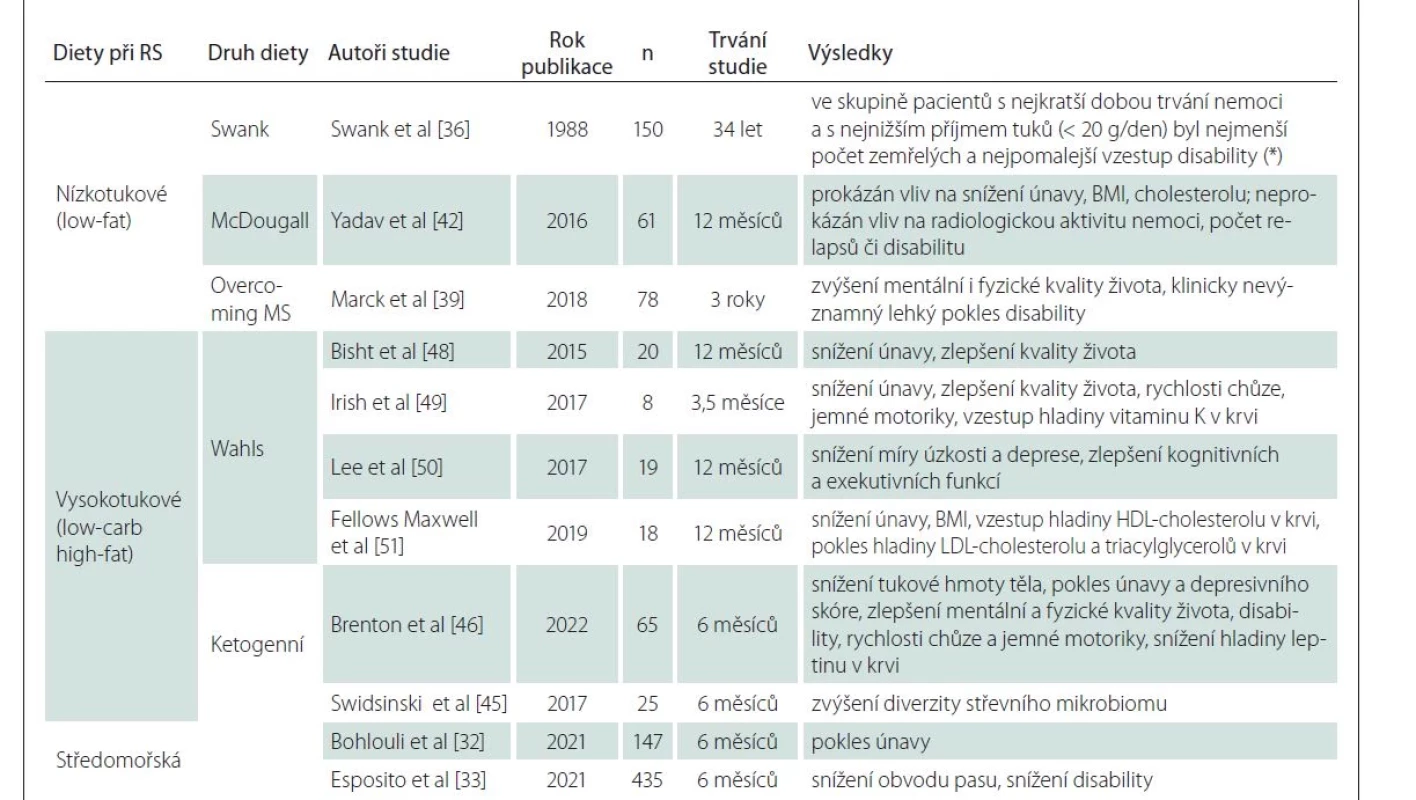
U středomořské diety je hůře definovatelné, v čem spočívá. Jedná se o bohatý příjem nenasycených tuků, zeleniny, ovoce, ořechů a celozrnných potravin, s přiměřeným příjmem ryb, drůbeže a vína a omezeným příjmem mléčných produktů, červeného masa a sladkostí. Jasný mechanizmus příznivého účinku této diety není znám, ale pravděpodobně se jedná o profitování z bohatého příjmu prospěšných složek potravy (omega-3 mastné kyseliny, polyfenoly, flavonoidy, apod.), jejichž antioxidační a protizánětlivý efekt na CNS byl zmíněn výše. Dieta je známou prevencí kardiovaskulárních chorob a se stářím spojeného kognitivního deficitu vč. Alzheimerovy nemoci [31]. U pacientů s RS byly na této dietě prokázány snížení únavy, užší obvod pasu a nižší míra celkové disability [32,33].
Nízkotukové diety
Mezi nejznámější specifické diety při RS patří ta podle kanadského neurologa Roye L. Swanka. Swank v roce 1950 publikoval přímou korelaci mezi incidencí RS v norských regionech s výší příjmu nasycených živočišných mastných kyselin. Z toho vznikla teorie o možném pozitivním vlivu nízkotukové diety na průběh RS. Podporou jeho teorie bylo, že před průmyslovou revolucí byla RS poměrně vzácnou chorobou. Za průmyslové revoluce mezi lety 1750 až 1860 narostla konzumace tuků ve společnosti z 60 g na 100 g/den. V roce 1868 byla pojmenována francouzským patologem Charcotem [34,35]. Je otázkou, zda zvýšený nárůst incidence RS nebyl jen důsledkem poznání a pojmenování nemoci.
V roce 1950 Swank začal testovat svou hypotézu na 144 pacientech s RS, které sledoval 34 let. Mezi nejcitovanější tvrzení ze zveřejněných výsledků patří, že mezi „good dieters“ na nejpřísnějším stupni nízkotukové diety (tj. pod 20 g tuků na den) bylo po 34 letech nejméně zemřelých pacientů, 31 vs. 81 % u pacientů s příjmem tuků nad 30 g/den. Zároveň je ale uvedeno, že skupina, ve které byla nejvyšší úmrtnost, měla v době začátku sledování téměř dvojnásobně dlouhou dobu trvání nemoci. Není uvedeno, jaký byl průměrný vstupní věk pacientů ve zkoumaných skupinách. Naopak je ve studii uvedeno, že při rozdělení pacientů dle doby trvání nemoci a věku byla zjištěna přímá korelace mezi dobou trvání nemoci, nárůstem disability i počtem zemřelých pacientů, aniž by se prokázal vliv příjmu tuků za den. Dále bylo všeobecně větší přežití sledováno po 34 letech u ženského pohlaví a u mladších pacientů s kratším trváním nemoci. Pacienti s příjmem tuků nad 20 g/den byli označeni jako „poor dieters“, ale bylo mezi nimi 7 % pacientů, kteří za celou dobu sledování nevyvinuli významné zhoršení nemoci, u některých naopak disabilita klesla. Průměrný příjem tuků této klinicky dobré podskupiny byl dokonce 38 g/den. Swank označil formu RS u těchto pacientů za benigní [36]. Odhady procenta přirozeně benigních forem RS se různí, navíc je komplikuje příchod efektivní terapie, hovoří se ale o 10 % pacientů [37].
Z výsledků Swankovy diety vychází i celostní léčebný protokol „Overcoming MS“ od australského lékaře Jelinka. V rámci diety je zde doporučen příjem nasycených tuků do 20 g/den, zakázány jsou mléčné výrobky, maso, palmový a kokosový tuk [38]. Efekt tohoto celostního protokolu byl prokázán ve zlepšení kvality života pacientů i jejich rodin, avšak klinický pokles aktivity nemoci byl nevýznamný [39].
Třetí ze specifických nízkotukových je dieta McDougallova podle amerického lékaře, který postavil svá dietní doporučení na pozorování historického vývoje zdraví obyvatel Havaje. První přistěhovalci z Asie se živili především rýží a zeleninou. Až u jejich potomků, kteří přešli na hyperkalorickou, tzv. západní dietu, se začaly projevovat klasické civilizační nemoci [40]. McDougall doporučuje veganskou vysokosacharidovou stravu s příjmem tuků do 10 % kalorického příjmu za den. Efekt diety sám McDougall ve studiích zaznamenal ve snížení rizika kardiovaskulárních a metabolických chorob [41]. U pacientů s RS bylo po 12 měsících diety zjištěno snížení míry únavy, hodnot cholesterolu, LDL cholesterolu, inzulinu a body mass indexu (BMI). Výsledky MR mozku, počtu relapsů či míry disability se nelišily od kontrolní skupiny [42].
Nízkosacharidové diety
Pro níže popsané diety je společný nízký příjem sacharidů kompenzovaný vysokým příjmem tuků pro udržení výživy. O nízkosacharidové stravě začínáme hovořit, pokud příjem sacharidů činí pod 100 g/den. Pokud klesne příjem sacharidů přibližně pod 20–50 g/den, tělo začne k produkci energie využívat metabolity tuků, ketolátky [43] (obr. 1). Za předpokladu, že nedochází pouze k využívání tukových zásob těla (hladovění, hubnutí), ale energie je dodávána pravidelným vysokým příjmem tuků, hovoříme o ketogenní dietě. Ideovým druhem nízkosacharidové diety je paleo dieta, která vychází z předpokladu, že naše tělo se ještě nezvládlo adaptovat na moderní dietu vzniklou ze zemědělské a průmyslové revoluce a měli bychom se vrátit ke složení stravy z dob lovců a sběračů, tedy jíst zeleninu, ovoce, maso optimálně od nedomestikované zvěře a vyhýbat se mléčným výrobkům a obilovinám s lepkem. [6].
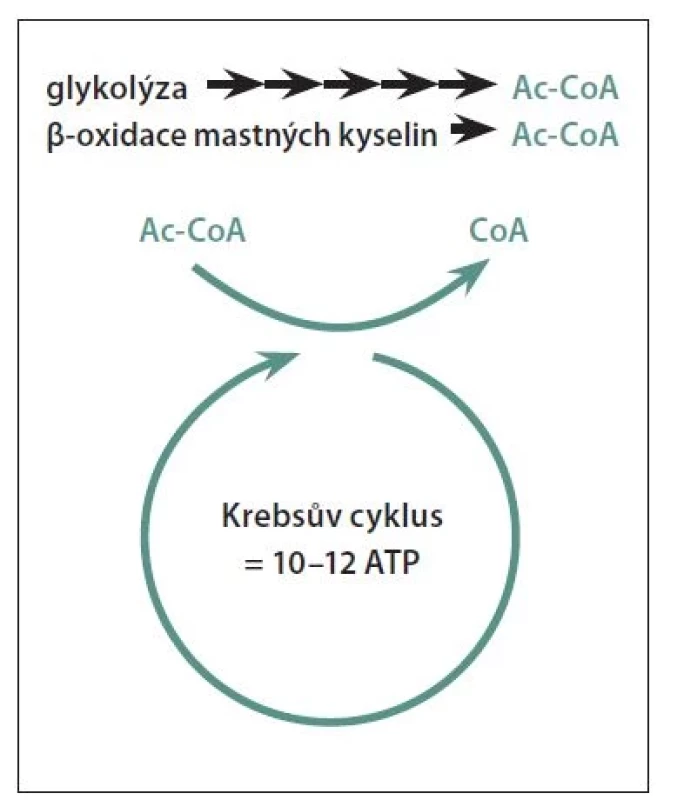
Ac-CoA – acetyl-koenzym A; ATP – adeno - sintrifosfát
Fig. 1. The production of energy in the cell takes place mainly thanks to the Krebs cycle, which produces 10–12 molecules of ATP. Ac-CoA, which is a metabolite of the degradation of glucose, but also of fats (fatty acids), is needed to start the Krebs cycle reactions. Therefore, fats are a full-fledged alternative source of fuel for the production of energy for the cell.
Ac-CoA – acetyl-coenzyme A; ATP – adenosine triphosphate
Cílem ketogenní diety je dosáhnout nutriční ketózy, stavu, kdy je výroba buněčné energie v podobě ATP zajištěna díky hladině ketolátek v krvi, nikoli glukózy. V neurologii začala být ketogenní dieta prvně využívána v léčbě farmakorezistentní epilepsie u dětí [44]. Postupně je rozkrýváno fyziologické působení ketolátek v CNS, kde fungují jako silné antioxidanty bránící zánětu, zvyšují produkci ATP, podporují biogenezi mitochondrií, stabilizují membránu neuronů skrze káliové kanály, a tím působí neuroprotektivně [10]. Po 6 měsících na ketogenní stravě došlo u pacientů s RS ke zlepšení střevního mikrobiomu [45], k poklesu únavy, deprese, disability, hladiny prozánětlivého leptinu v séru a ke zlepšení kvality života se zrychlením chůze [46].
Funkční celostní přístup k léčbě RS vč. specifické nízkosacharidové stravy obsahuje „Wahls protokol“ od americké lékařky Terry Wahls. Wahls byla v roce 2000 diagnostikována RS, která neodpovídala na terapii. Dominantně pomocí stravy vycházející z paleolitické diety se jí podařilo po usednutí na invalidní vozík vrátit zpět k samostatné chůzi a jízdě na kole. Podstatou diety je důraz na maximální příjem mikronutrientů pro CNS skrze pravidelný příjem zeleniny a ovoce ve třech kategoriích (listnaté, barevné a bohaté na síru), dále eliminace sacharidů vč. škrobnaté zeleniny, pravidelný příjem kokosového oleje, optimálně v kombinaci s přerušovaným půstem [47]. Wahls svou dietu podrobuje i četným studiím u pacientů s RS, u kterých bylo prokázáno zmírnění únavy, zlepšení kvality života, kognice, lipidogramu či snížení BMI [48–51]. V kombinaci diety s doporučenou neurostimulací a rehabilitací došlo ke zlepšení mobility u pacientů s progresivní formou RS [52].
Stručné shrnutí specifických diet při RS naleznete v tab. 1.
Závěr
Dodnes neexistuje jednotný doporučený dietní přístup pro pacienty s RS a z výše uvedeného přehledu ho ani nelze určit. V roce 2021 byly zveřejněny výsledky dlouho očekávané studie WAVES, která randomizovaně zkoumala vliv dvou asi nejpopulárnějších, a přitom režimově zcela opačných dietních přístupů dle Swanka a Wahls u pacientů s RS. Obě diety byly spojeny s poklesem únavy a zlepšením kvality života. Zlepšení v rychlosti chůze nebylo signifikantní ani při jedné dietě, ale u větve Wahls došlo k výraznějšímu zlepšení [53]. Obě diety byly spojeny s významnou redukcí příjmu důležitých minerálů a vitaminů, které bylo třeba suplementovat [54]. Ačkoli tedy nízkotuková dieta stojí spíše na teorii vycházející z pozorování změny stravy v historii lidstva a vysokotuková dieta na biologickém poznání působení ketolátek na organizmus, vliv na průběh RS byl obdobný.
Je třeba se držet racionálních doporučení ke zdravé stravě a aby pacienti dbali na kvalitu stravy. Vyšší kvalita celkové stravy je spojena s nižší mírou disability, deprese, únavy a kognitivního deficitu [2]. Důraz by měl být kladen i na redukci obezity, která je zejména v adolescenci rizikem pro incidenci RS. Při propuknutí onemocnění je diskutována role prozánětlivých adipocytokinů na jeho progresi [55]. Každá dietní intervence má vliv, pozitivní či negativní, na kvalitu a pestrost střevního mikrobiomu, který poté skrze své metabolity podstatně ovlivňuje zdraví celého těla. Lepšímu složení střevního mikrobiomu všeobecně prospívají redukce jednoduchých cukrů a navýšení příjmu vlákniny a zdravých tuků [56]. Prozánětlivě v organizmu působí vysoký příjem soli [57], vyšší poměr příjmu omega-6 než omega-3 mastných kyselin [58] a západní dieta s vysokým příjmem cukrů i tuků zároveň [59].
Je potřeba další výzkum pro objasnění mechanizmů dietních intervencí na zlepšení průběhu RS. Zatím lze pojmenovat, že téměř všechny diety s příznivými účinky pojí zvýšený příjem pestré palety zeleniny a ovoce s rozdílným obsahem tělu prospěšných látek. Pokud se pacienti rozhodnou ke specifické dietní intervenci pro RS, je třeba myslet na dodatečnou suplementaci mikronutrientů a aby byla dlouhodobě udržitelná, protože lepších výsledků bylo dosaženo s delším trváním diety [53].
Grantová podpora
Podpořeno Univerzitou Karlovou z GAUK 228120 a Agenturou pro zdravotnický výzkum ČR AZV NU20-04-00077.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem práce nemají žádný konflikt zájmů.
MUDr. Karolína Vodehnalová
Neurologická klinika
a Centrum klinických neurověd
1. LF UK a VFN v Praze
Kateřinská 468
120 00 Nové Město
e-mail: karolina.vodehnalova@vfn.cz
Přijato k recenzi: 22. 8. 2022
Přijato do tisku: 17. 1. 2023
Sources
1. Hadgkiss EJ, Jelinek GA, Weiland TJ et al. The association of diet with quality of life, disability, and relapse rate in an international sample of people with multiple sclerosis. Nutr Neurosci 2015; 18 (3): 125–136. doi: 10.1179/1476830514Y.0000000117.
2. Fitzgerald KC, Tyry T, Salter A et al. Diet quality is associated with disability and symptom severity in multiple sclerosis. Neurology 2018; 90 (1): e1–e11. doi: 10.1212/WNL.0000000000004768.
3. Leong EM, Semple SJ, Angley M et al. Complementary and alternative medicines and dietary interventions in multiple sclerosis: what is being used in South Australia and why? Complement Ther Med 2009; 17 (4): 216–223. doi: 10.1016/j.ctim.2009.03.001.
4. Katz Sand I. The role of diet in multiple sclerosis: mechanistic connections and current evidence. Curr Nutr Rep 2018; 7 (3): 150–160. doi: 10.1007/s13668-018-0236-z.
5. Schuh C, Wimmer I, Hametner S et al. Oxidative tissue injury in multiple sclerosis is only partly reflected in experimental disease models. Acta Neuropathol 2014; 128 (2): 247–266. doi: 10.1007/s00401-014-1263-5.
6. Langley MR, Triplet EM, Scarisbrick IA. Dietary influence on central nervous system myelin production, injury, and regeneration. Biochim Biophys Acta Mol Basis Dis 2020; 1866 (7): 165779. doi: 10.1016/j.bbadis.2020.165779.
7. Riccio P, Rossano R, Liuzzi GM. May diet and dietary supplements improve the wellness of multiple sclerosis patients? A molecular approach. Autoimmune Dis 2011; 2010 : 249842. doi: 10.4061/2010/249842.
8. Gilgun-Sherki Y, Melamed E, Offen D. The role of oxidative stress in the pathogenesis of multiple sclerosis: the need for effective antioxidant therapy. J Neurol 2004; 251 (3): 261–268. doi: 10.1007/s00415-004-0348-9.
9. Waslo C, Bourdette D, Gray N et al. Lipoic acid and other antioxidants as therapies for multiple sclerosis. Curr Treat Options Neurol 2019; 21 (6): 26. doi: 10.1007/s11940-019-0566-1.
10. Storoni M, Plant GT. The therapeutic potential of the ketogenic diet in treating progressive multiple sclerosis. Mult Scler Int 2015; 2015 : 681289. doi: 10.1155/2015/681289.
11. Carlson NG, Rose JW. Antioxidants in multiple sclerosis: do they have a role in therapy? CNS Drugs 2006; 20 (6): 433–441. doi: 10.2165/00023210-200620060-00001.
12. Jarrett SG, Milder JB, Liang LP et al. The ketogenic diet increases mitochondrial glutathione levels. J Neurochem 2008; 106 (3): 1044–1051. doi: 10.1111/j.1471-4159.2008.05460.x.
13. Tremlett H, Fadrosh DW, Faruqi AA et al. Gut microbiota in early pediatric multiple sclerosis: a case-control study. Eur J Neurol 2016; 23 (8): 1308–1321. doi: 10.1111/ene.13026.
14. Esposito S, Bonavita S, Sparaco M et al. The role of diet in multiple sclerosis: a review. Nutr Neurosci 2018; 21 (6): 377–390. doi: 10.1080/1028415X.2017.1303016.
15. Turnbaugh PJ, Ridaura VK, Faith JJ et al. The effect of diet on the human gut microbiome: a metagenomic analysis in humanized gnotobiotic mice. Sci Transl Med 2009; 1 (6): 6ra14. doi: 10.1126/scitranslmed.3000322.
16. Schepici G, Silvestro S, Bramanti P et al. The gut microbiota in multiple sclerosis: an overview of clinical trials. Cell Transplant 2019; 28 (12): 1507–1527. doi: 10.1177/0963689719873890.
17. Furusawa Y, Obata Y, Fukuda S et al. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells. Nature 2013; 504 (7480): 446–450. doi: 10.1038/nature12721.
18. Cignarella F, Cantoni C, Ghezzi L et al. Intermittent fasting confers protection in CNS autoimmunity by altering the gut microbiota. Cell Metab 2018; 27 (6): 1222–1235.e6. doi: 10.1016/j.cmet.2018.05.006.
19. Hedman AM, van Haren NEM, Schnack HG et al. Human brain changes across the life span: a review of 56 longitudinal magnetic resonance imaging studies. Hum Brain Mapp 2012; 33 (8): 1987–2002. doi: 10.1002/hbm. 21334.
20. Zivadinov R, Jakimovski D, Gandhi S et al. Clinical relevance of brain atrophy assessment in multiple sclerosis. Implications for its use in a clinical routine. Expert Rev Neurother 2016; 16 (7): 777–793. doi: 10.1080/14737175.2016.1181543.
21. Mao P, Reddy PH. Is multiple sclerosis a mitochondrial disease? Biochim Biophys Acta 2010; 1802 (1): 66–79. doi: 10.1016/j.bbadis.2009.07.002.
22. Rothhammer V, Mascanfroni ID, Bunse L et al. Type I interferons and microbial metabolites of tryptophan modulate astrocyte activity and central nervous system inflammation via the aryl hydrocarbon receptor. Nat Med 2016; 22 (6): 586–597. doi: 10.1038/nm.4106.
23. Xue Z, Li D, Yu W et al. Mechanisms and therapeutic prospects of polyphenols as modulators of the aryl hydrocarbon receptor. Food Funct 2017; 8 (4): 1414–1437. doi: 10.1039/c6fo01810f.
24. Joseph JA, Shukitt-Hale B, Denisova NA et al. Reversals of age-related declines in neuronal signal transduction, cognitive, and motor behavioral deficits with blueberry, spinach, or strawberry dietary supplementation. J Neurosci 1999; 19 (18): 8114–8121. doi: 10.1523/JNEUROSCI.19-18-08114.1999.
25. Xin J, Feinstein DL, Hejna MJ et al. Beneficial effects of blueberries in experimental autoimmune encephalomyelitis. J Agric Food Chem 2012; 60 (23): 5743–5748. doi: 10.1021/jf203611t.
26. Rinholm JE, Hamilton NB, Kessaris N et al. Regulation of oligodendrocyte development and myelination by glucose and lactate. J Neurosci 2011; 31 (2): 538–548. doi: 10.1523/JNEUROSCI.3516-10.2011.
27. Castellano CA, Nugent S, Paquet N et al. Lower brain 18F-fluorodeoxyglucose uptake but normal 11C-acetoacetate metabolism in mild Alzheimer‘s disease dementia. J Alzheimers Dis 2015; 43 (4): 1343–1353. doi: 10.3233/JAD-141074.
28. Kindred JH, Tuulari JJ, Bucci M et al. Walking speed and brain glucose uptake are uncoupled in patients with multiple sclerosis. Front Hum Neurosci 2015; 9 : 84. doi: 10.3389/fnhum.2015.00084.
29. Kuhlmann T, Miron V, Cui Q et al. Differentiation block of oligodendroglial progenitor cells as a cause for remyelination failure in chronic multiple sclerosis. Brain 2008; 131 (Pt 7): 1749–1758. doi: 10.1093/brain/awn 096.
30. Bai M, Wang Y, Han R et al. Intermittent caloric restriction with a modified fasting-mimicking diet ameliorates autoimmunity and promotes recovery in a mouse model of multiple sclerosis. J Nutr Biochem 2021; 87 : 108493. doi: 10.1016/j.jnutbio.2020.108 493.
31. Román GC, Jackson RE, Gadhia R et al. Mediterranean diet: the role of long-chain omega-3 fatty acids in fish; polyphenols in fruits, vegetables, cereals, coffee, tea, cacao and wine; probiotics and vitamins in prevention of stroke, age-related cognitive decline, and Alzheimer disease. Rev Neurol (Paris) 2019; 175 (10): 724–741. doi: 10.1016/j.neurol.2019.08.005.
32. Bohlouli J, Namjoo I, Borzoo-Isfahani M et al. Modified Mediterranean diet v. traditional Iranian diet: efficacy of dietary interventions on dietary inflammatory index score, fatigue severity and disability in multiple sclerosis patients. Br J Nutr 2022; 128 (7): 1274–1284. doi: 10.1017/S000711452100307X.
33. Esposito S, Sparaco M, Maniscalco GT et al. Lifestyle and Mediterranean diet adherence in a cohort of Southern Italian patients with multiple sclerosis. Mult Scler Relat Disord 2021; 47 : 102636. doi: 10.1016/j.msard.2020.102636.
34. Swank RL. Multiple sclerosis; a correlation of its incidence with dietary fat. Am J Med Sci 1950; 220 (4): 421–430.
35. Swank RL, Goodwin J. Review of MS patient survival on a Swank low saturated fat diet. Nutrition 2003; 19 (2): 161–162. doi: 10.1016/s0899-9007 (02) 00851-1.
36. Swank RL, Grimsgaard A. Multiple sclerosis: the lipid relationship. Am J Clin Nutr 1988; 48 (6): 1387–1393. doi: 10.1093/ajcn/48.6.1387.
37. Noseworthy JH, Lucchinetti C, Rodriguez M et al. Multiple sclerosis. N Engl J Med 2000; 343 (13): 938–952. doi: 10.1056/NEJM200009283431307.
38. Overcoming MS. Our history & context. [online]. Dostupné z: https: //overcomingms.org/about-us/our-history-context.
39. Marck CH, De Livera AM, Brown CR et al. Health outcomes and adherence to a healthy lifestyle after a multimodal intervention in people with multiple sclerosis: three year follow-up. PLoS One 2018; 13 (5): e0197759. doi: 10.1371/journal.pone.0197759.
40. Dr. McDougall. Our story. [online]. Dostupné z: https: //www.drmcdougall.com/our-story/.
41. McDougall J, Thomas LE, McDoufall C et al. Effects of 7 days on an ad libitum low-fat vegan diet: the McDougall Program cohort. Nutr J 2014; 13 : 99. doi: 10.1186/1475-2891-13-99.
42. Yadav V, Marracci G, Kim E et al. Low-fat, plant-based diet in multiple sclerosis: a randomized controlled trial. Mult Scler Relat Disord 2016; 9 : 80–90. doi: 10.1016/j.msard.2016.07.001.
43. Adam-Perrot A, Clifton P, Brouns F. Low-carbohydrate diets: nutritional and physiological aspects. Obes Rev 2006; 7 (1): 49–58. doi: 10.1111/j.1467-789X.2006.002 22.x.
44. Sourbron J, Klinkenberg S, van Kuijk SMJ et al. Ketogenic diet for the treatment of pediatric epilepsy: review and meta-analysis. Childs Nerv Syst 2020; 36 (6): 1099–1109. doi: 10.1007/s00381-020-04578-7.
45. Swidsinski A, Dörffel Y, Loening-Baucke V et al. Reduced mass and diversity of the colonic microbiome in patients with multiple sclerosis and their improvement with ketogenic diet. Front Microbiol 2017; 8 : 1141. doi: 10.3389/fmicb.2017.01141.
46. Brenton JN, Lehner-Gulotta D, Woolbright E et al. Phase II study of ketogenic diets in relapsing multiple sclerosis: safety, tolerability and potential clinical benefits. J Neurol Neurosurg Psychiatry 2022; 93 (6): 637–644. doi: 10.1136/jnnp-2022-329074.
47. Wahls T. The Wahls protocol: a radical new way to treat all chronic autoimmune conditions using paleo principles. Baltimore: Penguin Publishing Group 2014.
48. Bisht B, Darling WG, Torage Shivapour E et al. Multimodal intervention improves fatigue and quality of life in subjects with progressive multiple sclerosis: a pilot study. Degener Neurol Neuromuscul Dis 2015; 5 : 19–35. doi: 10.2147/DNND.S76523.
49. Irish AK, Erickson CM, Wahls TL et al. Randomized control trial evaluation of a modified Paleolithic dietary intervention in the treatment of relapsing-remitting multiple sclerosis: a pilot study. Degener Neurol Neuromuscul Dis 2017; 7 : 1–18. doi: 10.2147/DNND.S116949.
50. Lee JE, Bisht B, Hall MJ et al. A multimodal, nonpharmacologic intervention improves mood and cognitive function in people with multiple sclerosis. J Am Coll Nutr 2017; 36 (3): 150–168. doi: 10.1080/07315724.2016.1255160.
51. Fellows Maxwell K, Wahls T, Browne RW et al. Lipid profile is associated with decreased fatigue in individuals with progressive multiple sclerosis following a diet - -based intervention: results from a pilot study. PLoS One 2019; 14 (6): e0218075. doi: 10.1371/journal.pone.0218075.
52. Wahls TL, Reese D, Kaplan D et al. Rehabilitation with neuromuscular electrical stimulation leads to functional gains in ambulation in patients with secondary progressive and primary progressive multiple sclerosis: a case series report. J Altern Complement Med 2010; 16 (12): 1343–1349. doi: 10.1089/acm.2010.0080.
53. Wahls TL, Titcomb TJ, Bisht B et al. Impact of the Swank and Wahls elimination dietary interventions on fatigue and quality of life in relapsing-remitting multiple sclerosis: the WAVES randomized parallel-arm clinical trial. Mult Scler J Exp Transl Clin 2021; 7 (3): 20552173211035399. doi: 10.1177/20552173211035399.
54. Titcomb TJ, Brooks L, Smith KL et al. Change in micronutrient intake among people with relapsing-remitting multiple sclerosis adapting the Swank and Wahls diets: an analysis of weighed food records. Nutrients 2021; 13 (10): 3507. doi: 10.3390/nu13103507.
55. Schreiner TG, Genes TM. Obesity and multiple sclerosis – a multifaceted association. J Clin Med 2021; 10 (12): 2689. doi: 10.3390/jcm10122689.
56. Moszak M, Szulinska M, Bogdanski P. You are what you eat – the relationship between diet, microbiota, and metabolic disorders – a review. Nutrients 2020; 12 (4): 1096. doi: 10.3390/nu12041096.
57. Hucke S, Wiendl H, Klotz L. Implications of dietary salt intake for multiple sclerosis pathogenesis. Mult Scler 2016; 22 (2): 133–139. doi: 10.1177/1352458515609431.
58. Innes JK, Calder PC. Omega-6 fatty acids and inflammation. Prostaglandins Leukot Essent Fatty Acids 2018; 132 : 41–48. doi: 10.1016/j.plefa.2018.03.004.
59. Matveeva O, Bogie JFJ, Hendriks JJA et al. Western lifestyle and immunopathology of multiple sclerosis. Ann N Y Acad Sci 2018; 1417 (1): 71–86. doi: 10.1111/ nyas.13583.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2023 Issue 1
-
All articles in this issue
- Editorial
- Poděkování recenzentům
- Progressive multiple sclerosis in the light of the latest findings
- Recommendations for structural brain MRI in the diagnosis of epilepsy
- Dietary approaches specific to patients with multiple sclerosis
- Stroke specific measurement tools used to assess health related quality of life in young adults after ischemic stroke
- The role of dynamic MRI of the cervical spine and dynamic evoked potentials in the diagnosis of degenerative cervical myelopathy
- Validation of the Electronic Memory Test ALBAV
- Psychopathological context of alexithymia in patients with back pain
- Narcolepsy severity scale and its psychometric properties in patients with narcolepsy type 1 in the Czech Republic
- Decompressive craniectomy with watertight duroplasty and without watertight duroplasty - advantages and disadvantages
- The first Czech patient with aminoacylase I deficiency
- Komentář k článku autorů Kövári et al Ovlivnění spasticity pomocí elektrické stimulace podle Jantsche – pilotní studie
- Komentář k článku autorů Ehler et al Onemocnění bederní páteře – nová neurologická nemoc z povolání
- Doc. MUDr Zbyněk Kalita, CSc. dovršil 80 let zdařilého života
- Free serum triiodothyronine associations with the Mini-Mental State Examination score after experienced acute ischemic stroke
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Progressive multiple sclerosis in the light of the latest findings
- Recommendations for structural brain MRI in the diagnosis of epilepsy
- Dietary approaches specific to patients with multiple sclerosis
- The role of dynamic MRI of the cervical spine and dynamic evoked potentials in the diagnosis of degenerative cervical myelopathy
