Glatiramer acetát (Copaxone®) v léčbě atakovité formy roztroušené sklerózy mozkomíšní – klinická účinnost a bezpečnostní profil
Glatiramer Acetate (Copaxone®) in the Treatment of Relapsing/Remitting Cerebrospinal Multiple Sclerosis – Clinical Efficacy and Safety Profile
This extensive study of multiple sclerosis (MS) aims to evaluate the influence of glatiramer acetate (Copaxone®) on relapse rate, disease progression and changes in fatigue and quality of life (QoL) parameters in order to strengthen the profile of this immunomodulator through focusing on lesser-known but important clinical aspects. Glatiramer acetate is an effective long-term treatment for relapsing-remitting MS (RRMS), reducing relapse rate and stabilizing disease progression. The study covered the years 2006–2010 with a cohort consisting of 766 patients (n = 766) with RRMS. However, not all of them had complete records, which is reflected in the numbers of patients in specific subgroups. Patients received subcutaneous glatiramer acetate 20 mg once daily and were subsequently followed up for 13 months. Our study evaluated demographic data, annual relapse rate, EDSS progression, and QoL and fatigue scale questionnaires. The project was approved by the local ethics committees. Statistical significance was tested by T-test at a level of p<0.05. The average annual relapse rate (A-RR) was 1.8 before treatment and 0.46 after one year’s treatment. EDDS values were on average 2.63 before treatment, and 2.54 after 1 year’s treatment. QoL questionnaire results showed improvements in family relations, health concerns, tiredness and conservation of energy (p <0.01). The fatigue impact scale questionnaire disclosed statistically significant improvement for certain factors, such as flexibility, social isolation, working abilities, motivation, mental concentration and lesser rest requirement (p < 0.01–0.04). We conclude that significantly reduced A-RR and non-significant EDSS improvement were basic results confirming the efficacy of glatiramer acetate in this clinical observational study. Statistically significant improvement in various factors in QoL and fatigue impact scale questionnaires support the notion of a wider clinical impact for glatiramer acetate treatment in daily practice.
Key words:
multiple sclerosis – glatiramer acetate – treatment efficacy and safety
Autoři:
P. Štourač 1,2; P. Praksová 1; I. Kontrová 1; M. Hladíková 1; I. Okáčová 1; Y. Benešová 1
Působiště autorů:
Neurologická klinika LF MU a FN Brno
1; CEITEC (Středoevropský technologický institut), MU, Brno
2
Vyšlo v časopise:
Cesk Slov Neurol N 2011; 74/107(4): 447-454
Kategorie:
Původní práce
Souhrn
Cílem rozsáhlé observační klinické studie bylo vyhodnotit vliv glatiramer acetátu (Copaxone®) na četnost relapsů, progresi onemocnění a na parametry únavy a kvality života jakožto méně často hodnocené aspekty nemoci. Glatiramer acetát je lék, který dlouhodobě ovlivňuje počet relapsů a progresi onemocnění. Soubor sestával ze 766 pacientů s atakovitým průběhem roztroušené sklerózy s obdobím sledování v letech 2006–2010. Ne u všech byla k dispozici kompletní dokumentace, jak vyplyne z počtů pacientů v jednotlivých specifikovaných podsouborech. Pacienti dostávali denně subkutánně 20 mg glatiramer acetátu (Copaxone®) a byli sledováni 13 měsíců. S pomocí validovaných dotazníků byla hodnocena demografická data, roční četnost atak, progrese onemocnění hodnocená škálou EDSS (Expanded Disability Status Scale), kvalita života a únava. Projekt byl schválen etickou komisí. Statistická významnost byla hodnocena pomocí t-testu. Průměrná roční četnost atak byla 1,8 před léčbou a 0,46 po roce léčby. EDSS hodnota činila 2,63 na začátku léčby a 2,54 po roce léčby. Hodnocení dotazníků kvality života prokázalo statisticky významné zlepšení v následujících parametrech: rodinné vztahy, obavy o zdraví, únavnost, uchování energie (p < 0,01). V dotazníku týkajícím se únavy bylo prokázáno signifikantní zlepšení v následující parametrech: flexibilita, sociální izolace, motivace, psychická koncentrace a kratší doba odpočinku (p < 0,01–0,04). V uvedené studii jsme prokázali statisticky významnou redukci počtu atak a statisticky nevýznamné zlepšení v EDSS škále. Statisticky významná byla zlepšení v některých parametrech kvality života a únavy, což ukazuje na účinnost Copaxone i v těchto méně sledovaných aspektech.
Klíčová slova:
roztroušená skleróza mozkomíšní – glatiramer acetát – účinnost – bezpečnost
Úvod
Glatiramer acetát (GA; Copaxone®, Teva Inc., Izrael) je od roku 1996 schválený preparát k léčbě atakovité formy roztroušené sklerózy mozkomíšní (RR-RS) a patří mezi léky první volby. Donedávna byly glatiramer acetát a interferony beta jediné léky dostupné pro léčbu RR-RS. V současnosti však přibývají další léky, jako jsou monoklonální protilátka natalizumab (Tysabri) a první perorální preparát fingolimod (Gilenya). Problematika dlouhodobé účinnosti a bezpečnosti jednotlivých preparátů nabývá na významu a data získaná v podmínkách běžné klinické praxe umožňují lépe objektivizovat postavení jednotlivých preparátů ve spektru dostupných léčiv. Glatiramer acetát je tvořen směsí syntetických polypeptidů ze čtyř aminokyselin původně vytvořených jako peptidový analog myelinového bazického proteinu [1]. Mechanizmus působení GA je imunomodulační a neuroprotektivní [2]. GA způsobuje posun v subpopulacích T lymfocytů v systémové cirkulaci mechanizmem indukce Th2 subpopulace imunoregulačních lymfocytů. Th2 imunoregulační lymfocyty přestupují do centrálního nervového systému (CNS), kde dochází k uvolnění protizánětlivých cytokinů a růstových faktorů [3]. GA rovněž stimuluje sekreci neurotrofních faktorů v CNS, čímž vytváří protektivní vliv na axony a dochází k reparaci poškozených neuronů. Z hlediska účinnosti v kategoriích klinickým parametrů redukuje GA počet atak onemocnění ve srovnání s placebem o 29 % a dále zlepšuje disabilitu u RR-RS [4]. V současnosti je GA indikován také k léčbě klinicky izolovaného syndromu (CIS) s významným účinkem na prodloužení intervalu do fáze klinicky jisté roztroušené sklerózy [5].
Roztroušená skleróza je onemocnění postihující i neuropsychologické funkce a jejich případné léčebné ovlivnění zatím nebylo předmětem většiny studií. Zejména únava a deprese mají významný vliv na kvalitu života včetně práceschopnosti. Únava se objevuje u cca 75 % pacientů s RS a je považována za jeden z nejobtížnějších symptomů [6].
Pacientů, kteří únavu uvádějí jako důvod pouze částečné práceschopnosti, je 90 %. Léčba GA, která snížila únavu a vedla k menšímu počtu dnů nepřítomnosti v zaměstnání, byla prokázána ve studii Ziemssena et al [7].
Cílem uvedené observační studie bylo zhodnotit účinnost a bezpečnost GA v podmínkách běžné klinické praxe se zaměřením i na některé ojediněle sledované parametry, jako jsou únava a kvalita života pacientů s roztroušenou sklerózou. Studie byla multicentrická a byla prováděna ve specializovaných MS centrech v České republice v letech 2006–2011.
Soubor a metodika
Popis projektu a souboru pacientů
Projekt sledování bezpečnosti a účinnosti přípravku GA – Copaxone® byl neintervenční, multicentrický, národní, prospektivní observační projekt u pacientů s atakovitou formou roztroušené sklerózy. Jeho cílem bylo zjistit účinnost, výskyt nežádoucích účinků a toleranci přípravku Copaxone® v podmínkách běžné klinické praxe v monoterapii či v případné kombinaci s jinými léčivy, která pacient užíval.
Dalšími cíli sledování bylo zaznamenání demografických údajů pacientů, hodnocení kvality života a hodnocení únavy na základě údajů v dotaznících vyplněných pacienty. Projekt započal dne 11. 12. 2006 a ukončen byl dne 10. 12. 2010. Do sledování byli zařazeni pacienti s potvrzenou diagnózou roztroušené sklerózy léčení přípravkem Copaxone® starší 18 let. Další podmínkou zařazení do studie byl informovaný souhlas. Ke statistickému zpracování dat byly použity následující metody: program NCSS 2007 a základní statistické údaje. Vztahy kvalitativních proměnných byly hodnoceny pomocí párového t-testu, ve všech případech na hladině významnosti 95 %.
V rámci první vizity bylo hodnoceno 708 pacientů. Byla zaznamenána demografická data a dále probíhalo sledování dle protokolu během 12 měsíců. Průměrný věk všech pacientů činil 35,48 ± 10,01 roků. U celkem 53 pacientů bylo zjištěno, že mají pozitivní rodinnou anamnézu výskytu roztroušené sklerózy. Celkem 167 pacientů bylo před zařazením do sledování léčeno interferony. Z toho u 13 pacientů byly v předchozím období před zahájením aplikace léčivého přípravku Copaxone® aplikovány dva různé interferony.
V podávání interferonů před zařazením do sledování nebyly zjištěny žádné statisticky významné rozdíly mezi muži a ženami. Předchozí aplikace interferonů byla u výše uvedených 167 pacientů ukončena především kvůli nežádoucím účinkům (n = 109) a dále pak z důvodu neúčinnosti (n = 82). U 24 pacientů byla terapie interferony ukončena z obou důvodů. Průměrný počet atak roztroušené sklerózy od počátku onemocnění činil 4,23 ± 2,99. Průměrný počet atak roztroušené sklerózy za posledních 24, resp. 12 měsíců před zahájením aplikace léčivého přípravku Copaxone® činil 2,44 ± 1,10; resp. 1,80 ± 0,88. U pacientů bylo sledováno EDSS skóre. Při první vizitě činila jeho průměrná hodnota 2,63 ± 1,09. Ta byla mírně vyšší u mužů (2,74 ± 1,16) než u žen (2,59 ± 1,06), rozdíl byl hraničně statisticky nevýznamný (p = 0,05122). Uvedené hodnoty při první návštěvě představují referenční hodnoty k vyhodnocení účinnosti po 12 měsících u obou parametrů. Úkolem pacientů bylo vyplnit dotazníky kvality života (dotazník vyplnilo 589 pacientů) a hodnocení stupně únavy (dotazník vyplnilo 584 pacientů).
Výsledky
Účinnost léčivého přípravku Copaxone®
A) Vývoj počtu relapsů a počtu hospitalizací u všech pacientů zařazených do sledování
Za celé období sledování, tj. od první do páté vizity, bylo celkem identifikováno 387 relapsů onemocnění roztroušenou sklerózou. Celkem 56 pacientů bylo z důvodu relapsu onemocnění hospitalizováno a 326 pacientům byly nitrožilně aplikovány glukokortikoidy. V případě 151 pacientů (tj. 39,02 %) bylo dosaženo kompletní remise.
Údaje o počtech relapsů, hospitalizací a dosažení remise jsou uvedeny v souhrnné tabulce (tab. 1).
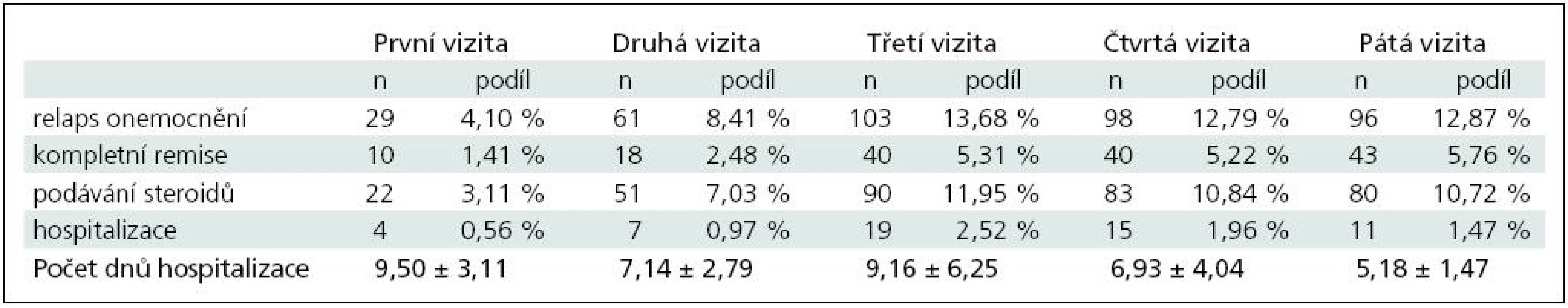
Podíl pacientů s relapsem onemocnění roztroušenou sklerózou při jednotlivých vizitách a počet pacientů, u nichž byla dosažena kompletní remise relapsu (graf 1).

B) Porovnání vývoje počtu relapsů u plně hodnotitelných pacientů v minulosti léčených interferony a v minulosti interferony neléčených
Byl porovnán vývoj počtu relapsů u pacientů, u kterých byly k dispozici všechny záznamy z první až páté vizity. Tito pacienti byli označeni jako plně hodnotitelní pacienti, protože u nich byly k dispozici údaje za kompletní roční terapii léčivým přípravkem Copaxone®.
Celkem bylo plně hodnotitelných 621 pacientů, z nichž 145 pacientů (tj. 23,35 %) bylo v minulosti léčeno některým z interferonů a 476 pacientů (tj. 76,65 %) pak v minulosti žádným z interferonů léčeno nebylo.
Výsledky zjištěných počtů relapsů, dosažení kompletní remise, nutnosti aplikace steroidů a případné hospitalizaci a její délky jsou uvedeny v tab. 2.
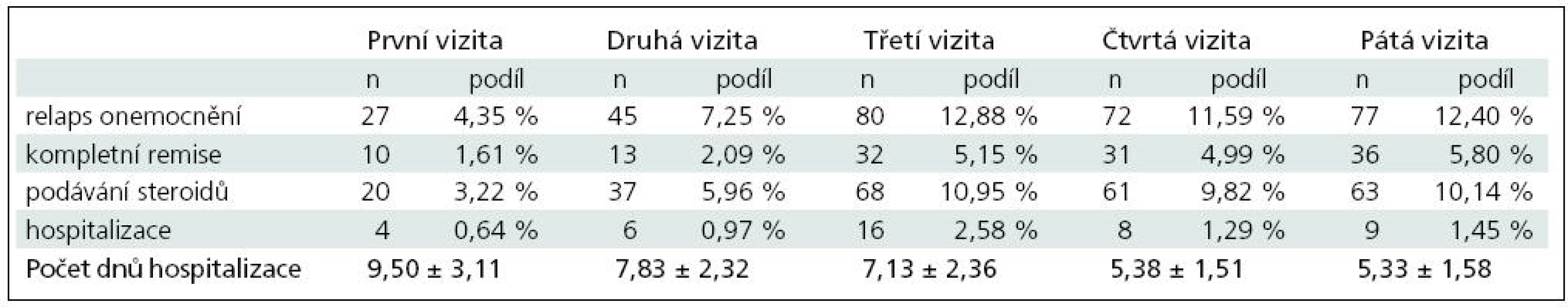
Celkem bylo u plně hodnotitelných pacientů zaznamenáno 301 relapsů onemocnění, na jednoho pacienta a rok tak připadalo průměrně 0,485 relapsu onemocnění. Z toho u 249 pacientů bylo nutné aplikovat steroidy, tj. na jednoho pacienta a rok připadala průměrně 0,401 aplikace steroidů. Celkem bylo zaznamenáno 43 hospitalizací s průměrnou délkou 6,74 ± 2,43 dne, a na jednoho pacienta a rok připadalo průměrně 0,069 hospitalizací.
V případě pacientů v minulosti léčených některým z interferonů (n = 145) jsou výsledky uvedeny v tab. 3.
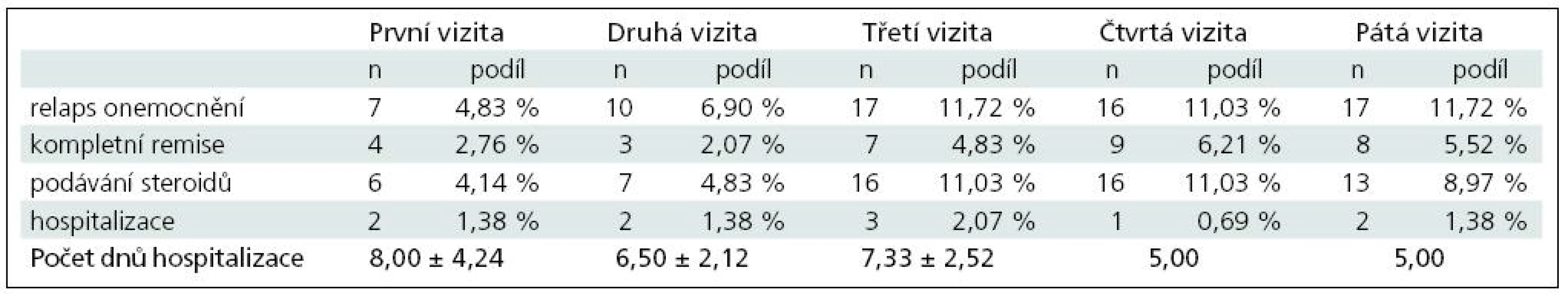
Celkem bylo u plně hodnotitelných pacientů v minulosti léčených některým z interferonů zaznamenáno 67 relapsů onemocnění, na jednoho pacienta a rok tak připadalo průměrně 0,462 relapsu onemocnění. Z toho u 58 pacientů bylo nutné aplikovat steroidy, tj. na jednoho pacienta a rok připadala průměrně 0,400 aplikace steroidů. Celkem bylo u těchto pacientů zaznamenáno 10 hospitalizací s průměrnou délkou 6,60 ± 2,32 dne, a na jednoho pacienta a rok připadalo průměrně 0,069 hospitalizací.
V případě pacientů v minulosti neléčených některým z interferonů (n = 476) jsou výsledky uvedeny v tab. 4.
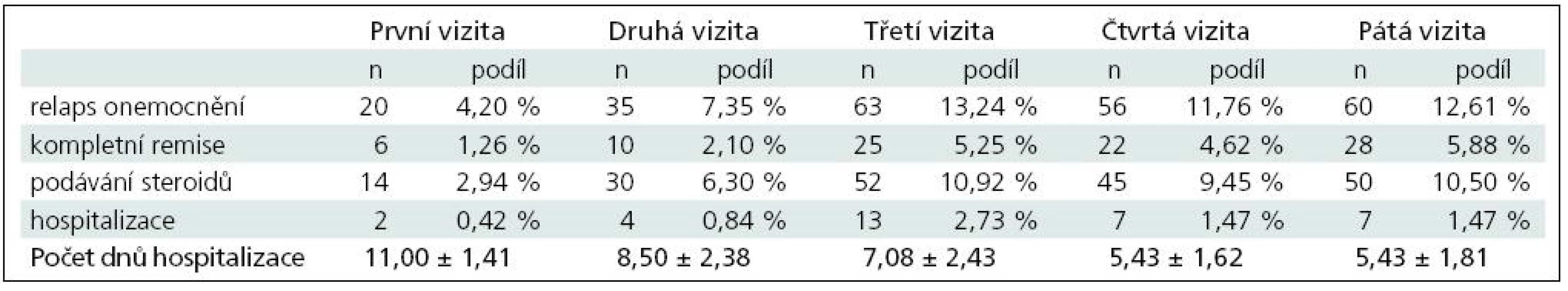
Celkem bylo u plně hodnotitelných pacientů v minulosti neléčených některým z interferonů zaznamenáno 234 relapsů onemocnění, na jednoho pacienta a rok tak připadalo průměrně 0,492 relapsu onemocnění. Z toho u 191 pacientů bylo nutné aplikovat steroidy, tj. na jednoho pacienta a rok připadala průměrně 0,401 aplikace steroidů. Celkem bylo u těchto pacientů zaznamenáno 33 hospitalizací s průměrnou délkou 6,79 ± 2,50 dne. Na jednoho pacienta a rok připadalo průměrně 0,069 hospitalizací.
Mezi pacienty v minulosti léčenými některým z interferonů a pacienty interferony v minulosti neléčenými nebyly zjištěny statisticky významné rozdíly ve výskytu relapsů onemocnění, nutnosti aplikace steroidů, počtu hospitalizací a jejich průměrné délky.
C) Porovnání vývoje EDSS skóre u hodnotitelných pacientů v minulosti léčených interferony a v minulosti interferony neléčených
Byl porovnáván vývoj hodnoty EDSS skóre u plně hodnotitelných pacientů v minulosti léčených některým z interferonů (n = 145) a v minulosti interferony neléčených (n = 476). Výsledky zjištěné v rámci první až páté vizity jsou uvedeny v tab. 5.

Zatímco průměrná hodnota EDSS skóre u všech plně hodnotitelných pacientů se v průběhu sledování (tj. v období mezi první až pátou vizitou) prakticky nezměnila a příslušné rozdíly nebyly statisticky významné, u pacientů v minulosti léčených některým z interferonů došlo k nárůstu průměrné hodnoty EDSS skóre a tato změna byla statisticky významná (p = 0,023). U pacientů v minulosti interferony neléčených hodnota EDSS skóre mírně poklesla. Tento pokles nebyl statisticky významný. Rozdíl mezi pacienty v minulosti léčenými některým z interferonů a pacienty interferony neléčených byl statisticky významný (p < 0,01). Podrobnosti jsou uvedeny v grafu 2.

D) Byl sledován vývoj počtu pacientů, u nichž byla terapie ukončena z důvodu neúčinnosti
Za celou dobu sledování byla aplikace léčivého přípravku Copaxone® ukončena z důvodu neúčinnosti pouze u 16 pacientů (tj. 2,09 %), přičemž nejvíce pacientů, u kterých byla terapie ukončena pro neúčinnost, bylo v rámci páté vizity. Jako kritérium neúčinnosti byl zvolen stejný počet atak jako před léčbou a/nebo progrese v EDSS o jeden stupeň během ročního sledování.
Bezpečnost léčivého přípravku Copaxone®
Celkem byl identifikován jeden závažný nežádoucí účinek. Závažné nežádoucí účinky ve sledovaném souboru pacientů tak postihly 0,13 % pacientů a tvořily 0,1 % všech zaznamenaných nežádoucích účinků. V tomto případě 27letá pacientka měla v průběhu léčby hepatopatii s následným jaterním selháváním. Hepatopatie byla však přítomna již před zahájením léčby Copaxone® a byla stanovena diagnóza autoimunitní hepatopatie. Stav pacientky se stabilizoval a nebyla prokázána souvislost poruchy s léčbou Copaxone®.
Výskyt ostatních nežádoucích účinků
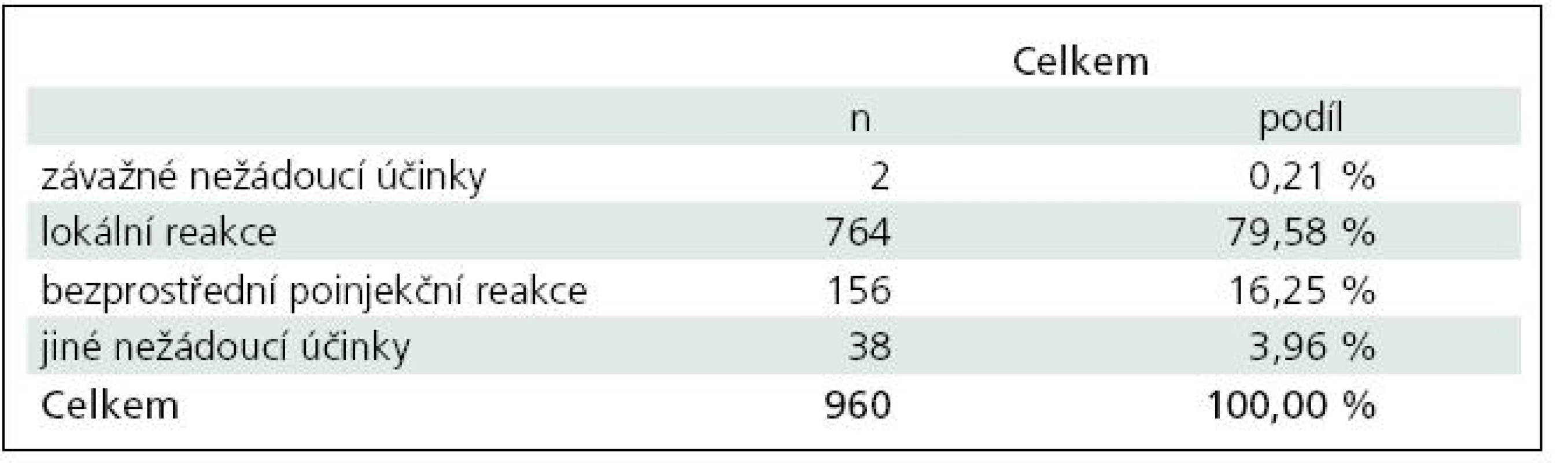
V období od první do páté vizity bylo hlášeno 960 nežádoucích účinků, které postihovaly v jednotlivých vizitách 17,69––32,77 % pacientů (přitom podle platného SPC postihují nezávažné nežádoucí účinky až 70 % pacientů ve srovnání s 37 % pacientů v placebo skupině). Nežádoucím účinkům zcela dominovaly lokální reakce, které byly popsány v celkem 764 případech a tvořily 79,58 % všech nežádoucích účinků. Bezprostřední poinjekční reakce byly zaznamenány ve 156 případech a tvořily 16,25 % všech nežádoucích účinků. Jiné než výše uvedené nežádoucí účinky se vyskytly v celkem 38 případech a tvořily 3,96 % všech nežádoucích účinků. Z tzv. ostatních nežádoucích účinků se ve všech případech jednalo o nežádoucí účinky očekávané a některé z těchto nežádoucích účinků by bylo možné zahrnout do bezprostřední poinjekční reakce (např. jeden případ izolované dušnosti) a mezi lokální reakce (např. sedm případů bolesti v místě aplikace) (tab. 6).
Hodnocení kvality života
Kvalita života byla hodnocena semikvantitativně a pacienti vyplňovali dotazník s osmi otázkami, na které odpovídali odpovědí vyjádřenou číselnou hodnotou 0 až 4, které značily: 0 – vůbec, 1 – málo, 3 – docela dost, 4 – velmi mnoho, významně. Byly sledovány a statisticky hodnoceny rozdíly v odpovědích na otázky v rámci první a páté vizity, přičemž důraz byl kladen na odpovědi „0“ a odpovědi „4“.
V případě odpovědí „0“, tj. problém obsažený v otázce se vůbec nevyskytuje, bylo ve čtyřech případech zjištěno, že rozdíly v odpovědích při první a páté vizitě jsou statisticky významné. Především se statisticky významně zvýšil podíl pacientů, u kterých není jejich zdravotní stav odpovědný za rodinné vztahy (p = 0,042). Statisticky významně se zvýšil podíl pacientů, kteří nepociťují obavy o své zdraví (p < 0,01), kteří se necítí unavení (p = 0,021). Mírně, ale statisticky významně poklesl podíl pacientů, kterým se nedostává energie jako dřív (p = 0,043) (tab. 7).
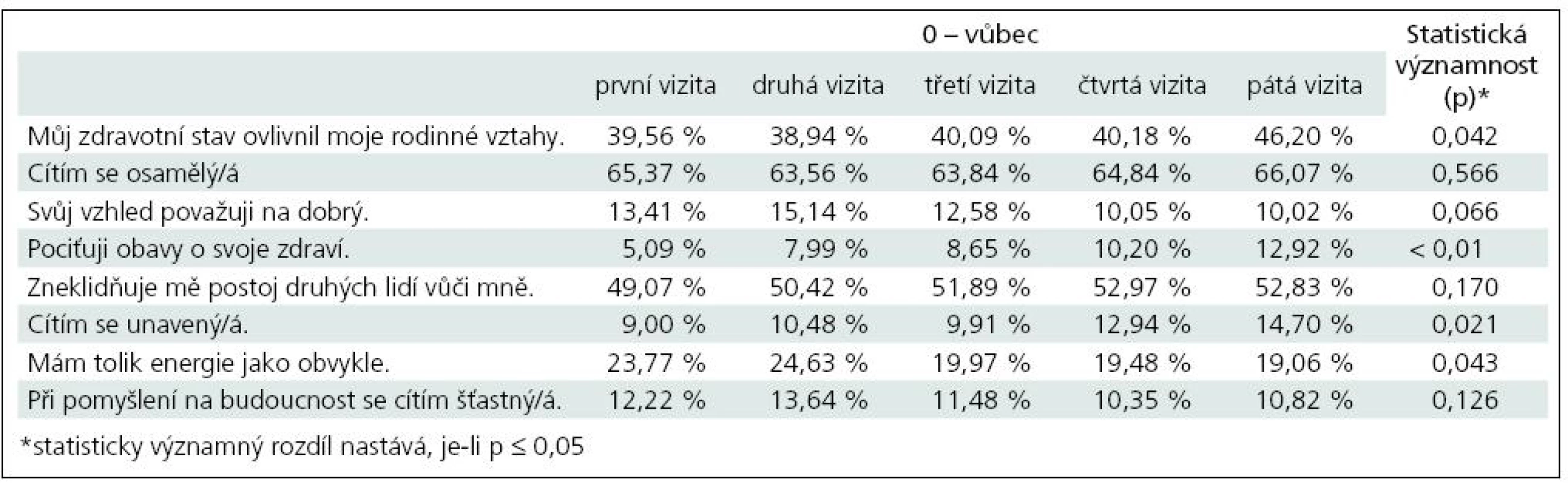
V případě odpovědí „4“, tj. problém obsažený v otázce se manifestuje velmi mnoho nebo významně, bylo v pěti případech zjištěno, že rozdíly v odpovědích při první a páté vizitě jsou statisticky významné.
Především se statisticky významně snížil podíl pacientů, kteří nepociťují obavy o své zdraví (p = 0,037). Statisticky významně poklesl podíl pacientů, které zneklidňuje postoj druhých lidí vůči nim (p = 0,014). Statisticky významně též poklesl podíl pacientů, kteří se necítí unavení (p = 0,045). Statisticky významně vzrostl podíl pacientů, kterým se nedostává energie jako dřív (p < 0,01). Statisticky významně vzrostl podíl pacientů, kteří se necítí šťastní při pomyšlení na budoucnost (p < 0,01) (tab. 8).
Hodnocení stupně únavy
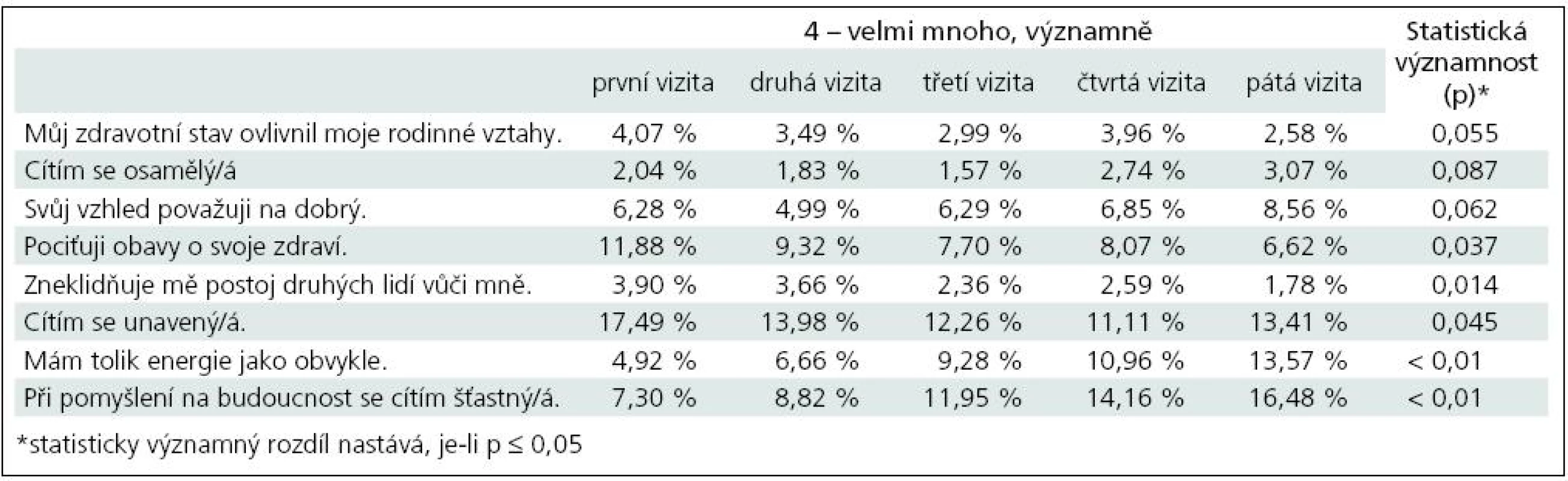
Stupeň únavy byl hodnocen semikvantitativně a pacienti vyplňovali dotazník s celkem 40 otázkami, na které odpovídali odpovědí vyjádřenou číselnou hodnotou 0 až 4, které značily: 0 – vůbec, 1 – málo, 3 – docela dost, 4 – velmi mnoho, významně. Byly sledovány a statisticky hodnoceny rozdíly v odpovědích na otázky v rámci první a páté vizity, přičemž důraz byl kladen na odpovědi „0“ a odpovědi „4“.
V případě odpovědí „0“, tj. problém obsažený v otázce se vůbec nevyskytuje, bylo v osmi případech zjištěno, že rozdíly v odpovědích při první a páté vizitě jsou statisticky významné (tab. 9).
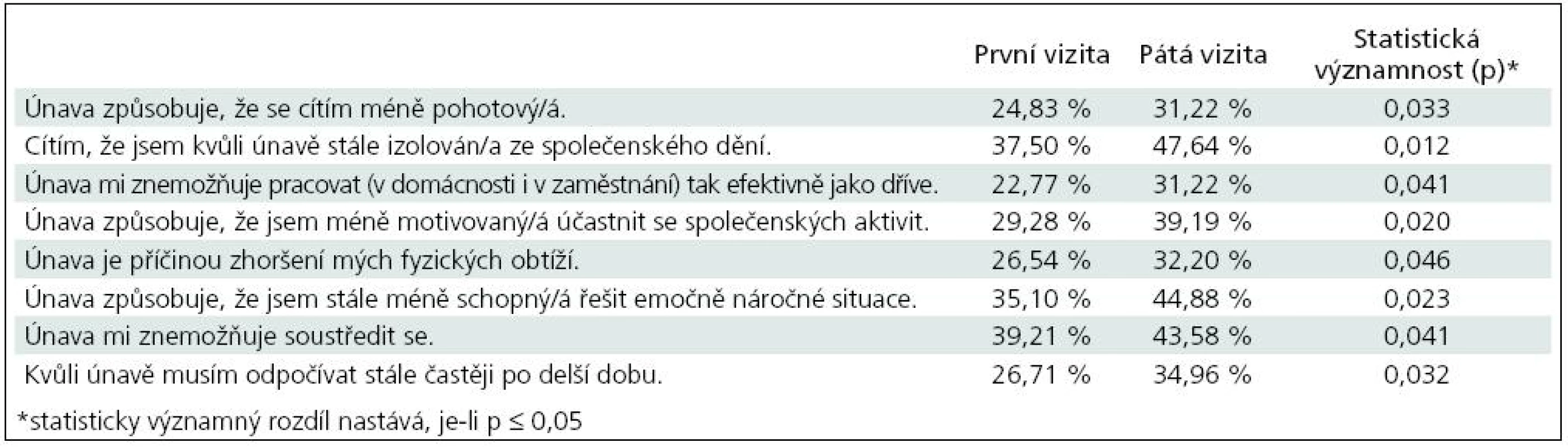
Především se statisticky významně zvýšil počet pacientů, u kterých únava nezpůsobuje, že se cítí méně pohotoví (p = 0,033). Stejně tak byl zjištěn statisticky významný rozdíl v odpovědích na otázku, zda pacient cítí, že je kvůli únavě stále izolován ze společenského dění (p = 0,012), nemůže pracovat tak efektivně jako dříve (p = 0,041), že je méně motivovaný účastnit se společenských aktivit (p = 0,020), že únava je příčinou jeho fyzických obtíží (p = 0,046), že je stále méně schopen řešit emočně náročné situace (p = 0,023), únava znemožňuje soustředit se (p = 0,041) a že kvůli únavě musí stále více odpočívat po delší dobu (p = 0,032). Ostatní rozdíly nebyly statisticky významně odlišné.
V případě odpovědí „4“, tj. problém obsažený v otázce se manifestuje velmi mnoho nebo významně, bylo ve 23 případech zjištěno, že rozdíly v odpovědích při první a páté vizitě jsou statisticky významné (tab. 10).
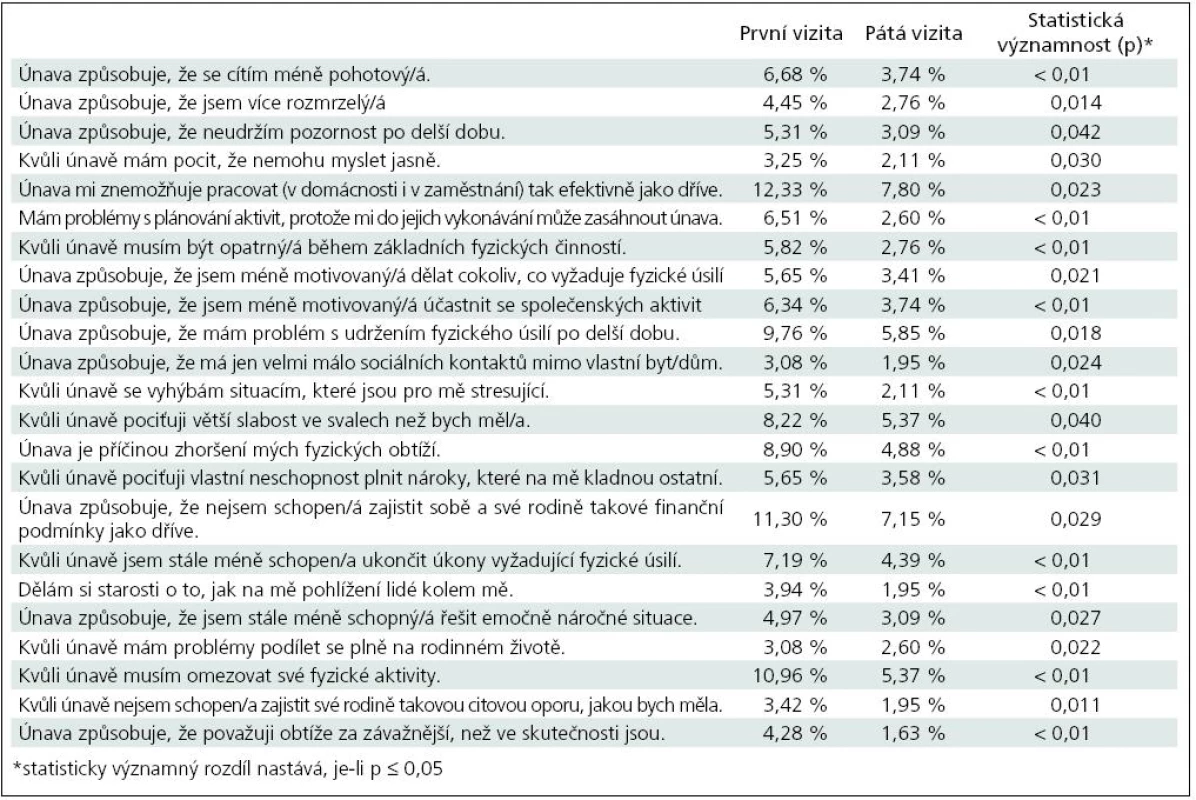
Statisticky velmi významné rozdíly (p < 0,01) byly ve snížení podílu pacientů odpovídajících odpovědí „4“ na otázky: únava způsobuje, že se cítí méně pohotový, že mám problémy s plánováním aktivit, že musím být kvůli únavě opatrný během základních fyzických činností, že jsem méně motivovaný účastnit se společenských aktivit, že se kvůli únavě vyhýbá stresujícím situacím, že je únava příčinou jeho fyzických obtíží, že kvůli únavě je stále méně schopen ukončit úkony, které vyžadují fyzické úsilí, že si dělá starosti, jak na něj pohlížejí lidé z okolí, a že kvůli únavě musí omezovat své fyzické aktivity a že únava způsobuje, že vnímá své obtíže závažněji, než ve skutečnosti jsou.
Diskuze
Bezpečnost a účinnost Copaxone® v podmínkách současné neustále se měnící praxe v léčbě roztroušené sklerózy vzhledem k nástupu nových léků může být nejlépe ověřena v podmínkách běžné klinické praxe formou observačních klinických studie. Z hlediska bezpečnosti je role těchto studií nezastupitelná, neboť vzhledem k velkému počtu pacientů a dlouhodobosti sledování mohou odkrýt nežádoucí účinky, obdobně jako se tomu stalo v případě PML (progresivní multifokální leukoencefalopatie) při léčbě Tysabri® po uvedení na trh. Relativně menší průkaznost ohledně účinnosti vzhledem k absenci randomizace a placebo skupiny je kompenzována srovnáním dat z předchozích studií třídy I, kdy by případný rozpor vedl k revizi původních dat. Ve studii byl prokázán velmi dobrý bezpečnostní profil Copaxone®, neobjevily se oportunní ani získané infekce, malignity ani autoimunitní onemocnění jako v případě některých terapií [8]. Nežádoucí účinky zaznamenané ve studii měly charakter přechodných nežádoucích zvláště lokálních reakcí, a to pouze v menším procentu (17–33 %), než je uvedeno v SPC přípravku. Ze závažných komplikací byla přítomna jedenkrát autoimunitní hepatopatie bez prokázané souvislosti s léčbou Copaxone®.
Z hlediska klinické účinnosti byla sledována redukce počtu atak při léčbě Copaxone® jednak celkově a jednak v podskupinách rozdělených vzhledem k přítomnosti či absenci předchozí léčby interferony beta. Počet atak (relaps rate) roztroušené sklerózy za posledních 24, resp. 12 měsíců před zahájením aplikace léčivého přípravku Copaxone® činil 2,44 ± 1,10; resp. 1,80 ± 0,88. Výsledky u léčených pacientů vykazují roční relaps rate 0,485 u všech hodnotitelných pacientů. Celkem bylo u plně hodnotitelných pacientů v minulosti léčených některým z interferonů zaznamenáno 67 relapsů onemocnění, na jednoho pacienta a rok tak připadalo průměrně 0,462 relapsu onemocnění. Dále bylo u plně hodnotitelných pacientů v minulosti interferony neléčených zaznamenáno 234 relapsů onemocnění, na jednoho pacienta a rok tak připadalo průměrně 0,492 relapsu. Uvedená statisticky významná redukce v ročním počtu atak z 1,8 na 0,485 je podobná výsledkům srovnávacích studií s interferonem beta-1a (REGARD), interferonem beta-1b (BECOME, BEYOND) [9–11]. Uvedená roční redukce atak představuje procentuální snížení o 73 %, ve výše uvedených studiích byla redukce v ročním relaps rate z 1,9 na 0,33 a představovala procentuální redukci 83 %. Copaxone® vykazoval v uvedených studiích obdobnou účinnost na redukci relapsů a počátek působení jako interferony beta-1a a 1b. Redukce počtu atak byla mnohem výraznější než v první studii v roce 1995, v níž byla dosažena hodnota 0,59. Uvedený rozdíl je pravděpodobně důsledkem odlišné populace pacientů zařazované nyní do studií na základě kritérií daných nálezem na magnetické rezonanci ve srovnání se studiemi založenými na klinických kritériích. Mírně vyšší frekvence atak u pacientů dříve neléčených interferony ve srovnání s léčenými interferony nedosáhla statistické významnosti. Dalším hodnoceným parametrem účinnosti byla změna v EDSS.
Zatímco v podskupině pacientů dříve léčených interferony byl statisticky významný nárůst v EDSS, ve skupině pacientů interferony neléčených byly hodnoty EDSS nezměněny nebo došlo ke statisticky nevýznamnému zlepšení (graf 2). Retrospektivně lze zvažovat možnost pokročilejšího a těžšího průběhu roztroušené sklerózy u pacientů, kteří byli převedeni na Copaxone® z důvodů neúčinnosti nebo intolerance vedlejších nežádoucích účinků při léčbě interferony. Tato podskupina pacientů by pak tvořila pacienty s primárně těžším průběhem onemocnění. Copaxone® byl v původním klinickém hodnocení v roce 1995 spojen s omezením progrese a částečným zlepšením disability. Takováto stabilizace a zlepšení hodnocené EDSS škálou byly zaznamenány u 79,2 % pacientů po 24 měsících léčby a u 81,6 % po 35 měsících léčby. Stabilizace ve skupině našich pacientů primárně léčených Copaxone® těmto údajům odpovídá.
Dalším sledovaným parametrem byla únava ovlivňující kvalitu života a práceschopnost. Patogeneze únavy není jednoznačně objasněna, avšak vysoké hladiny prozánětlivých cytokinů byly spojeny s exacerbací únavy [7]. Lze předpokládat, že snížení únavy ve spojitosti s léčbou Copaxone® může být způsobeno právě nižší sekrecí a aktivitou prozánětlivých cytokinů v centrálním nervovém systému [12]. Zmenšení únavy vede rovněž ke snížení počtu dnů absence v zaměstnání a tento parametr rovněž koresponduje s nižším počtem relapsů, stabilizací či zlepšením disability [7,13]. V naší studii se především statisticky významně zvýšil počet pacientů, u kterých únava nezpůsobuje, že se cítí méně pohotoví, že jsou kvůli únavě stále izolováni ze společenského dění a že jim únava znemožňuje pracovat tak efektivně jako dříve. Další příznivě ovlivněné parametry zahrnovaly motivaci účastnit se společenských aktivit, snížení únavy, která byla dříve příčinou i fyzických obtíží, zlepšení schopnosti řešit emočně náročné situace, lepší soustředění a zkrácení nutné doby odpočinku. Souhrnně lze říci, že výsledky z dotazníků týkajících se kvality života a únavy, které spolu těsně souvisejí, prokázaly příznivé a statisticky signifikantní ovlivnění těchto parametrů léčbou Copaxone®.
Závěr
V multicentrické observační studii s Copaxone® jsme prokázali přetrvávající a dostatečnou účinnost projevující se v klinických parametrech redukcí počtu atak, stabilizací a zlepšením disability. Dále jsme prokázali snížení únavy a zlepšení parametrů kvality života.
Výše uvedené skutečnosti potvrzují příznivý poměr účinnosti a bezpečnosti preparátu a určují jeho postavení ve spektru v současnosti dostupných léčebných preparátu u roztroušené sklerózy mozkomíšní.
Projekt podpořen firmami Sanofi-Aventis s.r.o a Teva Pharmaceuticals CR, s.r.o.
doc.
MUDr. Pavel Štourač, Ph.D.
Neurologická
klinika LF
MU a FN Brno
Jihlavská
20
625
00 Brno
e-mail:
pstourac@fnbrno.cz
Přijato
k recenzi: 2. 6. 2011
Přijato
do tisku: 18. 7. 2011
Zdroje
1. Arnon R. The development of Cop 1 (Copaxone), an innovative drug for the treatment of multiple sclerosis: personal reflections. Immunol Lett 1996; 50(1–2): 1–15.
2. Schrempf W, Ziemssen T. Glatiramer acetate: mechanisms of action in multiple sclerosis. Autoimmun Rev 2007; 6(7): 469–475.
3. Blanchette F, Neuhaus O. Glatiramer acetate: evidence for a dual mechanism of action. J Neurol 2008; 255 (Suppl 1): 26–36.
4. Johnson KP, Brooks BR, Cohen JA, Ford CC, Goldstein J, Lisak RP et al. Copolymer 1 reduces relaps rate and improves disability in relapsing-remitting multiple sclerosis: results of a phase III multicenter, double-blind, placebo-controlled trial. Neurology 1995; 45(7): 1268–1276.
5. Comi G, Martinelli V, Rodegher M, Moiola L, Bajenaru O, Carra A et al. Effect of glatiramer acetate on conversion to clinically definite multiple sclerosis in patients with clinically isolated syndrome (PreCISe) study: a randomised, double-blind, placebo-controlled trial. Lancet 2009; 374(9700): 1503–1511.
6. Fisk JD, Pontefract A, Ritvo PG, Archibald CJ, Murray TJ. The impact of fatigue on patients with multiple sclerosis. Can J Neurol Sci 1994; 21(1): 9–14.
7. Ziemssen T, Hoffman J, Apel R, Kern S. Effects of glatiramer acetate on fatigue and days of absence from work in the first time treated relapsing-remitting multiple sclerosis. Health Qual Life Outcomes 2008; 6 : 67.
8. Berger JF, Houff S. Opportunistic infections and other risks with newer multiple sclerosis therapies. Ann Neurol 2009; 65(4): 367–377.
9. Mikol DD, Barkhof F, Chang P, Coyle PK, Jeffery DR, Schwid SR et al. Comparison of subcutaneuos interferon-beta 1b with glatiramer acetate in patients with relapsing multiple sclerosis (the Rebif vs Glatiramer acetate in Relapsing MS Disease (Regard study): a multicentre, randomised, parallel, open - label trial. Lancet Neurol 2008; 7(10): 903–914.
10. O’Connor P, Fillipi M, Arnason B, Comi G, Cook S, Goodin D et al. 250 microg or 500 microg interferon beta 1b versus 20 mg glatiramer acetate in relapsing - remitting multiple sclerosis: a prospective randomised, multicentre study. Lancet Neurol 2009; 8(10): 889–897.
11. Cadavid D, Wolansky LJ, Skurnick J, Lincoln J, Cheriyan J, Szczepanowski K et al. Efficacy of treatment of MS with IFNB-1b or glatiramer acetate by monthly brain MRI in the BECOME study. Neurol 2009 : 72(23): 1976–1983.
12. Ziemssen T, Kumpfel T, Klinkert WEF, Neuhas O, Hohlfeld R. Glatiramer acetate specific T-helper 1 and 2 type cell lines produce BDNF: Implications for multiple sclerosis therapy. Brain 2002; 125(11): 2381–2391.
13. Heesen C, Nawrath L, Reich C. Fatigue in multiple sclerosis: an example of cytokine mediated sickness behaviour? J Neurol Neurosurg Psychiatry 2006; 77(1): 34–39.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie
2011 Číslo 4
-
Všechny články tohoto čísla
- Porucha pozornosti s hyperaktivitou (attention deficit/hyperactivity disorder – ADHD)
- Neurální komponenty motivačních a rozhodovacích procesů v lidském mozku
- Histopatologická diagnostika mitochondriálních myopatií – indikace a přínos svalové biopsie
- Vztah genotypu apolipoproteinu E ke klinickému průběhu a následkům poranění mozku u dětí a mladistvých
- Výskyt mutácií v géne Leucine rich repeat kinase 2 u pacientov s Parkinsonovou chorobou na Slovensku
- Glatiramer acetát (Copaxone®) v léčbě atakovité formy roztroušené sklerózy mozkomíšní – klinická účinnost a bezpečnostní profil
- Opožděný akutní subdurální hematom
- Víčkové implantáty v terapii lagoftalmu
- Kognitivní účinky dlouhodobé léčby subkutánními apomorfinovými infuzemi u pacientů s pokročilou Parkinsonovou nemocí
- Vrozená myotonie na podkladě mutací v genu pro chloridový kanál ClC-1
- Opakovaná intradetruzorová aplikace botulinumtoxinu A u dětí s hyperaktivitou detruzoru
- Radikulopatia spôsobená lumbálnymi epidurálnymi varixami – kazuistika
- Dehiscence stěny kanálu a výhřez lícního nervu – kazuistiky
- Spinální komplikace u genetických syndromů – kazuistiky
- Neurologické komplikace při onemocnění herpes zoster – kazuistika
- K životnímu jubileu primářky MUDr. Evy Urbánkové
- Webové okénko
-
Analýza dat v neurologii
XXVIII. Hodnocení diagnostických testů – křivky ROC - Aktuální informace o postgraduálním vzdělávání
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Porucha pozornosti s hyperaktivitou (attention deficit/hyperactivity disorder – ADHD)
- Opožděný akutní subdurální hematom
- Neurologické komplikace při onemocnění herpes zoster – kazuistika
- Vrozená myotonie na podkladě mutací v genu pro chloridový kanál ClC-1
