Chirurgická léčba hydrocefalu
Surgical Treatment of Hydrocephalus
Hydrocephalus is a disease developing as a result of failure in production, circulation or resorption of the cerebrospinal fluid. It develops due to congenital or acquired causes, including bleeding, inflammation, injury or tumour. Clinical symptoms depend on age, type and speed of development of hydrocephalus. Computed tomography, magnetic resonance and ultrasound in children with open anterior fontanel are used to diagnose hydrocephalus. Surgical therapy is a gold standard for the treatment of hydrocephalus. Shunt surgeries are performed more frequently than other types of surgical interventions. Ventriculoperitoneal shunts are preferred due to less serious complications that are easy to repair. Ventriculoatrial shunts are implanted when it is not possible to drain cerebrospinal fluid into the abdominal cavity. The need for multiple surgical revisions makes shunt surgery difficult. Endoscopic operations have a low complication rate and do not require implantation of a foreign material. However, endoscopic operations are not suitable in all types of hydrocephalus. They are mainly indicated in obstructive hydrocephalus, although they can also be used in some types of communicating hydrocephalus. In these instances, however, success rate is lower.
Key words:
hydrocephalus – shunt – ventriculoperitoneal shunt – ventriculoatrial shunt – lumboperitoneal shunt – endoscopy – endoscopic third ventriculostomy
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
Dr. Mu Václav Vybíhal, Ph.D.
Působiště autorů:
LF MU a FN Brno
; Neurochirurgická klinika
Vyšlo v časopise:
Cesk Slov Neurol N 2014; 77/110(1): 7-22
Kategorie:
Minimonografie
Souhrn
Hydrocefalus je onemocnění vzniklé na podkladě poruchy tvorby, cirkulace nebo resorpce mozkomíšního moku. Vzniká z příčin vrozených či získaných, ke kterým patří krvácení, zánět, trauma nebo nádor. Klinické projevy závisí na věku, typu a rychlosti vzniku hydrocefalu. Ze zobrazovacích metod se v diagnostice hydrocefalu používá výpočetní tomografie, magnetická rezonance a ultrazvuk u dětí s neuzavřenou velkou fontanelou. Zlatý standard v terapii hydrocefalu je chirurgická léčba. Nejčastěji prováděný výkon je zkratová operace. Preferují se ventrikuloperitoneální shunty vzhledem k méně závažným komplikacím, které jsou technicky dobře řešitelné. Pokud není možné derivovat mozkomíšní mok do břišní dutiny, implantují se ventrikuloatriální shunty. Zkratové operace jsou však zatíženy vysokým procentem nutných operačních revizí. Endoskopické operace mají malé procento komplikací a nejsou spojeny s implantací cizorodého materiálu. Nelze je ale použít u všech typů hydrocefalu. Indikují se především u obstrukčního hydrocefalu, ale i u některých druhů komunikujícího hydrocefalu. Zde bývá ale úspěšnost nižší.
Klíčová slova:
hydrocefalus – shunt – ventrikuloperitoneální shunt – ventrikuloatriální shunt – lumboperitoneální shunt – endoskopie – endoskopická ventrikulostomie třetí komory
Úvod
První zmínka o hydrocefalu a pokusu jej léčit pochází od Hippokrata (5. stol. př. n. l.)[1]. Po dlouhou dobu pak nedošlo ke změně v poznávání a chápání hydrocefalu [2]. První nové anatomické poznatky se začínají objevovat od 16. století. Další výrazný rozvoj na poli anatomie a fyziologie nastává v 19. století (François Magendie, Hubert von Luschka), kdy je také uvedena do praxe ventrikulární punkce (Carl Wernicke, 1881) a lumbální punkce (Heinrich Irenaeus Quincke, 1891). Ve 20. století dochází k několika zásadním změnám. V roce 1910 provedl Victor de l’Espinasseprvní endoskopickou operaci v mozkových komorách. Walter Edward Dandy a Kenneth D. Blackfan zhotovili v roce 1914 experimentální model hydrocefalu, na jehož základě bylo Dandym do klinické praxe zařazeno odstranění chorioideálního plexu v léčbě hydrocefalu a také ventrikulostomie třetí komory [3]. Endoskopicky ji poprvé provedl William Jason Mixter v roce 1923.
Moderní léčba hydrocefalu má počátky v roce 1952, kdy Frank Nulsen a Eugen Spitz ve spolupráci s Johnem Holterem uvedli do klinické praxe shunt regulovaný ventilem. Přibližně ve stejné době vyvinul Pudenz ventil ze silikonu jako biokompatibilního materiálu. V 70. letech 20. století se objevují první programovatelné ventily. V 90. letech pak dochází k rozvoji neuroendoskopie v souvislosti s pokrokem v optické technologii [4].
Současný technologický rozvoj umožňuje nejen vývoj dokonalejších ventilů, ale také komfortnější endoskopickou techniku – možnost full HD zobrazení aj. Moderní zobrazovací metody, především magnetická rezonance (MR), zpřesnily diagnostiku a indikace k jednotlivým výkonům. I přesto existuje dodnes řada nejasností týkajících se hydrocefalu a jeho terapie.
Definice a klasifikace hydrocefalu
Hydrocefalus (z řeckého hydro = voda, kefale = hlava) je definován jako abnormální hromadění mozkomíšního moku (CSF) v intrakraniálním prostoru, nejčastěji v mozkových komorách, vzniklé v důsledku poruchy jeho tvorby, cirkulace nebo vstřebávání.
Walter E. Dandy rozdělil hydrocefalus na komunikující a obstrukční (nekomunikující) [5]. Jako obstrukční hydrocefalus je označován hydrocefalus, jehož příčinou je překážka toku CSF v komorovém systému. Pokud jsou mozkové komory volně průchodné, je hydrocefalus označován jako komunikující. Podle rychlosti jeho vzniku jej lze rozdělit na akutní a chronický nebo podle věku na dětský a dospělý. Při poruše vstřebávání CSF hydrocefalus označujeme jako hyporesorpční a při jeho nadměrné tvorbě jako hyper-sekreční (vzácný). Etiologicky jej lze rozdělit na kongenitální nebo získaný – vzniklý v souvislosti s traumatem, nádorem, krvácením anebo infekcí. Komplexní hydrocefalus se vyznačuje přítomností jak obstrukční, tak i hyporesorpční složky.
S přibývajícími poznatky o hydrocefalu se někteří autoři pokusili vytvořit přesnější klasifikační schémata. Ale doposud neexistuje klasifikace, která by shrnovala současné poznatky o hydrocefalu a byla všeobecně akceptována. V poslední době se této problematice věnoval Oi, který vytvořil multikategoriální klasifikaci hydrocefalu (Multi‑categorical Hydrocefalus Classification). V ní je celkem 54 subtypů hydrocefalu rozděleno do 10 kategorií, z nichž každá obsahuje dva až sedm subtypů [6].
Příčiny a mechanizmy vzniku hydrocefalu se mohou zcela lišit ve fetálním či postnatálním období, v dětství nebo v dospělosti. Proto autor vytvořil klasifikaci kongenitálního hydrocefalu (Perspective Classification of Congenital Hydrocephalus), která je v závislosti na etapě, typu a klinické kategorii kongenitálního hydrocefalu rozdělena do pěti skupin (tab. 1) [7 – 9]. Na základě předpokladu změn v intrakraniální dynamice u hydrocefalu v průběhu času Oi vytvořil HCA klasifikaci (Hydrocephalus Chronology in Adults) pro hydrocefalus dospělých pacientů, která má také pět stupňů [10]. Klasifikuje stadia vedoucí od akutního až k chronickému hydrocefalu a období po implantaci shuntu, kdy změněné intrakraniální poměry po zkratové operaci mohou zapříčinit morfologické změny, jež vedou k izolaci jednotlivých kompartmentů [11 – 14].
![Klasifikace kongenitálního hydrocefalu (Perspective Classification of Congenital Hydrocephalus) do pěti skupin v závislosti na etapě, typu a klinické kategorii kongenitálního hydrocefalu [6].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/c99169389e7ecdc0a307a2676909c5c9.png)
Konsenzus týkající se klasifikace hydrocefalu vznikl na základě aktivity ISHCR (International Society for Hydrocephalus and CSF Research). Vytvořila se pracovní skupina (Members of the Hydrocephalus Classification Study Group) složená z předních světových odborníků na hydrocefalus a jeho klasifikaci [15]. První část klasifikace je založena na místu, kde dochází k restrikci proudění CSF – foramen Monroi, Sylviův mokovod, bazální cisterny, arachnoidální granulace a odtok venózní krve z durálních venózních sinů. Za pravý komunikující hydrocefalus je pak považován hydrocefalus, kde není žádné místo obstrukce nebo zvýšený odpor toku CSF. Tato primární klasifikace je poté modifikována etiologií a rychlostí jeho vzniku a věkem osoby. Doporučena je i pro použití při animálních experimentech.
Uvedené nové klasifikace sice vycházejí ze současných poznatků o hydrocefalu, ale přesto je klasifikace hydrocefalu na obstrukční a komunikující pro svoji jednoduchost a srozumitelnost dosud nejvíce používanou klasifikací v řadě prací.
Existují i specifické typy hydrocefalu, které se určitým způsobem liší od ostatních druhů. Takový příklad je třeba normotenzní hydrocefalus. Představuje specifickou formu komunikujícího hydrocefalu, kdy je dilatace komorového systému doprovázena různě vyjádřenou klinickou triádou sestávající z poruchy chůze, demence a poruchy sfinkterových funkcí při normálním tlaku CSF při lumbální punkci vleže (60 – 240 mm vodního sloupce, resp. 4,4 – 17,7 mmHg) [16].
Etiologie a klinické příznaky
Hydrocefalus lze z etiologického hlediska vymezit jako vrozený nebo získaný. Nejčastější příčinou vrozeného hydrocefalu je stenóza Sylviova mokovodu, která je většinou nahodilá, ale může být také následkem intrauterinní infekce [17]. Hydrocefalus provází rovněž některé malformace centrální nervové soustavy (Dandy ‑ Walkerova malformace, Chiariho malformace aj.) a existuje i forma hereditární (Bicker ‑ Adamsův syndrom). Jako získaný je hydrocefalus nejčastěji následkem krvácení, traumatu, infekce nebo nádorového onemocnění. Pokud nelze zcela jasnou příčinu zjistit, pak bývá hydrocefalus označován jako idiopatický (primární).
Klinický obraz hydrocefalu závisí na věku pacienta, rychlosti jeho vzniku, příčině a lokalizaci případné obstrukce. Symptomy navíc vykazují interindividuální variabilitu.
U dětí, které nemají srostlé švy (většinou v období prvních dvou let života), se hydrocefalus projevuje progresivním růstem obvodu hlavy, nechutenstvím, iritabilitou. Kůže skalpu je ztenčená a má zvýrazněnou žilní kresbu. Velká fontanela je napjatá, objevuje se diastáza švů, paréza šestého hlavového nervu, zvracení, dítě špatně prospívá. Při další progresi se lze setkat s tzv. příznakem zapadajícího slunce (deviace bulbů kaudálně), poruchami vědomí, bradykardiemi a poruchami dechového rytmu.
U starších dětí s nepoddajným kraniem jsou příznaky stejné jako u dospělých. Akutní hydrocefalus se projeví syndromem nitrolební hypertenze. U chronického hydrocefalu jsou příznaky plíživé, bývají bolesti hlavy, hlavně ráno, dochází ke zpomalení psychomotorického tempa, vyskytuje se nauzea, zvracení, změna chování, spavost. U starších dospělých pacientů se chronický hydrocefalus často projevuje poruchou chůze, demencí a inkontinencí.
Diagnostika
Pro primární skríning, a to nejen u akutních případů, je základní zobrazovací metoda výpočetní tomografie (CT). K získání detailních informací a stanovení optimální léčebné metody (především u chronického hydrocefalu) slouží MR. Jedná se o suverénní metodu v rozlišení obstrukčního hydrocefalu a umožňuje místo obstrukce přesně identifikovat. Přínosná je také v diferenciální diagnostice, zejména u normotenzního hydrocefalu. V T2 vážených sekvencích se můžeme setkat s tzv. flow void fenoménem, tj. s artefakty způsobenými tokem CSF (jejich přítomnost potvrzuje proudění CSF danou oblastí a naopak). Standardně prováděné sekvence se dají doplnit o metodu fázového kontrastu (cine ‑ MR, phase ‑ contrast MR), která umožňuje detekovat pohyb CSF a kvantifikovat jej. Nejčastěji je využívána ke stanovení průtoku CSF Sylviovým mokovodem s normou 13,3 ml × min–1 v sys-tole a – 10,6 ml × min–1 v diastole [18]. Norma tepového objemu činí 42 µl [19]. Metodu lze využít také ke stanovení patence endoskopicky vytvořené stomie s údaji o objemu a rychlosti toku přes stomii (obr. 1). Kromě těchto technik se využívají i další MR metody včetně zobrazení tenzorů difuze, nejčastěji u normotenzního hydrocefalu.
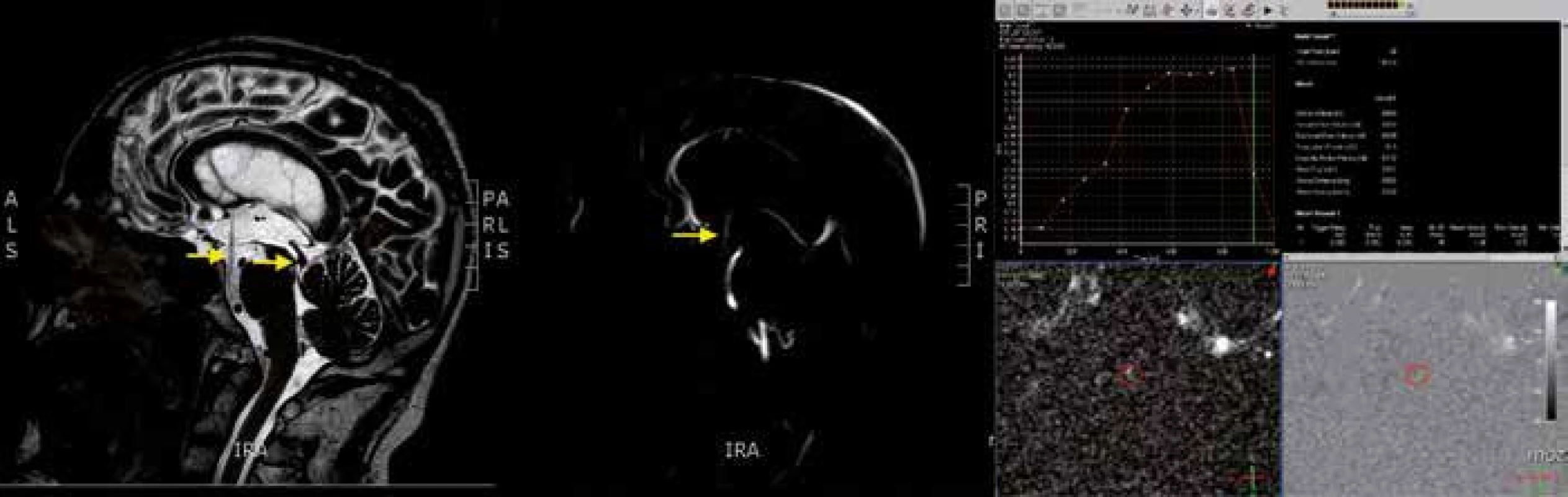
V prenatální diagnostice a rovněž u dětí s otevřenou velkou fontanelou se využívá ultrazvukové vyšetření. Zobrazovací metody určí rozsah ventrikulomegalie a umožňují stanovit ventrikulární indexy, z nichž nejpoužívanější je Evansův index. Vypočítává se jako poměr největšího rozměru frontálních rohů postranních komor a nejširšího rozměru vnitřní části lebky v jejich úrovni [20]. Za normu se považuje Evansův index 0,3 a méně.
K zobrazení průběhu zkratového systému slouží rentgenový snímek, využívaný především při podezření na malfunkci shuntu. Specifické vyšetření je shuntogram (obr. 2). Jeho princip je aplikace malého množství kontrastní látky do ventilu. Za normálních okolností by měla volně procházet systémem bez průsaku do okolí. Abnormální shuntogram tak může odhalit obstrukci ventrikulárního (VK), peritoneálního (PK) nebo atriálního (AK) katétru, netěsnost systému či malfunkci ventilu [21].
![Shuntogram, na kterém je vidět systém naplněný kontrastní látkou u VPS [21].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/d2ba7222be32af29bc89a15721b74b3f.jpg)
Kromě zobrazovacích metod lze v diagnostice hydrocefalu využít likvorodynamické testování. Nejčastěji se využívá při testování pacientů s normotenzním hydrocefalem, ale lze jej použít i u jiných typů komunikujícího hydrocefalu. Příkladem je odlišení posttraumatického hydrocefalu od mozkové atrofie u posttraumatické ventrikulomegalie [22]. Mezi nejvíce rozšířené testy patří tap test, lumbální infuzní test a zevní lumbální drenáž. Někteří autoři považují zmíněné testy v případě normotenzního hydrocefalu spíše za prognostické než diagnostické [23].
Principem tzv. tap testu je jednorázové odpouštění 40 – 50 ml CSF během lumbální punkce [23]. U pacienta, jehož stav se po lumbální punkci zlepší, lze předpokládat poruchu likvorodynamiky a následný benefit ze zkratové operace. Na některých pracovištích je prováděno opakované odpouštění CSF pomocí lumbálních punkcí.
Testování pomocí zevní lumbální drenáže zavedli do klinické praxe Haan a Thomeer [24]. Princip této metody je kontinuální odpouštění CSF rychlostí 10 ml za hod po dobu 3 – 5 dní. Na naší klinice se nám osvědčilo odpouštění cca 150 ml CSF za 24 hod frakcionovaně, protože pacienti větší množství derivovaného CSF špatně tolerovali. Požadováno je minimálně odvést 300 ml CSF. Pokud se stav pacienta nezlepší po zevní lumbální drenáži, je málo pravděpodobné, že má porušenou likvorodynamiku a že bude profitovat ze zkratové operace a naopak.
Lumbální infuzní test spočívá v aplikaci Ringerova, event. fyziologického roztoku cestou lumbální punkce konstantní rychlostí. Princip testu je měření tlakových změn po aplikaci roztoku a stanovení tzv. výtokového odporu, který se vypočítá podle vzorce:
kde Rout je výtokový odpor v mmHg × ml – 1 × min–1, Pmax je maximální naměřená hodnota tlaku, P0 je vstupní hodnota tlaku, IR je rychlost infuze (většinou 1,5 ml × min–1) a Rsyst je výtokový odpor systému (při puštěné infuzi a umístění jehly do výše místa vpichu změříme hodnotu tlaku, který ukazuje odpor celého systému s proudící kapalinou).
Čím je větší elevace tlaku, tím více je porušena likvorodynamika a resorpční schopnost a naopak. Za negativní výsledek testu se považuje hodnota výtokového odporu 12 mmHg × ml – 1 × min – 1 a méně [25]. Nutno také počítat s tím, že s přibývajícím věkem se hodnota výtokového odporu lehce zvyšuje [26]. Test se provádí ve dvou hlavních modifikacích. Při bolusové technice je rychle aplikováno menší množství roztoku, většinou 4 až 10 ml, a měří se tlakové poměry [27]. Druhá možnost je dosažení tzv. steady ‑ state, tedy dosažení plateau, kdy již maximálně dosažená hodnota tlaku zůstává konstantní či jemně osciluje [28]. Tato modifikace je přesnější než bolusová technika.
Terapie hydrocefalu
Zcela dominantní postavení v léčbě hydrocefalu má chirurgická terapie. Konzervativní léčba hydrocefalu byla nejvíce používána u dětí, zejména v raném dětství. Její úspěch byl variabilní a často sloužila pouze jako dočasná terapie před implantací shuntu. Farmakologická léčba byla zaměřena na snížení produkce a zvýšení resorpce CSF. Ke snížení produkce CSF se nejčastěji používal acetazolamid a furosemid. V randomizované studii u novorozenců s posthemoragickým hydrocefalem byla tato studie předčasně ukončena pro vyšší výskyt neurologických následků a zvýšenou frekvenci implantovaných shuntů [29]. Důvodem byly podle autorů nežádoucí účinky podávané medikace. Představitelem látek používaných ke zvýšení absorpce CSF byla hyaluronidáza, ale její efekt byl rovněž sporný [30]. Z léků vedoucích ke snížení intrakraniálního tlaku je nutno uvést manitol, ureu a glycerol, ale jejich použití je časově omezené.
V chirurgické terapii hydrocefalu se používají tři druhy výkonů:
- endoskopické operace,
- zkratové operace,
- otevřené mikrochirurgické operace.
Endoskopické operace jsou indikovány hlavně u obstrukčního hydrocefalu. Podle literárních pramenů je lze použít také u některých typů komunikujícího hydrocefalu a v případě opakovaných komplikací zkratového výkonu. Endoskopické ošetření je preferováno pro dobrou úspěšnost, nízké procento komplikací a není zde nutná implantace cizorodého materiálu. Endoskopické operace můžeme rozdělit na výkony restaurující přirozený tok CSF (např. akveduktoplastika), vytvoření bypassu pro alternativní cestu proudění CSF (endoskopická ventrikulostomie třetí komory, ETV) a operace omezující sekreci CSF (výkony na chorioidálním plexu).
Zkratové operace mají univerzální použití, ale znamenají dlouhodobou až celoživotní závislost na implantátu a představují vysoké riziko operační revize v dlouhodobém horizontu z důvodu malfunkce.
Otevřené mikrochirurgické operace mají význam především v odstranění nádorové či nenádorové léze způsobující obstrukční hydrocefalus. Výjimečně jsou v současnosti využívány k ošetření vlastního hydrocefalu, např. k fenestraci lamina terminalis.
Omezeně se dnes v trvalé terapii hydrocefalu používá ještě tzv. Torkildsenova drenáž (ventrikulocisternální). Její princip je zavedení drénu z okcipitálního přístupu do postranní komory a jeho vyústění v oblasti cisterna magna nebo subarachnoidálních prostor horní krční páteře. Indikuje se u obstrukčního hydrocefalu, který nelze ošetřit endoskopicky, např. u rozsáhlejších tumorů v oblasti třetí mozkové komory [31]. Stejně tak endoskopie nahradila tzv. Bretovu drenáž (interventrikulostomii), kdy byl zaveden pod radiologickou kontrolou katétr ze třetí komory přes Sylviův mokovod do čtvrté komory [32].
Zmíněné výkony jsou určeny k trvalému řešení hydrocefalu. Používají se především u chronického hydrocefalu, ale také někdy u akutního hydrocefalu. Akutní hydrocefalus může přejít v chronický, nebo po odstranění příčiny, která jej způsobila, pak vymizí. V jeho terapii se nejčastěji používají dočasné drenážní systémy:
- zevní komorová drenáž,
- zevní lumbální drenáž,
- implantace rezervoáru (Ommaya).
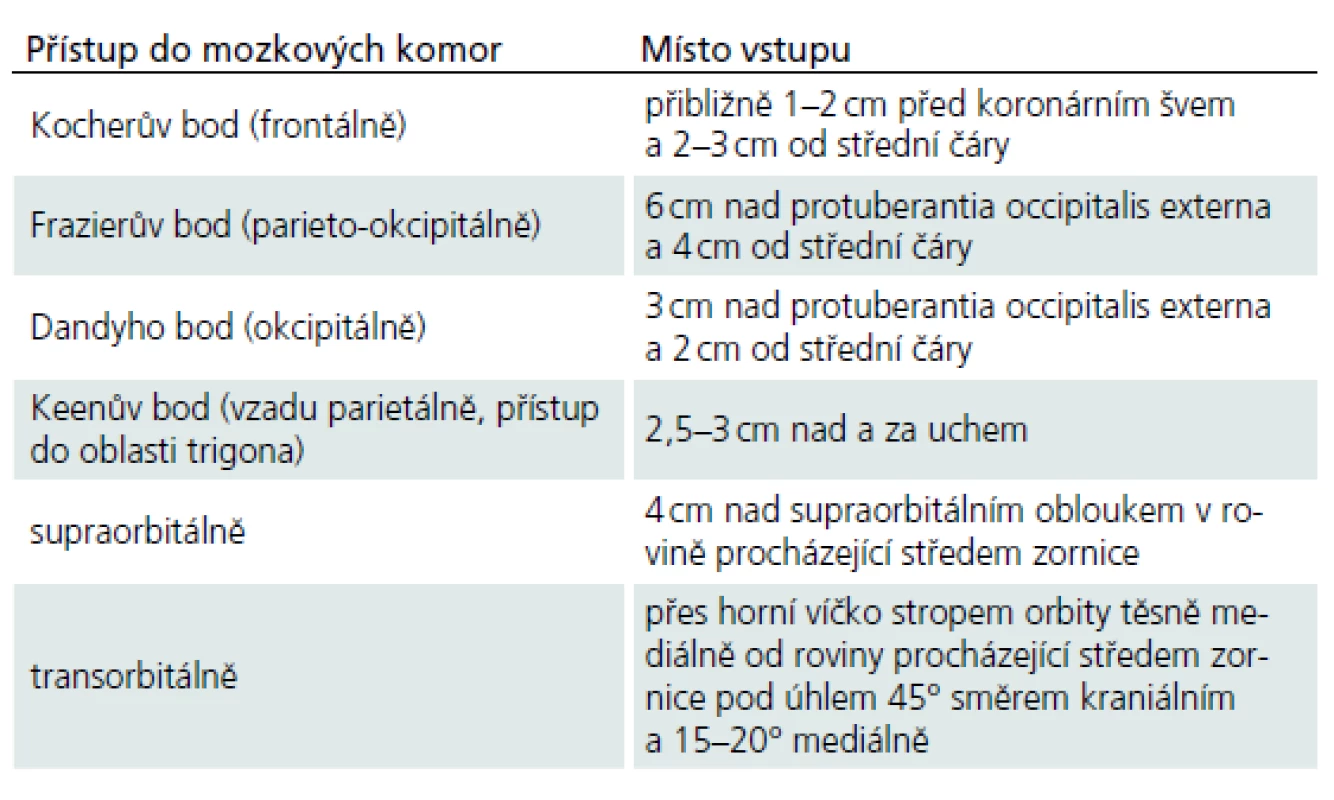
Zevní komorová drenáž je univerzální a lze ji použít jak u obstrukčního, tak v případě komunikujícího hydrocefalu. Přístup do komor je možný z několika bodů (tab. 2) [33]. Nejčastěji se používá přístup frontální, popřípadě parietookcipitální. Transorbitální přístup se volí velmi vzácně v urgentních případech.
Zevní lumbální drenáž je indikována pouze u komunikujícího hydrocefalu. Nejčastěji se v současné době používá u akutního hydrocefalu vzniklého při subarachnoidálním krvácení [34]. Alternativní metoda k zevní lumbální drenáži je provedení opakovaných lumbálních punkcí.
Implantace rezervoáru se využívá především u hydrocefalu vzniklém při krvácení nezralých novorozenců [35,36]. Umožňuje opakované perkutánní punkce s derivací CSF, než bude dítěti po dosažení požadované hmotnosti nebo po sanaci patologické příměsi v CSF implantován shunt. Alternativně se ještě v literatuře uvádí ventrikulosubgaleální shunt, kdy je CSF derivován z komor do vytvořeného subgaleálního prostoru [37].
Za určitých okolností je v terapii hydrocefalu nutno kombinovat jednotlivé metody, zejména endoskopii a implantaci shuntu. Endoskopie slouží ke zjednodušení anatomické situace – zrušení obstrukce nebo rozrušení intraventrikulárních sept (např. u multilokulárního hydrocefalu), přičemž následně je implantován shunt, většinou z důvodu hyporesorpce.
Je třeba se zmínit o tom, že odlišnosti má také léčba dětského hydrocefalu ve srovnání s terapií hydrocefalu vyskytujícího se v dospělosti, což je dáno několika faktory, a to příčinou vzniku hydrocefalu, nezralostí mozku včetně počínající myelinizace, růstem dítěte a fragilitou měkkých tkání [17].
Endoskopické operace
Endoskopické operace v komorovém systému mozku se provádějí s použitím endoskopu, který se skládá z vlastní optiky, zdroje světla (využívá se především xenonový zdroj vzhledem k jeho barevné teplotě světla), kamery přenášející obraz na monitor, pracovního kanálu (slouží k zavedení instrumentů, jako jsou nůžky, balónové katétry, klíšťky, bipolární a monopolární koagulace, graspery aj.) a irigačního kanálu, který umožňuje kontinuální proplach během výkonu (obr. 3). Použití rigidního endoskopu má výhodu ve vynikající optické kvalitě, extrémně širokoúhlém pohledu a snadné orientaci [38]. Vyrábí se ve čtyřech provedeních s různými úhly pohledu – 0, 30, 70 a 120 stupňů a také o různých průměrech. Výhodou flexibilního endoskopu je jeho schopnost měnit úhel pohledu. Optický systém je však již méně kvalitní a jeho ovládání je technicky daleko náročnější. V poslední době je také k dispozici velmi tenký endoskop, tzv. shuntoskop, který lze zavést do VK, a zjistit tak jeho pozici uvnitř komorového systému.

Nezbytná při endoskopických výkonech je řádná předoperační rozvaha, tj. jaký výkon budeme provádět, zda budeme potřebovat navigaci, naplánování trajektorie a místa vstupu aj. Navigaci se doporučuje používat při malých komorách nebo při atypických anatomických poměrech [38]. Její použití není nezbytné při dilatovaném komorovém systému a normální anatomii, např. při provádění ETV. Záleží rovněž na zkušenostech operatéra, frekvenci a druhu prováděné operace. Je třeba zdůraznit, že navigace, ať již bezrámová nebo stereotaktická, zvyšuje bezpečnost endoskopických výkonů [39]. Operace lze rovněž provádět tzv. z volné ruky, kdy většinou asistent pomáhá s fixací endoskopu, nebo lze využít různé fixační aparáty. Preferuje se přístup přes nedominantní hemisféru, v případě asymetrie komorového systému přes širší komoru. Výkony se provádějí v celkové anestezii s fixací hlavy.
Nejčastěji prováděná operace je ETV, s níž jsou také největší zkušenosti. Pokud existuje možnost vyřešit hydrocefalus tímto způsobem, měla by být preferována před ostatními endoskopickými procedurami a implantací shuntu. Posouzení pak závisí na každém operatérovi a jeho zkušenostech. Relativně častý a technicky dobře proveditelný endoskopický výkon používaný v terapii hydrocefalu je také septostomie. Z dalších operací je třeba připomenout ještě plastiku akveduktu s případným zavedením stentu, fenestraci lamina terminalis, foraminoplastiku (foramen Monroi nebo Magendie) nebo temporální ventrikulostomii.
Ventrikulostomie třetí komory
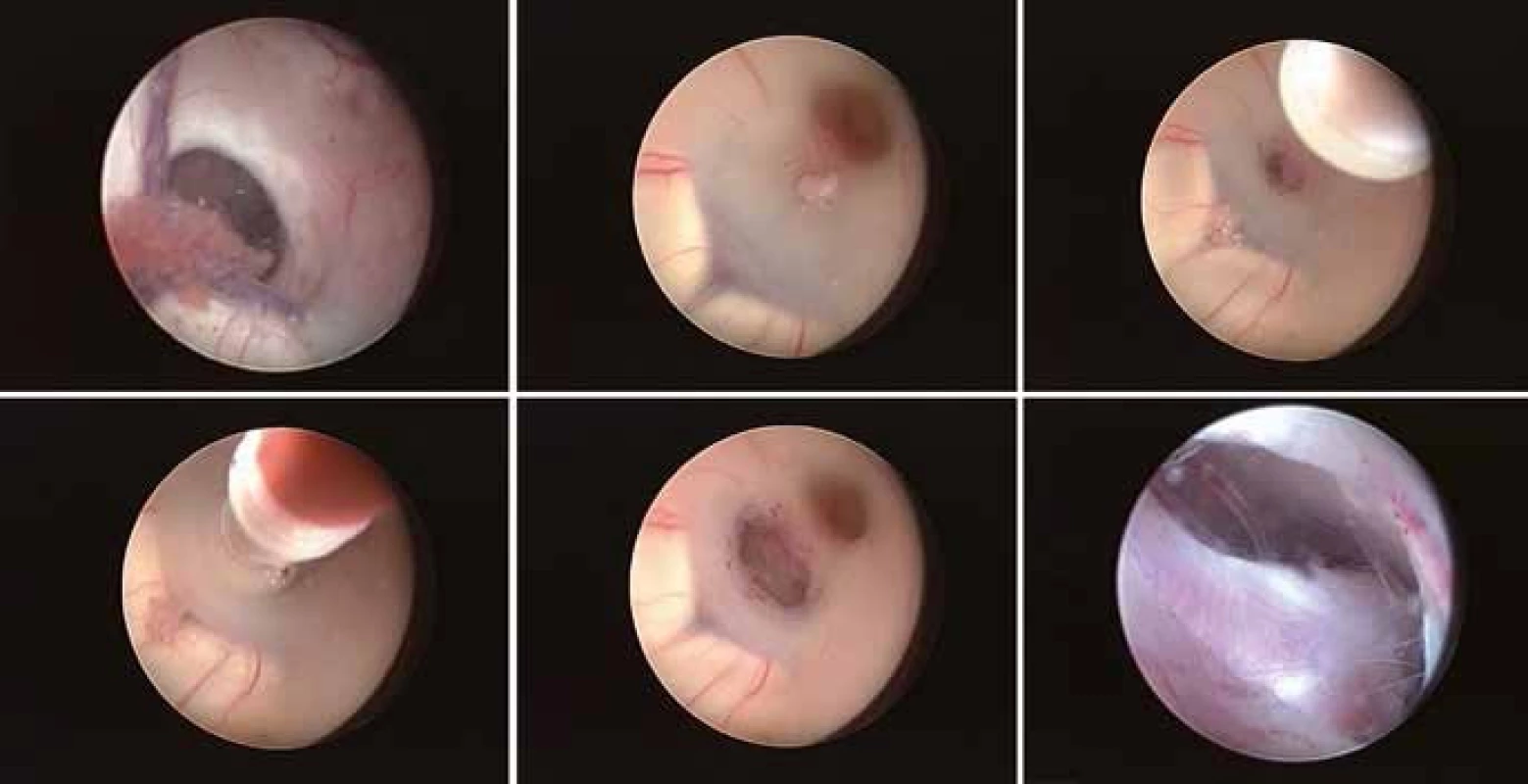
Jedná se o nejčastěji prováděný endoskopický výkon v léčbě hydrocefalu. Indikována je při jakékoli obstrukci distálně od spodiny třetí komory. Před jejím provedením je třeba znát vztah a. basilaris ke spodině třetí komory. Vstup bývá nejčastěji 2 až 3 cm paramediálně prekoronárně. Ideální místo fenestrace je vybráno podle individuální anatomie spodiny třetí mozkové komory. Většinou se perforace provádí uprostřed mezi infundibulárním recessem a corpora mammilaria ve střední čáře těsně za klivem [40]. Spodina může být perforována rigidním instrumentem, jako je bipolární koagulace bez použití koagulačního proudu, zavřenými bioptickými kleštěmi, samotným balónkovým katétrem aj. [38]. Ten se ale nedoporučuje u tuhé spodiny, kdy může sklouznout, udělat perforaci mimo plánovanou oblast a způsobit neurovaskulární poranění. V těchto případech se doporučuje provést iniciální perforaci pomocí bipolární koagulace s nízkou energií, aby se omezil tlak na spodinu a přilehlý hypothalamus. Stomie je pak dilatována Fogartyho balónkovým katétrem do velikosti od 3 do 6 mm. Balónek by měl být naplněn vodou, abychom měli kontinuální inflaci a zamezili jeho vyklouznutí. Možné je použít i speciální katétry se dvěma balónky. Doporučuje se také prohlédnout přes ventrikulostomii interpedunkulární a pontinní cisternu a fenestrovat případnou Liliequistovu membránu (obr. 4).
Úspěšnost léčby se udává větší než 75 % (v rozmezí od 50 do 94 %) v závislosti na typu hydrocefalu při pečlivé selekci pacientů k operaci s nejlepšími výsledky v případech stenózy mokovodu [41 – 43]. Vzhledem k velké variabilitě úspěšností ETV bylo na základě analýzy 15 studií včetně jedné studie z České republiky [44] autory vytvořeno skóre úspěšnosti ETV (ETV success score) od 0 do 90 %. Predikce vychází z údajů o věku, etiologii a případné předchozí zkratové operace (tab. 3) [45].
![Výpočet ETVSS (Endoscopic Third Ventriculostomy Success Score) na základě věku pacienta, etiologie hydrocefalu a případné implantace shuntu predikující úspěšnost ETV v rozsahu od nuly do 90 % v horizontu šesti měsíců [45].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/e06b81c2da2f7d812979694843e8482b.png)
Kromě obstrukčního hydrocefalu se v poslední době rozšiřuje indikace také o některé typy komunikujícího hydrocefalu – infekční nebo hemoragické etiologie (především po intraventrikulárním krvácení), ale s nižší úspěšností [46]. I když existují studie indikující ETV u normotenzního hydrocefalu [47], převážná většina prací preferuje zkratové operace včetně autorů, kteří srovnávali ETV s implantací shuntu [48,49].
V případě, že dojde k uzavření stomie (neadekvátní operační technika, malá velikost stomatu, jizvení, perzistující Liliequistova membrána aj.), doporučuje se zvážit opětovné provedení ETV, jejíž úspěšnost je srovnatelná s primárním provedením [44,50,51].
ETV patří mezi výkony s nízkým procentem komplikací. Přehledně je v poslední době zpracovali autoři Bouras a Sgouros [52]. Ve své práci sumarizují výsledky 34 publikovaných studií z let 1999 až 2010 týkající se celkového počtu 2 884 pacientů, u kterých bylo provedeno celkem 2 985 stomií. Zastoupeny byly všechny věkové kategorie s průměrným věkem 21,8 let (rozsah od jednoho dne do 88 let). Nebyly zde prokázány žádné statisticky významné rozdíly mezi dětskými a dospělými pacienty, ani mezi soubory s většími a menšími skupinami pacientů, i když v případě menších souborů byl výskyt komplikací lehce vyšší. Na druhé straně se ale můžeme setkat s názory, že existují rozdíly jak mezi jednotlivými pracovišti, tak i mezi jednotlivými neurochirurgy [53,54]. Celková frekvence komplikací byla 8,5 % (většina studií se pohybovala v rozmezí 5 až 15 %, s minimem 0 % a maximem 31,2 %) s trvalou morbiditou u 2,4 % pacientů a celkovou mortalitou 0,28 %. Náhlá úmrtí s delším časovým odstupem se vyskytovala s frekvencí 0,07 %. Výraznější rozdíly v počtu komplikací autoři přičítají rozdílným kritériím jednotlivých studií, co za komplikace bylo považováno a co nikoliv. Významné intraoperační krvácení bylo zaznamenáno v 3,7 %, kdy v 0,6 % bylo těžké a v 0,21 % bylo způsobeno bazilární rupturou. Pooperační hemoragie se vyskytovaly u 0,81 % nemocných. Podle některých autorů mohou být následkem nerozpoznaného nebo neadekvátně ošetřeného peroperačního krvácení [54 – 57]. Peroperační poranění nervových struktur nastalo u 0,24 % nemocných, kdy se u 0,12 % jednalo o poranění thalamu, a stejnou měrou se podílela poranění fornixu, hypothalamu a mezencefala (každé v 0,04 %). Podle autorů může být ale relativní zastoupení peroperačně vzniklých lézí vyšší o nerozpoznaná poranění během operace. Ve všech případech došlo k poranění buď při příliš prudkém nebo neočekávaném zavedení endoskopu do postranních komor anebo během průchodu přes foramen Monroi. Ve 4,2 % bylo upuštěno od provedení ETV z důvodu peroperačního krvácení, nejasných anatomických poměrů, anesteziologických příčin či pro příměs v CSF, která nedovolovala adekvátní vizualizaci. Prosakování CSF bylo v 1,61 % případů a infekce se vyskytovala s frekvencí 1,81 % s převahou meningitid (1,6 %). Na celkové morbiditě (2,4 %) se neurologická morbidita podílela 1,44 % (poruchy okohybných nervů, porucha vědomí, hemiparéza a poruchy paměti) a hormonální 0,94 % (diabetes insipidus, příbytek na váze a pubertas praecox). Epileptické paroxyzmy byly zjištěny u 0,21 % pacientů.
Fenestrace septum pellucidum (septostomie)
Indikace k provedení fenestrace septi pellucidi (septostomii) je obstrukce foramen interventriculare (Monroi), která vede k dilataci ipsilaterální postranní komory a vzniku unilaterálního hydrocefalu (v případě jednostranné obstrukce) [38]. Prací, které se zabývají pouze provedením septostomie, není v literatuře příliš mnoho, a větší soubory pacientů jsou prezentovány pouze několika autory [58 – 61]. I přesto se v literatuře diskutuje o přístupu přes frontální nebo okcipitální roh postranní komory, zda přistupovat přes více nebo méně dilatovanou část postranních komor a o přesném místě vstupu [61], které je v literatuře nejčastěji udáváno v rozmezí od 3 do 7 cm od střední čáry. Důvod je získat co nejlepší pracovní úhel k provedení výkonu. Schroeder et al doporučují vstupní bod 5 až 6 cm od střední čáry těsně před koronární suturou na straně dilatované postranní komory [38]. Využívají neuronavigaci k naplánování optimálního vstupního bodu a po prohlédnutí septa volí vhodné místo k vytvoření stomie v závislosti na jeho individuální anatomii. U chronických onemocnění zde často bývá avaskulární úsek septa, který je možno tupě perforovat a dilatovat pomocí Fogartyho balónového katétru anebo nůžek. Pokud je místo zamýšlené stomie vaskulární, doporučuje se jeho ošetření bipolární koagulací. Se silnějším septem se setkáváme především v akutních případech. Stomie by měla mít rozměr asi 1 cm, aby nedošlo k jejímu uzávěru, což je obzvláště důležité v případě silného septa.
Endoskopická septostomie je bezpečný výkon, který lze provést přes trepanační návrt. Úspěšnost se udává více než 95 %, v dlouhodobém horizontu 92 % [61]. Frekvence komplikací je velmi nízká.
Akveduktoplastika a akveduktální stenting
Akveduktoplastika je alternativní léčebná metoda v případě membranózní akveduktální stenózy. U většiny akveduktálních stenóz je metoda volby ETV. Vstup bývá většinou těsně za vlasovou hranicí, přibližně 5 cm před koronárním švem a 2 cm od střední čáry. V případě širokého foramen Monroi lze umístit vstupní bod 3 cm před koronární šev, což dovoluje přístup jak k akveduktu, tak ke spodině třetí komory. Distálně lokalizovaná stenóza se dá vizualizovat flexibilním endoskopem, kterým je možno zároveň provést preforaci, a na konci výkonu ověřit průchodnost Sylviova mokovodu. Akveduktoplastika se provádí pomocí Fogartyho balónkového katétru [38]. Protože průběh Sylviova mokovodu je lehce zakřivený, mohl by rovný katétr poškodit oblast tekta a způsobit diplopii. Akveduktoplastika má větší riziko komplikací a restenóz ve srovnání s ETV a navíc je daleko rizikovější u neurochirurgů bez zkušeností. Indikována je tedy v případě izolované čtvrté komory, kdy není možno provést ETV u stenózy mokovodu [62,63]. Stenting je indikován při zvýšeném riziku restenózy. Doporučuje se délka minimálně 6 cm jako prevence jeho migrace nebo fixace k duře v místě vstupu [64].
Retrográdní akveduktoplastika je vý-kon, kdy k akveduktu přistupujeme přes čtvrtou komoru a tímto přístupem pak provádíme plastiku. Tento postup volíme v situaci, kdy nelze proniknout k mokovodu přes postranní a třetí komoru, nejčastěji z důvodu slit ventricle syndromu. Nezbytné je v tomto případě použití navigace, protože anatomické poměry bývají často změněny [38]. Vstup bývá většinou 1 až 2 cm od střední čáry a pro vysoké riziko restenózy se zároveň zavádí stent.
Fenestrace lamina terminalis
Pokud nelze provést ETV, je alternativní léčba provedení perforace lamina terminalis transventrikulárně. Předpoklad provedení bezpečné stomie je translucentní lamina terminalis, aby bylo možno přesně lokalizovat oblast přední komunikanty, která bývá těsně před laminou terminalis. Technika závisí na šířce foramen Monroi – pokud je dostatečně široké, lze vizualizovat laminu terminalis pomocí přímé optiky [38]. V opačném případě je vhodné použití flexibilního endoskopu.
Publikace o prováděných výkonech jsou relativně vzácné a ojedinělé. Oertelet al se zmiňují o čtyřech pacientech v průběhu 15 let ošetřených touto technikou [65]. Autoři preferovali použití rigidního endoskopu. Jako potenciální kandidáty v diskuzi uvádějí pacienty s velmi štíhlými prepontinními cisternami, objemným terapeuticky neovlivnitelným aneuryzmatem a. basilaris nebo v případě nádorů mozkového kmene. Nevýhodou byly popsané drobné kontuze fornixů, které ale zůstaly klinicky němé. Použití flexibilního endoskopu v souboru 25 pacientů uvádějí Rangel ‑ Castilla et al [66]. Rozhodnutí o provedení fenestrace lamina terminalis učinili peroperačně. Indikací byla abnormální anatomie spodiny třetí komory, absence pulzací po provedení ETV nebo velmi štíhlé subarachnoidální prostory. Menší klinicky němé kontuze fornixů popisují ve 24 %. Úspěšnost udávají 76 %.
Foraminoplastika
Foraminoplastika (obnovení průchodnosti foramen interventriculare) je indikována v případě obstrukce obou foramin, která vede k oboustranné dilataci postranních komor [38], popř. u unilaterálního hydrocefalu [67]. Pokud je provedena fenestrace septum pellucidum, postačuje obnovení průchodnosti pouze jednoho foramen Monroi [68]. Foraminoplastika je považována za bezpečnou v případě tenké avaskulární membrány uzavírající foramen interventriculare [69]. Jestliže je foramen atretické nebo není zcela jasná jeho lokalizace, doporučuje se v těchto případech septostomie pro zvýšené riziko poranění fornixů či zkratová operace [69]. Vstup bývá přibližně 2 cm od střední čáry na straně širší postranní komory přibližně 2 až 3 cm před koronárním švem. Výhodné je použití navigace. Místo obliterovaného foramen interventriculare lze najít sledováním průběhu plexus chorioideus, který probíhá z postranní komory směrem do třetí komory za fornixem. Orientovat se je též možno pomocí v. thalamostriata a v. septi pellucidi. Po koagulaci ependymu lze tupě proniknout do třetí komory frontálně od chorioidálního plexu tak, abychom se vyhnuli poranění fornixu. Nezbytné je mít k dispozici informace o průchodnosti Sylviova mokovodu a v případě pochybností na předoperačně provedené MR je vhodné peroperačně ověřit jeho průchodnost. Foraminoplastiku foramen Magendie lze pak zvážit u obstrukce výtoku čtvrté komory.
Temporální ventrikulostomie
Temporální ventrikulostomie je indikována v případě izolovaného temporálního rohu nebo temporálního a okcipitálního rohu po shuntových infekcích či po resekci intraventrikulárních tumorů v případě, že fenestrace do postranní komory není možná kvůli jizvám anebo anatomické situaci [38]. Vstupní bod je stanoven za pomoci navigace v oblasti nad uchem a za ním a dále je trajektorie směřována do nejtenčího místa mediální stěny temporálního rohu. Zde se koaguluje stěna a potom tupě perforuje. Vzniklá stomie se dilatuje Fogartyho balónkovým katétrem (obr. 5). Pozor je třeba dávat na třetí hlavový nerv a arteria cerebri posterior. Výkon je však v literatuře uváděn ojediněle. Krähenbühl et al v průběhu 20 let popisují čtyři případy s úspěšností 50 %, kdy ve dvou případech vznikly restenózy. Byly ošetřeny v jednom případě novou fenestrací a ve druhém dilatací trigona a provedením septostomie [70].
![Temporální ventrikulostomie.
Na snímku z MR (obrázek nahoře) je znázorněno místo, kde byla provedena stomie(obrázek dole) [38].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/4409e454530be5b53c8f023926d4ddd8.jpg)
Zkratové operace
Zkratové operace představují dominantní řešení hydrocefalu jak u dospělých, tak i u dětí, kde patří mezi nejčastěji prováděné výkony v dětské neurochirurgii [17]. Podstata zkratových operací je derivace CSF z komorového systému do jiné části těla, kde se vstřebává. Nejčastěji používaná drenáž je derivace CSF do peritoneální dutiny (ventrikuloperitoneální shunt, VPS). V menší míře se pak využívá derivace CSF do cévního řečiště, resp. do pravé srdeční síně (ventrikuloatriální shunt, VAS). V případě lumboperitoneálního shuntu (LPS) je CSF odváděn ze subarachnoidálních prostor bederní oblasti do peritoneální dutiny. Na rozdíl od univerzálního použití u jakéhokoli typu hydrocefalu v předchozích dvou případech je LPS možno implantovat pouze v případě komunikujícího hydrocefalu. V literatuře je popsána celá řada dalších míst, kam byl CSF derivován, ale k jejich všeobecnému rozšíření nedošlo. Příkladem je ventrikulopleurální drenáž odvádějící CSF do pohrudniční dutiny.
Zkratová operace je obecně primární řešení u většiny pacientů s komunikujícím hydrocefalem. U obstrukčního hydrocefalu se doporučuje v případě, že nebylo možno provést endoskopický výkon nebo došlo k jeho selhání.
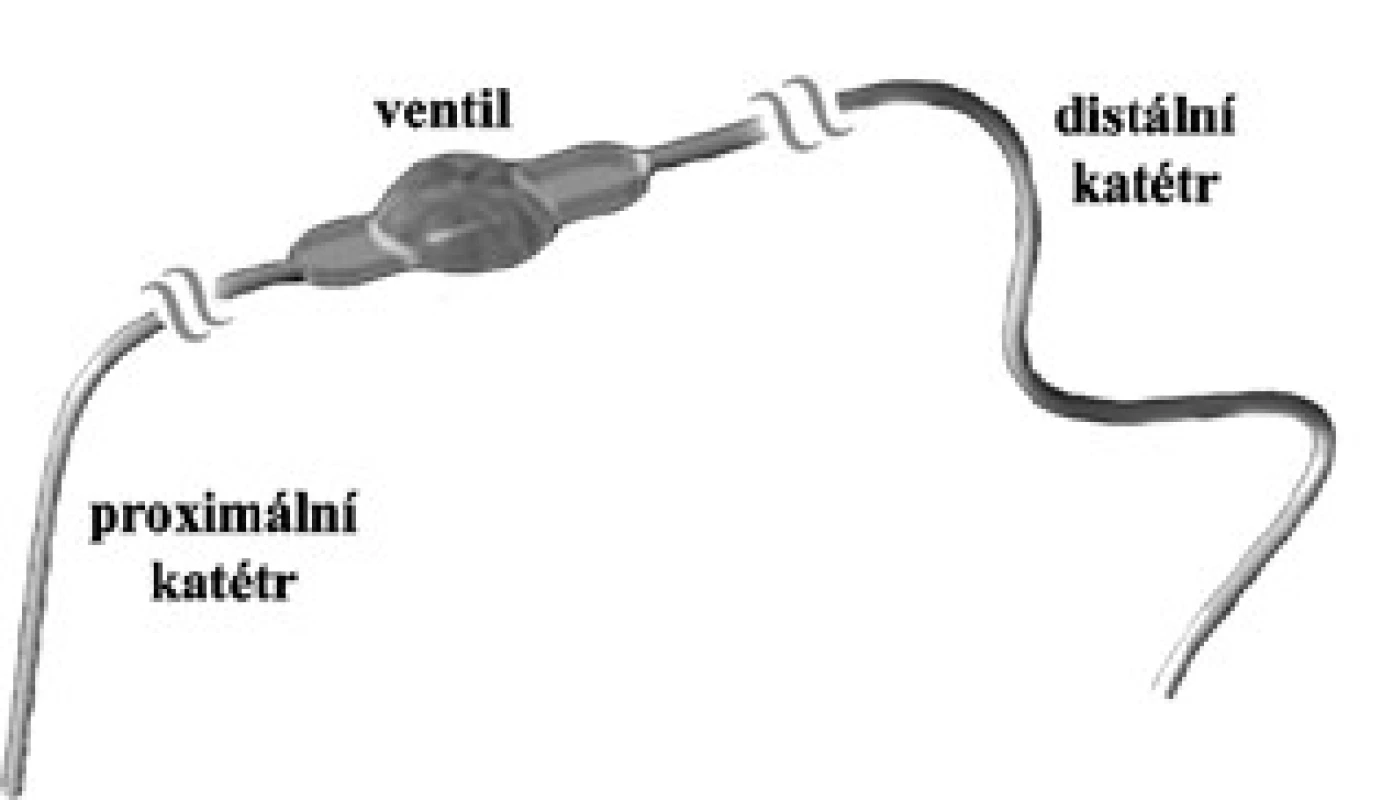
Zkratový systém se skládá ze tří hlavních částí: proximálního katétru (ventrikulárního nebo lumbálního), ventilu s případným přídavným zařízením (např. antisifónovou jednotkou) a distálního katétru (peritoneálního nebo atriálního) (obr. 6). Jako biokompatibilní materiál se používá především silikon s jeho deriváty, který je výborně tolerován a nevyvolává systémovou imunitní reakci [71]. Eymann et al udávají, že podíl katétrů na celkovém selhání vlastního zkratového systému představuje až 70 %. V animálním experimentu autoři prokázali, že kolem silikonového katétru vznikají kolagenní membrány, chronická imunitní reakce, kalcifikace a známky biodegradace [72]. Alergie na silikon jsou velmi vzácné. Pokud však dochází k opakovaným malfunkcím shuntu zapříčiněným obturací katétru, je nutno na tuto raritní alergii pomýšlet [73]. V CSF bývá eozinofilie, kultivace je negativní. Eozinofilie bývá i v krvi, kde dochází zároveň ke zvýšení hladiny IgE, a zvýšený podíl eozinofilů je rovněž v okolní tkáni kolem implantátu [74]. Po odstranění silikonového materiálu pak elevované hodnoty regredují k normálu. Silikonový systém lze nahradit komponenty z polyuretanu a není potom nutná dlouhodobá imunosupresivní léčba [75]. Imunitní reakce organizmu je někdy cílena také na proteiny, které adherují na povrch silikonového implantátu [76]. Daleko častěji se můžeme setkat s biodegradací katétrů a kalcifikacemi s predilekční lokalizací na krku z důvodu největšího mechanického stresu v této lokalizaci [77].
Ventily lze obecně rozdělit na dvě hlavní skupiny – diferenčně‑tlakové a hydrostatické. Diferenčně‑tlakové ventily jsou jednocestné ventily, které propouštějí CSF v závislosti na rozdílu tlaků na vstupu a výstupu ventilu. Tento tlak je pak buď fixně nastaven, nebo jej lze měnit – tyto ventily se označují jako programovatelné. Hydrostatické ventily, které byly zkonstruovány v polovině 90. let 20. století, pak regulují průtok CSF na základě fyzikálních parametrů a jejich změn, a zamezují tak především předrénování. Mohou být s regulovaným průtokem (Orbis ‑ Sigma Valve), s antisifónovým mechanizmem (Delta ‑ Valve) nebo řízené gravitačním působením (Gravity ‑ Assisted Valve).
Tlakový rozdíl, při kterém začíná ventil propouštět CSF, se nazývá otevírací tlak, a určuje se v milimetrech nebo centimetrech vodního sloupce. Je to rozdíl tlaku CSF před ventilem (tj. v mozkových komorách) a za ventilem. Podle jeho výše se rozlišují ventily s velmi nízkým tlakem (very low), nízkotlaké (low), střednětlaké (medium), vysokotlaké (high) a s velmi vysokým tlakem (very high) odpovídající tlakům 2 – 4 cm, 5 – 7 cm, 8 – 12 cm, 13 – 15 cm a 16 – 20 cm. Uvedené hodnoty jsou orientační, jsou závislé na průtoku a liší se u jednotlivých výrobců.
V horizontální pozici je u pacientů s implantovaným shuntem intraventrikulární tlak dán součtem otevíracího tlaku ventilu a intraabdominálního tlaku. Ve vertikální poloze je situace zásadně ovlivněna tzv. hydrostatickým tlakem, který je způsoben sloupcem CSF v katétru. Na sloupec tekutiny působí gravitační síla a zapříčiňuje vznik tzv. sifónového efektu, kdy dochází ke zvýšení průtoku systémem ve vertikální poloze (obr. 7) [78]. To je důvod, proč v současnosti bývají často ventily s horizontálním nastavením tlaku vybaveny také zařízením, které koriguje tlak vertikální.
![Znázornění závislosti průtoku CSF shuntem na poloze pacienta (upraveno), kdy ve vertikální poloze dochází k jeho zvýšení [78].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/880e33ad42f56edd2f669793af5014bf.jpg)
Podle Aschoffa et al bylo v roce 2006 v celosvětovém měřítku minimálně 25 firem vyrábějících shunty v 89 různých provedeních čítajících celkem 750 druhů ventilů [79]. Je možno tak využít výhod jednotlivých ventilů a použít je u daného typu hydrocefalu a za daných okolností. Nevýhodou je složitá orientace ve velkém množství ventilů a daleko vyšší riziko setkat se s ventilem, s nímž nemá neurochirurg žádnou zkušenost. Pokud by měl pacient zaveden programovatelný ventil s programovatelnou gravitační jednotkou, existuje pak několik set různých možných kombinací jeho nastavení u jednoho pacienta. Nicméně podle současného trendu lze předpokládat, že nabídka ventilů bude nadále vzrůstat. Je otázka, kam se bude další vývoj ubírat. Jednou z možností je vyvinutí tzv. chytrých shuntů (smart shunts), které by mohly být vybaveny senzory, zpětnou vazbou a telemetrickým přenosem, umožňovat individuální nastavení a kontrolu a případně pacienta směřovat k postupnému „odvykání“ od systému [80].
Používané ventily jsou v současné době kompatibilní s MR. Nová generace programovatelných ventilů je dobře odolná vůči magnetickému poli o síle 3 Tesla. Starší generace ventilů je odolná vůči poli 1,5 Tesla [81]. Většinu ventilů je nutno po provedení MR přeprogramovat (výjimkou je proGAV firmy Miethke a Polaris firmy Sophysa). Programovatelné ventily vytvářejí artefakty v obraze MR [82]. V rozsahu artefaktů existují rozdíly mezi jednotlivými ventily, s čímž je nutno počítat při implantaci shuntu, aby případná patologie nebyla překryta generovaným artefaktem.
Ventrikuloperitoneální shunty
VPS jsou nejrozšířenější typ drenážních operací. Princip je derivace CSF z komorového systému do peritoneální dutiny. VPS jsou preferovány pro snadnější provedení než ostatní druhy drenáží, menší náročnost reoperací a menší závažnost případných komplikací.
Zavedení do dutiny břišní se nedoporučuje u divertikulózy. Limitací mohou být také srůsty vzniklé po předchozích operacích nebo zánětech. Proto jsou v literatuře uváděny i různé modifikace uložení konce PK v dutině břišní. Jednou z možností je jeho uložení do bursa omentalis v případě adhezí přední poloviny břicha [83]. V jiné práci se zase doporučuje uložení do pravého subfrenického prostoru, kde je absorpce maximální kvůli rozlehlé peritoneální oblasti a dýchacím pohybům [84]. Nicméně jiní autoři upozorňují, že uložení v této lokalizaci může způsobovat dráždění, které se zvýrazňuje dýchacími pohyby [85].
Při implantaci PK je možno využít laparoskopii (LSK). Její výhodou je minimální traumatizace břišní stěny, menší pooperační bolestivost, lepší kosmetický výsledek, nižší riziko vzniku adhezí, vizualizace a umístění PK do požadované polohy, snadnější implantace u obézních pacientů, možnost rozrušit adheze aj. (obr. 8). LSK je doporučována v případě nutného odstranění rozpojených PK dislokovaných do břišní dutiny, u těžce obézních pacientů a u pacientů po předchozích abdominálních operacích [86]. Ventil umístěný v shuntu je dostatečně chráněn proti zpětnému tlaku, který mnohonásobně převyšuje tlaky používané při LSK [87]. Ani při tlaku odpovídajícím 80 mmHg se nevyskytl žádný problém s průnikem vzduchu dovnitř systému.
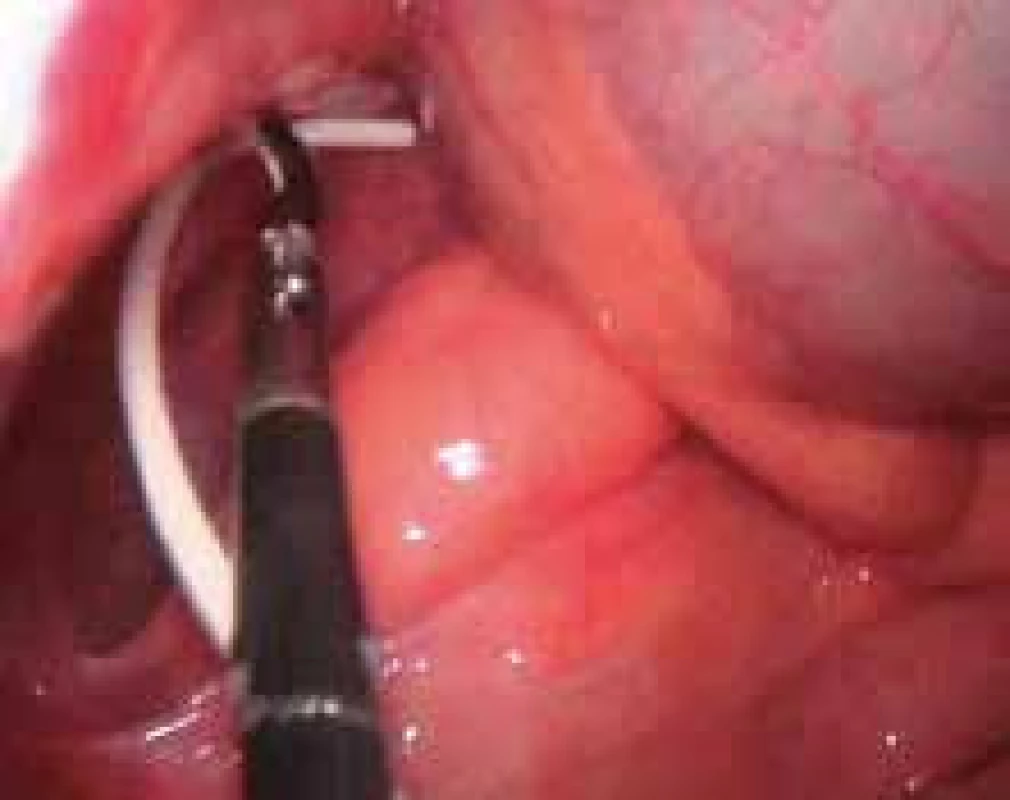
Ventrikuloatriální shunty
U VAS je distální katétr zaveden do pravé srdeční síně přes žilní systém. Používá se v případě, kdy není možno zavést VPS. Implantace VAS je kontraindikována u nemocných se srdečními vadami a u vážných kardiopulmonálních chorob [88]. AK se většinou umísťuje do oblasti Th6 [89], popř. Th6 – 8 u dospělých, u dětí do oblasti Th10 [90], a verifikuje se rentgenovým snímkem. Jiní doporučují provedení peroperační echokardiografie (obr. 9) [91]. AK je možno umístit také na základě snímání elektrokardiografického záznamu, kdy drén naplněný fyziologickým roztokem představuje jednu z elektrod a při správném zavedení dojde ke zvýraznění vlny P [92]. Při komplikovaných anatomických poměrech lze provést peroperační venografii [93]. Přístup k žilnímu systému je možný preparací v. facialis nebo přímo v. jugularis interna. S výhodou je možné použít punkční techniku do v. jugularis interna [94].
![Schéma implantace VAS s využitím ultrazvukové a rentgenové kontroly (upraveno) [91].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/a05f717de6c41adf4e47b4852cf0af92.jpg)
Lumboperitoneální shunty
U LPS je derivován CSF z lumbálního subarachnoidálního prostoru do dutiny břišní. Představují případnou alternativu k VPS, ale jsou limitovány použitím pouze u komunikujícího hydrocefalu. S výhodou je lze využít v případě štíhlého komorového systému u slit ventricle syndromu nebo u idiopatické nitrolební hypertenze [95]. Mezi výhody LPS patří to, že se jedná o extrakraniální výkon (což je důvod jeho preference z náboženských důvodů zejména v některých asijských zemích), je zde nižší riziko obstrukce a nehrozí nebezpečí vzniku slit ventricle syndromu. Nevýhoda je již zmíněné omezení na komunikující hydrocefalus, vznik radikulopatie nebo možnost vzniku tonzilární herniace a někdy nesnadná kontrola funkce ventilu [96].
Komplikace
Selhání (malfunkce) shuntu je poměrně častá komplikace. V případě pediatrických pacientů se udává selhání přibližně u 40 % nemocných během prvního roku a v 50 % případů během prvních dvou let po implantaci [97,98].
Malfunkci shuntu je nezbytné správně a včas diagnostikovat a také léčit [88]. Klinické zhoršení pacientova stavu může probíhat pozvolna, ale také velmi rychle, zejména u obstrukčního hydrocefalu. Funkce shuntu může být omezena zcela, jen částečně nebo shunt funguje intermitentně, což často způsobuje diagnostické obtíže.
Jednoznačné standardy pro předoperační diagnostiku malfunkce shuntu dosud neexistují [99 – 101]. Neléčená malfunkce shuntu je ale spjata s významnou morbiditou a mortalitou. Důležitou roli hraje rychlost stanovení diagnózy a léčby [102,103]. Doporučuje se provést řádné klinické vyšetření pacienta včetně palpačního vyšetření rezervoáru. Pokud jej nelze promáčknout, lze předpokládat nefunkčnost distálního katétru. Jestliže se po promáčknutí komůrka neplní, může být nefunkční VK. Pomalejší plnění je také u slit ventricle syndromu, kdy k naplnění může dojít s odstupem i několika minut. Je možné rovněž provést punkci komůrky (jehla 25 G a tenčí) a změřit tlak v systému, popřípadě odebrat CSF na vyšetření. Riziko infekce při punkci se udává 0,5 % [88]. Kromě klinického vyšetření je nutné provést vyšetření zobrazovacími metodami – prostý rentgenový snímek znázorňující průběh shuntu a zobrazení mozku a mozkových komor (CT, MR, ultrazvuk). Normální nález na mozkových komorách ale nevylučuje malfunkci shuntu [104]. Stěny komor mohou být nepoddajné, a nemusí tak dojít k dilataci komorového systému. Důležité je také srovnání případné dynamiky, tj. srovnání s předchozími vyšetřeními zobrazovacími metodami.
Při malfunkci shuntu u obstrukčního hydrocefalu je vhodné zvážit, zda není možné endoskopické řešení [105,106].
Zkratové operace mají komplikace společné pro všechny druhy drenáží a komplikace specifické pro jejich jednotlivé typy. Může dojít k obstrukci proximálního (komorového nebo lumbálního) katétru, k neprůchodnosti ventilu nebo k obstrukci distálního (peritoneálního, atriálního) katétru. Závažná komplikace je infekce zkratového systému. Kromě toho se lze setkat s malpozicí, rozpojením nebo zalomením katétru. Drenáž může odvádět méně CSF, než je potřeba, tj. dochází k tzv. poddrénování (underdrainage). V opačném případě, kdy je derivováno nadbytečné množství CSF, dochází k tzv. předrénování (overdrainage).
Obstrukce VK bývá často způsobena vrůstáním plexus chorioideus do jeho otvorů. Odstranění VK pak může být problematické. Jednou z možností je intraluminální koagulace plexus chorioideus pomocí drátěného zavaděče zavedeného do lumen VK a napojeného pomocí elektrody na unipolární koagulaci [107]. Pokud nelze VK extrahovat, je vhodnější jej ponechat in situ a zavést nový VK než riskovat vznik krvácení z poraněného plexus chorioideus. Další příčinou nefunkčního VK může být jeho přerušení nebo rozpojení od ventilu.
Selhání samotného ventilu se nevyskytuje příliš často. Nejčastěji je způsobeno příměsí krve v CSF nebo příliš vysokým obsahem bílkovin. Nepříznivější situace nastává při přítomnosti krve [108,109].
Selhání PK je v literatuře udáváno v rozmezí od 5 do 47 % [110], nejčastěji mezi 10 a 30 % [111,112]. Z celkového selhání shuntu představuje malfunkce PK asi jednu třetinu [113,114]. Jeho nejčastější příčina je dislokace, obstrukce nebo migrace katétru do břišní stěny, popř. infekce systému či formace pseudocysty. Velmi vzácně může PK způsobit i viscerální perforaci, jejíž mortalita bývá 15 % [115]. Raritně jsou popsány migrace PK do pleurální dutiny [116], jater [117], srdce [118], skrota [119], anu [120], vaginy [121], orálně [122] aj. U dětí během růstu může dojít k vytažení PK z dutiny břišní s nutností operační revize a prodloužení jeho délky. Prevencí je již primárně zavedený dostatečně dlouhý PK.
Mezi nejčastější v literatuře uváděné komplikace, se kterými se setkáváme u AK, patří jeho obstrukce, malpozice a infekce [123]. Jednou z nejzávažnějších komplikací je vznik plicní hypertenze s následným pravostranným srdečním selháváním [124]. Vyskytovat se může až u 8 % implantovaných VAS [125]. Proto autoři doporučují provedení echokardiografie a funkčních plicních testů k odhalení plicní hypertenze. Další závažná komplikace je shuntová nefritis vznikající na podkladě infikovaného shuntu [126]. V tomto případě je nutno extrahovat shunt, a pokud k tomu dojde během několika týdnů, nemusí být ohroženy ledvinné funkce. Mezi další vzácné komplikace patří plicní embolie způsobená tromby nebo i částmi AK, srdeční tamponáda aj.
Lumbální katétr není náchylný k obstrukci tak jako VK vzhledem k nepřítomnosti plexu v subarachnoidálním prostoru bederní oblasti. Může dojít ale k jeho malpozici, radikulárnímu dráždění, vzácně je při předrénování popisován vznik iatrogenní Chiariho malformace s poklesem mozečkových tonzil pod úroveň foramen magnum aj. [96].
Při předrénování systém odvádí více CSF, než je potřeba. Klinicky se projevuje bolestmi hlavy, vertigem a nauzeou. Typické je zhoršení ve vertikální poloze a zlepšení v poloze horizontální. Symptomatické předrénování se vyskytuje přibližně u 2 % pacientů [127]. Proč u někoho k předrénování dojde a u jiného nikoliv, není zcela jasné. Intraabdominální tlak omezuje průtok CSF shuntem a může hrát roli v omezení předrénování [128]. Možností je i vliv řady dalších činitelů včetně adaptace sekrece CSF k omezení předrénování [129].
Mezi diagnózy z předrénování patří slit ventricle syndrom, kraniostenóza, subdurální hematom, okluze Sylviova mokovodu a ortostatická cefalea [88]. Pro slit ventricle syndrom je typický nález úzkých štěrbinových komor na zobrazovacích metodách. Většinou je asymptomatický, ale může se projevovat intermitentními bolestmi hlavy, které se zlepšují vleže. Při palpaci se ventil zpomaleně plní. VAS k předrénování inklinují méně často než VPS. Je nezbytné upozornit, že u komor se sníženou kompliancí (příčinou je periventrikulární glióza a fibróza) nedochází k jejich rozšíření a jejich velikost nemusí signalizovat vůbec nic o hodnotě nitrolebečního tlaku či o funkčnosti implantovaného shuntu.
Infekční komplikace se většinou udávají v rozmezí od 5 do 15 % (v některých centrech jsou signifikantně nižší, v jiných vyšší), z nichž více než 70 % se rozvine do jednoho měsíce od operace a 90 % během prvních šesti měsíců [130]. Nejčastějšími patogeny jsou stafylokok koaguláza ‑ negativní a stafylokok zlatý [131,132]. Definice infekční komplikace je ale rozdílná napříč studiemi. Ve většině z nich je za infekci považován stav, kdy jsou pozitivní kultury z CSF nebo depo hnisu kolem shuntu, či dokonce je nález pleiocytózy s horečkou, malfunkce shuntu, popř.neurologická symptomatologie [132 – 136]. V jiné definici je za infekci shuntu považována pozitivní kultura ze shuntu nebo z tekutin obsažených v katétrech spojená s malfunkcí shuntu a vyžadující jeho odstranění [137]. Mezi rizikové faktory patří předchozí revize shuntu pro mechanickou obstrukci, prosakování CSF, implantace shuntu následující po kranitomii nebo zevní komorové drenáži. Infikovaný shunt je nutno extrahovat, je třeba přeléčit infekci a pacienta popřípadě zajistit dočasnou drenáží. Samotná léčba antibiotiky je úspěšná málokdy. Antibiotiky impregnované katétry jsou podle některých studií efektivní u rizikových skupin [138] a přínosné také finančně i přes vyšší pořizovací cenu [139]. Podle jiných studií však výskyt infekcí nesnížily ani u dětí [140], ani u dospělých [141].
Závěr
Hydrocefalus je patofyziologický stav, který má u jeho jednotlivých typů řadu specifik a charakteristik, jež je nutno mít na zřeteli při zvažování optimálního terapeutického postupu, volby případného implantátu a místa derivace CSF. Ze zobrazovacích metod se v diagnostice využívá CT, ultrazvuk a MR, která poskytuje detailní informace a umožňuje stanovení optimální léčebné metody. Diagnostiku lze v indikovaných případech rozšířit o provedení likvorodynamických testů. Hydrocefalus je možno ošetřit buď dočasnými nebo trvalými drenážními systémy. Z dočasných drenážních systémů se používá zevní komorová drenáž, zevní lumbální drenáž (popř. opakované lumbální punkce) nebo subkutánní rezervoár. Při trvalém řešení hydrocefalu je nutné znát, zda je přítomna či nepřítomna obstrukční složka. V případě prokázané obstrukce se preferuje ošetření endoskopickou technikou, v opačném případě by měla být zvažována zkratová operace. Z endoskopických výkonů je nejčastěji používána ETV, která je dobře technicky proveditelná s malým procentem komplikací. Ze zkratových operací se nejvíce používá VPS. Pokud jej nelze použít, alternativou je pak VAS. Jejich výhodou je univerzální použití, ale v dlouhodobém horizontu mají relativně vysoké procento komplikací.
Seznam použitých zkratek
AK atriální katétr
CSF mozkomíšní mok (CerebroSpinal Fluid)
ETV endoskopická ventrikulostomie třetí komory (Endoscopic Third Ventriculostomy)
LPS lumboperitoneální shunt
LSK laparoskopie
MR magnetická rezonance
PK peritoneální katétr
VAS ventrikuloatriální shunt
VK ventrikulární katétr
VPS ventrikuloperitoneální shunt
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 15. 10. 2013
Přijato do tisku: 15. 1. 2014
Recenzenti
MU Dr. Lubomír Jurák
MU Dr. Milan Mohapl, Ph.D.
MU Dr. Tomáš Radovnický
MU Dr. Václav Vybíhal, Ph.D.
Neurochirurgická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e‑mail: vvybihal@fnbrno.cz
MU Dr. Václav Vybíhal, Ph.D.
Václav Vybíhal se narodil 18. října 1970 v Kyjově. V letech 1989 až 1995 studoval na LF MU v Brně (obor všeobecné lékařství). V roce 1995 nastoupil jako sekundární lékař na Kliniku dětské chirurgie a traumatologie ve FDN v Brně. V roce 1998 atestoval v oboru chirurgie (I. stupeň). Od roku 2000 začal pracovat na Neurochirurgické klinice FN Brno, kde působí dodnes. V roce 2007 složil atestaci II. stupně z neurochirurgie. Je absolventem čtyřletého mezinárodního neurochirurgického kurzu EANS. Na odborné zahraniční stáži byl ve Finsku. V roce 2012 obhájil doktorskou dizertační práci zabývající se normotenzním hydrocefalem. Je autorem nebo spoluautorem více než 20 odborných článků včetně impaktovaných a zahraničních časopisů. Aktivně se zúčastnil celé řady tuzemských a zahraničních kongresů, kde prezentoval více jak 60 odborných sdělení. Je členem České neurochirurgické společnosti ČLS JEP, CENS a EANS.
Zdroje
1. Drake JM, Sainte ‑ Rose C. History of cerebrospinal fluid shunts. In: Drake JM, Sainte ‑ Rose C (eds). The shunt book. Cambridge: Blackwell Science 1995 : 3 – 12.
2. Hirsch JF. Surgery of hydrocephalus: past, present and future. Acta Neurochir (Wien) 1992; 116(2 – 4): 155 – 160.
3. Lifshutz JI, Johnson WD. History of hydrocephalus and its treatments. Neurosurg Focus 2001; 11(2): E1.
4. Grotenhuis JA. Manual of endoscopic procedures in neurosurgery. Nijmegen: Machaon 1995.
5. Dandy WE. Extirpation of the choroid plexus of the lateral ventricles in communicating hydrocephalus. Ann Surg 1918; 68(6): 569 – 579.
6. Oi S. Hydrocephalus research update ‑ controversies in definition and classification of hydrocephalus. Neurol Med Chir (Tokyo) 2010; 50(9): 859 – 869.
7. Oi S, Sato O, Matsumoto S. A new classification for congenital hydrocephalus: prospective classification of congenital hydrocephalus (PCCH) and postnatal prognosis. Part 1. A proposal of a new classification of fetal/ neonatal/ infantile hydrocephalus based on neuronal maturation proces and chronological changes. No Shinkei Geka Journal 1994; 26(3): 122 – 127.
8. Oi S, Honda Y, Hidaka M, Sato O, Matsumoto S. Intrauterina high‑resolution magnetic resonance imaging in fetal hydrocephalus and prenatal estimation of postnatal outcomes with „perspective classification“. J Neurosurg 1998; 88(4): 685 – 694.
9. Oi S, Di Rocco C. Proposal of „evolution theory in cerebrospinal fluid dynamics“ and minor pathway hydrocephalus in developing immature brain. Childs Nerv Syst 2006; 22(7): 662 – 669.
10. Oi S. Hydrocephalus chronology in adults: confused state of the terminology. Crit Rev Neurosurg 1998; 8(6): 346 – 356.
11. Oi S, Matsumoto S. Patophysiology of nonneoplastic obstruction of the foramen of Monro and progressive unilateral hydrocephalus. Neurosurgery 1985; 17(6): 891 – 896.
12. Oi S, Matsumoto S. Slit ventricles as a cause of isolated ventricles after shunting. Childs Nerv Syst 1985; 1(4): 189 – 198.
13. Oi S, Matsumoto S. Isolated fourth ventricle. J Pediat Neurosci 1986; 2 : 125 – 133.
14. Oi S, Kudo H, Yamada H, Kim S, Hamano S, Urui S et al. Hydromeylic hydrocephalus. Correlation of hydromyelia with variouos stages of hydrocephlaus in postshunt isolated compartments. J Neurosurg 1991; 74(3): 371 – 379.
15. Rekate HL. A consensus on the classification of hydrocephalus: its utility in the assessment of abnormalities of cerebrospinal fluid dynamics. Childs Nerv Syst 2011; 27(10): 1535 – 1541.
16. Relkin N, Marmarou A, Klinge P, Bergsneider M, Black PM. Diagnosing idiopathic normal ‑ pressure hydrocephalus. Neurosurgery 2005; 57 (Suppl 3): S4 – S16.
17. Lipina R, Paleček T. Chirurgické řešení hydrocefalu v dětském věku. Pediatr Pro Prax 2004; 3 : 133 – 136.
18. Ng SES, Low AMS, Tang KK, Chan YH, Kwok RK. Value of quantitative MRI biomarkers (Evans’ index, aqueductal flow rate, and apparent diffusion coefficient) in idiopathic normal pressure hydrocephalus. J Magn Reson Imaging 2009; 30(4): 708 – 715.
19. Parkkola RK, Komu ME, Kotilainen EM, Valtonen SO,Thomsen C, Gideon P. Cerebrospinal fluid flow in patients with dilated ventricles studied with MR imaging. Eur Radiol 2000; 10(9): 1442 – 1446.
20. Evans WA jr. An encephalographic ratio for estimating ventricular enlargement and cerebral atrophy. Arch Neurol Psychiatry 1942; 47(6): 931 – 937.
21. Bartynski WS, Valliappan S, Uselman JH, Spearman MP. The adult radiographic shuntogram. AJNR Am J Neuroradiol 2000; 21(4): 721 – 726.
22. Marmarou A, Foda MA, Bandoh K, Yoshihara M, Yamamoto T, Tsuji O et al. Posttraumatic ventriculomegaly: hydrocephalus or atrophy? A new approach for diagnosis using CSF dynamics. J Neurosurg 1996; 85(6): 1026 – 1035.
23. Marmarou A, Bergsneider M, Klinge P, Relkin N,Black PM. The value of supplemental prognostic tests for the preoperative assessment of idiopathic normal ‑ pressure hydrocephalus. Neurosurgery 2005; 57 (Suppl 3): S17 – S28.
24. Haan J, Thomeer RT. Predictive value of temporary external lumbar drainage in normal pressure hydrocephalus. Neurosurgery 1988; 22(2): 388 – 391.
25. Tisell M, Tullberg M, Hellström P, Edsbagge M, Högfeldt M, Wikkelsö C. Shunt surgery in patients with hydrocephalus and white matter changes. J Neurosurg 2011; 114(5): 1432 – 1438.
26. Czosnyka M, Czosnyka ZH, Whitfield PC, Donovan T, Pickard JD. Age dependence of cerebrospinal pressure‑volume compensation in patients with hydrocephalus. J Neurosurg 2001; 94(3): 482 – 486.
27. Marmarou A, Shulman K, Rosende RM. A nonlinear analysis of the cerebrospinal fluid system and intracranial pressure dynamics. J Neurosurg 1978; 48(3): 332 – 344.
28. Katzman R, Hussey F. A simple constant ‑ infusion manometric test for measurement of CSF absorption. Part I. Rationale nad Method. Neurology 1970; 20(6): 534 – 544.
29. International PHVD Drug Trial Group. International randomised controlled trial of acetazolamide and furosemide in posthaemorrhagic ventricular dilatation in infancy. Lancet 1998; 352(9126): 433 – 440.
30. Bhagwati SN, George K. Use of intrathecal hyaluronidase in the management of tuberculous meningitis with hydrocephalus. Childs Nerv Syst 1986; 2(1): 20 – 25.
31. Morota N, Ihara S, Araki T. Torkildsen shunt: re‑evaluation of the historical procedure. Childs Nerv Syst 2010; 26(12): 1705 – 1710.
32. Bret J. Recanalization of Sylvian aqueduct. Eur J Radiol 1981; 1(1): 67 – 70.
33. Ramamurthi R, Sridhar K, Vasudevan MC. Textbook of operative neurosurgery. New Delhi: BI Publications Pvt Ltd 2005.
34. Ormond DR, Dressler A, Kim S, Ronecker J, Murali R.Lumbar drains may reduce the need for permanent CSF diversion in spontaneous subarachnoid haemorrhage. Br J Neurosurg 2013; 27(2): 171 – 174.
35. Yu B, Li S, Lin Z, Zhang N. Treatment of posthemorrhagic hydrocephalus in premature infants with subcutaneous reservoir drainage. Pediatr Neurosurg 2009; 45(2): 119 – 125.
36. Willis B, Javalkar V, Vannemreddy P, Caldito G, Matsuyama J, Guthikonda B et al. Ventricular reservoirs and ventriculoperitoneal shunts for premature infants with posthemorrhagic hydrocephalus: an institutional experience. J Neurosurg Pediatr 2009; 3(2): 94 – 100.
37. Köksal V, Öktem S. Ventriculosubgaleal shunt procedure and its long‑term outcomes in premature infants with post‑hemorrhagic hydrocephalus. Childs Nerv Syst 2010; 26(11): 1505 – 1515.
38. Schroeder HW, Oertel J, Gaab MR. Endoscopic treatment of cerebrospinal fluid pathway obstructions. Neurosurgery 2007; 60 (2 Suppl 1): ONS44 – ONS51.
39. Novák Z, Kosorin K. Význam endoskopické septostomie. Cesk Slov Neurol N 2004; 67/ 100(2): 120 – 123.
40. Warf BC. Comparison of endoscopic third ventriculostomy alone and combined with choroid plexus cauterization in infants younger than 1 year of age: a prospective study in 550 African children. J Neurosurg 2005; 103 (Suppl 6): 475 – 481.
41. Brockmeyer D, Abtin K, Carey L, Walker LM. Endoscopic third ventriculostomy: an outcome analysis. Pediatr Neurosurg 1998; 28(5): 236 – 240.
42. Gangemi M, Donati P, Maiuri F, Longatti P, Godano U, Mascari C. Endoscopic third ventriculostomy for hydrocephalus. Minim Invas Neurosurg 1999; 42(3): 128 – 132.
43. Rezaee O, Sharifi G, Samadian M, Haddadian K, Ali ‑ Asgari A, Yazdani M. Endoscopic third ventriculostomy for treatment of obstructive hydrocephalus. Arch Iran Med 2007; 10(4): 498 – 503.
44. Lipina R, Reguli S, Doležilová V, Kunčíková M, Podešvová H. Endoscopic third ventriculostomy for obstructive hydrocephalus in children younger than 6 months of age: is it a first ‑ choice method? Childs Nerv Syst 2008; 24(9): 1021 – 1027.
45. Kulkarni AV, Riva ‑ Cambrin J, Browd SR. Use of the ETV Success Score to explain the variation in reported endoscopic third ventriculostomy success rates among published case series of childhood hydrocephalus. J Neurosurg Pediatr 2011; 7(2): 143 – 146.
46. Siomin V, Cinalli G, Grotenhuis A, Golash A, Oi S, Kothbauer K et al. Endoscopic third ventriculostomy in patients with cerebrospinal fluid infection and/ or hemorrhage. J Neurosurg 2002; 97(3): 519 – 524.
47. Gangemi M, Maiuri F, Naddeo M, Godano U, Mascari C, Broggi G et al. Endoscopic third ventriculostomy in idiopathic normal pressure hydrocephalus: an Italian multicenter study. Neurosurgery 2008; 63(1): 62 – 67.
48. Pinto FC, Saad F, Oliveira MF, Pereira RM, Miranda FL,Tornai JB et al. Role of endoscopic third ventriculostomy and ventriculoperitoneal shunt in idiopathic normal pressure hydrocephalus: preliminary results of a randomized clinical trial. Neurosurgery 2013; 72(5): 845 – 853.
49. Chan AK, McGovern RA, Zacharia BE, Mikell CB, Bruce SS, Sheehy JP et al. Inferior short ‑ term safety profile of endoscopic third ventriculostomy as compared to ventriculoperitoneal shunt placement for idiopathic normal pressure hydrocephalus: a population ‑ based study. Neurosurgery 2013; 73(6): 951 – 961.
50. Mahapatra A, Mehr S, Singh D, Tandon M, Ganjoo P, Singh H. Ostomy closure and the role of repeat endoscopic third ventriculostomy (re‑ETV) in failed ETV procedures. Neurol India 2011; 59(6): 867 – 873.
51. Hellwig D, Giordano M, Kappus C. Redo third ventriculostomy. World Neurosurg 2013; 79 (Suppl 2): S22.
52. Bouras T, Sgouros S. Complications of endoscopic third ventriculostomy: a systematic review. Acta Neurochir Suppl 2012; 113 : 149 – 153.
53. Navarro R, Gil ‑ Parra R, Reitman AJ, Olavarria G, Grant JA, Tomita T. Endoscopic third ventriculostomy in children: early and late complications and their avoidance. Childs Nerv Syst 2006; 22(5): 506 – 513.
54. Dusick JR, McArthur DL, Bergsneider M. Success and complication rates of endoscopic third ventriculostomy for adult hydrocephalus: a series of 108 patients. Surg Neurol 2008; 69(1): 5 – 15.
55. Gangemi M, Maiuri F, Buonamassa S, Colella G,de Divitiis E. Endoscopic third ventriculostomy in idiopathic normal pressure hydrocephalus. Neurosurgery 2004; 55(1): 129 – 134.
56. Grunert P, Charalampaki P, Hopf N, Filippi R. The role of third ventriculostomy in the management of obstructive hydrocephalus. Minim Invasive Neurosurg 2003; 46(1): 16 – 21.
57. Hader WJ, Walker RL, Myles ST, Hamilton M. Complications of endoscopic third ventriculostomy in previously shunted patients. Neurosurgery 2008; 63 (Suppl 1): ONS168 – ONS175.
58. Aldana PR, Kestle JR, Brockmeyer DL, Walker ML.Results of endoscopic septal fenestration in the treatment of isolated ventricular hydrocephalus. Pediatr Neurosurg 2003; 38(6): 286 – 294.
59. Hamada H, Hayashi N, Kurimoto M, Umemura K, Hirashima Y, Endo S. Neuroendoscopic septostomy for isolated lateral ventricle. Neurol Med Chir (Tokyo) 2003; 43(12): 582 – 587.
60. Oertel JM, Schroeder HW, Gaab MR. Endoscopic stomy of the septum pellucidum: indications, technique, and results. Neurosurgery 2009; 64(3): 482 – 491.
61. Tamburrini G, Frassanito P, Massimi L, Caldarelli M, Di Rocco C. Endoscopic septostomy through a standard precoronal ventricular access: feasibility and effectiveness. Acta Neurochir (Wien) 2012; 154(8): 1517 – 1522.
62. Manwaring KH, Fritsch MJ. Endoscopic aqueductal stenting as an option for obstructive hydrocephalus. Neurosurgery 1998; 43(3): 712 – 713.
63. Teo C, Burson T, Misra S. Endoscopic treatment of the trapped fourth ventricle. Neurosurgery 1999; 44(6): 1257 – 1261.
64. Schroeder HW, Gaab MR. Endoscopic aqueductoplasty: technique and results. Neurosurgery 1999; 45(3): 508 – 515.
65. Oertel JM, Vulcu S, Schroeder HW, Konerding MA,Wagner W, Gaab MR. Endoscopic transventricular third ventriculostomy through the lamina terminalis. J Neurosurg 2010; 113(6): 1261 – 1269.
66. Rangel ‑ Castilla L, Hwang SW, Jea A, Torres ‑ Corzo J.Efficacy and safety of endoscopic transventricular lamina terminalis fenestration for hydrocephalus. Neurosurgery 2012; 71(2): 464 – 473.
67. Oi S, Hidaka M, Honda Y, Togo K, Shinoda M, Shimoda M et al. Neuroendoscopic surgery for specific forms of hydrocephalus. Childs Nerv Syst 1999; 15(1): 56 – 68.
68. Kalhorn SP, Strom RG, Harter DH. Idiopathic bilateral stenosis of the foramina of Monro treated using endoscopic foraminoplasty and septostomy. Neurosurg Focus 2011; 30(4): E5.
69. Mohanty A, Das BS, Sastry Kolluri VR, Hedge T. Neuro‑endoscopic fenestration of occluded foramen of Monro causing unilateral hydrocephalus. Pediatr Neurosurg 1996; 25(5): 248 – 251.
70. Krähenbühl AK, Baldauf J, Gaab MR, Schroeder HW.Endoscopic temporal ventriculocisternostomy: an option for the treatment of trapped temporal horns. Neurosurg Pediatr 2013; 11(5): 568 – 574.
71. Kalousdian S, Karlan MS, Williams MA. Silicone elastomer cerebrospinal fluid shunt systems. Council on Scientific Affairs, American Medical Association. Neurosurgery 1998; 42(4): 887 – 892.
72. Eymann R, Kim YJ, Bohle RM, Antes S, Schmitt M,Menger MD et al. Microstructural alterations of silicone catheters in an animal experiment: histopathology and SEM findings. Acta Neurochir Suppl 2012; 113 : 87 – 90.
73. Ellis MJ, Kazina CJ, Del Bigio MR, McDonald PJ. Treatment of recurrent ventriculoperitoneal shunt failure associated with persistent cerebrospinal fluid eosinophilia and latex allergy by use of an “extracted” shunt. J Neurosurg Pediatr 2008; 1(3): 237 – 239.
74. Hashimoto M, Yokota A, Urasaki E, Tsujigami S, Shimono M. A case of abdominal CSF pseudocyst associated with silicone allergy. Childs Nerv Syst 2004; 20(10): 761 – 764.
75. Hussain NS, Wang PP, James C, Carson BS, Avellino AM. Distal ventriculoperitoneal shunt failure caused by silicone allergy. Case report. J Neurosurg 2005; 102(3): 536 – 539.
76. VandeVord PJ, Gupta N, Wilson RB, Vinuya RZ, Schaefer CJ, Canady AI et al. Immune reactions associated with silicone‑based ventriculo ‑ peritoneal shunt malfunctions in children. Biomaterials 2004; 25(17): 3853 – 3860.
77. Yamamoto S, Ohno K, Aoyagi M, Ichinose S, Hirakawa K. Calcific deposits on degraded shunt catheters: long‑term follow‑up of V ‑ P shunts and late complications in three cases. Childs Nerv Syst 2002; 18(1 – 2): 19 – 25.
78. Sotelo J. The hydrokinetic parameters of shunts for hydrocephalus might be inadequate. Surg Neurol Int 2012; 3 : 40.
79. Aschoff A, Biedermann D, Biedermann N, El Tayeh A, Ludwig J, Piotrowicz A. Intelligent design? Status and perspectives of hydrocephalus valves. Cerebrospinal Fluid Res 2006; 3 (Suppl 1): S58.
80. Lutz BR, Venkataraman P, Browd SR. New and improved ways to treat hydrocephalus: Pursuit of a smart shunt. Surg Neurol Int 2013; 4 (Suppl 1): S38 – S50.
81. Zabramski JM, Preul MC, Debbins J, McCusker DJ. 3T magnetic resonance imaging testing of externally programmable shunt valves. Surg Neurol Int 2012; 3 : 81.
82. Toma AK, Tarnaris A, Grieve JP, Watkins LD, Kitchen ND. Adjustable shunt valve‑induced magnetic resonance imaging artifact: a comparative study. J Neurosurg 2010; 113(1): 74 – 78.
83. Matushita H, Cardeal D, Pinto FC, Plese JP, de Miranda JS. The ventriculoomental bursa shunt. Childs Nerv Syst 2008; 24(8): 949 – 953.
84. Williams PL, Warwick R, Dyson M. The peritoneum. In: Williams PL, Dyson M (eds.) Gray’s anatomy. Churchill Livingstone 1989 : 1336 – 1347.
85. Tubbs RS, Wellons JC 3rd, Blount JP, Grabb PA, Oakes WJ. Referred shoulder pain from ventriculoperitoneal shunts. Report of three cases. J Neurosurg 2005; 102 (Suppl 2): 218 – 220.
86. Roth J, Sagie B, Szold A, Elran H. Laparoscopic versus non‑laparoscopic ‑ assisted ventriculoperitoneal shunt placement in adults. A retrospective analysis. Surg Neurol 2007; 68(2): 177 – 184.
87. Neale ML, Falk GL. In vitro assessment of back pressure on ventriculoperitoneal shunt valves. Is laparoscopy safe? Surg Endosc 1999; 13(5): 512 – 515.
88. Kala M. Hydrocefalus. Praha: Galén 2005.
89. Kunc Z. Neurochirurgie. 3. vydání. Praha: Avicenum 1983.
90. Plas J et al. Neurochirurgie. Praha: Galén ‑ Karolinum 2000.
91. Metellus P, Hsu W, Kharkar S, Kapoor S, Scott W, Rigamonti D. Accuracy of percutaneous placement of a ventriculoatrial shunt under ultrasonography guidance: a retrospective study at a single institution. J Neurosurg 2009; 110(5): 867 – 870.
92. Meyer FB. Atlas of neurosurgery. Philadelphia: Churchill Livingstone 1999.
93. Momin EN, Recinos PF, Coon AL, Rigamonti D. Use of intraoperative venography to guide the distal portion of a ventriculoatrial shunt past an obstruction in the central veins: technical case report. Neurosurgery 2010; 66 (Suppl Operative 6): 370 – 371.
94. Słowiński J, Stomal M, Skaba T, Pieniazek J, Mrówka R. Percutaneous ventriculoatrial shunt: experience with 179 cases. Neurol Neurochir Pol 2006; 40(3): 198 – 202.
95. McLone Dg. Comment. Neurosurgery 1993; 32 : 383.
96. Aoki N. Lumboperitoneal shunt: clinical applications, complications, and comparison with ventriculoperitoneal shunt. Neurosurgery 1990; 26(6): 998 – 1003.
97. Drake JM, Kestle JR, Milner R, Cinalli G, Boop F, Piatt J jr et al. Randomized trial of cerebrospinal fluid shunt valve design in pediatric hydrocephalus. Neurosurgery 1998; 43(2): 294 – 303.
98. Tuli S, Drake JM. Multiple shunt failures: an analysis of relevant features. Childs Nerv Syst 1999; 15(2 – 3): 79.
99. Barnes NP, Jones SJ, Hayward RD, Harkness WJ, Thompson D. Ventriculoperitoneal shunt block: what are the best predictive clinical indicators? Arch Dis Child 2002; 87(3): 198 – 201.
100. Garton HJ, Kestle JR, Drake JM. Predicting shunt failure on the basis of clinical symptoms and signs in children. J Neurosurg 2001; 94(2): 202 – 210.
101. Kim TY, Brown L, Stewart GM. Test characteristics of parent’s visual analog scale score in predicting ventriculoperitoneal shunt malfunction in the pediatric emergency department. Pediatr Emerg Care 2007; 23(8): 549 – 552.
102. Acakpo ‑ Satchivi L, Shannon CN, Tubbs RS, Wellons JC 3rd, Blount JP, Iskandar BJ et al. Death in shunted hydrocephalic children: a follow up study. Childs Nerv Syst 2008; 24(2): 197 – 201.
103. Iskandar BJ, Tubbs S, Mapstone TB, Grabb PA, Bartolucci AA, Oakes WJ. Death in shunted hydrocephalic children in the 1990s. Pediatr Neurosurg 1998; 28(4): 173 – 176.
104. Rekate HL. Comment. Neurosurgery 2001; 48(4): 770.
105. Brichtová E, Chlachula M, Hrbáč T, Lipina R. Endoscopic third ventriculostomy in previously shunted children. Minim Invasive Surg 2013; 2013 : 584567.
106. Neils DM, Wang H, Lin J. Endoscopic third ventriculostomy for shunt malfunction: What to do with the shunt? Surg Neurol Int 2013; 4 : 3.
107. Whitfield PC, Guazzo EP, Pickard JD. Safe removal of retained ventricular catheters using intraluminal choroid plexus coagulation. Technical note. J Neurosurg 1995; 83(6): 1101 – 1102.
108. Brydon HL, Hayward R, Harkness W, Bayston R. Does the cerebrospinal fluid protein concentration increase the risk of shunt complications? Br J Neurosurg 1996; 10(3): 267 – 273.
109. Brydon HL, Bayston R, Hayward R, Harkness W. The effect of protein and blood cells on the flow ‑ pressure characteristics of shunts. Neurosurgery 1996; 38(3): 498 – 504.
110. Schubert F, Fijen BP, Krauss JK. Laparoscopically assisted peritoneal shunt insertion in hydrocephalus: a prospective controlled study. Surg Endosc 2005; 19(12): 1588 – 1591.
111. Bryant MS, Bremer AM, Tepas JJ 3rd, Mollitt DL, Nquyen TQ, Talbert JL. Abdominal complications of ventriculoperitoneal shunts. Case reports and review of the literature. Am Surg 1988; 54(1): 50 – 55.
112. Komolafe EO, Adeolu AA, Komolafe MA. Treatment of cerebrospinal fluid shunting complications in a Nigerian neurosurgery programme. Case illustration and review. Pediatr Neurosurg 2008; 44(1): 36 – 42.
113. Cozzens JW, Chandler JP. Increased risk of distal ventriculoperitoneal shunt obstruction associated with slit valves or distal slits in the peritoneal catheter. J Neurosurg 1997; 87(5): 682 – 686.
114. Lazareff JA, Peacock W, Holly L, Ver Halen J, Wong A, Olmstead C. Multiple shunt failures : an analysis of relevant factors. Childs Nerv Syst 1998; 14(6): 271 – 275.
115. Popa F, Grigorean VT, Onose G, Popescu M, Strambu V, Sandu AM. Laparoscopic treatment of abdominal complications following ventriculoperitoneal shunt. J Med Life 2009; 2(4): 426 – 436.
116. Johnson MC, Maxwell MS. Delayed intrapleural migration of a ventriculoperitoneal shunt. Childs Nerv Syst 1995; 11(6): 348 – 350.
117. Thipphavong S, Kellenberger CJ, Rutka JT, Manson DE. Hepatic and colonic perforation by an abandoned ventriculoperitoneal shunt. Pediatr Radiol 2004; 34(9): 750 – 752.
118. Kim BJ, Cha SH, Park DJ, Song GS, Choi CH, Lee YW.A case of intracardiac migration of distal ventriculo ‑ peritoneal (V ‑ P) shunt catheter. J Korean Neurosurg Soc 2000; 29(2): 270 – 273.
119. Selcuklu A, Pasaoglu A, Akdemir H, Kurtsoy A, Kavuncu I. Migration of the peritoneal catheter of a ventriculoperitoneal shunt into the scrotum. Case report. Turk Neurosurg 1991; 2(1): 52 – 53.
120. Gupta SK, Jaiswal AK, Kumar S. Ventriculoperitoneal shunt catheter masquerading as ascariasis. J Clin Neurosci 2005; 12(8): 966 – 967.
121. Bani A, Telker D, Hassler W, Grundlach M. Minimally invasive implantation of the peritoneal catheter in ventriculoperitoneal shunt placement for hyrocephalus: analysis of data in 151 consecutive adult patients. J Neurosurg 2006; 105(6): 869 – 872.
122. Sridhar K, Karmarkar V. Peroral extrusion of ventriculoperitoneal shunt: case report and review of literature. Neurol India 2009; 57(3): 334 – 336.
123. Yavuz C, Demırtas S, Calıskan A, Kamasak K, Karahan O, Guclu O et al. Reasons, procedures, and outcomes in ventriculoatrial shunts: A single‑center experience. Surg Neurol Int 2013; 4 : 10.
124. Drucker MH, Vanek VW, Franco AA, Hanson M, Woods L. Thromboembolic complications of ventriculoatrial shunts. Surg Neurol 1984; 22(5): 444 – 448.
125. Kluge S, Baumann HJ, Regelsberger J, Kehler U, Gliemroth J, Koziej B et al. Pulmonary hypertension after ventriculoatrial shunt implantation. J Neurosurg 2010; 113(6): 1279 – 1283.
126. Haffner D, Schindera F, Aschoff A, Matthias S,Waldherr R, Schärer K. The clinical spectrum of shunt nephritis. Nephrol Dial Transplant 1997; 12(6): 1143 – 1148.
127. Choux M. Commentary. Surg Neurol 1995; 43(4): 323.
128. Kajimoto Y, Ohta T, Miyake H, Matsukawa M, Ogawa D, Nagao K et al. Posture‑related changes in the pressure environment of the ventriculoperitoneal shunt system. J Neurosurg 2000; 93(4): 614 – 617.
129. Lundkvist B, Eklund A, Kristensen B, Fagerlund M,Koskinen LO, Malm J. Cerebrospinal fluid hydrodynamics after placement of a shunt with an antisiphon device: a long‑term study. J Neurosurg 2001; 94(5): 750 – 756.
130. Choux M, Genitori L, Lang D, Lena G. Shunt implantation: reducing the incidence of shunt infection. J Neurosurg 1992; 77(6): 875 – 880.
131. Korinek AM, Fulla ‑ Oller L, Boch AL, Golmard JL,Hadiji B, Puybasset L. Morbidity of ventricular cerebrospinal fluid shunt surgery in adults: an 8‑year study. Neurosurgery 2011; 68(4): 985 – 994.
132. Kulkarni AV, Drake JM, Lamberti ‑ Pasculli M. Cerebrospinal fluid shunt infection: a prospective study of risk factors. J Neurosurg 2001; 94(2): 195 – 201.
133. Kestle JR, Garton HJ, Whitehead WE, Drake JM, Kulkarni AV, Cochrane DD et al. Management of shunt infections: a multicenter pilot study. J Neurosurg 2006; 105 (Suppl 3): 177 – 181.
134. Odio C, McCracken GH Jr, Nelson JD. CSF shunt infections in pediatrics. A seven‑year experience. Am J Dis Child 1984; 138(12): 1103 – 1108.
135. McGirt MJ, Zaas A, Fuchs HE, George TM, Kaye K,Sexton DJ. Risk factors for pediatric ventriculoperitoneal shunt infection and predictors of infectious pathogens. Clin Infect Dis 2003; 36(7): 858 – 862.
136. Tulipan N, Cleves MA. Effect of an intraoperative double‑gloving strategy on the incidence of cerebrospinal fluid shunt infection. J Neurosurg 2006; 104 (Suppl 1): 5 – 8.
137. Overturf GD. Defining bacterial meningitis and other infections of the central nervous system. Pediatr Crit Care Med 2005; 6 (Suppl 3): S14 – S18.
138. Parker SL, Attenello FJ, Sciubba DM, Garces ‑ Ambrossi GL, Ahn E, Weingart J et al. Comparison of shunt infection incidence in high‑risk subgroups receiving antibiotic ‑ impregnated versus standard shunts. Childs Nerv Syst 2009; 25(1): 77 – 83.
139. Sciubba DM, Lin LM, Woodworth GF, McGirt MJ,Carson B, Jallo GI. Factors contributing to the medical costs of cerebrospinal fluid shunt infection treatment in pediatric patients with standard shunt components compared with those in patients with antibiotic impregnated components. Neurosurg Focus 2007; 22(4): E9.
140. Kan P, Kestle J. Lack of efficacy of antibiotic ‑ impregnated shunt systems in preventing shunt infections in children. Childs Nerv Syst 2007; 23(7): 773 – 777.
141. Ritz R, Roser F, Morgalla M, Dietz K, Tatagiba M,Will BE. Do antibiotic ‑ impregnated shunts in hydrocephalus therapy reduce the risk of infection? An observational study in 258 patients. BMC Infect Dis 2007; 7(5): 38.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2014 Číslo 1
-
Všechny články tohoto čísla
- Význam elektromyografie v chirurgické rekonstrukci spasticity horní končetiny
- Stiff‑ person syndrom sdružený s myotonickou dystrofií 2. typu – kazuistika
- Parézy hlavových nervů a nekrotizující zánět zevního zvukovodu – dvě kazuistiky
- Úleva od neuropatické bolesti pomocí odvracení pozornosti – kazustika
- Lokální trombolýza u závažné formy trombózy mozkových žil a splavů – dvě kazuistiky
- Navždy prerušená vitalita profesora Daniela Bartka
- Entuziazmus neuropsychiatrie
- Webové okénko
-
Analýza dat v neurologii
XLIII. Grafy usnadňující studium zavádějících faktorů v asociačních studiích – I. Kategoriální data - Možnosti pohybových aktivit u pacientů s roztroušenou sklerózou mozkomíšní
- Upozornění na klasifikační, terminologické a obsahové inovace Mezinárodní klasifikace bolestí hlavy (ICHD-3 beta) pro primární bolesti hlavy
- Je dlouhodobá disabilita u roztroušené sklerózy spojena s difuzní mozkovou patologií nezávislou na relapsech?
- Predikce pooperačního stavu u spondylogenní cervikální myelopatie
- Validita Montrealského kognitivního testu pro detekci mírné kognitivní poruchy u Parkinsonovy nemoci
- Výsledky programu hluboké mozkové stimulace v Olomouci
- Nedostatečná antikoagulační terapie v primární prevenci kardioembolických cévních mozkových příhod – výsledky deskriptivní prevalenční studie
- Hodnocení kvality klinických doporučených postupů České neurologické společnosti ČLS JEP
- Chirurgická léčba hydrocefalu
- Kvantitativní měření krevního průtoku magistrálních tepen při operacích mozkových aneuryzmat
- Mezinárodní standardy pro neurologickou klasifikaci míšního poranění – revize 2013
- Intraspinální juxtaartikulární cysty bederní páteře
- Komentář ke článku Intraspinální juxtaartikulární cysty bederní páteře autorů Bludovský a spol.
- Mikrochirurgická léčba symptomatických pineálních cyst
- Česká verze Autonomic Scale for Outcomes in Parkinson’s Disease (SCOPA-AUT) – dotazníku k hodnocení přítomnosti a závažnosti příznaků autonomních dysfunkcí u pacientů s Parkinsonovou nemocí
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Mikrochirurgická léčba symptomatických pineálních cyst
- Chirurgická léčba hydrocefalu
- Stiff‑ person syndrom sdružený s myotonickou dystrofií 2. typu – kazuistika
- Mezinárodní standardy pro neurologickou klasifikaci míšního poranění – revize 2013


