Novinky ze světa NOAK – „Dienerovo pravidlo 1- 3- 6- 12“ a první antidotum s potvrzeným účinkem
Autoři:
prof. MUDr. Roman Herzig, Ph.D.; Feso; Fean
Působiště autorů:
Neurologická klinika, Komplexní cerebrovaskulární centrum, LF UK a FN Hradec Králové
Vyšlo v časopise:
Cesk Slov Neurol N 2015; 78/111(6): 729-731
Kategorie:
Zprávy z odborných akcí
„Nemocní s nevalvulární fibrilací síní (FS) mají pětinásobně vyšší riziko cévní mozkové příhody (CMP) oproti běžné populaci. CMP, k nimž dojde v souvislosti s FS, mají mnohem častěji fatální důsledky, vyčíslené jako 20% mortalita, či trvale invalidizující následky oproti CMP z jiných příčin.“ Tak uvedl 30. srpna 2015 neurolog prof. Hans‑ Christoph Diener z Universität Duisburg‑ Essen, SRN, v průběhu výročního kongresu European Society of Cardiology (ESC) sympozium podpořené společností Boehringer Ingelheim. Bylo věnováno novým perorálním antikoagulanciím (NOAK) a také prvnímu jejich antidotu pro rychlý zvrat účinku v urgentních situacích.
„Z registračních studií víme, že všechna NOAK – přímý inhibitor trombinu dabigatran i inhibitory faktoru Xa apixaban, edoxaban a rivaroxaban – jsou v prevenci CMP a systémového embolizmu (SE) účinné. Dabigatran 150 mg a apixaban prokázaly vůči dobře kontrolovanému warfarinu superioritu, ostatní jsou non‑inferiorní. Relativní riziko CMP/ SE bylo sníženo s dabigatranem 150 mg o 35 %, s apixabanem o 21 %,“ zrekapituloval prof. Diener.
Antikoagulační strategie u vysoce rizikových pacientů
Prof. Diener dále zdůraznil, že jako neurologa jej zajímá nejen účinnost, ale současně i bezpečnost NOAK. „V porovnání s dobře kontrolovaným warfarinem je relativní riziko závažných krvácení nižší s apixabanem o 31 %, s dabigatranem 110 mg o 20 %, s edoxabanem o 20 % a s dabigatranem 150 mg o 6 %. Rivaroxaban naopak ve studii toto riziko oproti warfarinu o 4 % zvyšoval,“ konstatoval prof. Diener a soustředil se na specifické rizikové subpopulace nemocných s FS.
Po předchozí CMP
Z metaanalýzy registračních studií s využitím Petovy metody pro kombinování poměrů šancí (Odds Ratio; OR) vyšlo pro vznik ischemické CMP/ SE u pacientů s FS a prokázanou CMP či tranzitorní ischemickou atakou (TIA) v anamnéze OR 0,85 ve prospěch NOAK celkově oproti warfarinu (konkrétně OR 0,75 ve prospěch dabigatranu 150 mg ve studii RE ‑ LY, OR 0,76 ve prospěch apixabanu ve studii ARISTOTLE, OR 0,84 ve prospěch dabigatranu 110 mg ve studii RE ‑ LY a OR 0,94 ve prospěch rivaroxabanu ve studii ROCKET ‑ AF).
S využitím stejné metody vyšlo pro vznik hemoragické CMP u pacientů s FS a prokázanou CMP či TIA v anamnéze OR 0,44 ve prospěch NOAK celkově oproti warfarinu (konkrétně OR 0,20 ve prospěch dabigatranu 110 mg ve studii RE ‑ LY, OR 0,31 ve prospěch dabigatranu 150 mg ve studii RE ‑ LY, OR 0,42 ve prospěch apixabanu ve studii ARISTOTLE a OR 0,73 ve prospěch rivaroxabanu ve studii ROCKET ‑ AF). „Samozřejmě se nejedná o výsledky srovnávacích head ‑ to ‑ head studií, proto tato data nelze interpretovat tak, že by nějaký lék byl horší nebo lepší než jiný,“ zdůraznil prof. Diener a dodal: „Obecně však potvrzují fakt, že NOAK jsou v sekundární prevenci CMP/ SE asociována s lepšími výsledky ve srovnání s dobře kontrolovaným warfarinem.“
Prof. Diener poté obrátil pozornost auditoria k dalšímu, pro klinickou praxi mimořádně významnému problému – kdy u pacientů s nevalvulární FS po prodělané ischemické CMP zahájit, resp. obnovit antikoagulaci? „K tomu neexistují exaktní data, protože tyto pacienty nelze randomizovat. Prezentované doporučení tedy vychází z mé osobní zkušenosti – říkejme jim třeba Dienerovo pravidlo 1 - 3 - 6 - 12,“ uvedl prof. Diener.
Kdy tedy podle jeho názoru zahájit nebo obnovit antikoagulaci po prodělané CMP či TIA?
- a) 1 den po události, pokud se jednalo o TIA;
- b) 3 dny po události, pokud se jednalo o lehkou CMP podle skóre National Institutes of Health Stroke Scale (NIHSS) < 8;
- c) 6 dnů po události, pokud se jednaloo středně závažnou CMP s NIHSS 8 – 16 a pokud je v 6. dnu magnetickou rezonancí (MR) či s výpočetní tomografií (CT) vyloučena hemoragická transformace ischemického iktu;
- d) 12 dnů po události, pokud se jednalo o těžkou CMP s NIHSS > 16 a pokud je ve 12. dnu MR či CT vyloučena hemoragická transformace ischemického iktu.
„Počet dnů od příhody podle její závažnosti je základní orientační kritérium, nikoli však jediné. Při rozhodování o dřívějším či pozdějším zahájení, resp. obnovení antikoagulace po prodělané CMP – od lehké až po těžkou – je nutno zvažovat další skutečnosti. Např. přítomnost mozkového infarktu na MR a jeho rozsah, riziko rekurence např. pro přítomnost trombu v srdci, předpokládanou nutnost chirurgických výkonů, např. provedení perkutánní endoskopické gastrostomie pro zajištění výživy či výkonu na karotidách, věk pacienta, klinickou stabilitu onemocnění nebo dosaženou míru kontroly hypertenze,“ zdůraznil prof. Diener.
Ve vyšším věku
Prof. Diener připomněl analýzu studie RE ‑ LY porovnávající výsledky dosažené s dabigatranem v prevenci CMP u pacientů s FS ve věku ≥ 80 let s těmi mladšími.
Účinnost obou dávek dabigatranu, tzn. 150 mg i 110 mg, byla u nejstarších pacientů ve shodě s výsledky celé studie RE ‑ LY. Konzistentní bylo snížení rizika intrakraniálního krvácení oproti warfarinu bez ohledu na věk, a to opět s oběma dávkami dabigatranu. Podobné bylo i vyšší riziko závažných krvácení s dabigatranem 150 mg a nižší riziko závažných i malých krvácení s dabigatranem 110 mg v subpopulaci nejstarších pacientů oproti warfarinu.
„I nejstarší pacienti s FS tedy měli stejný prospěch a stejnou míru rizika z léčby dabigatranem jako osoby mladší. V praxi je tedy možné se u této subpopulace rozhodovat stejně jako u všech ostatních nemocných s FS. Je‑li primárním cílem redukce rizika krvácení, je vhodnou volbou apixaban. Pokud ovšem primárně zvažujete snížení rizika CMP, pak je na místě dabigatran,“ dodal prof. Diener.
S chronickým onemocněním ledvin
O účinnosti a bezpečnosti NOAK v porovnání s dobře kontrolovaným warfarinem u pacientů s FS a se středně těžkou poruchou funkce ledvin (clearance kreatitin; CrCl) 30 – 49 ml/ min) vypovídají podle prof. Dienera rovněž analýzy registračních studií.
„V prevenci CMP/ SE nebylo v této subpopulaci pacientů žádné NOAK horší než warfarin. Dabigatran 150 mg však dokázal u těchto nemocných riziko dokonce snížit – relativní o 44 %, absolutní o 1,17 % ročně,“ uvedl prof. Diener.
Stejně tak ve snížení rizika závažných krvácení nebylo žádné NOAK horší než warfarin.
Apixaban a edoxaban byly přitom ještě bezpečnější. Apixaban snížil relativní riziko o 50 % a absolutní o 3,2 % ročně, p = 0,03. Edoxaban snížil relativní riziko o 25 %, absolutní o 1,3 % ročně, počet hodnocených subjektů ale nebyl dostatečný k dosažení statistické významnosti.
Závěrem této části prof. Diener zdůraznil, že podle doporučení ESC nejsou NOAK doporučována pacientům s těžkým renálním poškozením (CrCl < 30 ml/ min).
S diabetem mellitem
Ve studii RE ‑ LY bylo u nemocných s FS, kteří měli současně diabetes mellitus, identifikováno vyšší riziko CMP/ SE, ischemické CMP, úmrtí z vaskulárních příčin, úmrtí z jakékoli příčiny a také závažných krvácení. Nemocní s diabetem byli obecně mladší a častěji měli komorbidity v porovnání s nediabetickou populací.
V průběhu trvání studie RE ‑ LY diabetici antikoagulovaní warfarinem strávili statisticky významně kratší dobu v terapeutickém rozmezí TTR (65 vs. 68 %; p < 0,001).
Účinnost a bezpečnost dabigatranu v dané subpopulaci kopírovala celkové výsledky studie RE ‑ LY, podle prof. Dienera tedy nemají diabetici ve vztahu k indikaci dabigatranu žádná specifická omezení a naopak z jeho podávání profitují vzhledem ke svému obecně vyššímu riziku CMP více.
Prof. Diener shrnul své sdělení do tří bodů:
- U pacientů s FS po prodělané CMP nebo TIA zahajte léčbu co nejdříve dle pravidla 1 - 3 - 6-12.
- Pacienti s FS ve věku 80 let a starší s poruchou renálních funkcí nebo diabetem mají vysoké riziko CMP: pokud není kontraindikována, podejte jim antikoagulační léčbu.
- Klinické výhody dabigatranu oproti warfarinu byly prokázány v mnoha subpopulacích zahrnujících pacienty starší, s anamnézou CMP, poruchou renálních funkcí i diabetem.
Koagulaci lze urgentně obnovit i dnes ale s antidotem to bude rychlejší a snazší
„Historie antikoagulace má před sebou již třetí důležitý krok. Tím prvním byl příchod agonistů vitaminu K. Druhým krokem – po půlstoletí vlády warfarinu – byl nástup nových perorálních antikoagulancií, tzv. NOAK, jejichž éra se úspěšně rozvíjí. Třetím významným krokem bude, když ke stávajícímu NOAK přibude antidotum schopné v případě potřeby rychle zvrátit antikoagulační účinek. Registrace první takové protilátky je přede dveřmi a bude tím zahájena nová etapa antikoagulace a její kontroly,“ uvedl v další části sympozia prof. Charles V. Pollack z Perelman School of Medicine, University of Pennsylvania, USA.
Doložil, že při správném managementu lze zvratu antikoagulačního účinku NOAK dosáhnout již dnes. „V subpopulaci pacientů ve studii RE ‑ LY, kteří podstoupili urgentní chirurgický výkon, se míra incidence závažných krvácení nelišila mezi dávkami dabigatranu – 17,8 % s dabigatranem 110 mg a 17,7 % s dabigatranem 150 mg – a byla nižší než u warfarinizovaných pacientů – 21,6 %,“ připomněl prof. Pollack.
Při rozhodování, kdy a jak vysadit antikoagulaci před elektivními výkony, je podle něj zásadní jednak posouzení funkce ledvin, jejíž snížení může ovlivnit kapacitu pro vyloučení NOAK z organizmu, jednak provedení některého z koagulačních testů, jejichž využitelnost se však u různých NOAK liší (tab. 1). K dispozici jsou i standardní doporučení pro rychlý zvrat antikoagulace v urgentních případech (tab. 2).
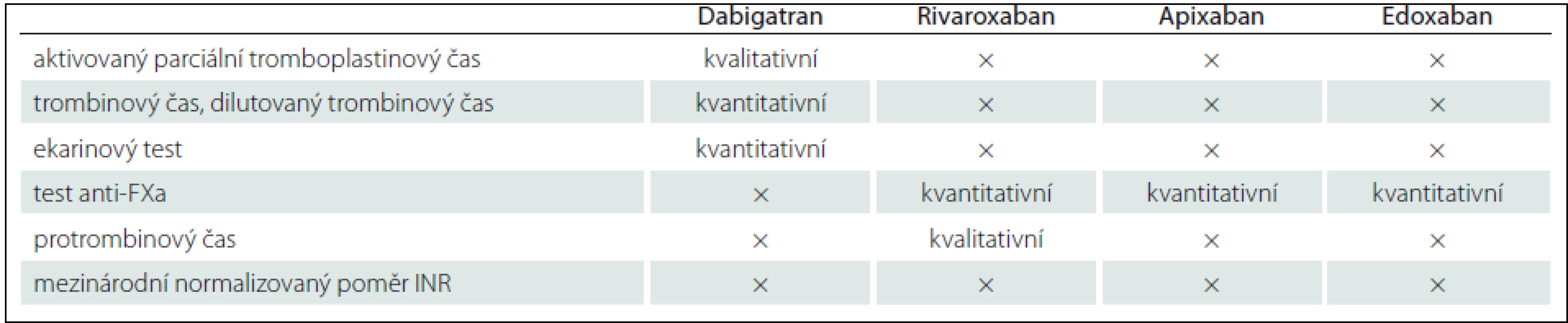
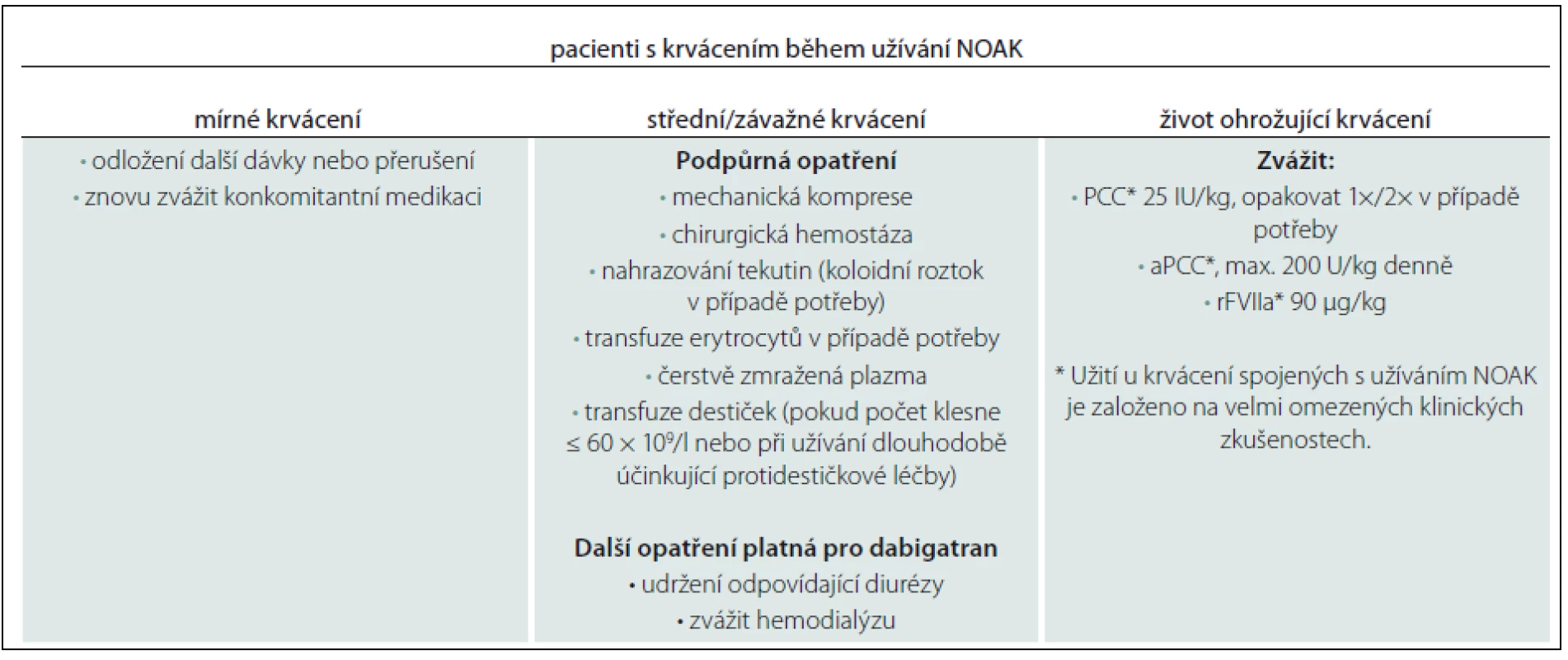
„Ideálem je samozřejmě NOAK s antidotem,“ uvedl prof. Pollack. „Jaké vlastnosti by taková protilátka měla mít? Nepochybně rychlý nástup účinku, setrvale stabilní působení... Celé bych to shrnul do jediné věty: musí umožnit lékařům soustředit se na životně nezbytné aspekty urgentní péče a nepřemýšlet o riziku krvácení.“
Podle prof. Pollacka je takových látek v klinickém zkoušení více. Nejdále je idarucizumab zaměřený specificky na zvrat účinku dabigatranu – přes klinickou studii fáze III dospěl již k podání žádosti o registraci Evropské lékové agentury (European Medicines Agency; EMA) i amerického úřadu pro potraviny a léky (Food and Drug Administration; FDA). V klinickém zkoušení fáze III je i andexanet alfa, který cílí na zvrat antikoagulačního účinku „ – xabanů“, tedy inhibitorů faktoru Xa. Studie fáze II probíhá s ciraparantagem, který má ambici stát se univerzálním antidotem všech NOAK.
Idarucizumab je humanizovaný fragment vázající antigen (Fab fragment), jehož vazebná afinita k trombinu je přibližně 350násobně vyšší, než má dabigatran. Při intravenózním podání dochází tedy k rychlému nástupu účinku (do 1 min) a látka má krátký poločas. Její účinnost ověřuje studie RE ‑ VERSE AD, která nemá žádná vylučovací kritéria. Předpokládá se, že zařadí až 300 dospělých pacientů užívajících dabigatran. Dosud bylo zařazeno 90 nemocných ve dvou skupinách – skupinu A (n = 51) tvořili nemocní s nekontrolovaným nebo život ohrožujícím krvácením (intrakraniálním, v důsledku traumatu po autonehodě apod.), skupinu B (n = 39) osoby vyžadující urgentní chirurgický nebo invazivní výkon.
Všichni obdrželi 5 g idarucizumabu intravenózně rozdělených do dvou infuzí podaných v rozmezí max. 15 min. Pacientům byly odebírány vzorky krve – bezprostředně po podaní první dávky idarucizumabu, po podání druhé dávky po 10 a 30 min a dále po 1, 2, 4, 12 a 24 hod.
Primárním cílem studie bylo zjistit stupeň zvratu antikoagulačního účinku dabigatranu během 4 hod od aplikace, přičemž jako ukazatele byly stanoveny dilutovaný trombinový čas (dTT) a ekarinový koagulační čas (ECT). Sekundární cíl zahrnoval podíl pacientů s úplnou normalizací dTT a ECT do 4 hod, pokles koncentrace volného dabigatranu v séru a celkové klinické hodnocení očetřujícím lékařem. Pro účely bezpečnosti byly nežádoucí účinky monitorovány po dobu 90 dnů od podání idarucizumabu a zahrnovaly podezření na trombotické příhody nebo úmrtí vaskulárního i nevaskulárního původu.
Ve studii RE ‑ VERSE AD bylo zatím hodnoceno 90 pacientů a bylo dosaženo primárního cíle. Jak konstatoval prof. Pollack, zvrat antikoagulačního účinku dabigatranu byl okamžitý již po podání první dávky idarucizumabu. Laboratorní testy provedené po 4 a 12 hod prokázaly normální hodnoty koagulace u téměř 90 % pacientů. Ve skupině pacientů, jejichž stav vyžadoval operaci nebo invazivní zákrok, byla normální hemostáza během výkonu potvrzena u 92 %. V souvislosti s podáním idarucizumabu nebyl zaznamenán jediný signál prokoagulačního efektu, trombotické příhody se vyskytly u pěti pacientů, z nichž žádný v době události neužíval antitrombotickou léčbu.
Jan Kulhavý
šéfredaktor AM Review
prof. MUDr. Roman Herzig, Ph.D., FESO, FEAN
Neurologická klinika,
Komplexní cerebrovaskulární centrum,
LF UK a FN Hradec Králové
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2015 Číslo 6
-
Všechny články tohoto čísla
- Nádory očnice
- Překrývání neurodegenerativních demencí
- Současný pohled na imunopatogenezi myasthenia gravis
- Roztroušená skleróza, neplodnost a její léčba
- Delirium u kriticky nemocných – prospektivní studie
- Poruchy srdečního rytmu u mladých pacientů s kryptogenní ischemickou cévní mozkovou příhodou
- Mobilita medianu před dekompresí karpálního tunelu a po ní
- Měření úrovně emočního uvědomění – pilotní studie ověřující základní psychometrické vlastnosti české verze Škály úrovně emočního uvědomění LEAS
-
Komentář k článku autorů Světlák et al.
Měření úrovně emočního uvědomění – pilotní studie ověřující základní psychometrické vlastnosti české verze Škály úrovně emočního uvědomění LEAS - Psychometrické vlastnosti české verze Epworthské škály spavosti
- Naše zkušenosti s chirurgickou léčbou tumorů periferních nervů
-
Komentář k článku autorů Sova et al.
Naše zkušenosti s chirurgickou léčbou tumorů periferních nervů - Kraniocervikální pneumatizace provázená neurologickou symptomatikou – kazuistika
- Časná rotace intratékální baklofenové pumpy – kazuistika
- Familiární amyloidová polyneuropatie – kazuistika
-
Komentář k článku autorů Pika et al.
Familiární amyloidová polyneuropatie – kazuistika - Webové okénko
-
Analýza dat v neurologii
LIV. Koncept atributivního rizika v analýze populačních studií – I. Aplikace v různých typech studií -
Péče o pacienty s dysfagií po cévní mozkové příhodě
Standard léčebného plánu - Novinky ze světa NOAK – „Dienerovo pravidlo 1- 3- 6- 12“ a první antidotum s potvrzeným účinkem
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Nádory očnice
-
Péče o pacienty s dysfagií po cévní mozkové příhodě
Standard léčebného plánu - Novinky ze světa NOAK – „Dienerovo pravidlo 1- 3- 6- 12“ a první antidotum s potvrzeným účinkem
- Psychometrické vlastnosti české verze Epworthské škály spavosti
