Simultánní vícečetné intracerebrální hemoragie
Simultaneous multiple intracerebral hemor rhages
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
S. Halúsková 1; D. Krajíčková 1; R. Dvořáková 2; M. Vališ 1
Působiště autorů:
Neurologická klinika LF UK, a FN Hradec Králové
1; Radiologická klinika LF UK, a FN Hradec Králové
2
Vyšlo v časopise:
Cesk Slov Neurol N 2019; 82(5): 583-585
Kategorie:
Dopis redakci
doi:
https://doi.org/10.14735/amcsnn2019583
Souhrn
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Vážená redakce,
intracerebrální hemoragie (ICH) je emergentní stav provázený signifikantní morbiditou a mortalitou, který je příčinou 10 – 20 % všech iktů [1]. Vzácnou kategorii představují simultánní vícečetné intracerebrální hemoragie (simultaneous multiple intracerebral hemorrhages; SMICH) s uváděnou prevalencí 0,8 – 5,7 % [2]. Jako SMICH hodnotíme přítomnost dvou nebo více akutních intraparenchymových hematomů lokalizovaných supra/ infratentoriálně v různých vaskulárních teritoriích, zjištěných při iniciálním zobrazení mozku [2,3]. Rizikové faktory a patofyziologické mechanizmy tohoto stavu nejsou jasně definovány, problémem je absence ustálené a jednotné etiologické klasifikace [4]. Proto jsou literární zprávy omezeny na několik málo studií, kazuistik či sérií případů s nekonzistentními soubory pacientů [1 – 3,5,6].
V centru vysoce specializované cerebrovaskulární péče FN v Hradci Králové (FNHK) bylo v období od 1. ledna 2016 do 31. prosince 2018 hospitalizováno celkem 205 nemocných s ICH, z nichž pouze jeden případ jsme hodnotili jako SMICH.
Prezentujeme kazuistiku 76letého vysokoškolsky vzdělaného aktivního muže s anamnézou léčené arteriální hypertenze, dyslipidémie, ischemické choroby srdeční a opakovaných intervencí pro ischemickou chorobu dolních končetin, který byl 3. 2. 2017 přeložen na iktové oddělení Neurologické kliniky FNHK z nemocnice v Annecy ve Francii. Tam byl přijat 25. 1. 2017 po pádu na lyžích s těžkou pravostrannou hemiparézou, úraz hlavy nebyl referován a známky úrazu nebyly zjištěny ani na akutní CT mozku, která zobrazila dvě ICH – temporálně vpravo velikosti 45 × 25 mm a parietálně vlevo 37 × 20 mm, 1. 2. 2017 doplněná MR navíc prokázala starší drobný hematom v levém mozečkovém pedunkulu, subchronický subdurální hematom (SDH) frontotemporálně vlevo velikosti 11 mm bez expanzivního chování a suspektní drobné subarachnoidální krvácení frontálně vlevo (obr. 1 A – D). Při přijetí k nám přetrvávala pravostranná hemiparéza s plegií dolní končetiny, psychomotorické tempo bylo zpomalené, pacient trpěl nočními halucinacemi. Kontrolní MR vyšetření 16. 2. 2017 při srovnání s cizími snímky zobrazilo stacionární subakutní ICH temporálně vpravo a parietálně vlevo s malým perifokálním vazogenním edémem, stacionární 6 mm drobný depozit hemosiderinu v oblasti mezencefala vlevo, obdobné ložisko okcipitálně vpravo a subependymálně nad cella media pravé postranní komory a prakticky stacionární subchronický SDH frontotemporálně vlevo. Byla patrná mírná difuzní mozková atrofie a vícečetná drobná nejspíše postischemická ložiska supratentoriálně v paraventrikulárních vrstvách bílé hmoty až splývajícího charakteru a při frontálních rozích. MRA zdroj krvácení neprokázala (obr. 1 E, F). Další klinický vývoj byl příznivý, při soustavné rehabilitaci se zlepšovala hybnost pravostranných končetin, ke konci pobytu byl pacient úspěšně vertikalizován do vysokého chodítka, psychomotorické tempo bylo přiměřené, halucinace odezněly. Po celou dobu hospitalizace byla arteriální hypertenze dobře korigována malou dávkou inhibitoru angiotenzin konvertujícího enzymu, výsledky základního koagulačního vyšetření byly normální, nebyly patrny žádné známky kognitivního deficitu. Po navazujících opakovaných ústavních rehabilitačních pobytech byl pacient ke konci roku schopen absolvovat 18 km pěší výlet a aktivní, bez vývoje kognitivního deficitu, zůstával i nadále. Kontrolní MR vyšetření s odstupem 2, 4 a 16 měsíců od začátku onemocnění (obr. 2 A – F) dokumentovala obvyklý vývoj ložisek hemoragie, bez nových projevů krvácení či progrese postischemických ložisek supratentoriálně, MRA nadále bez průkazu cévní malformace.
Fig. 1. First brain MRI and MRA; February 1, 2017 (Hospital in Annecy, France). A+B intracerebral hemorrhage in the right temporal lobe
(A – Flair sequence, B – T1 weighted sequence); C+D intracerebral hemorrhage in the left frontoparietal region (C – Flair sequence,
D – T1 weighted sequence); E+F 3D TOF-MRA MIP recon
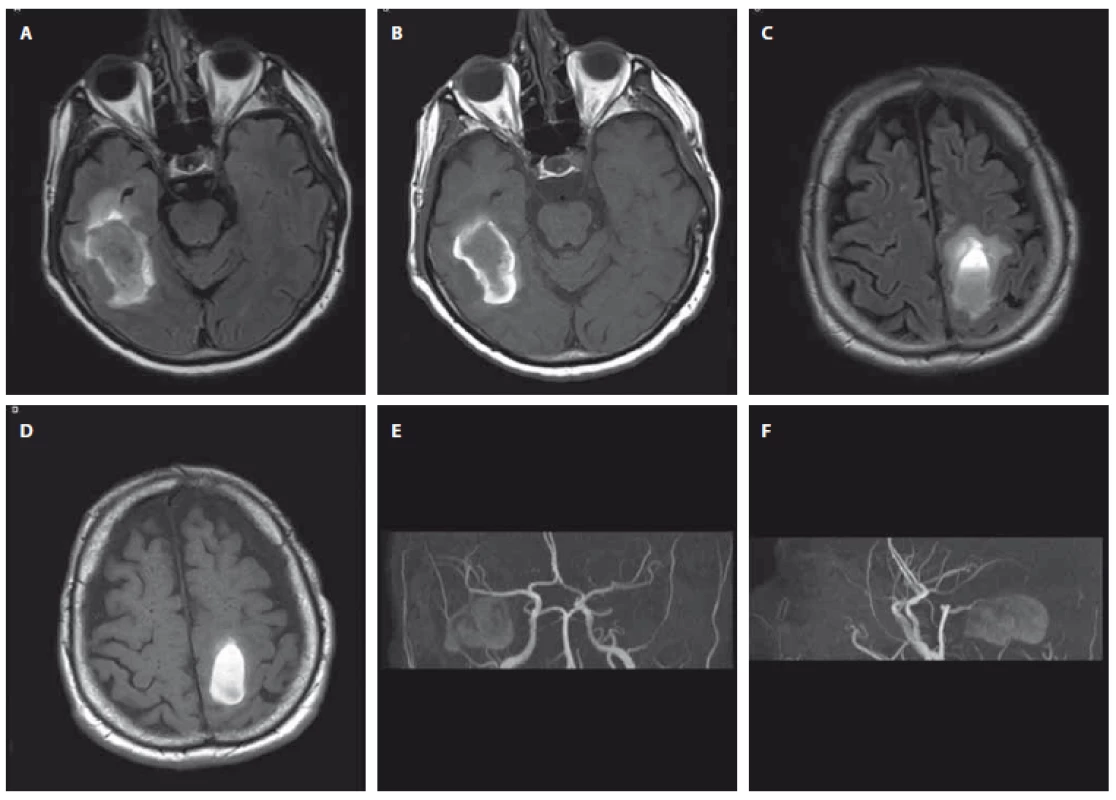
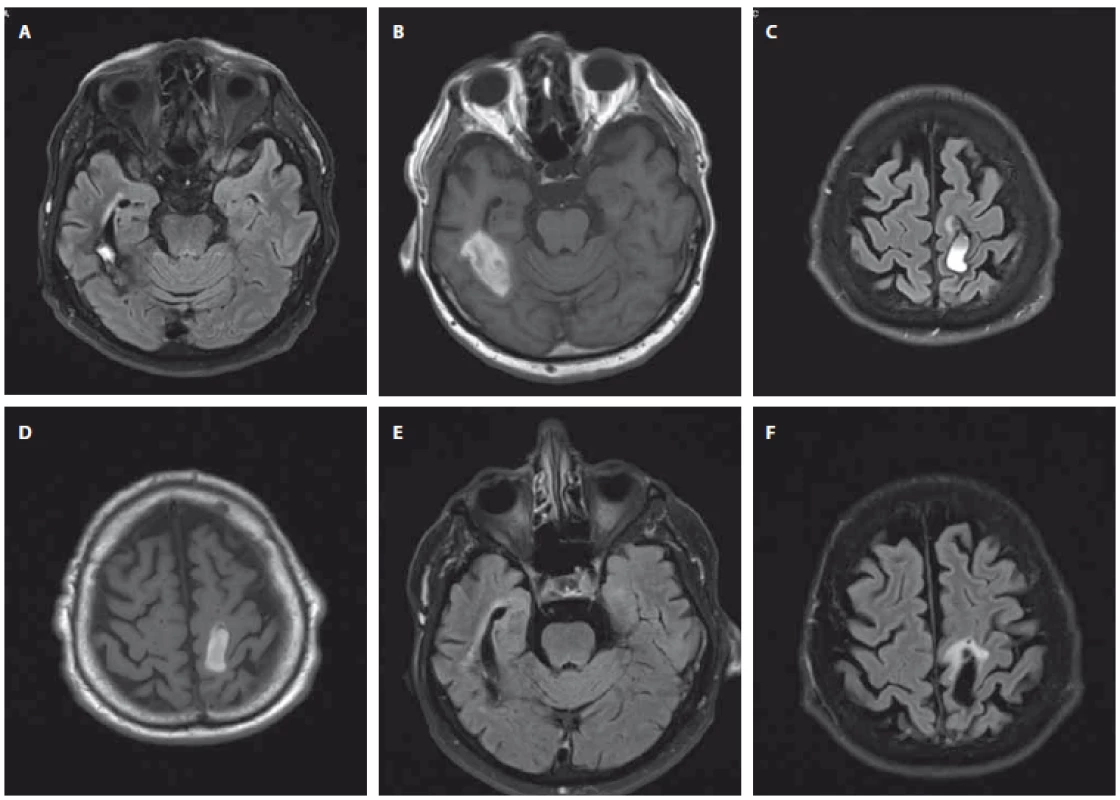
Fig. 2. Control brain MRI; May 10, 2017 (A–D) and May 21, 2018 (E, F) (University Hospital Hradec Králové). A+B intracerebral hemorrhage
in the right temporal lobe (A – Flair sequence, B – T1 weighted sequence); C+D intracerebral hemorrhage in the left frontoparietal
region (C – Flair sequence, D – T1 weighted sequence); E intracerebral hemorrhage in the right temporal lobe (Flair sequence); F intracerebral
hemorrhage in the left frontoparietal region (Flair sequence).
Pro relativně periferní uložení atypicky lokalizovaných ICH jsme v diferenciální diagnostice pomýšleli i na možnost krvácení do patologického terénu, onkoskríning (UZ břicha, RTG plic, vyšetření prostaty) však vyzněl negativně. Grafický nález připouštěl i možnost cerebrální amyloidové angiopatie (CAA), což je onemocnění vyššího věku projevující se recidivujícím mozkovým krvácením. Může se jednat o asymptomatická mikrokrvácení, ale také rozsáhlé lobární hemoragie. I když k určení definitivní diagnózy je nutný histologický rozbor bioptického vzorku, současné moderní zobrazovací techniky umožňují diagnostikovat tzv. „pravděpodobnou“ CAA [7]. Vzhledem k neobjasněné etiologii vícečetných ICH u našeho pacienta jsme se rozhodli i navzdory finanční náročnosti doplnit PET/ CT vyšetření s radiofarmakem, v našem případě se jednalo o 18F-flutemetamol, které umožňuje stanovení denzity beta-amyloidových neuritických plak v šedé hmotě mozku in vivo. V ČR je dostupné od léta 2015 a jeho provedení indikuje superkonziliární pracoviště u dospělých pacientů s kognitivní poruchou, kteří jsou vyšetřováni pro podezření na demenci Alzheimerova typu. Význam spočívá především ve spolehlivém potvrzení onemocnění již v časných, častokrát klinicky nejednoznačných stadiích, a diferenciální diagnostice různých typů demencí [8,9]. Vyšetření se nám v dubnu 2019 podařilo realizovat ve speciální ojedinělé indikaci i při intaktní kognici u našeho pacienta a výsledek byl očekávaně negativní.
V posledních letech se problematikou SMICH zabývalo několik prací, především z pohledu klinických a radiologických charakteristik, rizikových faktorů a možných mechanizmů vzniku. Značná část publikací je věnována porovnání outcome a prognózy u pacientů se SMICH a solitární ICH (sICH). Příkladem je finsko-australská studie, ve které splňovalo kritéria pro SMICH 5,9 % nemocných z celkového počtu 1 492 ICH. Patogeneticky byly SMICH hodnoceny podle tzv. SMASH-U klasifikace (Structural lesion, Medication related, Amyloid angiopathy, Systemic disease, Hypertension, Undetermined) [4]. Pacienti se SMICH měli v porovnání se skupinou sICH častěji CAA (32 vs. 23 %), krvácení vzniklé v souvislosti s užívanou medikací (16 vs. 14 %), systémová onemocnění (12 vs. 3 %) a cévní abnormality (6 vs. 4 %), s nižším zastoupením hypertonické angiopatie (20 vs. 37 %) a neurčených příčin (14 vs. 18 %). Mezi oběma analyzovanými soubory nebyl zjištěn významný rozdíl v 90denní mortalitě (37 vs. 35 %) [2]. Podobnou incidenci 5,4 % ze 313 ICH uvádí japonská studie, přestože jako SMICH hodnotila krvácení pouze v lokalizacích typických pro hypertonická krvácení. Funkční výsledek těchto nemocných hodnocený při propuštění nebyl rozdílný od ostatních ICH (modifikovaná Rankinova škála [mRS] 0 – 2 : 29,4 vs. 18,2 %; mRS 3 – 6 : 70,6 vs. 81,8 %) [5]. Naproti tomu francouzská studie s 5,7 % SMICH v souboru 562 ICH uvádí významně vyšší „in-hospital“ mortalitu pacientů se SMICH (65,6 vs. 42,5 %), u 59 % SMICH nebyla příčina objasněna [3]. Nejčastější lokalizací SMICH v souboru 105 případů publikovaných v letech 1950 – 2013 byla bazální ganglia (45,8 %) a talamus (30,6 %), nejhorší prognózu měla oboustranná krvácení v bazálních gangliích [1].
Náš nemocný představuje zajímavý příklad kombinace pravděpodobně traumatického SDH nejasného stáří a atypických simultánních ICH, jejichž etiologii se nám nepodařilo objasnit. Výsledek PET, který nepotvrdil CAA jako možnou příčinu SMICH, je pro našeho pacienta významný v tom, že jej zbaví obav z možného dalšího vývoje onemocnění.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Simona Halúsková
Neurologická klinika
FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: sim.haluskova@gmail.com
Přijato k recenzi: 6. 6. 2019
Přijato do tisku: 6. 9. 2019
Zdroje
1. Laiwattana D, Sangsawang B, Sangsawang N. Primary multiple simultaneous intracerebral hemorrhages between 1950 and 2013: analysis of data on age, sex and outcome. Cerebrovasc Dis Extra 2014; 4(2): 102 – 114. doi: 10.1159/ 000362111.
2. Wu TY, Yassi N, Shah DG et al. Simultaneous Multiple Intracerebral Hemorrhages (SMICH). Stroke 2017; 48(3): 581 – 586. doi: 10.1161/ STROKEAHA.116.015186.
3. Chen Y, Hénon H, Bombois S et al. Multiple simultaneous spontaneous intracerebral hemorrhages: a rare entity. Cerebrovasc Dis 2016; 41(1 – 2): 74 – 79. doi: 10.1159/ 000442475.
4. Meretoja A, Strbian D, Putaala J et al. SMASH-U: a proposal for etiologic classification of intra-cerebral hemorrhage. Stroke 2012; 43(10): 2592 – 2597. doi: 10.1161/ STROKEAHA.112.661603
5. Yamaguchi Y, Takeda R, Kikkawa Y et al. Multiple simultaneous intracerebral hemorrhages: clinical presentations and risk factors. J Neurol Sci 2017; 383 : 35 – 38. doi: 10.1016/ j.jns.2017.10.005.
6. Seo JS, Nam TK, Kwon JT et al. Multiple spontaneous simultaneous intracerebral hemorrhages. J Cerebrovasc Endovasc Neurosurg 2014; 16(2): 104 – 111. doi: 10.7461/ jcen.2014.16.2.104.
7. Bano S, Yadav SN, Garga UC et al. Sporadic cerebral amyloid angiopathy: an important cause of cerebral hemorrhage in the elderly. J Neurosci Rural Pract 2011; 2(1): 87 – 91. doi: 10.4103/ 0976-3147.80107.
8. Anand K, Sabbagh M. Amyloid imaging: poised for integration into medical practice. Neurotherapeutics 2017; 14(1): 54 – 61. doi: 10.1007/ s13311-016-0474-y.
9. Raposo N, Sonnen JA. Amyloid-PET in cerebral amyloid angiopathy: detecting vascular amyloid deposits, not just blood. Neurology 2017; 89(14): 1437 – 1438. doi: 10.1212/ WNL.0000000000004548.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2019 Číslo 5
-
Všechny články tohoto čísla
- Kompresivní neuropatie jako nemoc z povolání
- Refrakterní myastenia gravis – klinická charakteristika a možnosti biologické léčby
- Úloha pohybovej aktivity v liečbe pacientov s Parkinsonovou chorobou
- Změna struktury paraspinálních svalů u pacientů s chronickými nespecifickými bolestmi dolní části zad
- Léčba nespavosti při neuropatické bolesti
- Význam kolaterální cirkulace u akutní okluze arteria basilaris
- Jiný pohled na inhibitor agregace krevních destiček klopidogrel – vhodné antiedematikum v předklinickém modelu poranění mozku?
- Možnosti stanovení likvorového tripletu tau proteinů a β-amyloidu 42 metodami ELISA a orientační normativní vodítka
- Endoskopické operace výhřezu bederních meziobratlových plotének – první zkušenosti
- CRP stanovený vysoce senzitivní metodou u pacientů s ichemickou cévní mozkovou příhodou – od rizikových faktorů po vývoj
- Pegylovaný interferon beta 1-a v klinické praxi
- Kongenitální fibróza zevních okohybných svalů u české rodiny a její molekulárně genetická příčina
- Rozsáhlý cervikální hematom po minimálním traumatu
- Perinatální paréza brachiálního plexu na podkladě avulze, řešená konzervativně
- Plicní arteriovenózní malformace jako vzácná příčina ischemické cévní mozkové příhody
- Akutní amnestický syndrom při bilaterální lézi hipokampů jako raritní projev CMP
- Perforace jícnu způsobená dislokovanou krční dlahou pět let po operaci krční páteře – vzácná komplikace
- Závažné vaskulopatie u neurofibromatózy typu 1
- Simultánní vícečetné intracerebrální hemoragie
- Analýza dat v neurologii LXXVII. Korelační analýza vícerozměrných souborů kvantitativních dat – příklady
- Recenze knih
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Léčba nespavosti při neuropatické bolesti
- Kompresivní neuropatie jako nemoc z povolání
- Změna struktury paraspinálních svalů u pacientů s chronickými nespecifickými bolestmi dolní části zad
- Endoskopické operace výhřezu bederních meziobratlových plotének – první zkušenosti
