Glioblastom grade IV – dlouhodobé přežití
Glioblastoma grade IV – long-term survival
The Editorial Board declares that the manu script met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
L. Smetanová 1; P. Ryška 2; P. Malá 3; A. Kohout 4; M. Vališ 5
Působiště autorů:
Rehabilitační klinika, LF UK a FN Hradec Králové
1; Radiologická klinika, LF UK a FN Hradec Králové
2; Klinika onkologie a radioterapie, FN Hradec Králové
3; Fingerlandův ústav patologie, FN Hradec Králové
4; Neurologická klinika, LF UK a FN Hradec Králové
5
Vyšlo v časopise:
Cesk Slov Neurol N 2020; 83/116(3): 332-334
Kategorie:
Dopis redakci
doi:
https://doi.org/10.14735/amcsnn2020332
Souhrn
The Editorial Board declares that the manu script met the ICMJE “uniform requirements” for biomedical papers.
Vážená redakce,
glioblastom je nejčastější a nejagresivnější primární mozkový nádor. Vzniká de novo z gliových buněk CNS (primární glioblastom) nebo jde o sekundární nádor vznikající maligní transformací nižších gliomů [1]. Incidence je 3–4 případy na 100 000 obyvatel/rok [1,2]. Věk pacientů se pohybuje v rozmezí 45–75 let [2]. Charakteristickým nálezem na MR mozku je expanzivní růst s centrálními nekrózami a perifokálním edémem [2]. Navzdory agresivní kombinované strategii léčby, zahrnující radikální resekci tumoru, radioterapii a adjuvantní chemoterapii (temozolomidem), je prognóza nepříznivá pro vysokou mortalitu. Medián přežití je 12–18 měsíců [1–6]. Většina pacientů umírá do 3 let. Přežití delší než 10 let je raritní [4,7].
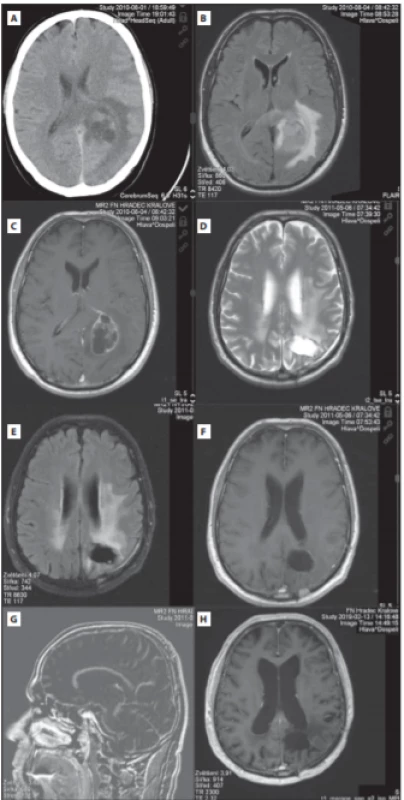
Prezentujeme případ nekuřáka s arteriální hypertenzí a benigní hyperplazií prostaty, který od 31. července 2010 (v 68 letech) pociťoval tupý tlak v hlavě, neobratnost, zhoršenou hybnost a sníženou citlivost pravostranných končetin. Pro CT nález multilokulárních expanzí vlevo s velkým perifokálním edémem parietookcipitálně a částečně i frontálně i temporálně vlevo (obr. 1A) byl přijat na neurologickou kliniku. Provedené RTG srdce a plic a UZ břicha bylo bez metastatického postižení. Na MR mozku byla popsána objemná cystická expanze parietálně a částečně okcipitálně vlevo (40 × 35 × 45 mm), po podání kontrastní látky se opacifikovala tenká stěna (obr. 1B, C). Perifokální vazogenní edém postihoval zejména parietální, méně okcipitální lalok. Vzhledem k nálezu na MR bylo uvažováno o anaplastickém astrocytomu, eventuálně glioblastomu, zvažována byla i možnost cystické solitární metastázy. Bakteriální absces byl vyloučen. Byla zahájena perorální antiedematózní terapie kortikoidy. Pacient byl propuštěn do domácího prostředí.
Fig. 1. (A) Preoperative brain CT with cystic
expansion in the left occipital lobe with
perifocal edema. (B,C) Preoperative brain MRI
with cystic expansion in the left occipital lobe
(FLAIR and post-contrast T1). (D–G) Control
MR (June 2011) with non-collapsed resection
cavity (D-axial T2 image, E-axial FLAIR, F- postcontrast T1, axial, G-sagittal subtracted image,
i.e. resulting from subtracting T1 native from
the contrast T1 image). The examination
shows only linear type of opacification of
the resection cavity edge, which belongs to
a benign type of opacifi cation. No nodular
type of opacifi cation has been demonstrated
to indicate the presence of tumor residue or
recurrence. Furthermore, traction changes
are present relative to the occipital corner of
the left lateral ventricle. (H) Control brain MRI
after 9 years (post-contrast T1 image) without
clear tumor residuum with post-radiation
changes in the white matter.
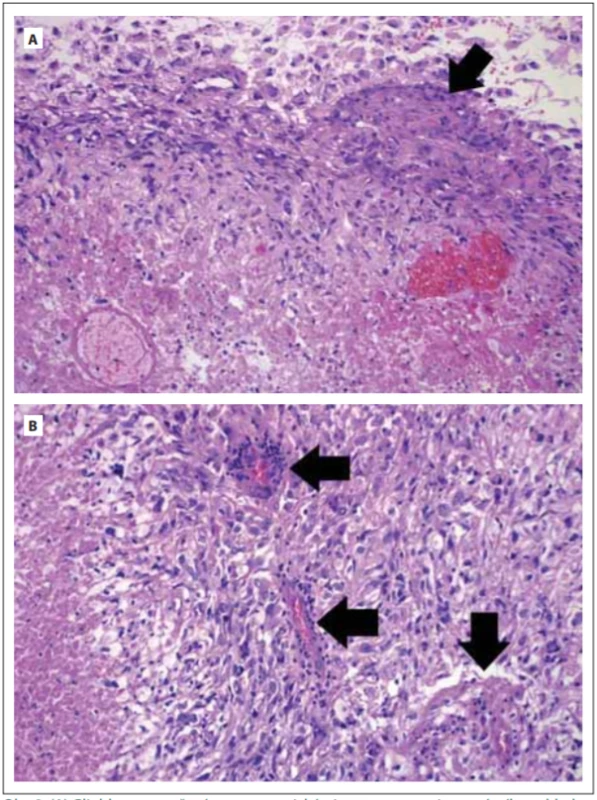
Následně byla 11. srpna 2010 na neurochirurgické klinice provedena parietookcipitální kraniotomie vlevo s makroskopicky radikální resekcí tumoru. Dle peroperační biopsie šlo o high-grade glioblastom. Pooperační MR mozku bylo bez rezidua. Byla provedena neuronavigace před plánovanou radioterapií. Porucha paměti a pravostranné oslabení s ataxií přetrvávaly i pooperačně. Dle histologického vyšetření nález splňoval kritéria pro diagnózu glioblastomu grade IV dle Světové zdravotnické organizace (WHO) (obr. 2A, B). Za hospitalizace na onkologické klinice 30. srpna až 12. října 2010 absolvoval adjuvantní radioterapii na oblast kavity s lemem 25 mm v dávce CD 50Gy/25fr. parieto-okcipitálně vlevo a následně boost LD 10Gy/5fr. na kavitu s lemem 15 mm, vzhledem k věku bez potenciace chemoterapií. Radioterapie byla provedena brzdným svazkem 6MV na lineárním urychlovači Varian Clinac (Varian Medical Systems, Palo Alto, CA, USA) s využitím 3 polí technikou 3D konformní. Při kortikoterapii se rozvinul diabetes mellitus s nutností inzulinoterapie. Radioterapii pacient snesl bez potíží, postupně se vysazovaly perorální kortikoidy a inzulín, zůstala pouze udržovací dávka kortikoidu.
Fig. 2. (A) Glioblastoma composed of highly atypical astrocytes with gemistocytic features (top). Focus of endothelial proliferation is present (arrow) as well as area of necrosis
(bottom). (B) Glioblastoma is composed of highly atypical astrocytes showing multiple
foci of endothelial proliferation (arrows) and area of necrosis (left). Haematoxylin-eosin.
Magnifi cation 200×.
V listopadu 2010 byl pacient hospitalizován na interní klinice pro bilaterální plicní embolii při nižší pohybové aktivitě a onkologické diagnóze. Od listopadu 2010 do dubna 2011 pacient absolvoval 6 sérií adjuvantní chemoterapie temozolomidem (v dávce 150 mg/m2/den, 5 dnů každý 28. den cyklu). Chemoterapii při současné antiemetické léčbě snášel dobře.
Kontrolní MR mozku prováděná každé 3–4 měsíce do června 2016 a následně přibližně každý půl rok neprokázaly recidivu tumoru. V květnu 2011 byly nově prokázány postiradiční změny paraventrikulární bílé hmoty vlevo parietookcipitálně (obr. 1D–G). V dubnu 2012 i několik postischemických ložisek v paraventrikulární zóně bílé hmoty obou hemisfér a v oblasti pontu. V září 2013 bylo provedeno 2. čtení histologického vzorku s potvrzením diagnózy glioblastomu.
V srpnu 2018, 8 let po operaci glioblastomu, byl pro celkové zhoršení stavu se zmateností, poruchou chůze a komunikace přijat na neurologickou kliniku. Byla vyloučena interní etiologie obtíží a během krátké hospitalizace došlo k jejich odeznění. Stav byl uzavřen jako amentní stav s přechodnou poruchou řeči bez průkazu na MR recidivy tumoru či ischemických změn. V uspokojivém stavu byl propuštěn do domácího prostředí. Neuropsychologické vyšetření v prosinci 2018 (v 76 letech) zjistilo středně těžkou demenci (Mini-Mental State Examination 19/30 bodů, Addenbrookský kognitivní test 48/100 bodů) výrazně limitující pacienta v běžných denních aktivitách. Poslední MR v únoru 2019 (9 let od diagnózy) neprokázalo recidivu tumoru (obr. 1H).
Na péči o pacienta s glioblastomem se podílí multioborový tým s účastí neurologa, neurochirurga a onkologa [2]. Důležité je včasné stanovení diagnózy a zahájení léčby s maximální radikalitou resekce. Je doporučováno vyšetření mutace IDH1/2 (izocitrát dehydrogenázy), kodelece 1p/19q a metylace MGMT (O6-metylguanin-DNA metyltransferáza), avšak zatím bez ovlivnění postupu léčby [8]. Tato vyšetření u námi prezentovaného pacienta nebyla provedena.
U glioblastomu představují pacienti s dlouhodobým přežitím velmi unikátní skupinu. Systematické review literatury s cílem prezentovat všechny případy 10letého a delšího přežití pacientů s glioblastomem (32 studií se 162 pacienty) provedli Tykocki et al [6]. Průměrné celkové přežití bylo 15,9 ± 6,3 let a přežití bez recidivy (progression free survival; PFS) 11,9 ± 5,6 let. Nejdelší přežití bylo 34 let a 81 pacientů žilo déle než 14 let [6]. Dva případy PFS delšího než 10 let popsali Yoshida et al [7] a 22leté přežití Caruso et al [4]. V literatuře jsou i další případy více než 20letého přežití [4]. Gately et al [9] provedli retrospektivní studii (7leté období) ke zjištění klinických prediktivních faktorů pro dlouhodobé přežití pacientů s glioblastomem. Dva a více roků přežilo 154 (20 %) z 776 pacientů s glioblastomem, z nich 20 % (32 pacientů) přežilo alespoň 5 let, tj. 4 % všech pacientů. Medián času do recidivy byl 20,1 měsíců od diagnózy, přičemž 51 pacientů (46 %) podstoupilo druhou kraniotomii a další léčbu. Malé procento dlouhodobě přeživších podstoupilo 3 a více kraniotomií [5]. Prognosticky příznivé klinické faktory jsou mladší věk a dobrý stav pacienta, resekce tumoru, chemoradioterapie a hypermetylace MGMT promotoru [1,3,5–7]. Avšak vyšší věk ani nepřítomnost metylace MGMT promotoru nevylučují dlouhodobé přežití [3]. Delší PFS je významný prediktor přežití, ovšem s výjimkami. Nebyla prokázána asociace mezi socioekonomickými, environmetálními a pracovními faktory a dlouhodobým přežitím [3]. Klinický průběh se zdá být nepředvídatelný [6].
Dle publikovaného review [9] 85 % dlouhodobě přeživších s glioblastomem trpělo neurologickým deficitem – hemiparézou, poruchou řeči. Kognitivní poškození bylo u 40–100 % pacientů, psychologické symptomy (úzkost, deprese) udávalo 30–35 % pacientů [9].
U námi prezentovaného pacienta s glioblastomem jde o dlouhodobé přežití v celkově dobrém stavu, bez výrazného neurodeficitu, bez recidivy tumoru, a to po standardní léčbě. Postupně došlo k rozvoji demence, a tím závislosti na okolí.
Skutečnost, že existují případy dlouhodobého přežití bez recidivy nádoru, by měla být podnětem k pokračování výzkumného snažení s cílem najít účinnou strategii léčby tohoto zhoubného nádoru.
Grantová podpora
Podpořeno MZ ČR – RVO (FNHK, 00179906) a programem PROGRES Q40. Podporováno projektem: PERSONMED – Centrum pro rozvoj personalizované medicíny u nemocí souvisejících s věkem, reg. Nr. CZ.02.1.01/0.0/0.0/17_048/0007441, spolufinancované z ERDF a státního rozpočtu ČR.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Libuše Smetanová, Ph.D.
Rehabilitační klinika LF UK a FN Hradec Králové
Nezvalova 265
500 03 Hradec Králové
e-mail: libuse.smetanova@fnhk.cz
Přijato k recenzi: 5. 10. 2019
Přijato do tisku: 27. 2. 2020
Zdroje
1. Polívka J, Polívka J Jr, Rohan V et al. Multiformní glioblastom – přehled nových poznatků o patogenezi, biomarkerech a perspektivách léčby. Cesk Slov Neurol N 2013; 76/109 (5): 575–583.
2. Burkoň P, Lakomý R, Burkoňová D et al. Konkomitantní chemoradioterapie a cílená biologická léčba u glioblastoma multiforme. Cesk Slov Neurol N 2010; 73/106 (5): 503–509.
3. Krex D, Klink B, Hartmann C et al. Long-term survival with glioblastoma multiforme. Brain 2007; 130 (Pt 10): 2596–2606. doi: 10.1093/brain/awm204.
4. Caruso R, Pesce A, Wierzbicki V. A very rare case report of long-term survival: a patient operated on in 1994 of glioblastoma multiforme and currently in perfect health. Int J Surg Case Rep 2017; 33 : 41–43. doi: 10.1016/j.ijscr.2017.02.025.
5. Gately L, McLachlan SA, Philip J et al. Long-term survivors of glioblastoma: a closer look. J Neurooncol 2018; 136 (1): 155–162. doi: 10.1007/s11060-017-2635-1.
6. Tykocki T, Eltayeb M. Ten-year survival in glioblastoma. A systematic review. J Clin Neurosci 2018; 54 : 7–13. doi: 10.1016/j.jocn.2018.05.002.
7. Yoshida T, Kawano N, Oka H et al. Clinical cure of glioblastoma – two case reports. Neurol Med Chir (Tokyo) 2000; 40 (4): 224–229. doi: 10.2176/nmc.40.224.
8. Kramář F, Minárik M, Belšánová B et al. Genetické a epigenetické faktory podmiňující vznik a prognózu mozkových gliomů – souhrn současných poznatků. Cesk Slov Neurol N 2016; 79/112 (4): 400–405. doi: 10.14735/amcsnn2016400.
9. Gately L, McLachlan SA, Dowling A et al. Life beyond a diagnosis of glioblastoma: a systematic review of the literature. J Cancer Surviv 2017; 11 (4): 447–452. doi: 10.1007/s11764-017-0602-7.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2020 Číslo 3
-
Všechny články tohoto čísla
- Primární progresivní afázie
- Jsme na dosah cílené terapie Huntingtonovy nemoci? ANO
- Jsme na dosah cílené terapie Huntingtonovy nemoci? NE
- Je cielená terapia Huntingtonovej choroby na dosah?
- Kognitivní poruchy u dětí s epilepsií
- Autoimunitní encefalitidy s negativitou neurálních protilátek – klinické charakteristiky a možnosti detekce protilátek
- APOE a BDNF jako rizikové genetické markery pro predikci nástupu a rozvoje kognitivního deficitu při Alzheimerově nemoci
- Význam nových laboratorních technik v diagnostice Niemann-Pickovy choroby typu C
- Bolesti hlavy v graviditě
- Výskyt a rizikové faktory neprovokovaných epileptických záchvatů u pacientů po ischemické cévní mozkové příhodě
- Validace dotazníku pro hodnocení dysfagie u pacientů s roztroušenou sklerózou – česká verze DYMUS
- Význam neuropaliativní péče pro zlepšení kvality života pacientů s progresivním neurologickým onemocněním – intervenční studie
- Vliv demence na trajektorie kvality života seniorů
- Charakteristika souboru chlapců s Duchennovou a Beckerovou svalovou dystrofií – studie z jednoho nervosvalového centra
- Metabolomika cerebrospinálneho likvoru pomocou magnetickej rezonančnej spektroskopie u pacientov so sclerosis multiplex, s klinicky izolovaným syndrómom, inými zápalovými ochoreniami mozgu a u zdravých kontrol
- Epidurální aplikace kortikoidů 2. část – Kvalita života pacientů před aplikací
- Fokální epileptický záchvat u mladé ženy z Jižní Korey
- Glioblastom grade IV – dlouhodobé přežití
- Stanovisko redakční rady k diskuzi o úrovni a směřování Cesk Slov Neurol N
- Erratum
- Informace vedoucího redaktora
- Recenze
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Glioblastom grade IV – dlouhodobé přežití
- Primární progresivní afázie
- Bolesti hlavy v graviditě
- Kognitivní poruchy u dětí s epilepsií
