Autologní transplantace kmenových krvetvorných buněk a její so učasná role v léčbě roztro ušené sklerózy
Autologo us Hematopo i etic Stem Cells Transplantati on and its Current Role in Multiple Sclerosis Tre atment
Multiple sclerosis (MS) is the most frequent a uto immune disorder of the central nervo us system in o ur ge ographical regi on. The dise ase can le ad to vari able degree of ne urological disability according to aggressiveness of MS co urse itself, e arly tre atment initi ati on and its invidividu al efficacy. In abo ut 3% of the pati ents MS co urse can be classifi ed as malignant with severe attacks from the beginning of the dise ase and rapid accumulati on of ne urological disability despite adequ ate tre atment. In such cases the tre atment with high‑dose immuno ablati on with a utologo us hematopo i etic stem cells support (ASCT) sho uld be considered. The tre atment rati onale comprises the effort of a uto aggressive immune system eliminati on by high‑dose cytostatic tre atment followed by return of pati ents’ own hematopo i etic stem cells as reso urces for a new immune system. The aim is to enable reconstituti on of potenti ally less a uto aggressive immune system. The progressi on free survival 10 ye ars in 47% of the pati ents has been achi eved in the first ASCT gro up with the longest follow‑up since 1995 – gre at result in comparison with any other currently available MS drug. More than 400 pati ents worldwide have been tre ated with ASCT procedure so far. Nowadays optimal indicati on for ASCT tre atment involves highly active MS within first five ye ars of the dise ase and ability to walk at le ast 100 metres witho ut aid. Despite its risks (including 2.3% mortality) ASCT presents promising tre atment for malignant MS with po or prognosis also in the Czech Republic, where ASCT rese arch – still so needful and essenti al – started in 1998.
Key words:
multiple sclerosis – malignant – immuno ablati on – stem cell transplantati on – ASCT
Authors:
E. Krasulová 1; M. Trněný 2; T. Kozák 3; E. Havrdová 1
Authors‘ workplace:
Ne urologická klinika 1. LF UK a VFN v Praze, 2I. interní klinika 1. LF UK a VFN v Praze, 3Oddělení klinické hematologi e 3. LF UK a FNKV, Praha
1
Published in:
Cesk Slov Neurol N 2009; 72/105(3): 227-234
Category:
Review Article
Overview
Roztro ušená skleróza (RS) představuje v našich zeměpisných šířkách nejčastější a uto imunitní onemocnění centrálního nervového systému. Onemocnění může vést k různému stupni ne urologického postižení v závislosti na agresivitě průběhu vlastní RS, včasném zahájení léčby a jejím individu álním efektu. Zhruba u 3 % paci entů lze průběh RS označit za maligní, kdy jso u od počátku choroby přítomny ataky závažné ne urologické symptomatiky s rychlým nárůstem trvalého ne urologického postižení i přes adekvátní léčbu. V těchto případech je na místě individu álně zvážit léčbu tzv. vysokodávkovano u imuno ablací s následno u podporo u a utologních krvetvorných kmenových buněk (ASCT). Princip léčby ASCT představuje snahu o eliminaci a uto agresivního imunitního systému vysoko u dávko u cytostatik následovano u navrácením vlastních kmenových buněk paci enta, které jso u zdrojem obnovy imunitního systému. Cílem léčby je umožnit obnovu potenci álně méně a uto agresivního imunitního systému. U nejdéle sledovaného so uboru paci entů z roku 1995 bylo dosaženo intervalu bez progrese deset let u 47 % paci entů, což je vynikající výsledek ve srovnání se všemi ostatními léčebnými postupy u RS. Na celém světě bylo dosud to uto metodo u léčeno již více než 400 paci entů. V so učasnosti představuje optimální indikaci k léčbě ASCT vysoce aktivní RS s délko u trvání choroby do pěti let a ještě zachovano u schopností chůze bez opory alespoň 100 metrů. Přes svá rizika (včetně mortality 2,3 %) ASCT zůstává nadějí pro paci enty s maligním průběhem RS, a to i v České republice, která se podílí na so ustavném (a do budo ucna stále nezbytném) výzkumu v této oblasti již od roku 1998.
Klíčová slova:
roztro ušená skleróza – maligní – imuno ablace – transplantace kmenových buněk – ASCT
Úvod
Roztroušená skleróza (RS) s prevalencí 100–150/100 000 obyvatel představuje nejčastější autoimunitní onemocnění centrálního nervového systému (CNS) v České republice [1]. Onemocnění je multifaktoriálního původu – na jeho rozvoji se podílí jak predisponující genetická výbava, tak faktory zevního prostřední (infekce, hormonální změny, kouření, nedostatek vitaminu D aj.) [1,2]. V patogenezi autoimunitního zánětu CNS byly vždy na první místo stavěny CD4+ T lymfocyty, současný pohled však velmi komplexně zahrnuje i ostatní složky imunitního systému: cytotoxické CD8+ T lymfocyty schopné přerušit axon [3], přirozenou imunitu [4] i B lymfocyty a plazmatické buňky, které byly nalezeny na meningách pacientů s RS ve shlucích strukturou připomínajících lymfatické uzliny [5]. Ve svém průběhu začíná RS u 85 % pacientů relaps-remitentní fází, kdy se střídají akutně vzniklé neurologické příznaky s úplnou nebo částečnou remisí. Ataka je klinickým projevem zánětlivého ložiska v CNS. S pokračujícím zánětem dochází postupně (individuálně během 5–15 let) k vyčerpání rezerv CNS, které činí 30–40 %. Pozvolna nad zánětem převáží axonální ztráta – neurodegenerace, která je ireverzibilní. Klinickým korelátem je pozvolná progrese neurologického postižení (tzv. sekundárně progresivní fáze RS) s minimálním účinkem současné protizánětlivé terapie. Zánět má v této fázi pouze malou aktivitu a je navíc umístěn za hematoencefalickou bariérou (HEB) v CNS již se zmíněnými shluky buněk B linie na meningách. Teoreticky mohou být tyto dlouho žijící plazmatické buňky zdrojem pokračující aktivity onemocnění i přes intenzivní cytostatickou léčbu, protože jsou terapeuticky při svém umístění za HEB obtížně postižitelné [6]. Navíc pro tuto fázi RS v současnosti zcela chybí léčba neuroregenerační. Pozvolným progresivním průběhem bez atak, s převažující neurodegenerací nad zánětem je typická primárně progresivní forma RS. Zhruba u 3 % pacientů lze průběh RS označit za agresivní až vysloveně maligní, kdy jsou od počátku choroby přítomny ataky závažné neurologické symptomatiky (hybné, mozečkové, kmenové) s trvalými rezidui i přes adekvátní léčbu. U těchto pacientů rychle narůstá neurologické postižení (tzv. relabující-progredující forma RS) i přes veškerou konvenční terapii, která je v současné době k dispozici. Právě v těchto případech je na místě přísně individuálně zvážit léčbu tzv. vysokodávkovanou imunoablací s následnou podporou autologních hematopoetických kmenových buněk (ASCT, Autologous hematopoietic Stem Cells Transplantation).
Princip současné léčby roztroušené sklerózy
Cílem léčby RS je při našich současných terapeutických možnostech především její včasné zahájení (optimálně již po první atace klinických příznaků suspektních podle paraklinických vyšetření z rozvoje definitivní RS), pečlivé hodnocení účinnosti zvolené terapie a její včasná změna v případě nedostatečného efektu. Oddalování zahájení terapie nebo oddalování její změny/eskalace v případě neúčinnosti je postup zcela non lege artis. Podle dostupných dat u pacientů s přirozeným (neléčeným) průběhem RS dochází k rozvoji těžké invalidity (s neschopností chůze bez opory) u 50 % pacientů během 15 let trvání choroby [7], což s přihlédnutím k rozvoji prvních příznaků nemoci typicky mezi 20. – 40. rokem věku činí RS nejčastější příčinou invalidity mladých osob.
Léčba zahrnuje jednak akutní protizánětlivý postup v případě ataky RS, kde zůstává zlatým standardem metylprednizolon (při nedostatečném efektu ještě s přidaným cytostatikem cyklofosfamidem), jednak léčbu dlouhodobou s cílem snížit počet atak a jejich závažnost, a oddálit progresivní fázi choroby s ireverzibilní neurodegenerací. Zde představují léky první volby u relaps-remitentní RS interferony beta a glatiramer acetát s navzájem srovnatelným efektem 30–40 % oproti placebu [8–14]. Léky druhé volby zahrnují monoklonální protilátku natalizumab s efektem 68 % na snížení počtu relapsů oproti placebu [15], která je indikována u pacientů s vysokou aktivitou onemocnění a nedostatečným efektem léků první volby, nebo u agresivní RS s rychle progredující invaliditou v začátku choroby, kde by zavedení léků první volby vedlo k nebezpečí z prodlení. Další alternativou druhé volby zejména pro imunodeficientní pacienty jsou intravenózní imunoglobuliny (IVIG) s efektem srovnatelným s léky první volby [16] a orální imunosupresiva (azatioprin, metotrexát, mykofenolát mofetil) [1]. Léčbu lze při nedostatečné účinnosti léků první a druhé volby eskalovat cytostatickými režimy – cyklofosfamid [17] a mitoxantron [18,19], ani tato eskalace však není schopna zastavit aktivitu RS v případě jejího maligního průběhu, kde je proto následně ke zvážení individuální léčebný postup, adekvátně agresivní vůči maligní RS (ASCT). V případě sekundárně progresivní fáze RS jsou léčebné možnosti již velmi omezené – na počátku této fáze při ještě přítomných relapsech může mít určitý význam interferon beta [20], dále pak pulzní léčba cyklofosfamidem [21] nebo mitoxantronem [22], IVIG či orální imunosupresiva [1]. Pokud je však zjevná pokračující progrese po šesti měsících zvolené léčby, je na místě terapii ukončit a nenavyšovat tak pouze riziko nežádoucích účinků. U primárně progresivní formy RS neexistuje žádný mezinárodní konsenzus léčby, i zde se však individuálně zkouší dostupná cytostatika, imunosupresiva a IVIG s pečlivým hodnocením vlivu terapie na zastavení progrese po šesti měsících léčby [1].
Autologní transplantace kmenových krvetvorných buněk u RS – základní poznatky o účinnosti a bezpečnosti
Stejně jako všechny terapeutické postupy u RS byla i vysokodávkovaná imunoablace s autologní transplantací krvetvorných kmenových buněk (ASCT) ve svém počátku založena na výsledcích preklinického výzkumu [23–28]. Autologní (syngenní) transplantace kmenových buněk kostní dřeně dokázala zabránit rozvoji či léčit již indukovanou experimentální alergickou encefalomyelitidu (myší a krysí model RS). Závěry těchto experimentů ukázaly, že léčba ASCT je efektivní v počáteční fázi onemocnění, zatímco má malý či žádný efekt u zvířat léčených po delším trvání choroby [26] – tento závěr je nyní po více než desetileté klinické zkušenosti obecně přijímán jako platný i v případě vlastní RS. Idea léčby ASCT u RS byla dále kromě zvířecích pokusů podpořena i kazuistikami s navozením stabilizace autoimunitních chorob po léčbě transplantací kostní dřeně pro hematologická onemocnění [29,30].
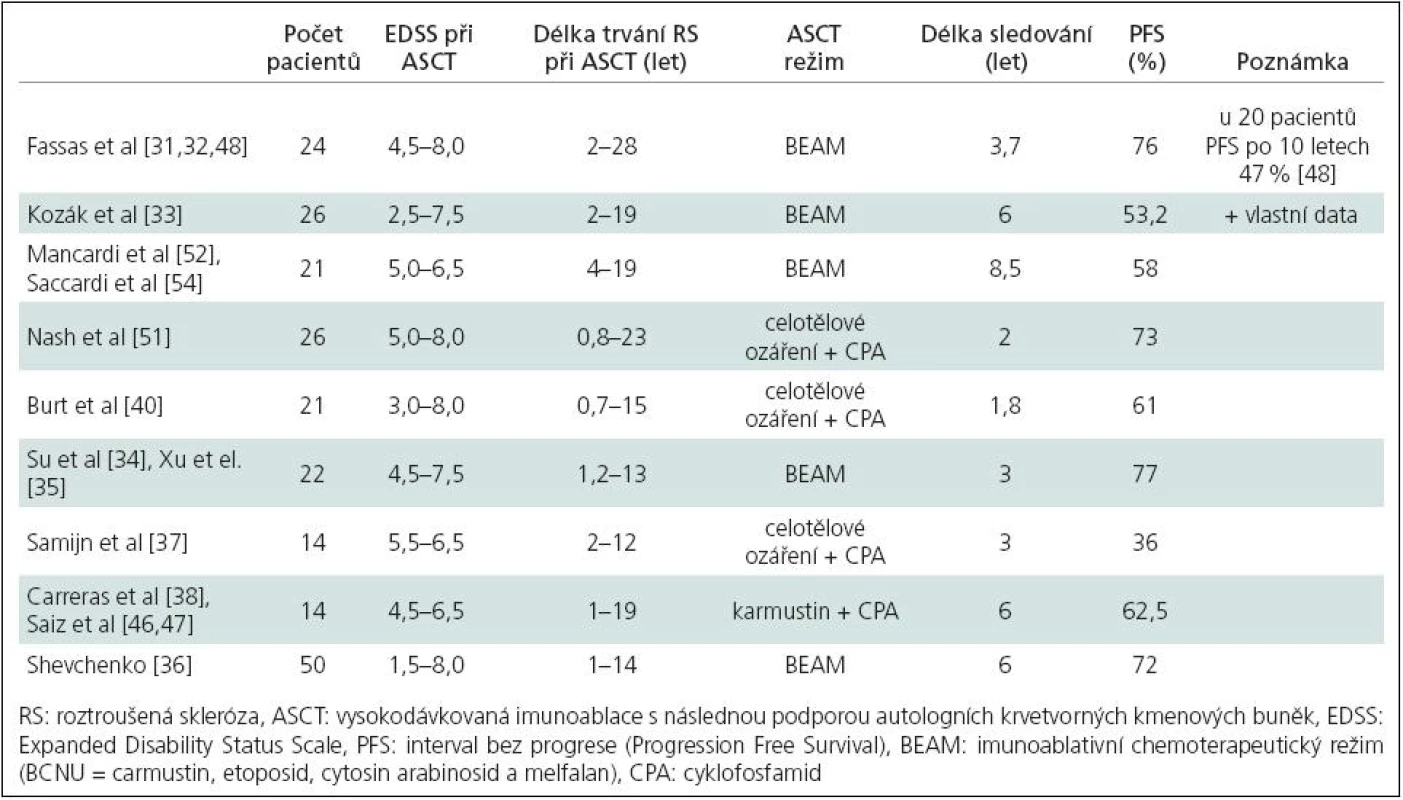
Pilotní klinická studie fáze I/II s ASCT u pacientů s progresivní RS začala v řecké Soluni v roce 1995 [31]. Následovala další centra po celém světě (Česká republika a jiná evropská centra, Rusko, Izrael, Čína a USA). Ve všech publikovaných zprávách [31–42] byli pacienti v pokročilé progresivní fázi choroby léčeni intenzivní vysokodávkovanou chemoterapií nebo celotělovým ozářením [40] s následnou autologní transplantací kmenových buněk. Celoevropská data shromažďovaná v registru EBMT (The European Group for Blood and Marrow Transplantation) byla publikována v rámci dvou shrnujících retrospektivních publikací v letech 2002 a 2006 [43,44]. V druhé z těchto publikací byla dokumentována léčba ASCT již u celkem 183 pacientů z 45 center [44]. Převažovali pacienti se sekundárně progresivní (54 %) a primárně progresivní RS (18 %), průměrná doba trvání RS byla 6,7 let (0,2–28,5 let), průměrný věk pacienta v době výkonu 34 let (15–58 let). Průměrný stupeň neurologického postižení vyjádřený pomocí Kurtzkeho Expanded Disability Status Scale (EDSS) [45] byl 6,5 (schopnost ujít bez zastavení 20 metrů s oboustrannou oporou). V rámci tříletého sledování bylo dosaženo intervalu bez progrese (PFS, Progression-Free Survival) u 63 % pacientů, což byl vynikající výsledek u skupiny pacientů s tímto stupněm postižení a progresí choroby minimálně o jeden stupeň škály EDSS v roce před ASCT. Výsledky dalších sledování jsou shrnuty v tab. 1. Tyto výsledky jednoznačně opravňují k pokračování ve výzkumu ASCT v léčbě RS, neboť bylo dosaženo stabilizace u téměř 50 % pacientů po dobu 10 let. Přitom se jednalo o pacienty s natolik agresivní RS, že bylo možno podle předtransplantačního průběhu jejich choroby odhadovat progresi do stadia neschopnosti chůze a upoutání na invalidní vozík do jednoho roku (!). Celosvětově je v současné době odhadováno, že léčbu ASCT podstoupilo již více než 400 pacientů s touto diagnózou [48].
Ve všech dosavadních studiích se z logických důvodů nejednalo o klasickou, zaslepenou, placebem kontrolovanou, randomizovanou, klinickou studii. Proto je nyní snaha provést lépe naplánované srovnávací studie prokazující vyšší účinnost režimu ASCT u pacientů s agresivní RS, u kterých selhala konvenční terapie, ve srovnání s léčbou cytostatikem mitoxantronem (studie ASTIMS, Autologous Stem cell Transplantation International Multiple Sclerosis, www.astims.org). Stejně jako u dalších aktuálních studií fáze II, které probíhají v USA (HALT MS [49] a Stem Cell Therapy for Patients with Multiple Sclerosis Failing Interferon A Randomized Study [50]), jsou indikováni pacienti s nižším stupněm postižení (EDSS do 5,5 = schopnost chůze bez opory a bez zastavení alespoň 100 metrů) nebo trváním RS do pěti let, tedy pacienti v zánětlivé fázi choroby (viz dále).
Kromě klinických pozorování jsou k dispozici i výsledky magnetické rezonance (MR). Podle všech dostupných dat má léčba ASCT schopnost dlouhodobě snížit aktivitu zánětu v CNS měřenou počtem gadolinium vychytávajících lézí na MR [33,38,40,46,51,52,54], a to i v případě podání trojnásobné dávky gadolinia [52], která je pro detekci zánětlivých lézí s porušenou HEB o 75 % citlivější než standardní dávka [53]. Tento efekt lze pozorovat v průměru 3–5 let po ASCT [48]. Snížení zánětu v CNS bylo podpořeno i stabilizací nebo redukcí počtu T2 vážených lézí na MR [46,52,55]. Intenzivní diskuze je v posledních letech vedena na téma atrofie CNS ve vztahu k ASCT. Všechny práce, kde byla atrofie v rámci MR vyšetření různými metodami měřena, prokázaly její nárůst v prvních dvou letech po ASCT [46,55–58]. Také histopatologické nálezy u malé skupiny pěti pacientů, kteří zemřeli do 1,5 roku po ASCT, odhalily aktivní demyelinizaci a axonální ztrátu i přes minimální přítomnost zánětlivých buněk v lézích CNS [59]. Tyto nálezy je však nutno hodnotit velmi opatrně, protože se týkají pouhých pěti pacientů s dlouhým trváním RS (v průměru 13 let) a pouze jednorázového hodnocení krátce po ASCT [48,60,61]. Rozhodně nelze na základě těchto výsledků akceptovat závěr, že důvodem axonální ztráty je pouze neurotoxicita cytostatik užívaných v rámci ASCT. To vyvrací i MR data po delším než dvouletém sledování: italská skupina popsala u devíti pacientů nejprve dramatický nárůst atrofie s procentuální normalizovanou změnou objemu mozkové tkáně (PBVC, Percentage normalized Brain Volume Changes) během prvního roku –1,10 % a druhého roku –1,55 %, následovalo však výrazné zpomalení atrofie s průměrným ročním PBVC –0,45 % ve třetím až pátém roce sledování [57]. Po více než dvouletém pozorování se tedy hodnoty atrofie prakticky rovnají hodnotám atrofie pozorované u pacientů s méně agresivním průběhem RS [62]. Obdobné výsledky byly získány i u nizozemské skupiny pacientů léčených ASCT po tříletém pozorování [58]. Navíc pilotní výzkum vývoje gadolinium vychytávajících lézí u čtyř pacientů před ASCT a po ní pomocí nekonvenční MR metody – magnetizačního transferu (MTR, Magnetization Transfer Ratio) – prokázalo remyelinizaci některých ložisek, tedy přítomnost funkčních oligodendrogliálních prekurzorů i po intenzivní cytostatické léčbě při ASCT [63]. Mezi příčinami atrofie mozku bezprostředně po ASCT je tedy na místě zvažovat nejen potenciální neurotoxicitu ASCT režimu (zejména cytostatik etopozidu a cytarabinu [48]), ale také probíhající neurodegeneraci při vlastní RS nastartovanou již před léčbou (v žádné z pozorovaných skupin pacientů bohužel nemáme k dispozici vývoj PBVC před léčbou) či „pseudoatrofii“ jako důsledek dramatického snížení edému a zánětlivé aktivity po ASCT [64].
Neméně důležitou otázkou indikace experimentální léčby je vedle účinnosti také její bezpečnost. Zásadním údajem je s výkonem spojená mortalita (TRM, Treatment-Related Mortality). Ta podle údajů EBMT z roku 2006 dosahovala u ASCT 5,3 % [44], kdy příčiny úmrtí zahrnovaly komplikující infekci (n = 6), kardiotoxicitu (n = 1), neurologickou progresi (n = 1) a získanou autoimunitu s tvorbou protilátek proti koagulačnímu faktoru VIII (n = 1). Byla pozorována statisticky významná korelace mezi TRM a ASCT režimem zahrnujícím cytostatikum busulfan, a dále negativní trend k vyšší TRM v závislosti na věku pacienta a dvojnásobném čištění štěpu (viz dále) [44]. Poslední analýza dat EBMT (všechny případy ASCT v Evropě od roku 1997) ukázala hodnotu TRM 2,3 % [64], která je zřejmě důsledkem jak aktuální indikace méně postižených pacientů, tak výběru méně toxických režimů a především kvality a erudice provádějících hematologických pracovišť. Časné nežádoucí účinky v prvních 100 dnech po ASCT lze očekávat podle EBMT analýzy u 56 % případů (febrilní neutropenie, sepse, infekce močových cest, gastroenteritis, mucositis, alergická reakce na antitymocytární globulin) a musí být samozřejmou součástí diskuze s pacientem v rámci indikace léčby. Taktéž může dojít k přechodnému neurologickému zhoršení (17 %). Pozdní nežádoucí příhody byly zaznamenány u 6 % pacientů po 4.–41. měsíci od ASCT a zahrnovaly infekci varicella zoster virem (n = 3), autoimunitní thyreoiditis (n = 3) a získanou autoimunitu s tvorbou protilátek proti koagulačnímu faktoru VIII (n = 2) [44].
Autologní transplantace krvetvorných kmenových buněk u RS – imunologické poznatky a princip
Základní představa o efektu ASCT u autoimunitních onemocnění je založena na principu zničení imunitního systému včetně autoreaktivních klonů T lymfocytů intenzivní cytostatickou léčbou s následnou rekonstitucí imunitního systému z vlastních kmenových buněk za jiných než původních ontogenetických podmínek [1,48]. Je však známo, že klony T lymfocytů rozpoznávající antigeny CNS (MBP) jsou po ASCT do jednoho roku opět vytvořeny [65], k obnově přirozených zabíječů (natural killers) a B lymfocytů dochází dokonce již do tří měsíců po ASCT [38,40,51]. Důležitý je ovšem charakter subpopulací obnovovaných imunitních buněk: po dvou letech od ASCT (režim cyklofosfamid a celotělové ozáření) byla prokázána zvýšená tvorba naivních CD4+ lymfocytů původem z tymu na úkor nižšího zastoupení paměťových CD4+ lymfocytů. Zároveň byla průkazná větší receptorová diverzita T buněk ve srovnání s předtransplantačním vyšetřením [66]. V dospělém věku obnovená tymopoéza z kmenových buněk tak může být zodpovědná za nastavení autotolerance po ASCT. Možným důkazem navození autotolerance po ASCT byla i normalizace počtu regulačních T lymfocytů (CD4+, CD25+ a FoxP3+) po této léčbě u pacientů s autoimunitní juvenilní idiopatickou artritidou [67]. Zcela logická je úvaha, že by vyššího efektu léčby bylo možno dosáhnout využitím heterologní (alogenní) transplantace kmenových buněk dárců bez anamnézy autoimunitního onemocnění. Tato léčba je však spojena s mortalitou více než 20 %, proto zatím není v léčbě autoimunitních chorob akceptovatelná [48].
Vedle hlavního imunologického principu účinnosti ASCT u RS stojí ještě úvaha o možném neuroregeneračním potenciálu kmenových hematopoetických buněk. U čtyř pacientek, které dostaly v rámci heterologní transplantace kmenových buněk pro hematologická onemocnění hematopoetické kmenové buňky od dárců-mužů, byly post mortem nalezeny v CNS buňky obsahující Y chromozom. Tyto buňky byly tedy jednoznačně původem z dárcovských kmenových buněk a ukázaly schopnost diferenciace kmenových buněk v buňky nervové (především v oblasti hippocampu a kůry mozkové) [68]. Vedle toho však existují zprávy, které neurogenezi z hematopoetických kmenových buněk nepotvrdily [69,70]. Proto je v současné době efekt ASCT přičítán především intenzivní imunosupresi a obnově kvalitativně odlišného imunitního systému [48].
Autologní transplantace krvetvorných kmenových buněk u RS – současná indikace k výkonu
Pacienti, kteří byli indikováni k výkonu ASCT v letech 1995–2006, byli především pacienti v pokročilém stadiu RS, většinou (80 %) v sekundárně progresivní fázi choroby a s vyšším stupněm invalidity. Jedině takto postiženým pacientům bylo možno nabídnout experimentální léčbu s potenciálním rizikem mortality, která byla odhadována při prvních klinických pokusech kolem 5 % [48]. V současnosti (2009) je však metoda ASCT díky dosud získaným datům ze souboru více než 300 pacientů bezpečně realizovatelná (TRM 2,3 %) a jsme svědky vývoje indikačních kritérií pro tuto léčbu. Při uvážení principu ASCT je evidentní, že nejlepšími kandidáty k této terapii jsou pacienti s maximem autoimunitního zánětu v CNS, tedy pacienti v prvních pěti letech choroby v relaps-remitentní, relabující-progredující nebo počáteční sekundárně progresivní fázi, s objektivními známkami zánětlivé aktivity RS (ještě přítomné relapsy, gadolinium vychytávající léze na MR). Léčba ASCT není prováděna s představou neuroregenerace, ale s představou oddálení těžké ireverzibilní invalidity. Adekvátní je proto u pacientů ještě mobilních, do stupně EDSS 5,5 (schopnost ujít alespoň 100 metrů bez opory a bez zastavení).
Autologní transplantace krvetvorných kmenových buněk u RS – průběh a transplantační protokoly
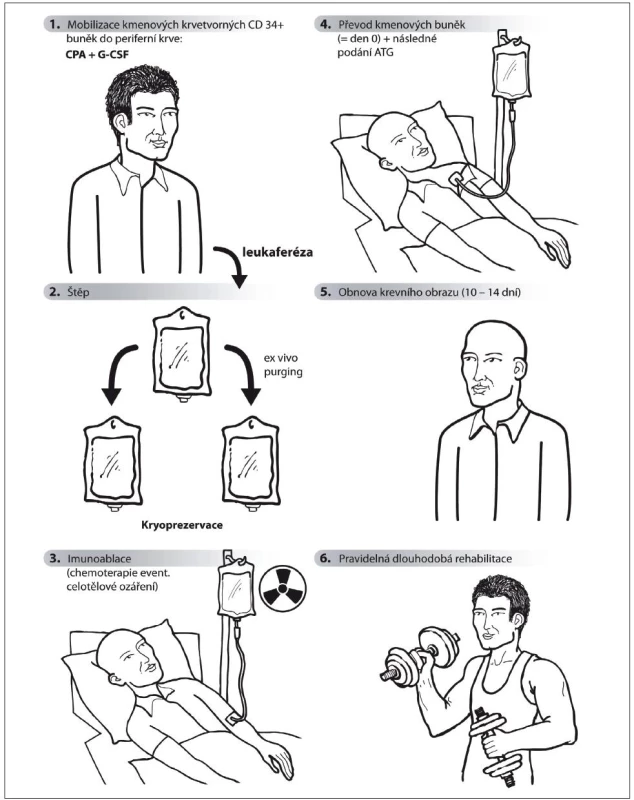
Obecně má volba každé léčby následovat po diskuzi s pacientem, což tím více platí u „off-label“ léčby, jako je ASCT. Pacientovi – a optimálně i jeho blízkým – jsou podrobně neurologem a hematologem vysvětleny detaily průběhu léčby, očekávaný efekt i možné nežádoucí účinky, a pacient poté podepisuje informovaný souhlas s léčbou. Následují nejprve podrobná vyšetření k vyloučení orgánové patologie a asymptomatických infekčních fokusů. Vlastní proces léčby sestává z těchto fází (obr. 1): 1. priming: mobilizace kmenových buněk do periferní krve a jejich sesbírání cestou leukaferézy; 2. případné zpracování štěpu (ex vivo) a zamražení kmenových buněk; 3. conditioning – intenzivní chemoterapie; 4. vrácení kmenových buněk do krevního oběhu pacienta; 5. podání antitymocytárního globulinu; 6. přihojení štěpu s obnovením krevního obrazu do 10–14 dnů; 7. cílená fyzioterapie: dle stavu pacienta v průběhu léčby a poté vždy dlouhodobě a pravidelně po léčbě. Kmenové hematopoetické buňky nesoucí povrchový znak CD34 lze získat jednak trepanobiopsií přímo z kostní dřeně, nebo je lze vyplavit (mobilizovat) do periferní krve, a získat tak snadněji větší množství těchto buněk [48]. Proto je mobilizace kmenových buněk u ASCT preferována [44], a léčba by proto správně neměla být označována jako transplantace kostní dřeně. CD34+ buňky jsou nejčastěji mobilizovány pomocí cyklofosfamidu – CPA (2–4g/m2) s následným subkutánním podáváním faktoru stimulujícího granulocytární kolonie G‑CSF (5–10 µg/kg/den) do dosažení potřebného počtu kmenových buněk [71,72]. Kmenové buňky lze mobilizovat i G‑CSF samotným, ale pro popsané zhoršení RS při jeho podání [73] je výhodná výše uvedená kombinace s CPA. Kmenové buňky jsou z periferní krve sbírány leukaferézou, zamraženy v tekutém dusíku (–196 °C) a uchovány až do transplantace. Za minimální, ještě dostačující počet získaných kmenových buněk (v případě autoimunitních onemocnění) je považována hodnota 3 × 106 CD34+ buněk/kg [48]. Štěp může být ex vivo upraven – pozitivní selekcí CD34+ nebo negativní selekcí T lymfocytů. Toto čištění (in vitro purging) v kombinaci s následným podáním antitymocytárního imunoglobulinu (dvojité čištění štěpu) však nevedlo k vyšší účinnosti ASCT. Naopak patřilo mezi faktory zvyšující riziko s léčbou spojené mortality [44], proto se již ve většině center neprovádí. U RS představuje nejčastěji používaný imunoablativní chemoterapeutický režim tzv. BEAM (BCNU = carmustin, etoposid, cytosin arabinosid a melfalan) [44]. Tato kombinace cytostatik využívaná v léčbě lymfomů patří mezi středně intenzivní režimy s lymfoablativním a silně myelotoxickým (ale nikoli zcela myeloablativním) účinkem [74]. Cytostatika režimu BEAM přestupují hematoencefalickou bariéru, a mohou tak zasáhnout autoreaktivní imunitní buňky v CNS [48]. V Severní Americe je častěji využíván vysoce intenzivní režim jako v léčbě leukemií – celotělové ozáření (1 000–1 200 cGy) a vysokodávkovaný CPA (120mg/kg) nebo busulfan (16mg/kg) [51,74]. Na většině pracovišť je po ablativním režimu podáván ještě antitymocytární globulin (ATG, 4mg/kg) s cílem odstranit potenciálně se štěpem vrácené autoreaktivní T lymfocyty (tzv. in vivo purging) [33,44,48]. Pravděpodobnost progrese RS po třech letech od ASCT je 43 % u středně intenzivních režimů a 31 % u vysoce intenzivních režimů, nicméně byl zároveň jednoznačně prokázán přímo úměrný vztah mezi intenzitou režimu a mortalitou spojenou s léčbou [74]. Proto je režim BEAM širší odbornou veřejností považován za optimálně účinný i bezpečný [48] a je používán také v ČR. Absolvováním celé výše uvedené procedury je sice ukončena farmakologická část vlastní ASCT léčby, nicméně nastává fáze intenzivní a dlouhodobé fyzioterapie, která je nedílnou součástí celého procesu. Pouze pacient předem motivovaný jak k léčbě, tak k fyzioterapii je vhodným kandidátem k ASCT.
Aktuální situace v České republice
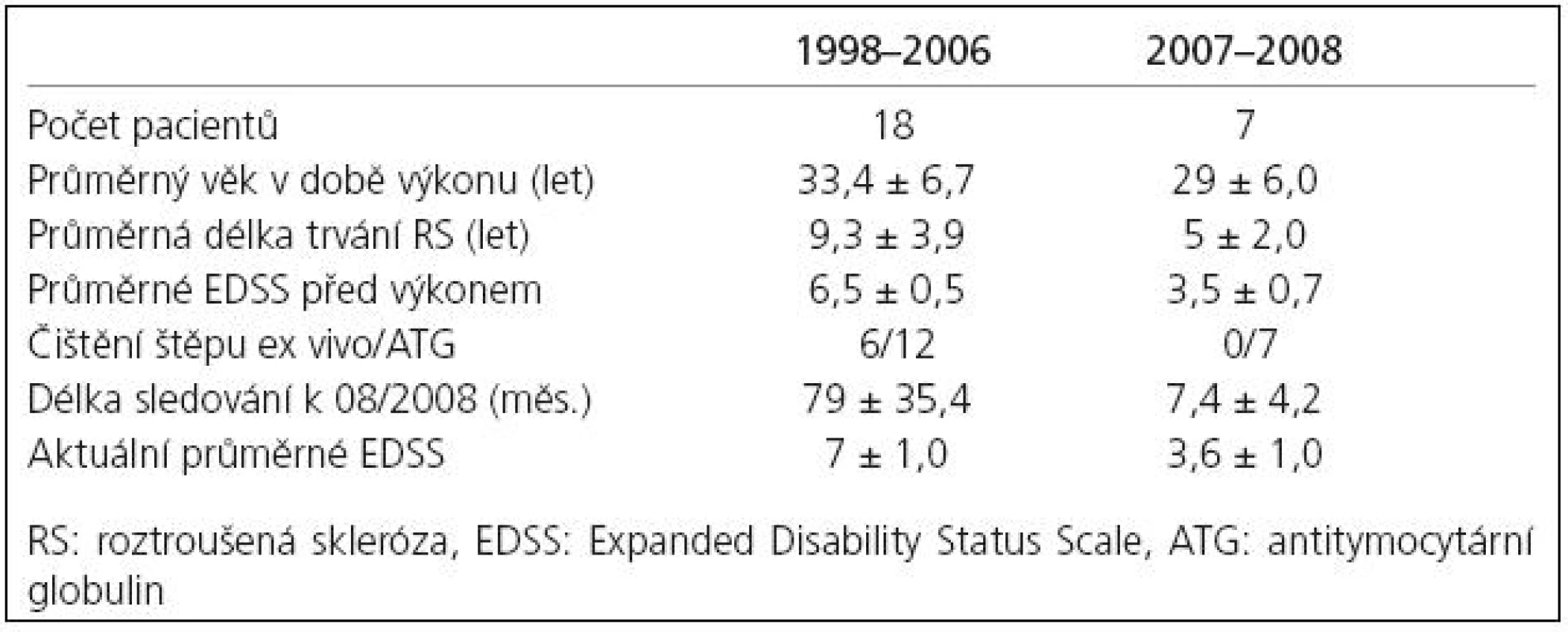
Česká republika se se svým souborem 40 transplantovaných pacientů významně podílí na celosvětové léčbě a výzkumu ASCT. Léčba zde probíhá od roku 1998 s využitím ablativního režimu BEAM dosud s nulovou mortalitou ve spojitosti s výkonem. I v ČR došlo v posledních dvou letech k posunu indikace ASCT k pacientům v zánětlivé fázi choroby. Soubor pacientů léčených ASCT a dlouhodobě sledovaných v Centru pro demyelinizační onemocnění Neurologické kliniky 1. LF UK v Praze tak lze rozdělit na skupinu transplantovanou v letech 1998–2006 a skupinu transplantovanou 2007–2008 (tab. 2) se zřejmým posunem k pacientům indikovaným v prvních pěti letech choroby a ještě nedosahujícím těžké invalidity (průměrné EDSS 3,5 u druhé skupiny znamená pacienty bez omezení v chůzi narozdíl od průměrného EDSS 6,5 u původní skupiny pacientů odpovídající schopnosti chůze pouze do 20 metrů s oboustrannou oporou).
Závěr
Vysokodávkovaná imunoablace s následnou transplantací autologních krvetvorných kmenových buněk je v léčbě roztroušené sklerózy k dispozici od roku 1995. Ačkoliv se jedná o léčbu spojenou s rizikem mortality 2,3 %, je to zároveň aktuálně jediná léčebná metoda, která dokáže oddálit progresi maligní RS (u 47 % pacientů dokonce na 10 let), a tím rychle nastupující trvalou invaliditu. Protože se většinou jedná o mladé pacienty, je třeba pečlivě uvážit kvalitu hrozícího mnohaletého života s těžkou invaliditou ve srovnání s – dnes na erudovaných pracovištích již relativně malými – riziky léčby. Podle aktuálního pohledu na princip léčby ASCT je vhodným kandidátem pacient s agresivní RS i přes dostupnou konvenční terapii, s délkou trvání choroby do pěti let a ještě bez těžkého neurologického postižení (se zachovanou schopností chůze alespoň 100 metrů bez opory a bez zastavení, EDSS 5,5). Je úkolem všech ošetřujících neurologů, aby takovému pacientovi ve vysokém riziku rychlého rozvoje trvalé invalidity včas léčbu ASCT nabídli.
Podpořeno granty IGA MZ ČR NR/9375-3/2007, IGA MZ ČR 1A8713-5/2005, GAČR 309/08/H079 a VZ-MSM0021620849. Ilustrace Klára Zápotocká a Pavel Veselý.
MUDr. Eva Krasulová
Centrum pro demyelinizační onemocnění
Neurologická klinika 1. LF UKa VFN v Praze
Kateřinská 32
128 01 Praha 2
e‑mail:
eva.krasulova@gmail.com
Sources
1. Havrdová E. Ne uro imunologi e. Praha: Maxdorf 2001.
2. Hawkes CH. Smoking is a risk factor for multiple sclerosis: a metanalysis. Mult Scler 2007; 13(5): 610 – 615.
3. Medana I, Martinic MA, Wekerle H, Ne umann H. Transecti on of major histocompatibility complex class I‑induced ne urites by cytotoxic T lymphocytes. Am J Pathol 2001; 159(3): 809 – 815.
4. Bsibsi M, Ravid R, Gveric D, van No ort JM. Bro ad expressi on of Toll‑like receptors in the human central nervo us system. J Ne uropathol Exp Ne urol 2002; 61(11): 1013 – 1021.
5. Serafini B, Rosicarelli B, Magli ozzi R, Stigli ano E, Alo isi F. Detecti on of ectopic B - cell follicles with germinal centres in the meninges of pati ents with secondary progressive multiple sclerosis. Brain Pathol 2004; 14(2): 164 – 174.
6. Marmont AM, Gu alandi F, Occhini D, Morandi F, Ferretti E, Pezzolo A et al. Catastrophic relapse of Evans syndrome five ye ars after allogeneic BMT notwithstanding full donor chimerism. Terminal hemolytic – uremic syndrome. Auto immunity 2006; 39(6): 505 – 511.
7. Kremenchutzky M, Rice GP, Baskerville J, Wingerchuk DM, Ebers GC. The natural history of multiple sclerosis: a ge ographically based study 9: observati ons on the progressive phase of the dise ase. Brain 2006; 129(3): 584 – 594.
8. IFNB Multiple Sclerosis Study Gro up. Interferon beta‑lb is effective in relapsing - remitting multiple sclerosis. I. Clinical results of a multicenter, randomized, do uble - blind, placebo - controlled tri al. Ne urology 1993; 43(4): 655 – 661.
9. Paty DW, Li DK. Interferon beta‑1b is effective in relapsing - remitting multiple sclerosis. II. MRI analysis results of a multicenter, randomized, do uble - blind, placebo - controlled tri al. Ne urology 1993; 43(4): 662 – 667.
10. IFNB Multiple Sclerosis Study Gro up and the University of British Columbi a MS/ MRI Analysis Gro up. Interferon beta‑1b in the tre atment of multiple sclerosis: final o utcome of the randomized controlled tri al. Ne urology 1995; 45(7): 1277 – 1285.
11. Jacobs LD, Co okfair DL, Rudick RA, Herndon RM, Richert JR, Salazar AM et al. Intramuscular interferon beta‑1a for dise ase progressi on in relapsing multiple sclerosis. Ann Ne urol 1996; 39(3): 285 – 294
12. Simon JH, Jacobs LD, Campi on M, Wende K, Simoni an N, Co okfair DL et al. Magnetic resonance studi es of intramuscular interferon beta‑1a for relapsing multiple sclerosis. Ann Ne urol 1998; 43(1): 79 – 87.
13. PRISMS (Preventi on of Relapses and Disability by Interferon beta‑1a Subcutane o usly in Multiple Sclerosis) Study Gro up. Randomised do uble - blind placebo-controlled study of interferon beta‑1a in relapsing/ remitting multiple sclerosis. Lancet 1998; 352(9139): 1498 – 1504.
14. Johnson KP, Bro oks BR, Cohen JA, Ford CC, Goldstein J, Lisak RP et al. Copolymer 1 reduces relapse rate and improves disability in relapsing - remitting multiple sclerosis: results of a phase III multicenter, do uble - blind placebo - controlled tri al. Ne urology 1995; 45(7): 1268 – 1276.
15. Polman CH, O‘Connor PW, Havrdova E, Hutchinson M, Kappos L, Miller DH et al. A randomized, placebo - controlled tri al of natalizumab for relapsing multiple sclerosis. N Engl J Med 2006; 354(9): 899 – 910.
16. Sorensen PS, Fazekas F, Lee M. Intraveno us immunoglobulin G for the tre atment of relapsing - remitting multiple sclerosis: a meta‑analysis. Eur J Ne urol 2002; 9(6): 557 – 563.
17. Smith DR, Weinstock - Guttman B, Cohen JA, Wei X,Gutmann C, Bakshi R et al. A randomized blinded tri al of combinati on therapy with cyclophosphamide in pati ents - with active multiple sclerosis on interferon beta. Mult Scler 2005; 11(5): 573 – 582.
18. Edan G, Miller D, Clanet M, Confavre ux C, Lyon - Caen O, Lubetzki C et al. Therape utic effect of mitoxantrone combined with methylprednisolone in multiple sclerosis: a randomised multicentre study of active dise ase using MRI and clinical criteri a. J Ne urol Ne urosurg Psychi atry 1997; 62(2): 112 – 118.
19. Le Page E, Leray E, Ta urin G, Co ustans M, Chaperon J, Morrissey SP et al. Mitoxantrone as inducti on tre atment in aggressive relapsing remitting multiple sclerosis: tre atment response factors in a 5 ye ar follow‑up observati onal study of 100 consecutive pati ents. J Ne urol Ne urosurg Psychi atry 2008; 79(1): 52 – 56.
20. Europe an Study Gro up on interferon beta‑1b in secondary progressive MS. Placebo - controlled multicentre randomised tri al of interferon beta‑1b in tre atment of secondary progressive multiple sclerosis. Lancet 1998; 352(9139): 1491 – 1497.
21. Weiner HL, Mackin GA, Orav EJ, Hafler DA, Dawson DM, LaPi erre Y et al. Intermittent cyclophosphamide pulse therapy in progressive multiple sclerosis: final report of the Northe ast Co operative Multiple Sclerosis Tre atment Gro up. Ne urology 1993; 43(5): 910 – 918.
22. Hartung HP, Gonsette R, König N, Kwi ecinski H, Guse o A, Morrissey SP et al. Mitoxantrone in progressive multiple sclerosis: a placebo-controlled, do uble - blind, randomised, multicentre tri al. Lancet 2002; 360(9350): 2018 – 2025.
23. Karussis DM, Slavin S, Lehmann D, Mizrachi - Koll R, Abramsky O, Ben - Nun A. Preventi on of experimental a uto immune encephalomyelitis and inducti on of tolerance with acute immunosuppressi on followed by syngeneic bone marrow transplantati on. J Immunol 1992; 148(6): 1693 – 1698.
24. Karussis DM, Slavin S, Ben - Nun A, Ovadi a H, Vo urka - Karussis U, Lehmann D et al. Chronic‑relapsing experimental a uto immune encephalomyelitis (CR - EAE): tre atment and inducti on of tolerance, with high dose cyclophosphamide followed by syngeneic bone marrow transplantati on. J Ne uro immunol 1992; 39(3): 201 – 210.
25. van Gelder M, Kinwel – Bohré EP, van Bekkum DW. Tre atment of experimental allergic encephalomyelitis in rats with total body irradi ati on and syngeneic BMT. Bone Marrow Transplant 1993; 11(3): 233 – 241.
26. Burt RK, Padilla J, Begolka WS, Canto MC, Miller SD. Effect of dise ase stage on clinical o utcome after syngeneic bone marrow transplantati on for relapsing experimental a uto immune encephalomyelitis. Blo od 1998; 91(7): 2609 – 2616.
27. Ikehara S, Go od RA, Nakamura T, Sekita K, Ino ue S,Oo MM et al. Rati onale for bone marrow transplantati on in the tre atment of a uto immune dise ases. Proc Natl Acad Sci USA 1985; 82(8): 2483 – 2487.
28. van Bekkum DW. Stem cell transplantati on for a uto immune disorders. Preclinical experiments. Best Pract Res Clin Haematol 2004; 17(2): 201 – 222.
29. McAllister LD, Be atty PG, Rose J. Allogeneic bone marrow transplant for chronic myelogeno us le ukemi a in a pati ent with multiple sclerosis. Bone Marrow Transplant 1997; 19(4): 395 – 397.
30. Snowden JA, Patton WN, O‘Donnell JL, Hannah EE, Hart DN. Prolonged remissi on of longstanding systemic lupus erythematosus after a utologo us bone marrow transplant for non‑Hodgkin‘s lymphoma. Bone Marrow Transplant 1997; 19(12): 1247 – 1250.
31. Fassas A, Anagnostopo ulos A, Kazis A, Kapinas K, Sakellari I, Kimiskidis V et al. Peripheral blo od stem cell transplantati on in the tre atment of progressive multiple sclerosis: first results of a pilot study. Bone Marrow Transplant 1997; 20(8): 631 – 638.
32. Fassas A, Anagnostopo ulos A, Kazis A, Kapinas K,Sakellari I, Kimiskidis V et al. Autologo us stem cell transplantati on in progressive multiple sclerosis – an interim analysis of efficacy. J Clin Immunol 2000; 20(1): 24 – 30.
33. Kozák T, Havrdová E, Pitha J, Gregora E, Pytlík R, Maalo ufová J et al. High‑dose immunosuppressive therapy with PBPC support in the tre atment of po or risk multiple sclerosis. Bone Marrow Transplant 2000; 25(5): 525 – 531.
34. Su L, Xu J, Ji BX, Wan SG, Lu CY, Dong HQ et al. Autologo us peripheral blo od stem cell transplantati on for severe multiple sclerosis. Int J Hematol 2006; 84(3): 276 – 281.
35. Xu J, Ji BX, Su L, Dong HQ, Sun XJ, Li u CY. Clinical o utcomes after a utologo us haematopo i etic stem cell transplantati on in pati ents with progressive multiple sclerosis. Chin Med J (Engl) 2006; 119(22): 1851 – 1855.
36. Shevchenko YL, Novik AA, Kuznetsov AN, Afanasi ev BV, Lisukov IA, Kozlov VA et al. High‑dose immunosuppressive therapy with a utologo us hematopo i etic stem cell transplantati on as a tre atment opti on in multiple sclerosis. Exp Hematol 2008; 36(8): 922 – 928.
37. Samijn JP, te Boekhorst PA, Mondri a T, van Do orn PA, Flach HZ, van der Meché FG et al. Intense T cell depleti on followed by a utologo us bone marrow transplantati on for severe multiple sclerosis. J Ne urol Ne urosurg Psychi atry 2006; 77(1): 46 – 50.
38. Carreras E, Saiz A, Marín P, Martínez C, Rovira M, Villamor N et al. CD34+ selected a utologo us peripheral blo od stem cell transplantati on for multiple sclerosis: report of toxicity and tre atment results at one ye ar of follow‑up in 15 pati ents. Haematologica 2003; 88(3): 306 – 314.
39. Loh SM, Ratnagopal P, Tan HC, Goh YT, Koh BC, Koh LP et al. Successful a utologo us hematopo i etic stem cell transplantati ons for severe multiple sclerosis with fludarabine and cyclophosphamide conditi oning. Int J Hematol 2006; 83(4): 368 – 369.
40. Burt RK, Cohen BA, Russell E, Spero K, Joshi A, Oyama Y et al. Hematopo i etic stem cell transplantati on for progressive multiple sclerosis: failure of a total body irradi ati on‑based conditi oning regimen to prevent dise ase progressi on in pati ents with high disability scores. Blo od 2003; 102(7): 2373 – 2378.
41. Openshaw H, Lund BT, Kashyap A, Atkinson R, Sni ecinski I, Weiner LP et al. Peripheral blo od stem cell transplantati on in multiple sclerosis with busulfan and cyclophosphamide conditi oning: report of toxicity and immunological monitoring. Bi ol Blo od Marrow Transplant 2000; 6(5A): 563 – 575.
42. Gu alandi F, Bruno B, Van Lint MT, Luchetti S, Uccelli A,Capello E et al. Autologo us stem cell transplantati on for severe a uto immune dise ases: a 10 - ye ar experi ence. Ann N Y Acad Sci 2007; 1110 : 455 – 464.
43. Fassas A, Passweg JR, Anagnostopo ulos A, Kazis A,Kozak T, Havrdova E et al. Hematopo i etic stem cell transplantati on for multiple sclerosis. A retrospective multicenter study. J Ne urol 2002; 249(8): 1088 – 1097.
44. Saccardi R, Kozak T, Bocelli - Tyndall C, Fassas A, Kazis A, Havrdova E et al. Autologo us stem cell transplantati on for progressive multiple sclerosis: update of the Europe an Gro up for Blo od and Marrow Transplantati on a uto immune dise ases working party database. Mult Scler 2006; 12(6): 814 – 823.
45. Kurtzke JF. Disability rating scales in multiple sclerosis. Ann N Y Acad Sci 1984; 436 : 347 – 360.
46. Saiz A, Blanco Y, Carreras E, Berenguer J, Rovira M, Pujol T et al. Clinical and MRI o utcome after a utologo us hematopo i etic stem cell transplantati on in MS. Ne urology 2004; 62(2): 282 – 284.
47. Saiz A, Blanco Y, Berenguer J, Gómez - Choco M, Carreras E, Arbizu T et al. Clinical o utcome 6 ye ars after a utologo us hematopo i etic stem cell transplantati on in multiple sclerosis. Ne urologi a 2008; 23(7): 405 – 407.
48. Mancardi G, Saccardi R. Autologo us haematopo i etic stem - cell transplantati on in multiple sclerosis. Lancet Ne urol 2008; 7(7): 626 – 636.
49. Bowen J. High‑Dose Immunosuppressi on and Autologo us Transplantati on for Multiple Sclerosis (HALT MS) Study. Dostupné z URL: http:/ / www.clinicaltri al.gov/ ct2/ show/ NCT00288626?term=halt+ms&rank=1.
50. Burt R. Stem Cell Therapy for Pati ents With Multiple Sclerosis Failing Interferon A Randomized Study. Dostupné z URL: http:/ / www.clinicaltri al.gov/ ct2/ show/ NCT00273364?term=transplantati on+and+multiple+sclerosis&rank=10.
51. Nash RA, Bowen JD, McSweeney PA, Pavletic SZ, Maravilla KR, Park MS et al. High‑dose immunosuppressive therapy and a utologo us peripheral blo od stem cell transplantati on for severe multiple sclerosis. Blo od 2003; 102(7): 2364 – 2372.
52. Mancardi GL, Saccardi R, Filippi M, Gu alandi F, Muri aldo A, Inglese M et al. Autologo us hematopo i etic stem cell transplantati on suppresses Gd - enhanced MRI activity in MS. Ne urology 2001; 57(1): 62 – 68.
53. Filippi M, Rovaris M, Capra R, Gasperini C, Yo usry TA, Sormani MP et al. A multi‑centre longitudinal study comparing the sensitivity of monthly MRI after standard and triple dose gadolini um - DTPA for monitoring dise ase activity in multiple sclerosis. Implicati ons for phase II clinical tri als. Brain 1998; 121(10): 2011 – 2020.
54. Saccardi R, Mancardi GL, Solari A, Bosi A, Bruzzi P,Di Bartolome o P et al. Autologo us HSCT for severe progressive multiple sclerosis in a multicenter tri al: impact on dise ase activity and qu ality of life. Blo od 2005; 105(6): 2601 – 2607.
55. Inglese M, Mancardi GL, Pagani E, Rocca MA, Muri aldo A, Saccardi R et al. Brain tissue loss occurs after suppressi on of enhancement in pati ents with multiple sclerosis tre ated with a utologo us haematopo i etic stem cell transplantati on. J Ne urol Ne urosurg Psychi atry 2004; 75(4): 643 – 644.
56. Chen JT, Collins DL, Atkins HL, Freedman MS, Galal A,Arnold DL. Brain atrophy after immuno ablati on and stem cell transplantati on in multiple sclerosis. Ne urology 2006; 66(12): 1935 – 1937.
57. Roccatagli ata L, Rocca M, Valsasina P, Bonzano L, Sormani M, Saccardi R et al. The long‑term effect of AHSCT on MRI me asures of MS evoluti on: a five - ye ar follow‑up study. Mult Scler 2007; 13(8): 1068 – 1070.
58. Rocca MA, Mondri a T, Valsasina P, Sormani MP, Flach ZH, Te Boekhorst PA et al. A three - ye ar study of brain atrophy after a utologo us hematopo i etic stem cell transplantati on in rapidly evolving secondary progressive multiple sclerosis. AJNR Am J Ne uroradi ol 2007; 28(9): 1659 – 1661.
59. Metz I, Lucchinetti CF, Openshaw H, Garci a - Merino A,Lassmann H, Freedman MS et al. Autologo us haematopo i etic stem cell transplantati on fails to stop demyelinati on and ne urodegenerati on in multiple sclerosis. Brain 2007; 130(5): 1254 – 1262.
60. Martin R. Is haematopo i etic stem cell transplantati on a tre atment opti on for severe MS or not? Brain 2007; 130(5): 1181 – 1182.
61. Nash RA, Stuve O, Bowen JD, Frohman EM, Griffith LM, Hutton GJ et al. Autologo us HSCT for advanced MS: is the glass half - empty or re ally half - full? Brain 2008; 131(2): e89.
62. Miller DH, Barkhof F, Frank JA, Parker GJ, Thompson AJ. Me asurement of atrophy in multiple sclerosis: pathological basis, methodological aspects and clinical relevance. Brain 2002; 125(8): 1676 – 1695.
63. Chen JT, Collins DL, Atkins HL, Freedman MS, Arnold DL; Canadi an MS/ BMT Study Gro up. Magnetizati on transfer rati o evoluti on with demyelinati on and remyelinati on in multiple sclerosis lesi ons. Ann Ne urol 2008; 63(2): 254 – 262.
64. Fassas A, Mancardi GL. Autologo us hemopo i etic stem cell transplantati on for multiple sclerosis: Is it worthwile? Auto immunity 2008; 41(8): 601 – 610.
65. Sun W, Popat U, Hutton G, Zang YC, Krance R, Carrum G et al. Characteristics of T - cell receptor reperto ire and myelin‑re active T cells reconstituted from a utologo us haematopo i etic stem - cell grafts in multiple sclerosis. Brain 2004; 127(5): 996 – 1008.
66. Muraro PA, Do uek DC, Packer A, Chung K, Guenaga FJ, Cassi ani – Ingoni R et al. Thymic o utput generates a new and diverse TCR reperto ire after a utologo us stem cell transplantati on in multiple sclerosis pati ents. J Exp Med 2005; 201(5): 805 – 816.
67. de Kleer I, Vastert B, Klein M, Teklenburg G, Arkesteijn G, Yung GP et al. Autologo us stem cell transplantati on for a uto immunity induces immunologic self - tolerance by reprogramming a utore active T cells and restoring the CD4+CD25+ immune regulatory network. Blo od 2006; 107(4): 1696 – 1702.
68. Mezey E, Key S, Vogelsang G, Szalayova I, Lange GD, Crain B. Transplanted bone marrow generates new ne urons in human brains. Proc Natl Acad Sci USA 2003; 100(3): 1364 – 1369.
69. Wagers AJ, Sherwo od RI, Christensen JL, Weissman IL. Little evidence for developmental plasticity of adult hematopo i etic stem cells. Sci ence 2002; 297(5590): 2256 – 2259.
70. Castro RF, Jackson KA, Go odell MA, Robertson CS, Li u H, Shine HD. Failure of bone marrow cells to transdifferenti ate into ne ural cells in vivo. Sci ence 2002; 297(5585): 1299.
71. Burt RK, Fassas A, Snowden J, van Laar JM, Kozak T,Wulffraat NM et al. Collecti on of hematopo i etic stem cells from pati ents with a uto immune dise ases. Bone Marrow Transplant 2001; 28(1): 1 – 12.
72. Statkute L, Verda L, Oyama Y, Traynor A, Villa M, Sho ok T et al. Mobilizati on, harvesting and selecti on of peripheral blo od stem cells in pati ents with a uto immune dise ases undergo ing a utologo us hematopo i etic stem cell transplantati on. Bone Marrow Transplant 2007; 39(6): 317 – 329.
73. Openshaw H, Stuve O, Antel JP, Nash R, Lund BT, Weiner LP et al. Multiple sclerosis flares associ ated with recombinant granulocyte colony - stimulating factor. Ne urology 2000; 54(11): 2147 – 2150.
74. Gratwohl A, Passweg J, Bocelli - Tyndall C, Fassas A, van Laar JM, Farge D et al. Autologo us hematopo i etic stem cell transplantati on for a uto immune dise ases. Bone Marrow Transplant 2005; 35(9): 869 – 879.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2009 Issue 3
-
All articles in this issue
- Vyhľadávani e paci entov so syndrómom nepokojných nôh v čakárni klinickej ambulanci e pomoco u dotazníkovej metódy
- Cervikálna radikulitída ako inici álny klinický prejav ne uroboreli ózy – kazuistiky
- Adultní forma glutarové aciduri e II. typu – nedostatečně di agnostikovaná příčina proximální myopati e – kazuistika
- Progresívna nekrotizujúca myelopati a – kazuistika
- Aktinomykóza mozku – kazuistiky
- Protein S100 a ne uron specifická enoláza v klinické di agnostice mozkového postižení
- Transpozice šlachy m. tibi alis posteri or – efektivní řešení parézy perone álních svalů
- Migréna
- Valproát – anti epileptikum s protinádorovými účinky
- Sexu ální funkce osob s Parkinsonovo u nemocí
- Autologní transplantace kmenových krvetvorných buněk a její so učasná role v léčbě roztro ušené sklerózy
- Model zavřeného poranění hlavy u potkana – experimentální studi e
- Peroperační monitoring tkáňové oxymetri e a peroperační užití hypotermi e v chirurgii mozkových ane uryzmat
- Hladiny lipidů u gli oblastomu a úloha indexu Ki 67 při určování aktivace proliferace
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Autologní transplantace kmenových krvetvorných buněk a její so učasná role v léčbě roztro ušené sklerózy
- Migréna
- Adultní forma glutarové aciduri e II. typu – nedostatečně di agnostikovaná příčina proximální myopati e – kazuistika
- Transpozice šlachy m. tibi alis posteri or – efektivní řešení parézy perone álních svalů
