Zhoršení kognitivních funkcí a snížení perfuze v kontralaterálním frontálním laloku u pacientů s lézí mozečku
Cognitive Deficit And Contralateral Frontal Hypoperfusion In Patients With Cerebellar Lesions
Introduction:
The cerebellum is considered to be mainly involved in motor circuits, particularly movement coordination and muscle tone regulation. However, recent findings show that its functions also include cognition and emotions. The aim of our study was to contribute to this discussion by investigating neuropsychological deficits in patients with cerebellar lesions.
Methods:
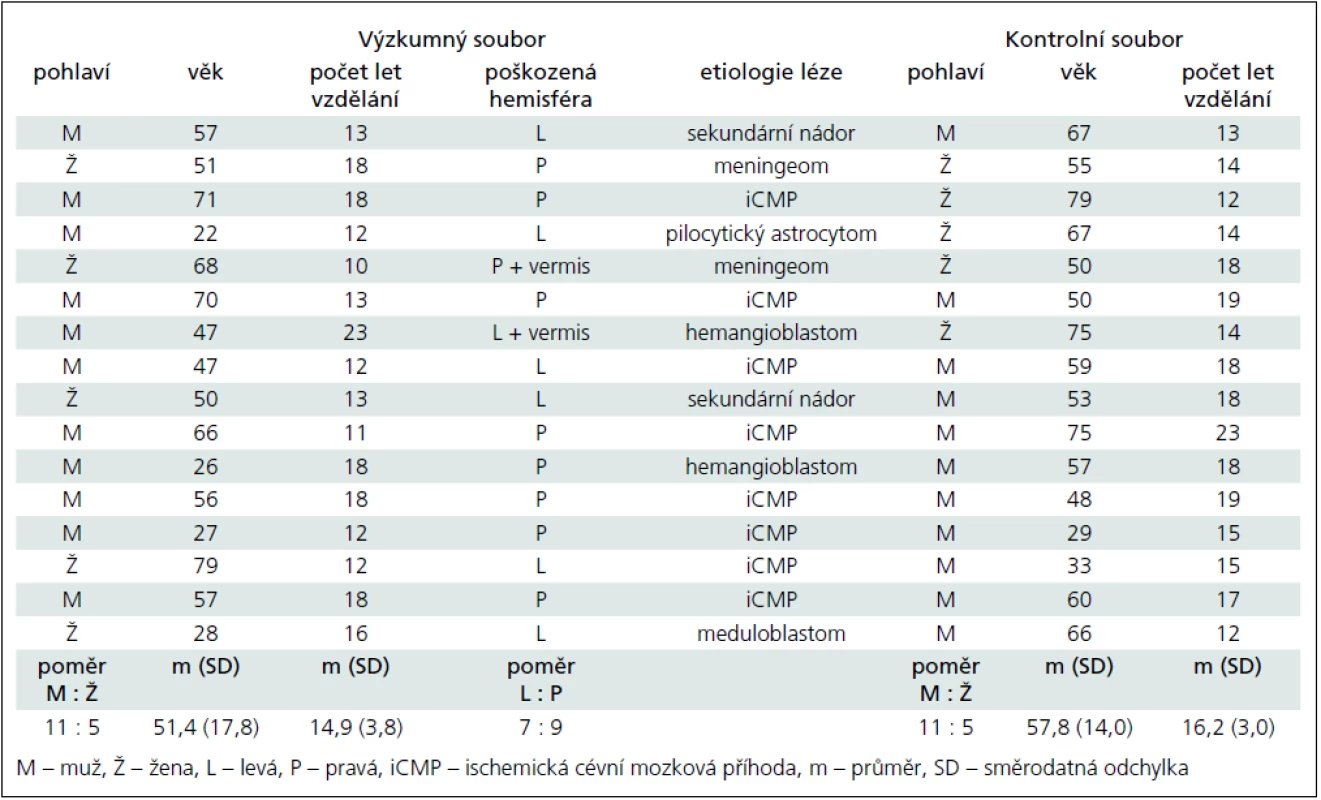
We included 16 subjects with a structural lesion limited to the cerebellum, five women and eight men, with mean age of 51.4 years (range 22–79 years). Etiology involved ischemia in eight patients and tumour surgery in the other eight. The control group was composed of 16 subjects, five women and eight men, mean age 57.7 (range 29–79 years). All subjects underwent a semistructured interview, neurological assessment of ataxia, comprehensive neuropsychological assessment of cognitive, executive and affective functions and single-photon emission computed tomography (SPECT).
Results:
Patients with cerebellar damage scored significantly lower on neuropsychological measurement of executive functions (planning, strategy, abstraction, flexibility, inhibition) and also on memory, visuospatial and attention measures. Affective changes, although clearly present in the clinical picture of the research sample, were not confirmed. SPECT revealed hypoperfusion in the affected cerebellar hemisphere associated with hypoperfusion in the contralateral frontal lobe, suggesting mutual functional relationship between these regions.
Conclusion:
Our quantitative study of neuropsychological deficits in patients with cerebellar lesions provides a comprehensive account of deficits associated with this type of insult: executive alteration is the most pronounced followed by visuospatial and construction impairment, whereas attention, learning and memory are less impaired.
Key words:
cerebellum – cognition – emotions – executive functions – SPECT
Autoři:
E. Bolcekováihash2 1,2 1,2
Působiště autorů:
Katedra psychologie, Filozofická fakulta UK v Praze
1; Neurologická klinika, IPVZ a Thomayerova nemocnice, Praha
2; Fakulta jaderná a fyzikálně inženýrská ČVUT v Praze
3; Radioizotopové pracoviště IKEM, Praha
4; Neurochirurgická klinika 1. LF UK, IPVZ a ÚVN Praha
5
Vyšlo v časopise:
Cesk Slov Neurol N 2012; 75/108(5): 595-601
Kategorie:
Původní práce
Souhrn
Úvod:
O mozečku je známo, že se podílí na regulaci motorických funkcí, jako jsou svalový tonus či koordinace pohybů. Poznatky z poslední doby ukazují, že má vliv i na kognitivní a emoční procesy. Cílem naší studie bylo přispět k přesnější definici neuropsychologických deficitů u pacientů s poškozením mozečku.
Soubor a metodika:
Výzkumnou skupinu tvořilo 16 nemocných s lézí omezenou na mozeček, pět žen a 11 mužů, s průměrným věkem 51,4 roku (rozpětí 22–79 let). Mozečková léze byla v osmi případech ischemie, u osmi nemocných operovaný tumor. Kontrolní skupinu tvořilo 16 zdravých osob, pět žen a 11 mužů, s průměrným věkem 57,7 roku (rozpětí 29–79 let). Všichni absolvovali semistrukturovaný rozhovor, neurologické vyšetření ataxie, vyšetření rozsáhlou neuropsychologickou baterií pokrývající kognitivní a exekutivní funkce i prožívaní emocí a dále vyšetření jednofotonovou emisní počítačovou tomografií (SPECT).
Výsledky:
Skupina s poškozením mozečku dosahovala ve srovnání s kontrolní skupinou statisticky významně horších výsledků v neuropsychologických metodách měřících exekutivní funkce (plánování, strategie, abstrakce, mentální flexibilita, inhibice) i v oblasti paměti, zrakově-prostorových funkcí a pozornosti. Emoční změny nebyly přesvědčivě potvrzeny, i když pozorování ukázalo vyšší emoční labilitu. SPECT nalezl v poškozené hemisféře nižší distribuci radiofarmaka a funkční propojení mezi poškozenou hemisférou mozečku a kontralaterálním frontálním lalokem.
Závěr:
Naše kvantitativní studie zabývající se neuropsychologickými deficity při mozečkovém postižení nachází výraznou alteraci exekutivy, dále jsou narušeny i zrakově-prostorové a konstrukční schopnosti, v menší míře pak pozornost, učení a paměť.
Klíčová slova:
mozeček – kognice – emoce – exekutivní funkce – SPECT
Úvod
Tradiční pojetí mozečku jako čistě motorické struktury bylo nověji rozšířeno o jeho možný funkční podíl na regulaci kognice a emocí. Kazuistické studie zaměřené na vliv mozečku u afektivních poruch nebo schizofrenie se v literatuře objevují již delší dobu [1]. Teoretické zpracování obecnějšího zapojení mozečku do kognitivních procesů začalo vznikat koncem 80. let 20. století, kdy byl na základě kazuistik a teorie zpracování informací navržen vztah mezi mozečkem a pozorností, pamětí, exekutivními a zrakově-prostorovými funkcemi [2–6]. Významným přínosem byl koncept mozečkového kognitivně-afektivního syndromu (Cerebellar Cognitive-Affective Syndrome, CCAS), který definovali Schmahmann a Sherman [7]. Poškození mozečku podle nich vede k narušení čtyř kognitivně-behaviorálních oblastí:
- exekutivní funkce (plánování, přesouvání pozornosti, abstraktní usuzování, pracovní paměť, verbální fluence),
- prostorové funkce (zrakově-prostorové zpracování a paměť),
- osobnost (oploštění afektivity, dezinhibované anebo nevhodné chování),
- řeč (dysprozodie, agramatizmus, anomie).
U sledovaných osob s mozečkovým poškozením navíc konstatovali celkovou deterioraci intelektových funkcí. Naopak zachována zůstala bdělost a dlouhodobá epizodická i sémantická paměť. Schopnost učení byla zhoršena pouze velmi mírně. Nebyly pozorovány známky apraxie či agnozie; motorické deficity byly velmi malé a nemohly vysvětlit zhoršení výkonu v testech kognice. Závažnost projevů CCAS pozitivně korelovala s velikostí léze a negativně s časem uplynulým od vzniku poškození [7].
V dalších letech se objevila řada studií zaměřených na zpřesnění vztahu mozečku a pozornosti [8], paměti a učení [9], exekutivních funkcí [10,11], řeči [12] a zrakově-prostorových funkcí [13]. Ukazuje se, že narušení kognitivních funkcí je mírnější, než se původně předpokládalo, a vliv mozečkového poškození na lidskou kognici a emoce dosud není plně objasněn [14].
Vysvětlení CCAS nabízí Schmahmann v teorii dysmetrie myšlení a univerzální mozečkové transformace [15,16]. V oblasti motoriky mozeček koordinuje rychlost a přesnost pohybů, v oblasti kognice a emocí analogicky upravuje rychlost, konzistenci a vhodnost probíhajících procesů [16]. Zda se léze mozečku projeví v podobě motorické, kognitivní nebo afektivní dysmetrie, záleží na tom, s kterými oblastmi mozku je poškozené místo mozečku propojeno. Ukazuje se, že anteriorní lalok mozečku souvisí s motorickým řízením, zatímco posteriorní s kognitivními funkcemi. Laterální oblasti posteriorního laloku více ovlivňují kognici a oblast vermis se podílí na emotivitě [15].
Další koncept nabízí Ito [17] v teorii mozečkových vnitřních modelů. Motorické vnitřní modely umožňují nácvik zručností, model mentálních aktivit umožňuje rychlou a přesnou manipulaci s mentálními reprezentacemi. V obou případech mozeček dostane kopii povelu z mozkové kůry a předpoví jeho výsledek. Tuto informaci odešle přes thalamus do korové oblasti. Následně dostane senzorickou zpětnou vazbu o správnosti své předpovědi a podle ní poopraví vnitřní model. Výhoda tohoto systému spočívá v možnosti rychlé korekce pohybů nebo mentálních operací podle předpovědi, neboť přímá zpětnovazebná kontrola řídícího centra z periferie by byla příliš pomalá.
U nás se vlivu mozečku na kognitivní funkce věnují zejména Husárová [18] a Bareš et al [19–22]. Práce zaměřené na spinocerebellární ataxie publikovali Zumrová et al [23,24]. Cílem studie bylo na souboru našich pacientů s mozečkovou lézí prozkoumat emoční a kognitivní změny a propojit výsledky neuropsychologických metod s daty získanými metodou SPECT.
Soubor a metodika
Soubor
Výzkumný soubor tvořilo 16 osob, z toho 11 mužů a pět žen. Jejich průměrný věk byl 51,35 roku (rozpětí 22–79, směrodatná odchylka 17,80). Průměrná doba vzdělání byla 14,88 roku (rozpětí 10–23, směrodatná odchylka 3,77 roku). U sedmi pacientů šlo o poškození levé mozečkové hemisféry, u devíti o pravostranné poškození. Léze byla v osmi případech způsobena ischemickou cévní mozkovou příhodou, v osmi případech tumorem. Od vzniku ischemie, resp. operace uplynulo méně než šest měsíců a nebyla zahájena onkologická léčba. Všichni pacienti byli v době vyšetření hospitalizováni na Neurologické klinice Thomayerovy nemocnice.
Kontrolní soubor tvořilo 16 zdravých osob bez neurologické anamnézy, z toho 11 mužů a pět žen. Jejich průměrný věk byl 57,81 roku (rozpětí 29–79, směrodatná odchylka 13,99 roku). Průměrná doba vzdělání tohoto souboru byla 16,19 roku (rozpětí 12–23, směrodatná odchylka 3,04 roku).
Přehled charakteristik obou souborů se nachází v tab. 1.
Metody
Rozhovor
Všichni účastníci absolvovali polostrukturovaný rozhovor, který trval 15–20 minut. Otázky se týkaly průběhu běžného dne a subjektivně vnímaných potíží. Během rozhovoru byly hodnoceny i behaviorální projevy: ochota spolupracovat, sdílnost, adekvátnost odpovědí, vyjadřovací schopnosti, emoční výkyvy.
Neurologické vyšetření ataxie
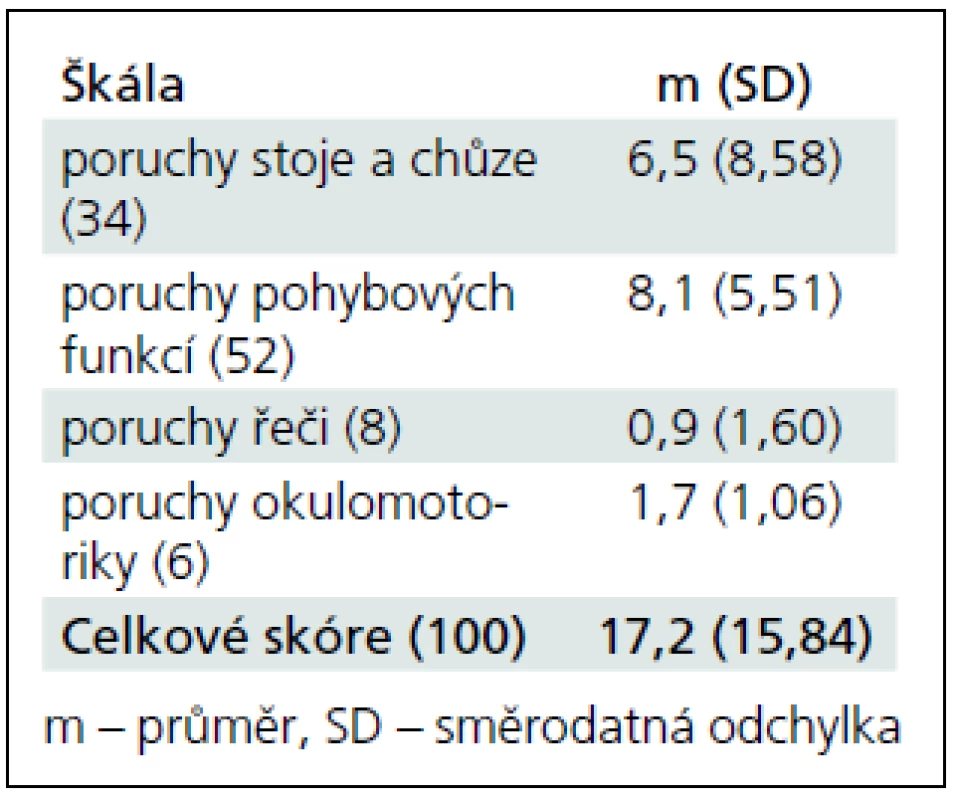
Pacienti s mozečkovou lézí absolvovali vyšetření neurologickou škálou zaměřenou na ataxii (International Co-operative Ataxia Rating Scale, ICARS [25]). Škála je tvořena 19 jednoduchými úkoly, z nichž každý je hodnocen několika body (maximální skór je 100 bodů, výsledek zdravé osoby bez mozečkového syndromu je 0 bodů). Škála se zaměřuje na čtyři oblasti potíží:
- poruchy stoje a chůze (sedm úkolů, maximum 34 bodů),
- poruchy pohybových funkcí (sedm úkolů, maximum 52 bodů),
- poruchy řeči (dva úkoly, maximum osm bodů),
- poruchy okulomotoriky (tři úkoly, maximum šest bodů).
Magnetická rezonance (MR) mozku
Pacienti byli vyšetřeni standardním protokolem používaným při zjišťování etiologie poškození mozečku v rámci klinického vyšetření a stanovování léčebného postupu. Pro účely studie byla semikvantitativně vyhodnocena velikost léze mozečku vztažená k jeho celkové velikosti. U každého pacienta byly manuálně změřeny rozměry mozečku a léze (výška, šířka, hloubka) a obě struktury byly aproximovány na kouli; velikost byla vypočtena podle vzorce V = 4/3ω * (výška/2) * (šířka/2) * (hloubka/2). Byl vypočten procentuální poměr velikosti léze vzhledem k mozečku.
Dále byla ověřena intaktnost ostatních částí mozku.
Jednofotonová emisní výpočetní tomografie (Single Photon Emission Computed Tomography, SPECT)
Po aplikaci 800 MBq radioizotopu 99mTc-hexametylpropylenaminooxim (HMPAO) bylo provedeno snímání v 360º ve 128 krocích, každý krok v rozsahu 3º. Rozlišení snímků je 128 × 128, projekce po 30 vteřinách, zoom 1,6. Distribuce radiofarmaka byla posuzována v trojrozměrném zobrazení programem MultiDimCerebral SOPHA.
Neuropsychologické vyšetření
Všichni účastníci absolvovali vyšetření neuropsychologickou baterií sestavenou pro účely této práce. Vyšetření pokrývalo následující domény:
- vizuospaciální funkce a konstrukční praxe (Rey-Osterriethova komplexní figura, kopie [26]),
- vizuospaciální paměť (Rey-Osterriethova komplexní figura, vybavení [26]; Labyrint [27]),
- verbální paměť a učení (Kalifornský test verbálního učení [28]),
- pozornost a rychlost (Test cesty, část A [26]; Test vigilance [27]),
- exekutivní funkce (Baterie hodnocení frontálních funkcí [29]; Test cesty, část B [26]; Test verbální fluence, lexikální a sémantická část [26]; Test prostorové fluence [30]; Wisconsinský test třídění karet [27]; Stroopův test, verze Victoria [31]; Hanojská věž [27]),
- neverbální intelekt (Ravenovy Barevné progresivní matice [32]),
- osobnost a nálada (Minnesotský inventář osobnosti, zkrácená verze [33]; Brunelská škála nálady [34]; Dotazník emoční empatie [35]).
Všichni účastníci byli obeznámeni s účelem vyšetření a ubezpečeni o zachování anonymity. Byla jim nabídnuta možnost přerušit vyšetření, pokud by jim bylo nepříjemné.
Získaná data byla analyzována pomocí statistického programu R (www.r-project.org/). Srovnávali jsme výsledky pacientů s mozečkovým poškozením s výsledky kontrolní skupiny. Také jsme srovnávali výsledky osob s mozečkovou lézí podle její lateralizace. Vzhledem k menšímu rozsahu souboru byl použit neparametrický Wilcoxonův test pro dva nezávislé výběry.
Výsledky
Rozhovor
Pacienti s poškozením mozečku si stěžovali mnohem více na somatické projevy než na změny v kognici a emocích. Nejvíce jim vadil tremor (čtyři osoby), nejistota v chůzi (tři osoby), dvojité vidění (tři osoby), únava (dvě osoby), závrať (dvě osoby) a zhoršení artikulace (jedna osoba). Čtyři osoby nepříjemně pociťovaly problémy s pamětí, jedna osoba horší soustředění. Emoční labilitu vnímal jeden nemocný, výraznější iritabilitu tři osoby, zhoršení nálady jedna osoba a v jednom případě pacient uvedl „mírnou, nepopsatelnou změnu prožívání“.
U kontrolní skupiny se nevyskytly stížnosti na fyzický ani psychický stav.
Spolupráce při vyšetření byla u většiny osob adekvátní. Několik osob odbíhalo od úkolů, všichni byli ale usměrnitelní. Sedm osob z výzkumného vzorku projevovalo během vyšetření zvýšenou emoční labilitu až nezdrženlivost, s projevy impulzivního pláče nebo smíchu. U kontrolních osob byla afektivita stabilní.
ICARS
Výsledky pacientů ve škále ataxie jsou uvedeny v tab. 2. Získané skóry jsou relativně nízké, motorické poškození bylo u sledovaných osob mírné.
MR mozku
Velikost mozečku byla průměrně 145,37 cm3 (směrodatná odchylka 32,03), velikost léze 13,99 cm3 (směrodatná odchylka 12,92), léze tvořila průměrně 8,9 % objemu mozečku (směrodatná odchylka 6,6). Ostatní oblasti mozku byly intaktní.
SPECT
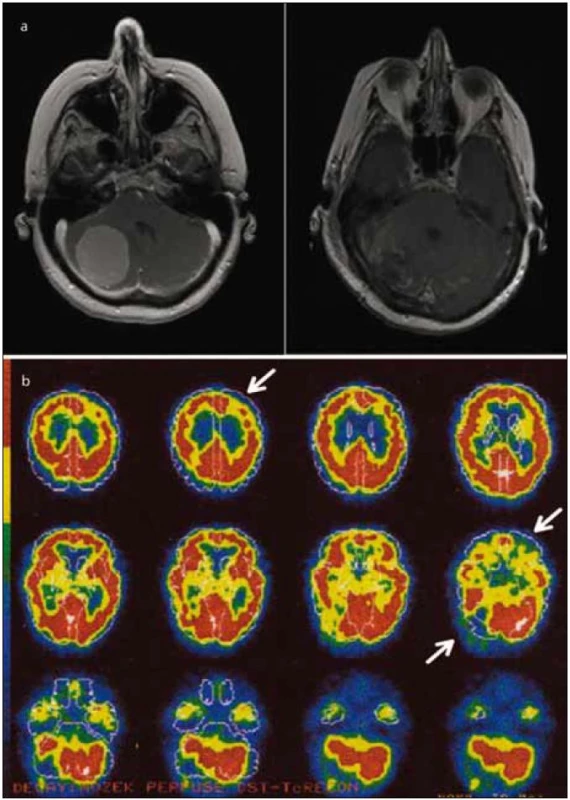
U všech vyšetřených osob jsme nalezli sníženou regionální perfuzi v poškozené mozečkové hemisféře ve srovnání s hemisférou bez léze. Hodnoty koncentrace radiofarmaka se pohybovaly od 78,80 % do 99,30 %, průměrně koncentrace dosáhla 89,30 % (vzhledem ke druhé mozečkové hemisféře), směrodatná odchylka 8,8. Rovněž bylo pozorováno snížení perfuze v kontralaterálním frontálním laloku, ve kterém strukturální poškození nebylo přítomno (obr. 1).
Neuropsychologické vyšetření
Výsledky neuropsychologických testů jsou kvůli lepší přehlednosti rozděleny do dvou tabulek: tab. 3 ukazuje výsledky testů kognitivních funkcí, tab. 4 výsledky testů exekutivních funkcí. Z důvodu přehlednosti jsme rovněž vypustili výsledky testů, ve kterých statistické metody neprokázaly významný rozdíl mezi výzkumnou a kontrolní skupinou.
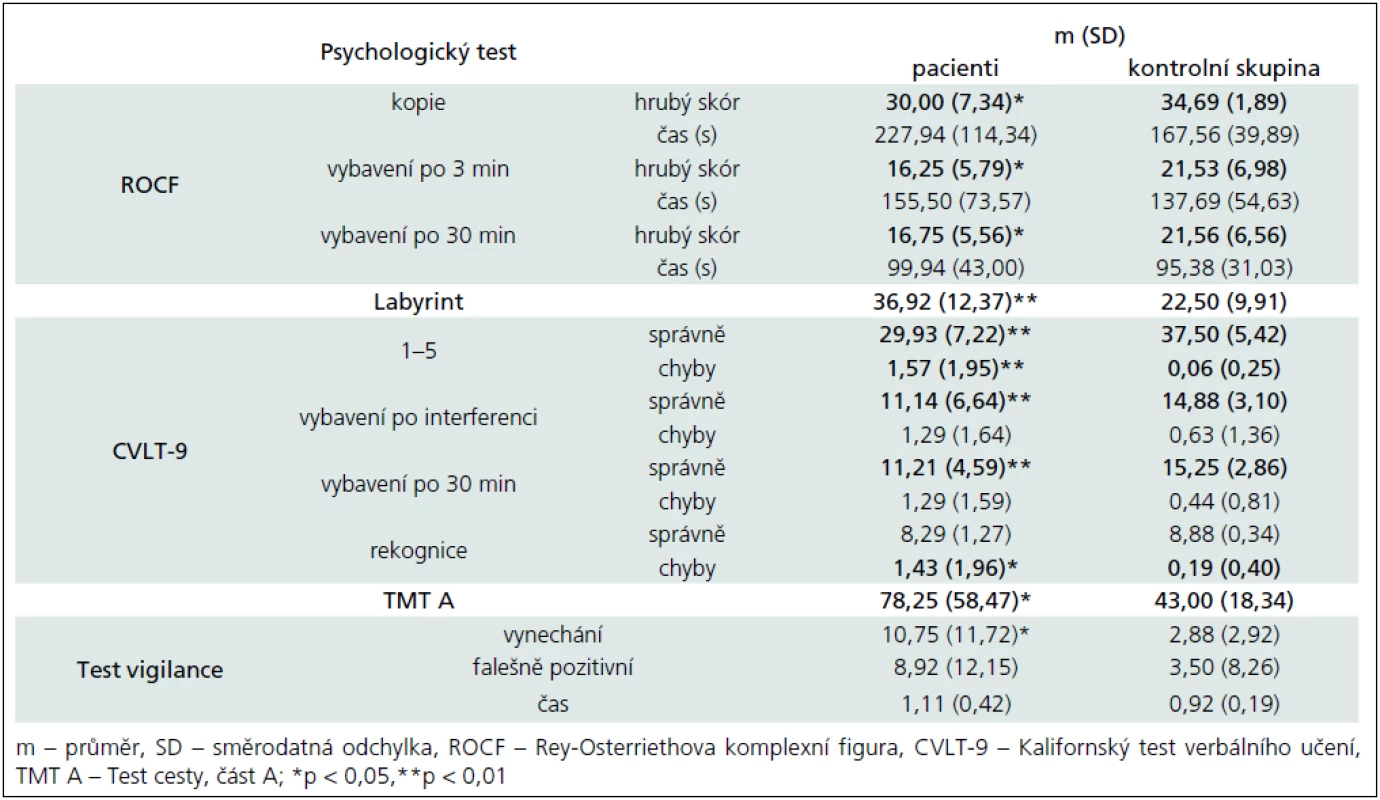
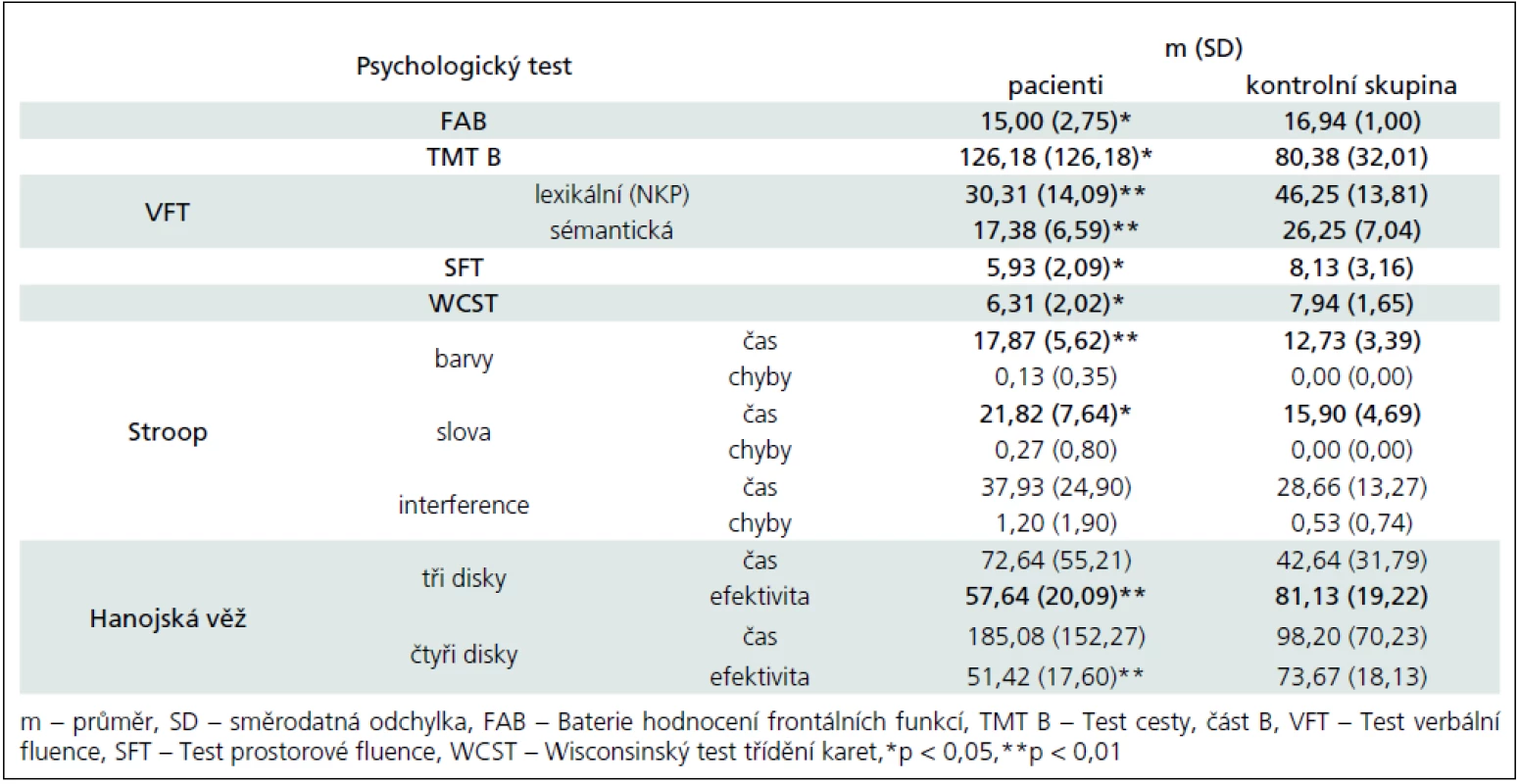
Výsledky kognitivních testů potvrzují zhoršení vizuospaciálních konstrukčních schopností i vizuospaciální paměti (Rey--Osterriethova komplexní figura – nepřítomnost významného rozdílu v čase řešení dále ukazuje, že není zpomaleno tempo kostrukční praxe, ale je narušena kvalita provedení; Labyrint), verbální paměti a učení (Kalifornský test verbálního učení), oslabenou selektivní pozornost a vizuální vyhledávání (Test cesty – TMT), zhoršení udržované pozornosti (Test vigilance). Co se týče psychomotorického tempa, výsledky nejsou konzistentní. Rozdíly byly nalezeny v TMT, ve Stroopově testu u barev a slov a u Hanojské věže se třemi disky; naopak se nezdají přítomny v době konstrukce Rey-Osterriethovy komplexní figury (v žádné z podmínek), ve Stroopově testu u interference, u Hanojské věže se čtyřmi disky, v čase řešení Ravenových matic (CPM) ani v reakčním čase v Testu vigilance.
Nejpřesvědčivější data byla získána u exekutivních funkcí. Již skríningová Baterie hodnocení frontálních funkcí (FAB) odhalila postižení této domény. Další metody tento nález potvrdily a upřesnily: TMT B ukazuje nižší efektivitu přesouvání pozornosti; testy verbální a prostorové fluence nižší flexibilitu myšlení a méně efektivní strategie řešení; Hanojská věž sníženou schopnost plánování postupu; Wisconsinský test třídění karet (WCST) zhoršení abstrakce a úsudku, sníženou flexibilitu a strategii řešení úkolů. Odolnost vůči interferenci podle výsledků ve Stroopově testu naopak není výrazněji snížena.
V testu neverbálního intelektu (CPM) se u našeho souboru zhoršení neprojevilo.
Dotazníky zaměřené na osobnost a náladu neukázaly přesvědčivé rozdíly. Výsledky v Dotazníku emoční empatie a ve všech škálách Minnesotského inventáře osobnosti byly u obou souborů velmi podobné, nepozorovali jsme ani nesignifikantní tendenci jakýmkoli směrem. Jediný statisticky významný rozdíl (p < 0,05) se ukázal ve škále „zmatenost“ v Brunelské škále nálady (BRUMS).
Porovnání pacientů s pravostrannou a levostrannou lézí neukázalo statisticky významné rozdíly (p > 0,05).
Kromě výsledků neuropsychologických metod byl porovnán věk a vzdělání obou výběrů: v těchto charakteristikách se soubory statisticky významně nelišily (p > 0,1).
Diskuze
Výrazné postižení exekutivních funkcí souhlasí s publikovanými daty [7,10,36]. U našeho souboru jsme našli významné zhoršení u všech použitých testů, které vyžadují vytváření a uplatnění určité strategie (např. generování slov u verbální fluence, odhad kategorie ve WCST, postup u Hanojské věže). Výjimkou je Stroopův test, ve kterém jde spíše o inhibici automatické reakce. Je možné, že osoby s lézí mozečku selhávají při vytváření a uplatňování strategií řešení nových situací právě kvůli oslabení vyhodnocování a adaptace vnitřních modelů, jak navrhuje Ito [17,36].
Postižení exekutivních funkcí pravděpodobně souvisí s mozečkovou diaschízou. Tento pojem zavedl Von Monakow pro narušení funkce oblasti mozku vzdálené, ale propojené s původní oblastí poškození [37]. Termín „zkřížená mozečková diaschíza“ označuje oslabení funkce mozečku v důsledku kontralaterální supratentoriální léze [38]. V našem případě jde o „zkříženou mozečkovo-mozkovou diaschízu“, kdy poškození mozečku ovlivňuje funkce mozku, zejména frontobazálně; tento efekt je dobře popsán v literatuře [5,12,38]. Není to tedy mozečkové poškození samo, ale jeho ovlivnění kontralaterálního frontálního laloku, které má za následek exekutivní dysfunkci.
U pacientů s mozečkovou lézí jsme zaznamenali i vyšší rozptyl výsledků testů kognice, což souhlasí se Schmahmannovou teorií dysmetrie myšlení [15,16].
Některé studie naznačují, že postižení pravé mozečkové hemisféry je spojeno s deficity ve zrakově-prostorové oblasti [39] a naopak léze levé mozečkové hemisféry jsou více spojeny s deficitem v oblasti řečové [6,40]. Naše výsledky tento rozdíl nepotvrzují. To může být způsobeno malým rozsahem našeho souboru. Nově publikovaná studie [41] na rozsáhlém vzorku ale rovněž nepotvrdila rozdíly v kognitivním profilu podle strany léze.
V klinické prezentaci pacientů s mozečkovou lézí často pozorujeme změny afektivity. Popisují je již Schmahmann a Sherman jako emoční oploštělost nebo dezinhibici chování [7], podobná zjištění nalezneme i u dalších autorů [42–44]. Naše zkušenosti přítomnost těchto změn potvrzují, pozorovali jsme hlavně zvýšenou afektivní labilitu (drobnými podněty vyvolaný pláč či smích). V rozhovoru asi čtvrtina zkoumaných osob připustila změny nálady. Pokusili jsme se změny zachytit pomocí dotazníků zaměřených na osobnost a náladu, ale statisticky významný rozdíl mezi výzkumnou a kontrolní skupinou objeven pouze v podškále „zmatenost“ v BRUMS. Relativní nepřítomnost postižení emocí v uvedených testech může být důsledkem nedostatku náhledu, případně neporozumění otázkám. Sebeposuzovací dotazníky se tedy u těchto pacientů nezdají být vhodné. Pro validní posouzení afektivity bychom mohli použít buď hodnocení blízkých osob, nebo „objektivnější“ testové metody (např. odhad emocí podle fotografií).
Hlavní omezení
Jsme si vědomi, že rozsah našeho vzorku není velký a navíc jde o léze různé etiologie. Tento nedostatek jsme se pokusili kompenzovat použitím neparametrických statistických testů, které omezují riziko falešně pozitivních výsledků. Namísto norem jsme ke srovnání použili kontrolní soubor, který demograficky přesněji odpovídá charakteristikám pacientů.
Data získaná metodou SPECT jsme zde posuzovali především kvalitativně, abychom ověřili přítomnost zkřížené mozečkovo-mozkové diaschízy (smyslem tohoto vyšetření nebyla přesná lokalizace léze). Dále jsme se zde nebrali do úvahy čas uplynulý od vzniku léze (u všech pacientů to bylo méně než šest měsíců). Jiným významným údajem, jež nemáme k dispozici, jsou data od rodinných příslušníků či jiných pečovatelů, kteří jsou s pacienty v denním kontaktu.
U všech výsledků výkonových neuropsychologických testů bychom měli mít na paměti případné ovlivnění motorickým deficitem. Motorické poškození identifikované škálou ICARS však bylo relativně nízké, proto můžeme předpokládat, že se jedná o deficity specifických kognitivních funkcí.
Závěry
Můžeme shrnout, že u pacientů s mozečkovou lézí jsou nejvýrazněji oslabeny exekutivní funkce (abstrakce, flexibilita, plánování, strategie řešení), dále u nich nacházíme deficity zrakově-prostorových a konstrukčních schopností, verbální i prostorové paměti a učení a selektivní i udržované pozornosti. Z deficitů jazykových funkcí je přítomno snížení sémantické a lexikální verbální fluence. Změny afektivity, ač byly zřetelně přítomné v klinickém obrazu, se dotazníkovými metodami nepodařilo prokázat. Podle současných poznatků se zdá, že lateralizace léze při poškození mozečku nemá vliv na kognitivní výkon.
„Mozečková kognice“ není izolovaná, ale je výrazně ovlivněna funkcí kontralaterálního (hlavně orbitofrontálního) kortexu. Neuropsychologický nález u pacientů s poškozením mozečku je tedy do značné míry podobný nálezu u pacientů s frontální lézí. Přidává se ale výraznější emoční labilita a kognitivní dysmetrie.
Při práci s pacienty s mozečkovou lézí je na místě informovat jejich blízké i je samotné o možné emoční labilitě nebo nedostatku náhledu na citový stav sebe či jiných osob. To jim pomůže vyhnout se nedorozuměním a konfliktům, jež mohou vycházet z nesprávného výkladu situace a chování v ní (např. z dojmu, „že to dělají schválně”) a které nemocným a jejich blízkým ještě více znesnadňují již tak prožívanou zátěž související s onemocněním.
Použité zkratky
- BRUMS – Brunel Mood Scale – Brunelská škála nálady
- CCAS – Cerebellar Cognitive-Affective Syndrome – mozečkový kognitivně-afektivní syndrom
- CPM – Color Progressive Matrices – Ravenovy Barevné progresivní matice
- FAB – Frontal Assessment Battery – Baterie hodnocení frontálních funkcí
- ICARS – International Co-operative Ataxia Rating Scale – Mezinárodní kooperativní škála měření ataxie
- MMPI-100 – Minnesota Multiphasic Personality Inventory – Minnesotský osobnostní inventář, zkrácená verze
- QMEE – The Questionnaire Measure of Emotional Empathy – Dotazník emoční empatie
- TMT – Trail Making Test – Test cesty
- WCST – Wisconsin Card Sorting Test – Wisconsinský test třídění karet
Projekt byl podpořen grantem GAUK č. 259050.Děkujeme Radiodiagnostickému oddělení ÚVN Praha za provedení a poskytnutí MR dokumentace.
Mgr. Eva Bolceková
Neurologická klinika
IPVZ a Thomayerova nemocnice
Vídeňská 800
140 59 Praha 4
e-mail: eva.bolcekova@gmail.com
Přijato k recenzi: 20. 1. 2012
Přijato do tisku: 27. 3. 2012
Zdroje
1. Hamilton NG, Frick RB, Takahashi T, Hopping MW. Psychiatric symptoms and cerebellar pathology. Am J Psychiatry 1983; 140(10): 1322–1326.
2. Leiner HC, Leiner AL, Dow RS. Does the cerebellum contribute to mental skills? Behav Neurosci 1986; 100(4): 443–454.
3. Daum I, Ackermann H, Schugens MM, Reimold C, Dichgans J, Birbaumer N. The cerebellum and cognitive functions in humans. Behav Neurosci 1993; 107(3): 411–419.
4. Grafman J, Litvan I, Massaquoi S, Stewart M, Sirigu A, Hallett M. Cognitive planning deficit in patients with cerebellar atrophy. Neurology 1992; 42(8): 1493–1496.
5. Gómez Beldarrain M, García-Monco JC, Quintana JM, Llorens V, Rodeño E. Diaschisis and neuropsychological performance after cerebellar stroke. Eur Neurol 1997; 37(2): 82–89.
6. Silveri MC, Leggio MG, Molinari M. The cerebellum contributes to linguistic production : a case of agrammatic speech following a right cerebellar lesion. Neurology 1994; 44(11): 2047–2050.
7. Schmahmann JD, Sherman JC. The cerebellar cognitive affective syndrome. Brain 1998; 121(Pt 4): 561–579.
8. Haarmeier T, Thier P. The attentive cerebellum – myth or reality? Cerebellum 2007; 6(3): 177–183.
9. Steinlin M. The cerebellum in cognitive processes: Supporting studies in children. Cerebellum 2007; 6(3): 237–241.
10. Bellebaum C, Daum I. Cerebellar involvement in executive control. Cerebellum 2007; 6(3): 184–192.
11. Ben-Yehudah G, Guediche S, Fiez JA. Cerebellar contributions to verbal working memory: beyond cognitive theory. Cerebellum 2007; 6(3): 193–210.
12. Ackermann H, Mathiak K, Riecker A. The contribution of the cerebellum to speech production and speech perception: clinical and functional imaging data. Cerebellum 2007; 6(3): 202–213.
13. Molinari M, Leggio MG. Cerebellar information processing and visuospatial functions. Cerebellum 2007; 6(3): 214–220.
14. Timmann D, Daum I. Cerebellar contributions to cognitive functions: a progress report after two decades of research. Cerebellum 2007; 6(3): 15–18.
15. Schmahmann JD. Disorders of the cerebellum: Ataxia, dysmetria of thought and the cerebellar cognitive affective syndrome. J Neuropsychiatry Clin Neurosci 2004; 16(3): 367–378.
16. Schmahmann JD. The cerebellar cognitive affective syndrome: clinical correlations of the dysmetria of thought hypothesis. Int Rev Psychiatry 2001; 13(4): 313–322.
17. Ito M. Control of mental activities by internal models in the cerebellum. Nat Rev Neurosci 2008; 9(4): 304–131.
18. Husárová I, Bareš M. Účasť cerebella na kognitívnych a nemotorických funkciách v obraze funkčnej magnetickej rezonancie. Neurol Prax 2008; 9(4): 236–239.
19. Bareš M. Mozeček a kognitivní funkce. In: Rektorová I (ed). Kognitivní poruchy a demence. 1st ed. Praha: Triton 2007 : 52–159.
20. Bareš M, Lungu O, Liu T, Waechter T, Gomez CM, Ashe J. Impaired predictive motor timing in patients with cerebellar disorders. Exp Brain Res 2007; 180(2): 355–365.
21. Bares M, Lungu OV, Husárová I, Gescheidt T. Predictive motor timing performance dissociates between early diseases of the cerebellum and Parkinson‘s disease. Cerebellum 2010; 9(1): 124–135.
22. Bares M, Lungu OV, Liu T, Waechter T, Gomez CM, Ashe J. Neural substrate of predictive motor timing. Cerebellum 2011; 10(2): 233–244.
23. Zumrová A, Kopečková M, Mušová Z, Křepelová A, Apltová L, Paděrová A. Autozomálně dominantní spinocerebellární ataxie. Neurol Prax 2007; 8(5): 277–282.
24. Zumrová A, Mušová Z, Košťálová E, Apltová L, Křepelová A Paděrová A. Autozomálně recesivní a X-vázané ataxie. Neurol Prax 2007; 8(5): 272–276.
25. Trouillas P, Takayanagi T, Hallett M, Currier RD, Subramony SH, Wessel K et al. International Cooperative Ataxia Rating Scale for pharmacological assessment of the cerebellar syndrome. J Neurol Sci 1997; 145(2): 205–211.
26. Preiss M, Rodriguez M, Kawaciuková R, Laing H. Neuropsychologická baterie Psychiatrického centra Praha. 2nd ed. Praha: Psychiatrické centrum Praha 2007.
27. Gaál L. Príručka k programom Neurop-2. 1. vyd. Bernried: Samco 2003.
28. Delis DC, Kramer JH, Freeland J, Kaplan E. Integrating clinical assessment with cognitive neuroscience: construct validation of the California Verbal Learning Test. J Consult Clin Psychol 1988; 56(1): 123–130.
29. Dubois B, Slachevsky A, Litvan I, Pillon B. The FAB: a frontal assessment battery at bedside. Neurology 2000; 55(11): 1621–1626.
30. Jones-Gotman M, Milner B. Design fluency: the invention of nonsense drawings after focal cortical lesions. Neuropsychologia 1977; 15(4–5): 653–674.
31. Regard M. Cognitive rigidity and flexibility: a neuropsychological study. In: Spreen O, Strauss E (eds). A compendium of neuropsychological tests. Administration, norms, and commentary. 1st ed. New York: Oxford University Press 1991 : 52–56.
32. Ferjenčík J. Farebné progresívne matice. 1st ed. Bratislava: Psychodiagnostické a didaktické testy 1985.
33. Stančák A. Skrátená verzia MMPI/100. 1st ed. Bratislava: Psychodiagnostické a didaktické testy 1989.
34. Terry PC, Lane AM. User guide for the Brunel Mood Scale (BRUMS). Unpublished 2003.
35. Mehrabian A, Epstein N. A measure of emotional empathy. J Pers 1972; 40(4): 525–543.
36. Karatekin C, Lazareff JA, Asarnow RF. Relevance of the cerebellar hemispheres for executive functions. Pediatr Neurol 2000; 22(2): 106–112.
37. Feeney DM, Baron JC. Diaschisis. Stroke 1986; 17(5): 817–830.
38. Komaba Y, Osono E, Kitamura S, Katayama Y. Crossed cerebellocerebral diaschisis in patients with cerebellar stroke. Acta Neurol Scand 2000; 101(1): 8–12.
39. Gottwald B, Wilde B, Mihajlovic Z, Mehdorn HM. Evidence for distinct cognitive deficits after focal cerebellar lesions. J Neurol Neurosurg Psychiatry 2004; 75(11): 1524–1531.
40. Mathiak K, Hertrich I, Grodd W, Ackermann H: Cerebellum and speech perception: a functional magnetic resonance imaging study. J Cogn Neurosci 2002; 14(6): 902–912.
41. Tedesco AM, Chiricozzi FR, Clausi S, Lupo M, Molinari M, Leggio MG. The cerebellar cognitive profile. Brain 2011; 134(12): 3669–3683.
42. Turner BM, Paradiso S, Marvel CL, Pierson R, Boles Ponto LL, Hochwa R et al. The cerebellum and emotional experience. Neuropsychologia 2007; 45(6): 1331–1341.
43. Schutter DJ, Van Honk J. The cerebellum on the rise in human emotion. Cerebellum 2005; 4(4): 290–294.
44. Passani B. The emotional cerebellum. Neuroreport 2002; 13(11): 1376.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2012 Číslo 5
-
Všechny články tohoto čísla
- Vliv malých dávek vína či jiných alkoholických nápojů na lidské zdraví a délku života
- Emoční paměť – patofyziologie a klinické souvislosti
- Endovaskulární léčba intrakraniálních aneuryzmat – metodika, indikace, komplikace
- Validita a prediktivní hodnota skríningových testů u prediabetické a časné diabetické polyneuropatie
- Komentář k práci Š. Buršové et al
- Incidence a rizikové faktory pooperačního deliria
- Bezpečnost a účinnost intravenózní trombolytické terapie mozkového infarktu u pacientů nad 80 let věku
- Likvorový triplet (tau proteiny a beta-amyloid) v diagnostice Alzheimerovy-Fischerovy nemoci
- Zhoršení kognitivních funkcí a snížení perfuze v kontralaterálním frontálním laloku u pacientů s lézí mozečku
- Baha jako řešení jednostranné hluchoty po operaci vestibulárního schwannomu
- Sekvestrace MBNL1 proteinu mutovaným ZNF9 mRNA v lymfocytech pacientů s myotonickou dystrofií 2. typu
- Lze detekovat intrakraniální venózní reflux z transkondylárního přístupu? Výsledky studie s Fusion Imaging
- Náhrada defektu kalvy u dítěte po úrazu CNS biokompatibilním materiálem na míru – kazuistika
- Motorické stereotypie v dětském věku – kazuistiky
- Léčba spinálních paragangliomů – kazuistiky
- Amyotrofická laterální skleróza v zařízení paliativní hospicové péče – kazuistika
- Idiopatická stenóza akveduktu a porucha vývoje řeči u dětí s neurofibromatosis von Recklinghausen typ 1 – dvě kazuistiky
- Neurologické komplikace spojené s asistovanou reprodukcí – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XXXV. Rozlišujme poměr šancí a relativní riziko -
8. olomoucké neuroimunologické sympozium s mezinárodní účastí
Olomouc, 20.–21. 9. 2012
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Motorické stereotypie v dětském věku – kazuistiky
- Emoční paměť – patofyziologie a klinické souvislosti
- Neurologické komplikace spojené s asistovanou reprodukcí – kazuistika
- Likvorový triplet (tau proteiny a beta-amyloid) v diagnostice Alzheimerovy-Fischerovy nemoci
