Neurologické komplikace spojené s asistovanou reprodukcí – kazuistika
Neurological Complications Associated with Assisted Reproductive Technology – a Case Report
Assisted reproductive techniques using hormonal ovarian hyperstimulation and intended induction of ovulation are the most important scientific and therapeutic discoveries in the treatment of sterility made over the last decades. This treatment is associated with a risk of a varied degree ovarian hyperstimulation syndrome. The aim of this review is to emphasize some neurological complications possibly resulting from ovarian stimulation. Cerebral strokes are the most important complications of ovarian stimulation. We present a case of ischemic stroke after a controlled ovarian hyperstimulation regimen in a previously healthy 27-year-old woman. An increased rate and intensity of headaches, mostly in patients with chronic migraine, is another neurological complication. In the second case report, we present a 35-year-old woman suffering from complicated migraine developed after ovarian stimulation. Treatment-induced hormonal fluctuation may have negative effect on the activity and susceptibility to autoimmune diseases, such as multiple sclerosis. In the third case report, we present a 37-year-old patient with the first attack of multiple sclerosis after ovarian stimulation.
Key words:
assisted reproductive technology – ovarian hyperstimulation syndrome – neurological complications
Autoři:
I. Okáčová 1; Y. Benešová 1; P. Štouračihash2 1,2 1,2
Působiště autorů:
Neurologická klinika LF MU a FN Brno
1; CEITEC – Středoevropský technologický institut MU, Brno
2; Radiologická klinika LF MU a FN Brno
3
Vyšlo v časopise:
Cesk Slov Neurol N 2012; 75/108(5): 637-640
Kategorie:
Kazuistika
Souhrn
Nejvýznamnějším vědeckým a terapeutickým objevem léčby neplodnosti v posledních desetiletích je asistovaná reprodukce, která využívá metod hormonální ovariální hyperstimulace a plánovanou indukci ovulace. Tato léčba s sebou nese riziko rozvoje tzv. ovariálního hyperstimulačního syndromu, který se může vyskytovat v různých stupních. Cílem práce je upozornit na některé neurologické komplikace, které se mohou v souvislosti s ovariální stimulací vyvinout. Mezi nejzávažnější řadíme cévní mozkové příhody. V první kazuistice prezentujeme 27letou pacientku, která prodělala po ovariální stimulaci ischemickou cévní mozkovou příhodu. Další neurologickou komplikací je pravděpodobně zvýšená frekvence a intenzita bolestí hlavy, zejména u nemocných s migrénami v anamnéze. V druhé kazuistice popisujeme 35letou ženu, u které došlo po terapii k rozvoji komplikované migrény. Léčbou navozená hormonální fluktuace může také nepříznivě ovlivnit aktivitu a vnímavost k rozvoji některých autoimunitních chorob, včetně roztroušené sklerózy. Ve třetí kazuistice se věnujeme 37leté pacientce, u které vznikla po ovariální stimulaci první ataka roztroušené sklerózy.
Klíčová slova:
asistovaná reprodukce – ovariální hyperstimulační syndrom – neurologické komplikace
Úvod
Poruchy plodnosti jsou v současné době diagnostikovány u 15–20 % párů v hospodářsky vyspělých zemích Evropy. Nejzásadnějším vědeckým a terapeutickým objevem léčby neplodnosti v posledních desetiletích je asistovaná reprodukce (ART). K jejím základním metodám patří in vitro fertilizace a embryotransfer (IVF + ET). Podstatou je navození ovariální hyperstimulace podáním agonistů nebo antagonistů gonadotropních hormonů. Následná aplikace choriového gonadotropinu (hCG) indukuje dozrání oocytů a před transferem embryí se podávají gonadotropiny k podpoře růstu děložní sliznice [1]. V České republice se v současnosti rodí více než 3 % dětí pomocí této metody.
Hormonální léčba je spojena s rizikem rozvoje ovariálního hyperstimulačního syndromu (OHSS). Jedná se o iatrogenní komplikaci umělého oplodnění. Podle závažnosti rozdělujeme OHSS do několika stupňů na lehký, střední a těžký (tab. 1), který může skončit i fatálně [2]. Incidence této komplikace je udávána v rozmezí 0,5–11,2 % a je dána pravděpodobně souhrou několika faktorů. Střední stupeň OHSS se vyskytuje ve 2–5 %, těžké případy vyžadující hospitalizaci se objevují v méně než 1 % stimulovaných cyklů [2].
![Stupně ovariálního hyperstimulačního syndomu [2].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/5c1fb97ed453232514f31433d983b93d.png)
Terapie OHSS je především symptomatická a empirická. Základní léčba spočívá v zachování bilance tekutin, včasném podání albuminu a koloidů, prevenci trombotické příhody, případně punkcích ascitu a sledování klinických parametrů. Lehčí formy mají tendenci ke spontánní úpravě [3].
Tato práce vznikla díky projektu „CEITEC – Středoevropský technologický institut“ (CZ.1.05/1.1.00/02.0068) z Evropského fondu regionálního rozvoje.
Predisponujícími faktory vzniku OHSS jsou astenický habitus, věk ženy do 30 let, přítomnost syndromu polycystických ovarií, typ použitého stimulačního protokolu, luteální suplementace hCG, OHSS v předchozí graviditě a v neposlední řadě také navozená gravidita [4–5].
V souvislosti s OHSS se mohou vyvinout některé neurologické komplikace, například rozvoj cévních mozkových příhod, předpokládá se také vyšší frekvence migrenózních záchvatů. Samotná ovariální stimulace může vést ke zvýšení vnímavosti k rozvoji některých autoimunitních onemocnění, včetně roztroušené sklerózy (RS).
V naší práci uvádíme několik pacientek s neurologickými komplikacemi v souvislosti s ovariální stimulací.
Kazuistika 1
Pacientka, 27 let, dosud zdravá bez interních komorbidit a známých vaskulárních rizikových faktorů podstoupila kompletní IVF cyklus s embryotransferem (ET). Během osmi dnů po ET se rozvíjel břišní dyskomfort a bolesti břicha. Osmý den byla ambulantně provedena punkce ascitu o objemu 3 000 ml. Následující, devátý den po ET došlo k náhlému rozvoji levostranné hemiparézy akcentované na horní končetině do plegie, postižení dolní končetiny bylo těžkého stupně. Na vstupním vyšetření mozku výpočetní tomografií (CT) nebylo prokázáno recentní ischemické ložisko. Transkraniální dopplerovská sonografie při přijetí prokázala okluzi v úseku M1 arteria cerebri media vpravo, tento nález zůstal stacionární i na kontrolním vyšetření po pěti dnech. Pacientce bohužel nemohla být podána intravenózní trombolýza ani jiná intervenční metoda, neboť byla přijata mimo časové okno i pro mechanickou trombektomii. Byla zjištěna gravidita, hodnota hCG při přijetí činila 105 U/l, narůstala až do 20. dne po ET, poté došlo k náhlému poklesu a pacientka spontánně potratila. Za hospitalizace byla provedena další punkce ascitu o objemu 2 000 ml. V krevních odběrech byla nalezena mírná leukocytóza, elevace jaterních testů, pokles celkové bílkoviny a albuminu. Byla prokázána heterozygotní Leidenská mutace faktoru V. Ultrasonografickým vyšetřením nebyla prokázána žilní trombóza dolních končetin ani pánevních žil. Také podezření na otevřené foramen ovale nebylo potvrzeno. Při propuštění z nemocnice desátý den od vzniku cévní mozkové příhody stále přetrvávala levostranná hemiparéza akcentovaná na horní končetině do plegie, postižení dolní končetiny zůstalo středně těžkého stupně. Pacientka je schopna chůze s doprovodem. Na kontrolní MR byla rozvinutá ischemie v oblasti bazálních ganglií vpravo a frontoparietálně vpravo (obr. 1 a 2) [6].
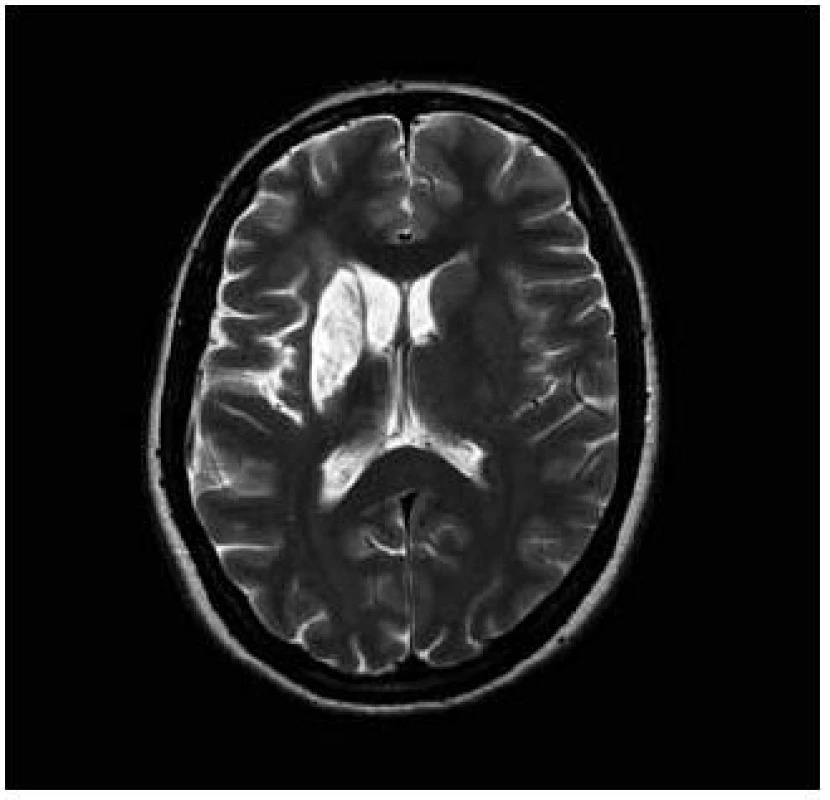
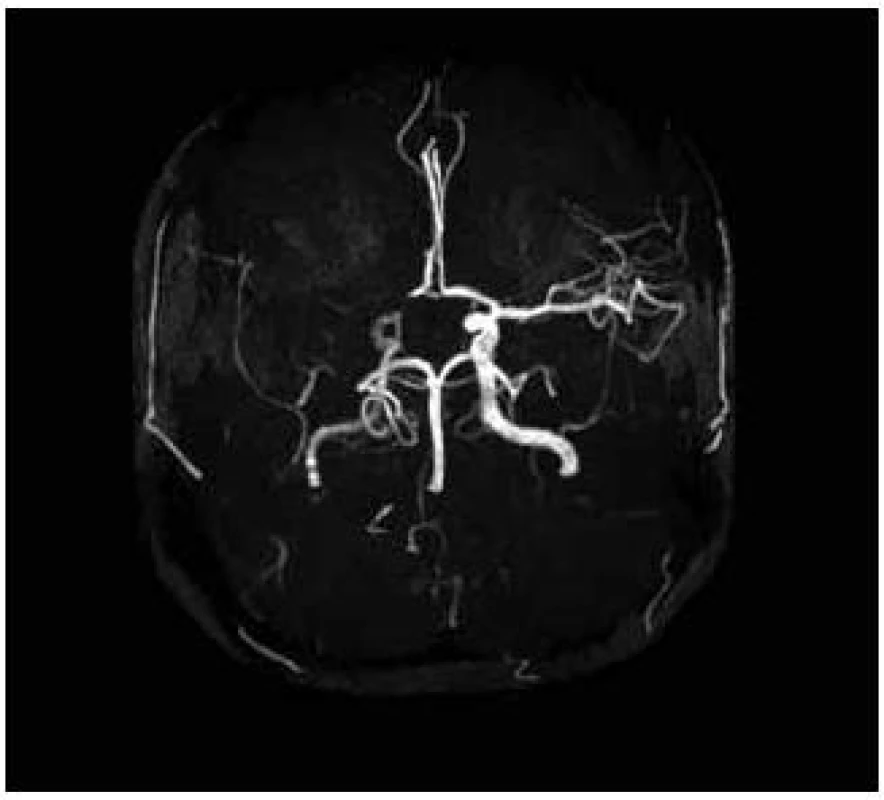
Kazuistika 2
Pacientka, 35 let, trpěla od osmi let migrénami, jinak neměla žádná onemocnění. Bolesti hlavy byly lokalizovány pravostranně, trvající průměrně dva dny s frekvencí asi jedenkrát měsíčně. Bolesti doprovázela fotofobie, fonofobie, nauzea a intermitentně zvracení. Od nástupu menstruace se bolesti hlavy vyskytovaly v souvislosti s menstruačním cyklem. Jednalo se o menstruační migrénu bez aury. Po nasazení hormonální antikoncepce došlo ke zvýšení intenzity bolestí hlavy, proto pacientka hormonální antikoncepci vysadila a stav se opět zlepšil. Pacientka byla vyšetřena a sledovaná na neurologii od roku 2004. Objektivní neurotopický nález byl v normě, CT vyšetření mozku s aplikací kontrastní látky a elektroencefalografické vyšetření neprokázalo patologický nález. Stav byl uzavřen jako migréna bez aury. Bolesti hlavy zpočátku reagovaly na běžná analgetika, od roku 2006 pacientka užívala triptany.
Ve 39 letech podstoupila ovariální stimulaci před IVF. Za měsíc se u pacientky rozvinula silná cefalea charakteru pravostranné hemikranie, která byla provázena zvracením a měla vyšší intenzitu než předchozí ataky. Během týdne se navíc přidaly subfebrilie a pravostranné otalgie, které odezněly do několika dní. Intenzita bolestí hlavy se poté zmírnila, jednalo se pravděpodobně o koincidenci migrény a sekundární bolesti hlavy při přechodném otogenním infektu. Kontrolní CT vyšetření mozku bylo v normě.
S odstupem jednoho měsíce se k bolestem hlavy přidaly parestezie pravé horní končetiny lokalizované akrálně a zraková aura. K vyloučení sekundární etiologie obtíží byla provedena magnetická rezonance (MR) mozku, která prokázala cystu glandulae pinealis o velikosti 8 × 6 mm bez známek útlaku okolních struktur. Neurochirurgická intervence nebyla indikována. Stav byl zhodnocen jako komplikace migrény (status migrenosus). Po léčbě triptany došlo ke zlepšení stavu, bolesti hlavy i ložiskové příznaky zcela odezněly do dvou měsíců. Cefalea nebyla kontraindikací k další ovariální stimulaci a pacientka absolvovala ve 40 letech znovu cyklus IVF. Nyní je ve 3. měsíci gravidity, bez obtíží.
Kazuistika 3
Pacientka, 37 let, trpěla od 30 let amenorrheou a opakovaně podstoupila IVF. V léčebném protokolu byl použit gonadotropin-releasing hormon, folikuly stimulační hormon, modulátory estrogenních receptorů a hCG. Pět stimulačních cyklů proběhlo bez komplikací. V průběhu šestého cyklu stimulace si pacientka začala stěžovat na nespecifické obtíže, zvýšenou únavnost, nesoustředěnost a poruchu kognitivních funkcí. K hospitalizaci byla přijata pro lehkou pravostrannou hemiparézu. Diferenciálně diagnosticky byla zvažována vaskulární nebo demyelinizační etiologie. Na CT vyšetření mozku bylo popsáno parietálně vlevo nad postranní komorou izodenzní ložisko okrouhlého tvaru o velikosti 25 mm, lemované malým edémem. Následně bylo provedeno MR vyšetření mozku, kde byla prokázána vícečetná T2 hyperintenzní ložiska supratentoriálně, největší z nich, tumoriformní o velikosti 40 × 26 × 28 mm s lehkým postkontrastním sycením vlevo při zadním rohu postranní komory. V minulosti pacientka neměla žádné zobrazovací vyšetření mozku, proto nebylo možno provést srovnání s předchozím nálezem. V mozkomíšním moku, který byl nezánětlivý, bylo prokázáno sedm oligoklonálních pásů, které nebyly přítomny v séru. Byl diagnostikován klinicky izolovaný syndrom. Pacientka byla léčena kortikoidy, podali jsme metylprednizolon v dávce 3 g a byla zahájena imunomodulační terapie interferony. Došlo ke zlepšení klinického stavu a snížení EDSS skóre ze stupně 3,5 na 1,5, pravostranná diparéza zcela regredovala. Kontrolní MR vyšetření mozku s odstupem dvou měsíců prokázalo zmenšení tumoriformní plaky a snížení počtu T2 hyperintenzních ložisek (obr. 3 a 4).
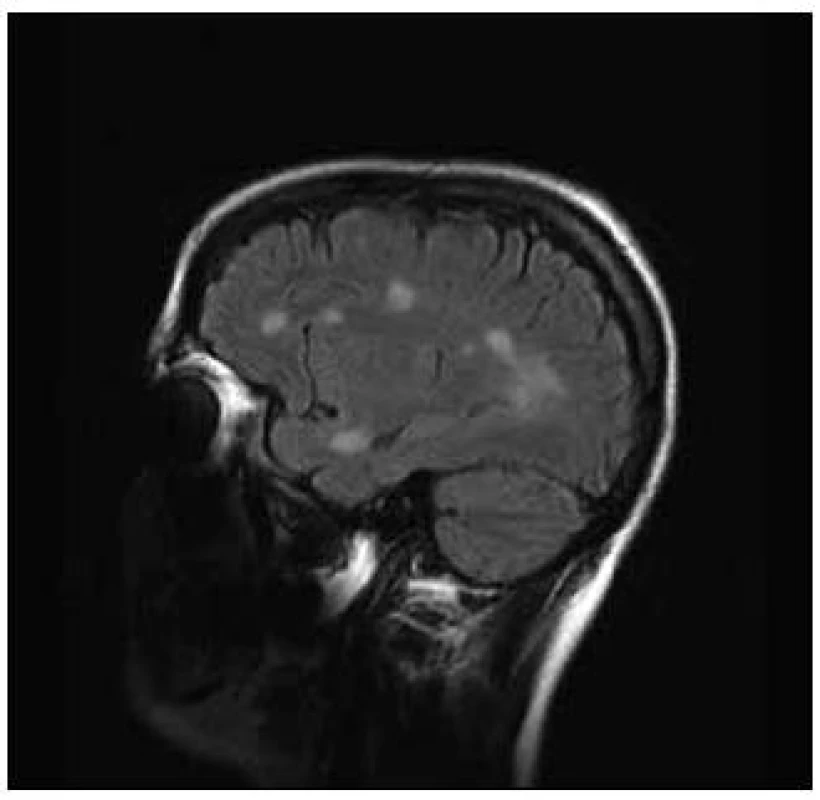
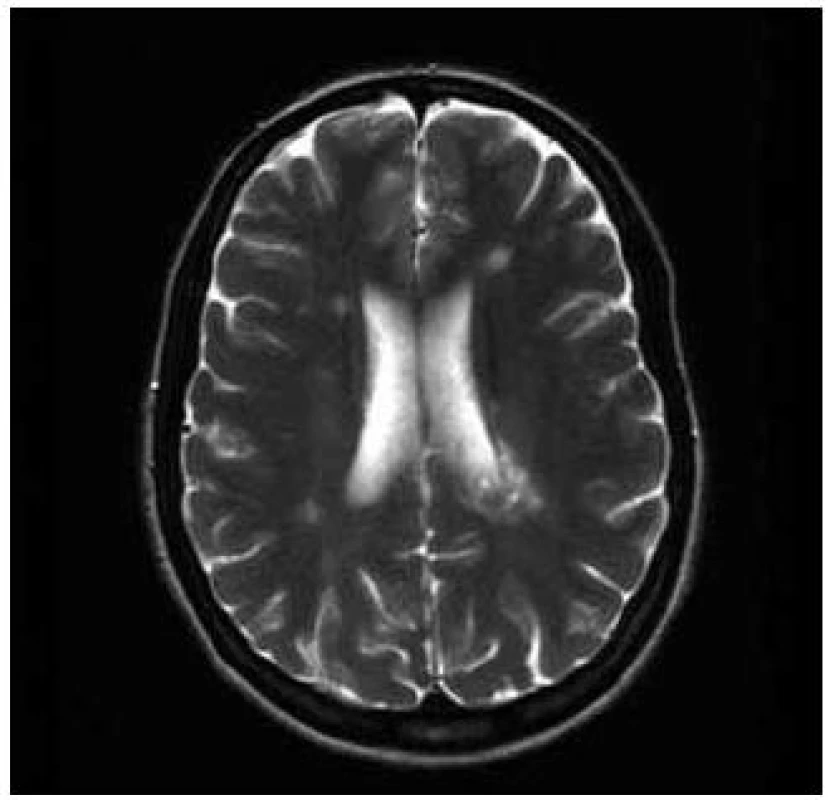
Diskuze
Klíčovou roli v patofyziologii OHSS hraje zvýšení kapilární permeability vlivem uvolněných vazoaktivních látek produkovaných vaječníky v průběhu ovariální stimulace a únik tekutiny z cév do extravaskulárního prostoru, zejména do dutiny břišní, pohrudniční nebo perikardiální. Na poruše kapilární permeability se podílejí především renin-angiotenzin systém, interleukiny, tumor nekrotizující faktor alfa, endotelin-1 a cévní endoteliální růstový faktor (VEGF) [7]. Větší výpotky se mohou projevit klinicky především dušností, která je jedním z prvních příznaků signalizujících závažný stav. K dušnosti přispívá vysoká poloha bránice při ascitu, který může být i monstrózních rozměrů, spolu s velkým objemem ovarií, která mohou dosáhnout většího průměru než 15 cm. Dušnost může být způsobena také pleurálním či perikardiálním exudátem [2].
Hemokoncentrace, která vznikla transsudací, zvyšuje riziko intravaskulární trombózy i bez větší primární alterace hodnot koagulačních parametrů [2].
Zvyšuje se riziko intravaskulární tepenné nebo žilní trombózy a rozvoje ischemických cévních mozkových příhod (CMP), embolizačních příhod nebo trombózy žilních splavů. Tyto komplikace se většinou vyskytují v souvislosti s rozvojem těžké formy OHSS. Incidence se uvádí mezi 0,5 a 1 % [6]. U pacientky popisované v kazuistice se jednalo o těžkou formu OHSS s nálezem masivního ascitu.
Bylo popsáno několik případů žen, u kterých vznikla po ovariální stimulaci ischemická (CMP) [8,9,10], trombóza žilních splavů [11] nebo kardioembolická příhoda [12]. Tyto případy prokazují, že ovariální stimulace může být rizikovým faktorem pro rozvoj CMP u jinak zdravých žen. Riziko trombóz se dále zvyšuje při současné koincidenci s dalšími faktory, např. Leidenskou mutací nebo antifosfolipodovým syndromem. U pacientek s antifosfolipidovým syndromem je popisována zvýšená incidence spontánních abortů [13], tyto nemocné častěji podstupují ART a jsou vystaveny vyššímu riziku rozvoje OHSS spolu s komplikací v podobě trombembolické příhody [13].
Léčba ischemické CMP v těhotenství je specifická. Pokud se pacientka dostaví v časovém okně a splňuje kritéria pro podání intravenózní nebo intraarteriální trombolýzy, je těhotenství považováno za všeobecnou kontraindikaci. Pouze v případě akutního, život ohrožujícího stavu je nutné posoudit terapeutický přínos a riziko této léčby. Ve studiích prováděných na zvířatech bylo prokázáno, že rekombinantní tkáňový aktivátor plazmimogenu (rTPA) neprostupuje placentou a nebyly prokázány známky teratogenicity [14]. V literatuře bylo popsáno také několik případů podání trombolýzy gravidní pacientce. rTPA byl například podán nemocné ve třetím trimestru těhotenství, u které byla prokázána okluze arteria carotis media vpravo, pět hodin po rozvoji levostranné hemiplegie. Neurologický nález kompletně regredoval a pacientka o tři dny později porodila zdravé dítě [15].
V léčbě sekundární prevence ischemické cévní mozkové příhody se užívá kyselina acetylsalicylová. Její podání může v počátku těhotenství zvýšit riziko potratu. Ve třetím trimestru vzrůstá riziko předčasného uzavření ductus arteriosus, prodloužení těhotenství a porodu a také hemoragických komplikací během porodu u matky i novorozence. Z těchto důvodů by kyselina acetylsalicylová neměla být ve třetím trimestru těhotenství podávána [16].
Další neurologickou komplikací in vitro fertilizace a embryotransferu je pravděpodobně zvýšená frekvence a intenzita bolestí hlavy, zejména u nemocných s migrénami v anamnéze. Kolísání sérové hladiny estrogenů je považováno za spouštěcí faktor migrenózní bolesti hlavy. Toto potvrzuje retrospektivní studie pacientek podstupujících stimulaci před IVF [17]. Protokoly ART jsou asociovány s výraznou hormonální fluktuací. Cefalea se nejčastěji vyskytovala ve fázi ovariální stimulace, kdy jsou sérové hladiny estrogenu nejnižší [17].
Předpokládá se také, že by mohla existovat asociace mezi migrénami a rozvojem OHSS. Ze studie Rolleneho et al vyplývá, že v patogenezi obou onemocnění se významně uplatňuje porušená regulace dopaminergního systému, na které by se mohly podílet podobné genové mutace vázané na dopamin. Bylo prokázáno, že po podání dopaminových agonistů došlo ke snížení kapilární permeability a zlepšení OHSS [18].
Léčbou navozená hormonální fluktuace může také nepříznivě ovlivnit aktivitu a vnímavost k rozvoji některých autoimunitních chorob, včetně RS [19]. RS postihuje 1,5–2,5krát častěji ženy než muže a k rozvoji onemocnění dochází nejčastěji ve fertilním věku [20]. Pohlavní hormony mají pleiotropní efekt, který závisí na koncentraci, zejména u estrogenů, jejich konverzi na jiné metabolity a interakci s vnitřním prostředím. Výsledné ovlivnění komplexních interakcí mezi imunitním systémem a lokálním prostředím pohlavními hormony vede ke zvýšení nebo útlumu autoimunitní reakce [21]. Bylo prokázáno, že nízké hladiny estrogenů navozují Th-1 typ imunitní odpovědi a expresi prozánětlivých cytokinů. Naopak vysoké hladiny estrogenů a progesteron navozují Th-2 typ imunitní odpovědi a zvýšení sekrece protizánětlivých cytokinů [22].
Byl popsán zvýšený počet roční frekvence relapsů; relaps rate u pacientek po ovariální stimulaci před IVF. Bylo také prokázáno, že podání agonistů gonadotropních hormonů v léčebném protokolu ovlivňuje nepříznivěji průběh nemoci a relaps rate než podání jejich antagonistů [23].
Závěr
Poruchy plodnosti jsou v současné době velmi časté. Metody umělého oplodnění dávají párům novou naději, současně ale mohou být spojeny s rizikem rozvoje hyperstimulačního syndromu. Cílem tohoto sdělení je upozornit na možné nejčastější neurologické komplikace, spojené s umělým oplodněním
Tato práce vznikla díky projektu „CEITEC – Středoevropský technologický institut“ (CZ.1.05/1.1.00/02.0068) z Evropského fondu regionálního rozvoje.
MUDr. Iva Okáčová
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: Iva.okacova@fnbrno.cz
Přijato k recenzi: 2. 11. 2011
Přijato do tisku: 20. 4. 2012
Zdroje
1. Crha I. Farmakoterapie v reprodukční medicíně. Prakt Lekaren 2010; 6(4): 173–176.
2. Marek D, Machač S. Ovariální hyperstimulační syndrom-soubor interních komplikací u gynekologických pacientek podstupujících in vitro fertilizaci. Interni Med 2003; 8 : 389–394.
3. Chen CD, Wu MY, Chao KH, Lien YR, Chen SU, Yang YS. Update on management of ovarian hyperstimulation syndrome. Taiwan J Obstet Gynecol 2011; 50(1): 2–10.
4. Delvigne A, Demoulin A, Smitz J. The ovarian hyperstimulation syndrome in vitro fertilization: a Belgian multicentric study. Hum Reprod 1993; 8(9): 1353–1360.
5. Mardešič T. Hyperstimulační syndrom, klasifikace, patofyziologie, prevence a léčba. Cesk Gynekol 1993; 58(1): 23–26.
6. Latová H, Bednařík J. Ischemický iktus jako komplikace ovariálního hyperstimulačního syndromu – kazuistika. Cesk Slov Neurol N 2008; 71/104 (Suppl 3): S128.
7. Elchalal U, Schenker JG. The pathophysiology of ovarian hyperstimulation syndrome – views and ideas. Hum Rep 1997; 12(6): 1129–1137.
8. Qazi A, Ahmed AN, Qazi MP, Usman F, Ahmad A. Ischemic stroke with ovarian hyperstimulation syndrome. J Pak Med Assoc 2008; 58(7): 411–413.
9. Hwang WJ, Lai ML, Hsu CC, Hou NT. Ischemic stroke in a young woman with ovarian hyperstimulation syndrome. J Formos Med Assoc 1998; 97(7): 503–506.
10. Bártková A, Sanak D, Dostál J. Acute ischaemic stroke in pregnancy: a severe complication of ovarian hyperstimulation syndrome. Neurol Sci 2008; 29(6): 463–466.
11. Man BL, Hui ACF. Cerebral venous thrombosis secondary to ovarian hyperstimulation syndrome. Hong Kong Med J 2011; 17(2): 155–156.
12. Worrell GA, Wijdicks EFM, Eggers MD. Ovarian hyperstimulation syndrome with ischemic stroke due to an intracardiac trombus. Neur Sci 2008; 29(6): 463–466.
13. Koo EJ, Rha JH, Lee BI, Kim MO, Ha CK. A case of cerebral infarct in combined antiphospholipid antibody and ovarian hyperstimulation syndrome. J Korean Med Sci 2002; 17(4): 574–576.
14. Tate J, Bushnell C. Pregnancy and stroke risk in women. Womens Health (Lond Engl) 2011; 7(3): 363–374.
15. Johnson D, Kramer D, Cohen E, Rochon M, Rosner M, Weinberger J. Trombolytic therapy for acute stroke in late pregnancy with intra-arterial recombinant tissue plasminogen activator. Stroke 2005; 36(6): E53–E55.
16. Keller O, Linhartová A. Některá další neurologická onemocnění a jejich léčba v graviditě a laktaci. Neurol Prax 2010; 11(5): 300–302.
17. Amir BY, Yaacov B, Guy B, Gad P, Itzhak W, Gal I. Headaches in women undergoing in vitro fertilization and embryo-transfer treatment. Headache 2005; 45(3): 215–219.
18. Rollene NL, Khan Z, Schroeder DR, Cutrer FM, Coddington CC. Migraines and ovarian hyperstimulation syndrome: a dopamine connection. Fertil Steril 2011; 95(1): 417–419.
19. Cutolo M, Sulli A, Capellino S. Sex hormones influence on the immune system: basic and clinical aspects in autoimmunity. Lupus 2004; 13(9): 635–638.
20. Orton SM, Herrera BM, Yee IM, Valdar W, Ramagopalan SV, Sadovnick AD et al. Canadian Collaborative Study Group. Sex ratio of multiple sclerosis in Canada: a longitudinal study. Lancet Neurol 2006; 5(11): 932–936.
21. Nicot A. Gender and sex hormones in multiple sclerosis pathology and therapy. Front Biosci 2009; 14 : 4477–4515.
22. Ebers G. Environmental factors in multiple sclerosis. MS Forum 1998; Modern Management Workshop, Montréal.
23. Laplaud DA, Lefrère F, Leray E, Barrière P, Wiertlewski S. Increased risk of relapse in multiple sclerosis patients after ovarian stimulation for in vitro fertilization. Gynecol Obstet Fertil 2007; 35(10): 1047–1050.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2012 Číslo 5
-
Všechny články tohoto čísla
- Vliv malých dávek vína či jiných alkoholických nápojů na lidské zdraví a délku života
- Emoční paměť – patofyziologie a klinické souvislosti
- Endovaskulární léčba intrakraniálních aneuryzmat – metodika, indikace, komplikace
- Validita a prediktivní hodnota skríningových testů u prediabetické a časné diabetické polyneuropatie
- Komentář k práci Š. Buršové et al
- Incidence a rizikové faktory pooperačního deliria
- Bezpečnost a účinnost intravenózní trombolytické terapie mozkového infarktu u pacientů nad 80 let věku
- Likvorový triplet (tau proteiny a beta-amyloid) v diagnostice Alzheimerovy-Fischerovy nemoci
- Zhoršení kognitivních funkcí a snížení perfuze v kontralaterálním frontálním laloku u pacientů s lézí mozečku
- Baha jako řešení jednostranné hluchoty po operaci vestibulárního schwannomu
- Sekvestrace MBNL1 proteinu mutovaným ZNF9 mRNA v lymfocytech pacientů s myotonickou dystrofií 2. typu
- Lze detekovat intrakraniální venózní reflux z transkondylárního přístupu? Výsledky studie s Fusion Imaging
- Náhrada defektu kalvy u dítěte po úrazu CNS biokompatibilním materiálem na míru – kazuistika
- Motorické stereotypie v dětském věku – kazuistiky
- Léčba spinálních paragangliomů – kazuistiky
- Amyotrofická laterální skleróza v zařízení paliativní hospicové péče – kazuistika
- Idiopatická stenóza akveduktu a porucha vývoje řeči u dětí s neurofibromatosis von Recklinghausen typ 1 – dvě kazuistiky
- Neurologické komplikace spojené s asistovanou reprodukcí – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XXXV. Rozlišujme poměr šancí a relativní riziko -
8. olomoucké neuroimunologické sympozium s mezinárodní účastí
Olomouc, 20.–21. 9. 2012
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Motorické stereotypie v dětském věku – kazuistiky
- Emoční paměť – patofyziologie a klinické souvislosti
- Neurologické komplikace spojené s asistovanou reprodukcí – kazuistika
- Likvorový triplet (tau proteiny a beta-amyloid) v diagnostice Alzheimerovy-Fischerovy nemoci
