Validita Testu 16 slov pro diferenciální diagnostiku demence Alzheimerova typu a behaviorální formy frontotemporální demence
Validity of Enhanced Cued Recall Test in the Diagnosis of Alzheimer Dementia and Behavioral Variant of Frontotemporal Dementia
Introduction:
Enhanced Cued Recall (ECR) memory test is especially valuable in screening for cognitive impairment in the elderly. ECR uses categorical cues during controlled encoding and recall; tests based on this paradigm are considered to be able to identify hippocampal memory impairment characterized by poor free recall with minimal effect of cueing, typical of Alzheimer’s disease (AD). The test could aid in differentiating memory impairment in behavioural variant frontotemporal dementia (bvFTD) versus AD – despite the poor free recall bvFTD patients benefit considerably from cueing.
Objective:
To establish the validity of ECR in diagnosing memory impairment in AD and bvFTD. Methods: Thirty six patients with probable mild AD (MMSE 21.7 ± 2.4), 15 with probable bvFTD (MMSE 23.8 ± 2.4) and 45 healthy elderly (HE) (MMSE 28.96 ± 1.17) underwent clinical and neuropsychological examination including ECR.
Results:
There was a statistically significant difference between all groups in all three ECR memory performance scores: free recall, total recall and cueing effect (p < 0.001). Free recall was the most effective score for discriminating dementias from healthy elderly (sensitivity 94% and specificity 100% for AD and sensitivity 80% and specificity 91% for bvFTD); total recall was most effective for differential diagnosis of both dementias (sensitivity 86% and specificity 87%).
Conclusion:
ECR is a highly sensitive and specific test for identification of memory impairment in AD and bvFTD, and can contribute to the differential diagnosis. We recommend it as highly useful test for clinical practice.
Key words:
Alzheimer dementia – frontotemporal dementia – memory
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
M. Urbanová 1; M. Vyhnálek 1,2; T. Nikolai 1,2; J. Michalec 3; K. Sheardová 1,4; J. Laczó 1,2; D. Hudeček 1,4; J. Hort 1,2
Působiště autorů:
Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně
1; Kognitivní centrum, Neurologická klinika 2. LF UK a FN v Motole, Praha
2; Psychiatrická klinika 1. LF UK a VFN v Praze
3; Neurologická klinika LF MU a FN u sv. Anny v Brně
4
Vyšlo v časopise:
Cesk Slov Neurol N 2014; 77/110(5): 576-581
Kategorie:
Původní práce
Za podpory projektu FNUSA‑ ICRC (no. CZ.1.05/ 1.1.00/ 02.0123) z Evropského fondu regionálního rozvoje, podpořeno MZ ČR – RVO, FN v Motole 00064203 a grantem IGA NT 11225-4.
Souhrn
Úvod:
Test 16 slov (T16S) (v originálu Enhanced Cued Recall Test) je skríningový test k diagnostice poruch paměti ve stáří. T16S využívá kategorickou nápovědu během kontrolovaného učení a vybavení. Předpokládá se, že testy vycházející z tohoto paradigmatu jsou schopny identifikovat tzv. hipokampální poruchu paměti, která je charakterizována nízkým skóre ve volném vybavení s minimálním efektem nápovědy a je typická pro Alzheimerovu demenci (AD), a odlišit ji od poruchy paměti frontálního typu, kdy například pacienti s behaviorální variantou frontotemporální demence (bvFTD) navzdory nízkému volnému vybavení relativně profitují z nápovědy.
Cíl:
Ověřit rozlišovací schopnost a využitelnost T16S v diferenciální diagnostice poruch paměti u pacientů s AD a s bvFTD. Metodika: Třicet šest pacientů s diagnózou pravděpodobné AD ve stadiu lehké demence (MMSE 21,7 ± 2,4), 15 pacientů s pravděpodobnou bvFTD (MMSE 23,8 ± 2,4) a 45 kognitivně zdravých seniorů (KS) (MMSE 28,96 ± 1,17) bylo vyšetřeno klinicky, absolvovali komplexní vyšetření neuropsychologickou baterií včetně T16S.
Výsledky:
Skupiny se lišily ve všech třech ověřovaných skórech T16S: ve volném a celkovém vybavení i ve využití nápovědy (p < 0,001). Pro odlišení obou demencí od norem je vhodné zejména skóre volného vybavení (senzitivita a specificita 94 % a 100 % pro AD a 80 % a 91 % pro bvFTD), pro diferenciální diagnostiku obou demencí je nejlepším indexem skór celkového vybavení (senzitivita 86 % a specificita 87 %).
Závěr:
Test paměti T16S je senzitivní a specifický test pro diagnostiku specifické poruchy paměti u AD a bvFTD. Může přispět k diferenciální diagnostice a jako takový ho doporučujeme k praktickému použití v klinické praxi.
Klíčová slova:
Alzheimerova demence – frontotemporální demence – paměť
Úvod
Alzheimerova demence (AD) a behaviorální forma frontotemporální demence (bvFTD) jsou časté demence degenerativní etiologie. Patologické změny sdružené s AD typicky postihují již v časném stadiu hipokampus, a klinickému obrazu proto dominují poruchy paměti [1]. Naproti tomu maximum neurodegenerativních změn u pacientů s behaviorální formou frontotemporální demence (bvFTD) je situováno ve frontálním laloku a na frontotemporálním pomezí. Časným projevem této choroby bývají proto poruchy chování a dysexekutivní syndrom projevující se poruchami plánování a logického myšlení [2]. Navzdory těmto odlišnostem v klinické manifestaci obou onemocnění existují četné překryvy v jejich kognitivní prezentaci [3], a tudíž je jejich diferenciální diagnostika v klinické praxi často obtížná.
Při stanovení diagnózy může pomoci MR mozku, kde pro bvFTD je charakteristická výrazná atrofie frontálně a temporálně, často stranově asymetrická, a pro pacienty s AD pak atrofie temporálního a parietálního laloku [4,5]. Vzhledem k častému výskytu atypických obrazů nemusí však ani MR v řadě případů přispět k rozlišení AD a bvFTD.
V diferenciální diagnostice časné fáze obou demencí je proto cenné vyšetření neuropsychologickou baterií prokazující u pacientů s bvFTD převažující dysexekutivní syndrom a u pacientů s AD pak dominující deficit paměti [6].
V některých paměťových testech výrazně selhávají jak pacienti s AD, tak i pacienti s bvFTD, a to i ti, kteří v běžném životě výraznější paměťové obtíže nemají. Týká se to zejména paměťových testů, jež neobsahují kontrolované ukládání ani vybavení s vodítky (z rutinně používaných testů například Paměťový test učení, Preiss 2002). Toto jejich selhání může být z velké části způsobeno poruchou pozornosti a strategie a nikoli primárně paměťovými obtížemi [7,8].
V nejnovějších evropských doporučeních pro diagnostiku Alzheimerovy nemoci (AN) [9] je přímo navrhován test, jenž využívá řízené ukládání informací a vybavování jak volné, tak s nápovědou, aby byl kontrolován vliv pozornosti a exekutivních funkcí na výkon ve vybavování – tyto charakteristiky splňuje Test 16 slov (v anglickém originálu Enhanced Cued Recall test) [10].
Česká verze T16S je zkrácená verze původního Grober Buschke Free and Cued Selective Reminding Testu (FCSRT), která byla upravena pro použití v Sedmiminutovém skríningovém testu demence [11,12]. Test je rutinně používán v lékařských i psychologických praxích. Od původního FCSRT se T16S liší zejména počtem pokusů vybavení z paměti (tři pokusy u originálního FCSRT vs jeden pokus v T16S).
Studie provedené s tímto typem paměťového testu nacházejí specifický obraz narušení paměti u pacientů s AD. Porucha paměti u AD je charakterizována jako amnestický syndrom hipokampálního typu, která se vyznačuje nízkou spontánní výbavností a nízkým efektem nápovědy v důsledku dominující poruchy ukládání a uchovávání nové informace. Oproti tomu poruchu paměti u bvFTD lze charakterizovat jako amnestický syndrom nehipokampálního typu, pro nějž je typická nízká spontánní výbavnost, ale relativně vysoký efekt nápovědy v případě použití testu s kontrolovaným ukládáním [13]. V souladu s touto teorií nalezla studie o testu FCSRT podobné snížení spontánní výbavnosti u pacientů s AD a bvFTD, ale výrazně vyšší efekt nápovědy u pacientů s bvFTD [7]. Při srovnání těchto dvou skupin se také prokázal kvalitativní rozdíl v paměťovém výkonu na základně analýzy chyb. U AD se prokázala výraznější ztráta informací mezi okamžitým a oddáleným vybavením oproti pacientům s bvFTD [14].
Samotný test T16S je používán rutinně zejména v diagnostice pacientů s demencí. Validizační studie pro tureckou jazykovou verzi prokázaly dobré psychometrické vlastnosti testu pro diagnostiku AD (při stanovených cut‑off skórech byla senzitivita celkového vybavení 100 % a specificita 93,9 % oproti zdravým věkově vázaným normám), menší senzitivita byla nalezena pro rozlišení mezi kontrolní skupinou a skupinou MCI (senzitivita skóru celkového vybavení při stanoveném cut‑off 50 a specificita 90,9 % [15]). Test se také ukázal jako dobrý diagnostický nástroj pro rozlišení poruchy paměti u pacientů s AD od pacientů s Parkinsonovou nemocí [16].
Cílem této studie je ověřit diskriminační validitu české verze T16S. Konkrétně ověřit diskriminační potenciál, a tedy klinickou využitelnost testu pro rozlišení mezi skupinami pacientů s AD, pacientů s bvFTD a kontrolními osobami na základě jejich paměťového výkonu a dále ověřit vztah výkonu v T16S a demografických proměnných věku a počtu let vzdělání. Výsledky této studie tak mohou přinést nové interpretační možnosti diagnostické metody, která je již v české klinické praxi zavedená.
Metodika
Výzkumný soubor tvořilo 51 osob s lehkou demencí (MMSE 18 – 24), klientů Kognitivního centra neurologického oddělení FN v Motole v Praze nebo Centra pro poruchy paměti ICRC a I. neurologické kliniky FN u sv. Anny v Brně. Všichni pacienti absolvovali komplexní vyšetřovací protokol obsahující neurologické vyšetření, skríningové laboratorní vyšetření, MR vyšetření mozku a komplexní vyšetření neuropsychologickou baterií popsanou níže. Skupina nemocných s AD čítala 36 osob, které splňovaly klinická kritéria NINCDS ‑ ADRDA [17], skupinu nemocných s bvFTD tvořilo 15 osob splňujících Nearyho kritéria [18].
Jako kontrolní skupina posloužilo 45 kog-nitivně zdravých dobrovolníků z řad příbuzných a známých pacientů a zaměstnanců obou výše uvedených pracovišť. Kognitivně zdravé kontroly neudávaly žádné subjektivní potíže s pamětí a splňovaly následující kritéria: byly vyloučeny osoby se zvýšenou mírou depresivních symptomů (pacienti škálující více než 5 bodů v 15bodovém dotazníku Geriatric depression scale [19]) a subjekty s úzkostnými symptomy škálující více než 7 bodů v dotazníku Beck anxiety inventory > 7), s poraněním mozku, s vážným neurologickým nebo psychiatrickým onemocněním postihujícím CNS, užívající psychoaktivní látky či léky s vlivem na CNS, lidé s poškozeným zrakovým nebo sluchovým vnímáním a lidé, kterým byla na základě neuropsychologické baterie diagnostikována mírná kognitivní porucha.
Všechny subjekty byly vyšetřeny komplexní neuropsychologickou baterií, která prověřovala výkon v doménách paměti, exekutivních funkcí, pozornosti, psychomotorického tempa, vizuokonstrukčních funkcí a fatických funkcí. Byly použity tyto testy: MMSE (Folstein 1975), Paměťový test učení (Preiss 2002), Test cesty A a B (Preiss 2004), Rey ‑ Osterreithova komplexní figura (Rey 1941, Osterreith 1944), Verbální fluence (Benton a Hamsher 1976, Preiss 1997), Opakování čísel (Wechsler 1997, Preiss 2004), Digit symbols (Wechsler 1997), Kreslení hodin (Lee 1996), Boston naming test (Kaplan 1983), Logická paměť (Wechsler 1997, Preiss 2003).
Všem subjektům byl také administrován T16S, jenž je součástí Sedmiminutového skríningového testu (7MST) [12]. Test se skládá ze čtyř karet, na každé z nich jsou čtyři černobílé kresby znázorňující běžné objekty (např. hrozny, tygr, noha, stůl). Počáteční fáze kontrolovaného učení, kdy jsou pacientovi prezentovány čtyři kresby spolu s kategorickou nápovědou (např. administrátor: „Na této straně je obrázek ovoce. Co je to?“, subjekt: „Hrozny.“) je následována fází kontroly uložení již bez prezentace kreseb (a.: „Na straně byl obrázek ovoce. Jaké ovoce to bylo?“ s.: „Hrozny.“). Tento postup se opakuje i s ostatními 12 obrázky. Následuje interferenční úkol a poté je subjekt požádán, aby si volně vybavil co nejvíce objektů. Po skončení volného vybavení následuje vybavení s poskytnutím kategorické nápovědy u položek, které subjekt nevybavil. Ve studii jsme pracovali s následujícími skóry i) volné vybavení – počet slov, která subjekt vybavil volně, ii) vybavení s nápovědou – počet slov, která subjekt vybavil po poskytnutí kategorické nápovědy, iii) celkové vybavení – součet volného vybavení a vybavení s nápovědou, iv) využití nápovědy – (vybavení s nápovědou / / (16 – volné vybavení)) * 100.
Statistické zpracování dat bylo provedeno v programu SPSS (verze 20 pro Windows). Vzhledem k tomu, že pacienti s bvFTD a AD se dle očekávání lišili věkem, byly vybrány kontroly věkově korespondující s oběma skupinami. Důvodem k tomu kroku bylo, že ze skórů T16S pouze skór volné vybavení měl u KS signifikantní vztah s věkem a u klinických skupin vede kognitivní postižení k tomu, že vliv demografických proměnných se jeví jako nevýznamný.
Pro srovnání skupin ve výkonu v T16S byly použity neparametrické metody především z důvodu malého počtu pozorování ve skupině bvFTD. Konkrétně byl použit Kruskal ‑ Wallisův H test a post‑hoc Mann‑Whitneyho U test pro mnohočetná porovnávání za použití Bonferroniho korekce hladiny významnosti pro tři porovnávání. K posouzení vztahu mezi výkonem v T16S a věkem a vzděláním byl použit Spearmanův korelační koeficient. Dále byla provedena ROC (Reciever Operating Characteristic) analýza ke zjištění diferenciačního potenciálu T16S pro rozlišení AD a bvFTD od KS, a pro rozlišení AD od bvFTD. Byly spočteny plochy pod ROC křivkami a pro jednotlivé cut‑off skóry senzitivita, specificita a pravděpodobnostní poměry (Likelyhood Ratio) LR+ a LR – . Na základě těchto výpočtů jsme stanovili cut‑off skóry s nejlepší rozlišovací schopností.
Výsledky
Deskriptivní statistika
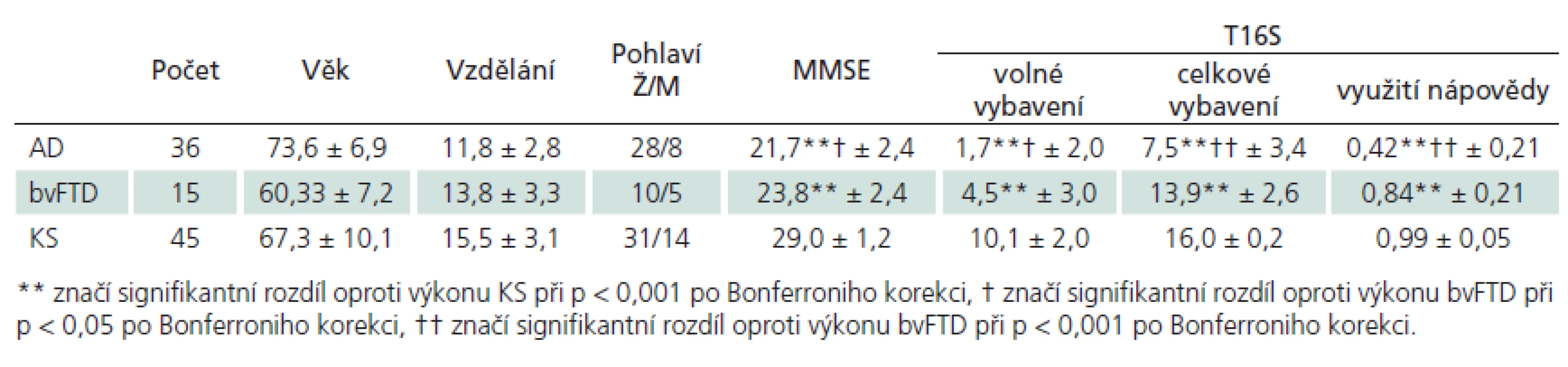
Dle očekávání se skupiny lišily věkem, kontroly od pacientských skupin pak i ve skóru MMSE. Rozdíl v MMSE mezi AD a bvFTD byl rovněž signifikantní. Demografické a výkonové charakteristiky kontrolního souboru a souboru pacientů s AD a bvFTD jsou uvedeny v tab. 1.
Závislost výkonu v T16S na věku a vzdělání
Závislost výkonu v T16S na věku a počtu let vzdělání byla ověřována za použití Spearmanových korelací samostatně na všech výzkumných skupinách. Jediný signifikantní vztah mezi výkonem v T16S, věkem a počtem let vzdělání v jednotlivých skupinách byl nalezen u kontrolní skupiny mezi věkem a volným vybavením (rho = – 0,427; p = 0,003).
Inferenční statistika
Za použití Kruskal ‑ Wallisova H ‑ testu byly mezi skupinami zjištěny signifikantní rozdíly ve všech třech ověřovaných skórech T16S: ve volném vybavení (χ2 = 67,118; p < 0,001), v celkovém vybavení (χ2 = 74,865; p < 0,001) a ve využití nápovědy (χ2 = 73,636; p < 0,001). Post hoc byly za použití Mann‑Whitneyho U testu s Bonferroniho korekcí hladiny významnosti zjištěny rozdíly mezi všemi skupinami ve všech skórech T16S. Jak lze vidět v tab. 1, pacienti s AD měli oproti KS i bvFTD signifikantně nižší volné i celkové vybavení. Zřetelný je vztah volného vybavení a celkového vybavení u jednotlivých skupin v grafu 1.

ROC analýza
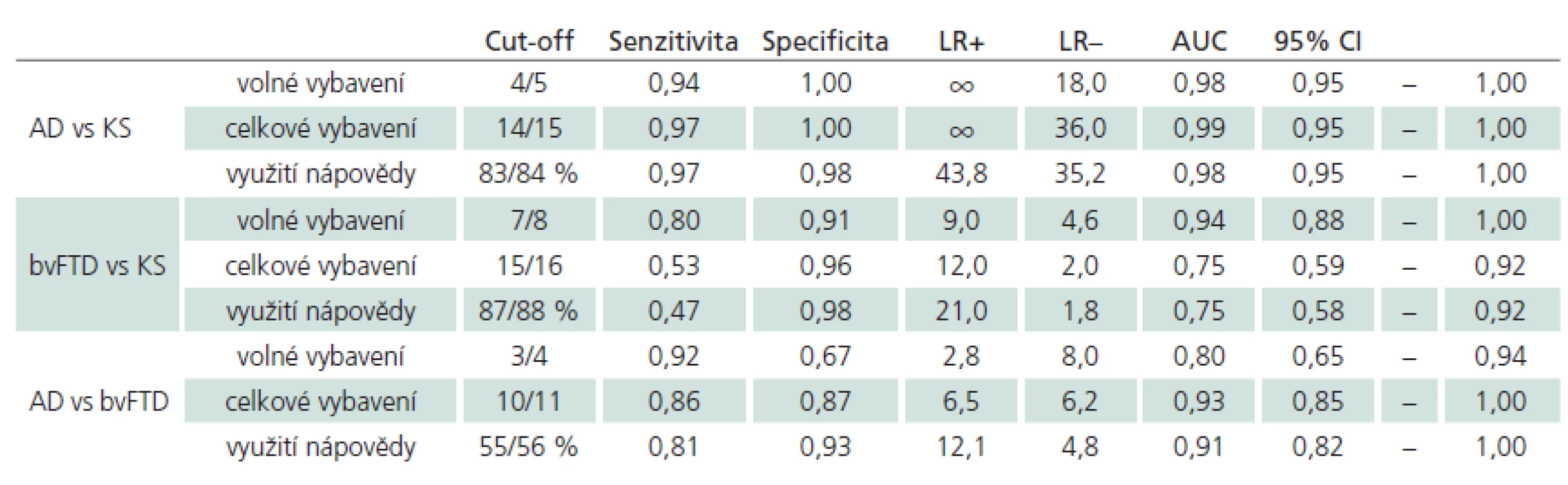
Diskriminační schopnost skórů T16S k zachycení AD vs KS, AD vs bvFTD a bvFTD vs KS je vidět v grafech 2 – 4. Tab. 2 pak poskytuje podrobný vhled do diskriminační schopnosti vybraných cut‑off skórů s nejlepší rozlišovací schopností (maximální kombinovanou senzitivitou a specificitou) a jejich prediktivních schopností vyjádřených pravděpodobnostními poměry (Likelyhood Ratio) LR+ a LR – . Tabulka dále také udává hodnotu oblasti pod ROC křivkou (AUC) včetně 95% intervalu spolehlivosti. Nejlepší senzitivita a specificita pro odlišení AD od bvFTD byla nalezena pro celkové vybavení (senzitivita 86 %, specificita 87 % s AUC 0,93).



Diskuze
Výzkum potvrdil výborné psychometrické vlastnosti T16S pro rozlišení pacientů s lehkou demencí při AD a bvFTD i pro rozlišení těchto dvou skupin mezi sebou. Výsledky potvrzují výrazně sníženou úroveň volného vybavení u obou pacientských skupin ve srovnání s kontrolami, dále pak výrazně lepší efekt nápovědy u pacientů s bvFTD ve srovnání s pacienty s AD. Uvedené rozdíly jsou statisticky významné a jsou velmi dobře využitelné v klinické praxi. Zatímco pro rozlišení pacientů s lehkou demencí u AD a bvFTD lze použít kterýkoli z indexů testu, pro odlišení obou demencí mezi sebou je jednoznačně nejvhodnější skór celkového vybavení.
Naše výsledky jsou ve shodě s obdobnou studií o FCSRT [7] a podporují užitečnost diagnostických kritérií pro diagnostiku Alzheimerovy nemoci, jež navrhli Dubois et al [20] s přihlédnutím k lokalizaci neuropatologických změn v hipokampální formaci u pacientů s AD. Tato kritéria diferencují pacienty s AD od kognitivně zdravých a od jedinců s jinými druhy demence mimo jiné na základě kvalitativního vzorce poškození deklarativní paměti. U pacientů s AD je poškození paměti tzv. hipokampálního typu charakterizováno deficitem v konzolidaci paměťové stopy, zatímco u pacientů s bvFTD je poškození paměti tzv. nehipokampálního typu charakterizováno deficitem v efektivním kódování a/ nebo strategickém vyhledávání informace k zapamatování.
Navazujeme tak na studii Topinkové et al [12], která standardizovala Sedmiminutový skríningový test na české populaci, jehož součástí je právě i T16S. Ve své studii se však zabývají psychometrickými vlastnostmi celé baterie a vlastnosti T16S podrobněji neanalyzuje. Naše studie se naproti tomu soustředí pouze na T16S a přináší jeho psychometrickou analýzu. Tímto ověřujeme diskriminační validitu a rozšiřujeme interpretační možnosti v české klinické praxi zavedené metody.
Jak u norem, tak i u části pacientů s bvFTD vykazoval T16S stropový efekt ve skóre celkového vybavení, což je pravděpodobně jednou z příčin nízké senzitivity tohoto skóre pro odlišení těchto dvou skupin. Zdá se tedy, že relativní jednoduchost T16S tedy není omezením jen ve skupině pacientů s mírnou kognitivní poruchou, jak jsme konstatovali v naší předchozí studii [21], ale má praktické důsledky i u pacientů s nealzheimerovskou demencí. Z tohoto hlediska se zdá do budoucna zajímavé zvážit český překlad a validizaci některého ze senzitivnějších testů využívajících paradigma kontrolovaného ukládání a vybavení s vodítky.
Mezi další limity studie patří malý počet pozorování ve skupině bvFTD, který je však pochopitelný vzhledem k vzácnosti onemocnění [18]. Dalším limitem by mohl být rozdílný věkový průměr výzkumných skupin, což je důsledek rozdílného časového nástupu manifestace AD a bvFTD a nepovažujeme to za vážný nedostatek vzhledem k tomu, že v klinických skupinách výkon v T16S s věkem neměl signifikantní vztah.
Test 16 slov umožňuje s vysokou senzitivitou a specificitou odlišit pacienty s AD ve stadiu lehké demence od pacientů s lehkou demencí při bvFTD a od norem a jako takový je vhodný ke klinickému použití v rutinní praxi.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Martin Vyhnálek
Neurologická klinika
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: martin.vyhnalek@fnmotol.cz
Přijato k recenzi: 5. 5. 2014
Přijato do tisku: 3. 7. 2014
Zdroje
1. Albert MS, Moss MB, Tanzi R, Jones K. Preclinical prediction of AD using neuropsychological tests. J Int Neuropsychol Soc 2001; 7(5): 631 – 639.
2. Gregory CA, Hodges JR. Clinical features of frontal lobe dementia in comparison to Alzheimer’s disease. J Neural Transm 2006; 47 : 103 – 123.
3. Hutchinson AD, Mathias JL. Neuropsychological deficits in frontotemporal dementia and Alzheimer‘s disease: a meta‑analytic review. J Neurol Neurosurg Psychiatry 2007; 78(9): 917 – 928.
4. Frisoni GB, Beltramello A, Geroldi C, Weiss C, Bianchetti A, Trabucchi M. Brain atrophy in fronto ‑ temporal dementia. J Neurol Neurosurg Psychiatry 1996; 61(2): 157 – 165.
5. Hirst W, Volpe BT. Memory strategies and brain damage. Brain Cogn 1988; 8(3): 379 – 408.
6. Lezak MD, Howieson DB, Bigler ED, Tranel D. Neuropsychological assessment. New York: Oxford university press 2012.
7. Pasquier F, Grymonprez L, Lebert F, Van der Linden M. Memory impairment differs in frontotemporal dementia and Alzheimer‘s disease. Neurocase 2001; 7(2): 161 – 171.
8. Carlesimo GA, Perri R, Caltagirone C. Category cued recall following controlled encoding as a neuropsychological tool in the diagnosis of Alzheimer‘s disease: a review of the evidence. Neuropsychol Rev 2011; 21(1): 54 – 65. doi: 10.1007/ s11065 ‑ 010 ‑ 9153 ‑ 7.
9. Hort J, O’Brien JT, Gainotti G, Pirttila T, Popescu BO,Rektorova I et al. EFNS guidelines for the diagnosis and management of Alzheimer’s disease. Eur J Neurol 2010; 17 : 1236 – 1248. doi: 10.1111/ j.1468 ‑ 1331.2010.03040.x.
10. Grober E, Buschke H, Crystal H, Bang S, Dresner R.Screening for dementia by memory testing. Neurology 1988; 38(6): 900 – 903.
11. Solomon PR, Pendlebury WW. Recognition of Alzheimer’s disease: the 7 Minute Screen. Fam Med 1998; 30(4): 265 – 271.
12. Topinková E, Jirák R, Kožený J. Krátká neurokognitivní baterie pro screening demence v klinické praxi: Sedmiminutový screeningový test. Neurol Prax 2002; 3(6): 323 – 328.
13. Dubois B, Albert ML. Amnestic MCI or prodromal Alzheimer’s disease? Lancet Neurol 2004; 3(4): 246 – 248.
14. Thompson JC, Stopford LC, Snowden JS, Neary D. Qualitative neuropsychological performance characteristics in frontotemporal dementia and Alzheimer’s disease. J Neurol Neurosurg Psychiatry 2005; 76(7): 920 – 927.
15. Saka E, Mihci E, Topcuoglu MA, Balkan S. Enhanced cued recall has a high utility as a screening test in the diagnosis of Alzheimer’s disease and mild cognitive impairment in Turkish people. Arch Clin Neuropsychol 2006; 21(7): 745 – 751.
16. Saka E, Elibol B. Enhanced cued recall and clock drawing test performances differ in Parkinson’s and Alzheimer’s disease‑related cognitive dysfunction. Parkinsonism Relat Disord 2009; 15 : 688 – 691. doi: 10.1016/ j.parkreldis.2009.04.008.
17. McKhann G, Drachman D, Folstein M, Katzman R,Price D, Stadlan EM. Clinical diagnosis of Alzheimer’s disease: report of the NINCDS ‑ ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer’s disease. Neurology 1984; 34(7): 939 – 944.
18. Neary D, Snowden JS, Gustafson L, Passant U, Stuss D, Black S et al. Frontotemporal lobar degeneration: a consensus on clinical diagnostic criteria. Neurology 1998; 51(6): 1546 – 1554.
19. Almeida OP, Almeida SA. Short versions of the geriatric depression scale: a study of their validity for the diagnosis of a major depressive episode according to ICD ‑ 10 and DSM ‑ IV. Int J Geriatr Psychiatry 1999; 14(10): 858 – 865.
20. Dubois B, Feldman HH, Jacova C, Dekosky ST, Barberger ‑ Gateau P, Cummings J et al. Research criteria for the diagnosis of Alzheimer’s disease: revising the NINCDS ‑ ADRDA criteria. Lancet Neurol 2007; 6(8): 734 – 746.
21. Vyhnalek M, Nikolai T, Andel R, Nedelska Z, Rubínová E, Marková H et al. Neuropsychological Correlates of Hippocampal Athrophy in Memory Testing in Nondemented Older Adults. J Alzheimers Dis 2014 [Epub ahead of print].
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2014 Číslo 5
-
Všechny články tohoto čísla
- Leukodystrofie – klinické a rádiologické aspekty
- Bariéry nervového systému za fyziologických a patologických stavů
- Experimentální a klinické aplikace mezenchymálních kmenových buněk u míšního poranění
- Volumetrické hodnocení resekability gliomů inzuly
- Validita Testu 16 slov pro diferenciální diagnostiku demence Alzheimerova typu a behaviorální formy frontotemporální demence
- Asymetrie trojklaného nervu u klasické neuralgie trigeminu – zhodnocení pomocí magnetické rezonance
- Komentář ke článku autorů Urgosik et al Trigeminal Nerve Asymmetry in Classic Trigeminal Neuralgia – Evaluation by Magnetic Resonance Imaging
- Česká tréninková verze Montrealského kognitivního testu (MoCA‑ CZ1) k časné detekci Alzheimerovy nemoci
-
Komentár ke článku autorů Bartoš et al. Česká tréninková verze Montrealského kognitivního testu (MoCA-CZ1) k časné detekci Alzheimerovy nemoci
Skríning kognitívnych porúch v klinickej praxi - Standardizace české verze testu Londýnské věže – administrace, skórování, validita
- Repetitivní transkraniální magnetická stimulace v léčbě depresivní poruchy – randomizovaná, jednoduše slepá, antidepresivy kontrolovaná studie
- Výsledky operační léčby adenomů hypofýzy na Neurochirurgické klinice FN Olomouc
- Komentář k článku autorů Krahulík et al Výsledky operační léčby adenomů hypofýzy na Neurochirurgické klinice FN Olomouc
- Endoskopická endonazální technika v léčbě kraniofaryngeomů
- Neuroborrelióza imitující mozkový nádor u dětí a vice versa
- Anti‑N‑ metyl‑ D‑ aspartát receptorová encefalitida
- Projekt ncRNAPain
- Chirurgická léčba supratentoriálních kortiko‑ subkortikálních kavernomů
- Neutralizační protilátky a Myxovirus resistance protein A při sledování biologické účinnosti interferonu β
- Vazospazmy jako komplikace subarachnoidálního krvácení – kazuistika
- Polyurie v neurointenzivní péči – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XLVII. Modelové příklady spojování výsledků vzájemně nezávislých asociačních studií - Časná a individualizovaná terapie se zapojením pacienta do terapeutického procesu byly hlavními tématy letošního mezinárodního setkání odborníků v oblasti roztroušené sklerózy
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Česká tréninková verze Montrealského kognitivního testu (MoCA‑ CZ1) k časné detekci Alzheimerovy nemoci
- Leukodystrofie – klinické a rádiologické aspekty
- Bariéry nervového systému za fyziologických a patologických stavů
- Chirurgická léčba supratentoriálních kortiko‑ subkortikálních kavernomů
