Anti‑N‑ metyl‑ D‑ aspartát receptorová encefalitida
Anti‑N ‑ Methyl ‑ D ‑ Aspartate Receptor Encephalitis
N-methyl-D-aspartate encephalitis is a recently defined autoimmune disorder of the central nervous system. Neurological symptoms are associated with antibody-dependent internalization of NMDA receptors that leads to synapse disruption. Information about the disease, therapy and diagnosis are followed by clinical experience with our group of five patients.
Key words:
anti-NMDAR encephalitis – diagnosis – therapy
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
Z. Libá 1; J. Hanzalová 2; V. Sebroňová 1; V. Komárek 1
Působiště autorů:
2. LF UK a FN v Motole, Praha
Klinika dětské neurologie, Ústav imunologie a neurologická klinika
1; 2. LF UK a FN v Motole, Praha
Likvorová laboratoř, Ústav imunologie a neurologická klinika
2
Vyšlo v časopise:
Cesk Slov Neurol N 2014; 77/110(5): 624-630
Kategorie:
Krátké sdělení
doi:
https://doi.org/10.14735/amcsnn2014624
Práce byla podpořena z nadačního fondu Pohyb bez pomoci. Děvana Dimmerová se podílela na zpracování mozkomíšních moků. MU Dr. David Krýsl se společně s RNDr. Jitkou Hanzalovou aktivně podílel na zavedení vyšetření autoprotilátek spojených s encefalitidami do repertoáru likvorové laboratoře ve FN v Motole. MU Dr. Zlata Baraniková se podílela na léčbě psychiatrických příznaků onemocnění. Kolegové z Pediatrické kliniky FN v Motole zajišťovali provedení eliminačních metod.
Souhrn
N ‑ metyl ‑ D ‑ aspartát receptorová (NMDAR) encefalitida je nedávno definované autoimunitní postižení centrálního nervového systému (CNS). Podstatou neurologických potíží je porucha synaptického přenosu v důsledku internalizace NMDA receptorů po navázání autoprotilátek. V následujícím sdělení přinášíme nejnovější informace o onemocnění a jeho diagnostice. Současně dokládáme klinický průběh, strategii léčby a sledování našich pěti pacientek.
Klíčová slova:
anti-NMDAR encefalitida – diagnostika –terapie
Úvod
Anti-N ‑ metyl ‑ D ‑ aspartát receptorová (a ‑ NMDAR) encefalitida patří do skupiny encefalitid na autoimunitním podkladě, kam se řadí i jiné autoimunní encefalitidy postihující převážně limbický systém (tab. 1) [1,2]. Neurologické příznaky jsou spojené s internalizací NMDA receptorů po navázání autoprotilátek (schéma 1). Produkce protilátek byla poprvé identifikována v rámci paraneoplastického (PNP) syndromu v roce 2007 u pacientek s teratomem ovarií, u kterých se rozvinuly akutní neuropsychiatrické příznaky. Poklestitru protilátek v mozkomíšním moku je spojen se zlepšením neurologického stavu [3].
![Diferenciální diagnostika encefalitid [5,6].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/c69afee3d88850b1b38b47b35718cbe9.jpg)
![Schéma 1. Klinický korelát snížení a-NMDAR, převzato z [3].
Široké zastoupení excitačních glutamátových iontových N-metyl-D-aspartát receptorů (NMDAR) v centrálním nervovém systému vysvětluje pestrost a závažnost klinických projevů onemocnění. Schéma je založeno na poznání u zvířecích modelů po farmakologickém či genetickém snížení NMDAR. Protilátkami zprostředkovaný pokles NMDAR přednostně inaktivuje GABAergní neurony, čímž dochází k desinhibici excitačních cest a zvýšení extracelulárního glutamátu. Ovlivnění dopaminergního, noradrenergního a cholinergního systému vysvětluje autonomní projevy (hypersalivaci, hypertenzi, hypertermii a srdeční arytmie). Přímé působení a-NMDAR protilátek na medulárně-pontinní jádro Kölliker-Fuse vede k hypoventilaci.](https://pl-master.mdcdn.cz/media/image/8e168ffbeb8be071b94fe5a34123569a.jpg?version=1537795222)
Klinický průběh a ‑ NMDAR encefalitidy je u většiny pacientů stupňovitý s postupnou progresí. Na počátku se objevují různé poruchy chování, akutní psychóza, porucha krátkodobé a střednědobé paměti, epileptické záchvaty. Postupně dochází ke zhoršování stavu, rozpadá se řeč, rozvíjí se katatonie s mimovolními pohyby a orofaciálními automatizmy, dostavuje se autonomní a dechová instabilita [2,3]. Všechny příznaky nemusejí být plně vyjádřeny. Onemocnění nejvíce postihuje děti a mladé dospělé, převážně ženy. V kalifornské studii 761 případů pacientů s encefalitidou do 30 let věku byla a ‑ NMDAR encefalitida diagnostikována u 32 případů a frekvence jejího výskytu byla více než čtyřikrát vyšší než frekvence výskytu encefalitidy způsobené virem herpes simplex (HSV) nebo varicella zoster (VZV) [4].
Diagnostika
Na počátku nemoci se klinické a laboratorní projevy nemusí lišit od projevů jiných encefalitid, včetně infekčních, které je třeba empiricky léčit (tab. 1) [5,6]. U 70 % pacientů s a ‑ NMDAR encefalitidou bylo popsáno nespecifické prodromální stadium (katar horních cest dýchacích, gastrointestinální problémy, bolesti hlavy, zvýšená teplota), které předcházelo až 14 dní nástupu vlastního onemocnění [7]. Stupňovitý průběh klinických potíží je popsán výše.
Elektroencefalografie (EEG)
Abnormální EEG záznam lze považovat za diagnostickou podmínku encefalitidy. U pacientů s a ‑ NMDAR encefalitidou můžeme vidět nespecifické rytmické zpomalení aktivity do pásma theta ‑ delta, difuzně, či s frontálním maximem, epileptiformní grafoelementy a nezřídka status epilepticus v úvodu onemocnění [7]. Jako specifický nález se uvádějí „delta brushes“ (kartáče nízkovoltážních vysokofrekvenčních hrotů nasedajících na rytmické delta vlny), které však nejsou nutným diagnostickým kritériem [8].
Mozkomíšní mok
Lumbální punkce bývá na počátku onemocnění abnormální u 80 %. Můžemevidět střední pleocytózu s lymfocytární převahou, mírnou proteinorhachii a v 60 % jsou přítomny oligoklonální pásy [2,7].
Magnetická rezonance (MR)
Až v polovině případů může být magnetická rezonance mozku normální. Při hodnocení je třeba se zaměřit na mediální části temporálních laloků a hipokampy, kde mohou být vidět diskrétní signálové změny ve FLAIR nebo T2 vážených sekvencích. Signálové změny mohou být i v jiných částech mozku [2].
Stanovení protilátek
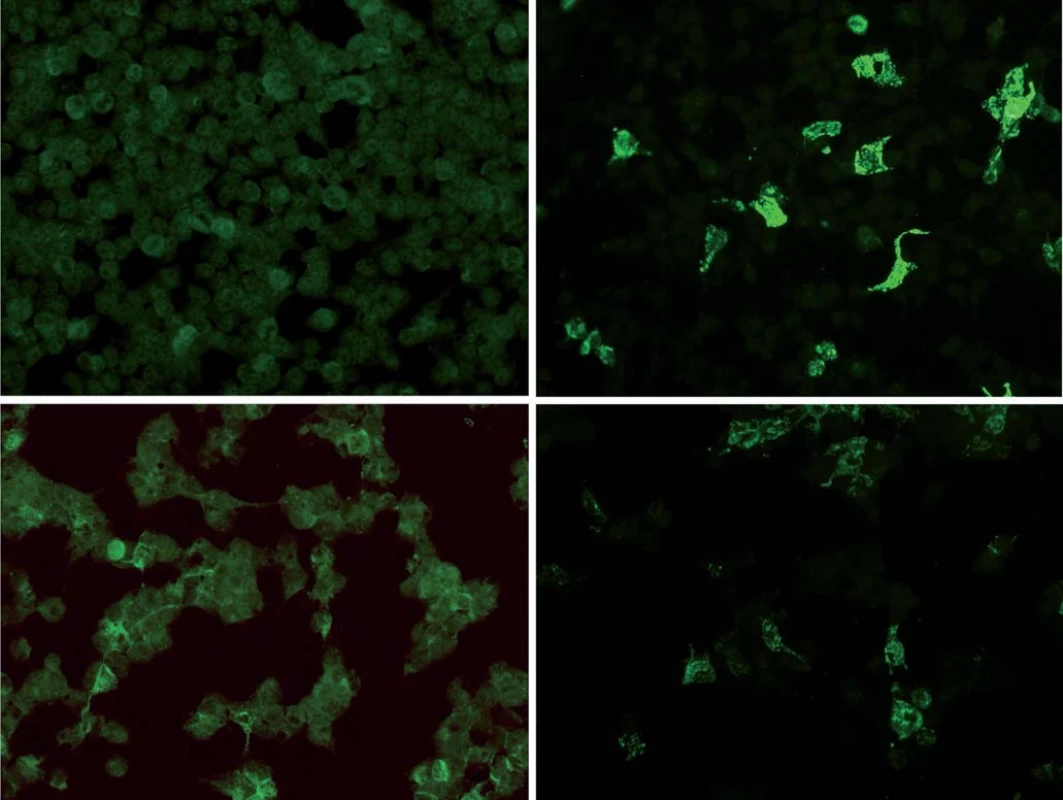
Stanovení a ‑ NMDAR protilátek je diagnostická podmínka [1 – 3]. Vyšetření lze provést ze séra a likvoru. Pokud jsou protilátky v séru negativní, mohou být pozitivní v likvoru. Laboratorní testy jsou založeny na buněčných testech a fluorescenčních metodách, hodnocení je kvantitativní (obr. 1). Při diagnostice našich pacientek byly použity komerční laboratorní kity (Anti‑Glutamate receptor (type NMDA) IIFT, Euroimmun, Německo).
Terapie
Symptomatická terapie obnáší léčbu epileptických záchvatů, psychomotorického neklidu, halucinací, insomnie, mimovolních pohybů, katatonie, stejně jako bazální péči o pacienty v bezvědomí.
Kauzální terapie zahrnuje odstranění nádorové tkáně, je‑li přítomna. Následně je nutné ovlivnit hladinu a ‑ NMDAR protilátek. V rámci první linie je aplikován pulz metylprednizolonu (u dospělých 1 g/ den, 5 dní) a souběžně vysokodávkované imunoglobuliny (IVIG; 0,4 mg/ kg/ den, 5 dní) [2,3,6]. V případě závažného stavu lze, dle možností pracoviště, upřednostnit provedení plazmaferézy, po kterém následuje podání kortikoidů (a IVIG). Limitací plazmaferézy může být věk pacienta, výrazný psychomotorický neklid a autonomní instabilita [7]. Pokud je vidět malá nebo žádná odezva, doporučuje se zahájit léčbu druhé linie [7,9]. Podává se rituximab (375 mg/ m2 1× týdně, celkově čtyři týdny, nebo u dospělých 2× 1 000 mg s odstupem dvou týdnů) samostatně či v kombinaci s cyklofosfamidem (750 mg/ m2, každý měsíc) [2,3,6,7]. Vzhledem ke zvýšenému riziku nežádoucích reakcí se aplikace obou léků odehrává v premedikaci, v případě cyklofosfamidu se navíc provádí hyperhydratace a ochrana močového měchýře. Kumulativní dávky cyklofosfamidu mohou vést k infertilitě [6]. Efekt rituximabu přetrvává několik měsíců. Při imunosupresi se výrazně zvyšuje riziko infekčních komplikací. O anti‑infekční profylaxi a režimových opatřeních je vhodné poradit se s imunologem (či hemato ‑ onkologem).
Onkologické sledování
A ‑ NMDAR encefalitida může být součástí PNP syndromu, je nutné po přítomnosti nádoru pátrat. PNP produkce protilátek je věkově závislá a může předcházet vlastnímu nádorovému onemocnění, nicméně u pacientů pod 18 let je méně než v 50 % [7]. Nejčastější je přítomnost ovariálního teratomu, vzácně byl popsán neuroblastom, Hodgkinův lymfom, germinální testikulární nádor a u starších pacientů karcinom plic a prsu [7,9]. Strategie jednotlivých vyšetření (zobrazení, biologické markery atp.) je v kompetenci onkologa. U žen starších 12 let se doporučuje zobrazení (magnetická rezonance či ultrazvuk) břicha a malé pánve každých šest měsíců po dobu čtyř let. U mužů se provádí ultrazvuk varlat [7].
Vlastní soubor
Náš vlastní soubor je tvořen pěti dívkami, které sledujeme na Klinice dětské neurologie 2. LF UK a FN v Motole v Praze. První pacientku sledujeme od ledna 2012, poslední od června 2013. Základní klinické údaje jsou shrnuty v tab. 2, pořadí pacientek je udáno chronologicky, v závorce je věk na počátku diagnózy. U žádné dívky jsme dosud neprokázali PNP produkci a ‑ NMDAR protilátek. Pacientky 2, 3 a 5 jsme léčili podle upraveného protokolu z nemocnice SickKids Hospital, Toronto, Kanada, který jsme získali osobní korespondencí. V úvodu jsme nechali provést sérii plazmaferéz (celkem pět sezení), aplikovali pulz metylprednizolonu (20 – 30 mg/ kg/ den, 5 dní, max. 3 – 5 g celkem) s následným tappingem kortikoidů (vstupní dávka prednizon 1 mg/ kg/ den, max. 60 mg/ den, nebo ekvivalent metylprednizolonu, snižování každé 1 – 2 týdny, celkem 8 – 12 týdnů) a poté podali vysokodávkované imunoglobuliny (IVIG 2 g/ kg během pěti dní, max. 70 g celkem), které jsme opakovali s odstupem 14 dní (v dávce 1 g/ kg celkem) a jednoho měsíce (v dávce 0,5 g/ kg celkem) a pak pokračovali v měsíčním podávání IVIG 0,5 mg/ kg (max. 20 – 25 g) dalších šest měsíců. Navíc jsme ponechali malou dávku kortikoidů s plánem vysazení po 24 měsících. Při použití léků druhé a další linie jsme podávali antiinfekční profylaxi. Dle potřeby dívky dostávaly antiepileptickou a psychiatrickou medikaci. Probíhá pravidelný onkologický skríning.
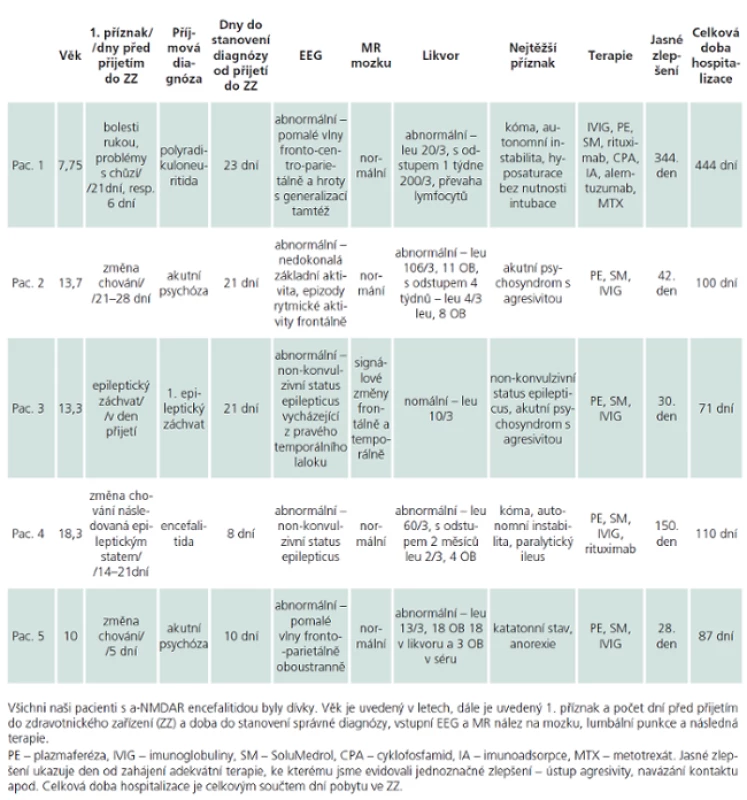
Pacientka 1
Pacientka (7 let a 9 měsíců) měla ze všech sledovaných dívek nejkomplikovanější průběh onemocnění. I přes včasnou imunosupresivní dávku imunoglobulinů dosáhla maximálního počtu klinických příznaků, mimo dechové selhání s nutností intubace. Prvními příznaky byly nespecifické bolesti rukou a později problémy s chůzí do schodů, které budily podezření na polyradikuloneuritidu. Teprve po přijetí do nemocnice se v rychlém sledu objevovaly další postupně se zhoršující příznaky, změna chování se střídáním nálad – pláč vs nekontrolovatelný smích, senzitivní parciální záchvaty, rozpad řeči, sebepoškozování, bizarní pohyby, dystonické postury s rizikem poranění, plazení jazyka s křikem a vyvalením očí, porucha příjmu potravy atd. Do kómatu se dostala během 21 dní od přijetí. Kóma s autonomní instabilitou (hyposaturace, profuzní pocení, retence moče) se postupně během týdnů proměnilo v kóma s výrazným psychomotorickým neklidem. Psychomotorický neklid trval celé týdny, pacientka byla kurtována a masivně psychiatricky medikována, nicméně bez efektu. Pak následovalo několikaměsíční vigilní kóma. Po devíti měsících neúspěšné terapie byla nakonec pro pacientku zvolena experimentální biologická léčba monoklonální protilátkou proti lymfocytům (alemtuzumab) kombinovaná s intratékální aplikací cytostatika (metotrexát). Tato léčba nebyla ve světě u této diagnózy nikdy vyzkoušena a vycházela ze znalostí imunopatologického procesu onemocnění a ze zkušeností léčby dětských hemato ‑ onkologických pacientů a dospělých pacientů s roztroušenou sklerózou [10]. Terapie byla úspěšná a pacientka se po 344 dnech probrala k vědomí. Pamatovala si vše do doby, než byla přijata do nemocnice a pak ještě úvod hospitalizace. Krátce po probuzení se dotazovala na personál, který již v nemocnici nepracoval. Po propuštění z nemocnice u pacientky dominovaly poruchy chování a problémy s koncentrací, jež se pozvolna zlepšují. Dosud, 24 měsíců od rozvoje onemocnění, přetrvává pozitivita a ‑ NMDAR protilátek v mozkomíšním moku, zatímco protilátky v séru jsou již negativní. Dívka začíná chodit do školy.
Pacientka 2
Pacientka (13 let a 8 měsíců) měla odložené stanovení diagnózy. Prvními příznaky u premiantky třídy byly změna chování a střídání nálad, např. bezdůvodně ukradla lízátka v obchodě. Po epizodě, kdy dorazila zmatená a pozdě do cizí třídy, aniž to dokázala vysvětlit, byla přijata na nemocniční lůžko pediatrického oddělení. Tam se s personálem prala a rozbíjela zařízení. I přes jasně zánětlivý obraz v mozkomíšním moku byla, po vyloučení herpetické encefalitidy, překládána na psychiatrické lůžko s diagnózou akutní psychózy se stavy neklidu. Správná diagnóza byla stanovena na základě vyšetření séra. Další průběh byl již nekomplikovaný, dívka dobře reagovala na úvodní léčbu první linie. Své onemocnění si pamatuje útržkovitě, vstupní lumbální punkci a ani pozdější plazmaferézy si nepamatuje vůbec. Ještě 18 měsíců po léčbě přetrvávala slabá pozitivita a ‑ NMDAR protilátek v séru, kontrolní odběr mozkomíšního moku plánujeme až v odstupu 24 měsíců od začátku onemocnění. Dívka se nyní připravuje na zkoušky na gymnázium, má nadprůměrný intelekt a její školní výsledky jsou vynikající.
Pacientka 3
Pacientka (13 let a 4 měsíce) je v našem sledování téměř 15 měsíců. V úvodu onemocnění prodělala několik epileptických záchvatů a docházelo ke změně chování, což vyústilo v přijetí na psychiatrické lůžko. Jako u předchozích dívek i u této pacienty se začaly náhle střídat nálady, plačtivost střídala nezvyklá sebejistota, záchvaty vzteku se střídaly s výraznou úzkostí, měnila se schopnost řeči, dívka šeptala, později byla i výrazně bradypsychická a objevovala se zmatenost. Následovala porucha vědomí s obrazem non‑konvulzivního statu na EEG, což bylo důvodem překladu na naše pracoviště. Během prvních dní byla dívka agresivní vůči personálu i vůči sobě, kousala sebe i sestry, prala se, vytrhávala invaze, musela být kurtována. I tato dívka velmi dobře reagovala na léčbu první linie, ale bohužel měla komplikace. Při zavádění dialyzačního katétru došlo ke vzniku hemotoraxu, při léčbě epileptického statu se objevil hypersenzitivní syndrom jako odezva na podaná antiepileptika v kombinaci s podávanými antibiotiky. Obojí si vyžádalo opakovanou několikadenní anesteziologicko‑resuscitační péči a umělou plicní ventilaci. Nakonec byla propuštěna v celkově dobrém stavu. S odstupem 12 měsíců přetrvává pozitivita a ‑ NMDAR protilátek v mozkomíšním moku i séru. Přesto i tato dívka je již plně zařazena do běžného života, chodí do školy, má lehké problémy ve verbální oblasti, které však mohou být v souvislosti s pokračováním zajišťující léčby topiramátem.
Pacientka 4
Pacientka (18 let a 4 měsíce) je v našem sledování téměř devět měsíců. Onemocnění u ní propuklo při dlouhodobém studijním pobytu v zahraničí, na naše pracoviště byla překládána po dvou měsících léčby první linie. Prvními projevy byly opět změny chování – z veselé dívky se stala uzavřená osoba s výbuchy vzteku, stav kulminoval po několika dnech na softbalovém zápase, kde začala křičet, byla zmatená, s poruchou vědomí. Další příznaky přicházely v rychlém sledu – dystonie, katatonie, autonomní instabilita. Dívčino onemocnění mělo závažný průběh, včetně dva týdny trvajícího kómatu. Při přijetí na naši kliniku přetrvávala dezorientace, porucha paměti a kognitivní deficit na úrovni lehké mentální retardace. Rodina odmítla podání cyklofosfamidu, proto jsme dívce aplikovali pouze rituximab. V dalším průběhu došlo k pozvolné úpravě kognitivních funkcí, dosud je přítomen deficit v socio ‑ emoční oblasti. I u této pacientky přetrvává pozitivita a ‑ NMDAR protilátek v likvoru i séru.
Pacientka 5
Pacientka (10 let) měla již premorbidně lehkou mentální retardaci a byla v péči dětského domova. V úvodu nemoci začaly nápadné poruchy chování – dívka původně spíše poslušná, v kolektivu tichá začala být agresivní, prala se, křičela. Pod obrazem akutní psychózy byla přijata na psychiatrické lůžko, odkud byla překládána na naše pracoviště k dalšímu vyšetření. Při přijetí jsme viděli bradypsychickou pacientku s dystonickou posturou trupu, prakticky neschopnou samostatné chůze, v „katatiformním stavu“, s výraznou hypersalivací a poruchou příjmu potravy. Dívka dobře reagovala na léky první linie. V době propuštění dosáhla své premorbidní úrovně, zvýraznily se však poruchy chování, které se postupně upravují. Dosud přetrvává pozitivita a ‑ NMDAR protilátek v likvoru i séru.
Diskuze
Na vlastním souboru pacientek s a ‑ NMDAR encefalitidou ukazujeme rozmanitý klinický průběh, složitost a komplikace léčby. Tři z našich pěti pacientek se dostaly do bezprostředního ohrožení života, jak v důsledku vlastního onemocnění, tak intenzivní terapie. Na druhé straně nelze vyloučit případy se spontánní úpravou. Jaký je tedy nejlepší přístup k pacientům s a ‑ NMDAR encefalitidou a jejich vyhlídky?
Na velkých souborech se ukazuje, že po stanovení diagnózy je vhodné zahájit léčbu co nejdříve, a pokud není dostatečný efekt, přejít k razantnější léčbě druhé linie. I přes několikaměsíční rekonvalescenci se až 81 % pacientů uzdraví zcela nebo jen s mírnými následky. Očekávaná mortalita se pohybuje kolem 7 %. Neléčení anebo nedostatečně léčení pacienti mají vyšší riziko relapsů, jež se obecně udává v 20 – 25 %, častěji u pacientů s non‑PNP produkcí protilátek. Nejlepší prognózu mají pacienti, kteří mají malý počet klinických příznaků a dobře reagují na časnou léčbu první linie. Také PNP produkce protilátek s odstraněním nádoru a podáním léků první linie je spojena s dobrou prognózou. Nejhorší prognózu mají pacienti v bezvědomí, u kterých selhala léčba druhé linie [9].
Na základě těchto vědomostí jsme u pacientky 1 zvolili experimentální přístup, jehož podrobnější rozbor přesahuje rozsah tohoto sdělení [10]. Pacientka 5byla příkladem toho, že v praxi může být někdy obtížné přejít ke druhé linii terapie. Rodina viděla pozitivní efekt léčby na stav vědomí a zlepšující se celkovou fyzickou kondici. Kognitivní deficit si ve světle nežádoucích účinků léků druhé linie nepřipouštěla.
S ohledem na možný relaps onemocnění je strategie dlouhodobé imunologické léčby po odeznění akutních neurologických příznaků nejednoznačná. V literatuře jsou zmínky o zajišťovací léčbě mykofenolát mofetilem nebo azatioprimem ještě minimálně rok [6,7,9]. U našich pacientek jsme na základě faktu, že žádná neměla PNP produkci protilátek, velmi obezřetní. Zvolili jsme podávání IVIG ještě šest měsíců a malé dávky kortikoidů, do celkové dávky 24 měsíců. Pacientka 1 dostává pouze substituční nízké dávky IVIG a je zajištěna mykofenolát mofetilem a nízkou dávkou kortikoidů. U všech probíhá pravidelný onkologický skríning.
Je zajímavé, jak dlouho přetrvává pozitivita a ‑ NMDAR protilátek v likvoru, a to i u dívek bez klinických obtíží. K tomuto faktu se neumíme vyjádřit. Stejně jak je uváděno v literatuře i v našem souboru, nejprve mizí pozitivita a ‑ NMDAR protilátek ze séra [2]. Současné laboratorní techniky zatím neumožňují stanovení konkrétní koncentrace a ‑ NMDAR protilátek, spoléháme se tedy na kvalitativní vyšetření vzorků.
Závěr
A ‑ NMDAR encefalitida je potenciálně život ohrožující onemocnění. Péče o pacienta je dlouhodobá, složitá a vyžaduje kvalifikovaný a komplexní přístup lékařů i ošetřujícího personálu. Mimo vlastní neurologické projevy onemocnění jsme konfrontováni s řadou problémů, které vyžadují multioborový přístup. Po celou dobu je důležité mít na paměti, že při správné diagnóze, adekvátní terapii a následné péči mají pacienti velkou naději na úplné uzdravení.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Zuzana Libá, Ph.D.
Klinika dětské neurologie
2. LF UK a FN v Motole
V Úvalu 84, 150 06 Praha 5
e-mail: zuzana.liba@fnmotol.cz
Přijato k recenzi: 4. 2. 2014
Přijato do tisku: 31. 3. 2014
Zdroje
1. Greenlee JE. Treatment of paraneoplastic neurologic disorders. Curr Treat Options Neurol 2010; 12(3): 212 – 230. doi: 10.1007/ s11940 ‑ 010 ‑ 0066 ‑ 9.
2. Rosenfeld MR, Dalmau J. Anti‑NMDA ‑ receptor encefalitis and other synaptic autoimmune disorders. Curr Treat Options Neurol 2011; 13(3): 324 – 332. doi: 10.1007/ s11940 ‑ 011 ‑ 0116 ‑ y.
3. Florance ‑ Ryan N, Dalmau J. Update on anti‑N ‑ Methyl ‑ D ‑ Aspartate Receptor encephalitis in children and adolescens. Curr Opin Pediatr 2010; 22(6): 739 – 744. doi: 10.1097/ MOP.0b013e3283402d2f.
4. Gable MS, Sheriff H, Dalmau J, Tilley DH, Glaser CA.he frequency of autoimmune N ‑ methyl ‑ D ‑ aspartate receptor encephalitis surpasses that that of individual viral etiologies in young individuals enrolled in the California Encephalitis Project. Clin Infect Dis 2012; 54(7): 899 – 904. doi: 10.1093/ cid/ cir1038.
5. Kennedy PG. Viral encephalitis: causes, differential diagnosis and management. J Neurol Neurosurg Psychiatry 2004; 75 (Suppl 1): i10 – i15.
6. Grisold W, Giometto B, Vitaliani R, Oberndorfer S. Current approaches to the treatment of paraneoplastic encephalititis. Ther Adv Neurol Disord 2011; 4(4): 237 – 248. doi: 10.1177/ 1756285611405395.
7. Dalmau J, Lancaster E, Martinez ‑ Hernandez E, Rosenfeld MR, Balice ‑ Gordon R. Clinical experience and laboratory investigation in patients with anti‑NMDAR encephalitis. Lancet Neurol 2011; 10(1): 63 – 74. doi: 10.1016/ S1474 ‑ 4422(10)70253 ‑ 2.
8. Schmitt SE, Pargeon K, Frechette ES, Hirsch LJ, Dalmau J, Friedman D. Extreme delta brush: a unique EEG pattern in adults with anti‑NMDA receptor encephalitis. Neurology 2012; 79(11): 1094 – 1100. doi: 10.1212/ WNL.0b013e3182698cd8.
9. Titulaer MJ, McCracken L, Gabilondo I, Armangue T, Glaser C, Iizuka T et al. Treatment and prognostic factors for long‑term outcome in patients with anti‑NMDA receptor encephalitis: an observational cohort study. Lancet Neurol 2013; 12(2): 157 – 165. doi: 10.1016/ S1474 ‑ 4422(12)70310 ‑ 1.
10. Liba Z, Sebronova V, Komarek V, Sediva A, Sedlacek P. Prevalence and treatment of anti‑NMDA receptor encephalitis. Lancet Neurol 2013; 12(5): 424 – 425. doi: 10.1016/ S1474 ‑ 4422(13)70070 ‑ X.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2014 Číslo 5
-
Všechny články tohoto čísla
- Leukodystrofie – klinické a rádiologické aspekty
- Bariéry nervového systému za fyziologických a patologických stavů
- Experimentální a klinické aplikace mezenchymálních kmenových buněk u míšního poranění
- Volumetrické hodnocení resekability gliomů inzuly
- Validita Testu 16 slov pro diferenciální diagnostiku demence Alzheimerova typu a behaviorální formy frontotemporální demence
- Asymetrie trojklaného nervu u klasické neuralgie trigeminu – zhodnocení pomocí magnetické rezonance
- Komentář ke článku autorů Urgosik et al Trigeminal Nerve Asymmetry in Classic Trigeminal Neuralgia – Evaluation by Magnetic Resonance Imaging
- Česká tréninková verze Montrealského kognitivního testu (MoCA‑ CZ1) k časné detekci Alzheimerovy nemoci
-
Komentár ke článku autorů Bartoš et al. Česká tréninková verze Montrealského kognitivního testu (MoCA-CZ1) k časné detekci Alzheimerovy nemoci
Skríning kognitívnych porúch v klinickej praxi - Standardizace české verze testu Londýnské věže – administrace, skórování, validita
- Repetitivní transkraniální magnetická stimulace v léčbě depresivní poruchy – randomizovaná, jednoduše slepá, antidepresivy kontrolovaná studie
- Výsledky operační léčby adenomů hypofýzy na Neurochirurgické klinice FN Olomouc
- Komentář k článku autorů Krahulík et al Výsledky operační léčby adenomů hypofýzy na Neurochirurgické klinice FN Olomouc
- Endoskopická endonazální technika v léčbě kraniofaryngeomů
- Neuroborrelióza imitující mozkový nádor u dětí a vice versa
- Anti‑N‑ metyl‑ D‑ aspartát receptorová encefalitida
- Projekt ncRNAPain
- Chirurgická léčba supratentoriálních kortiko‑ subkortikálních kavernomů
- Neutralizační protilátky a Myxovirus resistance protein A při sledování biologické účinnosti interferonu β
- Vazospazmy jako komplikace subarachnoidálního krvácení – kazuistika
- Polyurie v neurointenzivní péči – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XLVII. Modelové příklady spojování výsledků vzájemně nezávislých asociačních studií - Časná a individualizovaná terapie se zapojením pacienta do terapeutického procesu byly hlavními tématy letošního mezinárodního setkání odborníků v oblasti roztroušené sklerózy
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Česká tréninková verze Montrealského kognitivního testu (MoCA‑ CZ1) k časné detekci Alzheimerovy nemoci
- Leukodystrofie – klinické a rádiologické aspekty
- Bariéry nervového systému za fyziologických a patologických stavů
- Chirurgická léčba supratentoriálních kortiko‑ subkortikálních kavernomů
