Neurosonologické markery predikce kognitivní deteriorace
Neurosonological Markers Predict ing Cognitive Deterioration
Introduction:
Vascular brain changes and risk factors play a role in development and progression of Alzheimer‘s disease (AD). The primary aim of our study was to determine the predictive value of neurosonological biomarkers of cerebral microvasculature – resistance index (RI) and breath-holding index (BHI) for the development AD dementia in the older non-demented population. The secondary aim was to compare RI and BHI with other vascular biomarkers.
Methods:
A prospective study with patients with mild cognitive impairment (MCI), subjective memory complaints (SCD) and AD dementia patients as controls. All subjects underwent a detailed neuropsychology examination, brain magnetic resonance imaging and transcranial colour-coded sonography, including the evaluation of BHI and RI in the middle cerebral artery (MCA).
Results:
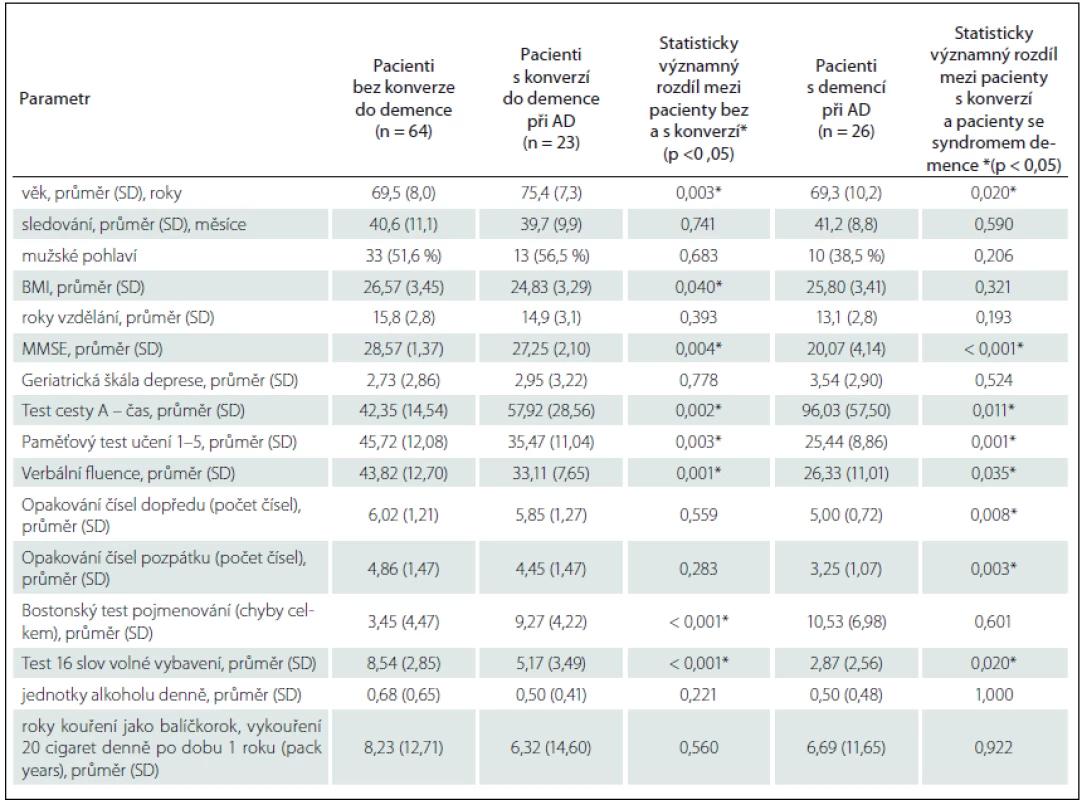
One hundred and eighty-three patients were enrolled, of which 113 patients with a diagnosis of MCI (n = 38), SCD (n = 49) and AD (n = 26) were included in the analysis. During the follow-up period (mean 40 months), 23 (26.4%) patients converted to dementia. Patients in the conversion group had a significantly lower BHI for both hemispheres; there was no significant difference in the RI values. The ROC analysis showed the cut-off values of BHI = 0.50 for left and BHI = 0.57 for right MCA (Z-score BHI < 0) to be the best predictive factors for dementia conversion. The hazard ratio (HR) of AD conversion for Z-score BHI < 0 was 5.61 (95%CI 1.66 – 18.97). The patients with conversion also had a significantly higher age, lower body mass index, higher frequency of ischaemic heart disease, APOE ε4 allele and more severe hippocampal atrophy and vascular white matter lesions.
Conclusion:
BHI measurement seems to be the most useful neurosonological marker of AD conversion. In our study, BHI = 0.50 for left MCA and BHI = 0.57 for right MCA show the best predictive value for conversion to AD dementia.
Key words:
Alzheimer‘s disease – dementia – older nondemented population – vascular risk factors – vascular changes – magnetic resonance imaging – neurosonology – breath-holding index – resistance index – vascular theory of Alzheimer‘s disease
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Chinese summary - 摘要
神经生物学标记预测认知衰退介绍:
脑血管的变化和风险因素在阿尔茨海默病(AD)的发生和发展中起着重要的作用。本研究的主要目的是确定在老年非痴呆人群中,脑微血管阻力指数(RI)和屏气指数(BHI)作为神经生物学标记对 AD型痴呆发展的预测价值。 此外,本研究还将RI和BHI与其他血管生物学标记指标进行比较。
方法:
研究包括轻度认知障碍(MCI),主观记忆障碍(SCD)和AD型痴呆患者。 所有受试者均进行详细的神经心理学检查,脑磁共振成像和经颅彩色超声检查,以及评估大脑中动脉(MCA)的BHI和RI值。
结果:
本研究共纳入183例患者,其中有113例患者分别被诊断为MCI(38例),SCD(49例)和AD(26例)。 在随访期间(平均40个月),有23例(26.4%)患者发展为痴呆。发展为痴呆的患者在大脑两个半球内BHI值显着降低; RI值没有显着变化。 ROC分析显示,左侧大脑中动脉BHI值为0.5、右侧为0.57时,是预测痴呆发展的最佳指标。发展为AD(Z分数BHI <0)的风险比(HR)为5.61(95%置信区间 1.66-18.97)。症状发展的患者具有如下特点:普遍年龄偏高、体重指数较低、缺血性心脏病发生率较高、伴有APOEε4基因、大脑海马萎缩更为严重、血管白质损伤更为严重。
结论:
BHI测量可能是老年痴呆发展最有价值的神经生物学标记。我们的研究表明,左侧大脑中动脉BHI = 0.50、右侧BHI = 0.57为预测老年痴呆转化的最佳参考值。
关键词:
老年痴呆症 - 老年痴呆症人群 - 血管危险因素 - 血管变化 - 磁共振成像 - 神经超声 - 呼吸指数 - 抵抗指数 - 阿尔茨海默病血管学
Autoři:
A. Tomek; B. Urbanová; H. Magerová; H. Marková; J. Paulasová Schwabová; P. Janský; T. Růžičková; I. Mokrišová; J. Laczó; M. Vyhnálek; J. Hort
Působiště autorů:
2. LF UK a FN Motol, Praha
; Neurologická klinika
Vyšlo v časopise:
Cesk Slov Neurol N 2017; 80/113(4): 409-417
Kategorie:
Původní práce
doi:
https://doi.org/10.14735/amcsnn2017409
Souhrn
Úvod:
Vaskulární změny mozku ovlivňují riziko rozvoje i rychlost progrese Alzheimerovy choroby (AD). Primárním cílem studie bylo ověřit prediktivní hodnotu neurosonologických parametrů mozkové mikroangiopatie – indexu rezistence (RI) a indexu zadržení dechu (BHI) pro rozvoj AD demence u starší nedementní populace. Vedlejším cílem bylo porovnání RI a BHI s dalšími vaskulárními biomarkery.
Soubor a metodika:
Do prospektivní studie byli zařazeni pacienti s mírnou kognitivní poruchou (MCI) a subjektivním kognitivním poklesem (SCD). Jako kontrolní skupina byli vyšetřeni pacienti s prokázanou AD demencí. Všichni pacienti podstoupili neuropsychologické vyšetření, MR mozku, neurosonologické vyšetření vč. stanovení RI a BHI ve střední mozkové tepně (ACM).
Výsledky:
Analyzováno bylo 113 z 183 skrínovaných pacientů s diagnózou MCI (n = 38), SCD (n = 49) a prokázanou AD (n = 26). Během průměrné doby sledování 40 měsíců konvertovalo do demence 23 (26,4 %) z 87 zařazených pacientů s MCI a SCD. Skupina s konverzí vykazovala nižší BHI pro obě hemisféry, hodnoty RI se významně nelišily. Dle ROC analýzy predikci konverze nejpřesněji určovaly hodnoty BHI 0,50 pro levou a 0,57 pro pravou ACM (Z-skóre BHI < 0). Riziko konverze do demence pro Z-skóre BHI < 0 bylo 5,61 (95%CI 1,66 – 18,97). Pacienti s konverzí vykazovali významně vyšší věk, nižší index tělesné hmotnosti, častější výskyt ischemické choroby srdeční, alely ε4 APOE, atrofie hipokampů a vaskulárních změn bílé hmoty mozku.
Závěr:
Vyšetření BHI lze využít jako neurosonologický marker konverze do demence u pacientů s MCI a SCD. BHI < 0,50 pro levou a BHI < 0,57 pro pravou ACM vykazují nejvyšší prediktivní hodnotu.
Klíčová slova:
Alzheimerova choroba – demence – starší nedementní populace – vaskulární rizikové faktory – vaskulární změny – magnetická rezonance – neurosonologie – index zadržení dechu – rezistenční index – vaskulární teorie Alzheimerovy nemoci
Úvod
Alzheimerova choroba (Alzheimer‘s disease; AD) je považována za demenci neurodegenerativní etiologie, avšak přesný mechanizmus jejího rozvoje je stále předmětem výzkumu. V 90. letech minulého století byla de la Torrem vyslovena vaskulární hypotéza vzniku AD, která předpokládala primární postižení mozkových kapilár jako podklad rozvoje AD s následnou poruchou mozkové cirkulace, a tím i zásobení mozku důležitými živinami [1]. V dalších letech došlo k odklonu od této hypotézy a rozvoj AD byl přisuzován neurodegenerativnímu procesu. V posledních letech se vaskulární hypotéza vrátila zpět do popředí vědeckého zájmu. Přítomnost vaskulárních rizikových faktorů (VRF) – hypertenze, diabetes mellitus, dyslipidemie, kouření, obezita či kardiovaskulárních onemocnění – zvyšuje riziko rozvoje AD i rychlost její progrese [2 – 4]. Výsledky studií také ukazují, že prevencí a léčbou VRF lze riziko rozvoje AD snížit [5]. Existují indicie, že mechanizmus působení VRF je přímé působení na metabolizmus beta-amyloidu [6]. Zdokonalení zobrazovacích metod dále umožnilo u pacientů s AD detekovat změny, u kterých se předpokládá cévní podklad. Těmito změnami jsou leukoaraióza (White Matter Lesions; WML) a mozková mikrokrvácení (Cerebral Microbleeds; CB). WML přestavují postižení bílé hmoty mozku, v užším slova smyslu jsou považovány za důsledek postižení malých cév centrálního nervového systému (CNS). Jsou přítomny i u zdravých osob, jejich rozsah vzrůstá s věkem, riziková je přítomnost hypertenze či cerebrální amyloidové angiopatie (CAA) [7]. Rozložení WML u pacientů s AD je shodné s lokalizací u zdravých osob, s maximem u rohů postranních komor a v parietálním laloku, jejich rozsah je však u AD výrazně větší [8]. Větší rozsah WML byl rovněž zjištěn u nositelů ε4 alely genu APOE [9], která je riziková pro rozvoj AD. CB představují perivaskulární depozita hemosiderinu, která jsou důsledkem drobných mozkových petechiálních krvácení, většinou klinicky němých. I v případě vzniku CB se uplatňuje zejména hypertenzní angiopatie a CAA, v případě CB v kortiko-subkortikálních lokalizacích, které jsou typické pro AD, je to především CCA [10]. I zde byla prokázána souvislost s APOE genotypem, větší výskyt CB je u ε4 homozygotů [11].
Vzhledem k dostupnosti a neinvazivitě, které z ní dělají vhodnou skríningovou metodu, zasahuje v posledních letech do výzkumu vaskulární hypotézy AD i neurosonologie [12]. U pacientů s AD byla zjištěna vyšší hodnota intimomediální šíře (IMT, šíře komplexu intima/ médie v a. carotis communis) [13], která je považována za známku časné aterosklerózy. Rozsah aterosklerotických změn se rovněž zdá být spojen s rizikem rozvoje AD u nedementních osob [14]. Zjištěn byl i pokles cerebrovaskulární rezervy, která je při transkraniálním dopplerovském (TCD) vyšetření hodnocena jako vazomotorická reaktivita na vzestup pCO2 po zadržení dechu [15]. Studie též ukázaly snížení mozkové perfuze [16], i častější mikroembolizace do tepen CNS [17] u pacientů s AD.
AD, obdobně jako ostatním typům demence, předchází stadium mírné kognitivní poruchy (Mild Cognitive Impairment; MCI). MCI představuje přechodné stadium mezi fyziologickým, věku odpovídajícím poklesem kognitivních funkcí, a syndromem demence. Pacienti s MCI mají poruchu jedné či více kognitivních funkcí objektivizovatelnou neuropsychologickými testy. Ta ale dosud není natolik závažná, aby omezovala pacientovo vykonávání běžných denních aktivit. Dle Petersena je MCI klasifikována na formu amnestickou (aMCI), charakterizovanou postižením paměti a event. i dalších kognitivních funkcí, a formu neamnestickou (naMCI), kdy paměť zůstává intaktní a dochází k postižení jedné či více jiných kognitivních domén [18]. Skupina aMCI je riziková pro konverzi do AD, která se rozvine až u 15 % těchto pacientů ročně [19]. Oproti tomu pacienti s naMCI mají vyšší riziko přechodu do jiných typů demence. Výskyt aMCI v populaci je více než dvakrát častější než naMCI [20]. Naproti tomu pacienti se subjektivním kognitivním poklesem (SCD) mají subjektivní pocit poklesu kognitivních funkcí, který ale nedosahuje tíže objektivizované neuropsychologickými testy.
Hlavní hypotéza naší studie je předpoklad, že sonograficky detekovatelné změny mozkové mikrocirkulace vyjádřené vzestupem rezistenčního indexu (RI) a dále snížená cerebrovaskulární reaktivita měřená pomocí indexu zadržení dechu (Breath-Holding Index; BHI) predikují konverzi do demence. Primárním cílem je porovnání RI a BHI v a. cerebri media (ACM) u starších nedementních pacientů se stížnostmi na paměť s konverzí a bez konverze do demence při AD. Vedlejší cíle jsou:
- porovnání těchto sonografických parametrů u pacientů s konverzí do demence s kontrolní skupinou pacientů s AD;
- porovnání významnosti predikce konverze do demence sonografických markerů (RI a BHI) s dalšími vaskulárními biomarkery – vaskulárními změnami v MR obraze, APOE a anamnestickými cévními rizikovými faktory.
Pacienti a metodika
Do prospektivní monocentrické studie byli zařazeni pacienti s nově vzniklou poruchou kognice udávanou pacientem anebo pečovatelem, kteří byli vyšetřeni v Kognitivním centru Neurologické kliniky 2. LF UK a FN Motol od ledna 2011 do prosince 2015 a splnili následující kritéria.
Vstupní kritéria
Na základě stávajících diagnostických kritérií byli zařazeni do sledování následující pacienti:
- pacienti s aMCI nebo naMCI se subjektivní stížností na paměť, kteří skórovali více než 1,5 SD od norem v některém z paměťových testů;
- pacienti s nově vzniklou stížností na poruchu kognice, jejichž výkon v neuropsychologické baterii byl v mezích normy – nesplňoval kritéria pro MCI, byli označeni jako pacienti se subjektivním kognitivním poklesem (SCD).
Všichni pacienti s MCI (aMCI a naMCI) byli soběstační (Clinical Dementia Rating; CDR; 0,5 bodů) a na škále Mini-Mental State Examination (MMSE) skórovali více než 24 bodů. Do kontrolní skupiny byli zařazeni pacienti, kteří splnili klinická kritéria National Institute of Neurological and Communicative Disorders and Stroke a Alzheimer‘s Disease and Related Disorders Association (NINCDS-ADRDA) pro diagnózu demence při AD [21] a jejichž skóre v MMSE bylo v rozmezí 10 – 24 bodů. Podmínkou pro zařazení do analýzy bylo absolvování nejméně dvou studijních návštěv.
Vylučující kritéria
Do studie nebyly zařazeny subjekty se zvýšenou mírou depresivních symptomů (pacienti dosahující více než 5 bodů ve zkrácené 15položkové verzi Geriatrické škály deprese a subjekty s úzkostnými symptomy, kteří dosahovali více než 7 bodů v Beckově škále úzkosti), s poraněním mozku, s jiným vážným neurologickým nebo psychiatrickým onemocněním postihujícím CNS, užívající psychoaktivní látky či léky s vlivem na CNS, lidé s poškozeným zrakovým nebo sluchovým vnímáním.
Všichni pacienti podepsali informovaný souhlas se studií. Projekt byl schválen etickou komisí FN Motol.
Algoritmus vyšetření
Všichni zařazení pacienti absolvovali při vstupní návštěvě komplexní vyšetřovací protokol obsahující neurologické vyšetření s detailní anamnézou cílenou na vaskulární a kognitivní rizika, neurosonologické vyšetření, MR mozku a komplexní vyšetření neuropsychologickou baterií. Během sledování vždy v rozmezí 12 ± 2 měsíců bylo při každé kontrole opakováno neurologické a neuropsychologické vyšetření a odběr anamnézy, kontrolní návštěvy byly nejméně dvě a max. čtyři. Pro hodnocení prediktivní schopnosti neurosonologických parametrů a vaskulárních rizik byla použita data z prvního vstupního vyšetření do studie, konverze byla hodnocena podle posledního neuropsychologického vyšetření.
Neuropsychologické vyšetření
Všechny subjekty byly vyšetřeny komplexní neuropsychologickou baterií, která prověřovala výkon v doménách pozornosti a pracovní paměti, paměti, exekutivních funkcí, vizuokonstrukčních funkcí, fatických funkcí a psychomotorického tempa. Byly použity tyto testy: MMSE, Paměťový test učení, Test 16 slov, Test cesty, Reyova-Osterriethova komplexní figura, fonemická verbální fluence (hlásky N, K, P), Opakování čísel, Kódování symbolů, Test hodin, Bostonský test pojmenování (BNT-30), Logická paměť. Neuropsychologická baterie obsahovala také škály ke zhodnocení míry depresivní a úzkostné symptomatologie (Geriatrická škála deprese, 15položková verze, Beckova škála úzkosti).
Neurosonologické vyšetření
Transkraniální barevně kódované sonografické (TCCS) vyšetření bylo provedeno na duplexním ultrazvukovém přístroji Toshiba Nemio 20 (Toshiba Healthcare Systems, Tokyo, Japonsko). Protokol vyšetření zahrnoval vyšetření průtokových parametrů mozkových tepen v extrakraniálním průběhu – a. carotis communis a interna a a. vertebralis (VA) vč. posouzení a kvantifikace aterosklerotických změn a změření intimomediální šíře (IMT). Následovalo klidové vyšetření ACM, kdy byly měřeny systolická (PSV), střední (MV) a diastolická (EDV) rychlost toku a indexy pulzatilní (PI) a rezistenční (RI). Všechna měření byla třikrát opakována, analyzována byla průměrná hodnota. Vzhledem k známému rozdílu mezi průtokovými parametry jednotlivých hemisfér [22] jsme přistoupili k lineární transformaci hodnot průtoku pro dané tepny obou hemisfér vytvořením celkového Z-skóre pro lepší vyjádření celkové perfuze. Na závěr byl proveden test zadržení dechu (breath-holding test) podle metodiky Markuse [23] s výpočtem průměrné hodnoty BHI ze tří měření ACM pro každou stranu. Za patologický, tzn. svědčící pro vyčerpanou cerebrovaskulární rezervní kapacitu, byl považován BHI < 0,7 [23].
MR mozku
Vyšetření bylo provedeno na přístroji Magnetom AVANTO 1,5T (Siemens AG, Erlangen, Německo) s následujícími sekvencemi: T2 vážená gradient-echo sekvence, T2 a FLAIR. Hodnocení bylo semikvantitativní pomocí vizuálních škál, odečítající lékař byl zaslepený stran diagnózy pacienta. Hodnoceny byly škála vaskulárních změn hluboké bílé hmoty podle Fazekase [24], Scheltensova vizuální škála hodnocení atrofie hipokampů [25,26] a manuálně odečtený počet depozit hemosiderinu (microbleeds).
Statistická metodika
Jednotlivé podskupiny souboru predefinované pro analýzu dat byly:
- pacienti bez syndromu demence a bez konverze do demence během sledování;
- pacienti iniciálně bez syndromu demence s konverzí do demence během sledování;
- kontrolní skupina pacientů se syndromem demence již iniciálně při vstupu do studie.
Plánované porovnání skupin bylo vzhledem k velikosti souboru omezeno na párové porovnání skupiny 1 se skupinou 2 a skupiny 2 se skupinou 3, jednotlivé diagnostické jednotky aMCI, naMCI a SCD nebyly vzájemně analyzovány pro nízký počet subjektů. Porovnání parametrů jednotlivých definovaných podskupin souboru bylo provedeno s využitím χ2 testu, Fisherova exaktního testu, T-testu nezávislých vzorků a Mannova-Whitneyova U testu podle charakteru proměnných. Přesnost predikce jednotlivých parametrů byla analyzována pomocí ROC (Receiver Operating Characteristics) křivek s výpočtem relevantní plochy pod křivkou (Area Under the Curve; AUC) s odhadem konkrétní specificity a senzitivity. Pro stanovení rizika konverze do stadia demence byl použit Coxův model proporcionálních rizik. Vzhledem k počtu konverzí jsme nezahrnuli všechny proměnné, byl použit algoritmus postupné zpětné selekce s likelihood ratio statistikou. Vybrané proměnné byly hodnoceny jako kontinuální a současně s použitím nominální hodnoty s cut-off 70 let (věk), > 0,7 (BHI), > 0 (Z-skóre BHI) a 28 bodů (MMSE). Do definitivního modelu byly zařazeny pouze proměnné s významností p ≤ 0,2. Platnost modelu byla ověřena podle testu Grønnesbyho a Borgana [18], počet rizikových skupin byl stanoven podle Mayové a Hosmera [19]. Dále byly vytvořeny Kaplanovy-Meierovy křivky přežití s porovnáním faktoru přežití pomocí log-rank testu. Výsledky byly považovány za statisticky signifikantní v případě p < 0,05. Statistické analýzy byly provedeny v softwaru IBM SPSS Statistics 23 (IBM Corporation, Armonk, New York, USA) a STATA 14 (Stata Corp., College Station, Texas, USA).
Výsledky
Kompletní klinická, MR a neurosonologická data a dokončené sledování bylo u 113 pacientů, jejichž data byla analyzována. Nejčastějšími důvody vyloučení bylo chybějící vyšetření magnetickou rezonancí (32 pacientů), neurosonologické (24 pacientů), ztráta ze sledování (13 pacientů) a potvrzené úmrtí (1 pacient). V analyzovaném souboru bylo 87 (77 %) osob bez syndromu demence a 26 (23 %) pacientů s demencí při AD. Během průměrné doby sledování 40 měsíců konvertovalo 23 (26,4 %) pacientů do stadia demence, 64 (73,6 %) bylo bez progrese kognitivní diagnózy. Původní diagnóza konvertovaných pacientů byla SCD u 7 (26,1 %), aMCI u 14 (60,9 %) a naMCI u 2 (8,7 %) pacientů.
Skupina s konverzí ve srovnání s pacienty bez konverze vykazovala významně vyšší věk a nižší BMI, zastoupení pohlaví bylo vyrovnané, detailní demografická a neuropsychologická charakteristika skupin je uvedena v tab. 1. Mezi jednotlivými skupinami byl prokázán již vstupně rozdíl v neuropsychologickém vyšetření. Jmenovitě byl významný rozdíl v MMSE, v Testu cesty A, Paměťovém testu učení (součet slov vybavených v pokusu 1 – 5), v Testu 16 slov, Testu verbální fluence a v Bostonském testu pojmenování (tab. 1). Základní přehled vaskulárních rizikových faktorů a farmakologické anamnézy je uveden v tab. 2. Pacienti s konverzí měli pouze častěji ischemickou chorobu srdeční a častěji užívali antiagregační léčbu. V genu APOE byl prokázán významný rozdíl (p = 0,016) v zastoupení alely ε4 mezi pacienty bez konverze (22,4 %) a s konverzí (50 %), pacienti s konverzí se genotypem významně nelišili od pacientů s demencí (65,4 %). Další vaskulární rizikové faktory se mezi skupinami nelišily.
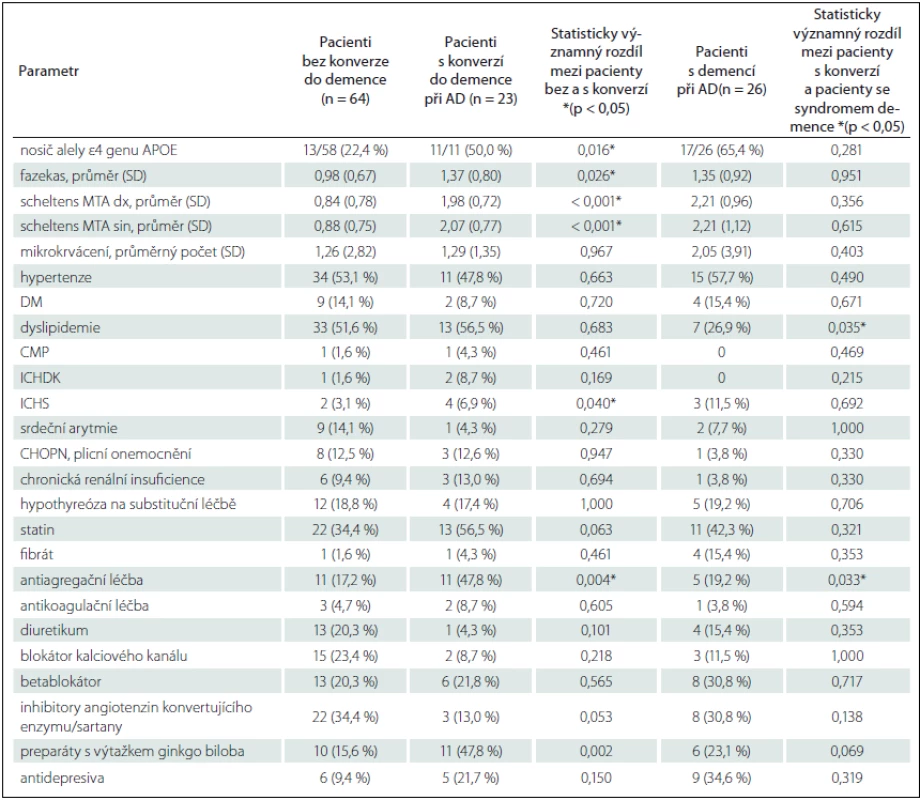
Zobrazení mozku MR na přítomnost vaskulárních změn vykazovalo významné rozdíly mezi skupinami s konverzí a bez ní. Hodnocena byla Fazekasova škála vaskulárních změn hluboké bílé hmoty, kdy průměrná hodnota u pacientů s konverzí byla významně vyšší. Mimo průměrné hodnoty byl rozdíl i v počtu pacientů s 0 body (bez vaskulárních změn) – 21,3 % pacientů bez konverze oproti pouze 13 % pacientům s konverzí. Významné změny (2 a více bodů) naopak mělo jen 9,8 % pacientů bez konverze proti 34,7 % konvertujícím pacientům. Pacienti s konverzí dále vykazovali významně vyšší stupeň atrofie hipokampů hodnocené podle Scheltense. Prokázali jsme pouze nevýznamný trend v častější přítomnosti mikrokrvácení – depozit hemosiderinu u konvertujících pacientů (tab. 2).
Primární cíl
Primárním cílem bylo porovnání RI a BHI v a. cerebri media (ACM) u starších nedementních pacientů, kteří si stěžovali na paměť a u nichž došlo či nedošlo ke konverzi do demence při AD. Hodnota BHI se významně lišila pro obě hemisféry. Pacienti s pozdější konverzí do stadia demence vykazovali významně nižší hodnoty. Hodnoty RI se významně nelišily mezi pacienty s konverzí a bez konverze (tab. 3).
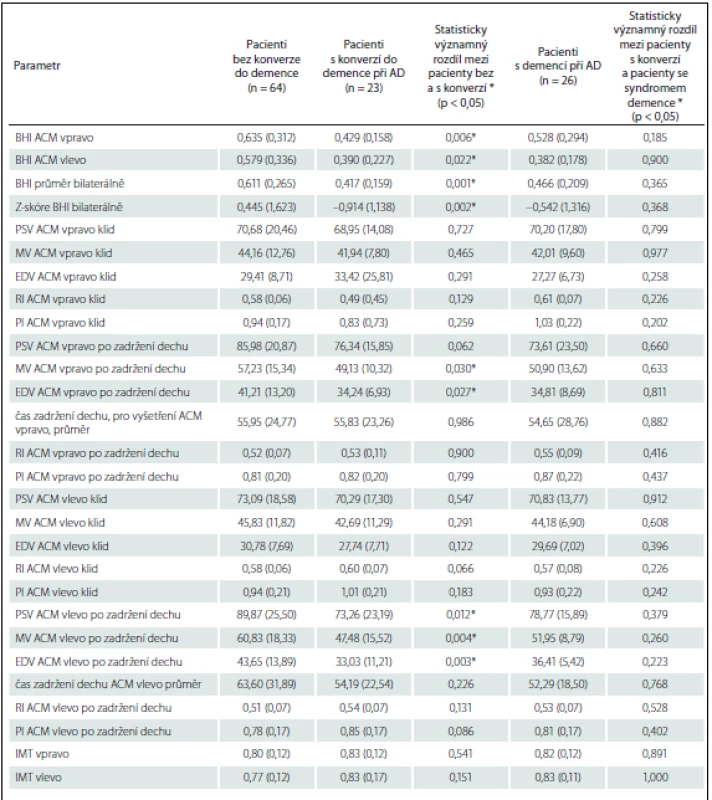
Průměrná hodnota průtokových rychlostí i BHI vykazovala stranovou asymetrii. Hodnoty pro levou ACM byly konstantně nižší celkově i v rámci jednotlivých podskupin pacientů. Průměrný rozdíl BHI, pro celý soubor o 0,06, nebyl dle párového t-testu významný (p = 0,10). Z hlediska obecně uznávané normy, kdy za patologicky snížený je považován BHI < 0,7, byla v našem souboru pro průměrnou hodnotu BHI pod normou většina pacientů – 88,5 % pacientů s demencí, 91,3 % pacientů s konverzí, 65,6 % pacientů bez konverze. Pro odstranění možného vlivu rozdílné hodnoty průtokových rychlostí mezi oběma hemisférami jsme vytvořili Z-skóre pro BHI bilaterálně a z nich pak hodnotu průměrnou (Z-skóre BHI).
Pro určení přesnosti predikce konverze do demence byly vytvořeny ROC křivky s výpočtem AUC pro hodnoty BHI pro ACM vlevo a vpravo, průměrnou BHI, průměrnou hodnotu BHI < 0,7 a totéž pro Z-skórové hodnoty těchto proměnných s použitím cut-off hodnoty < 0. Tato hodnota odpovídá BHI = 0,50 pro levou ACM a BHI = 0,57 pro pravou ACM.
Jako nejpřesnější prediktor konverze v našem souboru vyšla hodnota průměrné BHI < 0,5, kdy plocha pod křivkou (AUC) 71,2 (p = 0,008), senzitivita pak je 88,2 % a specificita 54,2 %.
Výsledky detailních parametrů neurosonologického vyšetření ACM jsou uvedeny v tab. 3.
Významný rozdíl vykazovaly také některé vstupní parametry pro výpočet BHI i samostatně – střední a diastolická rychlost toku v ACM vpravo po zadržení dechu a systolická, střední i diastolická rychlost v ACM vlevo po zadržení dechu. Průtokové rychlosti, přítomnost aterosklerotických změn extrakraniálních mozkových tepen a intimomediální šíře v a. carotis communis se mezi skupinami rovněž významně nelišily (tab. 3).
Sekundární cíle
Sekundárními cíli bylo porovnání BHI a RI v ACM starších nedementních pacientů s kontrolní skupinou pacientů s AD demencí. Hodnoty BHI ani RI se mezi pacienty s demencí a konverzí do demence významně nelišily (tab. 3).
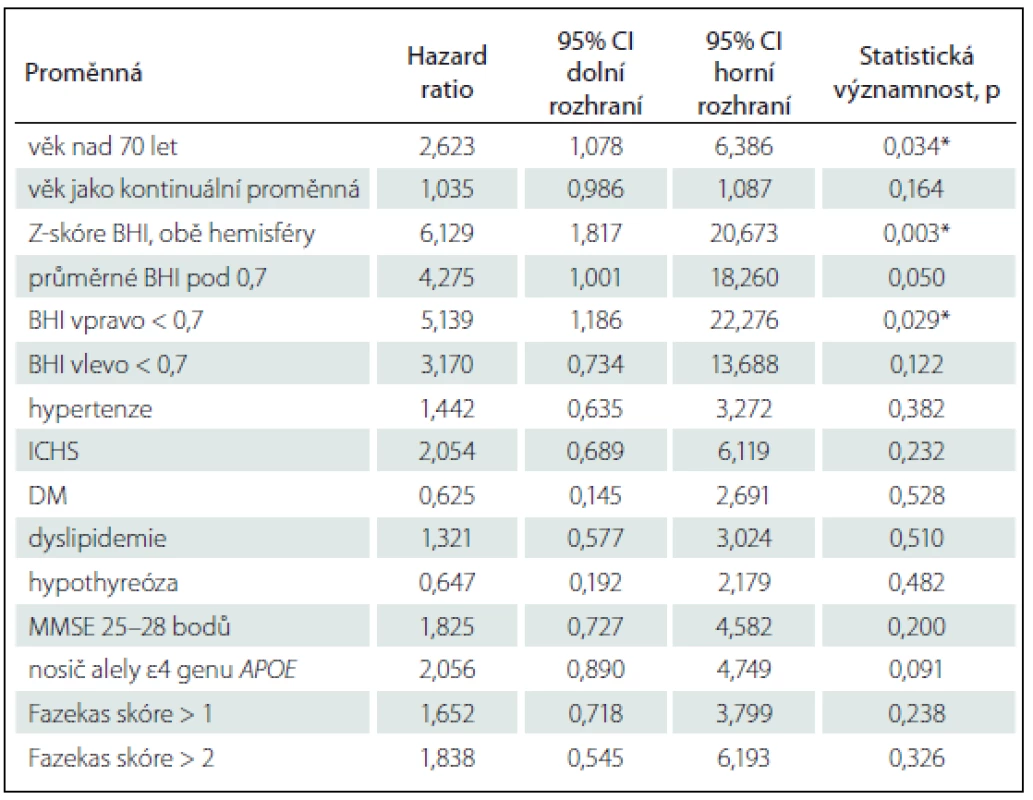
Dalšími sekundárními cíli bylo porovnání prediktivní schopnosti dalších vaskulárních biomarkerů s BHI a RI v ACM pomocí Coxova modelu poměrných rizik. Výsledky univariátního testování poměru rizik (Hazard Ratio; HR) konverze do demence pomocí Coxova modelu proporcionálních rizik jsou uvedeny v tab. 4. Významně vyšly ze všech testovaných proměnných pouze věk kontinuálně i nominálně > 70 let (HR = 2,62; 95% CI 1,08 – 6,39; p = 0,034) a Z-skóre BHI (HR = 6,13; 95% CI 1,82 – 20,67; p = 0,003). Další proměnné ani po dosazení do modelu nedosáhly statistické významnosti, nezměnily parametry modelu a nebyly do modelu zařazeny. Definitivní upravené riziko konverze do AD pro pacienty se Z-skóre BHI < 0 je HRadj = 5,61 (95% CI 1,66 – 18,97; p = 0,006), upravené HR pro věk je 1,068 (95% CI 1,012 – 1,127; p = 0,017). Ostatní proměnné nebyly statisticky významné. Významnost vztahu nízkého Z-skóre BHI a pravděpodobnosti konverze do demence v našem souboru demonstruje Kaplanova-Meierova křivka s hladinou významnosti podle log-rank testu χ2 = 9,259; p = 0,002 (graf 1).

Diskuze
Hlavním výsledkem naší práce je potvrzení významnosti BHI pro predikci konverze do demence u pacientů s kognitivními obtížemi. Obdobný výsledek prokázala práce Viticchiové et al, kdy riziko konverze do demence bylo OR = 5,80 (95% CI 1,83 – 18,37; p = 0,05), riziko bylo stanoveno podle průměrné hodnoty BHI pro obě hemisféry [27]. Tento postup nám přijde méně adekvátní, protože nezahrnuje dobře známou diferenci v perfuzi mozkových hemisfér, kdy povodí levé ACM vykazuje v řadě metodik nižší perfuzi [22,28]. Průměrné hodnoty pak mohou díky vyšším hodnotám toku z ACM vpravo anulovat možnou patologii levé ACM. Stejně i všechny další práce prokazující validitu BHI použily průměrné hodnoty pro obě ACM [29,30]. V našem souboru rozhraní BHI < 0,7 predikovalo s nižší hladinou významnosti než rozhraní vytvořené jako Z-skóre BHI < 0. Další otázkou pro praktické využití BHI v diagnostice preklinických stadií AD je otázka úpravy normy pro index BHI, která je 0,7. Tato norma byla vytvořena pro pacienty se stenózou a okluzí vnitřní karotidy a zřejmě plně nereflektuje odlišnou situaci mozkové mikrocirkulace u angiopatie při neurodegeneraci.
Námi naměřené hodnoty rychlostí i BHI pak byly celkově nižší než literárně udávané hodnoty obdobných souborů [27,31]. Možnou příčinou je přesnější měření rychlostí TCCS s úhlovou korekcí oproti ostatním studiím s klasickým TCD přístrojem bez možnosti korekce. Vzájemný vztah sníženého BHI a rozvoje alzheimerovské patologie není dosud uspokojivě patofyziologicky uzavřen. Nejpravděpodobnější příčinou snížení BHI je strukturální poškození se sníženou pružností tepen malého kalibru. Předpokládaným mechanizmem je zvýšená akumulace (snížené odplavování) amyloidu v perikapilárních prostorech při chronické hypoperfuzi [32]. Jednou z možných rolí amyloidu je účast na vaskulárních opravných mechanizmech hematoencefalické bariéry zabráněním prosakování z malých mozkových tepen [33]. Tento mechanizmus je jistě v mladším věku a zejména dobré perfuzi CNS protektivní, nicméně při patologické hypoperfuzi může akcelerovat degeneraci. Citlivým markerem snížené mozkové perfuze je právě BHI posuzující cerebrovaskulární reaktivitu. BHI je pak dále snížen při celkové hypoperfuzi při kardiálním selhání nebo při lokální hypoperfuzi na podkladě významné stenózy mozkové přívodné tepny, přičemž oba tyto faktory se určitě na patogenezi AD podílí minimálně minoritně. Naše práce však nepotvrdila další literárně udávaný významný sonologický prediktor konverze – IMT, který je markerem celkového kardiovaskulárního rizika [27]. Porucha cerebrovaskulární mikrocirkulace nebude zřejmě nikdy jediným kauzálním faktorem, ale určitě zrychluje progresi u pacientů s již preexistujícími genetickými a lifestylovými riziky pro rozvoj AD.
Sledované MR parametry a faktory vaskulárního rizika z anamnézy neměly v našem souboru žádný zásadní prediktivní význam. Podíl faktorů, jako je dyslipidemie, diabetes mellitus, je zřejmě minoritní a nepodílí se významně na riziku konverze do demence u jednotlivých pacientů. Jejich význam je pravděpodobně třeba hodnotit na zásadně větších souborech s 1 000 pacienty. Jedinou výjimkou v našem souboru byla přítomnost ischemické choroby srdeční, nicméně pro celkový model rizika nebyla významnou proměnnou.
Zásadní limitací studie je zejména velikost zkoumaného souboru, která umožnila ověření naší hypotézy, ale již neumožnila tvorbu stabilního predikčního modelu s více proměnnými. Velikost souboru rovněž omezila porovnání jednotlivých podskupin starší nedementní populace vzájemně – tj. aMCI, naMCI a SCD. Další možnou limitací neurosonologického vyšetření je závislost na zkušenosti vyšetřujícího. Tato nevýhoda ale může být vyvážena menší závislostí testování BHI na aktuální psychické kondici vyšetřovaného pacienta, která je jednou z možných limitací reproducibility neuropsychologického vyšetření. Toto vyšetření lze provést v běžné ambulantní praxi do 15 min a může jako rychlý skríningový test doplnit mozaiku vyšetření u pacientů se subjektivními stížnostmi na kognitivní deficit.
Závěr
Jako nejperspektivnější neurosonologický marker konverze do stadia demence se jeví vyšetření BHI. Než budou provedeny větší normativní studie starší populace s neurodegenerací a bez ní, navrhujeme používat námi vytvořené rozhraní normy: BHI = 0,50 pro levou ACM a BHI = 0,57 pro pravou ACM, které vykazuje alespoň v naší kohortě nejvyšší prediktivní hodnotu pro konverzi do syndromu demence.
Podpora: IGA MZ ČR, projekt NT/ 13319-4.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Aleš Tomek, Ph.D., FESO
Neurologická klinika
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha
e-mail: ales.tomek@fnmotol.cz
Přijato k recenzi: 26. 1. 2016
Přijato do tisku: 4. 5. 2016
Zdroje
1. de la Torre J, Mussivand T. Can disturbed brain microcirculation cause Alzheimer’s disease? Neurol Res 1993;15(3):146 – 53.
2. Snyder H, Corriveau R, Craft S, et al. Vascular contributions to cognitive impairment and dementia including Alzheimer’s disease. Alzheimers Dementia 2015;11(6):710 – 7. doi: 10.1016/ j.jalz.2014.10.008.
3. Kume K, Hanyu H, Sato T, et al. Vascular risk factors are associated with faster decline of Alzheimer disease: a longitudinal spect study. J Neurol 2011;258(7):1295 – 303. doi: 10.1007/ s00415-011-5927-y.
4. Li J, Wang YJ, Zhang M, et al. Vascular risk factors promote conversion from mild cognitive impairment to Alzheimer disease. Neurology 2011;76(17):1485 – 91. doi: 10.1212/ WNL.0b013e318217e7a4.
5. Hort J, O’Brien JT, Gainotti G, et al. Efns guidelines for the diagnosis and management of Alzheimer’s disease. Eur J Neurol 2010;17(10):1236 – 48. doi: 10.1111/ j.1468-1331.2010.03040.x.
6. Cao D, Lu H, Lewis TL, et al. Intake of sucrose-sweetened water induces insulin resistance and exacerbates memory deficits and amyloidosis in a transgenic mouse model of Alzheimer disease. J Biol Chem 2007;282(50):36275 – 82.
7. Longstreth W, Manolio T, Arnold A, et al. Clinical correlates of white matter findings on cranial magnetic resonance imaging of 3301 elderly people. The cardiovascular health study. Stroke 1996;27(8):1274 – 82.
8. Holland C, Smith E, Csapo I, et al. Spatial distribution of white-matter hyperintensities in Alzheimer disease, cerebral amyloid angiopathy, and healthy aging. Stroke 2008;39(4):1127 – 33. doi: 10.1161/ STROKEAHA.107.497438.
9. Stenset V, Hofoss D, Johnsen L, et al. White matter lesion load increases the risk of low csf aβ42 in apolipoprotein e-4 carriers attending a memory clinic. J Neuroimaging 2011;21(2):e78 – 82. doi: 10.1111/ j.1552-6569.2009.00444.x.
10. Schrag M, McAuley G, Pomakian J, et al. Correlation of hypointensities in susceptibility-weighted images to tissue histology in dementia patients with cerebral amyloid angiopathy: a postmortem mri study. Acta Neuropathol 2010;119(3):291 – 302. doi: 10.1007/ s00401-009-0615-z.
11. Goos JDC, Kester MI, Barkhof F, et al. Patients with Alzheimer disease with multiple microbleeds: relation with cerebrospinal fluid biomarkers and cognition. Stroke 2009;40(11):3455 – 60. doi: 10.1161/ STROKEAHA.109.558197.
12. Tomek A, Urbanova B, Hort J. Utility of transcranial ultrasound in predicting Alzheimer‘s disease risk. J Alzheimers Dis 2014;42(Suppl 4):S365 – 74. doi: 10.3233/ JAD-141803.
13. Stefani A, Sancesario G, Pierantozzi M, et al. CSF biomarkers, impairment of cerebral hemodynamics and degree of cognitive decline in Alzheimer‘s and mixed dementia. J Neurol Sci 2009;283(1 – 2):109 – 15. doi: 10.1016/ j.jns.2009.02.343.
14. Hofman A, Ott A, Breteler M, et al. Atherosclerosis, apolipoprotein e, and prevalence of dementia and Alzheimer‘s disease in the rotterdam study. Lancet 1997;349(9046):151 – 4.
15. Vicenzini E, Ricciardi M, Altieri M, et al. Cerebrovascular reactivity in degenerative and vascular dementia: a transcranial doppler study. Eur Neurol 2007;58(2):84 – 9.
16. Maalikjy Akkawi N, Borroni B, Agosti C, et al. Volume reduction in cerebral blood flow in patients with Alzheimer‘s disease: a sonographic study. Dementi Geriatr Cogn Disord 2003;16(3):163 – 9.
17. Purandare N, Burns A. Cerebral emboli in the genesis of dementia. J Neurol Sci 2009;283(1 – 2):17 – 20. doi: 10.1016/ j.jns.2009.02.306.
18. Petersen R. Mild cognitive impairment as a diagnostic entity. J Intern Med 2004;256(3):183 – 94.
19. Gauthier S, Reisberg B, Zaudig M, et al. Mild cognitive impairment. Lancet 2006;367(9518):1262 – 70.
20. Petersen R, Roberts R, Knopman D, et al. Prevalence of mild cognitive impairment is higher in men. The mayo clinic study of aging. Neurology 2010;75(10):889 – 97. doi: 10.1212/ WNL.0b013e3181f11d85.
21. Dubois B, Feldman H, Jacova C, et al. Research criteria for the diagnosis of Alzheimer‘s disease: revising the nincds-adrda criteria. Lancet Neurol 2007;6(8):734 – 46.
22. Brinkmann BH, Jones DT, Stead M, et al. Statistical parametric mapping demonstrates asymmetric uptake with tc-99m ecd and tc - 99m hmpao spect in normal brain. J Cereb Blood Flow Metab 2011;32(1):190 – 8. doi: 10.1038/ jcbfm.2011.123.
23. Markus H. Estimation of cerebrovascular reactivity using transcranial doppler, including the use of breath-holding as the vasodilatory stimulus. Stroke 1992;23(5):668 – 73.
24. Fazekas F, Chawluk J, Alavi A, et al. MR signal abnormalities at 1.5 t in Alzheimer’s dementia and normal aging. AJR Am J Roenthenol 1987;149(2):351 – 6.
25. Scheltens P, Leys D, Barkhof F, et al. Atrophy of medial temporal lobes on MRI in „probable“ Alzheimer’s disease and normal ageing: diagnostic value and neuropsychological correlates. J Neurol Neurosurg Psychiatry 1992;55(10):967 – 72.
26. Kadlecová A, Vyhnálek M, Laczó J, et al. Interrater variabilita v hodnocení míry atrofie hipokampů pomocí scheltensovy škály. Cesk Slov Neurol N 2013;76/ 109(5):603 – 7.
27. Viticchi G, Falsetti L, Vernieri F, et al. Vascular predictors of cognitive decline in patients with mild cognitive impairment. Neurobiol Aging 2012;33(6):1121.e1 – 9. doi: 10.1016/ j.neurobiolaging.2011.11.027.
28. Van Laere KJ, Dierckx RA. Brain perfusion spect: age - and sex-related effects correlated with voxel-based morphometric findings in healthy adults1. Radiology 2001;221(3):810 – 7.
29. Stefani A, Sancesario G, Pierantozzi M, et al. CSF biomarkers, impairment of cerebral hemodynamics and degree of cognitive decline in Alzheimer‘s and mixed dementia. J Neurol Sci 2009;283(1 – 2):109 – 15. doi: 10.1016/ j.jns.2009.02.343.
30. Bär KJ, Boettger MK, Seidler N, et al. Influence of galantamine on vasomotor reactivity in Alzheimer’s disease and vascular dementia due to cerebral microangiopathy. Stroke 2007;38(12):3186 – 92.
31. Demarin V, Kes VB, Morović S, et al. Evaluation of aging vs dementia by means of neurosonology. J Neurol Sci 2009;283(1 – 2):9 – 12. doi: 10.1016/ j.jns.2009.02.006.
32. Pimentel-Coelho PM, Rivest S. The early contribution of cerebrovascular factors to the pathogenesis of Alzheimer’s disease. Eur J Neurosci 2012;35(12):1917 – 37. doi: 10.1111/ j.1460-9568.2012.08126.x.
33. Weller RO, Subash M, Preston SD, et al. Perivascular drainage of amyloid-β peptides from the brain and its failure in cerebral amyloid angiopathy and Alzheimer‘s disease. Brain Pathology 2007;18(2):253 – 66. doi: 10.1111/ j.1750-3639.2008.00133.x.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2017 Číslo 4
-
Všechny články tohoto čísla
- Ataxie
- Editorial
- Pacient s hemiplegií má být vezen přímo do KCC
- Pacient s hemiplegií nemá být vezen přímo do KCC
- Má být pacient s hemiplegií vezen přímo do KCC?
- Kognitivní funkce u pacientů s nízkostupňovými gliomy – přehledová studie
- Klinický přínos radiologických parametrů u lumbální spinální stenózy
- Neurosonologické markery predikce kognitivní deteriorace
- Český národní registr Guillainova-Barrého syndromu
- Možné využití spánkové endoskopie pro zvýšení efektivity léčby (operační i neoperační) u pacientů s obstrukční spánkovou apnoí
- Prevalence Martin-Gruberovy anastomózy – elektrofyziologie studie
- Poranění periferních nervů při suprakondylických zlomeninách humeru u dětí
- Systematická evaluace center provádějících mechanické trombektomie u akutního mozkového infarktu v České republice za rok 2016
- Predikce úmrtnosti na neurochirurgické jednotce intenzivní péče
- Klinický pohled otorinolaryngologa a radiologa na klasifikaci zlomenin spánkové kosti
- Vliv různých technik pracovních terapií na pacienty po mozkové mrtvici
- Comment of Article The Effect of Different Occupational Therapy Techniques on Post-stroke Patients
- Disekce všech čtyř přívodných mozkových tepen v terénu fibromuskulární dysplazie – kazuistika
- Intravenózní trombolýza po zrušení účinku dabigatranu specifickým antidotem idarucizumabem
- Zkušenosti s použitím thuliového laseru RevoLix Jr při resekci glioblastomu – kazuistiky
- Doporučený postup České pneumologické a ftizeologické společnosti a České společnosti dětské pneumologie pro dlouhodobou domácí léčbu poruch expektorace pomocí přístroje CoughAssist
- Analýza dat v neurologii
- Recenze knih
- Výbor Cerebrovaskulární sekce ČNS spolupořádal v Praze European Stroke Organisation Conference
- Cena za přínos péči o cévní mozkové příhody doc. MUDr. Robertu Mikulíkovi, Ph.D., FESO
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Český národní registr Guillainova-Barrého syndromu
- Klinický pohled otorinolaryngologa a radiologa na klasifikaci zlomenin spánkové kosti
- Doporučený postup České pneumologické a ftizeologické společnosti a České společnosti dětské pneumologie pro dlouhodobou domácí léčbu poruch expektorace pomocí přístroje CoughAssist
- Poranění periferních nervů při suprakondylických zlomeninách humeru u dětí
