Efektivita prodlouženého dávkovacího intervalu natalizumabu u pacientů s roztroušenou sklerózou
Effectiveness of natalizumab extended interval dosing in multiple sclerosis patients
Aim: Natalizumab is a highly effective drug used in the treatment of multiple sclerosis, but it is also often associated with a risk of inducing progressive multifocal leukoencephalopathy. In order to minimalize this risk, extended interval dosing has been proposed. The aim of this study was to assess possible consequences of extended interval dosing on the effectivity of the treatment.
Patients and methods: We conducted a retrospective analysis of all patients treated with natalizumab using a 6-week interval dosing schedule at the Centre for Diagnostics and Treatment of Demyelinating Disorders at Motol University Hospital. Only patients pre-treated for at least 1 year with a standard 4-week interval schedule, and then treated for at least 1 year with 6-week interval schedule were enrolled. The reasons to switch to an extended interval dosing were either a high risk of progressive multifocal leukoencephalopathy or long-term clinical stabilization on natalizumab.
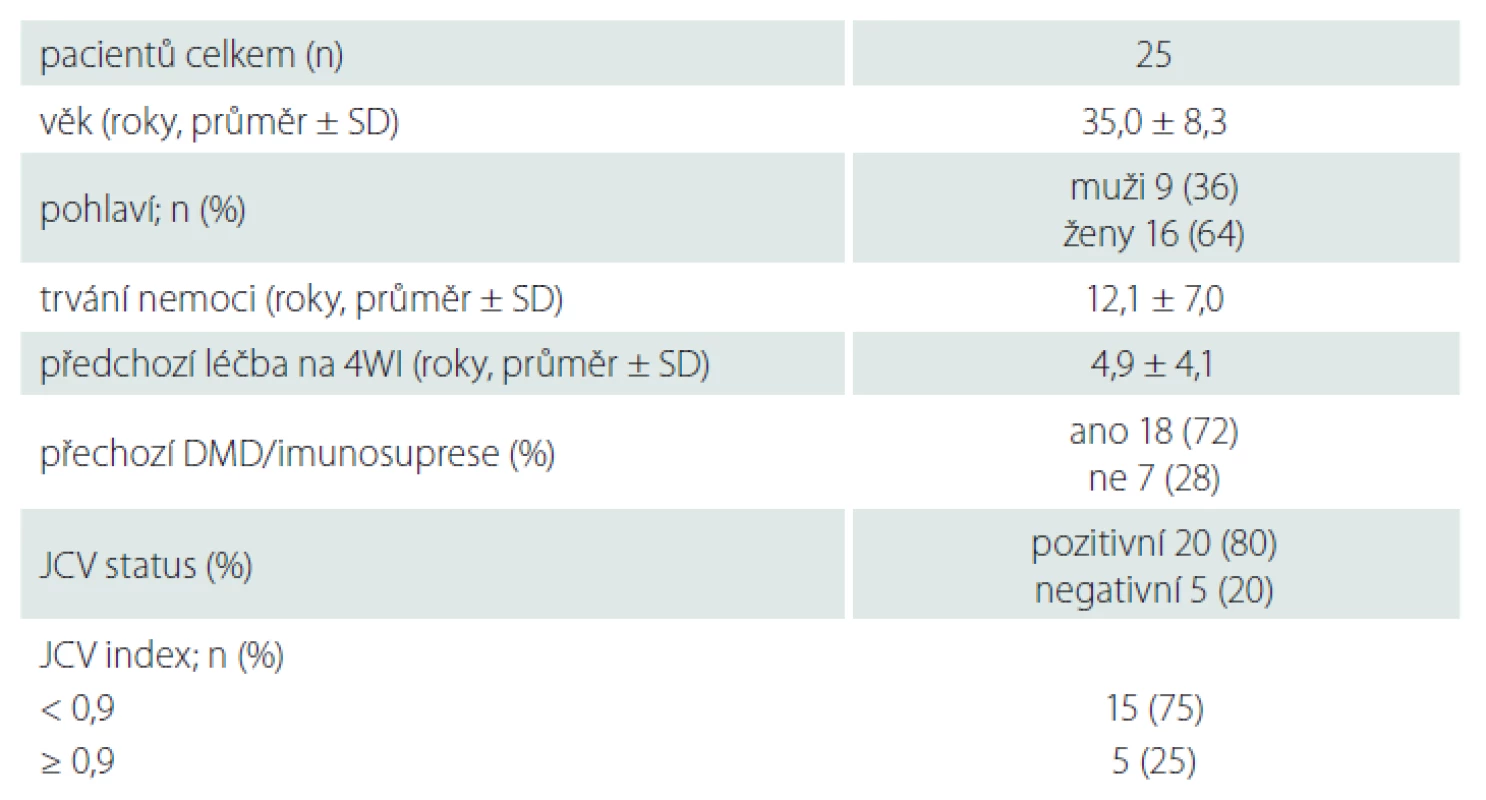
Results: Overall, 25 patients were enrolled in this study. Data were collected for the periods before and after switching to 6-week interval dosing. The average analyzed period was 3.8 ± 1.9 years (for both dosing regimens altogether). The average annualized relapse rate in 4-week and 6-week interval periods was 0.073 ± 0.209 and 0.074 ± 0.178, resp. (P = 1.0000). The average new yearly MRI activity in 4-week and 6-week interval periods was 0.29 ± 0.40 and 0.16 ± 0.33, resp. (P = 0.1250). The average Expanded Disability Status Scale score in 4-week and 6-week interval periods was 2.29 ± 0.90 and 2.16 ± 0.88, resp. (P = 0.0127). There was one case of progressive multifocal leukoencephalopathy recorded in the 6-week interval group; none occurred in the 4-week interval group.
Conclusions: In the population of patients treated with natalizumab at our centre, we did not prove that 6-week interval dosing was less effective compared to the standard 4-week interval dosing.
Keywords:
Multiple sclerosis – natalizumab – extended dosing interval
Autoři:
M. Petržalka; E. Meluzínová; H. Mojžíšová; J. Libertínová; P. Ročková; E. Němá; M. Elišák; P. Marusič
Působiště autorů:
Neurologická klinika 2. LF UK a FN Motol, Praha
Vyšlo v časopise:
Cesk Slov Neurol N 2020; 83(1): 79-83
Kategorie:
Původní práce
doi:
https://doi.org/10.14735/amcsnn202079
Souhrn
Cíl: Natalizumab je vysoce efektivní lék používán v terapii RS. Nejzávažnějším nežádoucím účinkem natalizumabu je riziko rozvoje progresivní multifokální leukoencefalopatie. Za účelem minimalizace tohoto rizika bylo navrženo prodloužení dávkovacího intervalu. Cílem této studie bylo posoudit možné důsledky prodloužení intervalu na účinnost léčby.
Soubor a metodika: Retrospektivní analýza všech pacientů léčených natalizumabem v Centru pro diagnostiku a léčbu demyelinizačních onemocnění FN Motol, kteří byli vzhledem ke zcela stabilizovanému stavu a/nebo zvýšenému riziku rozvoje progresivní multifokální leukoencefalopatie převedeni na 6týdenní dávkovací interval. Zahrnuti byli pouze pacienti léčení alespoň 1 rok v 4týdenním intervalu a zároveň alespoň 1 rok v 6týdenním dávkovacím intervalu.
Výsledky: Do studie bylo zařazeno 25 pacientů. Data byla sbírána před převedením na 6týdenní interval a po něm. Průměrná délka sledovaného období byla celkem 3,8 ± 1,9 roku (v součtu pro oba intervaly). Průměrná roční četnost atak (annualized relapse rate) byla při 4týdenním intervalu 0,073 ± 0,209, při 6týdenním 0,074 ± 0,178 (p = 1,0000). Průměrná nová roční aktivita na MR byla při 4týdenním intervalu 0,29 ± 0,40, při 6týdenním 0,16 ± 0,33 (p = 0,1250). Průměrné skóre Expanded Disability Status Scale činilo při 4týdenním intervalu 2,29 ± 0,90, při 6týdenním 2,16 ± 0,88 (p = 0,0127). Při 6týdenním intervalu jsme zaznamenali jeden případ progresivní multifokální leukoencefalopatie, při standardním intervalu nebyl zaznamenán žádný.
Závěr: V našem souboru jsme neprokázali nižší efektivitu 6týdenního dávkovacího intervalu natalizumabu oproti 4týdennímu.
Klíčová slova:
natalizumab – roztroušená skleróza – prodloužený dávkovací interval
Úvod
Natalizumab je rekombinantní humanizovaná monoklonální protilátka proti α4-integrinu [1,2]. Integrinové podjednotky α4 tvoří s podjednotkami β1 a β7 komplexy, které se nacházejí zejména v membránách leukocytů a v menší míře i v membránách buněk jiných tkání [3]. V patogenezi RS se uplatňuje vazba těchto komplexů na adhezivní molekuly (VCAM1, MAdCAM-1, osteopontin, fibronectin) exprimované endoteliálními buňkami cév v zánětlivě změněné tkáni CNS, čímž je umožněn přestup aktivovaných buněk imunitního systému přes hematoencefalickou bariéru (HEB), kde potencují zánětlivou reakci [4–8]. Natalizumab této interakci brání, čímž redukuje vznik a udržování autoimunitního zánětu [9].
Natalizumab je vysoce účinný lék ze skupiny „disease modifying drugs“ (DMD) pro léčbu RS, s efektem jak na stabilizaci rozvoje funkčního postižení (měřeného dle Expanded Disability Status Scale; EDSS), tak na roční počet atak (annualized relapse rate; ARR) i aktivitu na MR [8]. Jeho vysoká účinnost je doplněna obecně příznivým bezpečnostním profilem [10]. Terapie natalizumabem však může u cca jednoho pacienta z 1 000 indukovat velmi závažnou komplikaci – progresivní multifokální leukoencefalopatii (PML). Jedná se o lytický proces mozkové tkáně s letalitou překračující 20 %, který je způsoben nekontrolovaným šířením viru Johna Cunninghama (JCV) v mozkové tkáni. Infekce JCV je u zdravého jedince inaparentní a je poměrně častá (prevalence 50–90 %); virus může přetrvávat v latentní formě v kostní dřeni a v ledvinách a nepředstavuje zvýšené riziko. Současné teorie vzniku PML předpokládají působení několika mechanizmů, které indukuje právě terapie natalizumabem. Stejná inhibice interakce integrinů a adhezivních molekul jako na HEB způsobuje v kostní dřeni sníženou afinitu lymfoidních buněk k této tkáni, čímž dochází ke zvýšenému vyplavování potenciálně JCV infikovaných buněk do periferní krve. Dále dochází ke změnám na genetické úrovni, které mají za následek upregulaci JCV v buňkách, a konečně také ke snížení imunitního dohledu [11–13]. Z literatury je známo, že tyto děje představují zvýšené riziko vzniku PML u pacientů, jež setrvávají na terapii natalizumabem déle než 2 roky, JCV séropozitivních a s anamnézou předchozí imunosupresivní léčby [14].
Minimalizace rizika PML je velmi živým tématem klinického výzkumu RS. Stále častěji je studována možnost prodloužení dávkovacího intervalu natalizumabu, který se standardně podává i.v. infuzí v dávce 300 mg pravidelně každé 4 týdny [15,16]. Teorie prodloužení dávkovacího intervalu vychází z farmakokinetických studií, dle kterých je saturace receptorů pro natalizumab (adhezivní molekuly, viz výše) i po 6 týdnech ∼60 %, a tedy dostatečně účinná [17]. Předpokládá se, že nižší úroveň saturace zároveň umožní dostatečný imunitní dohled nad oportunními infekcemi, jako je právě JCV [18]. Prodloužení intervalu na 6 týdnů by v takovém případě vedlo ke snížení rizika PML za současného udržení dostatečné účinnosti přípravku. Cílem této studie bylo srovnat účinnost natalizumabu v léčbě RS při použití dávkovacího intervalu prodlouženého na 6 týdnů (6WI) proti standardnímu 4týdennímu intervalu (4WI) za pomoci ukazatelů klinické aktivity (ARR), aktivity na MR a dlouhodobého hodnocení funkčního postižení (EDSS).
Soubor a metodika
V této retrospektivní kohortové studii byli hodnoceni pacienti léčení natalizumabem v Centru pro diagnostiku a léčbu demyelinizačních onemocnění FN Motol. Zařazeni byli všichni pacienti, kteří byli léčeni alespoň 1 rok v 4WI a zároveň alespoň 1 rok v 6WI. Léčba byla vždy zahájena ve standardním dávkování 4WI. Do studie nebyli zařazeni pacienti, u kterých délka intervalu mezi dávkami výrazněji kolísala, a to zejména pro časté prolongované infekce či non-compliance. Významné odchýlení od dávkovacího intervalu bylo definováno jako prodloužení stanoveného intervalu o 6 a více dnů v alespoň dvou po sobě jdoucích intervalech; zkrácení intervalu nebylo zaznamenáno. Všichni pacienti byli ve sledovaném období v relaps remitentní fázi onemocnění RS.
U pacientů jsme sledovali tři hlavní parametry – ARR, aktivitu na MR a funkční postižení dle EDSS. Sledovací období bylo kontinuální a časově symetrické – každý jednotlivý pacient byl hodnocen po stejnou dobu na 4WI a na 6WI. Rozhodnutí o změně dávkovacího intervalu bylo ponecháno na ošetřujícím neurologovi (lékař se zkušenostmi s léčbou pacientů s RS). Vzhledem k retrospektivnímu charakteru studie nebyla provedena žádná forma randomizace a délka sledování byla pro jednotlivé pacienty rozdílná.
Údaje pro statistické zpracování byly získány z nemocničního informačního systému a zdrojové dokumentace, která jeho zavedení předcházela. Zpracování probíhalo anonymizovaně za užití nepřímých identifikátorů a vzhledem k retrospektivnímu charakteru studie nebyl od zařazených pacientů získáván informovaný souhlas. Všichni pacienti byli informováni o důvodech a rizicích prodloužení dávkovacího intervalu, s tímto postupem souhlasili a ošetřující neurolog provedl o této změně zápis do zdrojové dokumentace. Každá ataka onemocnění byla potvrzena ošetřujícím neurologem. Míra funkčního postižení, kterou představuje škála EDSS, byla hodnocena při každé ambulantní kontrole – standardně každé 3 měsíce. Pro účely studie jsme pracovali s údaji o EDSS v ročních intervalech, zaznamenávanými mimo ataku. V rámci monitorace pacientů se v našem centru provádí kontrolní MR mozku a krční míchy standardně 1× ročně. U JCV pozitivních pacientů, kteří byli na terapii natalizumabem déle než 2 roky, byla navíc prováděna „bezpečnostní“ vyšetření MR každé 3 měsíce. V rámci této studie byla aktivita onemocnění na MR stanovena jako nová či zvětšující se ložiska v sekvencích T2 (nebo FLAIR), gadolinium u kontrolních vyšetření není rutinně podáváno. Aktivita byla hodnocena dichotomicky – jako přítomna/ nepřítomna za období posledního roku. Před převedením na 6WI bylo vždy provedeno kontrolní vyšetření MR, proto údaje o MR aktivitě korespondují s obdobím na příslušném dávkovacím intervalu. Údaj o četnosti nové roční aktivity za sledovací období poskytuje obdobnou informaci o MR aktivitě jako ARR o aktivitě klinické.
V rámci komplexního sběru dat byly hodnoceny také údaje o eventuálním vzniku PML a JCV status. Testování JCV je prováděno v rámci rutinního sledování pacientů každých 6 měsíců a samotné vyšetření je prováděno v laboratoři Unilabs a.s. v Kodani metodou STRATIFY JCV™ (Biogen International GmbH, Baar, Switzerland) (test ELISA o dvou krocích).
Statistická analýza byla provedena pomocí software SAS (SAS Institute Inc., Cary, NC, USA). Pro měřené parametry v celém souboru a v jednotlivých skupinách a podskupinách byly počítány základní statistické údaje jako průměr, směrodatná odchylka, rozptyl, medián, rozpětí, minimum, maximum. Změna zkoumaných hodnot v čase byla testována pomocí párových testů polohy (znaménkový párový test nebo Wilcoxonův párový test). Vztahy mezi proměnnými byly zkoumány pomocí Spearmanova korelačního koeficientu. Statistická významnost byla stanovena na hranici alpha = 5 %.
Výsledky
Ze všech pacientů sledovaných v Centru pro diagnostiku a léčbu demyelinizačních onemocnění FN Motol splnilo zařazovací kritéria studie celkem 25 subjektů. Základní demografické údaje a charakteristika souboru v době přechodu z 4WI na 6WI jsou uvedeny v tab. 1. Průměrná délka sledování byla 3,8 ± 1,9 roku (souhrnně pro oba intervaly, rozptyl 2–8 let). Nejčastějším důvodem pro prodloužení dávkovacího intervalu (76 %) byla přetrvávající séropozitivita JCV, a tedy vyšší riziko rozvoje PML. Z JCV pozitivních pacientů byli na 6WI nejčastěji převáděni pacienti dlouhodobě léčení (32 %), dále při dovršení 2 let léčby (24 %) a v několika případech i při kratší době terapie natalizumabem (20 %). U JCV negativních pacientů byla jako důvod uváděna dlouhodobá stabilizace na terapii, a tedy nízké riziko reaktivace nemoci (16 %). Nejméně častým důvodem byla obava z PML i při JCV negativitě, a to při terapii natalizumabem déle než 2 roky a zároveň anamnéze předchozí imunosuprese či jiného DMD (8 %).
Ve studované populaci pacientů se aktivita onemocnění hodnocená pomocí průměrného ARR mezi 4WI a 6WI výrazně nelišila (0,073 ± 0,209, resp. 0,074 ± 0,178; p = 1,0000) (tab. 2). Bez ataky bylo 88 % pacientů při 4WI a 84 % pacientů při 6WI. Průměrná nová aktivita na MR, hodnocená dichotomicky v ročních intervalech, se mezi 4WI a 6WI nelišila (0,29 ± 0,40, resp. 0,16 ± 0,33; p = 0,1250). Bez aktivity na MR bylo 56 % pacientů při 4WI a 76 % pacientů při 6WI. Míra funkčního postižení hodnocená jako průměrné EDSS během sledovaného období byla vyšší během léčby v dávkovacím schématu 4WI než 6WI (2,29 ± 0,90, resp. 2,16 ± 0,88; p = 0,0127). Tato diskrepance již nebyla patrna při srovnání průměrného EDSS při 4WI a posledního zaznamenaného EDSS při 6WI (p = 0,0703). Nebyla prokázána korelace ARR, aktivity na MR ani EDSS s věkem, pohlavím, trváním nemoci, celkovou délkou terapie při 4WI ani s předchozím užíváním DMD/ imunosuprese. V rámci sledovaného období byl zaznamenán jeden případ PML u pacienta při 6WI, při 4WI se PML nevyskytla.
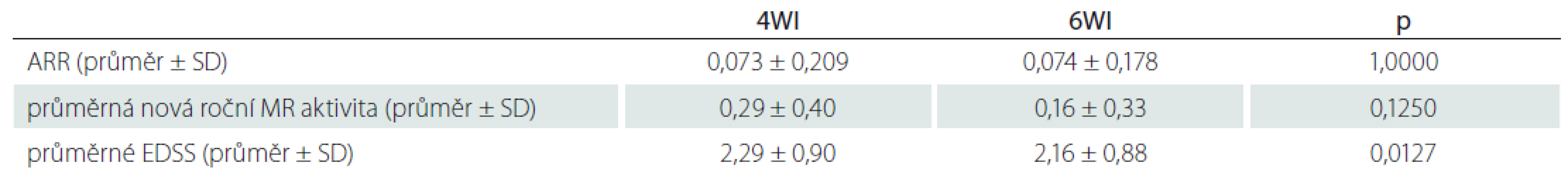
Diskuze
Výsledky naší retrospektivní kohortové studie podporují hypotézu, že účinnost natalizumabu dávkovaného v 6WI není nižší než při dávkování v 4WI (úroveň důkazu 3B dle medicíny založené na důkazech [19]). Východiskem pro všechny podobné studie je poznatek, že saturace receptorů pro natalizumab zůstává 4 týdny po jedné 300mg i.v. infuzi více než 80 % [20]. Takto vysoká saturace však nemusí být nutná pro udržení dostatečné efektivity léčiva. Desaturace receptorů definovaná jako pokles saturace pod 50 % byla prokázána jenom u pacientů se sérovou koncentrací natalizumabu pod 1 µg/ ml [18,21]. Sérová koncentrace po podání infuze postupně klesá, při opakovaném podávání však ani po 6 týdnech neklesne pod 1 µg/ ml. Naopak se ukazuje, že opakované podávání natalizumabu významně prodlužuje poločas vazby na jeho receptor, což umožní detekci natalizumabu (nad 0,01 µg/ ml) v séru některých pacientů až po dobu 200 dnů [22,23]. Recentní farmakokinetická analýza uvádí, že při prodlouženém intervalu (extended interval dosing; EID) (zde 35–49 dnů) je v čase před následující infuzí průměrná sérová koncentrace natalizumabu 18,2 µg/ ml a saturace receptorů 78,2 % vs. 35,7 µg/ ml a 87,4 % na 4WI. Udržení saturace receptorů je na EID kompenzováno mírně vyšší expresí receptorů, a je také ovlivněno tělesnou hmotností [24].
Natalizumab prostřednictvím redukce subpopulací lymfocytů v mozkomíšním moku a jejich schopnosti migrovat přes HEB snižuje míru imunitního dohledu v CNS. Efekt na imunitní systém však není kompletní ani ireverzibilní, určitá míra imunitního dohledu je tak zachována. V rámci bezpečnosti je patrně nezbytné, aby byla umožněna obnova funkce α4-integrinů mezi jednotlivými infuzemi natalizumabu, jinak jsou pacienti ve vyšším riziku oportunních infekcí [23,25]. Jako efektivní se v tomto směru jeví prodloužení dávkovacího intervalu, což podporují i data z amerického registru TOUCH, ve kterém byla srovnávána četnost výskytu PML na různých dávkovacích schématech. V tomto souboru o 16 571 až 25 801 pacientech (dle definice EID) bylo na EID prokázáno o 80–90 % nižší riziko PML než na intervalu standardním [26].
V našem souboru jsme neprokázali statisticky významný rozdíl v ARR ani v aktivitě na MR mezi dávkovacími intervaly 4WI a 6WI. Při srovnání průměrného EDSS v obou skupinách jsme prokázali statisticky významný rozdíl ve prospěch 6WI (2,29 vs. 2,16). Vzhledem k charakteru skórovací škály EDSS (rozsah 0–10 bodů, výsledek je celé číslo nebo půlbod) s významnou inter-rater variabilitou, je rozdíl v setinách bodu (i když statisticky významný) klinicky zanedbatelný. Při srovnání průměrného EDSS na 4WI a posledního zaznamenaného EDSS na 6WI již rozdíl mezi intervaly patrný nebyl. Během sledovacího období se celkem vyskytl jenom jeden případ PML, proto nebylo možné provést statistickou analýzu bezpečnostních dat. Jednalo se o pacienta již na 6WI, s velmi vysokým rizikem rozvoje PML – na terapii natalizumabem déle než 2 roky, s anamnézou předchozí imunosupresivní terapie a zejména s vysokým JCV indexem (3,91).
Naše výsledky jsou v souladu s dříve publikovanými studiemi o efektivitě EID u natalizumabu. Bomprezzi et al hodnotili efektivitu EID (6–8 týdnů) na souboru 361 pacientů na 4WI, z kterých 96 přešlo po 12–24 měsících na EID. Jejich výsledky byly podobné výsledkům americké multicentrické studie, která srovnávala soubor 1 080 pacientů na 4WI se souborem 894 pacientů převedených po minimálně 6 měsících na různě dlouhé dávkovací intervaly (4,5–8,5 týdnů). Ani jedna z těchto studií neprokázala vyšší ARR či MR aktivitu na EID [15,18]. Nevýhodou obou studií však bylo srovnávání dvou různých skupin pacientů, což umožnilo selekční bias; na EID byli velmi pravděpodobně převedeni pacienti s nižší aktivitou nemoci. Tomuto se podobně jako v naší studii snažili zamezit Yamout et al, kteří sledovali stejný soubor 85 pacientů před převedením na EID a po něm. Ani tato studie neprokázala horší výsledky EID ve smyslu ARR, MR aktivity či EDSS [16]. Očekávají se výsledky evropské multicentrické randomizované studie, která poskytne důležité informace o bezpečnosti a efektivitě užívání EID (osobní sdělení, Kubala Havrdová v roce 2019 [27]).
Limitacemi naší studie jsou její retrospektivní charakter a relativně malý soubor pacientů. Vzhledem k malému souboru pacientů nebylo možné hodnocení rizika rozvoje PML.
Prodloužení dávkovacího intervalu při léčbě natalizumabem se do budoucna zdá být realistickým scénářem vybudovaným na solidních farmakokinetických datech. Naše retrospektivní kohortová studie (úroveň důkazu 3B) je další z řady prací, které poukazují na zachování jeho efektivity při nižší frekvenci aplikace. Výsledky několika studií svědčí pro snížení rizika PML, které představuje největší bariéru ve využití tohoto jinak velmi efektivního léku. Z pohledu pacienta by prodloužení intervalu mezi jednotlivými dávkami snížilo nutný počet návštěv v RS centru, a tím zvýšilo komfort léčby. Nelze pominout ani význam snížení počtu infuzí této velmi nákladné léčby z hlediska ekonomického. Před oficiálním zavedením nového dávkovacího schématu do klinické praxe je zapotřebí velká kontrolovaná randomizovaná studie, která by potvrdila nejenom efektivitu a bezpečnost, ale stanovila i přesnou délku či rozmezí dávkovacího intervalu, jasný profil vhodných pacientů a také podmínky, za kterých je toto dávkovací schéma možné uplatnit. K prodlužování dávkovacího intervalu se bude muset přistupovat individuálně a u všech pacientů pravděpodobně až po určité době terapie ve standardním dávkovacím schématu [28]. V lokálních podmínkách ČR bude z hlediska úhrady před zavedením změn v dávkování natalizumabu jistě nutné ošetření této problematiky s plátci (než dojde ke změně v SPC), zde však neočekáváme odpor vzhledem k nižším nákladům v případě nižší frekvence aplikace. Z hlediska etického je zapotřebí pacienta plně seznámit s navrhovaným postupem a jeho souhlas zdokumentovat.
Etické principy
Studie byla provedena ve shodě s Helsinskou deklarací z roku 1975 (a jejími revizemi z let 2004 a 2008). Vzhledem k retrospektivnímu sběru dat a neintervenčnímu přístupu nebylo vyžadováno schválení studie etickou komisí. Rovněž z tohoto důvodu nebyl od pacientů vyžadován informovaný souhlas, o změně terapie v rámci rutinně poskytované lékařské péče a o souhlasu pacienta byl vždy proveden zápis do zdrojové dokumentace.
Grantová podpora
Tato práce byla podpořena Grantovou agenturou Univerzity Karlovy (projekty č. 470119 a č. 546317).
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Přijato k recenzi: 8. 9. 2019
Přijato do tisku: 12. 11. 2019
MUDr. Marko Petržalka
Neurologická klinika
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha
e-mail: markopetrzalka@gmail.com
Zdroje
1. Rice GP, Hartung HP, Calabresi PA. Anti-α4 integrin therapy for multiple sclerosis – mechanisms and rationale. Neurology 2005; 64(8): 1336–1342. doi: 10.1212/ 01.wnl.0000158329.30470.d0.
2. Yousry TA, Major EO, Ryschkewitsch C et al. Evaluation of patients treated with natalizumab for progressive multifocal leukoencephalopathy. N Engl J Med 2006; 354(9): 924–933. doi: 10.1056/ NEJMoa054693.
3. Engelhardt B. α4-integrins: structure, function and secrets. In: Ley K (ed). Adhesion molecules: function and inhibition. Basel: Birkhäuser 2007 : 117–139.
4. Carlos T, Schwartz B, Kovach N et al. Vascular cell adhesion molecule-1 mediates lymphocyte adherence to cytokine-activated cultured human endothelial cells. Blood 1990; 76(5): 965–970.
5. Erle DJ, Briskin MJ, Butcher EC et al. Expression and function of the MAdCAM-1 receptor, integrin alpha 4 beta 7, on human leukocytes. J Immunol 1994; 153(2): 517–528.
6. Bayless KJ, Meininger GA, Scholtz JM et al. Osteopontin is a ligand for the alpha4beta1 integrin. J Cell Sci 1998; 111(9): 1165–1174.
7. Guan JL, Hynes RO. Lymphoid cells recognize an alternatively spliced segment of fibronectin via the integrin receptor alpha 4 beta 1. Cell 1990; 60(1): 53–61. doi: 10.1016/ 0092-8674(90)90715-Q.
8. Polman CH, O‘Connor PW, Havrdova E et al. A randomized, placebo-controlled trial of natalizumab for relapsing multiple sclerosis. N Engl J Med 2006; 354(9): 899–910. doi: 10.1056/ NEJMoa044397.
9. Yednock TA, Cannon C, Fritz LC et al. Prevention of experimental autoimmune encephalomyelitis by antibodies against α4βl integrin. Nature 1992; 356(6364): 63–66. doi: 10.1038/ 356063a0.
10. van Pesch V, Sindic CJ, Fernández O. Effectiveness and safety of natalizumab in real-world clinical practice: review of observational studies. Clin Neurol Neurosurg 2016; 149 : 55–63. doi: 10.1016/ j.clineuro.2016.07.001.
11. Major EO, Yousry TA, Clifford DB. Pathogenesis of progressive multifocal leukoencephalopathy and risks associated with treatments for multiple sclerosis: a decade of lessons learned. Lancet Neurol 2018; 17(5): 467–480. doi: 10.1016/ S1474-4422(18)30040-1.
12. Frohman EM, Monaco MC, Remington G et al. JC Virus in CD34+ and CD19+ cells in patients with multiple sclerosis treated with natalizumab. JAMA Neurol 2014; 71(5): 596–602. doi: 10.1001/ jamaneurol.2014.63.
13. Bellizzi A, Anzivino E, Rodio DM et al. New insights on human polyomavirus JC and pathogenesis of progressive multifocal leukoencephalopathy. Clin Dev Immunol 2013; 2013 : 839719-19. doi: 10.1155/ 2013/ 839719.
14. Bloomgren G, Richman S, Hotermans C et al. Risk of natalizumab-associated progressive multifocal leukoencephalopathy. N Engl J Med 2012; 366(20): 1870–1880. doi: 10.1056/ NEJMoa1107829.
15. Bomprezzi R, Pawate S. Extended interval dosing of natalizumab: a two-center, 7-year experience. Ther Adv Neurol Disord 2014; 7(5): 227–231. doi: 10.1177/ 1756285614540224.
16. Yamout BI, Sahraian MA, Ayoubi NE et al. Efficacy and safety of natalizumab extended interval dosing. Mult Scler Relat Disord 2018; 24 : 113–116. doi: 10.1016/ j.msard.2018.06.015.
17. Puñet-Ortiz J, Hervás-García JV, Teniente-Serra A et al. Monitoring CD49d receptor occupancy: a method to optimize and personalize natalizumab therapy in multiple sclerosis patients. Cytometry B Clin Cytom 2018; 94(2): 327–333. doi: 10.1002/ cyto.b.21527.
18. Zhovtis Ryerson L, Frohman TC, Foley J et al. Extended interval dosing of natalizumab in multiple sclerosis. J Neurol Neurosurg Psychiatry 2016; 87(8): 885–889. doi: 10.1136/ jnnp-2015-312940.
19. Brainin M, Barnes M, Baron JC et al. Guidance for the preparation of neurological management guidelines by EFNS scientific task forces – revised recommendations 2004. Eur J Neurol 2004; 11(9): 577–581. doi: 10.1111/ j.1468-1331.2004.00867.x.
20. Miller DH, Khan OA, Sheremata WA et al. A controlled trial of natalizumab for relapsing multiple sclerosis. N Engl J Med 2003(348): 15–23. doi: 10.1056/ NEJMoa020696.
21. Khatri BO, Man S, Giovannoni G et al. Effect of plasma exchange in accelerating natalizumab clearance and restoring leukocyte function. Neurology 2009; 72(5): 402–409. doi: 10.1212/ 01.wnl.0000341766.59028.9d.
22. Rispens T, Vennegoor A, Wolbink GJ et al. Natalizumab remains detectable in patients with multiple sclerosis long after treatment is stopped. Mult Scler 2011; 18(6): 899–901. doi: 10.1177/ 1352458511431073.
23. Stüve O, Marra CM, Jerome KR et al. Immune surveillance in multiple sclerosis patients treated with natalizumab. Ann Neurol 2006; 59(5): 743–747. doi: 10.1002/ ana.20858.
24. Foley JF, Goelz S, Hoyt T et al. Evaluation of natalizumab pharmacokinetics and pharmacodynamics with standard and extended interval dosing. Mult Scler Relat Disord 2019; 31 : 65–71. doi: 10.1016/ j.msard.2019.03.017.
25. Niino M, Bodner C, Simard ML et al. Natalizumab effects on immune cell responses in multiple sclerosis. Ann Neurol 2006; 59(5): 748–754. doi: 10.1002/ ana.20859.
26. Zhovtis Ryerson L, Foley J, Chang I et al. Reduced risk of progressive multifocal leukoencephalopathy (PML) associated with natalizumab extended interval dosing (EID): updated analysis of the TOUCH Prescribing Program database (S26.006) [abstract]. Neurology 2019; 92 (15 Suppl): S26.006.
27. Kubala Havrdová E. Osobní sdělění: 19. Jedličkovy neuroimunologické a likvorologické dny. Praha 24. 5. 2019.
28. Wipfler P, Harrer A, Pilz G et al. Natalizumab saturation: biomarker for individual treatment holiday after natalizumab withdrawal? Acta Neurol Scand 2014; 129(3): e12–e15. doi: 10.1111/ ane.12182.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2020 Číslo 1
-
Všechny články tohoto čísla
- Randomizovaná kontrolovaná studie efektu terapie poruch rovnováhy s využitím audiovizuální zpětné vazby u seniorů
- Primární non-Hodgkinův B-lymfom centrálního nervového systému
- Analýza dat v neurologii
- Vzpomínka na prof. Pavla Petrovického
- Prof. MUDr. Rudolf Malec, CSc. (1924–2019)
- Recenze monografie
- Kognitivní rehabilitace pacientů s Parkinsonovou nemocí
- Homeostáza mědi jako terapeutický cíl u amyotrofické laterální sklerózy s mutací superoxiddismutázy 1 a sloučenina CuATSM
- Možnosti prevence Alzheimerovy choroby
- Editorial
- Dominantní (Kjerova) atrofie optiku asociovaná s mutacemi v OPA1 genu
- Metodologie měření kognitivního deficitu u depresivní poruchy
- Novorozenecké záchvaty – současný pohled na problematiku
- Polysomnografické nálezy u osob nad 50 let bez subjektivních příznaků poruch spánku
- Poděkování recenzentům
- Neuropsychiatrické symptomy jako časná manifestace Alzheimerovy nemoci
- Choroidální tloušťka u asymptomatických pacientů se stenózou karotidy
- Efektivita prodlouženého dávkovacího intervalu natalizumabu u pacientů s roztroušenou sklerózou
- Role zánětu v etiopatogenezi farmakorezistentní epilepsie a refrakterního status epilepticus
- Charakteristika aterosklerotického plátu a riziko mozkové ischemie při stentování vnitřní karotidy
- Komorbidity Alzheimerovej choroby – výsledky multicentrickej prierezovej observačnej štúdie COSMOS v Slovenskej republike
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Novorozenecké záchvaty – současný pohled na problematiku
- Možnosti prevence Alzheimerovy choroby
- Primární non-Hodgkinův B-lymfom centrálního nervového systému
- Neuropsychiatrické symptomy jako časná manifestace Alzheimerovy nemoci
