Dekompresivní kraniektomie u maligního hemisferálního infarktu – monoinstitucionální retrospektivní analýza souboru 33 pacientů
Decompressive craniectomy in malignant middle cerebral artery infarction – monoinstitutional retrospective analysis of a set of 33 patients
Aim: Decompressive craniectomy is a method of choice in the treatment of malignant middle cerebral artery infarction. Based on the conclusions of the three European prospective trials DECIMAL, DESTINY and HAMLET and their pooled analysis, we performed a retrospective analysis for years 2014–2018 at our department to assess the clinical outcome of patients who underwent decompressive craniectomy for malignant middle cerebral artery infarction. Patients and methods: The set consisted of 33 patients.
Results: 22 operated patients died as a result of the disease, three patients were grade 4 and four patients grade 3 on the modified Rankin Scale. Four patients had to be excluded from the cohort. We monitored parameters such as the patient’s age at time of stroke, the time that had elapsed since the clinical manifestation and since determination of diagnosis according to CT to the start of surgery and midline shift on CT. We performed a statistical analysis of the baseline data, but these were not entirely beneficial for a probably small group of patients.
Conclusion: In general, in line with the findings of European studies, the patient’s age at stroke onset (below 60 years) and the time elapsed from the clinical manifestation and from graphic signs of ischemia to the start of decompressive craniectomy (less than 48 h) are essential positive prognostic factors.
Keywords:
indications – decompressive craniectomy – malignant middle cerebral artery infarction – retrospective analysis
Autoři:
K. Pištěk; M. Sameš
Působiště autorů:
Neurochirurgická klinika FZS UJEP, a Krajské zdravotní a. s. – Masarykovy, nemocnice v Ústí nad Labem, o. z.
Vyšlo v časopise:
Cesk Slov Neurol N 2020; 83/116(5): 559-562
Kategorie:
Krátké sdělení
doi:
https://doi.org/10.14735/amcsnn2020559
Souhrn
Cíl: Dekompresivní kraniektomie je metodou volby v terapii maligního hemisferálního infarktu. Na základě závěrů tří evropských prospektivních studií DECIMAL, DESTINY a HAMLET a jejich společné analýzy jsme na našem pracovišti zpracovali retrospektivní analýzu za roky 2014–2018 zabývající se výsledným klinickým stavem pacientů, jimž byla provedena dekompresivní kraniektomie pro maligní hemisferální infarkt.
Soubor a metody: Jednalo se o soubor 33 pacientů. Výsledky: 22 operovaných pacientů na následky onemocnění zemřelo, tři pacienti dosáhli v modifikované Rankinově škále stupeň 4 a čtyři pacienti stupeň 3. Čtyři pacienti museli být ze souboru vyřazeni. Sledovali jsme parametry jako věk pacienta v době příhody, čas uplynulý klinické manifestace a od stanovení diagnózy podle CT do začátku operace a přesun středočárových struktur na CT. Provedli jsme statistickou analýzu základních údajů, avšak ty nebyly zcela výtěžné pro pravděpodobně malý soubor pacientů.
Závěr: Obecně můžeme ve shodě se závěry evropských studií konstatovat, že věk pacienta v době iktu (pod 60 let) a čas uplynulý od klinické manifestace a grafických známek ischemie do začátku dekompresivní kraniektomie (pod 48 h) jsou zásadní pozitivní prognostické faktory.
Klíčová slova:
dekompresivní kraniektomie – maligní hemisferální infarkt – retrospektivní analýza – indikace
Úvod
Termínem maligní hemisferální infarkt je označován infarkt mozkové tkáně v povodí arteria cerebri media (middle cerebral artery; MCA). Jedná se o podskupinu ischemické CMP (iCMP). Tento masivní hemisferální mozkový infarkt tvoří 1–10 % všech supratentoriálních mozkových infarktů a je charakterizovaný rozvojem expanzivně se chovajícího mozkového edému, který ve svém důsledku způsobuje mozkovou herniaci [1–3]. Tím se snižuje šance pacienta na jeho uspokojivý výsledný klinický stav. Rozvoj život ohrožujícího mozkového edému většinou nastupuje mezi 2. a 5. dnem po vzniku iktu [1,2]. Dle rozsáhlé prospektivní studie je mortalita tohoto onemocnění až 80 % [3,4].
Konzervativní terapie zahrnující sedaci, hyperventilaci, podávání kortikoidů, barbiturátů a osmotickou terapii glycerolem, mannitolem či hydroxyetylem, se v současnosti nejeví jako efektivní v boji s tímto akutním stavem. Některé články dokonce vyhodnocují tuto konzervativní terapii jako pacienta poškozující [5–8]. Je tedy na místě zabývat se v takových případech otázkou neurochirurgické intervence ve smyslu dekompresivní kraniektomie (DK) jakožto metodou první volby v terapii tohoto akutního stavu. Indikace DK u maligního hemisferálního infarktu vychází v současnosti tří evropských prospektivních randomizovaných studií, kterými jsou DECIMAL [9], DESTINY [10] a HAMLET [11], a z jejich společné analýzy.
Na základě těchto studií a s vědomím jejich závěrů jsme se na našem pracovišti rozhodli provést retrospektivní analýzu za roky 2014–2018 u operovaných pacientů, kteří podstoupili DK právě pro maligní hemisferální infarkt. Naším cílem bylo analyzovat náš indikační postup, zhodnotit výsledný klinický stav u těchto pacientů a výsledky porovnat se závěry randomizovaných studií.
Soubor a metodika
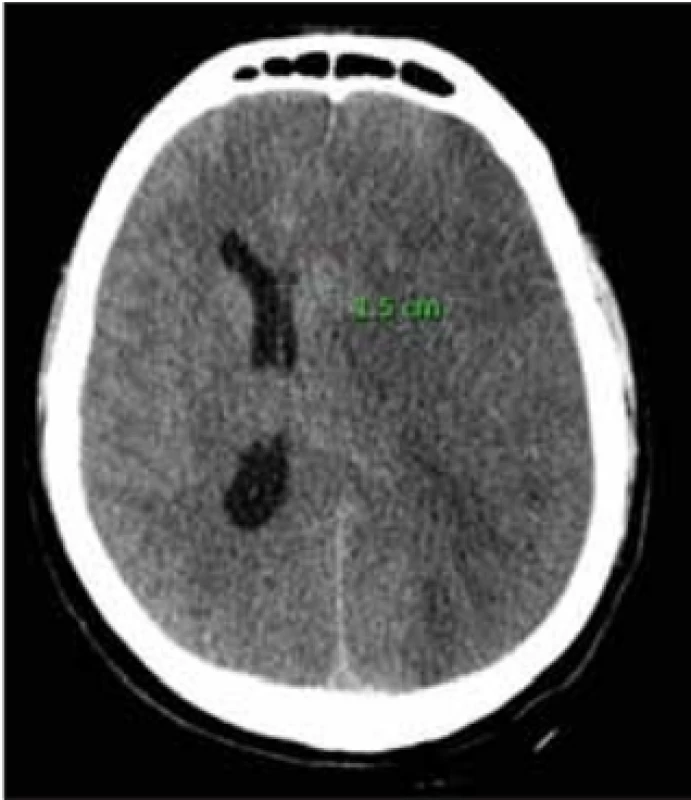
Na našem pracovišti jsme provedli retrospektivní analýzu pacientů, kterým byla provedena DK pro maligní hemisferální infarkt v povodí MCA za roky 2014–2018. Jedná se celkem o 33 pacientů, u kterých jsme ze zdravotnické dokumentace zaznamenali stranu postižené hemisféry, přesun středočárových struktur na CT mozku (obr. 1), věk pacienta v době příhody a čas uplynulý od stanovení diagnózy podle CT do začátku operace. Tato kritéria jsme zvolili na základě výsledků studií DECIMAL, DESTINY a HAMLET.
Fig. 1. CT scan of the brain with the fi nding of the expansive process of the left
hemisphere caused by a malignant middle cerebral artery infarction; midline shift
15 mm.
Data z případné monitorace intrakraniálního tlaku (intracranial pressure; ICP) jsme nedohledávali, neboť monitorace ICP není u pacientů s diagnózou maligního hemisferálního infarktu využívána a navíc jisté práce hovoří o tom, že maligní hemisferální infarkt, byť expanzivně se chovající, není doprovázen rozvojem nitrolební hypertenze [12].
Ty pacienty, u kterých jsme v dokumentaci neměli záznam o úmrtí, jsme telefonicky kontaktovali a dotazovali jsme se přímo pacientů, případně jejich rodinných příslušníků, na soběstačnost pacientů a jejich subjektivní pocit kvality života. Každého dotázaného jsme následně zařadili do jedné z 5 (resp. 6) skupin modifikované Rankinovy škály (mRS). Zpětně jsme také zjišťovali, kde probíhala dlouhodobá ošetřovatelská péče po operaci, zda ve zdravotnických zařízeních či v domácí ošetřovatelské péči.
Pro určení statisticky významných rozdílů jsme používali t-test pro nezávislé soubory. Pro zjištění případných závislostí jsme u kategoriálních veličin používali chí kvadrát test nezávislosti a u metrických veličin součinovou korelaci. Ve všech případech byla nulová hypotéza zamítána s 5% pravděpodobností chyby, tedy v případě, kdy by nám hodnota p klesla pod 0,05.
Výsledky
Na základě dat, která jsme získali ze zdravotnické dokumentace, a informací získaných z telefonických rozhovorů s pacienty jsme dospěli k následujícím epidemiologickým faktorům:
- Do souboru bylo zařazeno celkem 33 pacientů, přičemž poměr mužů a žen souboru 19 : 14. Zkoumaný soubor operovaných pacientů kteří ve věkovém rozmezí 26–81 let, medián 61 let (průměr 61,9 let).
- Poměr postižených stran pravé ku levé hemisféře byl 17 : 16.
- Průměrný čas uplynulý od poslední provedené CT mozku, jež vedla k indikaci DK, k začátku samotné operace byl 6 h 18 min.
- Průměrný přesun středočárových struktur na nativní CT mozku vedoucí k indikaci chirurgické intervence byl 10,4 mm (rozmezí 0,5–16 mm).
- Z hlediska dlouhodobého sledování 22 operovaných pacientů na následky onemocnění zemřelo, 3 pacienti dosáhlimRS = 4 (57, 61, 67 let), 4 pacienti mRS == 3 (30, 49, 49, 59 let) a u 4 pacientů nebylo možné dohledat jejich aktuální stav.
- U 11 pacientů, kteří nebyli po smrti, jsme zjistili, že všichni byli z nemocnic propuštěni do rehabilitačních ústavů, na oddělení dlouhodobé intenzivní ošetřovatelské péče či do léčebny dlouhodobě nemocných.
- U 100 % přeživších pacientů, u kterých jsme byli schopni zjistit jejich stávající klinický stav, jsme zaznamenali pozitivní reakci pacientů samotných i rodinných příslušníků v tom smyslu, že by zpětně znovu zvolili terapii cestou DK.
- Průměrný věk těch pacientů, kteří zemřeli časně po operaci, nebo zemřeli do několika měsíců od operace, byl v době operace 66 let (věkové rozmezí 51–81 let). Průměrný věk pacientů v době operace s hodnotou mRS 3 49 let (věkové rozmezí 30–61 let).
- Průměrný čas uplynulý od poslední provedené CT mozku, jež vedla k indikaci DK, do začátku samotné operace u pacientů, kteří zemřeli časně po operaci nebo zemřeli do několika měsíců od operace, byl 6 h 25 min. Tento čas byl u přeživších pacientů s hodnotou mRS 3 a mRS 4 v průměru 6 h 8 min.
- Průměrný přesun středočárových struktur na nativní CT mozku vedoucí k indikaci chirurgické intervence u pacientů, kteří zemřeli časně po operaci nebo zemřeli do několika měsíců od operace, byl 10,3 mm. Průměrný přesun středočárových struktur na nativní CT mozku u pacientů v době operace s výslednou hodnotou mRS 3 a mRS 4 byl 10,4 mm.
Pomocí chí kvadrátu bylo prokázáno, že proměnné, jako postižená strana a pohlaví, s případnou smrtí nesouvisí. Dále jsme se pokoušeli zjistit případné rozdíly u proměnných, jako čas uplynulý od CT mozku zahájení operace, věk a přesun středočárových struktur u pacientů, u kterých nastala smrt, a pacientů, u kterých smrt nenastala. Výsledky poukázaly na to, že mezi těmito pacienty nebyly u námi sledovaných proměnných statisticky významné rozdíly. Faktor úmrtí zde tedy nehraje významnou roli. Sledovali jsme také vztah mezi proměnnými (čas uplynulý od CT mozku do zahájení operace, věk a přesun středočárových struktur) u přeživších pacientů ve vztahu k výsledné hodnotě mRS, ovšem ani zde nebyly zjištěny významné rozdíly.
Diskuze
I přes jisté limitace v interpretaci výsledků naší retrospektivní analýzy v kontextu randomizovaných studií lze diskutovat následující důležitá fakta:
Horní věková hranice v randomizovaných studiích DECIMAL, DESTINY a HAMLET, jakožto jedno z inkluzivních kritérií, byla 55–60 let [10–12]. V porovnání s tímto lze tak konstatovat, že průměrný věk pacientů v naší retrospektivní analýze, kteří zemřeli časně po operaci nebo zemřeli do několika měsíců od operace, dalece přesahuje tuto arbitrárně stanovenou hranici. V souladu s výsledky studií také míra soběstačnosti našich pacientů je nepřímo úměrná věku, v jakém byli operováni. Na základě těchto dat se můžeme jistě přiklonit k závěru, že zásadním prognostickým kritériem je věk pacienta v době iktu. Právě věk pacienta s maligním hemisferálním infarktem by měl sloužit jako hlavní kritérium, nikoli však jediné, k indikaci k DK. Je však nutné vzít v úvahu i výsledky studie DESTINY II, která zjišťovala efekt DK u pacientů starších 60 let. Studie prokázala, že DK je život zachraňující výkon i u nemocných starších 60 let, zvyšuje se však podíl pacientů invalidních, závislých na pomoci ostatních. Indikaci k DK u pacientů nad 60 let je tedy nutné zvažovat individuálně. U těchto pacientů je nutné brát v potaz jejich zdravotní stav před příhodou a závažnost a pokročilost případných komorbidit [13].
Čas od provedení CT mozku vedoucí k indikaci provedení DK k zahájení samotné operace v žádném z našich případů nepřesáhl 48 h, rozdíly v časových rozmezích však byly poměrně výrazné. Po podrobné analýze však v našem vzorku pacientů nenacházíme jasnou signifikantní kauzalitu mezi tímto časovým intervalem a mortalitou či mírou morbidity. Společná analýza v „pooled“ studii, kde byla sloučena data ze studií DECIMAL, DESTINY a HAMLET, však hovoří o snížení mortality a zvýšení podílu přeživších v příznivém výsledném klinickém stavu (mRS 0–4) při provedení DK během 48 h od začátku příznaků maligního hemisferálního infarktu. I zde je však druhou nezbytnou podmínkou věk v době operace, a to maximálně 60 let [14]. Tato kritéria jsou uvedena také v národním doporučení pro diagnostiku a léčbu pacientů s iCMP a s tranzitorní ischemickou atakou [15]. Momentem, od kterého jsme zjišťovali časový interval do začátku operace, je pouze CT mozku s grafickými známkami maligního hemisferálního infarktu (obr. 1), a nikoli kombinace grafického a klinického nálezu tak, jako tomu bylo u randomizovaných studií. Vzhledem k této skutečnosti tak nemohou být naše data ohledně časového intervalu plně kompatibilní s daty studií.
Provedli jsme statistickou analýzu základních údajů, avšak ty nebyly zcela výtěžné pro pravděpodobně malý soubor pacientů.
I přes zdánlivě neuspokojivé výsledky naší retrospektivní analýzy může mít tato praktický přínos. Výstupem může být úprava diagnostického protokolu tak, aby se stal efektivnějším a rychlejším a aby se maximálně eliminovalo provedení DK v případech, kdy již postrádá smysl. DK hraje v terapii maligního hemisferálního infarktu superiorní roli, což dokazují primárně světové randomizované studie, dále to potvrzují závěry předních odborníků [16] a také zkušenosti, výsledky a výsledný klinický stav pacientů na našem pracovišti. Už dávno totiž neplatí tvrzení, že DK se standardně provádí pouze u vybraných případů, jako jsou ikty v nedominantní hemisféře a ikty u dětí a mladých nemocných, jako to dříve uváděla odborná literatura [17].
V grafickém nálezu, kde při podezření na iktus v povodí MCA po nativním vyšetření CT mozku t.č. nejsou vyjádřeny jasné známky expanzivního chování, je vhodné následně zhotovit difuzí vážený obraz na MR (MR diffusion-weightedimaging; MR-DWI) ke zhodnocení rozsahu čerstvé ischemie. Studie DECIMAL hovoří o třech kategoriích. V první kategorii jsou pacienti s objemem ischemického ložiska > 210 cm3, u kterých je přežití bez DK 0 %. Druhá kategorie zahrnuje pacienty s objemem ischemického ložiska v rozmezí 145–210 cm3, u kterých je při neprovedení DK stále vysoké riziko úmrtí v důsledku mozkové herniace. V třetí kategorii byli pacienti s objemem ischemického ložiska < 145 cm3, kteří nebyli do studie randomizováni, ale přežili. Z toho vyplynul závěr, že objem ischemického ložiska 145 cm3 je hranicí, při jejímž dosažení či překročení je provedení DK nanejvýš indikované [10].
Je tedy na místě standardizace objektivního klinického a grafického nálezu u pacientů s maligním hemisferálním infarktem napříč zainteresovanými odbornostmi daných iktových center, resp. komplexních cerebrovaskulárních center, tak, aby byl postup na všech pracovištích pružnější. K tomu lze přispět i jasným stanovením kritérií v obrazu klinickém (hodnoceném dle National Institutes of Health StrokeScale či Glasgow Coma Scale) a grafickém. Za úvahu stojí zavedení MR-DWI jako rutinního vyšetření u pacientů, kteří splňují klinická kritéria, ale u kterých v době indikační rozvahy nejsou vyjádřeny jasné známky expanzivního chování na CT mozku.
Jelikož čas hraje spolu s věkem pacienta kruciální roli v jeho výsledném klinickém stavu, je nutné konstatovat, že po splnění klinických a grafických kritérií by měl být operační výkon proveden v co nejkratší možné době od jeho indikace s využitím akutního sálu. Za neadekvátní lze považovat postup, kdy se u pacientů s maligním hemisferálním infarktem implantuje čidlo monitorující ICP a zahájí se antiedemová terapie, případně se opakovaně provádějí kontrolní CT mozku, kde se hlídá případný rozvoj expanzivního chování.
Vzhledem k tomu, že je v dnešní době součástí terapie iCMP stále častěji i mechanická trombektomie, je vhodné na tomto místě zmínit závěry studie, jež hovoří o tom, že provedení DK u pacienta po mechanické trombektomii sice nezlepšuje jeho výsledný klinický stav, ale ani jej nijak nezhoršuje. Mechanická trombektomie tedy není kontraindikací k provedení DK [18].
Závěr
Závěry tohoto krátkého sdělení můžeme shrnout do následujících bodů:
- Zásadním prognostickým kritériem pro indikaci k provedení DK je věk, jehož horní hranice se v randomizovaných studiích pohybuje mezi 55–60 lety pacienta.
- DK je nutno provést do 48 h od stanovení diagnózy maligního hemisferálního infarktu.
- Při objemu ischemického ložiska > 145 cm3 na MR-DWI a splnění klinických podmínek je provedení DK nanejvýš indikované.
- Při splnění klinických a grafických kritérií je výkon považován za akutní a v případě pracovního dne by pro takovouto situaci měl být využit akutní sál.
- Indikaci k DK u pacientů nad 65 let je nutné zvažovat individuálně. Je nutné brát v potaz zdravotní stav pacientů před příhodou a závažnost a pokročilost případných komorbidit.
- Zásadní je také co nejpřesněji predikovat stupeň případného postižení pacienta a seznámit s touto informací nejbližší příbuzné pacienta (a také samotného pacienta) tak, aby jejich názor na další terapeutický postup byl zahrnut jako jeden z relevantních bodů v rozhodovacím schématu k indikaci provedení DK.
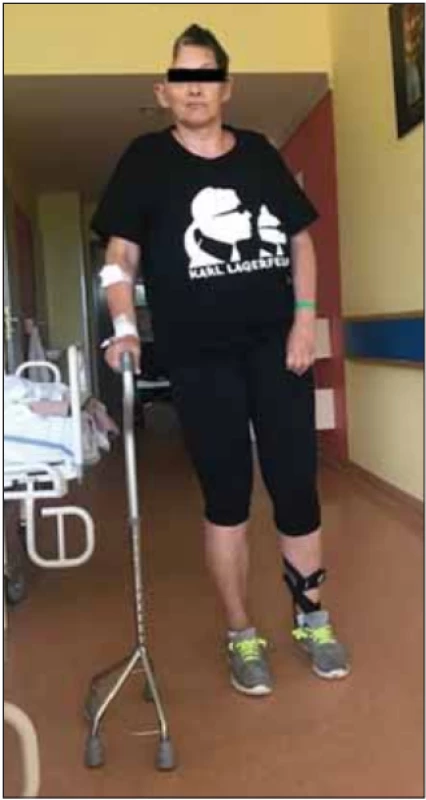
- Cílem časného provedení DK u pacientů s maligním hemisferálním infarktem je jejich uspokojivý výsledný klinický stav, kdy je pacient schopen chůze s oporou čtyřbodové berle (mRS 3) (obr. 2) či chůze s dopomocí druhé osoby (mRS 4).
Fig. 2. Patient after decompressive craniec tomy on the right side for malignant middle cerebral artery infarction. Modifi ed Rankin Scale 3 – the patient is able to walk with the support of a four-legged pyramid cane.
Etické aspekty
Tato retrospektivní analýza probíhala v souladu s etickými standardy. Vzhledem k retrospektivnímu charakteru studie nebylo vyžadováno schválení etickou komisí.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
MUDr. Karel Pištěk
Neurochirurgická klinika
Masarykova nemocnice
Sociální péče 3316/12A
400 11 Ústí nad Labem
e-mail: karel.pistek@kzcr.eu
Přijato k recenzi: 30. 3. 2020
Přijato do tisku: 13. 8. 2020
Zdroje
1. Moulin DE, Lo R, Chiang J et al. Prognosis in middle cerebral artery occlusion. Stroke 1985; 16 (2): 282–284. doi: 10.1161/01.str.16.2.282.
2. Frank JI. Large hemispheric infarction, deterioration, and intracranial pressure. Neurology 1995; 45 (7): 1286–1290. doi: 10.1212/wnl.45.7.1286.
3. Hacke W, Schwab S, Horn M, et al. Malignant middle cerebral artery territory infarction: clinical course and prognostic signs. Arch Neurol 1996; 53 (4): 309–315. doi: 10.1001/archneur.1996.00550040037012.
4. Berrouschot J, Sterker M, Bettin S et al. Mortality of space-occupying („malignant“) middle cerebral artery infarction under conservative intensive care. Intensive Care Med 1998; 24 (6): 620–623. doi: 10.1007/s001340050625.
5. Hofmeijer J, van der Worp HB, Kappelle LJ. Treatment of space-occupying cerebral infarction. Crit Care Med 2003; 31 (2): 617–625. doi: 10.1097/01.CCM.0000050446.16158.80.
6. Schwarz S, Schwab S, Bertram M et al. Effects of hypertonic saline hydroxyethyl starch solution and mannitol in patients with increased intracranial pressure after stroke. Stroke 1998; 29 (8): 1550–1555. doi: 10.1161/01.str.29.8.1550.
7. Schwarz S, Georgiadis D, Aschoff A et al. Effects of body position on intracranial pressure and cerebral perfusion in patients with large hemispheric stroke. Stroke 2002; 33 (2): 497–501. doi: 10.1161/hs0202.102376.
8. Schwab S, Spranger M, Schwarz S et al. Barbiturate coma in severe hemispheric stroke: useful or obsolete? Neurology 1997; 48 (6): 1608–1613. doi: 10.1212/wnl.48.6.1608.
9. Vahedi K, Vicaut E, Mateo J et al. Sequential-design, multicenter, randomized, controlled trial of early decompressive craniectomy in malignant middle cerebral artery infarction (DECIMAL Trial). Stroke 2007; 38 (9): 2506–2517. doi: 10.1161/STROKEAHA.107.485235.
10. Jüttler E, Schwab S, Schmiedek P et al. Decompressive surgery for the treatment of malignant infarction of the middle cerebral artery (DESTINY): a randomized, controlled trial. Stroke 2007; 38 (9): 2518–2525. doi: 10.1161/STROKEAHA.107.485649.
11. Hofmeijer J, Kappelle LJ, Algra A et al. Surgical decompression for space-occupying cerebral infarction (the Hemicraniectomy After Middle Cerebral Artery infarction with Lifethreatening Edema Trial [HAMLET]): a multicentre, open, randomized trial. Lancet Neurol 2009; 8 (4): 326–333. doi: 10.1016/S1474-4422 (09) 70047-X.
12. Poca MA, Benejam B, Sahuquillo J et al. Monitorin intracranial pressure in patients with malignant middle cerebral artery infarction: is it useful? J Neurosurg 2010; 112 (3): 648–657. doi: 10.3171/2009.7.JNS081677.
13. Jüttler E, Unterberg A, Woitzik J et al. Hemicraniectomy in older patients with extensive middle-cerebral-artery stroke. N Engl J Med 2014; 370 (12): 1091–1100. doi: 10.1056/NEJMoa1311367.
14. Vahedi K, Hofmeijer J, Jüttler E et al. Early decompressive surgery in malignant infarction of the middle cerebral artery: a pooled analysis of three randomized controlled trials. Lancet Neurol 2007; 6 (3): 215–222. doi: 10.1016/S1474-4422 (07) 70036-4.
15. Škoda O, Herzig R, Mikulík R et al. Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016. Cesk Slov Neurol N 2016; 79/112 (3): 351–363. doi: 10.14735/amcsnn2016351.
16. Mraček J. Indications for decompressive craniectomy. Cesk Slov Neurol N 2016; 79/112 (1): 7–21. doi: 10.14735/amcsnn20167.
17. Náhlovský J et al. Neurochirurgie. Praha: Galén 2006; 229
18. Göttsche J, Flottmann F, Jank L et al. Decompressive craniectomy in malignant MCA infarction in times of mechanical thrombectomy. Acta Neurochirurgica 2020; 162 (12): 3147–3152. doi: 10.1007/s00701-019-04180-0.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2020 Číslo 5
-
Všechny články tohoto čísla
- Difuzní nízkostupňové gliomy
- Dechová rehabilitace u pacientů s amyotrofickou laterální sklerózou
- Socioekonomické dopady bolestí hlavy – příčiny a možnosti ovlivnění
- Neurorehabilitácia u pacientov s amyotrofickou laterálnou sklerózou
- Chirurgická liečba degeneratívnej skoliózy
- Funkční a strukturální změny na kortikální úrovni u pacientů s nespecifickými bolestmi zad v bederním úseku páteře
- Kognitivně-motorická interference po cévní mozkové příhodě
- Sonografické hodnocení nervus ischiadicus u jedinců s radikulární symptomatikou S1
- Taste strips – metoda samovyšetření chuti
- Test Amnesia Light and Brief Assessment (ALBA) – druhá verze a opakovaná vyšetření
- Účinnost mikrovaskulární dekomprese v porovnání s mikrovaskulární dekompresí s parciální senzorickou rhizotomií při klasické neuralgii trojklanného nervu – retrospektivní analýza 58 pacientů
- Pacient s Parkinsonovou nemocí v datových zdrojích Národního zdravotnického informačního systému
- Léčba intravenózní trombolýzou mimo iktové centrum
- Dekompresivní kraniektomie u maligního hemisferálního infarktu – monoinstitucionální retrospektivní analýza souboru 33 pacientů
- Dvoudobý nízkoprůtokový a vysokoprůtokový EC-IC bypass v prevenci ischemie při obětování vnitřní karotidy u intrakavernózního aneuryzmatu
- Stentování durálních splavů u idiopatické intrakraniální hypertenze
- Syndrom reverzibilní encefalopatie v zadní cirkulaci ve spojitosti s meningitidou vyvolanou Neisseria elongata
- Hyperbarická oxygenoterapie & mozek; přehled z výroční konference EUBS 2019
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Difuzní nízkostupňové gliomy
- Dechová rehabilitace u pacientů s amyotrofickou laterální sklerózou
- Test Amnesia Light and Brief Assessment (ALBA) – druhá verze a opakovaná vyšetření
- Neurorehabilitácia u pacientov s amyotrofickou laterálnou sklerózou
