Klonální hematopoéza neurčitého potenciálu při ischemické cévní mozkové příhodě – studijní protokol
Clonal hematopoiesis of indeterminate potential in ischemic stroke – study protocol
Aim: The exact relationship between the gene mutation of hematopoietic cells (clonal hematopoiesis of indeterminate potential; CHIP) and the clinical manifestation has not yet been clearly described. The aim of this academic multicentric clinical study is to investigate the association between the presence of CHIP in peripheral blood and the incidence of ischemic stroke, and at the same time, to demonstrate whether CHIP contributes to the etiopathogenesis of atherosclerosis. This could lead to the identification of a new potential risk factor in the diagnosis of ischemic stroke predisposition. Methodology: This is a multicenter prospective study involving 14 primary and comprehensive stroke centers in the Czech Republic. The total number of enrolled patients aged ≥ 70 years is expected to be 1,000. The selected surgical centers will collaborate to provide 50 atherosclerotic plaque samples. Monitored parameters include personal and pharmacological history, laboratory parameters, neurological parameters, and results of selected imaging examinations. The expected outcome will be the definition of specific allelic variants and their frequencies as risk factors for the development of atherosclerosis and subsequent manifestation of ischemic stroke.
Keywords:
stroke – Mutation – Hematopoiesis – Atherosclerosis – ischemia – cell clones
Autoři:
M. Haršány 1,2; V. Kunešová 1; B. Kalousová 3; R. Slavkovský 3; J. Drábek 3,4; J. Stránská- 3 5; M. Hajdúch 3
; R. Mikulík 1,2
Působiště autorů:
Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně
1; I. neurologická klinika LF MU a FN u sv. Anny v Brně
2; Ústav molekulární a translační medicíny, LF UP, Olomouc
3; Laboratoř experimentální medicíny, FN Olomouc
4; Neurologická klinika FN Olomouc
5
Vyšlo v časopise:
Cesk Slov Neurol N 2022; 85(6): 496-500
Kategorie:
Původní práce
doi:
https://doi.org/10.48095/cccsnn2022496
Souhrn
Cíl: Přesný vztah mezi genovou mutací hematopoetických buněk (clonal hematopoiesis of indeterminate potential; CHIP) a klinickým projevem nebyl doposud jasně popsán. Cílem této akademické multicentrické klinické studie je prozkoumat souvislost mezi přítomností CHIP v periferní krvi a incidencí ischemické CMP (iCMP) a současně tak prokázat, zda CHIP ovlivňuje etiopatogenezi aterosklerózy, což by mohlo vést k určení nového možného rizikového faktoru v diagnostice predispozice k iCMP. Metodika: Jedná se o multicentrickou prospektivní studii, do které je zapojeno 14 iktových a komplexních cerebrovaskulárních center v ČR. Předpokládaný celkový počet je 1 000 zařazených pacientů ve věku 70 a více let a 50 odebraných vzorků aterosklerotických plátů, na jejichž zajištění budou spolupracovat vybraná chirurgická pracoviště. Sledované parametry zahrnují osobní a farmakologickou anamnézu, laboratorní parametry, neurologické parametry a výsledky vybraných zobrazovacích vyšetření. Předpokládaným výstupem bude definování role konkrétních alelických variant a jejich zastoupení jako rizikového faktoru pro rozvoj aterosklerózy a následné manifestace iCMP.
Klíčová slova:
ateroskleróza – mutace – cévní mozková příhoda – ischemie – buněčné klony – hematopoéza
Úvod
Při klonální hematopoéze se vytvářejí populace hematopoetických buněk s jednou nebo více somatickými genetickými variantami, které mohou nést patologickou morfologií a/nebo funkcionalitu a přitom expandovat pod vlivem mnoha faktorů. Klonální hematopoéza neurčitého potenciálu (clonal hematopoiesis of indeterminate potential; CHIP) popisuje somatické varianty v řídících genech spojených s manifestací různých patologických projevů, jako jsou hematologická malignita, choroby kardiovaskulárního systému, endoteliální dysfunkce a další [1].
Z dostupných informací je zřejmé, že CHIP vede k tvorbě buněk defektních zejména ve své funkci. To se může manifestovat jako poměrně široké množství patologií, které se mohou odrážet v aktivitě trombocytů (riziko trombózy nebo hemoragie), erytrocytů (různé formy anémie) a zásadním způsobem ve fyziologii leukocytů, které mají významnou roli v imunitních nebo zánětlivých procesech. Vzhledem k tomu, že makrofágy a T-lymfocyty jsou široce zastoupeny i v nehematologické tkáni [2], ovlivňuje CHIP nejen funkci krvetvorných buněk, ale může přispět k jakémukoli chorobnému procesu, který hematopoetický systém protíná.
V současné době existují důkazy, které poukazují na skutečnost, že jedinci s nejméně jednou prokázanou CHIP mutací mají zvýšenou úmrtnost ve srovnání s věkově shodnou kohortou [2]. U pacientů s neznámými nosiči klonální hematopoézy se poměr rizika úmrtí pohybuje kolem 1,2. Poměr rizika, který přímo souvisí s CHIP, je vyšší, a to 1,5–2 v závislosti na věku. Toto rozmezí může být způsobeno interindividuálními rozdíly, protože u jedinců s CHIP se mohou klinicky manifestovat další patologie jako přímý efekt specifické klonální mutace [3]. Stejně tak u těchto pacientů narůstá riziko progrese hematologické neoplazie, infarktu myokardu a ischemické CMP (iCMP) a zvyšuje se následná mortalita, a to až o 1 % ročně [2]. Recentní studie naznačují, že CHIP hraje důležitou roli ve vývoji kardiovaskulárních chorob, vč. infarktu myokardu a iCMP [4]. Základem této asociace by mohl být mimo jiné i důsledek interakce mezi dysfunkčním endotelem cév podmíněným CHIP [1] a leukocytárními klony. Právě tato souvislost by mohla představovat významný etiopatogenetický podklad aterosklerózy [5].
U 30 % pacientů s CMP není jasná příčina jejího vzniku ani nejsou přítomny tradiční rizikové faktory, jako jsou arteriální hypertenze, diabetes mellitus, dyslipidémie, kouření apod. Dále mnoho pacientů s aterosklerózou karotid nikdy neprodělalo CMP, z čehož vyplývá, že samotná ateroskleróza nemusí stačit k vyvolání aterotrombózy a vaskulárních příhod. Klony hematopoetických buněk byly v původních studiích nalezeny jen vzácně u osob mladších 40 let, avšak vyskytovaly se u více než 10 % populace nad 70 let [4].
Cíle a účel studie
• Vyhodnotit míru koexistence klonální hematopoézy typu CHIP a aterosklerózy karotid.
• Identifikovat nový rizikový faktor iCMP v podobě klonální hematopoézy typu CHIP.
Metodika
V tomto protokolu je popsána metodika multicentrické prospektivní studie zaměřené na objasnění souvislostí mezi výskytem buněčných klonů v periferní krvi a iCMP a prozkoumání následujících hypotéz:
Hypotéza 1: Klonální hematopoéza je etiopatogenetický faktor aterosklerózy karotid.
Hypotéza 2: Klonální hematopoéza je u české populace etiopatogenetickým faktorem symptomatické aterosklerózy karotid.
Hypotéza 3: Klonální hematopoéza vede ke vzniku iCMP.
Hypotéza 4: Klonální hematopoéza je častější u leukocytů fixovaných na endotel, zasažený aterosklerózou karotid než u cirkulujících leukocytů nebo nepostiženého endotelu.
Hypotéza 5: Klonální makrofágy/monocyty jako podtyp leukocytů sehrávají hlavní roli při tvorbě aterosklerózy. Častěji se vyskytují v aterosklerotickém plátu (AS) než v periferní krvi.
Nábor pacientů
Zařazeni budou pacienti ve věku 70 let a více s iCMP v karotickém povodí (žádné tranzitorní ischemické ataky). Pacienti budou rozděleni dle anamnestických údajů a na základě sonografického vyšetření nebo CTA nebo MRA karotid do 4 skupin, a to buď při příjmu do nemocnice, nebo v rámci hospitalizace či ambulantní kontroly z důvodu jiné diagnózy než iCMP.
1. skupina: pacienti s karotickou stenózou (symptomatická karotická stenóza ≥ 50 % podle kritérií NASCET [North American Symptomatic Carotid Endarterectomy Trial]), kteří utrpěli iCMP. Etiologie – TOAST 1 (Trial of Org 10172 in Acute Stroke Treatment), tedy makroangiopatie.
2. skupina: pacienti s asymptomatickou karotickou stenózou ≥ 50 % podle kritérií NASCET.
3. skupina: pacienti bez karotické aterosklerózy anebo se stenózou karotid ≤ 30 %, kteří utrpěli iCMP. Etiologie – TOAST 2 a 3, tedy kardioembolizace nebo mikroangiopatie
4. skupina: pacienti bez iCMP v anamnéze a bez karotické aterosklerózy anebo se stenózou karotid ≤ 30 %.
Vstupní a vylučující kritéria jednotlivých skupin
Skupina 1:
• vstupní kritéria: věk 70 let a více, iCMP v karotickém povodí s jednoznačnou etiologií dle klasifikace TOAST (aterotrombotická), symptomatická karotická stenóza ≥ 50 %, podpis informovaného souhlasu
• vylučující kritéria: tranzitorní ischemická ataka nebo iCMP ve vertebrobazilárním povodí, fibrilace síní
Skupina 2:
• vstupní kritéria: věk 70 let a více, asymptomatická karotická stenóza ≥ 50 %, podpis informovaného souhlasu
• vylučující kritéria: iCMP nebo tranzitorní ischemická ataka v anamnéze
Skupina 3:
• vstupní kritéria: věk 70 let a více, iCMP v karotickém povodí s jednoznačnou etiologií dle klasifikace TOAST (kardioembolizační, lakunární), symptomatická karotická stenóza ≤ 30 %, podpis informovaného souhlasu
• vylučující kritéria: tranzitorní ischemická ataka nebo iCMP ve vertebrobazilárním povodí
Skupina 4:
• vstupní kritéria: věk 70 let a více, podpis informovaného souhlasu
• vylučující kritéria: iCMP nebo tranzitorní ischemická ataka v anamnéze
Sledované parametry
• osobní anamnéza: ischemická choroba srdeční, infarkt myokardu, fibrilace síní, arteriální hypertenze, diabetes mellitus, hyperlipidemie, ischemická choroba dolních končetin, chronická renální insuficience, syndrom spánkové apnoe, onkologická anamnéza vč. chemoterapie a aktinoterapie, anamnéza nikotinizmu a abúzus ethanolu;
• farmakologická anamnéza: chronická protidestičková léčba, chronická antikoagulační léčba, chronická hypolipidemická léčba (atorvastatin, rosuvastatin);
• klinické a neurologické parametry: věk, hmotnost, výška, BMI (body mass index), vstupní mRS (modifikovaná Rankinova škála [modified Rankin Scale]), vstupní NIHSS (National Institutes of Health Stroke Scale), systolický a diastolický krevní tlak, etiologie iktu dle klasifikace TOAST, NIHSS a mRS při dimisi;
• zobrazovací vyšetření: ASPECTS (Alberta Stroke Program Early CT Score) na akutním zobrazení CT mozku, vstupní vyšetření CTA magistrálních a mozkových tepen, akutní CT perfuzní vyšetření mozku, přítomnost hemoragické transformace na kontrolní CT, resp. MR mozku;
• léčba akutní iCMP: intravenózní trombolýza, mechanická trombektomie, kombinovaná terapie intravenózní trombolýzou a mechanickou trombektomií, protidestičková monoterapie, duální protidestičková terapie;
• laboratorní parametry: krevní obraz + diferenciální počet krevních buněk, koagulační parametry (trombinový čas [thrombin time; TT], aktinovaný parciální tromboplastinový čas [activated partial thromboplastin time; aPTT], mezinárodní normalizovaný poměr [international normalized ration; INR], protrombinový čas [prothrombin time; PT], fibrinogen), lipidogram (celkový cholesterol, vysokodenzitní lipoproteiny [high density lipoproteins; HDL], nízkodenzitní lipoproteiny [low density lipoproteins; LDL], triacylglyceroly), C-reaktivní protein (CRP), glykémie, glykovaný hemoglobin (HbA1c).
Pseudonymizovaná data pacientů budou zadávána proškoleným zdravotnickým personálem v souladu s legislativou klinických studií do eCRF Clindata, který bude vytvořen pro potřeby tohoto projektu.
Získání biologických vzorků
Odběr vzorku krve pro DNA analýzu
Pro analýzu sekvence DNA ze vzorků celé krve bude odebráno do zkumavky Cell-Free DNA BCT CE (Streck, La Vista, NE, USA) 10 ml periferní krve. Zkumavky Streck budou skladovány při pokojové teplotě a odeslány na pracoviště Ústav molekulární a translační medicíny (IMTM) do týdne od odběru krve.
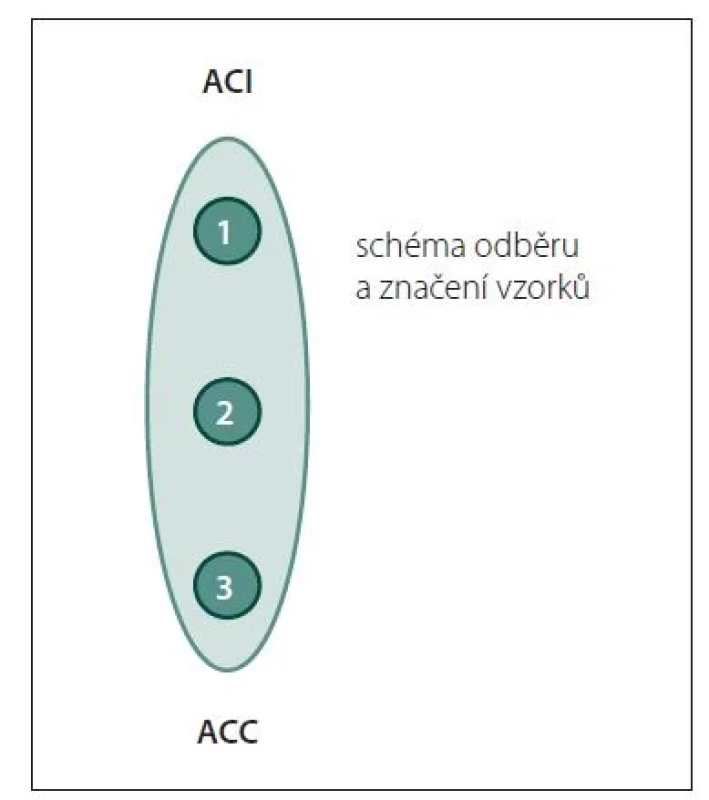
Odběr vzorku aterosklerotického plátu
Pro analýzu plátu budou odebrány 3 vzorky dle obr. 1 o velikosti 5 × 5 × 5 mm tkáně endotelu/plátu. Tyto vzorky budou stabilizovány umístěním do 1 000 µl stabilizačního roztoku (RNAlater [Thermo Fisher Scientific, Waltham, MA, USA] nebo Allprotect Tissue Reagent [QIAGEN, Hilden, Německo]) při pokojové teplotě. Zbytek AS tkáně bude umístěn do pufrovaného 4% roztoku formaldehydu. Odebraný materiál AS plátu bude do týdne odeslán do laboratoře IMTM ke zpracování.
ACC – arteria carotis communis; ACI – arteria
carotis interna
Fig. 1. Atherosclerotic plaque sampling
and labeling scheme.
ACC – common carotid artery; ACI – internal
carotid artery
Všechny potřebné nástroje jsou snadno dostupné v IMTM, stejně jako stabilizační činidla, roztoky a zkumavky na krev, které budou z tohoto pracoviště poskytovány.
Laboratorní metody
Metody molekulární biologie
• Průtoková cytometrie – pro definování buněčné populace (makrofágy/monocyty a/nebo cirkulující endoteliální buňky a endotelové progenitorové buňky) bude použitý metodický přístup průtokové cytometrie FACS BD (Beckman Coulter, Brea, CA, USA). Pro tuto analýzu bude do zkumavek Cyto-Chex BCT (Streck, La vista, NE, USA) pro imunitní buňky odebráno 5 ml ze vzorku periferní krve.
• Extrakce DNA, metoda masivně paralelního sekvenování (MPS) – k detekci přítomnosti variant CHIP souvisejících s aterosklerózou nebo známých kauzálních variant v definované pod/skupině buněk v panelu často mutovaných genů uváděných v literatuře bude použito MPS [3,6,7]. Sekvenační knihovny budou připraveny metodou cíleného obohacení pomocí PCR (polymerase chain reaction) amplifikace s jedinečnými molekulárními indexy a budou sekvenovány na platformě NovaSeq 6000 (Illumina, San Diego, CA, USA).
Imunohistochemická analýza
U vzorků AS plátu bude provedena imunohistochemická analýza s volbou protilátek specificky vázajících se na povrchové CD receptory buněk, které se podílejí na vzniku a/nebo rozvoji aterosklerózy. Konkrétně se bude jednat o: T-lymfocyty – antigen CD3; B-lymfocyty – antigen CD20; endotelie – antigen CD34; makrofágy a jejich deriváty – antigen CD68. Dále bude použito základní barvení fibroblastů a hladké svaloviny. Histopatologická diagnostika (kvantitativní, kvalitativní) bude porovnávat vzorky AS plátů mezi pacienty s CHIP a pacienty bez výskytu CHIP v periferní krvi ve skupině 1 a 2.
Statistická analýza
Vzhledem k výše uvedeným hypotézám je projekt designován do dvou fází.
První fází bude soubor explorativních studií s pragmatickou velikostí vzorku 50 pacientů na skupinu, jejichž hlavním cílem bude optimalizovat extrakci DNA, metodu MPS a metodu FACS a prokázat schopnost detekovat očekávaný signál ve skupinách pacientů. Jsme si vědomi toho, že tento vzorek nemá dostatečnou statistickou sílu, ale umožní prioritizovat hypotézy, zvýšit přesnost výpočtu velikosti vzorku a odhadnout/optimalizovat míru náboru pacientů. Celkový počet pacientů zařazených do všech skupin dohromady v první fázi studie by měl být 200, tj. pětina z celkového počtu zařazených pacientů.
Jedním z cílů explorativní studie bude získat znalosti o biologických mechanizmech CHIP a AS vzorků tkáně odebrané během karotické endarterektomie (klasická i everzní), které budou testovány na přítomnost CHIP pozitivních leukocytů a jejich kvantitativní komparace s výskytem v periferní krvi (preferenčně se bude jednat o makrofágy/monocyty). Následně bude předmětem zájmu zjištění, zda existuje rozdíl mezi CHIP v endoteliálních buňkách přítomných v AS plátu a endotelem nezasaženým aterosklerózou. K tomuto účelu bude zajištěno 50 vzorků AS plátu. Tento počet je určen dle plánovaných výkonů spolupracujících chirurgických pracovišť.
Ve druhé fázi bude provedena studie o náležité síle s cílem zjistit statistický rozdíl mezi dvěma skupinami pacientů. Předchozí explorativní studie pomůže zaměřit se na skupiny pacientů, které hypotézu s největší pravděpodobností potvrdí.
Pro výpočet statisticky významné velikosti vzorku celkem 1 000 zařazených pacientů byl použitý PASS software (version 14.0, NCSS, LLC. Kaysville, UT, USA). Do každé skupiny je plánováno zařadit 250 pacientů.
Statistické vyhodnocení dat bude postaveno zejména na analýze genových variant v rámci jednotlivých studijních skupin pacientů v periferní krvi. Dále bude statisticky hodnocena diference mezi zastoupením buněčných typů v AS plátu a v periferní krvi u skupiny 1 a 2. Interpretace a analýza výsledků může být ovlivněna případnými rozdíly mezi skupinami v klinických charakteristikách zařazených pacientů. Pro účely statistické analýzy bude sloužit one-way ANOVA doplněný Mann-Whitneyho testem. Anamnestická a klinická data a frekvence výskytu genových mutací budou hodnoceny c2 testem.
Diskuze
Faktory, které byly zvažovány při designu studie:
1) I když má CHIP souvislost s iCMP, případně ji způsobuje, není jasné, jak přesně a do jaké míry. Existuje tedy několik hypotéz, které by vyžadovaly odlišný design, zejména pokud jde o definici populace pacientů.
2) Mez detekce pro detekci variant v genových panelech podskupin leukocytů a výkonnost sortování fluorescenčně značených buněk (fluorescent activated cell sorting; FACS) nejsou stanoveny a musí se otestovat.
3) Velikost potřebného populačního vzorku pro průkaz rozdílu CHIP mezi dvěma populacemi pacientů bude záviset na frekvenci CHIP v těchto dvou skupinách. Tato frekvence není známá a lze ji odvodit pouze z velmi omezených údajů (tab. 1). Proto je před provedením studie s náležitou silou statistického testu zapotřebí více informací o předpokládané četnosti CHIP u různých skupin pacientů.
![Příklady studií, které dokumentují četnost CHIP u pacientů s aterosklerózou a bez aterosklerózy. Zároveň je zde uvedena
vypočítaná velikost vzorku, která je k detekci tohoto rozdílu potřebná [5].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image_pdf/b17332b6891850ffccaab3e39c7cfbb8.jpg)
4) Prevalence CHIP je u pacientů mladších 70 let nízká (obr. 2). Studium CHIP u pacientů mladších 70 let by proto vyžadovalo zvětšení velikosti vzorku. Vyloučení pacientů mladších 70 let sníží počet potřebných pacientů.
Fig. 2. Prevalence of somatic mutations depending on the age of patients. The color
differentiation in different shades of lightness expresses the 50th, 75th, and 95th percentiles.
Adapted from [4].
![Prevalence somatických mutací v závislosti na věku pacientů. Barevné odlišení
v různých odstínech světlosti vyjadřuje 50., 75. a 95. percentil. Převzato z [4].<br>
Fig. 2. Prevalence of somatic mutations depending on the age of patients. The color
differentiation in different shades of lightness expresses the 50th, 75th, and 95th percentiles.
Adapted from [4].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image_pdf/6f0548ad4a18261f5e353fcd5035ffa1.jpg)
V případě nalezení a objasnění vztahu mezi přítomností CHIP v periferní krvi a iCMP, popřípadě aterosklerózou, by potenciální klinický význam mohly představovat:
1. nalezení významného diagnosticko-prognostického faktoru/markeru;
2. individualizace terapie sekundární prevence iCMP na základě detekce CHIP u pacientů po iCMP;
3. modifikace současně zavedené metodiky sekundární prevence iCMP.
Ad 1) Výstupy současných studií poukazují na možnou souvislost některých chorobných stavů, do kterých může CHIP zasáhnout prostřednictvím hematopoetického systému. S touto úvahou tak koreluje vyšší riziko úmrtnosti a případné komorbidity pacientů s CHIP. Přítomnost CHIP u daného jedince by pak představovala významný faktor ovlivňující prognózu zdravotního stavu, a to nejen z pohledu iCMP.
Ad 2) Z důvodu vlivu klonální hematopoézy na prozánětlivou modifikaci imunokompetentních buněk v konsekvenci patologických aspektů CHIP by bylo možné považovat zavedenou farmakoterapii sekundární prevence iCMP za nedostačující [8]. Antitrombotická a statinová medikace by u pacientů s CHIP měla být případně doplněna o protizánětlivou léčbu zpomalující zejména vznik a progresi AS plátu. Na potřebu ovlivnit zánětlivý proces v souvislosti s aterosklerózou mimo jiné upozorňuje i klinická studie CONVINCE [9], která si klade za cíl prokázat efektivitu kolchicinu v sekundární prevenci cévního zánětu po nekardioembolické CMP. Pozitivní efekt kolchicinu již byl prokázán v oblasti kardiologie, kde dávka 0,5 mg denně vedla k signifikantnímu poklesu ischemických kardiovaskulárních příhod ve srovnání s placebem [8].
Ad 3) Prokázání souvislosti mezi koexistencí CHIP (případně konkrétní genové mutace) a klinickou manifestací aterosklerózy – iCMP – by mohlo vést k modifikaci současně zavedené metodiky sekundární prevence iCMP, jako je antihypertenzní, hypolipidemická léčba apod., pokud by ona souvislost prokázala, že CHIP je faktor, který modifikuje účinnost preventivního postupu (např. agresivnější hypolipidemická léčba u pacientů s CHIP).
Etické principy
Práce je prováděna ve shodě s Helsinskou deklarací z roku 1975 a jejími revizemi v letech 2004 a 2008. Studie byla schválena Etickými komisemi: Nemocnice České Budějovice 25. 6. 2021 s č.j. 108/21, Fakultní nemocnice Králov - ské Vinohrady 2. 3. 2022 s č.j. KH/07/00/2022, Fakultní nemocnice u sv. Anny v Brně (v prvním znění) 10. 7. 2019 s č.j. 42V/2019, IKEM a Fakultní Thomayerova nemocnice 28. 5. 2021 č.j. 12282/21 + 15151/21; A-21-18, Nemocnice Na Homolce 4. 3. 2021 č.j. 4. 3. 2021/7, Fakultní nemocnice Hradec Králové 1. 7. 2021 č.j. 202107 I59P, Krajská zdravotní a. s. Nemocnice Chomutov o.z. 15. 9. 2021 č.j. 321-1, Nemocnice Jihlava 25. 11. 2021, Karvinská hornická nemocnice 9. 6. 2021 č.j. 58KS/2021, Nemocnice Liberec 20. 10. 2021 č.j. EK/80/2021, Fakultní nemocnice v Motole 6. 10. 2021 č.j. EK-800/21, Nemocnice AGEL Ostrava-Vítkovice 5. 5. 2021 č.j. EK/69/2021, Fakultní nemocnice Ostrava 25. 3. 2021 č.j. 108/2021, Ústřední vojenská nemocnice 17. 5. 2021 č.j. 108/16-3/2021. Pacienti podepisují informovaný souhlas. V případě, že nejsou schopni nebo nemohou udělit souhlas, je zde varianta podpisu osoby blízké nebo zákonného zástupce. Pro případ, že je pacient schopen udělit souhlas, ale není schopen souhlas podepsat, existuje varianta potvrzení souhlasu pacienta nezávislým svědkem a nezávislým lékařem.
Poděkování
Autorský kolektiv děkuje všem kolegům a spolupracovníkům za cenné rady a připomínky, které přispěly ke vzniku nejen protokolu, ale celé této akademické klinické studie. Poděkování patří zejména těm centrům, které se na této studii podílejí, a CZECRINu, který poskytuje podporu pro realizaci akademických klinických projektů.
Finanční podpora
Výzkumný projekt je podpořen z Evropského fondu pro regionální rozvoj – projekt ENOCH (reg. č. CZ.02.1. 01/0.0/0.0/16_019/0000868), LM2018133, LM2018125, EF16_013/0001674, IGA LF UP 2022_012 a dále je podpořen sítí STROCZECH v rámci výzkumné infrastruktury CZECRIN (č. projektu LM2018128) financované státním rozpočtem České republiky.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem práce nemají žádný konflikt zájmů.
PharmDr. Veronika Kunešová, Ph.D.
Cerebrovaskulární výzkumný
program
STROCZECH
Mezinárodní centrum klinického
výzkumu
FN u sv. Anny v Brně
Pekařská 664/53
602 00 Brno
e-mail: veronika.kunesova@fnusa.cz
Přijato k recenzi: 4. 11. 2022
Přijato do tisku: 6. 12. 2022
Zdroje
1. Kusne Y, Xie Z, Patnaik MM. Clonal hematopoiesis: molecular and clinical implications. Leuk Res 2022; 113 : 106787. doi: 10.1016/j.leukres.2022.106787.
2. Gibson JCh, Steensma DP. New insights from studies of clonal hematopoiesis. Clin Cancer Res 2018; 24 (19): 4633–4642. doi: 10.1158/1078-0432.CCR-17-3044.
3. Zink F, Stacey SN, Norddahl GL et al. Clonal hematopoiesis, with and without candidate driver mutations, is common in the elderly. Blood 2017; 130 (6): 742–752. doi: 10.1182/blood-2017-02-769869.
4. Jaiswal S, Fontanillas P, Flannick J et al. Age-related clonal hematopoiesis associated with adverse outcomes. N Engl J Med 2014; 371 (26): 2488–2498. doi: 10.1056/NEJMoa1408617.
5. Jaiswal S, Natarajan P, Silver AJ et al. Clonal hematopoiesis and risk of atherosclerotic cardiovascular disease. N Engl J Med 2017; 377 (2): 111–121. doi: 10.1056/NEJMoa1701719.
6. Xie M, Lu C, Wang J et al. Age-related mutations associated with clonal hematopoietic expansion and malignancies. Nat Med 2014; 20 (12): 1472–1478. doi: 10.1038/nm.3733.
7. Genovese G, Kähler AK, Handsaker RE et al. Clonal hematopoiesis and blood-cancer risk inferred from blood DNA sequence. N Engl J Med 2014; 371 (26): 2477–2487. doi: 10.1056/NEJMoa1409405.
8. Murray PJ, Wynn TA. Protective and pathogenic functions of macrophage subsets. Nat Rev Immunol 2011; 11 (11): 723–737. doi: 10.1038/nri3073.
9. Nidorf SM, Aernoud TLF, Mosterd A et al. Colchicine in patients with chronic coronary disease. N Engl J Med 2020; 383 (19): 1838–1847. doi: 10.1056/NEJMoa2021372.
10. Tardif JC, Kouz S, Waters DD et al. Efficacy and safety of low-dose colchicine after myocardial infarction. N Engl J Med 2019; 381 (26): 2497–2505. doi: 10.1056/NEJM oa1912388.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2022 Číslo 6
-
Všechny články tohoto čísla
- Pletencové svalové dystrofie
- Pokrok ve znalostech patofyziologie migrény
- Základní principy anesteziologické péče k perioperační monitoraci transkraniálních motorických evokovaných potenciálů
- Nové farmakologické možnosti v léčbě Alzheimerovy nemoci
- Role skórovacích systémů v indikaci léčby meningeomů u pacientů vyššího věku
- Validační studie a představení nového testu porozumění větám TEPO pro děti ve věku 3–8 let
- Potenciál projektivní Metody asociace barev odrážet fyziologické reakce na podněty s jiným emočním nábojem (studie PARC) – protokol studie
- Kognitivní funkce pacientů při celomozkovém ozařování pro mozkové metastázy karcinomu plic a strategie řízení radioterapie pomocí inteligentního softwaru
- Klonální hematopoéza neurčitého potenciálu při ischemické cévní mozkové příhodě – studijní protokol
- Extrapontinní centrální myelinolýza s extrapyramidovými příznaky u 14letého chlapce s PIMS-TS související s onemocněním COVID-19
- Myoklonus středního ucha jako příčina objektivního tinnitu
- Chronická zánětlivá senzitivní polyradikulopatie asociovaná s monoklonální gamapatií nejasného významu
- Hraniční koncentrace likvorového tripletu tau proteinů a beta-amyloidu 42 v diagnostice Alzheimerovy nemoci a dalších neurodegenerativních demencí
- Doporučení pro vývojovou dysfázii – verze 2022
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Doporučení pro vývojovou dysfázii – verze 2022
- Validační studie a představení nového testu porozumění větám TEPO pro děti ve věku 3–8 let
- Nové farmakologické možnosti v léčbě Alzheimerovy nemoci
- Pletencové svalové dystrofie

