Základní principy anesteziologické péče k perioperační monitoraci transkraniálních motorických evokovaných potenciálů
Basic principles of anaesthetic care for intraoperative transcranial motor evoked potentials monitoring
Intraoperative evoked potentials monitoring is an essential neurophysiological modality used in surgeries with a risk of CNS functional integrity damage. Transcranial motor evoked potentials (MEPs) are one of the most important modalities. Trained surgeons can effectively monitor MEPs under the supervision of a neurophysiologist. Effective cooperation among all operating team members, anaesthesiologists, and neurophysiologist is essential for proper neuromonitoring. The aim of this article is to comprehensively summarize all possible factors that can affect the quality of intraoperative MEPs monitoring. The authors focus on the effect of anaesthetic drugs and anaesthetic management, including anaesthesia maintenance or non-pharmacological factors, which can affect the MEPs’ reproducibility. This review provides essential information to all members of a perioperative team that take care for patients during surgery with MEPs monitoring. This information can facilitate cooperation and streamline communication across all related disciplines.
Keywords:
motor evoked potentials – general anaesthesia – neurophysiological monitoring – total intravenous anaesthesia
Autoři:
J. Hudec 1,2; M. Kosinová 2,3; Martin Němec 4
Působiště autorů:
Klinika anesteziologie, resuscitace a intenzivní medicíny LF MU a FN Brno
1; Ústav simulační medicíny, LF MU, Brno
2; Klinika dětské anesteziologie a resuscitace LF MU a FN Brno
3; Neurologická klinika LF MU a FN Brno
4
Vyšlo v časopise:
Cesk Slov Neurol N 2022; 85(6): 457-461
Kategorie:
Přehledný referát
doi:
https://doi.org/10.48095/cccsnn2022457
Souhrn
Intraoperační sledování evokovaných potenciálů představuje v současnosti významnou neurofyziologickou metodu používanou v rámci operačních výkonů, u kterých hrozí riziko narušení funkční integrity CNS. Jednou z nejvýznamnějších monitorovacích modalit jsou transkraniální motorické evokované potenciály (MEP), které mohou být efektivně sledovány proškoleným operačním týmem pod dohledem neurofyziologa. Pro správný neuromonitoring je potřeba efektivní spolupráce mezi operačním týmem, anesteziologickým týmem a neurofyziologem. Cílem tohoto článku je vytvořit ucelený přehled všech potenciálních faktorů, jež mohou ovlivnit výbavnost MEP v intraoperačním období. Autoři se zaměřují nejen na vliv jednotlivých léčiv používaných v rámci anestezie, ale i na samotnou formu anestezie či nefarmakologické faktory s možným vlivem na výbavnost MEP. Tento přehledový článek poskytuje základní informace všem, kteří se podílejí na perioperační péči o pacienty podstupující výkony s monitorací MEP, a může tak usnadnit spolupráci a zefektivnit komunikaci napříč zainteresovanými obory.
Klíčová slova:
celková anestezie – motorické evokované potenciály – neurofyziologický monitoring – totální intravenózní anestezie
Úvod
Intraoperační monitorace transkraniálních motorických evokovaných potenciálů (MEP) v současné době představuje standardní součást operačních výkonů, u kterých hrozí riziko peroperačního neurologického deficitu. Jedná se zejména o výkony v neurochirurgii, spondylochirurgii, případně o operace aorty, které mohou být spojeny s mechanickým či ischemickým poškozením míchy vedoucím k iatrogennímu poškození pacientů. Monitorace MEP poskytuje velmi cenné informace operačnímu týmu o zachování funkční integrity v operované oblasti a zásadně tak přispívá ke zvýšení bezpečnosti pacientů. Současně s tím vede ke zvýšení jistoty celého týmu [1–3]. Transkraniální elektrická stimulace vedoucí k vybavení MEP nahradila dříve běžně užívaný wake-up test. Díky tomu není nutné rutinní probouzení pacientů v průběhu operačního výkonu se zvýšeným rizikem selfextubace, poškození invazivních vstupů či narušení operační polohy spojené s motorickým neklidem pacienta. Další nevýhodou je nemožnost stanovení porušení integrity nervového systému reálně v čase, ale až s latencí, v době probuzení [4,5].
K adekvátní neurofyziologické monitoraci je klíčová týmová spolupráce mezi operačním týmem, neurofyziologem a anesteziologickým týmem. Peroperační anesteziologické postupy mohou mít zásadní vliv na výbavnost MEP a nepřímo ovlivnit výsledný neurologický stav operovaných pacientů. Anesteziologický tým tak musí zvládat management výkonů s neurofyziologickou monitorací, neboť je známo, že farmaka užívaná v anestezii více či méně ovlivňují výbavnost MEP. Stejně tak musí být zajištěny stabilita vnitřního prostředí, adekvátní oxygenace, ventilace či teplotní komfort pacienta [6,7]. V případě jakýchkoli pochybností při omezené výbavnosti MEP musí být anesteziolog připraven vyloučit potenciální anesteziologické vlivy. Proto je nezbytné vybudování důvěry mezi jednotlivými členy operačního týmu a adekvátní komunikace, která prokazatelně zlepšuje pooperační výsledný stav pacientů [8,9].
Tento přehledový článek je zaměřen na základní aspekty anesteziologické péče, která může ovlivnit výbavnost peroperační monitorace MEP. Zaměříme se na vytvoření adekvátních podmínek správnou volbou anestetik, monitoraci hloubky anestezie a péči o stabilitu vnitřního prostředí.
Transkraniální motorické evokované potenciály
Motorické evokované potenciály jsou používány při posuzování funkční integrity motorického systému. Tyto potenciály jsou vybaveny prostřednictvím elektrické stimulace s užitím podkožních elektrod v pozici C1 a C2, resp. C3 a C4, které jsou umístěné na skalpu podle standardního systému EEG 10/20, přičemž stimulovaný kortex se typicky nachází pod anodou v důsledku vyšší stimulační účinnosti ve srovnání s katodou [10].
Původně bylo v průběhu celkové anestezie obtížné vybavit a správně reprodukovat MEP, zvláště při užití inhalačních anestetik. Nicméně novější anesteziologické postupy s užitím totální intravenózní anestezie (TIVA), stejně tak jako vývoj stimulačních metod, vedly k rozšíření této metody do praxe i v průběhu celkové anestezie. Sled krátkých stimulačních pulzů umožňuje vybavit a snímat MEP ze svalů horních i dolních končetin s užitím povrchových nebo jehlových elektrod [10,11].
V souvislosti s aplikací elektrického impulzu panují obavy ohledně rizika vyvolání epileptických záchvatů, popálenin hlavy či srdečních arytmií. V některých pracích bylo popsáno snadné vyvolání záchvatů po kontinuální, několik vteřin trvající stimulaci mozku o frekvenci 50–60 Hz [10]. Nicméně při standardním použití v průběhu operace nebylo prokázáno, že by transkraniální stimulace vedla k vyvolání záchvatů. Z tohoto hlediska je použití MEP bezpečnou metodou [12].
Interpretace MEP je obtížná a vyžaduje zkušenosti. Některé studie prokazují výskyt motorického deficitu navzdory žádné či nesignifikantní změně v parametrech MEP. To může být způsobeno poškozením jednotlivého nervového kořene, které se neprojeví změnou neurofyziologické monitorace. V některých případech byla naopak popsána alterace MEP, ačkoli nebyl pozorován motorický deficit [13,14].
Při interpretaci MEP se jako signifikantní změna považuje jejich ztráta (vymizení, absence), která znamená pooperační parézu. Některé retrospektivní studie však za tzv. cut-off, vyžadující zvýšenou obezřetnost a komunikaci mezi členy týmu, považují kombinaci poklesu amplitudy o více než 70 % a prodloužení latence o více než 10 %. Pro tyto arbitrární hranice je však potřeba více studií [15,16].
Inhalační anestezie
Inhalační anestetika prokazatelně vedou ke snížení excitability motorických neuronů. Užití volatilních anestetik může být kontraindikováno u pacientů s určitým preexistujícím neurologickým onemocněním pro riziko maligní hypertermie či rhabdomyolýzy, jakou jsou např. myopatie [17]. Mechanizmus účinku inhalačních anestetik není doposud zcela jasný. Předpokládá se ovlivnění propustnosti buněčných membrán či působení na některých iontových kanálech. Použití sevofluranu i desfluranu vede v závislosti na dávce k poklesu amplitudy a prodloužení latence MEP, podle některých prací má desfluran silnější inhibiční efekt oproti sevofluranu. Ačkoli lze zvýšením stimulačního impulzu dosáhnout alespoň parciální výbavnosti MEP v průběhu výkonu, inhalační anestetika vedou k falešně pozitivním změnám ve výbavnosti MEP. Z toho důvodu není jejich užití vhodné [18,19].
Použití oxidu dusného (N2O) do nosné směsi vedlo u zdravých dobrovolníků ke snížení amplitudy MEP [20]. Expozice N2O u dlouhých výkonů (operace aorty, skolióz, …) navíc významně zvyšuje riziko pooperační nevolnosti a zvracení (PONV), není tedy vhodnou součástí celkové anestezie pro dlouhé výkony s monitorací MEP [21].
Zlatým standardem pro operace s monitorací MEP je TIVA, dle možností s použitím režimu Target Controlled Infusion (TCI) a s monitorací hloubky anestezie [10].
Totální intravenózní anestezie
Totální intravenózní anestezie je definována jako forma celkové anestezie s aplikací jednotlivých složek anestezie výhradně intravenózní cestou, tedy bez užití inhalačních anestetik. Ve srovnání s doplňovanou inhalační anestezií se jedná o méně používanou techniku, nicméně anesteziologové by tuto techniku měli rutinně ovládat, protože ne všichni pacienti mohou být exponováni inhalačním anestetikům (maligní hypertermie, rhabdomylýza). U některých pacientů je pak TIVA preferovanou metodou (nitrolební hypertenze, hypovolémie, vysoké riziko PONV). TIVA přináší výhody v podobě redukce PONV nebo právě u výkonů s monitorací MEP. Při této monitoraci je však vhodné minimalizovat podávání bolusů anestetik. Pokud musíme aplikovat bolus anestetik, např. z důvodu rizika poškození pacienta, je nutné o této skutečnosti informovat všechny členy týmu na operačním sále. Standardní součástí TIVA, zvláště při současném použití svalových relaxancií, by měla být monitorace hloubky anestezie pro vyšší riziko perioperační bdělosti ve srovnání s anestezií vedenou inhalačními anestetiky. Česká společnost anesteziologie, resuscitace a intenzivní medicíny (ČSARIM) doporučuje monitoraci hloubky anestezie vedené prostřednictvím TIVA [22,23].
Propofol
Propofol představuje v současnosti nejrozšířenější intravenózní anestetikum používané jak k úvodu, tak vedení anestezie. Mechanizmus anestetického účinku spočívá v aktivaci receptorů A pro g-aminomáselnou kyselinu (receptor GABAA). Výhodou užití je rychlá eliminace především v játrech i při kontinuálním podávání. Jeho nežádoucí účinky jsou alterace kardiovaskulárních funkcí s arteriální hypotenzí, útlum dechového centra či tzv. syndrom propofolové infuze (PRIS), který zpravidla vzniká při aplikaci dávky vyšší než 5 mg/kg/h po dobu delší než 48 h. Operační výkony takové délky bývají popisovány vzácně, nicméně je potřeba s touto komplikací počítat při pokračující sedaci po operačním výkonu na JIP [24]. Propofol v závislosti na dávce snižuje amplitudu MEP, mechanizmus tohoto poklesu není dosud známý. Pokles amplitudy je však ve srovnání s inhalačními anestetiky nižší a anestezie vedená kontinuální infuzí propofolu je vhodnou metodou k monitoraci MEP [25].
Benzodiazepiny
Benzodiazepiny působí rovněž prostřednictvím aktivace receptorů GABAA. Délka působení benzodiazepinů je přímo úměrná délce jejich podávání, nicméně délka jejich působení i po jednorázovém podání anestetické dávky je podstatně delší oproti výše zmíněnému propofolu. Proto může být u delších výkonů prolongované vyvedení z celkové anestezie, zvláště u pacientů s alterací jaterních či renálních funkcí. Benzodiazepiny jsou tudíž v rámci úvodu a vedení anestezie užívány v monoterapii spíše zřídka [26]. Podobně jako u propofolu dochází v závislosti na dávce k poklesu amplitudy MEP, nicméně nízké dávky benzodiazepinů, t. č. nejčastěji zastoupených midazolamem, sloužící k premedikaci či anxiolýze neovlivňují signifikatně MEP [27].
Etomidát
Dalším intravenózním hypnotikem je etomidát, který působí jako modulátor receptorů GABAA a tím zesiluje inhibiční účinek GABA. Jeho výhodou je, že mezi ostatními hypnotiky vyvolává nejmenší kardiovaskulární a respirační depresi. Z tohoto důvodu je preferován u kardiálně kompromitovaných pacientů. Stále diskutovaným tématem je vliv etomidátu na inhibici syntézy kortizolu. Etomidát je rychle metabolizován jaterními esterázami, předpokládá se i vliv metabolizace plazmatickými esterázami, díky čemuž může být alternativou pro vedení anestezie při kontraindikaci propofolu [28]. Limitace prací zkoumající vliv etomidátu na výbavnost MEP jsou dány nižším počtem pacientů. Nicméně etomidát byl úspěšně aplikován u výkonů s neurofyziologickou monitorací. Parametry MEP byly velmi variabilní, od vzestupů amplitud až po nevýznamný pokles. Signifikantní pokles amplitudy byl zaznamenán jen ojediněle, po aplikaci bolusu. Navíc podle některých prací byly pooperačně monitorované hladiny kortizolu po kontinuální infuzi etomidátu v normě [29,30].
Ketamin
Ketamin představuje zcela unikátní anestetikum, které působí dominantně jako antagonista receptoru N-methyl-D-asparagové (NMDA) kyseliny a tím navozuje tzv. disociativní anestezii. Mezi jeho výhody patří sympatomimetický účinek a minimální vliv na dechové centrum. Pro jeho analgetický účinek je ketamin v současnosti stále více využívaný anesteziology k terapii jak akutní, tak i chronické bolesti. Pro analgetický účinek bývají aplikovány nižší, subanestetické dávky [31]. Vliv ketaminu na výbavnost MEP byl zkoumán jak v anestetických, tak v subanestetických dávkách. Současná literatura uvádí, že ketamin má příznivé účinky a může být bezpečně aplikován u operací s monitorací MEP. V subanestetických dávkách byly dokonce naměřeny vyšší amplitudy MEP bez vlivu na latenci [32,33].
Thiopental
Thiopental patří mezi nejdéle používané barbituráty. Mechanizmus účinku spočívá rovněž v aktivaci receptorů GABAA. Jeho zásadní nevýhodou je prodloužená eliminace po kontinuálním podávání, nicméně kontinuální infuze thiopentalu není v rámci anestezie běžnou praxí. Ačkoli thiopental negativně ovlivňuje výbavnost MEP, může být bezpečně použit k úvodu do celkové anestezie, neboť jednorázová dávka k úvodu nepředstavuje problém při další monitoraci MEP [34,35].
Dexmedetomidin
Dexmedetomidin patří do skupiny vysoce selektivních a-2 agonistů, který snadno přestupuje do CNS a tam inhibuje uvolnění zejména noradrenalinu, méně pak acetylcholinu či serotoninu. Dominantně je užíván k sedaci pacientů na JIP. Nicméně v posledních letech je stále více zkoumán jeho vliv v perioperačním období pro jeho možný koanalgetický efekt, dále snižuje výskyt pooperačního třesu. Použití dexmedetomidinu k vedení anestezie u intubovaných zatím nemá schválenou indikaci, a tudíž se jedná o podání off-label. Jeho aplikace v kombinaci s dalšími anestetiky však umožňuje snížit celkové dávky opioidů i anestetik. Z nežádoucích účinků, jaké jsou popisovány v průběhu tzv. bdělé sedace neintubovaných pacientů, je třeba počítat s rizikem arteriální hypotenze a bradykardie [36,37]. Ve studiích zkoumajících vliv dexmedetomidinu na MEP byl dexmedetomidin aplikován ke standardní kombinaci propofol/opioid za monitorace hloubky anestezie. Dexmedetomidin v závislosti na dávce signifikantně ovlivňuje amplitudu MEP a podle současných dat nelze jeho užití v průběhu celkové anestezie u operací s neurofyziologickou monitorací MEP doporučit [38,39].
Opioidy
Opioidy zajišťují analgezii prostřednictvím opioidních receptorů v CNS a periferním nervovém systému (PNS). Jsou důležitou součástí doplňované anestezie, tlumí adrenergní autonomní reakci na chirurgickou stimulaci. V současné době je u dlouhých výkonů preferována kontinuální infuze remifentanilu. Jedná se o silný opioid, který je metabolizován tkáňovými a plazmatickými esterázami. Bez ohledu na délku trvání infuze či farmakokinetickou variabilitu našich pacientů je jeho kontext senzitivní poločas 3 min. Je možné použít i další opioidy se stejným mechanizmem účinku, např. sufentanil, nicméně je nutné znát farmakokinetické vlastnosti jednotlivých opioidů. Použití opioidů má jen nesignifikantní vliv na výbavnost MEP v průběhu operace [27,40,41].
Svalová relaxancia
Periferní myorelaxancia navozují svalovou relaxaci obsazením nikotinového receptoru nervosvalové ploténky. V anestezii jsou využívána především pro usnadnění endotracheální intubace či optimalizaci operačních podmínek. V závislosti na dávce snižují výbavnost MEP až po úplnou absenci jejich vybavení, čímž mohou zásadně ovlivnit až znemožnit neurofyziologickou monitoraci. Proto je doporučeno aplikovat svalová relaxancia s krátko - či střednědobým účinkem, a to při úvodu do anestezie k zajištění dýchacích cest, bez další aplikace v průběhu operace. Monitorace reziduální svalové blokády pomocí akcelerometrie zvyšuje bezpečnost pacientů. Obnovení plné svalové síly (TOFr nad 90 %) umožňuje získat výchozí parametry MEP před začátkem operace bez vlivu myorelaxancií. Další možností je aplikace sugammadexu, kterým lze během 3 min zvrátit vliv reziduální nervosvalové blokády navozené rocuroniem či vekuroniem [27,42,43].
Vnitřní prostředí a fyziologické změny
Péče o vnitřní prostředí v rámci výkonů s monitorací MEP musí cílit na zajištění adekvátní dodávky kyslíku do míchy, která má vysoké nároky na přívod kyslíku a dalších metabolitů potřebných pro správnou funkci nervové tkáně. Ideální anesteziologická péče tak cílí na optimalizaci oxygenace, ventilace, perfuze míchy a teplotního managementu [27].
Extrémní hypoxémie či hyperoxémie, stejně tak jako hypokapnie, respektive hyperkapnie vedou k alteraci MEP. Mírné vychýlení těchto fyziologických funkcí nepovedé ke změně amplitudy či latence [44,45].
Adekvátní dodávka kyslíku do tkání souvisí s hrazením krevních ztrát a respektováním transfuzního triggeru dle aktuálních doporučení. V současné době je preferován restriktivní přístup s indikací transfuze při hladině hemoglobinu mezi 70–80 g/l [27,46].
Perfuze míchy je zajišťována prostřednictvím autoregulačních mechanizmů, ale i u zdravých jedinců při běžném rozmezí středního arteriálního tlaku (MAP) je třeba počítat s rizikem ischémie míchy způsobené lokálními faktory, a tím se změnami v neuromonitoringu. Preventivní aplikace permisivní hypotenze proto není doporučována. Naopak někdy může být nutné zvýšit MAP k zajištění adekvátní perfuze míchy na podkladě zhoršení neuromonitorace. Navíc je třeba respektovat věk pacienta, komorbidity, jako jsou arteriální hypertenze či diabetes mellitus, které mohou dále posouvat autoregulační práh směrem nahoru [27,44].
S dodávkou kyslíku do míchy také souvisí adekvátní náplň cévního řečiště. Hypovolémie může vést k arteriální hypotenzi a nedostatečné perfuzi míchy, hypervolémie může způsobit otok nervových obalů, případně otok skalpu, kde jsou umístěny stimulační elektrody. Prodlužuje se tak dráha nutná ke stimulaci, což se projeví sníženou výbavností MEP [45].
Teplotní management hraje zásadní roli nejen v rámci peroperačních komplikací, jako jsou ranné infekce, prodloužená eliminace léků s prolongovaným probouzením či rozvoj koagulopatie [47]. Hypotermie vede k poruše axonálního vedení ve smyslu snížení rychlosti, hypertermie má opačný efekt. Změny v monitoraci MEP byly prokázány při změně tělesné teploty o více než 2,5 °C oproti výchozí tělesné teplotě. V tomto rozmezí bychom se tak měli pohybovat při monitoraci MEP [27,44,45].
Anesteziologické kroky při alteraci MEP
V případě signifikantních změn MEP je nutná vzájemná spolupráce a komunikace mezi anesteziologickým týmem, operačním týmem a neurofyziologem s cílem včasné identifikace problému. Při těchto situacích je vhodné přechodně přerušit operativu a ověřit funkčnost a správné nastavení neurofyziologické monitorace. V případě, že se jedná o změny MEP pod neurotopickou úrovní chirurgické manipulace, se zachováním výbavnosti MEP nad touto úrovní, bude se jednat pravděpodobně o příčinu chirurgickou [27].
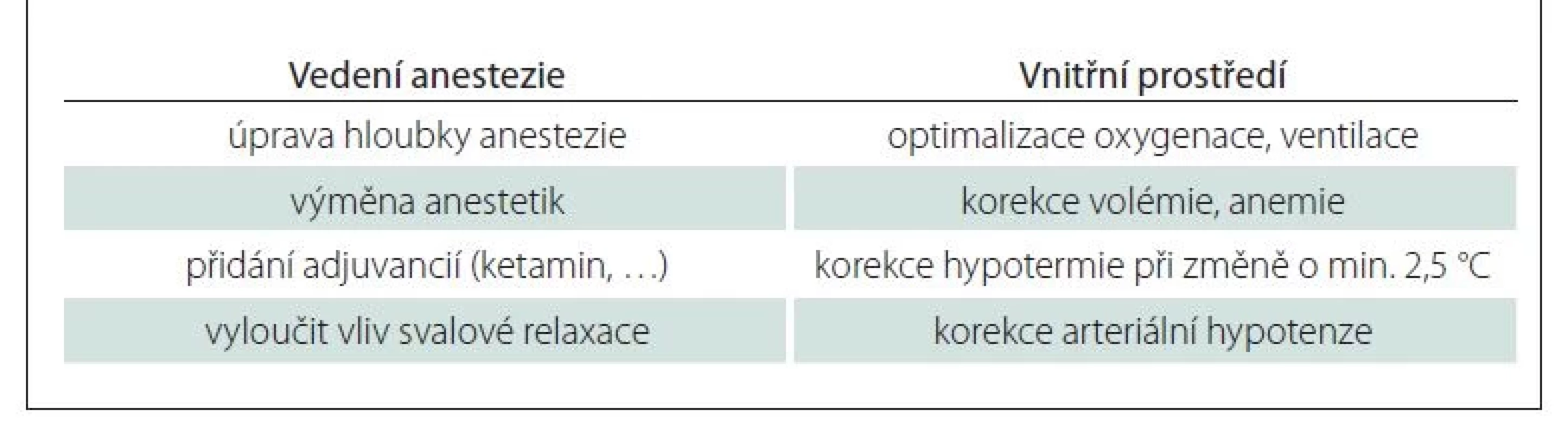
Při globální alteraci MEP je třeba hledat příčinu systémovou, respektive anesteziologickou. Anesteziologický tým by se měl zaměřit na vedení anestezie, kontrolu polohy pacienta a korekci vnitřního prostředí (tab. 1). Při příliš hluboké anestezii je nutné upravit hloubku anestezie. Případně lze zvážit přidání ketaminu do kombinace s cílem snížení dávky ostatních anestetik a s tím spojeného zlepšení výbavnosti MEP. Po úvodu do anestezie je v neposlední řadě nezbytné vyloučit vliv neuromuskulární blokády a případně zvážit farmakologickou antagonizaci či vyčkání spontánního zotavení z nervosvalové blokády. Kontrola polohy pacienta je nutná jednak z důvodu možného pohybu pacienta při práci operačního týmu, jednak z důvodu změny polohy při motorické odpovědi na transkraniální stimulaci. Změna polohy pacienta může ovlivnit prokrvení operované oblasti a tím může být změněna výbavnost MEP. Dle potřeby je vhodné korigovat krevní tlak k zajištění adekvátní perfuze míchy a podat krevní deriváty při hladině hemoglobinu pod 70 g/l. Důležitou součástí anesteziologické péče je zajistit vyhřívání pacienta s cílem prevence hypotermie z důvodu výše zmíněných nežádoucích účinků. V rámci monitorace MEP je dostačující zabránit výkyvům tělesné teploty o více než 2,5 °C oproti výchozí teplotě. Posledním krokem při selhání těchto postupů je provedení wake-up testu k posouzení motorické deficitu u bdělého pacienta [27,44,45,48].
Závěr
S přibývajícím počtem operací s možností monitorace zachování funkční integrity nervové tkáně (operace mozku, páteře či aorty) stoupají nároky na všechny členy týmu pečující o pacienta na operačním sále. Výhodou této monitorace je vyšší bezpečnost pro pacienty, ale i vyšší jistota pro operatéry. MEP představují v současnosti nejvýznamnější metodu intraoperační neurofyziologické monitorace. Pro správnou a kvalitní monitoraci je nezbytná spolupráce operačního týmu, neurofyziologa a anesteziologického týmu.
Tento přehledový článek se zaměřuje na základní principy, ze kterých by měl každý anesteziologický tým vycházet, aby byl schopen zajistit co nejlepší podmínky pro monitoraci MEP. Současně podává informace o anesteziologických krocích, které jsou nezbytné při signifikantní poruše výbavnosti MEP.
Konflikt zájmů
Autoři prohlašují, že nemají žádný konflikt zájmů v souvislosti s předmětem práce.
doc. MUDr. Martina Kosinová, Ph.D.
Klinika dětské anesteziologie
a resuscitace
LF MU a FN Brno
Jihlavská 340/20
625 00 Brno
e-mail: kosinova.martina@fnbrno.cz
Přijato k recenzi: 18. 7. 2022
Přijato do tisku: 18. 10. 2022
Zdroje
1. Daniel JW, Botelho RV, Milano JB et al. Intraoperative neurophysiological monitoring in spine surgery: a systematic review and meta-analysis. Spine 2018; 43 (16): 1154–1160. doi: 10.1097/BRS.0000000000002575.
2. Gruenbaum BF, Gruenbaum SE. Neurophysiological monitoring during neurosurgery: anesthetic considerations based on outcome evidence. Curr Opin Anaesthesiol 2019; 32 (5): 580–584. doi: 10.1097/ACO.0000000 000000753.
3. Jellish WS. Motor-evoked potentials are an important determinant of spinal cord ischemic injury during aortic arch surgery. But can they be used exclusively? J Cardiothorac Vasc Anesth 2019; 33 (7): 1843–1844. doi: 10.1053/j.jvca.2019.01.044.
4. Strike SA, Hassanzadeh H, Jain A et al. Intraoperative neuromonitoring in pediatric and adult spine deformity surgery. Clin Spine Surg 2017; 30 (9): E1174–E1181. doi: 10.1097/BSD.0000000000000388.
5. Padberg AM, Bridwell KH. Spinal cord monitoring: current state of the art. Orthop Clin North Am 1999; 30 (3): 407–433, viii. doi: 10.1016/s0030-5898 (05) 70095-x.
6. Sahinovic MM, Gadella MC, Shils J et al. Anesthesia and intraoperative neurophysiological spinal cord monitoring. Curr Opin Anaesthesiol 2021; 34 (5): 590–596. doi: 10.1097/ACO.0000000000001044.
7. Nunes RR, Bersot CDA, Garritano JG. Intraoperative neurophysiological monitoring in neuroanesthesia. Curr Opin Anaesthesiol 2018; 31 (5): 532–538. doi: 10.1097/ACO.0000000000000645.
8. Christian CK, Gustafson ML, Roth EM et al. A prospective study of patient safety in the operating room. Surgery 2006; 139 (2): 159–173. doi: 10.1016/j.surg.2005.07.037.
9. Etherington C, Wu M, Cheng-Boivin O et al. Interprofessional communication in the operating room: a narrative review to advance research and practice. Can J Anaesth 2019; 66 (10): 1251–1260. doi: 10.1007/s12630-019-01413-9.
10. Tsutsui S, Yamada H. Basic principles and recent trends of transcranial motor evoked potentials in intraoperative neurophysiologic monitoring. Neurol Med Chir (Tokyo) 2016; 56 (8): 451–456. doi: 10.2176/nmc.ra.2015-0307.
11. Burbridge MA, Nguyen V, Min JG et al. Intraoperative transcranial motor-evoked potential stimulation does not seem to cause seizures. J Neurosurg Anesthesiol 2021; 33 (4): 351–355. doi: 10.1097/ANA.0000000000000671.
12. Burbridge MA, Nguyen V, Min JG et al. Intraoperative transcranial motor-evoked potential stimulation does not seem to cause seizures. J Neurosurg Anesthesiol 2021; 33 (4): 351–355. doi: 10.1097/ANA.0000000000000671.
13. Nakagawa Y, Tamaki T, Yamada H et al. Discrepancy between decreases in the amplitude of compound muscle action potential and loss of motor function caused by ischemic and compressive insults to the spinal cord. J Orthop Sci 2002; 7 (1): 102–110. doi: 10.1007/s776-002-8430-x.
14. Iwasaki H, Tamaki T, Yoshida M et al. Efficacy and limitations of current methods of intraoperative spinal cord monitoring. J Orthop Sci 2003; 8 (5): 635–642. doi: 10.1007/s00776-003-0693-z.
15. Kobayashi K, Ando K, Shinjo R et al. A new criterion for the alarm point using a combination of waveform amplitude and onset latency in Br (E) -MsEP monitoring in spine surgery. J Neurosurg Spine 2018; 29 (4): 435–441. doi: 10.3171/2018.3.SPINE171348.
16. Beňuška J, Čembová N, Naser Y et. al. Evaluation of a combination of waveform amplitude latency and decrease of waveform amplitude magnitude during spinal surgery in intraoperative neurophysiological monitoring of transcranial motor evoked potentials and its incidence on postoperative neurological deficit. Acta Chir Orthop Traumatol Cech 2020; 87 (1): 39–47.
17. Riazi S, Kraeva N, Hopkins PM. Updated guide for the management of malignant hyperthermia. Can J Anaesth 2018; 65 (6): 709–721. doi: 10.1007/s12630-018-1108-0.
18. Chong CT, Manninen P, Sivanaser V et al. Direct comparison of the effect of desflurane and sevoflurane on intraoperative motor-evoked potentials monitoring. J Neurosurg Anesthesiol 2014; 26 (4): 306–312. doi: 10.1097/ANA.0000000000000041.
19. Xiang B, Jiao S, Zhang Y et al. Effects of desflurane and sevoflurane on somatosensory-evoked and motor-evoked potential monitoring during neurosurgery: a randomized controlled trial. BMC Anesthesiol 2021; 21 (1): 240. doi: 10.1186/s12871-021-01463-x.
20. Zentner J, Kiss I, Ebner A. Influence of anesthetics – nitrous oxide in particular – on electromyographic response evoked by transcranial electrical stimulation of the cortex. Neurosurgery 1989; 24 (2): 253–256. doi: 10.1227/00006123-198902000-00016.
21. Peyton PJ, Wu CY. Nitrous oxide-related postoperative nausea and vomiting depends on duration of exposure. Anesthesiology 2014; 120 (5): 1137–1145. doi: 10.1097/ALN.0000000000000122.
22. Nimmo AF, Absalom AR, Bagshaw O et al. Guidelines for the safe practice of total intravenous anaesthesia (TIVA): Joint Guidelines from the Association of Anaesthetists and the Society for Intravenous Anaesthesia. Anaesthesia 2019; 74 (2): 211–224. doi: 10.1111/anae.14 428.
23. Adamus M, Cvachovec K, Cerny V et al. Zásady bezpečné anesteziologické péče. Anest Intenziv Med 2018; 29 (2): 107–110.
24. Sahinovic MM, Struys MMRF, Absalom AR. Clinical pharmacokinetics and pharmacodynamics of propofol. Clin Pharmacokinet 2018; 57 (12): 1539–1558. doi: 10.1007/s40262-018-0672-3.
25. Nathan N, Tabaraud F, Lacroix F et. al. Influence of propofol concentrations on multipulse transcranial motor evoked potentials. Br J Anaesth 2003; 91 (4): 493–497. doi: 10.1093/bja/aeg211.
26. Olkkola KT, Ahonen J. Midazolam and other benzodiazepines. Handb Exp Pharmacol 2008; (182): 335–360. doi: 10.1007/978-3-540-74806-9_16.
27. Sahinovic MM, Gadella MC, Shils J et. al. Anesthesia and intraoperative neurophysiological spinal cord monitoring. Curr Opin Anaesthesiol 2021; 34 (5): 590–596. doi: 10.1097/ACO.0000000000001044.
28. Valk BI, Struys MMRF. Etomidate and its analogs: a review of pharmacokinetics and pharmacodynamics. Clin Pharmacokinet 2021; 60 (10): 1253–1269. doi: 10.1007/s40262-021-01038-6.
29. Liu HY, Zeng HY, Cheng H et. al. Comparison of the effects of etomidate and propofol combined with remifentanil and guided by comparable BIS on transcranial electrical motor-evoked potentials during spinal surgery. J Neurosurg Anesthesiol 2012; 24 (2): 133–138. doi: 10.1097/ANA.0b013e31823dfb2e.
30. Kalkman CJ, Drummond JC, Ribberink AA. Effects of propofol, etomidate, midazolam, and fentanyl on motor evoked responses to transcranial electrical or magnetic stimulation in humans. Anesthesiology 1992; 76 (4): 502–509. doi: 10.1097/00000542-199204000-00003.
31. Gao M, Rejaei D, Liu H. Ketamine use in current clinical practice. Acta Pharmacol Sin 2016; 37 (7): 865–872. doi: 10.1038/aps.2016.5.
32. Andleeb R, Agrawal S, Gupta P. Evaluation of the effect of continuous infusion of dexmedetomidine or a subanesthetic dose ketamine on transcranial electrical motor evoked potentials in adult patients undergoing elective spine surgery under total intravenous anesthesia: a randomized controlled exploratory study. Asian Spine J 2022; 16 (2): 221–230. doi: 10.31616/asj.2021.0015.
33. Lam S, Nagata M, Sandhu SK et. al. Effect of ketamine on transcranial motor-evoked potentials during spinal surgery: a pilot study. Br J Anaesth 2019; 123 (6): e530–e532. doi: 10.1016/j.bja.2019.09.005.
34. Dumps C, Halbeck E, Bolkenius D. Drugs for intravenous induction of anesthesia: barbiturates. Anaesthesist 2018; 67 (7): 535–552. doi: 10.1007/s00101-018-0440-7.
35. Woodforth IJ, Hicks RG, Crawford MR et al. Depression of I waves in corticospinal volleys by sevoflurane, thiopental, and propofol. Anesth Analg 1999; 89 (5): 1182–1187.
36. Davy A, Fessler J, Fischler M et al. Dexmedetomidine and general anesthesia: a narrative literature review of its major indications for use in adults undergoing non-cardiac surgery. Minerva Anestesiol 2017; 83 (12): 1294–1308. doi: 10.23736/S0375-9393.17.12040-7.
37. Nguyen V, Tiemann D, Park E et al. Alpha-2 agonists. Anesthesiol Clin 2017; 35 (2): 233–245. doi: 10.1016/j.anclin.2017.01.009.
38. Lee WH, Park CK, Park HP et al. Effect of dexmedetomidine combined anesthesia on motor evoked potentials during brain tumor surgery. World Neurosurg 2019; 123: e280–e287. doi: 10.1016/j.wneu.2018.11.152.
39. Chen Z, Lin S, Shao W. Effects on somatosensory and motor evoked potentials of senile patients using different doses of dexmedetomidine during spine surgery. Ir J Med Sci 2015; 184 (4): 813–818. doi: 10.1007/s11845-014-1178-0.
40. Vearrier D, Grundmann O. Clinical pharmacology, toxicity, and abuse potential of opioids. J Clin Pharmacol 2021; 61 (Suppl 2): S70–S88. doi: 10.1002/jcph.1923.
41. Smith MA, Morgan M. Remifentanil. Anaesthesia 1997; 52 (4): 291–293. doi: 10.1111/j.1365-2044.1997.00085.x.
42. Iwasaki H, Tamaki T, Yoshida M et al. Efficacy and limitations of current methods of intraoperative spinal cord monitoring. J Orthop Sci 2003; 8 (5): 635–642. doi: 10.1007/s00776-003-0693-z.
43. Venkatraghavan L, Royan N, Boyle SL et al. Effect of reversal of residual neuromuscular blockade on the amplitude of motor evoked potentials: a randomized controlled crossover study comparing sugammadex and placebo. Neurol Sci 2022; 43 (1): 615–623. doi: 10.1007/s10072-021-05318-8.
44. Macdonald DB, Skinner S, Shils J et al. Intraoperative motor evoked potential monitoring – a position statement by the American Society of Neurophysiological Monitoring. Clin Neurophysiol 2013; 124 (12): 2291–2316. doi: 10.1016/j.clinph.2013.07.025.
45. Oro J, Haghighi SS. Effects of altering core body temperature on somatosensory and motor evoked potentials in rats. Spine (Phila Pa 1976) 1992; 17 (5): 498–503. doi: 10.1097/00007632-199205000-00005.
46. Carson JL, Guyatt G, Heddle NM et al. Clinical Practice Guidelines from the AABB: red blood cell transfusion thresholds and storage. JAMA 2016; 316 (19): 2025–2035. doi: 10.1001/jama.2016.9185.
47. Ruetzler K, Kurz A. Consequences of perioperative hypothermia. Handb Clin Neurol 2018; 157 : 687–697. doi: 10.1016/B978-0-444-64074-1.00041-0.
48. Li XJ, Lenke LG, Thuet E et al. Prone position-induced quadriceps transcranial motor evoked potentials signal loss – a case report. Spine Deform 2018; 6 (5): 627–630. doi: 10.1016/j.jspd.2018.02.008.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2022 Číslo 6
-
Všechny články tohoto čísla
- Pletencové svalové dystrofie
- Pokrok ve znalostech patofyziologie migrény
- Základní principy anesteziologické péče k perioperační monitoraci transkraniálních motorických evokovaných potenciálů
- Nové farmakologické možnosti v léčbě Alzheimerovy nemoci
- Role skórovacích systémů v indikaci léčby meningeomů u pacientů vyššího věku
- Validační studie a představení nového testu porozumění větám TEPO pro děti ve věku 3–8 let
- Potenciál projektivní Metody asociace barev odrážet fyziologické reakce na podněty s jiným emočním nábojem (studie PARC) – protokol studie
- Kognitivní funkce pacientů při celomozkovém ozařování pro mozkové metastázy karcinomu plic a strategie řízení radioterapie pomocí inteligentního softwaru
- Klonální hematopoéza neurčitého potenciálu při ischemické cévní mozkové příhodě – studijní protokol
- Extrapontinní centrální myelinolýza s extrapyramidovými příznaky u 14letého chlapce s PIMS-TS související s onemocněním COVID-19
- Myoklonus středního ucha jako příčina objektivního tinnitu
- Chronická zánětlivá senzitivní polyradikulopatie asociovaná s monoklonální gamapatií nejasného významu
- Hraniční koncentrace likvorového tripletu tau proteinů a beta-amyloidu 42 v diagnostice Alzheimerovy nemoci a dalších neurodegenerativních demencí
- Doporučení pro vývojovou dysfázii – verze 2022
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Doporučení pro vývojovou dysfázii – verze 2022
- Validační studie a představení nového testu porozumění větám TEPO pro děti ve věku 3–8 let
- Nové farmakologické možnosti v léčbě Alzheimerovy nemoci
- Pletencové svalové dystrofie
