Cenobamát v léčbě farmakorezistentní fokální epilepsie
Autoři:
J. Kočvarová
Působiště autorů:
Centrum pro epilepsie Brno, 1. neurologická klinika LF MU a FN u sv. Anny v Brně
Vyšlo v časopise:
Cesk Slov Neurol N 2023; 86(2): 153-154
Kategorie:
Dopis redakci
doi:
https://doi.org/10.48095/cccsnn2023153
Vážená redakce,
v ČR byl v lednu 2023 uveden na trh nový protizáchvatový léčivý přípravek (anti-seizure medication – ASM) cenobamát. Na Slovensku byl cenobamát uveden na trh v srpnu 2022. Ve Spojených státech je registrován od roku 2019 pod obchodním názvem XCOPRI®, Evropská léková agentura (European Medicines Agency; EMA) udělila cenobamátu registraci v březnu 2021 a v zemích EU je uváděn na trh pod obchodním názvem ONTOZRY®. Je indikován k přídatné léčbě fokálních záchvatů s přechodem do bilaterálních tonicko-klonických křečí nebo bez něj u dospělých pacientů s epilepsií bez adekvátní kontroly navzdory předchozí léčbě nejméně dvěma protizáchvatovými léčivými přípravky [1]. To odpovídá definici farmakorezistentní epilepsie dle International League Against Epilepsy (ILAE) [2].
Cenobamát je malá molekula s dvojím mechanizmem účinku. Jedná se o pozitivní alosterický modulátor subtypů iontového kanálu kyseliny g-aminomáselné (GABAA), který se neváže na vazebné místo benzodiazepinu. Bylo také prokázáno, že cenobamát snižuje opakované výboje neuronů vyšší inaktivací sodíkových kanálů a inhibicí perzistentní složky sodíkového proudu [1].
Doporučená počáteční dávka je 12,5 mg 1× denně perorálně, s postupnou titrací na doporučenou cílovou dávku 200 mg denně. Na základě klinické odpovědi může být dávka zvýšena na maximálně 400 mg denně (tab. 1) [1].
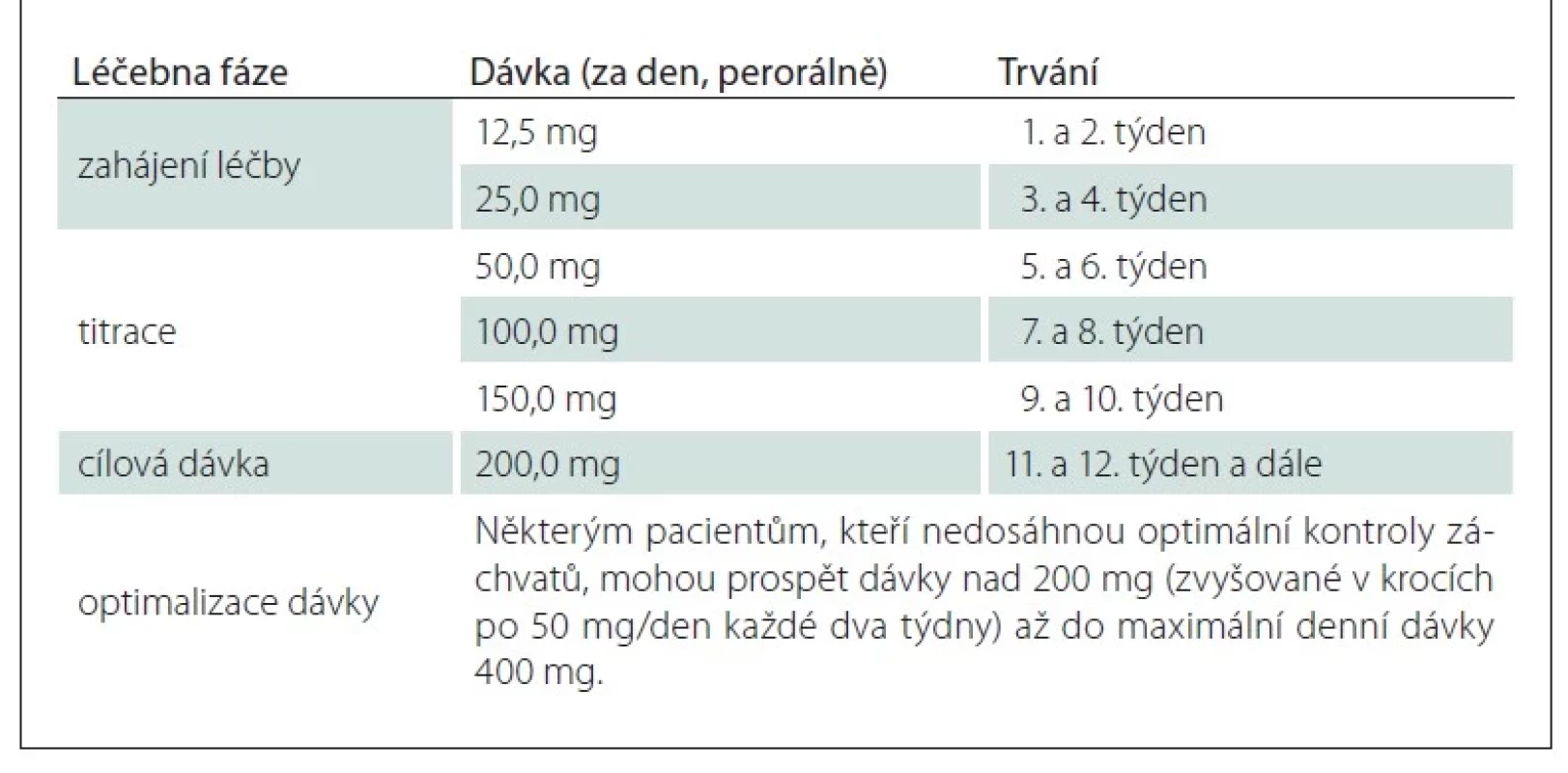
V multicentrické, randomizované placebem kontrolované klinické studii C013 u dospělých pacientů s fokálními záchvaty byla porovnávána účinnost cílové dávky 200 mg cenobamátu v přídatné léčbě ke stávající terapii. Významné odpovědi (> 50% snížení frekvence záchvatů) dosáhlo ve sledovaném období 50,4 % pacientů užívajících cenobamát v dávce 200 mg denně ve srovnání s 22,2 % pacienty, kteří užívali dosud podávanou léčbu a placebo. Celkem 28,3 % pacientů léčených 200 mg cenobamátu spolu se standardní léčbou dosáhlo během 6týdenní udržovací fáze léčby bezzáchvatovosti, ve srovnání s 8,8 % pacientů, kterým bylo k jejich standardní léčbě podáváno placebo [3].
Jiná multicentrická, dvojitě zaslepená, randomizovaná, placebem kontrolovaná studie (NCT01866111), sledující subjekty s fokálními záchvaty, hodnotila účinnost a bezpečnost cenobamátu v závislosti na dávce (100 mg, 200 mg a 400 mg denně). Během 12týdenní udržovací fáze léčby dosáhlo 11,2 % pacientů užívajících 200 mg cenobamátu denně, resp. 21,1 % pacientů užívajících 400 mg cenobamátu denně stavu bez záchvatů, oproti 1 % pacientů, kterým bylo spolu s jejich původní protizáchvatovou léčbou podáváno placebo [1,4]. Vysokou účinnost měl cenobamát u fokálních záchvatů přecházejících do bilaterálních tonicko-klonických (focal to bilateral tonic-clonic seizures; FBTCS), kdy u pacientů užívajících v přídatné léčbě 200 mg cenobamátu denně došlo k 92% redukci v mediánu 28denní frekvence takových záchvatů [5].
Osmdesát procent pacientů, kteří vstoupili do otevřeného prodloužení předchozích randomizovaných studií, zůstalo v léčbě cenobamátem po dobu nejméně 1 roku a 58 % pacientů po dobu nejméně 5 let [1].
Kolektiv kolem Josemira W. Sandera se ve své práci zabýval mimo jiné množstvím pacientů setrvávajících na léčbě. Kaplan-Meierova analýza souhrnných dat z otevřeného prodloužení klinického programu podávání cenobamátu (n = 1 844) ukázala odhadovanou kumulativní míru retence pacientů na léčbě 80 % v prvním roce a 72 % po druhém roce přídatné léčby cenobamátem. Z práce také vyplývá, že jakmile účastníci studií dosáhli udržovací fáze, bylo vysoké setrvání pacientů, kteří užívali dávku ≥ 100 mg cenobamátu denně, a konkomitantní protizáchvatová medikace neměla na dlouhodobé udržení na léčbě vliv [6].
Nejčastějšími nežádoucími účinky jsou ospalost, bolest hlavy a problémy s udržením rovnováhy. Přípravek Ontozry je kontraindikován u pacientů s vrozeným syndromem krátkého QT, což je vzácné genetické onemocnění, které může vést k náhlé maligní srdeční arytmii.
Prezentujeme případ 24leté ženy, která je cenobamátem léčena od května 2017 dosud. Léčba byla zahájena v rámci klinické studie C021.
Jedná se o jinak zdravou ženu bez perinatálních rizik. K rozvoji epilepsie došlo v 6 letech věku. Jednalo se o fokální záchvaty s poruchou vědomí bez aury (focal impaired awareness seizures; FIAS) a fokální záchvaty s přechodem do bilaterálních tonicko-klonických křečí (focal to bilateral tonic-clonic seizures; FBTCS). Frekvence záchvatů byla po většinu jejího života vysoká, 10–40 záchvatů za měsíc.
V průběhu onemocnění byla léčena řadou léků ze skupiny protizáchvatových léčiv. Jednalo se o topiramát, valproát, fenytoin, lacosamid, zonisamid, pregabalin, perampanel a retigabin.
Objektivní neurologický nález byl v normě.
MR mozku v roce 2012 prokázala mozečkovou atrofii a zesílení tloušťky kortexu v oblasti temporoparietookcipitální junkce vlevo.
V EEG byly zachyceny výboje frekvence SWC 4–6 Hz s temporoparietálním maximem více vlevo. V dubnu 2012 podstoupila stereoelektroencefalografické vyšetření pomocí intracerebrálních elektrod (SEEG) a následně byla provedena v červnu 2012 kortektomie v oblasti levostranné temporoparietookcipitální junkce.
Peroperační kortikografií byla monitorována epileptiformní abnormita i v elokventním kortexu, který nebylo možné resekovat. Histologicky nebyla zjištěna v resekovaném kortexu žádná patologie. Důvodem této skutečnosti je zmíněné šetření elokventního kortexu a pravděpodobně i odsátí části tkáně během operačního výkonu. Pooperačně došlo k vymizení FBTCS, ale FIAS se vyskytovaly nadále. V období nejlepší kompenzace měla 10–15 záchvatů za měsíc.
V roce 2013 byl implantován stimulátor bloudivého nervu (vagus nerve stimulator; VNS). Po 5 letech stimulace byla hodnocena jako nonrespondér.
V době nasazení cenobamátu byla léčena karbamazepinem 1 200 mg/den a levetiracetamem 3 000 mg/den. Frekvence záchvatů FIAS byla 30/měsíc. Užívání cenobamátu bylo zahájeno 19. 5. 2017 v dávce 12,5 mg jedenkrát denně. Každé dva týdny byla dávka navýšena postupně na 25 mg, 50 mg, 100 mg, 150 mg, 200 mg, 250 mg a 300 mg/denně. Během prvního měsíce zaznamenala 5 dní bez záchvatů, během druhého a třetího měsíce 10 a 11 dní bez záchvatů. Po navýšení dávky na 350 mg/den se objevily mírné závratě, které během 2 týdnů odezněly. Poslední záchvat zaznamenala 7. 9. 2017.
Parametry stimulace VNS ani dávky protizáchvatové medikace nebyly po celou dobu užívání cenobamátu měněny. Byly sledovány vitální funkce a monitorováno EKG. EKG křivka byla hodnocena kardiologem a nebyly shledány patologické změny. Dále byla hodnocena škála Columbia Suicide Severity Rating Scale (C-SSRS), která nevykazovala výskyt sebevražedných myšlenek. Nedocházelo ke změnám hmotnosti. V laboratorních nálezech byly sledovány krevní obraz a biochemické parametry, nebyly zaznamenány klinicky významné odchylky.
Popisujeme případ pacientky s farmakorezistentní fokální epilepsií, u které dosavadní epileptochirurgická, neurostimulační ani farmakologická léčba nevedla ke kompenzaci záchvatů. Z literatury i běžné praxe je známo, že u takových pacientů je malá pravděpodobnost, že přidáním dalšího protizáchvatového léku dojde k významnému zlepšení kontroly záchvatů. U této pacientky však došlo přidáním cenobamátu ke stávající medikaci k dosažení dlouhodobé bezzáchvatovosti. Úvodní frekvence záchvatů byla 30 FIAS za měsíc, od dávky 200 mg denně se frekvence záchvatů snižovala. Po dosažení 350 mg denně záchvaty zcela vymizely. Jediným nežádoucím účinkem byl přechodný pocit závratí na dávce 350 mg denně.
Dostupná data z randomizovaných studií i první klinické zkušenosti ukazují, že cenobamát by mohl nabídnout reálnou naději na dosažení bezzáchvatovosti i dosud farmakorezistentním pacientům.
Finanční podpora
Tato práce byla podpořena společností Angelini Pharma.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
MUDr. Jitka Kočvarová
Centrum pro epilepsie Brno
1. neurologická klinika
LF MU a FN u sv. Anny v Brně
Pekařská 53
602 00 Brno
e-mail: jitka.krizova@fnusa.cz
Přijato k recenzi: 28. 9. 2022
Přijato do tisku: 2. 3. 2023
Zdroje
1. SPC léčivého přípravku Ontozry. [online]. Dostupné z: https: //www.ema.europa.eu/en/documents/product-information/ontozry-epar-product-information_cs.pdf.
2. Kwan P, Arzimanoglou A, Berg AT et al. Definition of drug resistant epilepsy: consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies. Epilepsia 2010; 51 (6): 1069–1077. doi: 10.1111/j.1528-1167.2009.02397.x.
4. Chung SS, French JA, Kowalski J et al. Randomized phase 2 study of adjunctive cenobamate in patients with uncontrolled focal seizures. Neurology 2020; 94 (22): e2311–e2322. doi: 10.1212/WNL.0000000000009530.
5. Krauss GL, Klein P, Brandt C et al. Safety and efficacy of adjunctive cenobamate (YKP3089) in patients with uncontrolled focal seizures: a multicentre, double-blind, randomised, placebo-controlled, dose-response trial. Lancet Neurol 2020; 19 (1): 38–48. doi: 10.1016/S1474-4422 (19) 30399-0.
6. Sperling MR, Klein P, Aboumatar S et al. Cenobamate (YKP3089) as adjunctive treatment for uncontrolled focal seizures in a large, phase 3, multicenter, open-label safety study. Epilepsia 2020; 61 (6): 1099–1108. doi: 10.1111/epi.16525.
7. Sander JW, Rosenfeld WE, Halford JJ et al. Long-term individual retention with cenobamate in adults with focal seizures: pooled data from the clinical development program. Epilepsia 2022; 63 (1): 139–149. doi: 10.1111/epi.17134.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2023 Číslo 2
-
Všechny články tohoto čísla
- Současné a budoucí terapeutické možnosti léčby generalizované formy myasthenia gravis
- Standardizované a pokročilé techniky MR v diagnostice dětských nádorů mozku
- Vestibulární rehabilitace u pacientů po operaci vestibulárního schwannomu
- Změny v mozkovém objemu při monokulární slepotě s pozdním nástupem – studie volumetrického zobrazení
- Hladiny neurotrofického faktoru odvozeného od gliových buněk a nervového růstového faktoru v séru u pacientů s onemocněním COVID-19
- Srovnání metabolického profilu zdravého mozku na dvou 3T MR tomografech VIDA Siemens
- Vaskulární koridor pro implantaci stimulační elektrody do nucleus anterior thalami – experimentální studie
- Problematika posuzování invalidity po prodělané cévní mozkové příhodě
- Cenobamát v léčbě farmakorezistentní fokální epilepsie
- Roboticky asistovaná resekce presakrálního neurofibromu
- Inspirativní výročí: 60. narozeniny prof. MUDr. Ivany Štětkářové, CSc., MHA, FEAN
- Vzpomínka na neurochirurga MUDr. Jana Kremra
- Rokyta R, Fricová J, Šebková A a kol. Dětská bolest. Praha: Indigoprint 2022.
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Problematika posuzování invalidity po prodělané cévní mozkové příhodě
- Současné a budoucí terapeutické možnosti léčby generalizované formy myasthenia gravis
- Cenobamát v léčbě farmakorezistentní fokální epilepsie
- Standardizované a pokročilé techniky MR v diagnostice dětských nádorů mozku
