Ultrazvukové hodnocení substantia nigra u pacientů s parkinsonskými syndromy
Ultrasound Evaluation of Substantia Nigra in Patients with Parkinsonian Syndromes
The hyperechogenic and extended area of the substantia nigra is detectable in more than 90 % of patients with Parkinson's disease (PD). However, its maximum rate of incidence in healthy population is 10 %. The objective of our study was to detect the rate of incidence of hyperechogenic or extended substantia nigra in patients with atypical Parkinsonian syndrome (APS).
Method:
Over 15 months, we performed transcranial sonography in 209 patients with PD, multisystem atrophy (MSA), vascular Parkinsonian syndrome (VPS) and essential tremor (ET). Both PD and healthy patients were selected for the control group.
Results:
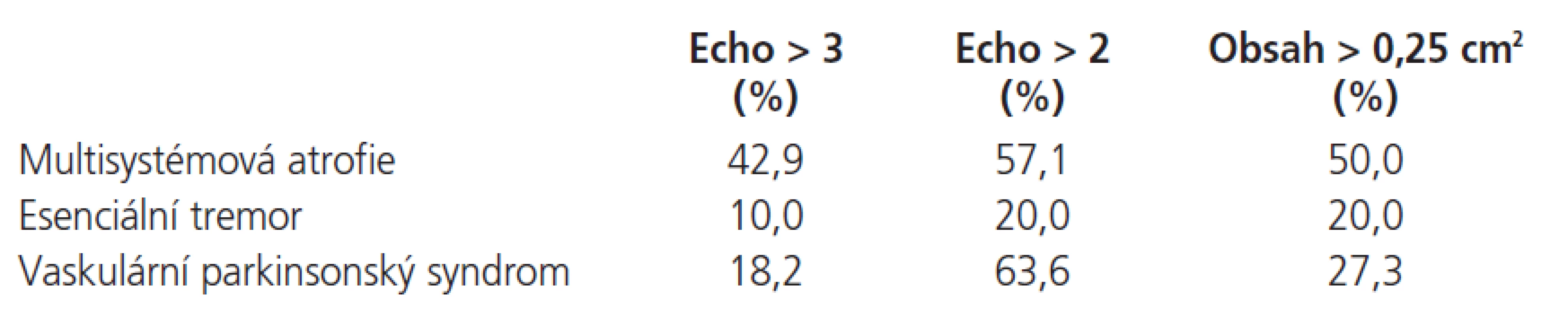
Hyperechogenic SN was detected in 42.9 % patients with MSA, in 10 % with ET and in 18.2 % with VP. The rate of incidence of extended area of SN larger than 0.25 cm2 was 50 % for patients with MSA, 20 % for patients with VPS and 27.3 % for patients with ET. The rate of incidence of the hyperechogenic, extended area of SN was significantly higher in PD patients (84.7 %) and MSA patients (50 %) (p > 0.05) as compared with VPS patients (27.3 %), ET patients (20 %) and healthy volunteers (0 %).
Conclusion:
The rate of incidence of hyperechogenic, extended area of SN is significantly higher in patients with PD and MSA. TCS detection of SN can be used as an additional method in differential diagnostics of PD and of atypical Parkinsonian syndromes.
Key words:
transcranial sonography – substantia nigra – multisystem atrophy – vascular parkinsonism – essential tremor
Autoři:
P. Bártová 1; D. Školoudík 1,2; T. Fadrná 1; P. Ressner 3; M. Bar 1; R. Herzig 2; P. Kaňovský 2
Působiště autorů:
Neurologická klinika FNsP Ostrava
1; Neurologická klinika LF UP a FN Olomouc
2; Neurologické oddělení nemocnice Nový Jičín
3
Vyšlo v časopise:
Cesk Slov Neurol N 2007; 70/103(6): 653-657
Kategorie:
Původní práce
Předneseno formou přednášky na 16th Meeting of the European Neurological Society, Lausanne, Švýcarsko, 29. 5. 2006, 21. sjezdu Slovenských a českých mladých neurologů, Martin, Slovensko, 17. 2. 2006, 6. neurosonologických dnnech v Olomouci 5. 5. 2006 a formou posteru na 10th Congress of the European Federation of Neurological Societies, Glasgow, UK 4. 9. 2006 a 10th International Congress of Parkinsons disease and Movement Disorders, Kyoto, Japonsko 2. 11. 2006.
Souhrn
Hyperechogenní a rozšířená oblast substantia nigra je detekovatelná u více než 90 % pacientů s Parkinsonovou nemocí (PN). U zdravé populace se však tento nález vyskytuje maximálně v 10 %. Cílem naším práce bylo zjistit zastoupení nálezu hyperechogenní či rozšířené substantia nigra u pacientů s atypickým parkinsonským syndromem (APS).
Metodika:
Během 15 měsíců jsme vyšetřili pomocí transkraniální sonografie 209 pacientů s PN, multisystémovou atrofií (MSA), vaskulárním parkinsonským syndromem (VP) a esenciálním tremorem (ET). Jako kontrolní skupina byli vybráni pacienti s prokázanou PN a zdraví dobrovolníci.
Výsledky:
Hyperechogenní SN byla nalezena u 42,9 % u pacientů s MSA, 10 % u ET, a 18,2 % u VP. Rozšířená oblast SN větší než 0,25 cm2 byla detekována u pacientů s MSA v 50 %, u VP ve 20 % a u ET ve 27,3 %. Hyperechogenní, rozšířená SN byla signifikantně častější u PN (84,7 %) a MSA (50 %) (p > 0,05) ve srovnání s VP (27,3 %), ET (20 %) a zdravými dobrovolníky (0 %).
Závěr:
Nález hyperechogenní, rozšířená oblast SN je signifikantně častější u pacientů s PN a MSA. TCS detekce SN může být použita jako další metoda v diferenciální diagnostice PN a atypických parkinsonských syndromů.
Klíčová slova:
transkraniální sonografie – substantia nigra – multisystémové atrofie – vaskulární parkinsonizmus – esenciální tremor
Úvod
Rozlišení mezi idiopatickou Parkinsonovou chorobou (PN) a atypickými parkinsonskými syndromy (APS) podle klinických kritérii není vždy jednoznačné, zvláště v počátečních stadiích onemocnění. [1,2]. Zobrazovací metody, především počítačovou tomografii (CT) a magnetickou rezonanci (MRI), lze využít v diferenciální diagnostice parkinsonských syndromů k detekci strukturální léze centrální nervové soustavy a vyloučení jiné příčiny poškození centrální nervové soustavy [3]. MRI mozku však často neprokazuje žádnou patologii v počátečních stadiích onemocnění, a to nejen u PN, ale také atypických parkinsonských syndromů včetně multisystémové atrofie (MSA) [1-5].
Jednofotonovou emisní tomografii (SPECT) a pozitronovou emisní tomografii (PET) lze využít u pacientů s parkinsonským syndromem k detekci funkčního postižení jader mozkového kmene, bazálních ganglií a mozečku. Avšak pro jejich obtížnou dostupnost a finanční náročnost je lze využít jen u omezeného počtu pacientů. [6,7]. Indikací pro tato vyšetření je především odlišení esenciálního tremoru od Parkinsonovy choroby, ev dalších neurodegenerativních onemocnění [8]. Senzitivita a specificita těchto vyšetření je však stále relativně nízká [6-8].
Transkraniální sonografie (TCS) je neinvazivní metodou, která dokáže zobrazit strukturální postižení nigrostriatálního systému [9-11]. První práce s průkazem hyperechogenní, rozšířené substantia nigra (SN) u pacientů s PN pomocí TCS byla publikována již v roce 1995 [9]. Etiopatogeneticky se spekuluje o porušení metabolizmu železa a dalších kovů se zvýšeným ukládáním v oblasti SN a bazálních ganglií [12,13]. Několik prací z posledních let potvrdilo, že hyperechogenní, rozšířenou oblast SN lze při TCS vyšetření detekovat u více než 88 % pacientů s PN [10,11,14,15].
Cílem naší studie bylo zhodnotit echogenitu a velikost SN u pacientů s MSA, vaskulárním parkinsonským syndromem (VP) a esenciálním tremorem (ET) ve srovnání s pacienty s PN a zdravými dobrovolníky.
Soubor a metodika
V průběhu 15 měsíců bylo do studie zařazeno celkem 202 pacientů. U 8 pacientů byla stanovena diagnóza MSA dle diagnostických kritérií dle Quina [5], u 10 pacientů diagnóza ET dle kritérií Esential tremor consortium [16] a u 11 pacientů diagnóza VP dle skóre pro vaskulární parkinsonský syndrom [17,18].
Jako kontrolní skupina (KS) bylo vybráno 111 pacientů s parkinsonovu nemocí, u kterých bylo provedeno TCS vyšetření v letech 2005-2006. Druhou KS tvořilo celkem 60 dobrovolníků bez extrapyramidové symptomatiky. Základní charakteristiky pacientů v jednotlivých skupinách a dobrovolníků uvádí tab. 1.
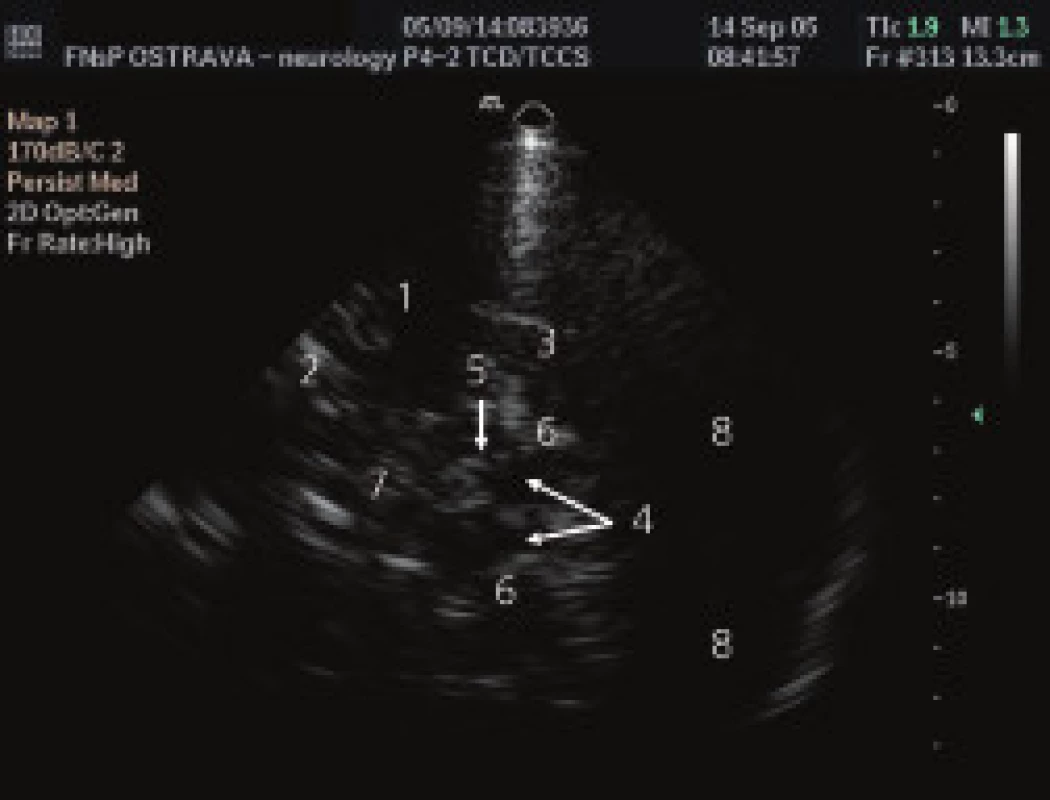
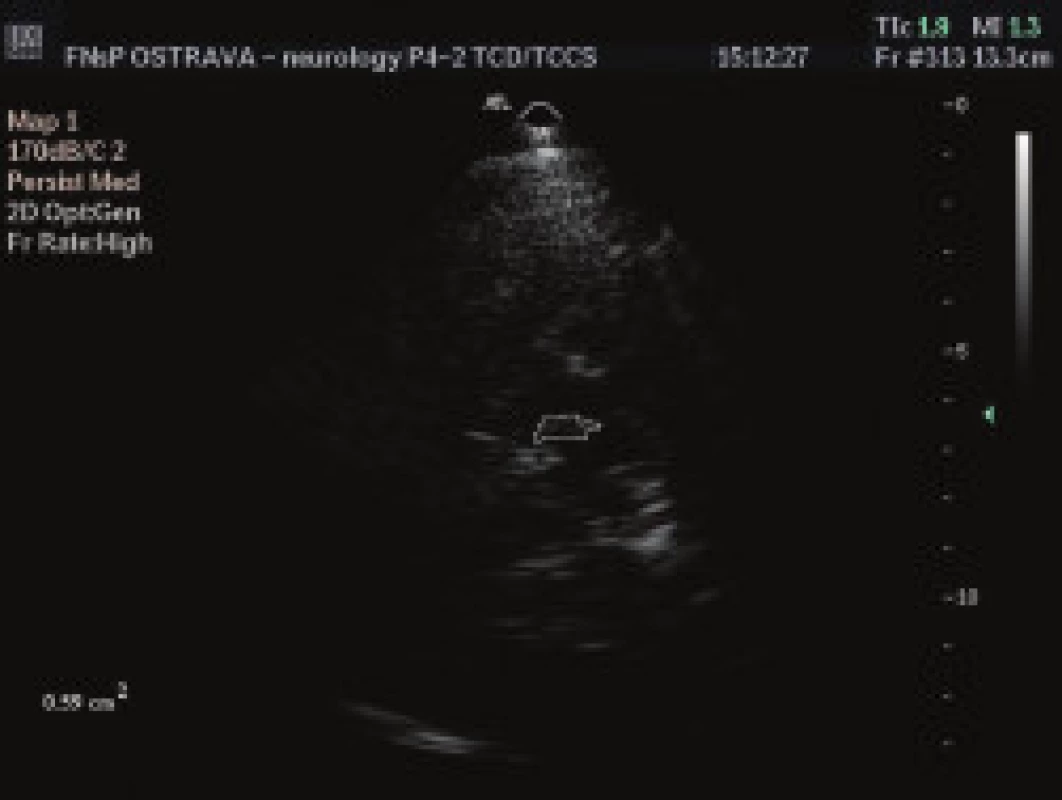
Všem pacientům bylo provedeno TCS vyšetření oblasti SN z transtemporálního přístupu (obr. 1). Vyšetření byla provedena zkušeným lékařem sonografistou, který neměl informaci o diagnóze pacientů. K ultrazvukovému vyšetření byl použit přistroj Philips HDI 5000 (Philips, Bothel , USA) se sondou 2-4 MHz (P 4-2) a penetrační hloubky 16 cm. Pro posouzení echogenity signálu sledované tkáně byla použita semikvantitativní škála – (tab. 2) [14]. Zároveň byl měřen obsah zobrazené oblasti SN pomocí programu Vista Matrix (SkillCrest LLC, Chicago, USA) (obr. 2).

Celá studie byla provedena v souladu s Helsinskou deklarací z r. 1975 (revidovanou v r. 1983) a byla schválena etickou lékařskou komisí FN.
Statistické hodnocení
Pro statistické hodnocení byly vybrány jako hraniční hodnoty echogenity stupně 2 a 3 a velikost substantia nigra 0,25 cm2. Pro statistické zpracování byly použity Mannův-Whitneyův test a Studentův t-test.
Výsledky
Do studie bylo vybráno celkem 31 pacientů s atypickým parkinsonským syndromem, z nichž 2 pacienti (6 %) byli vyřazeni pro neprostupné transtemporální okno při TCS vyšetření. Všichni pacienti byli starší 60 let. Bližší charakteristika pacientů je uvedena v tab. 1.
U všech 8 pacientů s MSA bylo klinické stadium onemocnění podle škály Hoehnové a Yahra (HY) stanoveno stupněm 3 nebo 4 a MRI mozku prokazovala atrofii kmene a striata. Rozložení klinických syndromů a odpovídavosti na L-dopu zobrazuje tab. 3.

Ve druhé skupině 11 pacientů s VP bylo klinické stadium onemocnění dle HY škála v rozmezí 2. až 4. stupně. Podle skóre pro vaskulární parkinsonský syndrom [17,18] dosáhlo 36,3 % pacientů 2 body, 54,6 % pacientů 3 body a 9,1 % pacientů 4 body. U všech pacientů s VP zobrazovací metody prokázaly difuzní vaskulární postižení centrální nervové soustavy nebo lakunární infarkty ve více oblastech (CT mozku u 36,3 % pacientů , MR mozku u 36,3 % pacientů a neurosonologické vyšetření u 27,2 % pacientů). Ischemické změny v bazálních gangliích byly detekovány u 27,3 % pacientů. Klinicky bylo postižení dolní části těla, tzv. lower body parkinsonismus, patrno u 72,6 % pacientů. U 45 % pacientů byla diagnostikovaná demence a u 81,8 % další příznaky spojené s multiinfarktovým postižením CNS jako anxieta, posturální tremor, cerebelární syndrom, pyramidové jevy či hemiatetóza. U 18,2 % byl parkinsonský syndrom podobný Parkinsonově chorobě s částečnou odpovídavostí na L-dopu.
Třetí skupinou pacientů byl o 12 pacientů s esenciálním tremorem. Všichni pacienti měli progresivní průběh onemocnění, oboustranný posturální tremor horních končetin, u 30 % i tremor hlavy. Rodinný výskyt esenciálního tremoru byl u 30 % pacientů a u 50 % byl přítomný pozitivní alkoholový test se zmírněním tremoru. Byly vyloučeny jiné příčiny tremoru při ložiskových změnách mozku (dle CT a MRI vyšetření), endokrinní či psychické příčiny.
Porovnání echogenity a velikosti SN v jednotlivých skupinách ukazuje tab. 4. Zastoupení echogenity vyšší než 2 a zároveň rozšíření obsahu SN nad 0,25 cm2 v jednotlivých skupinách ve srovnání s pacienty s PN a zdravými dobrovolníky ukazuje tab. 5.

Diskuse
U pacientů s PN a atypickým parkinsonským syndromem lze detekovat pomocí TCS rozšířenou, hyperechogenní SN [10,11,14]. U pacientů s PN lze pomocí TCS detekovat hyperechogenní, rozšířenou SN ve více než 88 % případů [10,11,14]. U parkinsonských syndromů je hyperechogenní, rozšířená SN detekovatelná u podstatně menšího procenta pacientů [1,2] .V našem souboru u MSA pacientů byla detekovaná hyperechogenní (>3) v 42,9 % a středně echogenní (3) u 14,2 % pacientů. Rozšířená oblast SN nad 0,25 cm2 byla detekován u 50 % pacientů. Behnke et al nalezli také hyperechogenní SN u 25 % pacientů s MSA, středně echogenní SN pak u dalších 37,5 %. U většiny těchto pacientů byl detekován také hyperechogenní nucleus lentiformis [1,2].
Výsledek nálezu hyperechogenní, rozšíření SN u pacientů s ET v naší studii byl pouze u 20 %, což nebylo významně odlišné od nálezů ve zdravé populaci, kde je udáván výskyt hyperechogenní, rozšíření SN v 8–10 % [12,13]. Signifikantní rozdíl v echogenitě SN u pacientů s ET nenalezli ani Niehaus et al [15].
V našem souboru pacientů s VP byla hyperechogenní SN (>3} detekována v 18,2 % případů a středně echogenní SN (3) u 45,4 % pacientů. V dostupných literárních zdrojích jsme zatím nenalezli jinou práci studující TCS nálezy u pacientů s VP.
Přesná příčina hyperechogenity a rozšíření SN u PN a parkinsonských syndromů zatím není známa. Výsledky výzkumů post mortem na zvířecích modelech uvádějí souvislost s metabolizmem železa a jeho ukládáním v SN. Je možné, že i u parkinsonských atypických syndromů, jako je MSA a VP, je hyperechogenní rozšířená SN způsobena tímto mechanizmem. Důvody, proč u těchto atypických parkinsonských syndromů vznikají různé poruchy metabolizmu železa, budou předmětem dalších výzkumů. Zvažuje se také možnost příčin neurální degenerace v oblasti SN a souvislost této degenerace s působením toxických expozic, jako jsou pesticidy, těžké kovy, nebo poraněním bazálních ganglií, ev vliv oxidativního stresu [12,13]. Autoři spekulují také možný vliv pouhé atrofie jádra SN.
U pacientů s PN je prokázána určitá závislost velikosti hyperechogenní SN na délce trvání choroby, tíži onemocnění a věku pacientů. Vzhledem k omezenému počtu pacientů s APS jsme v našem souboru tyto faktory zatím nehodnotili.
Je třeba zmínit také omezení naší studie. Sonografické vyšetření uvedených struktur je závislé na erudici vyšetřujícího a kvalitě transkraniálního kostního okna. Pomocí TCS lze detekovat také další mozkové struktury a jejich změny u pacientů s APS, např. echogenitu nucleus lentiformis, nucleus caudatus, talamu a velikost 3. komory, které pak slouží k rozlišení dalších neurodegenerativních a heredodegenerativních onemocnění, jako je multisystémová atrofie, progresivní supranukleární paralýza, kortikobazální degenerace, Huntingtonova choroba a další [5]. Hodnocení jiných struktur než SN jsme zatím vzhledem k omezenému počtu pacientů neprováděli. Omezený počet pacientů v naší pilotní studii je významný z hlediska potenciální chyby sledovaných výsledků. V budoucnu je nutné ověřit tyto výsledky ve větším souboru pacientů.
Závěr
Pomocí TCS lze detekovat hyperechogennní, rozšířenou SN u pacientů s APS. U pacientů s MSA a VP se tento patologický nález na rozdíl od pacientů s ET vyskytuje častěji než v běžné populaci. Hyperechogenní SN se v současné době jeví jako marker indikující strukturální postižení SN. Sonografické vyšetření může v budoucnu přispět k diferenciální diagnostice atypických parkinsonských syndromů a Parkinsonovy choroby.
Přijato k recenzi: 12. 4. 07
Přijato do tisku: 23. 5. 07
MUDr. Petra Bártová
Neurologická klinika FN Ostrava
tř. 17. listopadu 1790
708 52 Ostrava
email: petrabartova@seznam.cz
Zdroje
1. Behnke S, Berg D, Naumann M, Becker G. Differentiation of Parkinson’s disease and atypical parkinsonian syndromes by transcranial ultrasound. J Neurol Neurosurg Psychiatry 2005; 76 : 423–425.
2. Walter U, Niehaus L, Probst T, Benecke R, Meyer BU, Dressler D. Brain parenchyma sonography discriminates Parkinson’s disease and atypical parkinsonian syndromes. Neurology 2003; 60 : 74–77.
3. Schrag A, Good CD, Miszkiel K, Morris HR, Mathias CJ, Lees AJ et al. Differentiation of Atypical Parkinsonian Syndromes with Routine MRI. Neurology 2000; 54 : 697–702.
4. Růžička E, Roth J, Kaňovský P, Sekyrová M, Urgošík D, Vladyka V. Parkinsonova nemoc a parkinsonské syndromy. Praha: Galén 2000 : 118–165.
5. Gilman S, Low P, Quinn N, Albanese A, Ben-Shlomo Y, Fowler C et al. Consensus statement on the diagnosis of multiple system atrophy. American Autonomic Society and American Academy of Neurology. Clinical Auton Res 1998; 8 : 359–362.
6. Brucke T, Asenbaum S, Pirker W, Djamshidian S, Wenger S, Wober C et al. Measurement of the Dopaminergic Degeneration in Parkinson’s Disease with [123I]-CIT and SPECT: Correlation with Clinical Findings and Comparison with Multiple System Atrophy and Progressive Supranuclear Palsy. J Neural Transmit 1997; 50(Suppl.): 9–24.
7. Booij J, Speelman JD, Horstink MW, Wolters EC. The Clinical Benefit of Imaging Striatal Dopamine Transporters with [123I]FP-CIT SPECT in Differentiating Patients with Presynaptic Parkinsonism from those with Other Forms of Parkinsonism. Eur J Nuclear Med 2001 Mar; 28 : 266–272.
8. Asenbaum S, Pirker W, Angelberger P, Bencsits G, Pruckmayer M, Brucke T. [123I] beta-CIT and SPECT in Essential Tremor and Parkinson’s Disease. J Neural Transm 1998; 105 : 1213–1228.
9. Becker G, Berg D. Neuroimaging in basal ganglia disorders: perspectives for transcranial ultrasound. Mov Disord 2001; 16 : 23–32.
10. Berg D, Becker G, Zieler B, Tucha O, Hofman E, Preier M et al. Vulnerability of the nigrostriatal system as detected by transcranial ultrasound. Neurology 1999; 53 : 1026–1031.
11. Becker G, Seufert J, Bogdahn U, Reichmann H, Reiners K. Degeneration of substantia nigra in chronic Parkinson´s disease visualized by transcranial color-coded real-time sonography. Neurology 1995; 45 : 182–184.
12. Berg D, Grote C, Rausch WD, Maurer M, Wesemann W, Riederer P et al. Iron accumulation of the substantia nigra in rats visualized by ultrasound. Ultrasound Med Biol 1999; 25 : 901–904.
13. Berg D, Roggendorf W, Schroder U, Klein R, Tatschner T, Benz P et al. Echogenicity of substantia nigra association with increased iron content and marker for susceptibility to nigrostriatal injury. Arch Neurol 2002; 59 : 999–1005.
14. Ressner P, Školoudík D, Kaňovský P. Echogenita substantia nigra u Parkinsonovy nemoci - pilotní studie. Ces Slov Neurol N 2006; 102 : 376–379.
15. Niehaus L, Savyer N, Weber U, Hertel R, Trottenberg T, Kupsch A. Brain parenchyma sonography in patients with essential tremor and Parkinson´s disease. Cerebrovasc Dis 2004; 17(Suppl 4): 3 [abstract].
16. Jankovic J. Essencial Tremor: clinical characteristics. Neurology 2000; 54 (Suppl 4): S21-S5.
17. Thanvi B, Lo N, Robinson T. Vascular parkinsonism - an important cause of parkinsonism in older people. Age and Ageing 2005; 34 : 114–119.
18. Demirkiran M, Bozdemir H, Sarica Y. Vascular Parkinsonism: a distinct, heterogenous clinical entity. Acta Neurol Scand 2001; 104 : 63–67.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2007 Číslo 6
-
Všechny články tohoto čísla
- Obrna lícního nervu
- Elektrofyziologické vyšetření lícního nervu
- Protilátky proti glykokonjugátům v diagnostice autoimunitních neuropatií
- 5 let činnosti Národní referenční laboratoře lidských prionových onemocnění při Oddělení patologie a molekulární medicíny FTNsP: naše zkušenosti a přehled literatury
- Klinický pohled na výpočetní tomografii u akutní ischemie mozku
- Ultrazvukové hodnocení substantia nigra u pacientů s parkinsonskými syndromy
- Porovnání výsledků vyšetření zrakových evokovaných potenciálů u pacientů s roztroušenou sklerózou a neuroboreliózou
- Kognitívne evokované potenciály – vlna P300 u pacientov so sclerosis multiplex: vzťah k forme ochorenia, somatickému postihnutiu a kvalite života
- Relabující-remitující roztroušená skleróza a oligoklonální pruhy v průběhu léčby modifikující průběh choroby
- Mozková žilní trombóza u uživatelek hormonální antikoncepce
- Úspěšné použití jediné otázky pro screening syndromu neklidných nohou v České republice
- Závisí vývoj dysfunkce mikce u roztroušené sklerózy na typu neurologické léčby?
- Poruchy polykání ve vztahu k vertebrogenním dysfunkcím
- Centrální neurocytom: kazuistika a přehled literatury
- Gelastické záchvaty u hypotalamického hamartomu: kazuistika
- Dercumova choroba (lipomatosis dolorosa) – zriedkavo diagnostikované ochorenie: kazuistika
- Poúrazová porucha čichu: kazuistiky
- K šedesátinám doc. MUDr. Martina Bojara, CSc.
-
Směruje použití mediánu ke statistickým neparametrickým postupům zpracování dat?
Okénko statistika – Analýza dat v neurologii – III.
Nebojme se mediánu a robustních statistik - Webové okénko
-
Analýza dat v neurologii VI.
Přesnost, spolehlivost a reprodukovatelnost měření u diskrétních dat
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Obrna lícního nervu
- Poruchy polykání ve vztahu k vertebrogenním dysfunkcím
- Protilátky proti glykokonjugátům v diagnostice autoimunitních neuropatií
- Dercumova choroba (lipomatosis dolorosa) – zriedkavo diagnostikované ochorenie: kazuistika
