Spontánní intrakraniální hypotenze
Spontaneous intracranial hypotension
Spontaneous intracranial hypotension (SIH) is a disease in which headache is the main symptom. Recently, it has become an important part of the broad differential diagnosis of causes of headache. Advances in understanding of pathophysiology, indication of proper imaging modalities, and expansion of microsurgical techniques contributed to increased recognition of the disease. Young patients in productive age commonly suffer from SIH, and it might negatively influence both their social and professional life. Therefore, it is of great importance to recognize the symptoms of the disease and treat it properly. The aim of our article is to provide a review of the pathogenesis, current recommendations for the diagnosis and therapy of SIH. A report of a typical case should support our effort.
Keywords:
spontaneous intracranial hypotension – orthostatic headache – cerebrospinal fluid leakage – epidural blood plug
Autoři:
H. Zítek 1; M. Stratilová 1; T. Radovnický 1; A. Sejkorová 1; L. Hofmann Klzo 2,3; M. Sameš 1
Působiště autorů:
Neurochirurgická klinika FZS UJEP, a KZ, a. s. – Masarykovy nemocnice, v Ústí nad Labem, o. z.
1; Radiologická klinika FN Hradec, Králové
2; Radiodiagnostické oddělení KZ, a. s. –, Nemocnice Teplice, o. z.
3
Vyšlo v časopise:
Cesk Slov Neurol N 2022; 85(1): 18-23
Kategorie:
Přehledný referát
doi:
https://doi.org/10.48095/cccsnn202218
Souhrn
Spontánní intrakraniální hypotenze (SIH) je onemocnění, jehož hlavním příznakem je bolest hlavy. V posledních letech zaujala důležité místo v široké diferenciální diagnostice příčin tohoto symptomu. Přispívají k tomu také pokroky, kterých bylo dosaženo při pochopení patofyziologie, zpřesnění diagnostiky a rozšíření terapeutických možností tohoto onemocnění. SIH často postihuje mladé pacienty v produktivním věku a může vést k významnému narušení jejich sociálního i pracovního života. Její rozpoznání a správná léčba tak mají jistě velký význam. V tomto referátu přehledně shrnujeme pohled na patogenezi SIH, současné postupy a doporučení v diagnostice a terapii této nemoci, podpořené typickou kazuistikou.
Klíčová slova:
spontánní intrakraniální hypotenze – ortostatická bolest hlavy – průsak mozkomíšního moku – epidurální krevní zátka
Úvod
Spontánní intrakraniální hypotenze (SIH) patří celosvětově mezi poddiagnostikované jednotky v rámci široké diferenciální diagnostiky bolestí hlavy. Onemocnění poprvé popsal kontroverzní německý neurolog Georges Schaltenbrand v roce 1938 a nazval ho hypoliquorrhea, tedy názvem vyjadřujícím nedostatečný objem mozkomíšního moku, což je patofyziologickou podstatou nemoci [1]. Příčinou sníženého objemu moku je v drtivé většině případů jeho únik defektem v míšních obalech. Spontánní intrakraniální hypotenze se dominantně projevuje ortostatickou bolestí hlavy ve spojení s typickými znaky na magnetické rezonanci mozku a páteře, které jsou zásadní ke stanovaní správné diagnózy.
Cílem naší práce je prezentovat odborné veřejnosti základní znaky, patofyziologii, aktuálně uznávané možnosti diagnostiky a terapie tohoto onemocnění. Vše podpoříme případem jedné naší pacientky.
Incidence
SIH patří mezi vzácné, ale poddiagnostikované onemocnění, jehož incidence se pohybuje kolem 5 na 100 000 obyvatel/rok. Průměrný věk manifestace je 40–50 let [2].
Klinický obraz
Charakteristickým znakem SIH je ortostatická bolest hlavy. Pacienti většinou udávají cefaleu především ve druhé polovině dne. Typickým je u pacientů rychlý nástup potíží, třetina pacientů udává jako spouštěč namáhavou fyzickou aktivitu, kašel, chiropraktickou manipulaci [3,4]. U některých pacientů při delším trvání SIH dochází ke změně charakteru cefaley, kdy z typicky ortostatické se postupně stává bolest nezávislá na poloze pacienta [5]. K této změně typu cefaley došlo i u naší pacientky.
Konkomitantní příznaky jsou tinnitus, závratě, sluchová porucha (pocit jako pod vodou), nauzea, zvracení, meningismus, diplopie či případně jiné potíže se zrakem. Vzácněji se může vyskytnout galaktorea, frontotemporální demence, parestezie horních končetin nebo hyposenzitivita tváře. Ve velmi vzácných případech se může vyskytnout transtentoriální a transforaminální herniace, porucha vědomí nebo kóma [2,5].
Patofyziologie
U sníženého objemu likvoru, který je u SIH dán únikem moku v oblasti páteřního kanálu, dochází k poklesu mozku kaudálním směrem, což vede k trakci nociceptivních struktur, jakými jsou meningy, mozkové a mozečkové cévy a některé hlavové nervy. Ortostatický charakter potíží je dán poklesem mozku ve směru gravitačních sil při změně polohy pacienta. Trakce kraniálních nervů způsobuje symptomy, jakými jsou diplopie (n. abducens) a hypestezie (n. trigeminus) nebo vestibulo-kochleární příznaky, za které může především změna tlaku v perilymfě [6].
SIH je primárně onemocněním páteře. Nejčastější příčinou je únik moku v oblasti přechodu krční a hrudní páteře, který lokálně nezpůsobuje žádné klinické obtíže [2,7]. Příčinu úniku moku lze patofyziologicky rozdělit do čtyř kategorií [3]:
- longitudinální durální trhlina;
- meningeální divertikl;
- přímá likvoro-venózní fistula;
- nedeterminovaná kategorie.
Nejčastější příčinou úniku moku je longitudinální durální trhlina velikosti do 10 mm. U tohoto typu malý diskogenní kostní úlomek nacházející se ve ventrální části kanálu působí jako ostrý hrot poškozující míšní pleny [8]. Meningeální divertikl způsobuje únik moku ve 20–42 % případů. Locus resistentiae minoris pro vznik symptomatického divertiklu je oblast nervového kořene s durální dehiscencí a skrz ni prolabující arachnoideou [3]. Výše uvedené příčiny úniku moku se mohou vyskytovat i u zdravých jedinců, kterým nezpůsobují žádné obtíže, proto je nelze standardně zařadit do diagnostiky SIH jako patognomické [3]. Likvoro-venózní fistula je způsobena přímým propojením pouzdra nervového kořene s periradikulárními žilami. Je považována za nejméně častou příčinu SIH, ale její incidence roste se zlepšující se diagnostikou [3].
Diagnostika
Diagnostická kritéria pro bolesti hlavy spojené s intrakraniální hypotenzí obsahuje Mezinárodní klasifikace bolestí hlavy (The International Classification of Headache Disorders; ICHD-3) (tab. 1). V případě spontánní intrakraniální hypotenze není v anamnéze prokázána intervence či trauma schopné způsobit únik mozkomíšního moku (MM) [4].
![Diagnostická kritéria dle ICHID-3 [4].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image_pdf/3c3bd8fb4f9d32a6338452323f312e9b.jpg)
V praxi se diagnostika kromě typického klinického obrazu opírá o změření tlaku mozkomíšního moku lumbální punkcí v horizontální poloze a o baterii grafických vyšetření.
Lumbální punkce
Dle ICHD-3 je kritériem pro diagnózu tlak MM pod 60 mm H20. Tlak je typicky měřen lumbální punkcí v horizontální poloze. Je však opakovaně prokazováno, že pacienti s intrakraniální hypotenzí mají normální, nebo dokonce zvýšené hodnoty tlaku [9,10]. Ukazuje se tak, že tlak vyšší než 60 mm H20 by neměl být záminkou k vyloučení tohoto onemocnění, jelikož jde o vyšetření značně nespecifické.
Radiodiagnostika
Grafická vyšetření při SIH lze dle jejich indikace rozdělit do dvou skupin. První skupinou jsou vyšetření, která mají diagnózu SIH potvrdit, či vyvrátit (CT mozku, MR mozku a páteře). Druhou skupinou jsou vyšetření myelografická, která jsou invazivnější a zaměřená na přesnou lokalizaci úniku MM (CT myelografie, MR myelografie, digitální subtrakční myelografie).
CT mozku
Nativní CT mozku nebývá při SIH průkazné. Pouze v případě pokročilé fáze onemocnění mohou být viditelné bilaterální subdurální kolekce, které však mohou vyvolat podezření v případě nízkého věku pacienta a absence kraniotraumatu v anamnéze [7,11,12].
MR mozku a páteře
Magnetická rezonance mozku a páteře je stěžejní a sensitivní diagnostickou metodou u SIH. Až 83 % pacientů vykazuje abnormality na MR mozku. Grafický nález je úzce spjatý s patofyziologií onemocnění. Dle Monro-Kellieho doktríny je intrakraniální objem tvořený mozkem, MM a krví konstantní a při poklesu objemu jedné složky dochází ke kompenzačnímu zvýšení objemu složky jiné [13]. V případě poklesu objemu MM u SIH tak dojde ke kompenzačnímu zvýšení objemu intrakraniální krve, a to především v oblasti tvrdé pleny [12]. Typickým a častým znakem je tedy difuzní hladké pachymeningeální sycení po podání gadolinia supratentoriálně, infratentoriálně a v oblasti krční páteře (obr. 1). Tento znak se vyskytuje až u 80–83 % pacientů s klinickým obrazem SIH [2,14]. Na podobném principu hrazení ztraceného objemu také dochází k rozšíření žilních splavů. Farb et al prokázali vysokou specificitu i sensitivitu nálezu tzv. znaku žilní distenze, tedy konvexního zakřivení sagitálního průřezu dominantního transverzálního splavu u pacientů s intrakraniální hypotenzí [15]. Stejně tak dochází k překrvení v oblasti hypofýzy, které imituje její zvětšení [16].
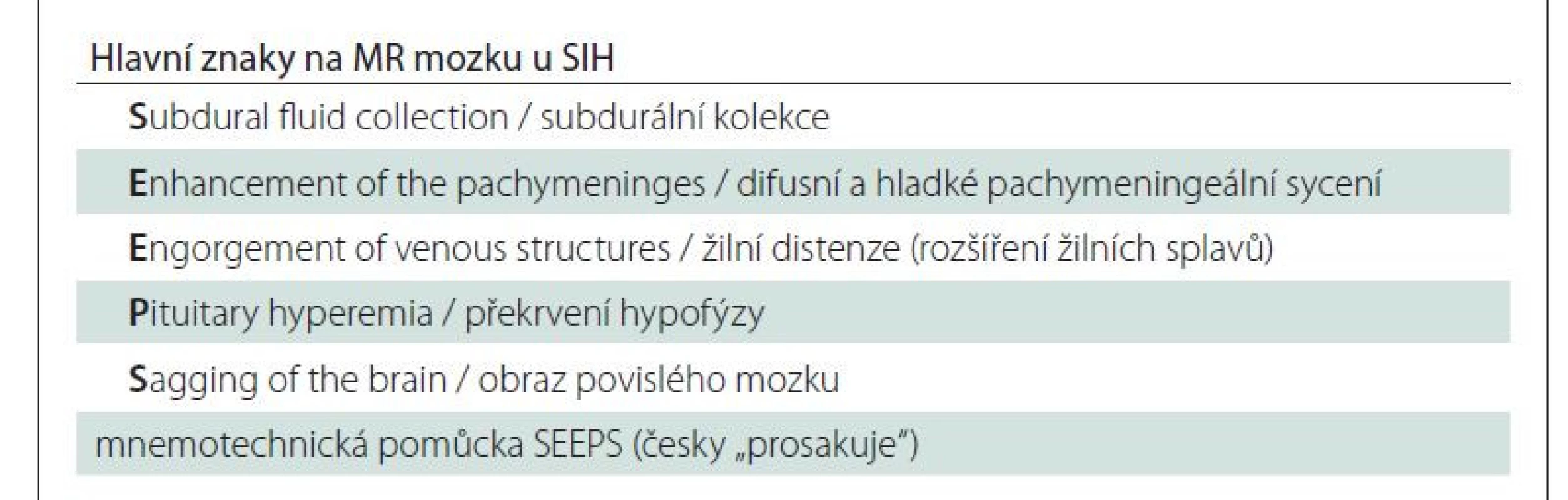
Fig. 1. Brain MRI contrast-enhanced T1-weighted image showing
diffuse pachymeningeal enhancement.
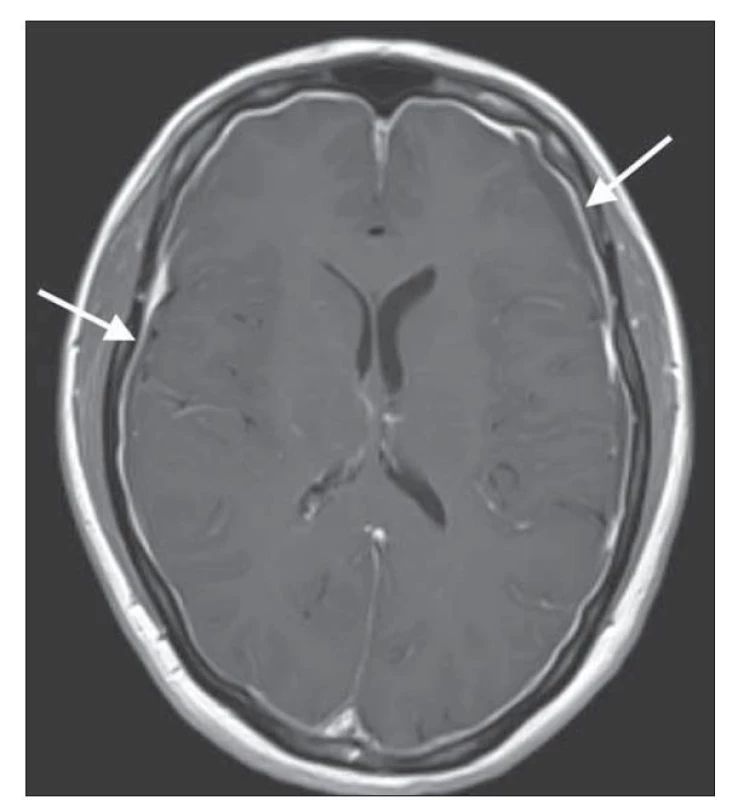
Další skupina znaků na MR přímo souvisí s typickým obrazem tzv. povislého mozku (sagging brain), což je vyjádření pro nález kaudálně posunutých bazálních struktur mozku a mozkového kmene na sagitálním zobrazení, často ve spojení se zúžením komorového systému (obr. 3) [11]. Obraz povislého mozku se vyskytuje až u 72 % pacientů [14].
Fig. 2. Brain MRI with bilateral subdural collections.
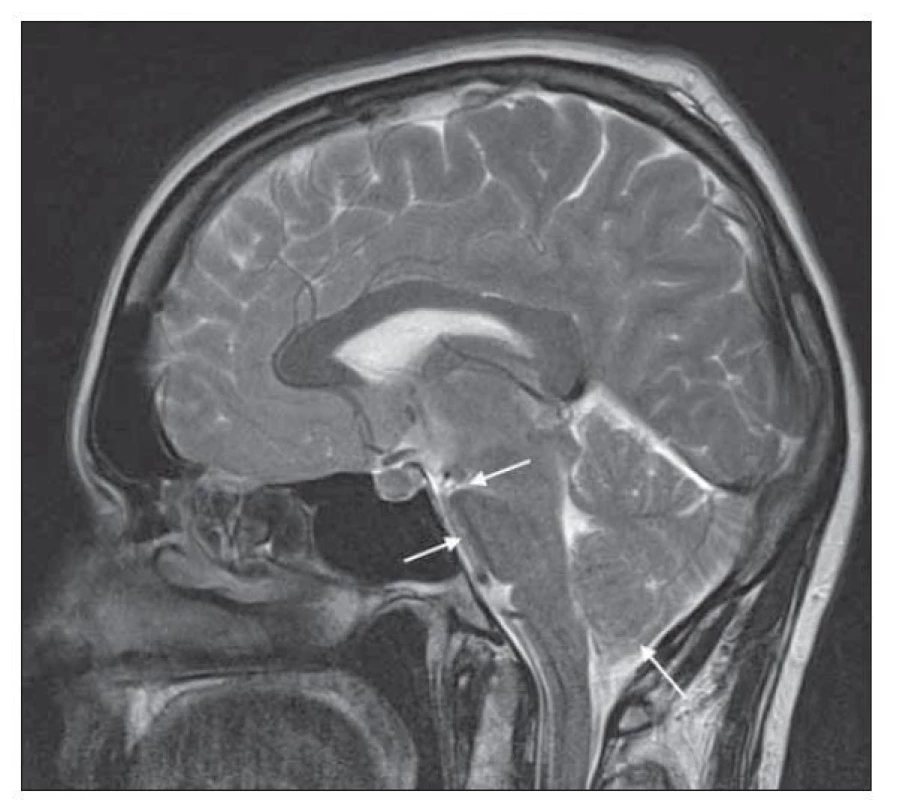
Fig. 3. T2-weighted brain MRI with bilateral subdural collections.
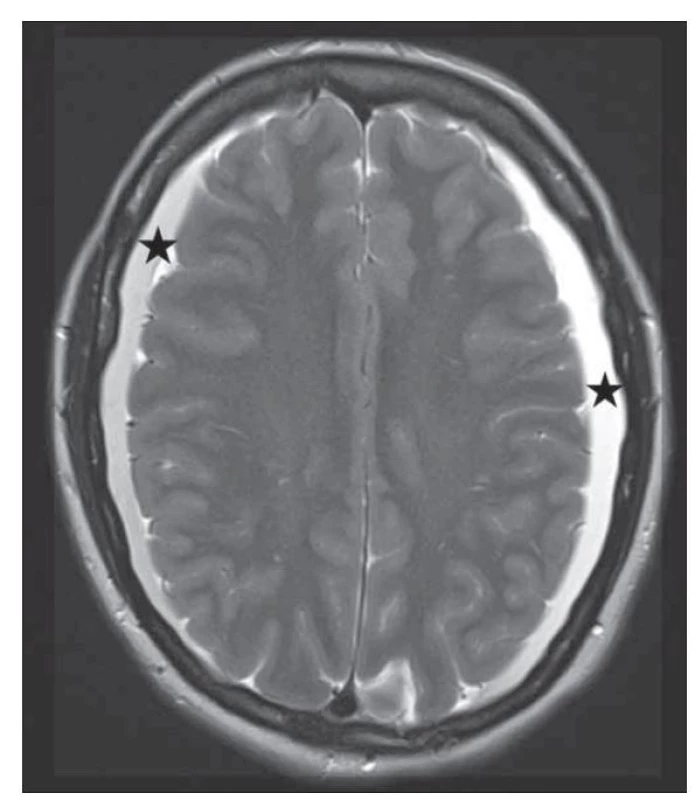
MR mozku také dobře prokáže subdurální kolekce jak nad konvexitami mozku, tak i v oblasti infratentoriální (obr. 2). Složení kolekcí může graficky odpovídat likvoru nebo mohou obsahovat příměs krve vlivem krvácení z dilatovaných cév tvrdé pleny či přemosťujících žil. Subdurální kolekce jsou až v 90 % oboustranné [17].
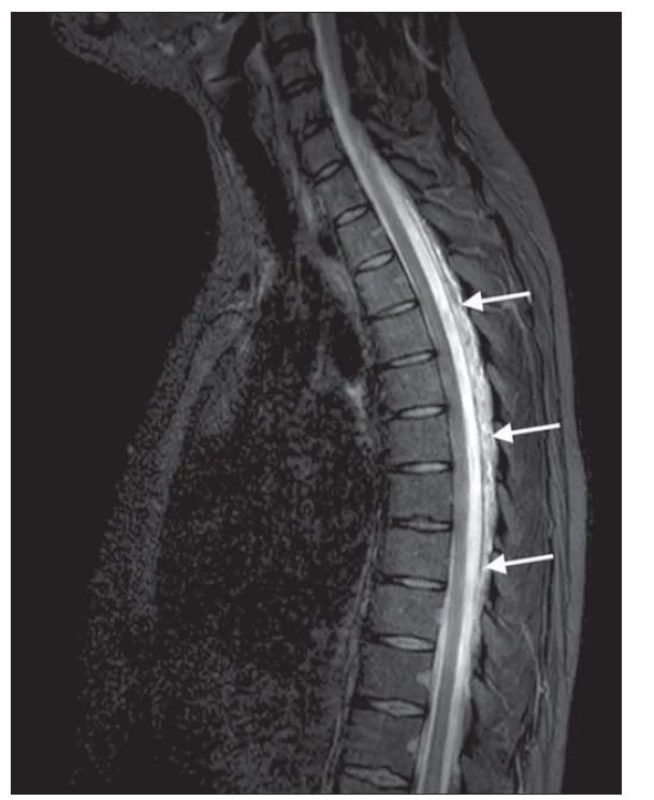
MR celé páteře patří stejně jako MR mozku mezi základní zobrazovací metody, které mohou potvrdit diagnózu SIH. Hlavním nálezem patrným u pacientů se SIH je longitudinální extradurální kolekce (obr. 4). Bývá nejčastěji lokalizována v cervikothorakální oblasti a její kraniokaudální rozsah pravděpodobně souvisí s mírou úniku MM defektem. Větší defekty tak vedou k rozsáhlejším kolekcím přes mnoho segmentů [12]. V publikovaných sériích byla epidurální kolekce diagnostikována v 67–100 % [18–20].
Fig. 4. T2-weighted STIR spine MRI showing dorsal longitudinal
epidural fluid collection at the level of T2 -10.
Myelografie
Účelem myelografických vyšetření je objasnit lokalizaci úniku MM extradurálně. V současnosti se prosazují dvě varianty myelografie, a to CT myelografie (konvenční či dynamická) a digitální subtrakční myelografie.
CT myelografie a dynamická
CT myelografie
CT myelografie bývá považována za zlatý standard a metodu první volby při lokalizaci průsaku MM [21]. Metoda umožňuje prokázat velkou většinu úniků likvoru. Musí být zajištěna zvýšená poloha lumbální oblasti oproti hlavě pomocí vhodného podložení, a to buď v pronační poloze, nebo v poloze na boku. Při vyšetření musí být dodržena co nejkratší doba mezi aplikací kontrastní látky a pořízením zobrazení. Avšak v případě výrazně vysokoprůtokových úniků často nelze jejich přesné místo nalézt i přes minimální prodlevu. Důvodem je časné vyrovnání koncentrace kontrastní látky mezi intradurálním a extradurálním prostorem [12,22]. Řešení nabízí technika dynamické CT myelografie. Při té je kontrastní látka aplikována těsně před pořízením obrazu přímo v CT gantry a akvizice jsou pořízeny v různém časovém odstupu, dokud není odhalen únik MM. Nevýhodou tohoto vyšetření je však nemalá radiační zátěž [22–25].
Digitální subtrakční myelografie
Digitální subtrakční myelografie (DSM) je dynamické vyšetření, které umožňuje zachycení i místa vysokoprůtokového úniku MM. Díky fluoroskopickému stolu lze pacienta snadno napolohovat do Trendelenburgovy polohy, a umožnit tak rozlití kontrastu kraniálně od místa aplikace v bederní oblasti. Díky subtrakci lze tuto metodu dobře využít i při diagnostice likvoro-venózní fistuly, a to především v poloze na boku. Nevýhodou této metody je obtížná prostorová orientace, interference stínu ramen s případným místem defektu a nutnost eliminace dýchacích pohybů pacienta [26,27]
Dle současných doporučení tedy u pacientů s podezřením na SIH zahajujeme diagnostiku MR mozku s kontrastní látkou. Při nálezu typických znaků na MR mozku je vhodné doplnit MR celé páteřní osy v sagitálních a koronárních rovinách, která může odhalit longitudinální epidurální kolekce nebo meningeální divertikly. Tato vyšetření spolu s klinickým obrazem postačí k vyslovení diagnózy SIH. K přesnému určení místa průsaku moku jsou pak určena myelografická vyšetření. U pacientů s longitudinální kolekcí a podezřením na ventrální únik likvoru se osvědčuje (dynamická) CT myelografie či DSM v pronační poloze. U pacientů s podezřením na laterální průsak pak v poloze na boku. Pokud není nalezena longitudinální kolekce a je tedy suspekce na likvoro-venózní fistulu, tak je vhodná DSM [3].
Terapie
Možnosti léčby u SIH jsou tři, a to konzervativní terapie, aplikace epidurální krevní zátky a chirurgická terapie. Ukazuje se, že efektivita terapie s trváním příznaků klesá, a proto není na místě s jejím zahájením otálet, a to ani v případě invazivních metod [3].
Konzervativní terapie
Konzervativní léčba zahrnuje klid na lůžku, analgetika, zvýšený příjem tekutin a zvýšený příjem kofeinu (např. 2× 200 mg p.o.) jako podpory tvorby MM. V literatuře je často zmiňováno, že u velké části případů SIH dojde ke spontánnímu ústupu pouze vlivem klidového režimu na lůžku. K tomuto opatření se uchyluje většina pacientů, jelikož jim přináší úlevu, avšak jeho výrazná efektivita nebyla prokázána a neexistuje ani doporučení jeho trvání před přistoupením k dalším možnostem [11,28].
Epidurální krevní zátka
Vzhledem k často opožděné diagnostice bývá čas určený ke konzervativní terapii vyčerpán a na řadu přichází aplikace epidurální krevní zátky. Mechanizmus jejího efektu se zdá být dvojí. Prvním je přímá okluze místa úniku MM krevním koagulem a druhým je vyplnění epidurálního prostoru a snížení compliance durálního vaku, který posune tlakový gradient MM kraniálně. Technik aplikace autologní krve pacienta do epidurálního prostoru bylo popsáno několik. Pro svou jednoduchost je pravděpodobně nejpoužívanější metoda slepé epidurální zátky, která spočívá v aplikaci krve epidurálně v oblasti bederní páteře, a to jedno-, dvou - nebo víceetážově. Výhodou je absence potřeby znát přesnou lokalizaci úniku likvoru. Slepou aplikaci lze dále zpřesnit fluoroskopickou či CT navigací, která může také zajistit rozprostření zátky přes delší úsek páteře [23]. Neexistují jasná doporučení ohledně objemu aplikované krve. V publikacích se objem zátky pohybuje mezi 10–50 ml [3,11] a v některých souborech i přes 100 ml. Někteří autoři uvádí, že horní limit je dominantně určen subjektivními obtížemi pacienta při aplikaci a že vyšší objem vede k lepšímu efektu. V našem případě byl aplikován celkový objem 70 ml ve dvou dobách, aplikace byla ukončena právě na základě bolestí zad a hýždí pacientky. Alternativou ke slepé zátce je pak cílená aplikace zátky, která však vyžaduje znalost místa průsaku MM. Názory na efektivitu obou metod se v literatuře různí. Existují práce, které nenašly rozdíl v účinnosti [29], ale i práce s opačným výsledkem [30]. V obou případech by měl následovat klidový režim v horizontální či Trendelenburgově poloze po dobu 24 h [3]. Alternativou ke krevní zátce je potom cílená zátka tvořená fibrinovým lepidlem nebo kombinací krve a lepidla [23].
Chirurgická terapie
I přes opakované aplikace krevní zátky přetrvávají symptomy u 10–64 % pacientů [8,12]. V těchto případech musí být maximalizována snaha o přesnou lokalizaci úniku MM, která je podmínkou k úspěšné chirurgické léčbě. Její technika se odvíjí od příčiny durálního defektu. Většinu z nich lze řešit z dorsálního přístupu po provedení hemilaminektomie [31]. V případě nejhůře dostupného ventrálního durálního defektu způsobeného kostním úlomkem lze provést jeho extirpaci a přímou suturu transdurálním přístupem po transcizi ligamentum denticulatum. Meningeální divertikl lze podle lokálního nálezu řešit podvazem či klipem, při komplexnějším nálezu pak wrappingem nebo podvazem obětovatelného kořene či augmentací krytí hemostatickým materiálem nasáklým pacientovou krví [32,33]. V případě likvoro-venózní fistuly lze uplatnit aplikaci klipu a recentně byla publikována i endovaskulární embolizace Onyxem [34,35]. Beck at al publikovali soubor 47 operovaných pacientů se SIH, z nichž u 96 % došlo ke zlepšení ortostatických symptomů, 9 % utrpělo přechodné neurologické zhoršení a 13 % bylo revidováno z důvodu pooperačního hematomu, pooperační bolest nebo trvající průsak MM.
Na základě současného poznání je tedy terapie zahájena konzervativní léčbou, u které však neexistují jasné údaje o efektivitě ani doporučeném trvání. Lze říct, že u pacientů, u kterých trvají symptomy více než několik týdnů, již nemají konzervativní postupy valný smysl, a mělo by se tak v terapii přistoupit k aplikaci epidurální krevní zátky. Bez ohledu na znalost přesného místa úniku MM je doporučeno začít slepou jedno - nebo víceetážovou aplikací zátky vzhledem k nenáročnosti jejího provedení a dobré efektivitě. Pokud nedojde ke zlepšení, může být po asi 5 dnech aplikace zopakována. V případě, že selžou 2–3 zátky, lze přistoupit k cílené aplikaci zátky přímo do místa zjištěného průsaku nebo k chirurgickému výkonu [2,11,36].
Subdurální kolekce
U pacientů se SIH s významnými subdurálními kolekcemi může nesprávná interpretace MR nálezu a neuvážená drenáž vést k sestupné herniaci, a tím způsobit závažné komplikace. Navíc recidiva kolekce u pacienta se SIH bez terapeutického managementu úniku MM je velmi pravděpodobná, takže případné evakuaci hematomu by měla předcházet aplikace epidurální krevní zátky či chirurgické řešení durálního defektu [7]. V našem případě došlo ke spontánnímu vymizení kolekcí vlivem úspěšné aplikace epidurální krevní zátky.
Kazuistika
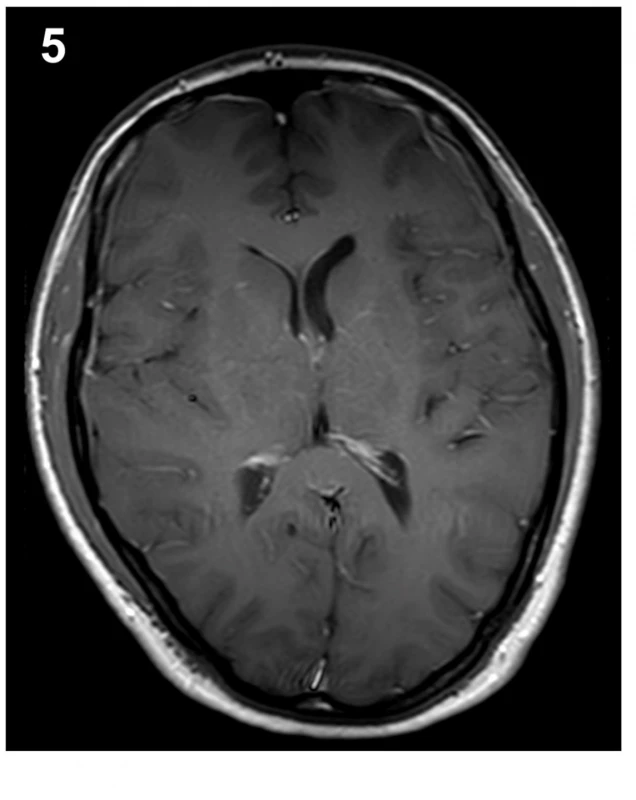
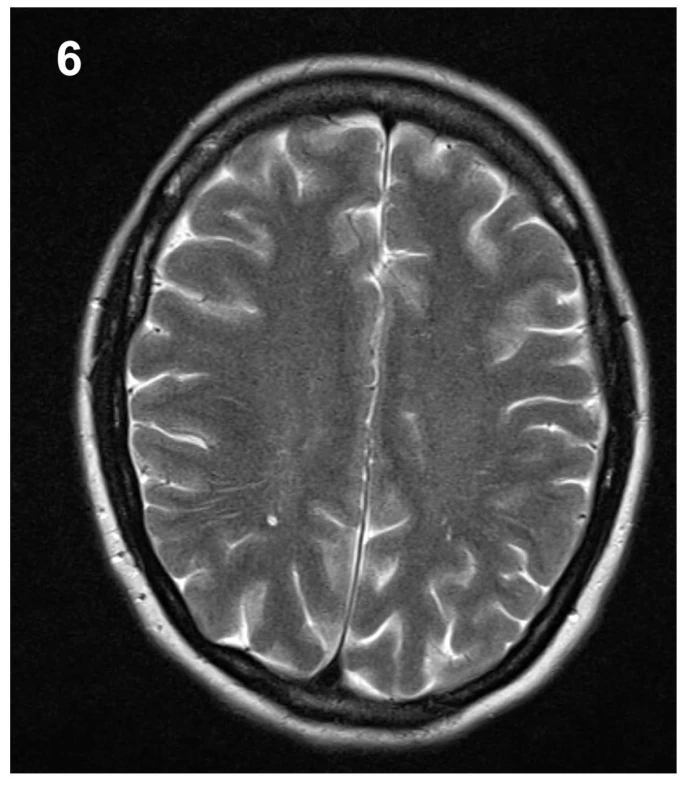
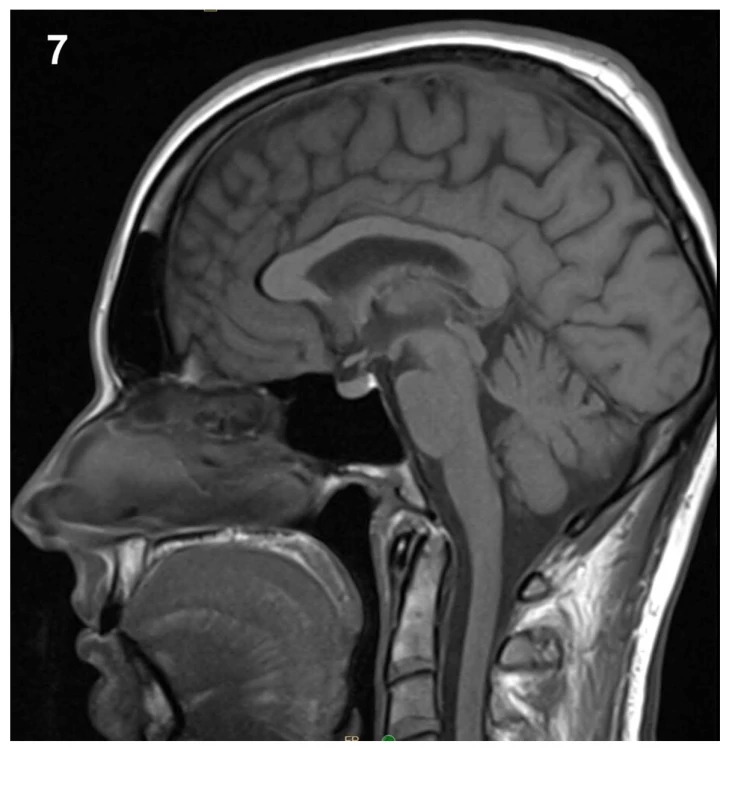
37letá pacientka přišla pro 4 dny trvající a náhle vzniklé vysilující bolesti hlavy, progredující při vertikalizaci. Pacientka přitom popřela jakékoliv kraniotrauma v poslední době, jen v týdnu před počátkem obtíží popsala úder padající větví do zad. Fyzikální vyšetření ukázalo na meningeální dráždění ve spojení s foto - a fonofobií a po vstupním CT mozku bez popsané patologie byla pacientka hospitalizována na infekčním oddělení se suspektní neuroinfekcí. Zánětlivá formule v likvoru po lumbální punkci nalezena nebyla, avšak další podrobné cytologické a imunologické vyšetření likvoru vyslovilo podezření na neuroboreliózu se známkami autoimunitní reakce. Následná cílená antibiotická terapie v kombinaci s analgetiky však nevedly k významnému ústupu obtíží. Necelý měsíc od počátku symptomů byla provedena MR mozku a krční páteře, jejímž dominantním nálezem bylo difuzní hladké sycení mening mozku a krční míchy, symetrické oboustranné subdurální kolekce a pokles intrakraniálního obsahu (obr. 1–3). Trvající obtíže a grafický nález tak vedly k podezření na obraz intrakraniální hypotenze. U pacientky časem došlo k vývoji obtíží v podobě výraznější cefaley, která již byla bez vazby na polohu, rozostřeného vidění, vertiga a nauzey doprovázené zvracením. Při očním vyšetření nebyla prokázána akutní nitrooční patologie. Ve shodě s dostupnou literaturou byla na našem pracovišti zahájena terapie nejprve pomocí režimových opatření, jako jsou klid na lůžku, dostatečná hydratace, přísun kofeinu. Tato opatření však nevedla ke kýženému efektu, a proto byla necíleně aplikována epidurální krevní zátka v prostoru L4/5 užitím 40 ml autologní krve, o 6 dní později byla tato procedura v prostoru L3/4 zopakována, tentokrát s aplikací 30 ml autologní krve. Limitací aplikovaného objemu byly bolesti v bederní oblasti či dolních končetinách. Za hospitalizace došlo ke zmírnění obtíží a pacientka mohla být propuštěna domů. Na plánované kontrolní MR mozku 5 měsíců od dimise bylo prokázáno vymizení grafických známek intrakraniální hypotenze, vč. ústupu sycení mening i poklesu intrakraniálního obsahu (obr. 5–7). Subjektivně pacientka taktéž popsala plnou úlevu od obtíží a byla schopna návratu do zaměstnání.
Závěr
Svou incidencí nepatří SIH mezi častá onemocnění, avšak svojí patofyziologií, klinickým obrazem, a především typickými radiologickými znaky přináší zajímavou alternativu v široké diferenciální diagnostice bolestí hlavy, u které lze úspěšně nabídnout kauzální léčbu pacientům v produktivním věku.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem práce nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
MUDr. Hynek Zítek
Neurochirurgická klinika
FZS UJEP a KZ, a.s. – Masarykovy
nemocnice v Ústí nad Labem, o.z.
Sociální péče 3316/12A
401 13 Ústí nad Labem
e-mail: hynek.zitek@kzcr.eu
Přijato k recenzi: 6. 12. 2021
Přijato do tisku: 2. 2. 2022
Na webu csnn.eu naleznete kazuistiku k tomuto článku.
Zdroje
1. Schaltenbrand G. Neuere Anschauungen zur Pathophysiologie der Liquorzirkulation. Zentralbl Neurochir 1938; 3 : 290–300.
2. Schievink WI. Spontaneous spinal cerebrospinal fluid leaks and intracranial hypotension. Jama 2006; 295(19): 2286–2296. doi: 10.1001/jama.295.19.2286.
3. Beck J, Häni L, Ulrich CT et al. Diagnostic challenges and therapeutic possibilities in spontaneous intracranial hypotension. Clin Transl Neurosci 2018; 2(2): 2514183X1878737. doi: 10.1177/2514183X18787371.
4. Headache classification committee of the International Headache Society (IHS) the international classification of headache disorders, 3rd edition. Cephalalgia 2018; 38(1): 1–211. doi: 10.1177/0333102417738202.
5. Mokri B. Spontaneous low pressure, low CSF volume headaches: spontaneous CSF leaks. Headache 2013; 53(7): 1034–1053. doi: 10.1111/head.12149.
6. Paldino M, Mogilner AY, Tenner MS. Intracranial hypotension syndrome: a comprehensive review. Neurosurg Focus 2003; 15(6): ECP2.
7. Ducros A, Biousse V. Headache arising from idiopathic changes in CSF pressure. Lancet Neurol 2015; 14(6): 655–668. doi: 10.1016/S1474-4422(15)00015-0.
8. Beck J, Ulrich CT, Fung C et al. Diskogenic microspurs as a major cause of intractable spontaneous intracranial hypotension. Neurology 2016; 87(12): 1220–1226. doi: 10.1212/WNL.0000000000003122.
9. Kranz PG, Tanpitukpongse TP, Choudhury KR et al. How common is normal cerebrospinal fluid pressure in spontaneous intracranial hypotension? Cephalalgia 2016; 36(13): 1209–1217. doi: 10.1177/0333102415623071.
10. He FF, Li L, Liu MJ et al. Targeted epidural blood patch treatment for refractory spontaneous intracranial hypotension in China. J Neurol Surg B Skull Base 2018; 79(3): 217–223. doi: 10.1055/s-0037-1606312.
11. Mokri B. Spontaneous intracranial hypotension. Continuum (Minneap Minn) 2015; 21(4 Headache): 1086–1108. doi: 10.1212/CON.0000000000000193.
12. Kranz PG, Gray L, Malinzak MD et al. Spontaneous intracranial hypotension: pathogenesis, diagnosis, and treatment. Neuroimaging Clin N Am 2019; 29(4): 581–594. doi: 10.1016/j.nic.2019.07.006.
13. Monro A. Observations on structure and functions of the nervous system. Lond Med J 1783; 4(2): 113–135.
14. Watanabe A, Horikoshi T, Uchida M et al. Diagnostic value of spinal MR imaging in spontaneous intracranial hypotension syndrome. AJNR Am J Neuroradiol 2009; 30(1): 147–151. doi: 10.3174/ajnr.A1277.
15. Farb RI, Forghani R, Lee SK et al., The venous distension sign: a diagnostic sign of intracranial hypotension at MR imaging of the brain. AJNR Am J Neuroradiol 2007; 28(8): 1489–1493. doi: 10.3174/ajnr.A0621.
16. Mokri B. Spontaneous cerebrospinal fluid leaks: from intracranial hypotension to cerebrospinal fluid hypovolemia – evolution of a concept. Mayo Clin Proc 1999; 74(11): 1113–1123. doi: 10.4065/74.11.1113.
17. Takahashi K, Mima T, Akiba Y. Chronic subdural hematoma associated with spontaneous intracranial hypotension: therapeutic strategies and outcomes of 55 cases. Neurol Med Chir (Tokyo) 2016; 56(2): 69–76. doi: 10.2176/nmc.oa.2015-0032.
18. Rabin BM, Roychowdhury S, Meyer JR et al. Spontaneous intracranial hypotension: spinal MR findings. AJNR Am J Neuroradiol 1998; 19(6): 1034–1039.
19. Tsai PH, Fuh JL, Lirng JF et al. Heavily T2-weighted MR myelography in patients with spontaneous intracranial hypotension: a case-control study. Cephalalgia 2007; 27(8): 929–934. doi: 10.1111/j.1468-2982.2007.01376.x.
20. Chiapparini L, Farina L, D´Incerti L et al. Spinal radiological findings in nine patients with spontaneous intracranial hypotension. Neuroradiology 2002; 44(2): 143–150. doi: 10.1007/s002340100685.
21. Wendl CM, Schambach F, Zimmer C et al. CT myelography for the planning and guidance of targeted epidural blood patches in patients with persistent spinal CSF leakage. AJNR Am J Neuroradiol 2012; 33(3): 541–544. doi: 10.3174/ajnr.A2808.
22. Kranz PG, Luetmer PH, Diehn FE et al. Myelographic techniques for the detection of spinal CSF leaks in spontaneous intracranial hypotension. AJR Am J Roentgenol 2016; 206(1): 8–19. doi: 10.2214/AJR.15.14884.
23. Urbach H. Intracranial hypotension: clinical presentation, imaging findings, and imaging-guided therapy. Curr Opin Neurol 2014; 27(4): 414–424. doi: 10.1097/WCO.0000000000000105.
24. Dobrocky T, Mosimann PJ, Zibold F et al. Cryptogenic cerebrospinal fluid leaks in spontaneous intracranial hypotension: role of dynamic CT myelography. Radiology 2018; 289(3): 766–772. doi: 10.1148/radiol.2018180732.
25. Urbach H, Fung C, Dovi-Akue P et al. Spontaneous intracranial hypotension. Dtsch Arztebl Int 2020; 117(27–28): 480–487. doi: 10.3238/arztebl.2020.0480.
26. Farb RI, Nicholson PJ, Peng PW et al. Spontaneous intracranial hypotension: a systematic imaging approach for CSF leak localization and management based on MRI and digital subtraction myelography. AJNR Am J Neuroradiol 2019; 40(4): 745–753. doi: 10.3174/ajnr.A6016.
27. Hoxworth JM, Trentman TL, Kotsenas AL et al. The role of digital subtraction myelography in the diagnosis and localization of spontaneous spinal CSF leaks. AJR Am J Roentgenol 2012; 199(3): 649–653. doi: 10.2214/AJR.11.8238.
28. Amrhein TJ, Kranz PG. Spontaneous intracranial hypotension: imaging in diagnosis and treatment. Radiol Clin North Am 2019; 57(2): 439–451. doi: 10.1016/j.rcl.2018.10.004.
29. Ahn C, Lee E, Lee JW et al. Two-site blind epidural blood patch versus targeted epidural blood patch in spontaneous intracranial hypotension. J Clin Neurosci 2019; 62 : 147–154. doi: 10.1016/j.jocn.2018.11.039.
30. Cho KI, Moon HS, Jeon HJ et al. Spontaneous intracranial hypotension: efficacy of radiologic targeting vs blind blood patch. Neurology 2011; 76(13): 1139–1144. doi: 10.1212/WNL.0b013e318212ab43.
31. Beck J, Raabe A, Schievink WI et al. Posterior approach and spinal cord release for 360 degrees repair of dural defects in spontaneous intracranial hypotension. Neurosurgery 2019; 84(6): E345–E351. doi: 10.1093/neuros/nyy312.
32. Cohen-Gadol AA, Mokri B, Piepgras DG et al. Surgical anatomy of dural defects in spontaneous spinal cerebrospinal fluid leaks. Neurosurgery 2006; 58 (4 Suppl 2): 238–245. doi: 10.1227/01.NEU.0000204712.16099.FB.
33. Schievink WI, Morreale VM, Atkinson JL et al. Surgical treatment of spontaneous spinal cerebrospinal fluid leaks. J Neurosurg 1998; 88(2): 243–246. doi: 10.3171/jns.1998.88.2.0243.
34. Schievink WI, Moser FG, Maya MM et al. Digital subtraction myelography for the identification of spontaneous spinal CSF-venous fistulas. J Neurosurg Spine 2016; 24(6): 960–964. doi: 10.3171/2015.10.SPINE15855.
35. Brinjikji W, Savastano LE, Atkinson JLD et al. A novel endovascular therapy for CSF hypotension secondary to CSF-venous fistulas. AJNR Am J Neuroradiol 2021; 42(5): 882–887. doi: 10.3174/ajnr.A7014.
36. Davidson B, Nassiri F, Mansouri A et al. Spontaneous intracranial hypotension: a review and introduction of an algorithm for management. World Neurosurg 2017; 101 : 343–349. doi: 10.1016/j.wneu.2017.01.123.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2022 Číslo 1
-
Všechny články tohoto čísla
- Prof. MUDr. Zdeněk Kadaňka, CSc., osmdesátiletý
- Analytické a preanalytické aspekty stanovení lehkých řetězců neurofilament v biologických tekutinách
- Komentář k článku autorů Fialová et al Analytické a preanalytické aspekty stanovení lehkých řetězců neurofilament v biologických tekutinách
- Spontánní intrakraniální hypotenze
- Novinky v liečbe hlbokou mozgovou stimuláciou pri neurologických ochoreniach
- Editorial
- Poruchy čichu po transnazálních endoskopických operacích adenomu hypofýzy
- Výsledky chirurgické terapie meralgia paresthetica 15 pacientů
- Test-retest hodnocení spolehlivosti čichového testu (Odorized Markers Test)
- Česká verze nástroje Mini-BESTest a doporučení pro jeho klinické použití
- Validace české jazykové verze dotazníků DN4 a PainDetect pro diagnostiku neuropatické bolesti
- Vliv fluoxetinu na obnovu funkční nezávislosti u pacientů po akutní ischemické cévní mozkové příhodě a prognostické faktory
- Sakrální deaferentace a implantace sakrálního neurostimulátoru u pacienta s transverzální míšní lézí
- Lokalizovaná neurofibromatóza typu 1 v mozaice
- Anémie z nedostatku železa vykazující progresivní retinální, kochleární a cerebrální trombózu
- Vícečetná tumoriformní ložiska mozku jako první projev demyelinizačního onemocnění
- Cerebrální hyperperfuzní syndrom – vzácná komplikace revaskularizačního výkonu
- Poděkování recenzentům
- Dilatace skalpu podkožními expandéry před sekundární počítačově modelovanou kranioplastikou z porózního polyethylenu
- Zemřel doc. MUDr. Vilibald Vladyka, CSc.
- Zemřela doc. MUDr. Miluše Havlová, CSc.
- Odešel prim. MUDr. Hanuš Baš, CSc.
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Vícečetná tumoriformní ložiska mozku jako první projev demyelinizačního onemocnění
- Spontánní intrakraniální hypotenze
- Novinky v liečbe hlbokou mozgovou stimuláciou pri neurologických ochoreniach
- Analytické a preanalytické aspekty stanovení lehkých řetězců neurofilament v biologických tekutinách