Extrémna hypertrofia periférnych nervových štruktúr pri CIDP – kazuistika
Extreme Hypertrophy of Peripheral Neuronal Structures in CIDP – a Case Study
Chronic inflammatory demyelinating polyradiculoneuropathy (CIDP) is an autoimmune peripheral nerve disease characterized by flaccid quadriparesis with loss of sensitivity and possible damage to cranial nerves. The diagnosis of CIDP nay involve electromyography (EMG), cerebrospinal fluid analysis, nerve biopsy, magnetic resonance imaging (MRI) of peripheral nerves and the clinical response to immunosuppression and/or immunomodulation. MRI facilitates early detection of nerve hypertrophy. In our case report we present an unusual CIDP with extreme hypertrophy of the peripheral nerves and spinal roots.
Key words:
chronic inflammatory demyelinating polyradiculoneuropathy – hypertrophy – magnetic resonance imaging
Autoři:
J. Michalik 1; E. Kurča 1; M. Hladká 2; B. Hofericová 1; V. Nosáľ 1; M. Grofik 1; E. Kantorová 1; M. Adámková 1
Působiště autorů:
JLF UK a UN Martin
Neurologická klinika
1; JLF UK a UN Martin
Rádiologická klinika
2
Vyšlo v časopise:
Cesk Slov Neurol N 2011; 74/107(1): 72-75
Kategorie:
Kazuistika
Souhrn
Chronická zápalová demyelinizačná polyradikuloneuropatia (chronic inflammatory demyelinating polyradiculoneuropathy, CIDP) predstavuje autoimunitné ochorenie periférneho nervového systému charakterizované obyčajne chabou kvadruparézou spojenou s poruchou povrchovej aj hlbokej citlivosti a možným postihnutím kraniálnych nervov. Okrem klinického obrazu sa v diagnostike CIDP používa elektromyografia (EMG), vyšetrenie cerebrospinálneho likvoru, biopsia nervu, vyšetrenie periférnych nervových štruktúr magnetickou rezonanciou (MR) a posúdenie vývoja klinického stavu vo vzťahu k použitej imunosupresívnej a imunomodulačnej liečbe. MR vyšetrenie umožňuje včasnú detekciu hypertrofie periférnych nervových štruktúr, ktorá nie je zriedkavá. V našej kazuistike predstavujeme prípad CIDP s ojedinelou hypertrofiou periférnych nervových štruktúr extrémnych rozmerov.
Klíčová slova:
chronická zápalová demyelinizačná polyneuropatia – hypertrofia – magnetická rezonancia
Úvod
Chronická zápalová demyelinizačná polyradikuloneuropatia (CIDP) je súčasťou skupiny imunitne podmienených demyelinizačných alebo demyelinizačne-axonálnych polyneuropatií s chronickým priebehom. Na patogenéze CIDP sa spolupodieľa aberantná celulárna a humorálna imunitná odpoveď cielená proti antigénom periférnych nervových štruktúr s ich následnou perivaskulárnou a intersticiálnou infiltráciou zápalovými T bunkami a makrofágmi. Dôsledkom inflamácie je segmentálna demyelinizácia periférnych nervových štruktúr spolu s možným zánikom axónov a ložiskovými nekrózami tkaniva, ale aj procesy remyelinizácie a patologickej reaktívnej hypertrofie. Stanovenie diagnózy CIDP je dôležité, nakoľko klinický obraz CIDP je rôznorodý a neexistuje jednoznačný biologický marker tejto nozologickej jednotky, ktorá je ale potenciálne terapeuticky ovplyvniteľná imunosupresívnymi a imunomodulačnými postupmi.
Epidemiológia, klinický obraz, pomocné vyšetrenia a liečba
CIDP postihuje mužov a ženy v pomere približne 2 : 1. Jedná sa o ochorenie všetkých vekových skupín. Najčastejšie vzniká CIDP medzi 50. a 60. rokom života, pričom asi 10 % z celkového počtu prípadov začína v detskom veku.
Klinický obraz obyčajne pozostáva z pomaly progredujúceho (najmenej dva mesiace) proximálneho aj distálneho zmiešaného symetrického kvadrupoškodenia v zmysle chabej periférnej obrny a asociovanej poruchy citlivosti pre všetky kvality s možným poškodením hlavových nervov a zároveň bez poškodenia zvieračov. Okrem uvedeného typického klinického obrazu CIDP poznáme aj atypické formy CIDP a diagnózu vylučujúce klinické okolnosti.
Z pomocných vyšetrení zohráva kľúčovú úlohu v diagnostike CIDP elektrofyziológia. Cieľom elektroneurografických kondukčných štúdií (distálne latencie, rýchlosť vedenia motorickými a senzitívnymi vláknami, charakteristika F odpovedí, kondukčné bloky, temporálna disperzia CMAP, trvanie distálnych CMAP) je preukázanie najmenej jedného ložiska presvedčivej demyelinizácie. Dve ložiská demyelinizácie spolu so zodpovedajúcim klinickým obrazom postačujú podľa kritérií EFNS k definitívnej diagnóze CIDP [1]. K podporným pomocným vyšetreniam radíme:
- vyšetrenie likvoru s nálezom proteinocytologickej disociácie;
- MR vyšetrenie periférnych nervových štruktúr s obrazom hypertrofie a ich možným patologickým sýtením po podaní gadolínia;
- biopsia nervu s nálezom demyelinizačných a remyelinizačných zmien a možným úbytkom axónov.
V 10 % prípadov je hypertrofia periférnych nervov detegovateľná klinickým vyšetrením aspekciou a palpáciou. MR vyšetrením je možné detegovať hypertrofiu periférnych nervových štruktúr až v 50 % pacientov, a to obzvlášť v prípadoch s dlhotrvajúcim priebehom ochorenia. Jedná sa o hypertrofiu miechových koreňov, brachiálneho a lumbosakrálneho plexu, kraniálnych, interkostálnych a ďalších periférnych nervov. Hypertrofiu cervikálnych miechových koreňov je možné zistiť aj ultrazvukovým vyšetrením (UZ) [2]. Biopsia nervu môže byť prínosom pri vylučovaní alternatívnych príčin polyneuropatie (napr. amyloidóza, vaskulitídy, iné hereditárne alebo toxické neuropatie).
Liečba CIDP zásadne alebo čiastočne zlepšuje stav až v 70 % prípadov. K liečbe CIDP v rámci medicíny založenej na dôkazoch radíme steroidy (prednizón), humánny polyklonálny imunoglobulín (IVIG) a plazmaferézu. V terapii CIDP sa používajú aj ďalšie imunosupresívne a imunomodulačné postupy (napr. azatioprín, cyklofosfamid, cyklosporín A, interferon a-2a, mycophenolat mofetil, rituximab).
Kazuistika
Uvádzame kazuistiku 59-ročnej pacientky s 10 rokov trvajúcou anamnézou ťažkostí. V popredí klinického obrazu bola symetrická progredujúca kvadruparéza periférneho typu s predominujúcim ťažkým poškodením dolných končatín a intermitentnými relapsmi ochorenia. Manifestné poškodenie kraniálnych nervov nebolo prítomné. Ďalej sme konštatovali zníženie povrchovej aj hlbokej citlivosti, neuropatické bolesti a ataxiu postoja a chôdze. V poslednom období pacientka udávala výraznú lumbalgiu s difúznou propagáciou bolesti do dolných končatín. Miera bolesti významne narastala pri vzostupe intraabdominálneho tlaku (napr. pri defekácii). Stupeň funkčného zneschopnenia pacientky bol ťažký. Pacientka bola schopná samostatnej chôdze s oporou na krátku vzdialenosť (relatívna samostatnosť v rámci bytovej jednotky) a bolesti rovnako zásadne znižovali kvalitu jej života (napr. sťaženie až znemožnenie spánku).
EMG vyšetrenie ukázalo obraz chronickej periférnej lézie ťažkého stupňa. Motorické neurogramy (n. fibularis, n. tibialis, n. medianus a n. ulnaris obojstranne) a antidrómne senzitívne neurogramy (n. plantaris medialis, n. medianus a n. ulnaris obojstranne) boli nevýbavné. Ihlová EMG z viacerých inzerčných polôh v m. tibialis anterior obojstranne ukázala neprítomnosť pokojovej aktivity, pri vôľovej kontrakcii spomalený nábor motorických jednotiek s výrazne preriedenou krivkou a prítomnosťou iba ojedinelých normofázických MUAPs vysokej amplitúdy a predĺženého trvania. Vyšetrenie likvoru ukázalo diskrétnu pleiocytózu (2/3 lymfocyty a 23/3 monocyty) spolu s výraznou hyperproteinorhachiou (4,9 g/ l). Histopatologické vyšetrenie n. suralis preukázalo degeneratívne zmeny axónov s fokálnou demyelinizáciou a iba ojedinelými známkami regenerácie nervových vlákien. Prítomnosť infiltrátov buniek mononukleárneho fagocytujúceho systému nebola potvrdená.
Počas relapsov ochorenia bola pacientka liečená vnútrožilovým podaním metylprednizolónu a plazmaferézami. V medziobdobí bola pacientka nastavená na dlhotrvajúcu perorálnu terapiu prednizonom a bolesti boli ovplyvňované pregabalinom a tramadolom. V prospech diagnózy CIDP svedčila aj pozitívna terapeutická odpoveď na liečbu relapsov v zmysle zásadného zlepšenia chôdze (chôdza bez opory, rádovo väčšia vzdialenosť).
MR vyšetrenie periférnych nervových štruktúr
Aborálny úsek vertebrálneho kanála je vyplnený hypertrofickými miechovými koreňmi (obr. 1) a po výstupe z vertebrálneho kanála je šírka jednotlivých miechových koreňov v priemere 12 mm (obr. 2). Rovnako sú rozšírené foramina intervertebralia a foramina sacralia. Plocha n. ischiadicus v priečnom reze je 48 × 22 mm a plocha n. femoralis je 16 × 12 mm. V porovnaní s normálnym nálezom to predstavuje 3–4-násobné zväčšenie (obr. 3). V cervikálnom úseku sú miechové korene po výstupe z vertebrálneho kanála široké 12–18 mm (obr. 4). Extrémna hypertrofia postihuje aj kraniálne nervy, a to najmä vetvy n. trigeminus a nervy postranného zmiešaného systému (n. glossopharyngeus, n. vagus, accesorius) (obr. 4–6). Po podaní gadolínia sa hypertrofické periférne nervové štruktúry mierne, okrskovite a nehomogénne sýtili iba v čase relapsu ochorenia. V pokojovom štádiu CIDP sa MR obraz periférnych nervových štruktúr po podaní kontrastnej látky nezmenil.
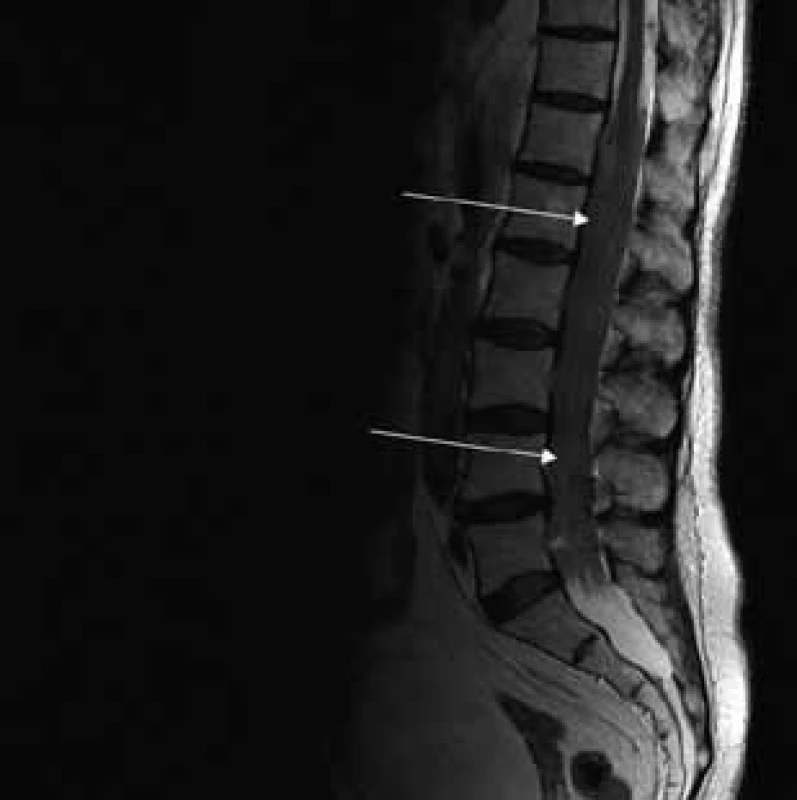
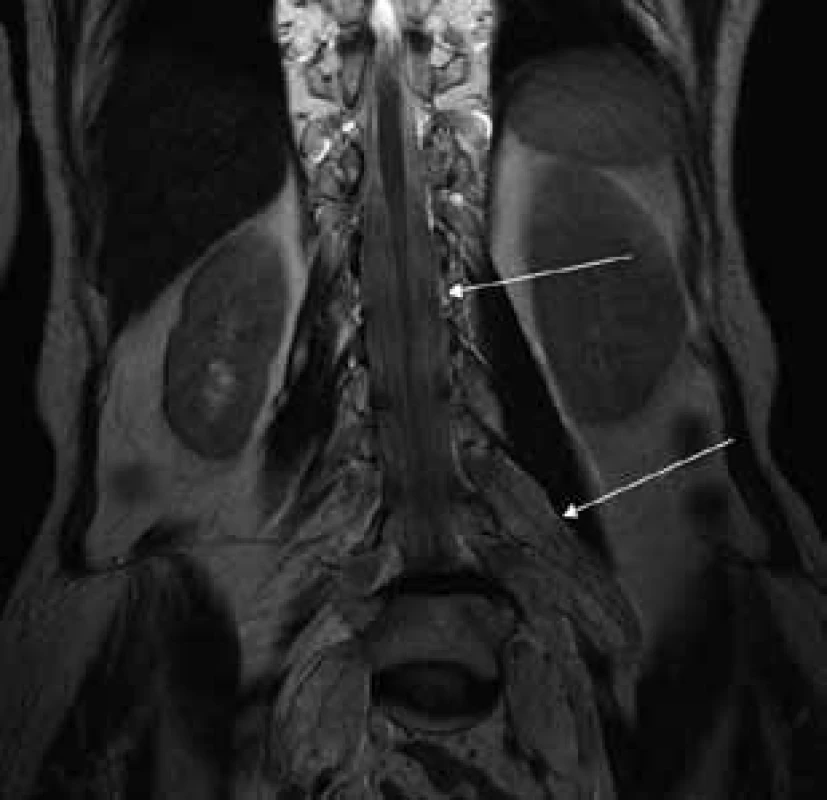
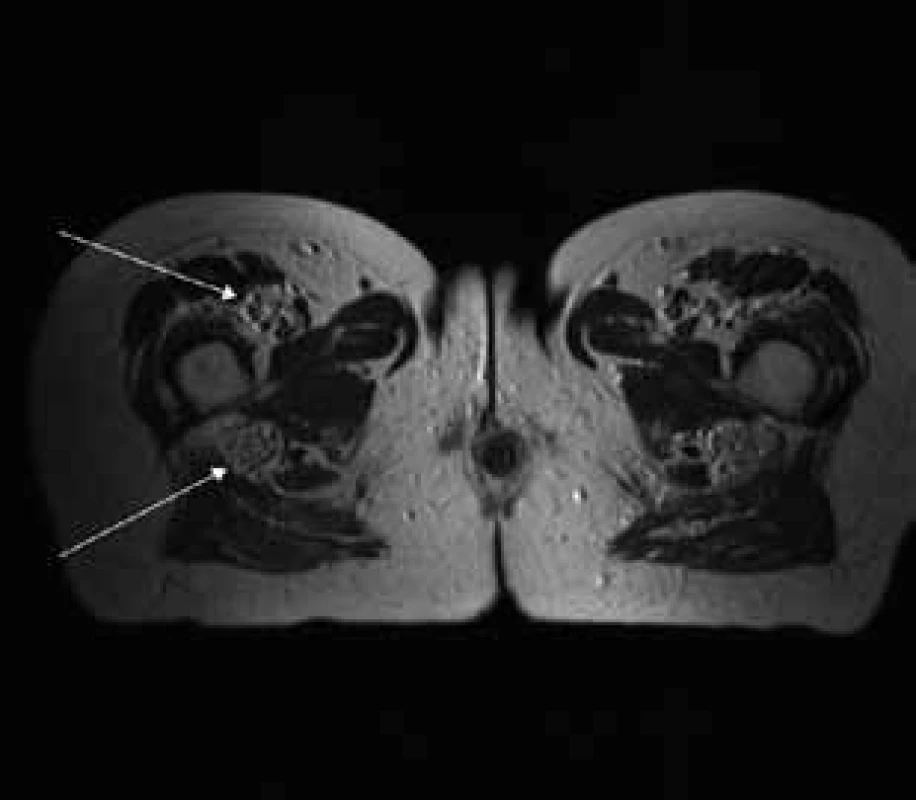
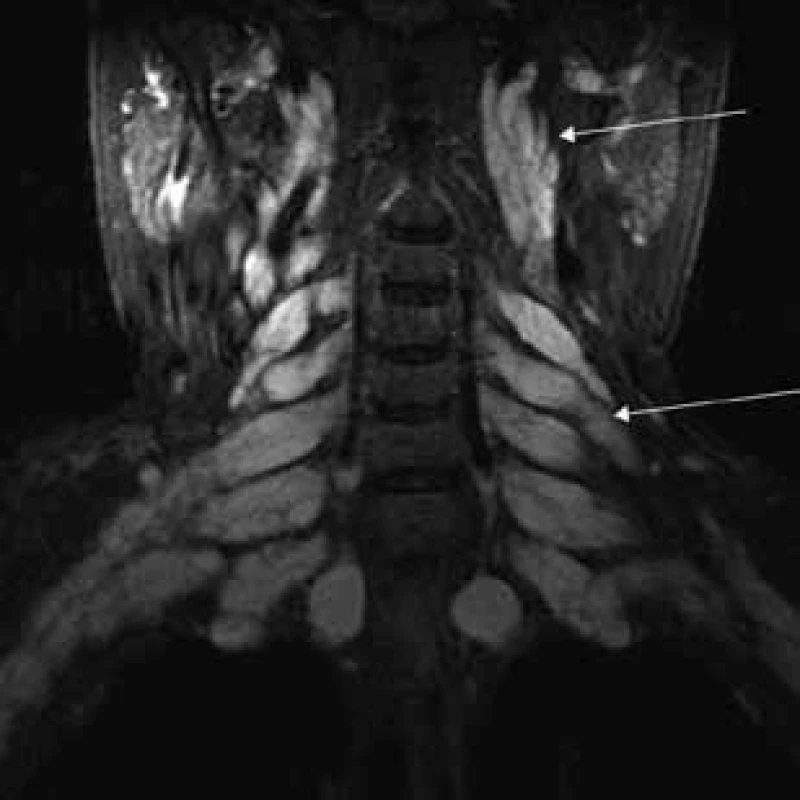
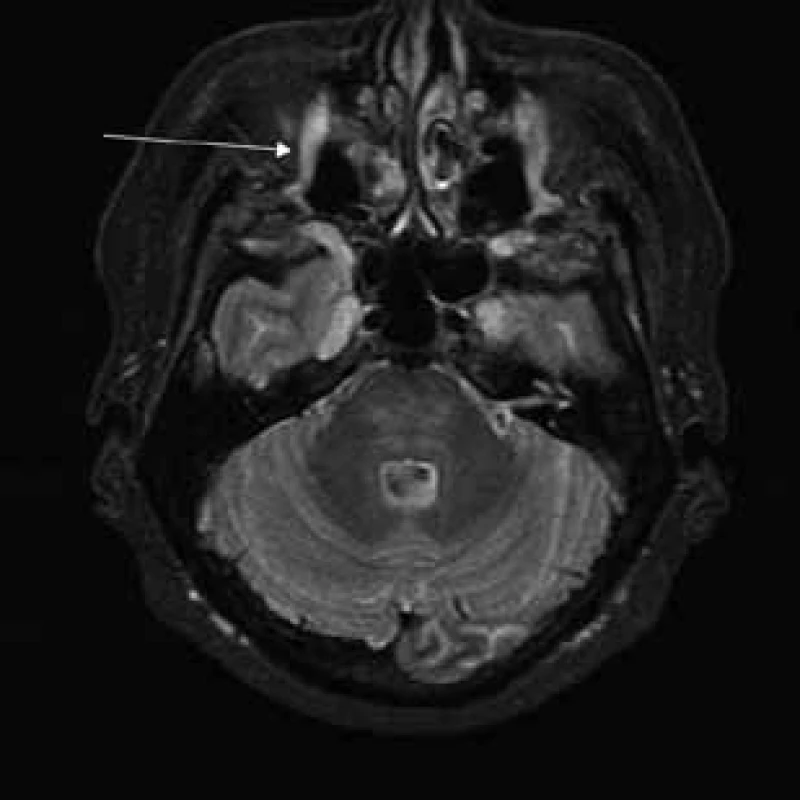
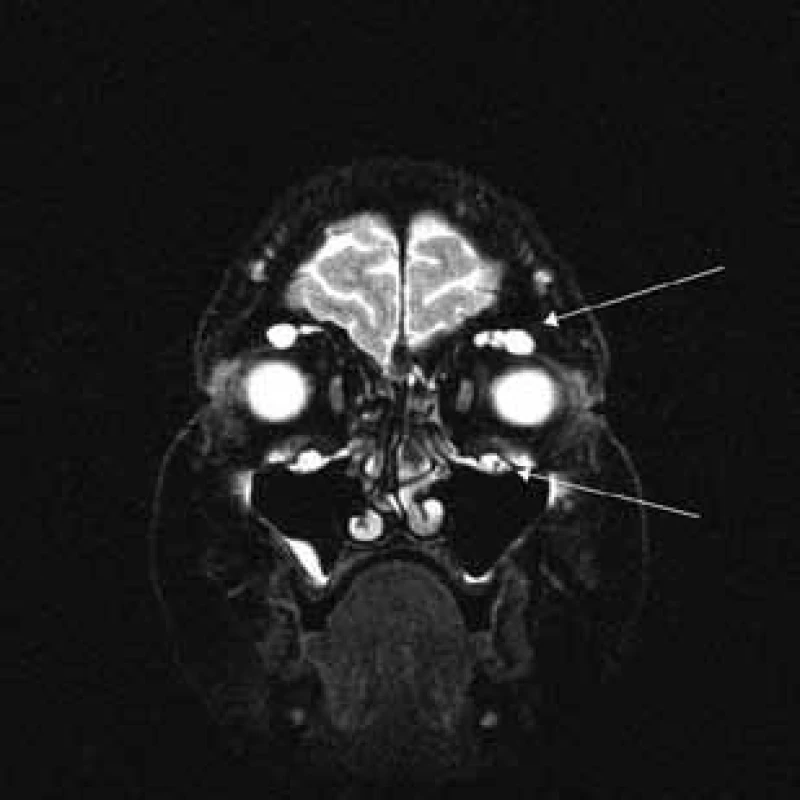
Diskusia
V diferenciálnej diagnóze generalizovaných hypertrofických neuropatií je potrebné od CIDP odlíšiť vybrané hereditárne hypertrofické neuropatie (HMSN 1. a 3. typu, Refsumova choroba, neurofibromatóza) a zo získaných neuropatií hlavne amyloidózu, multifokálnu motorickú neuropatiu alebo zriedkavé nádorové ochorenie neurolymfomatózu.
CIDP s extrémnou hypertrofiou periférnych nervových štruktúr sa môže manifestovať iritačným a/alebo zánikovým viackoreňovým syndrómom na horných a dolných končatinách podmieneným okrem základného zápalového a reparačného procesu kompresívnym mechanizmom. V lumbálnom úseku vzniká dokonca obraz typickej spinálnej stenózy spojenej okrem klaudikácie s torpídnym bolestivým stavom, ktorý nereaguje na konvenčnú protibolestivú terapiu a rovnako nemusí dostatočne odpovedať na liečbu ovplyvňujúcu neuropatickú bolesť [3]. Ďalším možným dôsledkom nedostatku priestoru môže byť syndróm kompresie cervikálnej miechy pri patologickej hypertrofii cervikálnych koreňov [4]. V literatúre sú opísané ojedinelé prípady, v ktorých až chirurgická liečba zmiernila príznaky známky kompresívnej pluriradikulopatie. Napr. pri hypertrofickej radikulopatii caudae equinae bola s úspechom vykonaná lumbálna dekompresívna laminektómia s plastikou dura mater [5]. Aj v našom prípade sme v pokročilom štádiu ochorenia zistili prítomnosť lumbálnej spinálnej stenózy. Excesívne zvýšenú hladinu celkových bielkovín v cerebrospinálnom likvore získanom lumbálnou punkciou (4,9 g/ l) považujeme čiastočne za dôsledok obštrukcie spinálneho kanála hypertrofickými koreňmi kaudy. V liečbe pacientky sme doteraz nemuseli pristúpiť k chirurgickej terapii a zatiaľ sa nám podarilo stav dostatočne ovplyvniť medikamentóznou liečbou.
Ťažká paréza dolných končatín, ľahšie poškodenie horných končatín a chýbanie klinicky manifestného poškodenia kraniálnych nervov vysvetľujeme čiastočne vplyvom dĺžky nervu na jeho funkciu pri ťažkej hypertrofickej demyelinizačnej polyneuropatii, kedy majú anatomicky krátke nervy podstatne vyššiu pravdepodobnosť a potenciál úspešného prevodu vzruchov v porovnaní s dlhými končatinovými nervami hlavne dolných končatín. Túto skutočnosť považujeme za nepriamy dôkaz demyelinizácie, nakoľko miera hypertrofie nervov dolných končatín a kraniálnych nervov nie je odlišná. Tazawa et al dokonca potvrdili signifikantný vzťah medzi mierou hypertrofie miechových koreňov a stupňom predĺženia minimálnych latencií F odpovedí pri CIDP [6].
Určitou otázkou zostáva miera správnosti stanovenia diagnózy CIDP. Je zrejmé, že konvenčné elektroneurografické kritéria neboli naplnené ani v rovine možnej demyelinizácie, nakoľko sme konštatovali úplnú periférnu elektrickú nedráždivosť. Uvedenú skutočnosť však vysvetľujeme práve pokročilou hypertrofiou periférnych nervov, ktorá neumožňuje ich povrchovú stimuláciu a ani povrchovú registráciu z nich. Dôvodom je izolačná schopnosť hypertrofického tkaniva, ktoré dokonale elektricky izoluje reziduálne funkčné axóny v centre extrémne hypertrofického nervu pri bežne používaných intenzitách stimulačného prúdu. Predpokladáme, že v prípade vyšetrenia pacientky skôr vo včasných štádiách ochorenia by bola viacložisková periférna demyelinizácia preukázaná bez pochybností.
Počet buniek v likvore ľahko prevyšuje ten, ktorý je uvedený v diagnostických odporučeniach (≤ 10/3). Vysvetlenie vidíme v parciálnej obštrukcii miechového kanála hypertrofickými štruktúrami s následnou proteino-cytologickou disociáciou (4,9 g /l vs 25/3 buniek).
V prospech diagnózy CIDP je aj fakt, že sú prítomné všetky štyri podporné diagnostické kritéria podľa EFNS/PNS (vyšetrenie likvoru, MR, biopsia nervu a pozitívna terapeutická odpoveď na imunosupresiu/imunomoduláciu). Sme toho názoru, že napriek nenaplneniu časti štandardných diagnostických kritérií CIDP (elektroneurografický dôkaz demyelinizácie) môžeme v kontexte vyššie uvedených informácií hovoriť o diagnóze aspoň pravdepodobnej CIDP [1,7].
Záverom môžeme konštatovať, že aj keď hypertrofia periférnych nervových štruktúr pri CIDP nie je zriedkavá, tak iba v ojedinelých prípadoch dosahuje podobne extrémne rozmery, ako je tomu v našej kazuistike. Vtedy sa k autoimunitnému zápalu a reparačným pochodom pridáva ďalší patofyziologický mechanizmus a tým je priestorová kompresia vo vybraných lokalizáciach. Suverénnou diagnostickou metódou je zobrazovacie vyšetrenie magnetickou rezonanciou (MR), ako to dokumentuje náš obrazový materiál. UZ v diagnostike hypertrofie periférnych nervových štruktúr má miesto podriadené MR vyšetreniu. Z anatomických dôvodov je v dobrej technickej kvalite uskutočniteľné iba v krčnej a hornej brachiálnej oblasti. V prípade realizácie MR vyšetrenia sa stáva UZ redundantným. Pri neprítomnosti palpačne detegovateľnej hypertrofie nervov a ťažšej dostupnosti MR môže byť UZ alternatívou určujúcou smer ďalšieho diagnostického postupu. V liečbe týchto pacientov môže byť okrem odporúčanej farmakoterapie v rámci medicíny založenej na dôkazoch a symptomatickej farmakoterapie výnimočne indikovaná aj neurochirurgická, resp. spondylochirurgická dekompresívna liečba.
prof.
MUDr. Egon Kurča, PhD.
Neurologická
klinika
JLF
UK a UN Martin
Kollárova
2
036
59 Martin
e-mail:
kurca@mfn.sk
Zdroje
1. Hughes RA, Bouche P, Cornblath DR, Evers E, Hadden RD, Hahn A et al. EFNS/PNS guideline on management of chronic inflammatory demyelinating polyradiculoneuropathy: report of a joint task force of the EFNS and the PNS. Eur J Neurol 2006; 13(4): 326–332.
2. Matsuoka N, Kohriyama T, Ochi K, Nishitani M, Sueda Y, Mimori Y et al. Detection of cervical nerve root hypertrophy by ultrasonography in chronic inflammatory demyelinating polyradiculoneuropathy. J Neurol Sci 2004; 219(1–2): 15–21.
3. Ishida K, Wada Y, Tsunemi T, Kanda T, Mizusawa H. Marked hypertrophy of the cauda equina in a patient with chronic inflammatory demyelinating polyradiculoneuropathy presenting as lumbar stenosis. J Neurol 2005; 252(2): 239–240.
4. Freitas MR, Nascimento OJ, Soares CN, Brito AR, Domingues RC. Chronic inflammatory demyelinating polyradiculoneuropathy: two cases with cervical spinal cord compression. Arq Neuropsiquiatr 2005; 63(3): 666–669.
5. Kretzer RM, Burger PC, Tamargo RJ. Hypertrophic neuropathy of the cauda equina: case report. Neurosurgery 2004; 54(2): 515–518.
6. Tazawa K, Matsuda M, Yoshida T, Shimojima Y, GonoT, Morita H et al. Spinal nerve root hypertrophy on MRI: clinical significance in the diagnosis of chronic inflammatory demyelinating polyradiculoneuropathy. Intern Med 2008; 47(23): 2019–2024.
7. Van den Bergh PY, Hadden RD, Bouche P, Cornblath DR,Hahn A, Illa I et al. European Federation of Neurological Societies/Peripheral Nerve Society Guideline on management of chronic inflammatory demyelinating polyradiculoneuropathy: report of a joint task force of the European Federation of Neurological Societies and the Peripheral Nerve Society – first revision. Eur J Neurol 2010; 17(3): 356–363.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie
2011 Číslo 1
-
Všechny články tohoto čísla
-
Výroční kongres České neurochirurgické společnosti ČLS JEP
3.–5. 11. 2010, Clarion Congress Hotel Ostrava
Neurochirurgická klinika Fakultní nemocnice Ostrava - Farmakologická neuroprotekce u akutní ischemické cévní mozkové příhody
- Účinnost piracetamu, vinpocetinu a Ginkgo biloba na poruchy učení a paměti vyvolané antipsychotiky.
- Neurologie v České a slovenské neurologii a neurochirurgii
- Validizační studie české verze dotazníku FAQ
- Resekční epileptochirurgie u pacientů s perirolandickou epilepsií
- 12-kDa FK 506-vážící protein zapojený do neuroprotektivního účinku dantrolenu v mozkové kůře potkanů po ischemicko-reperfuzním postižení
- Spasticita horní končetiny – modulace terapií botulotoxinem typu A a odraz v kortikální somatosenzitivní aktivaci
-
Botulotoxin v léčbě spasticity horní končetiny po cévní mozkové příhodě
Komentář k práci Opavského et al. Spasticita horní končetiny – modulace terapií botulotoxinem typu A a odraz v kortikální somatosenzitivní aktivaci - Peroperační kontrola funkce extra-intrakraniálního bypassu ultrazvukovými metodami
- Nadužívání léků pacienty s chronickou denní bolestí hlavy v České republice
- Extrémna hypertrofia periférnych nervových štruktúr pri CIDP – kazuistika
- Komentář k článku J. Michalika et al Extrémna hypertrofia periférnych nervových štruktúr pri CIDP
- Nokardiové abscesy mozku – dvě kazuistiky
- Komentář k práci Krajina et al Endovaskulární rekanalizace při léčbě akutních uzávěrů mozkových tepen
- Komentář ke komentáři Masopust et al k práci Matoušek et al Endoskopická transnazální chirurgie hypofýzy – výhody spolupráce otorinolaryngologa a neurochirurga
- Komentář k minimonografii Ošlejšková et al Autizmy: Poruchy autistického spektra v pohledu biomedicíny
- Prof. MUDr. Vladimír Beneš, DrSc., st. – devadesát let
- Lacosamid (Vimpat®) – nový lék pro přídatnou léčbu pacientů s fokální epilepsií
- Monitoring pacientů s těžkým poraněním mozku
- Webové okénko
-
Analýza dat v neurologii
XXV. Hodnocení diagnostických testů – senzitivita a specificita
-
Výroční kongres České neurochirurgické společnosti ČLS JEP
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Monitoring pacientů s těžkým poraněním mozku
- Lacosamid (Vimpat®) – nový lék pro přídatnou léčbu pacientů s fokální epilepsií
- Účinnost piracetamu, vinpocetinu a Ginkgo biloba na poruchy učení a paměti vyvolané antipsychotiky.
- Nadužívání léků pacienty s chronickou denní bolestí hlavy v České republice
