Lacosamid (Vimpat®) – nový lék pro přídatnou léčbu pacientů s fokální epilepsií
Lacosamide (Vimpat®) – a Novel Agent for Add-on Treatment of Focal Epilepsies
Lacosamide is a new anti-epileptic drug approved in the USA and Europe as adjunctive (add-on) therapy for focal (partial onset) epilepsy in adult patients. Lacosamide has a novel mechanism of action and an excellent pharmacokinetic profile with no clinically relevant drug-drug interactions. The efficacy of lacosamide has been shown in animal models and clinical trials in highly refractory focal epilepsy. Lacosamide is well tolerated. The most common adverse events in recommended doses (up to 400 mg/day) were dizziness, headache and nausea. In this paper, we present a drug profile of lacosamide.
Key words:
epilepsy – treatment of epilepsy – antiepileptic drugs – lacosamide
Autoři:
Doc. MUDr. Jiří Hovorka, CSc.
Působiště autorů:
Neurologické oddělení, neuropsychiatrické a epileptologické centrum, Nemocnice Na Františku, Praha
1
Vyšlo v časopise:
Cesk Slov Neurol N 2011; 74/107(1): 88-95
Kategorie:
Novinky v léčbě
Souhrn
Lacosamid je nové antiepileptikum registrované v USA i v Evropě k přídatné léčbě fokální epilepsie u dospělých pacientů. Lacosamid má nový mechanizmus účinku a optimální farmakokinetický profil bez klinicky významných lékových interakcí. Účinnost léčby lacosamidem byla prokázána experimentálně i v klinických studiích u pacientů s vysoce refrakterní epilepsií. Lacosamid je dobře tolerovaný. Nejčastějšími nežádoucími účinky v doporučených terapeutických dávkách (do 400 mg/den) byly závratě, bolesti hlavy a nauzea. V této práci prezentujeme lékový profil lacosamidu.
Klíčová slova:
epilepsie – léčba epilepsie – antiepileptika – lacosamid
Úvod
Epilepsie patří k nejčastějším chronickým neurologickým onemocněním. Aktivní epilepsie postihuje 0,5–1 % populace [1] a v ČR se dlouhodobá léčba týká až 100 000 obyvatel, což je vysoké číslo [2].
Epilepsie je definována trvající tendencí-dispozicí k opakovanému výskytu neprovokovaných záchvatů na podkladě systémové poruchy nebo neurologického inzultu [3].
V současné době vždy individuálně zvažujeme možnost zahájení léčby (monoterapie) již po prvním epileptickém záchvatu. Více to odpovídá variabilní patofyziologické podstatě epileptického onemocnění a také nově navržené definici epilepsie [4]. Není-li epilepsie kompenzována monoterapií, je rovněž důležité včasné využití kombinované léčby [5]. Současné možnosti totiž nabízejí její vysokou efektivitu, tedy vyšší účinnost a mnohdy lepší toleranci než u monoterapie za každou cenu. I zde je potenciální přínos nového antiepileptika, kdy vedle dobré účinnosti a snášenlivosti se mohou významně uplatnit nové mechanizmy jeho působení a optimální farmakokinetický profil. Podle řady experimentálních a některých klinických prací je výhodné kombinovat léky s odlišnými mechanizmy účinku. Cílem je dosáhnout aditivního/synergického terapeutického efektu a infraaditivního efektu z hlediska nežádoucích účinků [2].
Léčba epilepsie dnes patří k nejatraktivnějším a nejoptimističtějším terapeutickým tématům v neurologii. Je tomu tak ze dvou základních důvodů. Těmi jsou současné možnosti léčby a počet pacientů, kterým můžeme úspěšně pomoci [2].
Zlepšení efektivity léčby je spojeno s příchodem nových antiepileptik a nových možností invazivní léčby epilepsie (epileptochirurgie, stimulační léčba). Z hlediska účinnosti se dnes daří dosáhnout plné kompenzace záchvatů až u tří čtvrtin pacientů (obr. 1). Tím se může pochlubit málokterá oblast medicíny. Z hlediska tolerance léčby můžeme pacientům nabídnout léky, které více zohledňují typ epileptických záchvatů/syndromů, navíc také individuální somatický i psychický stav pacienta. To je stejně důležité jako kompenzace záchvatů. Léčba epilepsie totiž bývá dlouhodobá a velmi často celoživotní. Optimálně volená léčba tak pacientům nabízí dobrou kvalitu života a plnohodnotné zařazení se do života. To je také její jediný a konečný cíl [2].
Přes široké terapeutické možnosti však nadále zůstává čtvrtina až třetina pacientů neuspokojivě kompenzovaná (obr. 1). A to je výzva k hledání nových léčebných postupů a možností. Jednou z nich je rozšíření farmakoterapie a zavedení nových antiepileptik do klinické praxe. Od nového antiepileptika vždy očekáváme dostatečnou účinnost a její jasně definované spektrum podle typu záchvatu (záchvaty fokální, sekundárně generalizované či případně primárně generalizované), dobrou toleranci (somatickou, psychickou), dobrý farmakokinetický profil včetně lékových interakcí (s antiepileptiky i jinými léky). Za potenciálně přínosný se považuje i nový mechanizmus jejich působení.
![Přibližná prognóza léčené epilepsie [2].
Prezentované studie s LCM se týkaly farmakorezistentní fokální epilepsie, klinické využití LCM je možné již v první přídatné léčbě.](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/9dfc0645f6b6596a66cc20efa906af5e.jpeg)
V řadě těchto parametrů je lacosamid atraktivní nové antiepileptikum určené k léčbě fokání epilepsie [6,7]. V této práci podáváme základní profil předklinických a klinických údajů o lacosamidu.
Farmakologický profil
Chemická struktura lacosamidu je odvozena od specificky upravené, funkcionalizované aminokyseliny. Jde o aktivní pravotočivý enantiomer, (R)-2-acetamido-N-benzyl-3-metoxyproprionamid s molekulovou hmotností 250,3 Da, prostupující hematoencefalickou bariérou. K léčbě epilepsie je v ČR dostupný p.o., v USA též v i.v. formě [6–8].
Farmakodynamické vlastnosti
Mechanizmus účinku
Přesný mechanizmus účinku LCM u lidí není, obdobně jako u ostatních antiepileptik, plně znám. Z experimentálních studií však vyplývá, že jde o nový mechanizmus účinku, odlišný od působení ostatních antiepileptik (obr. 2).
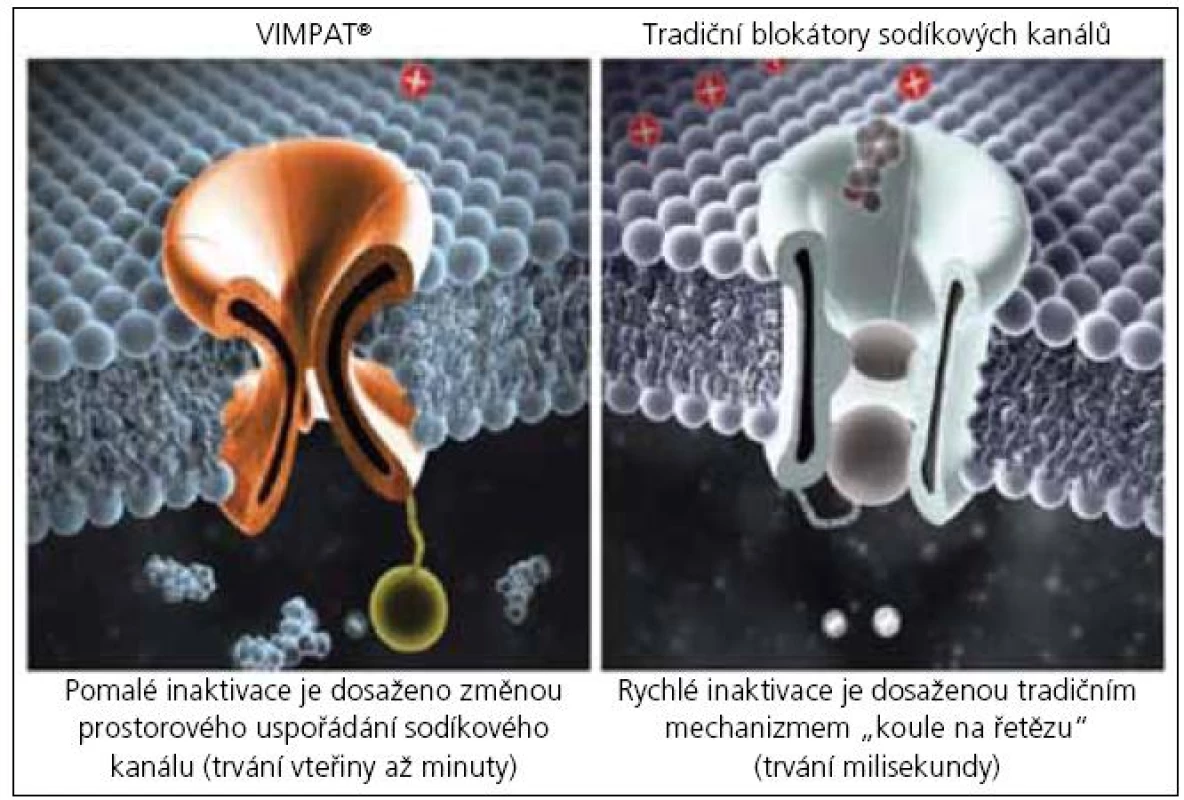
LCM selektivně zesiluje pomalou inaktivaci napěťově řízených (voltage-gated) sodíkových (Na+) kanálů, a tím stabilizuje patologicky hyperexcitabilní membránu neuronů. Pomalé inaktivace (vteřiny-minuty) je dosaženo změnou prostorové konfigurace Na+ kanálu. Tento mechanizmus účinku je odlišný od ostatních antiepileptik, např. PHT, CBZ, LTG, která rovněž působí prostřednictvím Na+ kanálu. V jejich případě jde o rychlou inaktivaci (milisekundy), které je dosaženo uzavřením kanálu „koulí na řetězu“ (obr. 2). Nové, odlišné ovlivnění Na+ kanálu tedy potenciálně nabízí např. posílení nedostatečně účinné léčby tradičními antiepileptiky (rychlá inaktivace) a další rozšíření kombinované léčby s ostatními antiepileptiky.
Předklinický profil účinnost lacosamidu v modelu epilepsie
LCM byl testován v animálních modelech různých typů epileptických záchvatů, o kterých se předpokládá, že odpovídají klinické praxi [6–9].
LCM byl účinný v modelu generalizovaných, resp. sekundárně generalizovaných tonicko-klonických záchvatů u maximálních elektrošokových křečí.
LCM byl rovněž účinný v modelu fokálních komplexních záchvatů u hipokampálního kindlingu. V tomto modelu byl v potlačení samostatných následných výbojů účinnější než jiné testované léky (PHT, CBZ, VPA, ETS).
V modelech primárně generalizovaných záchvatů včetně absencí, záchvatů myoklonických nebyly nálezy zcela jednoznačné. V pentylentetrazolovém modelu nebyl LCM účinný při podání prokonvulzivní látky s.c., ale při podání i.v. účinný byl. LCM nebyl účinný v modelu bikukulinových křečí (GABA A antagonista), ani v modelu pikrotoxinovém (blokátor chloridového kanálu), v modelu NMDA-indukovaných křečí byl částečně účinný.
Za model refrakterní fokální (parciální) epilepsie jsou pokládány psychomotorické záchvaty vyvolané 6Hz stimulací korney. V tomto modelu byl LCM vysoce účinný, vedl k plnému potlačení záchvatů, obdobně jako VPA a LEV, naopak PHT a CBZ byly jen částečně účinné.
V modelu epileptogeneze LCM zpomalil rozvoj záchvatů u amygdalového kindlingu.
LCM byl účinný v modelu generalizovaného tonicko-klonického epileptického statu, efekt byl na dávce závislý. Oproti kontrolám vykazovala zvířata léčená LCM v histologických nálezech menší poškození v oblasti hipokampu.
Nálezy z posledních dvou uvedených studií jsou zvažovány ve vztahu k možným neuroprotektivním účinkům LCM, resp. k jeho potenciálu ovlivnit průběh vlastní choroby (disease-modifying potential). Skutečný význam těchto nálezů pro klinickou praxi však zatím nebyl ověřen.
V předklinických studiích vykazoval LCM potenciálně přínosné farmakodynamické interakce s ostatními antiepileptiky, aditivní, resp. synergický efekt kombinací LCM s PHT, VPA, LTG, GBP, TPM, CBZ, LEV.
Z předklinických studií vyplynul závěr, že LCM je nadějný lék pro klinickou praxi při léčbě fokálních záchvatů, GTCS, při léčbě farmakorezistentní epilepsie a epileptického statu. Z hlediska přídatné léčby vykazuje s řadou antiepileptik aditivní a synergický efekt.
Další účinky lacosamidu
LCM byl úspěšně studován z pohledu možných analgetických účinků ve zvířecích modelech i v klinických studiích u neuropatické bolesti [10]. Léčba LCM byla obecně dobře tolerována. Z hlediska předklinických údajů ve vztahu k bezpečnosti léčby byly zjištěny: přechodné prodloužení PR a QRS intervalu při současném snížení TK, zpomalení AV vedení, AV blok, AV disociace, útlum, snížení lokomotorické aktivity, hypotermie, ataxie, tremor [6–9]. Většina těchto příznaků byla na dávce závislá. LCM ve studiích nevyvolával syndrom závislosti, nebyly prokázány poruchy fertility a teratogenní účinky, snadno procházel placentární bariérou.
Farmakokinetické vlastnosti
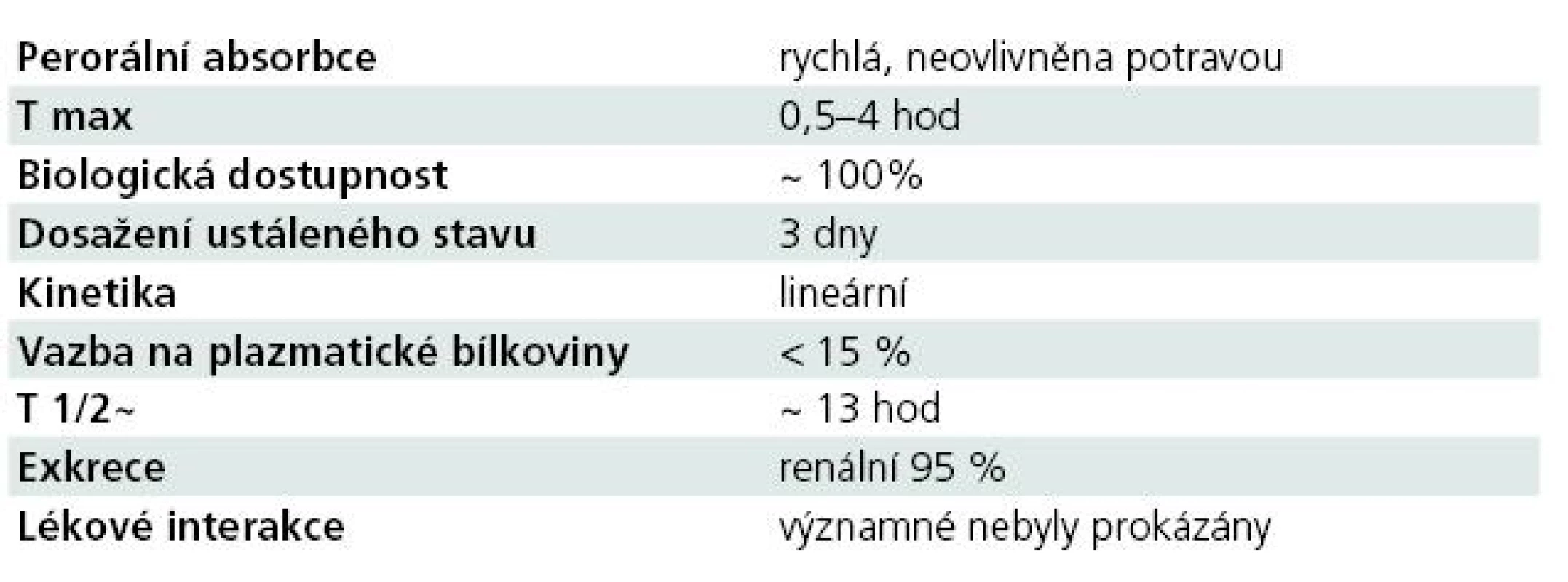
Farmakokinetické vlastnosti antiepileptika, včetně jeho lékových interakcí, hrají v jeho klinickém využití zásadní roli. Souhrnně řečeno, farmakokinetický profil LCM je optimální (tab. 1) [6–8,11–14].
Absorpce
Absorpce LCM po perorálním podání je rychlá, biologická dostupnost je 100 %, potrava neovlivňuje rychlost ani rozsah vstřebávání. Maximální koncentrace je dosaženo mezi 0,5–4 hod, ustáleného stavu po třech dnech při podávání LCM ve dvou denních dávkách. Byla zjištěna bioekvivalence mezi p.o. podávanými tabletami a sirupem, mezi p.o. podáním a i.v. 30–60 minut trvající infuzí.
Distribuce
Distribuční objem LCM je 0,6 l/ kg, vazba na plazmatické bílkoviny je nízká, < 15 %.
Metabolizmus a eliminace
Eliminační poločas LCM je dlouhý (13 hod). Farmakokinetika LCM je úměrná dávce, časově konstantní s nízkou intra - a interindividuální variabilitou. LCM není extenzivně metabolizován, z 95 % se vylučuje močí, ze 40 % v nezměněné formě a z necelých 30 % ve formě O-desmetyl metabolitu. Ten tvoří asi 15 % plazmatické hladiny LCM. LCM nemá klinicky významné účinky na CYP, není jeho induktorem ani inhibitorem.
Lékové interakce
LCM má velmi nízký potenciál k farmakokinetickým interakcím, není významným induktorem ani inhibitorem v systému CYP-450, vazba na plazmatické bílkoviny a riziko kompetice jsou rovněž minimální. Ve studiích neovlivňoval hladiny CBZ, VPA, omeprazolu, midazolamu, metforminu, dioxinu, etinylestradiolu, levonorgestrelu a progestagenu. Současným podáváním silných enzymatických induktorů (PHT, CBZ, PHB, rifampicin, třezalka tečkovaná) může docházet ke snížení hladiny LCM až o 25 %.
Farmakokinetika u speciálních skupin pacientů
Z hlediska farmakokinetiky LCM a ostatních antiepileptik je tradičně větší pozornost věnována následujícím skupinám pacientů [6–8,11–15]:
- u dětí ve věku pod 16 let není LCM zatím k léčbě doporučován vzhledem k nedostatku klinických dat;
- pohlaví klinicky významně neovlivňovalo hladiny LCM u mladých i starších pacientů, k mírnému zvýšení hladin LCM docházelo u žen;
- ve vyšším věku docházelo ke zvýšení hladin LCM u mužů i žen o 23–26 %, pozorována byla i větší variabilita hladin. Nálezy jsou vysvětlovány nižší hmotností pacientů, změnou obsahu vody a mírně sníženou renální clearance ve studii. Plošné snížení dávky u těchto pacientů není považováno za nutné, pokud není indikováno z důvodu narušení funkce ledvin či jater.
- u pacientů s poruchou renálních funkcí je narušena hlavní cesta eliminace LCM a dochází k nárůstu jeho koncentrací v závislosti na renální clearance. U pacientů s těžkým stupněm postižení (clearance ≤ 30 ml/min), event. v terminálním stadiu renálního onemocnění, je doporučována maximální denní dávka LCM 250 mg/den v EU nebo 300 mg/den v USA. U pacientů s lehkým a středně těžkým postižením není úprava dávky doporučována. U pacientů léčených hemodialýzou se doporučuje ihned po jejím ukončení doplnit 50 % z poloviny celkové denní dávky.
- porucha funkce jater mírného stupně vedla ke zvýšení koncentrace LCM (AUC přibližně o 50 %), uváděn je však vliv současně snížených renálních funkcí. Podle odhadů je podíl nerenální clearance na navýšení LCM 20 %. Dle doporučení EMA není úprava dávky u poruchy jater lehkého a středního stupně nutná, dle doporučení FDA činí u těchto pacientů maximálně 300 mg/den. Farmakokinetika LCM u těžké poruchy jater nebyla studována.
- těhotenství a kojení. Údaje o léčbě LCM u těhotných žen nejsou k dispozici, proto by neměl být během těhotenství podáván, pokud to není nezbytně nutné. Je třeba pečlivě vážit přínos léčby pro matku s potenciálními riziky pro plod. Není známo, zda se LCM vylučuje do mateřského mléka obdobně jako u zvířat. Doporučuje se tedy v současné době kojení přerušit.
Klinické studie – účinnost, snášenlivost a bezpečnost léčby u pacientů s epilepsií
Účinnost – přídatná léčba farmakorezistentní fokální epilepsie u dospělých pacientů
Pivotní, registrační studie
Účinnost LCM byla potvrzena ve třech obdobně uspořádaných registračních klíčových (pivotních) klinických studiích, multicentrických, randomizovaných, placebem kontrolovaných u dospělých pacientů s refrakterní fokální epilepsií [16–18].
Do studií bylo celkem zařazeno 1 308 pacientů (ITT) ve věku 16–70 let. Šlo o pacienty vysoce farmakorezistentní, o čemž svědčí následující údaje [7]: průměrná délka onemocnění 23,7 let; měsíční frekvence záchvatů 9,9–16,5; 84 % pacientů současně užívalo 2–3 antiepileptika, 45 % pacientů užilo více než sedm antiepileptik, invazivně bylo léčeno 17 % pacientů pomocí vagového stimulátoru.
Uspořádání studií je uvedeno na obr. 3: po 8týdenním výchozím období následovalo 4–6 týdnů titrace, udržovací-léčebná fáze 12 týdnů a poslední fáze 2–3 týdny s přechodem do otevřené studie, případně snižování a vysazení léčby. Primárními cíli studií bylo hodnocení podílu respondérů (redukce záchvatů ≥ 50 % oproti výchozímu období) a mediánu redukce průměrné měsíční frekvence záchvatů. Studovány byly dávky 200, 400 a 600 mg/den oproti placebu. V obou primárně sledovaných parametrech došlo u všech studovaných dávek k signifikantnímu zlepšení, a to v populaci všech zařazených pacientů (ITT) i u 1 294 pacientů, kteří absolvovali alespoň jednu studijní návštěvu v léčebné fázi (ITT Maintenance) [7]. Efekt léčby byl na dávce závislý, podíl respondérů v ITT populaci byl 23 % ve skupině placeba, 34 % ve skupině s dávkou LCM 200 mg/den a 40 % ve skupině s dávkou LCM 400 mg/den (obr. 4). Medián měsíční redukce frekvence záchvatů byl 18 % ve skupině placeba, 33 % ve skupině s dávkou LCM 200 mg/den a 39 % ve skupině s dávkou LCM 400 mg/den. Dávka 600 mg/den již nepřinesla významné zlepšení a naopak byla zatížena nárůstem výskytu nežádoucích účinků a špatnou tolerancí. Podíl pacientů plně kompenzovaných, kteří dokončili léčebnou fázi, byl 0,9 % ve skupině placeba; 2,7% ve skupině s dávkou LCM 200 mg/den; 3,3 % ve skupině s dávkou LCM 400 mg/den a 4,8 % ve skupině s dávkou 600 mg/den [7,8,16–18].
![Uspořádání tří pivotních, registračních klinických studií.
Maximální terapeutická dávka lacosamidu registrovaná v EU je 400 mg/den; **Na konci fáze titrace povoleno jedno snížení dávky; PBO – placebo; LCM – lacosamid. Upraveno dle [16–18]](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/c9864f65cccbc1df536a59e6d87f60e2.jpeg)
![Podíl respondérů, pacientů s alespoň 50% snížením frekvence záchvatů v registračních studiích.
Maximální terapeutická dávka lacosamidu registrovaná v EU je 400 mg/den;
*P < 0,05; ** P < 0.001, IT – všichni randomizovaní pacienti, kteří užili ≥ 1 dávku LCM s ≥ 1 měřením účinnosti po výchozím období. Upraveno dle [7,17]](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/32d7d9f1043ed9a0a6681e2fd4638fdc.jpeg)
Výsledky pivotních studií potvrdili vysokou účinnost LCM, a to i vzhledem k neobvykle vysoké míře farmakorezistence studované populace. Potvrdily se tak i předklinické nálezy účinnosti LCM v modelu refrakterní epilepsie.
Na základě výsledků těchto studií byl LCM v EU a v USA registrován k přídatné léčbě u fokální (parciální) epilepsie (záchvaty fokální s/bez sekundární generalizace) u pacientů ve věku nad 16 let v EU, nad 17 let v USA, v maximální doporučené terapeutické dávce 400 mg/den [7,8].
Dlouhodobá léčba lacosamidem
Průběh dlouhodobé léčby je významnou položkou pro zhodnocení skutečného přínosu antiepileptika pro léčbu epilepsie. Setrvání pacientů na léčbě (RR, retention rate) v sobě zahrnuje nejen dlouhodobou účinnost, ale také tolerabilitu léku, a tedy kvalitu dlouhodobého soužití pacientů s léčbou. Setrvání pacientů na léčbě a jejich úbytek jsou graficky vyjádřeny tzv. Kaplan-Meierovou křivkou (obr. 5).
![Dlouhodobé setrvání na léčbě.
Upraveno dle [19]](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/dca8257325c203a44d649ba0711b0c30.jpeg)
Vyhodnocení dlouhodobé léčby LCM bylo provedeno v otevřené studii u 370 pacientů s rezistentní fokální epilepsií [19]. Setrvání na léčbě je znázorněno na obr. 5. Nejméně rok setrvalo na léčbě 77 % pacientů, nejméně dva roky 61 % a 56 % nejméně 30 měsíců. Během studie byl podíl respondérů 46,6 % a medián redukce měsíční frekvence záchvatů 48 %. V další otevřené dlouhodobé studii navazující na pivotní studie byla hodnocena dlouhodobá účinnost léčby LCM u 892 pacientů s následujícím podílem respondérů: 45 % po třech měsících léčby, 48 % po roce, 44 % po dvou letech a 52 % po třech letech léčby. Obdobně byl medián měsíční redukce frekvence záchvatů po roce 48 %, po dvou letech 48 % a po třech letech 47 % [20]. Uvedená data potvrdila dlouhodobou účinnost léčby LCM a také vysoký podíl pacientů, kteří na ní setrvávají.
Léčba lacosamidem s kombinaci s různými antiepileptiky
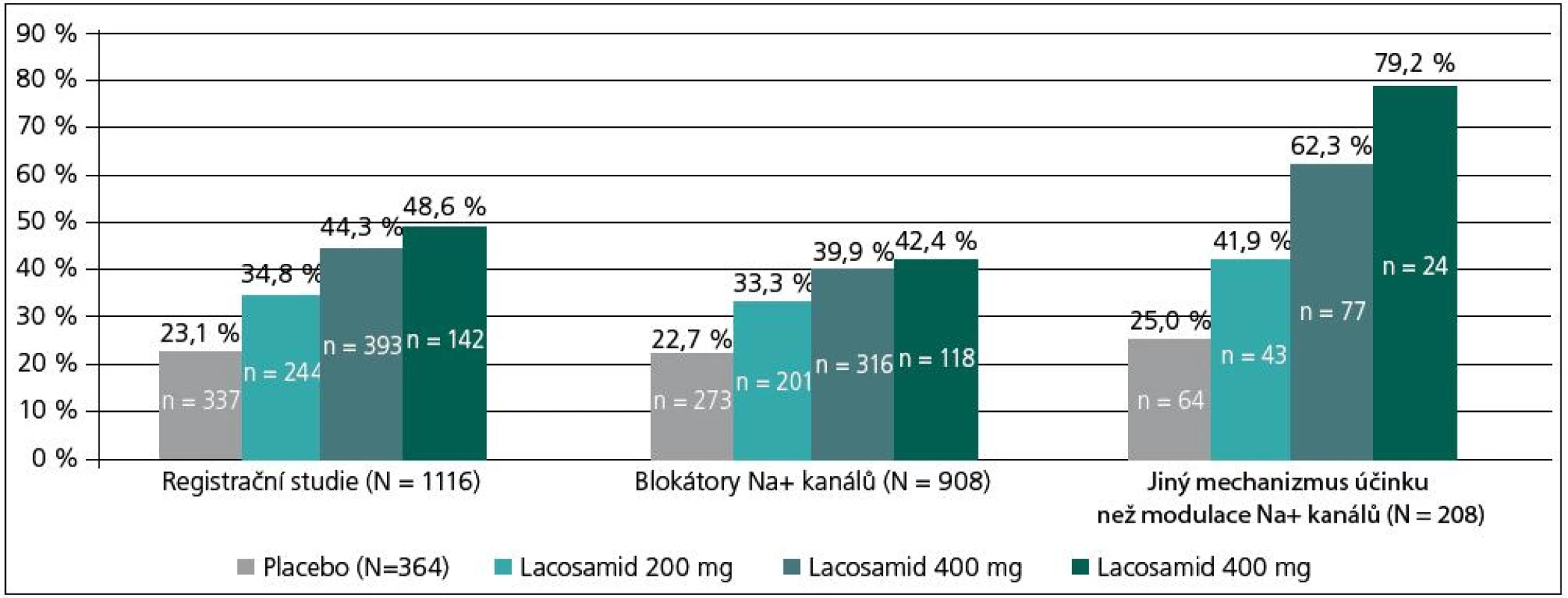
Výsledky pivotních studií byly dále analyzovány z hlediska dalších parametrů. K nim patří analýza kombinované léčby s antiepileptiky rozdělenými podle mechanizmu účinku. Z tohoto pohledu byla provedena analýza kombinace LCM s tradičními léky, které působí prostřednictvím klasického ovlivnění Na+ kanálů (rychlá inaktivace), např. PHT, CBZ, LTG a s léky, které působí odlišným mechanizmem, a tedy Na+ kanály neovlivňují.
Kombinace LCM s oběma skupinami léků byla v hodnocené populaci 1 116 pacientů oproti placebu signifikantně účinnější (obr. 6). Počet respondérů byl při dávkách LCM 400 mg/den bez ohledu na typ kombinace 44,3 %, v kombinaci s tradičními blokátory Na+ 39,9 % a v kombinaci s léky působícími odlišným mechanizmem 62,3 % (obr. 6) [21]. Výsledky analýzy potvrzují, že přídatná léčba LCM je účinná bez ohledu na typ lékové kombinace. O těchto nálezech se dále diskutuje v tom smyslu, že v případě kombinace s tradičními blokátory Na+ kanálů se navíc uplatňuje jiný mechanizmus působení LCM (pomalá inaktivace), jež zvyšuje účinnost původní léčby. V případě kombinace s léky působícími odlišným mechanizmem byla účinnost LCM vyšší a navíc se snížil výskyt nežádoucích účinků [21]. Využití léků s odlišnými mechanizmy účinku v kombinované léčbě se dnes doporučuje kvůli její účinnosti i toleranci, též vzhledem k potenciálnímu aditivnímu/synergickému efektu [2]. Ten se týká účinnosti i tolerance léčby.
Snášenlivost a bezpečnost
Profil nežádoucích účinků v předklinických studiích jsme zmínili výše.
Tolerabilita léčby LCM byla hodnocena ve třech pivotních studiích u 1 308 pacientů [7–8,16–18,22]. Nežádoucích účinky se při léčbě LCM vyskytující častěji než u placeba. Jejich přehled uvádíme na obr. 7. Nejčastějšími nežádoucími účinky byly závratě, bolesti hlavy, nauzea a diplopie. Byly mírného až středního stupně, obdobně jako účinnost závisely na dávce a výrazněji narůstaly při dávkách 600 mg/den a vyšších. Jejich výskyt byl častější v době titrace, s tendencí k postupnému odeznívání. Celkový výskyt vedlejších účinků byl u pacientů léčených placebem 65 %, u pacientů léčených doporučenými dávkami LCM byl 70 % a 82 % při dávkách 200 a 400 mg/den. Z důvodů nežádoucích účinků ukončilo léčbu 5,2 % pacientů na placebu; 8,1 % a 17,2 % pacientů léčených LCM 200 a 400 mg/den a 28,6 % na dávce 600 mg/den. Nejčastějšími příčinami ukončení léčby byla závrativost a poruchy koordinace [7,16–18,22]. Z pivotních studií pak vyplynula maximální doporučená terapeutická dávka 400 mg/den, která zohledňuje optimální poměr účinnosti a tolerability LCM.
![Výskyt nežádoucích účinků v registračních studiích (populace bezpečnosti, N = 1 308).
Upraveno dle [8]](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/9a45f6ee655d7b4d85c411e07ef93d33.jpeg)
Léčba LCM byla spojena s mírným, na dávce závislým prodloužením PR intervalu a s rizikem AV blokády I. stupně (0,4–0,7 % pacientů). Blokády II. a III. stupně nebyly zaznamenány. Kontraindikací k léčbě LCM jsou AV blokády II. a III. stupně, pozornost je nutno věnovat všem pacientům s převodními poruchami, kardiálním onemocněním, starším pacientům a kombinacím s léky, které mohou prodlužovat PR interval.
LCM nezpůsoboval změny v hmotnosti, v krevním obraze a v biochemických nálezech, kromě přechodné elevace ALT (0,7 % pacientů), bez vzestupu bilirubinu a nutnosti další léčby. Výskyt psychických poruch byl nízký, deprese se vyskytovala u 1,5–2,1 % pacientů.
V dlouhodobých studiích byl profil nežádoucích účinků obdobný, k ukončení léčby vedly u 11 % léčených pacientů. Profil vedlejších účinků po i.v. podání LCM byl obdobný [7,23].
V následných analýzách [21] byl výskyt nežádoucích účinků LCM vyšší v případě kombinace s blokátory Na+ (obdobný profil nežádoucích účinků) oproti kombinaci s léky působícími jinými mechanizmy (obr. 8). Někteří autoři proto doporučují v případě kombinace LCM s Na+ blokátory pozvolnější titraci, případně mírné snížení původní léčby.
![Nežádoucí příhody vedoucí k vysazení ve vztahu ke kombinované léčbě, nejnižší hodnoty byly při kombinaci LCM s antiepileptiky nepůsobícími přes Na+ kanál.
Upraveno dle [21]](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/351b3b88f93462c6d5c624836cd36fbe.jpeg)
Současné postavení lacosamidu v léčbě epilepsie
Lacosamid je v současné době nejnovější moderní antiepileptikum, které je indikováno k přídatné léčbě fokální epilepsie u dospělých pacientů. LCM má nový mechanizmu účinku a optimální farmakokinetický profil, včetně nevýznamných lékových interakcí s ostatními antiepileptiky a dalšími léky, bez indukce či inhibice hepatálních enzymů. V klinických studiích prokázal vysokou a dlouhodobou účinnost i přes značnou míru farmakorezistence sledovaných pacientů. Nástup účinku byl rychlý, a to již při dávkách 100 mg/den [7]. Účinnost LCM nezávisela na typu původní léčby, nicméně studie naznačují, že by mohla být vyšší v případě kombinace s antiepileptiky, která nepůsobí prostřednictvím Na+ kanálů [21].
Profil nežádoucích účinků je obdobný jako u ostatních antiepileptik působících přes Na+ kanály, v doporučených terapeutických dávkách nejčastěji závratě, bolesti hlavy a nauzea. Většinou byly lehkého až středního stupně, vyskytovaly se nejvíce v době titrace a během další léčby měly tendenci odeznívat. Na tyto skutečnosti je vhodné pacienty předem upozornit. V kombinaci s blokátory Na+ kanálů může být, vzhledem k jejich obdobnému profilu, výskyt nežádoucích účinků vyšší. V případě přídatné léčby k Na+ blokátorům někteří autoři doporučují mírné snížení původní léčby, případně pomalejší titraci. Léčba LCM nebyla provázena změnami hmotnosti ani zvýšeným výskytem vyrážek (rash). Oproti klasickým antiepileptikům byl výskyt útlumu, kognitivních poruch a deprese nízký.
Iniciální dávka LCM je 50 mg dvakrát denně, podle klinické potřeby je možno ji zvýšit po týdnu o 100 mg/den (2 × 100 mg/den) do maximální doporučené terapeutické dávky 400 mg/den (2 × 200 mg/den). Z hlediska nežádoucích účinků a dávkování LCM je nutno zohlednit především renální a hepatální funkce, případná kardiální rizika a vyšší věk pacientů.
Lacosamid je nadějný lék při nutnosti parenterální léčby epilepsie, dávkování i profil nežádoucích účinků jsou obdobné. Na zasedání American Epilepsy Society, Annual Meeting 2010, San Antonio, Texas byly referovány dobré zkušenosti LCM při léčbě epileptického statu a byl zařazen do léčebného algoritmu jako alternativa např. k PHT.
V předklinických i klinických studiích je LCM účinný při léčbě neuropatické bolesti, a potenciálně tak využitelný u pacientů s epilepsií a touto komorbiditou. K léčbě vlastní neuropatické bolesti však zatím není v ČR registrován. Dle dostupných poznatků není LCM lékem volby u epilepsií idiopatických, generalizovaných.
Provedené studie se dosud týkaly přídatné léčby LCM u dospělých pacientů s farmakorezistentní fokální epilepsií a s polyterapií. LCM je však využitelný již jako lék druhé volby. Přináší nové možnosti kombinované léčby a lze očekávat, že při včasném využití u méně refrakterních pacientů může být jeho přínos vyšší než v původních studiích. Zajímavé jistě budou další cílené analýzy kombinované léčby LCM s blokátory Na+ kanálů a s léky působícími jinými mechanizmy. Probíhající vědecké studie budou hodnotit přínos léčby LCM v monoterapii, v pediatrické populaci a u generalizovaných záchvatů. Lacosamid však čekají i otevřené, naturalistické studie u méně refrakterních pacientů, které více odpovídají klinické praxi.
Seznam zkratek
- CBZ karbamazepin
- GBP gabapentin
- LCM lacosamid
- LEV levetiracetam
- LTG lamotrigin
- PHT fenytoin
- TPM topiramát
- VPA valproát, soli kyseliny valproové
- GTCS záchvat generalizovaných tonicko-klonických křečí
Práce je podpořena výzkumným záměrem Patofyziologie neuropsychických onemocnění a její klinické aplikace VZ 002-1620816
doc.
MUDr. Jiří Hovorka, CSc.
Neurologické
oddělení, neuropsychiatrické
a epileptologické centrum
Nemocnice Na Františku
Na Františku 847/8
110
00 Praha 1
Neurochirurgická
klinika 1. LF UK a ÚVN Praha
e-mail:
hovorka@nnfp.cz
Zdroje
1. Hauser WA, Annegers JF, Kurland LT. Incidence of epilepsy and unprovoked eizures in Rochester, Minnesota: 1935–1984. Epilepsia 1993; 34(3): 453–468.
2. Hovorka J.Farmakologická léčba epilepsie. Cesk Slov Neurol N 2010; 73/106(4): 351–373.
3. Blume WT, Luders HO, Mizrahi E, Tassinari C, van Boas E, Engel J jr. Glossary of descriptive terminology for ital semiology: report of the ILAE task force on classification and terminology. Epilepsia 2001; 42(9): 1212–1218.
4. Fisher RS, van Emde Boas W, Blume W, Elger C, Genton P, Lee P et al. Epileptic seizures and epilepsy: definitions proposed by the International League Against Epilepsy (ILAE) and the International Bureau for Epilepsy (IBE). Epilepsia 2005; 46(4): 470–472.
5. Canevini MP, De Sarro G, Galimberti CA, Gatti G, Licchetta L, Malerba A et al. Relationship between averse effects of antiepileptic drugs, number of coprescribed drugs, and drug load in large cohort of consecutive patients with drug-refractory epilepsy. Epilepsia 2010; 51(5): 797–804.
6. Beyreuther BK, Freitag J, Heers C, Krebstfanger N, Scharfenecker U, Stohr T. Lacosamide: a review of preclinical properties. CNS Drug Rev 2007; 13(1): 21–42.
7. Beydoun A, D’Souza J, Hebert D, Doty P. Lacosamide: pharmacology, mechanisms of action and pooled efficacy and safety data in partial-onset seizures. Expert Rev Neurotherapeutics 2009; 9(1): 33–42.
8. Cross SA, Curran MP. Lacosamide in partial-onset seizures. Drugs 2009; 69(4): 449–459.
9. Errington AC, Stohr T, Heers C, Lees G. The investigational anticonvulsant lacosamide selectively enhances slow inactivation of voltage-gated sodium channels. Mol Pharmacol 2008; 73(1): 157–169.
10. McCleane G. Lacosamide for pain. Expert Opin Investig Drugs 2010; 19(9): 1129–1134.
11. Bialer M, Johannenssen SI, Kupferberg HJ, Levy RH, Perruca E, Thomson T. Progress report on new antiepileptic druha: a summary of the Eight Eilat Konference (EILAT VIII). Epilepsy Res 2007; 73(1): 1–52.
12. Cawello W, Kropeit D, Schiltmeyer B, Hammes W, Hostmann R. Foot does not affect the pharmacokinetics of SPM 927. Epilepsia 2007; 45 (Suppl 7): 307.
13. Thomas D, Scharfenecker U, Schiltmeyer B. Low potential for drug-drug interaction of lacosamide. Epilepsia 2006; 47 (Suppl 4): 200.
14. Kropeit D, Schiltmeyer B, Cawello W, Hammes W, Horstmann R. Bioequivalence of short –time infusions comparet to oral administration of SPM 927. Epilepsia 2004; 45 (Suppl 7): 123–124.
15. Donáth V, Kuchar M, Sýkora P. Epilepsia. Bratislava: Slovenské pedagogické nakladatelstvo 2000.
16. Ben-Menachem E, Biton V, Jatuzis D, Abou-Khalil B, Doty P, Rudd GD. Efficacy and safety of oral lacosamide as adjuctive therapy in adults with partial-onset seizures. Epilepsia 2007; 48(7): 1308–1317.
17. Chung S, Sperling MR, Biton V, Krauss G, Hebert D, Rudd GD et al. Lacosamide as adjunctive therapy for partial-onset seizures: a randomizes controlled trial. Epilepsia 2010; 51(6): 958–967.
18. Halász P, Kälviäinen R, Mazurkiewicz-Beldzińska M, Rosenow F, Doty P, Hebert D, Sullivan T. Adjunctive lacosamide for partial –onset seizures: Efficacy and safety results from a randomized controlled trial. Epilepsia 2009; 50(3):443–453.
19. Rosenfeld W, Fountain NB, Koubrys G, Heinzen L, McShea C. Lacosamide an interim evaluation of long--term safety an efficacy as oral adjunctive therapy in subjects with partial-onset seizures. Poster, 8th European Epilepsy Congress on Epileptology, 2008, Berlin, Germany.
20. Ben-Menachem E, French JA, Isojarvi J, Hebert D, Daty P. Long term efficacy of lacosamide for partial-onset seizures on interim evaluation of completer cohorts exposed to lacosamide for up to 36 month. Poster, American Epilepsy Society 63rd Annual Meeting 2009, Boston, MA.
21. Sake JK, Hebert D, Isojärvi J, Doty P, De Backer M, Davies K et al. A Pooled Analysis of Lacosamide Clinical Trial Data Grouped by Mechanism of Action of Concomitant Antiepileptic Drugs. CNS Drugs 2010; 24(12): 1055–1068.
22. Gil-Nagel A, Biton V, Fountain J, Hebert D, Daty P. The safety and tolerability of lacosamide in randomised, double-blind, placebo-controlled phase II/III clinical trials. Poster, 28th International Epilepsy Congress 2009, Budapešť, Hungary.
23. Biton V, Rosenfeld WE, Whitesides J, Fountain NB, Vaicinie N, Rudd GD. Intravenous lacosamide as replacement for oral lacosamide in patients with partial-onset seizures. Epilepsia 2008; 49(3): 418–424.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie
2011 Číslo 1
-
Všechny články tohoto čísla
-
Výroční kongres České neurochirurgické společnosti ČLS JEP
3.–5. 11. 2010, Clarion Congress Hotel Ostrava
Neurochirurgická klinika Fakultní nemocnice Ostrava - Farmakologická neuroprotekce u akutní ischemické cévní mozkové příhody
- Účinnost piracetamu, vinpocetinu a Ginkgo biloba na poruchy učení a paměti vyvolané antipsychotiky.
- Neurologie v České a slovenské neurologii a neurochirurgii
- Validizační studie české verze dotazníku FAQ
- Resekční epileptochirurgie u pacientů s perirolandickou epilepsií
- 12-kDa FK 506-vážící protein zapojený do neuroprotektivního účinku dantrolenu v mozkové kůře potkanů po ischemicko-reperfuzním postižení
- Spasticita horní končetiny – modulace terapií botulotoxinem typu A a odraz v kortikální somatosenzitivní aktivaci
-
Botulotoxin v léčbě spasticity horní končetiny po cévní mozkové příhodě
Komentář k práci Opavského et al. Spasticita horní končetiny – modulace terapií botulotoxinem typu A a odraz v kortikální somatosenzitivní aktivaci - Peroperační kontrola funkce extra-intrakraniálního bypassu ultrazvukovými metodami
- Nadužívání léků pacienty s chronickou denní bolestí hlavy v České republice
- Extrémna hypertrofia periférnych nervových štruktúr pri CIDP – kazuistika
- Komentář k článku J. Michalika et al Extrémna hypertrofia periférnych nervových štruktúr pri CIDP
- Nokardiové abscesy mozku – dvě kazuistiky
- Komentář k práci Krajina et al Endovaskulární rekanalizace při léčbě akutních uzávěrů mozkových tepen
- Komentář ke komentáři Masopust et al k práci Matoušek et al Endoskopická transnazální chirurgie hypofýzy – výhody spolupráce otorinolaryngologa a neurochirurga
- Komentář k minimonografii Ošlejšková et al Autizmy: Poruchy autistického spektra v pohledu biomedicíny
- Prof. MUDr. Vladimír Beneš, DrSc., st. – devadesát let
- Lacosamid (Vimpat®) – nový lék pro přídatnou léčbu pacientů s fokální epilepsií
- Monitoring pacientů s těžkým poraněním mozku
- Webové okénko
-
Analýza dat v neurologii
XXV. Hodnocení diagnostických testů – senzitivita a specificita
-
Výroční kongres České neurochirurgické společnosti ČLS JEP
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Monitoring pacientů s těžkým poraněním mozku
- Lacosamid (Vimpat®) – nový lék pro přídatnou léčbu pacientů s fokální epilepsií
- Účinnost piracetamu, vinpocetinu a Ginkgo biloba na poruchy učení a paměti vyvolané antipsychotiky.
- Nadužívání léků pacienty s chronickou denní bolestí hlavy v České republice
