Monitoring pacientů s těžkým poraněním mozku
Monitoring of Patients with Severe Head Injury
Head injury is defined as severe in patients with a post-resuscitation Glasgow coma scale (GCS) figure of ≤8. Such patients are relatively deeply unconscious and cannot follow instructions. Therefore we need continuously to monitor those parameters that provide us with important information regarding patient condition and brain function. In recent years, the possibility of monitoring certain cerebral and intracranial function parameters has been added to the routine intensive care watch repertoire of pulse oxymetry, blood pressure, body temperature, laboratory monitoring, central venous pressure, fluid balance, end-tidal CO2, etc. Monitoring of neurological status, particularly the level of consciousness (GCS) and the pupils is obvious. In terms of invasive intracranial monitoring it is currently practically mandatory that intracranial pressure (ICP) be monitored, either by means of external ventricular drainage or by intraparenchymal probe. As well as this, we monitor cerebral perfusion pressure (CPP). Monitoring of brain tissue oxymetry (PtiO2) is becoming a standard modality, while microdialysis is also frequent in some departments. CT monitoring is very important to the clinician, particularly in the initial phases after the injury, mainly as an indication for decision-making in certain operative procedures. Individual approaches to multimodal monitoring have to be evaluated in relationship to one another and the patient. Special types of software help us to evaluate the indices of vascular reactivity and this knowledge is currently used to establish the optimal CPP for the individual patient. Monitoring of cerebral physiology should not be purposeless, but should serve for early diagnostics of pathological conditions and at the same time may indicate a correctly performed therapeutical intervention.
Key words:
severe head injury – multimodal monitoring
Autoři:
prof. MUDr. Martin Smrčka, CSc.
Působiště autorů:
Neurochirurgická klinika LF MU a FN Brno
Vyšlo v časopise:
Cesk Slov Neurol N 2011; 74/107(1): 9-21
Kategorie:
Minimonografie
Souhrn
Pacienti s těžkým poraněním mozku jsou obecně definováni jako pacienti s poresuscitačním GCS ≤ 8. Jedná se tedy o pacienty, kteří jsou v relativně hlubokém bezvědomí a nevyhoví výzvě. Z toho důvodu je nutný kontinuální multimodální monitoring parametrů, které nám poskytnou nezbytné informace o zdravotním stavu pacientů a jejich mozkových funkcích. V současné době máme možnost kromě běžných monitorovaných parametrů v rámci intenzivní péče (krevní tlak, centrální žilní tlak, pulzní oxymetrie, end-tidal CO2 ve vydechovaném vzduchu, tělesná teplota, laboratorní monitoring, bilance tekutin) monitorovat také hodnoty některých mozkových a nitrolebních parametrů. Pochopitelný je monitoring neurologického stavu, především stav vědomí a šíře zornic. V rámci metod invazivního monitoringu je v současné době u této skupiny pacientů prakticky povinností monitorovat nitrolební tlak (ICP), a to buď pomocí komorové drenáže, nebo intraparenchymovým čidlem. Zároveň s tím monitorujeme také mozkový perfuzní tlak (CPP). Prakticky standardem se stal také monitoring tkáňové oxymetrie (PtiO2) a na mnoha pracovištích se provádí též běžně monitoring pomocí mikrodialýzy. Pro klinika je samozřejmě také velmi důležitý CT monitoring, hlavně v počátečních fázích po poranění, kvůli eventuální indikaci operačního výkonu. Velmi důležité je, že jednotlivé metody multimodálního monitoringu musejí být vyhodnocovány ve vzájemné souvislosti. Speciální softwary nám pomáhají vyhodnocovat indexy cévní reaktivity, které slouží ke stanovení optimálního mozkového perfuzního tlaku pro konkrétního pacienta. Monitoring mozkové fyziologie nesmí být samoúčelný, ale musí sloužit k včasné diagnostice patologických stavů a zároveň musí fungovat jako kontrolní indikátor správně provedené terapeutické intervence.
Klíčová slova:
těžké poranění mozku – multimodální monitoring
Úvod
Pacienti s těžkým poraněním mozku jsou definováni jako pacienti s poresuscitačním stavem vědomí na úrovni GCS 3–8. V současné době je známo, že o osudu pacienta s těžkým poraněním mozku rozhoduje kromě operace také kvalitní resuscitační a intenzivní péče. Léčebné úkony, které se provádějí v rámci intenzivní péče o pacienta po těžkém poranění mozku, jsou v současné době uskutečňovány racionálně na základě řady monitorovaných parametrů. Vzhledem k tomu, že se jedná o pacienty v bezvědomí, je monitoring ať už systémových nebo intrakraniálních veličin pro tyto pacienty naprosto zásadní. Protože jde o mnoho nejrůznějších monitorovaných parametrů, mluvíme o tzv. multimodálním monitoringu.
Základní multimodální monitoring již byl doporučován evropskými a americkými guidelines jako monitorovací standard u pacientů s těžkým KCP koncem 90. let [1,2].
Monitoring systémových parametrů:
- pulzní oxymetrie
- krevní tlak (invazivně)
- tělesná teplota
- laboratorní monitoring
- centrální žilní tlak
- bilance tekutin
Monitoring cerebrálních parametrů:
- neurologický stav
- nitrolební tlak (ICP)
- perfuzní tlak (CPP)
- jugulární oxymetrie (SvjO2)
- tkáňová oxymetrie (ptiO2)
- regionální saturace hemoglobinu kyslíkem (near infrared spectroscopy, NIRS)
- monitorování průtoku krve mozkem (CBF)
- mikrodialýza
- teplota mozku
- CT monitoring
Monitoring systémových parametrů
EKG
EKG je pochopitelně modalita, kterou je nutno sledovat u všech závažných pacientů, pacienty po těžkém poranění mozku nevyjímaje. Z neurochirurgického hlediska nás může zajímat bradykardie, která v souvislosti se systémovou hypertenzí může znamenat nitrolební hypertenzi (Cushingův reflex). V tomto ohledu je samozřejmě podstatnější samotný ICP monitoring. Tachykardie může mít nejrůznější příčiny (kardiální příčiny, šokový stav, febrilie). Tachykardie může být způsobena také vazopresory (především dopaminem), které někdy používáme k dosažení optimálního CPP. Rovněž z toho důvodu dáváme v této indikaci přednost noradrenalinu. Další patologické nálezy na EKG (extrasystoly, převodní poruchy a jiné) obvykle nemívají přímou souvislost s poraněním mozku, ale příčina bývá spíše kardiální.
Pulzní oxymetrie
Saturace hemoglobinu kyslíkem v periferní krvi by měla být u pacientů po těžkém poranění mozku na hodnotě > 95 %. Vzhledem k tomu, že se u nich snažíme zamezit rozvoji sekundární mozkové ischemie, je tento požadavek logický. Problémy vznikají u pacientů s polytraumaty, kontuzemi hrudníku nebo s rozvinutým ARDS. Hodnotu saturace můžeme ovlivnit nastavením ventilačního režimu včetně přechodného zvýšení frakce kyslíku ve vdechované směsi nad obvyklých 40 %.
Krevní tlak
Dnes je již nezbytným požadavkem kontinuální monitoring arteriálního krevního tlaku invazivně, nejčastěji cestou a. radialis. Tento monitoring slouží nejen ke zjištění aktuálních hodnot systémového krevního tlaku, ale také se z hodnoty středního arteriálního krevního tlaku a ICP odvozuje hodnota mozkového perfuzního tlaku (CPP). Mnohé monitory v současnosti již tento výpočet provádějí automaticky. V obecné rovině platí, že krevní tlak u pacientů s těžkým poraněním mozku by měl být normální nebo vyšší s přihlédnutím k individuálním potřebám pacienta. Úmyslně využíváme hypertenzi v případech, kdy léčíme podle CPP protokolu a nejsme schopni jinak než pomocí vazopresorů dosáhnout CPP většího než 60 mmHg. Korelace hodnot krevního tlaku a ICP se také používá ke zjištění schopností autoregulace mozkových cév (tzv. pressure reaktivity index, PRx) [3].
Tělesná teplota
Monitoring tělesné teploty je pochopitelně u pacientů s těžkým poraněním mozku velmi důležitý, protože zvýšená tělesná teplota prokazatelně zhoršuje rozvoj sekundárního ischemického postižení mozku. Navíc pacienti na řízené ventilaci mají často nejrůznější infekční komplikace, které vedou k hyperpyrexii. V takovém případě je kromě obvyklé léčby infekce standardním postupem také fyzikální chlazení za účelem dosažení normotermie [4]. Vhodnou metodou měření tělesné teploty u těchto pacientů je měření centrální teploty například pomocí močového katétru, které navíc může být kontinuální. Centrální teplota lidského těla je asi o 0,5 °C vyšší než teplota periferní a více se blíží teplotě mozku. Hypotermie aplikovaná léčebně u pacientů po těžkém poranění mozku byla zkoušena v mnoha klinických studiích, ale jednoznačné závěry zatím nejsou. Většina studií však prokazuje efekt hypotermie na nitrolební hypertenzi ve smyslu snížení ICP [5].
Laboratorní monitoring
V tomto případě se samozřejmě nejedná o kontinuální monitoring, ale vzhledem k relativně častým laboratorním abnormalitám u pacientů po těžkém poranění mozku by zvláště v iniciální fázi po poranění měla být četnost vyšetření poměrně vysoká. Samozřejmostí je vyšetření krevních plynů nejlépe z arterie, ve vztahu k řízené ventilaci těchto pacientů, alespoň po 8 hod. Optimální hodnoty vyšetření krevních plynů (Astrup) jsou: paO2 >13,3 kPa; SaO2 > 95 %; paCO2 4,2–4,8 kPa; pH – norma (2). PaCO2 < 4,2 kPa již představuje specifickou léčebnou modalitu – hyperventilaci. Důležitou roli v tomto ohledu hraje též monitoring end-expiratory ETCO2, který může být navíc kontinuální. Velmi nutné je v iniciální fázi vyšetření hemokoagulace a krevního obrazu. Důvodem je možná warfarinizace nebo abnormální jaterní funkce, které jsou nyní poměrně časté. Nejhorší situací je diseminovaná intravaskulární koagulopatie (DIC) u polytraumatizovaných pacientů. Vyšetření iontů, osmolality, urey a kreatininu a močové vyšetření je také velmi důležité vzhledem k možnosti rozvoje cerebral salt wasting syndromu (CSWS) a syndromu inadekvátní sekrece antidiuretického hormonu (SIADH) [6]. Výše uvedená vyšetření by měla být prováděna denně. Samozřejmě v iniciální fázi po poranění a také v souvislosti s možnými operačními výkony i mnohem častěji.
Centrální žilní tlak (CVP)
Monitoring CVP u pacientů po těžkém poranění mozku provádíme buď kontinuálně, nebo intermitentně. Protože tito pacienti obvykle vyžadují zvýšenou polohu horní poloviny těla o 15–30 stupňů, kontinuálně monitorovaná hodnota CVP by neodpovídala realitě. Proto CVP měříme spíše intermitentně, např. po 8 hod, kdy uvedeme pacienta na co nejkratší dobu do horizontální polohy. Na některých pracovištích se poloha pacienta při měření CVP nemění a hodnotí se pouze trend. Vzhledem k častému využití antiedematózní terapie pomocí diuretik je měření CVP (v souvislosti s bilancí tekutin) velmi důležitý parametr [7]. Naší snahou je antiedematózní terapie a nikoliv dehydratace. Pochopitelně dalším důvodem monitoringu CVP je funkce srdečního svalu. Snažíme se o udržení CVP v normálních mezích, tedy 0–10 cm H2O.
Bilance tekutin
Měření bilance tekutin probíhá nepřetržitě. Mozkový edém je častou komplikací těžkého poranění mozku a přispívá k rozvoji nitrolební hypertenze. V těchto případech použití diuretik a antiedematózních látek způsobuje nejen přesun tekutiny z mozkového parenchymu do cév mozkového řečiště, ale také zvýšenou diurézu. Systémová dehydratace by pak mohla být kontraproduktivní. Z tohoto důvodu u pacientů po těžkém poranění mozku hradíme tekutiny do přibližně vyrovnané bilance a snažíme se o příjem a výdej cca tří litrů tekutin za den [8]. V některých případech iontové dysbalance a poruchy sekrece ADH (CSWS a SIADH) může být velikost diurézy až život ohrožující stav, a to zvláště u dětí [9].
Monitoring mozkových parametrů
Neurologický stav
Základní zhodnocení neurologického nálezu je nutností již od prvního vyšetření v přednemocniční fázi péče o kraniocerebrální poranění, kdy ještě pacient není pod vlivem sedace a relaxace. Do zhodnocení základního neurologického obrazu patří:
- stanovení stavu vědomí – Glasgow Coma Scale (GCS)
- stav zornic (šířka, fotoreakce)
- postavení očních bulbů
- zhodnocení motorické odpovědi každé končetiny zvlášť
Pokud je pacient po přijetí do nemocnice pod vlivem sedace a relaxace a jeho neurologický stav před podáním farmak není spolehlivě znám (především GCS), je někdy vhodné provést wake-up test. Zejména hodnocení GCS a stavu zornic musí být prováděno opakovaně (např. po hodině) i u pacientů sedovaných a relaxovaných [10]. Je nezbytné, aby tuto činnost uměl provádět střední zdravotnický personál. Za zmínku stojí opatrnost při otvírání očí pacienta. Mechanické poškození rohovky nebo přenos infekce může mít za následek rohovkový vřed a ztrátu zraku.
Monitoring nitrolebního tlaku (ICP) a perfuzního tlaku (CPP)
Monitoring ICP je nezbytný k vedení správné terapie orientované na zachování normálního perfuzního tlaku a k indikování určitých opatření k udržení ICP a CPP v normálních mezích. V současnosti je monitoring ICP a CPP u pacientů po těžkém poranění mozku již standardní postup.
Indikace k ICP monitoringu
U pacientů s poraněním mozku byly stanoveny indikace pro ICP monitoring následovně [11]:
- pacient s GCS ≤ 8 + abnormální CT nález (hematom, kontuze mozku, edém mozku, komprese bazálních cisteren)
- pacient s GCS ≤ 8 + normální CT nález při přítomnosti aspoň dvou z těchto podmínek:
- věk > 40 let
- porucha hybnosti
- TKsyst < 90 mmHg.
- není doporučení pro rutinní monitoring u pacientů s GCS > 8
Metodika ICP monitoringu
Zlatým standardem z hlediska technologie měření ICP zůstává intraventrikulární katétr se snímačem tlaku nebo v kombinaci s elektronickým měřením. Evakuace likvoru, kterou tento způsob měření umožňuje, je nejen léčebnou, ale může být i diagnostickou metodou. Stejnou výpovědní hodnotu jako intraventrikulární měření má také intraparenchymová lokalizace snímače. Jiná lokalizace snímače ICP než intraventrikulární nebo intraparenchymová není v současné době doporučována [12].
Technika zavedení snímače ICP:
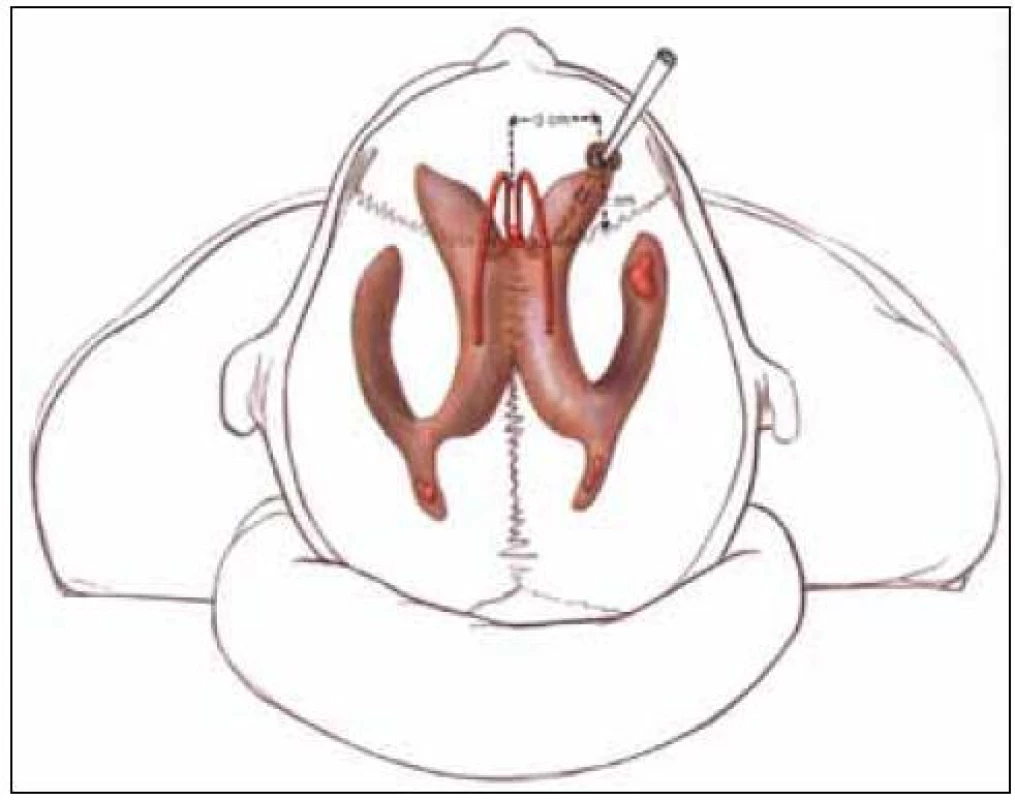
Provedení tohoto výkonu patří do rukou neurochirurga. Podle CT nálezu (velikosti komorového systému) je rozhodnuto o tom, zda bude snímač zaveden intraventrikulárně nebo intraparenchymově. Typická lokalizace trepanace je ve frontální kosti před koronárním švem za hranicí vlasaté části hlavy asi 2 až 3 cm před bregmou a 1,5 až 2 cm laterálně od střední čáry (tzv. Kocherův bod) (obr. 1). Pokud se rozhodneme pro intraventrikulární zavedení snímače, neměli bychom použít víc než tři pokusy. První pokus by měl být směřován na vnitřní koutek homolaterálního oka, druhý pokus na kořen nosu a třetí pokus na vnitřní koutek kontralaterálního oka. Ve směru předozadním je orientačním bodem linie zevních zvukovodů. Důsledně je nutno sledovat hloubku zavedení. V případě neúspěšnosti zavedení do mozkové komory je preferována intraparenchymová lokalizace snímače. Výhodné je použití fixačního šroubu při monitoringu intraparenchymově. Bez ohledu na větší mechanickou odolnost umožňuje také eventuální opětovné zavedení snímače při technické poruše nebo pochybnosti o validitě měření. Při použití vícecestného šroubu je možná instalace dalších snímačů – např. sondy pro tkáňovou oxymetrii nebo mikrodialyzačního katétru. Použití šroubu klade vyšší nároky na kvalitu sutury kůže (možnost okrajových nekróz) (obr. 2).
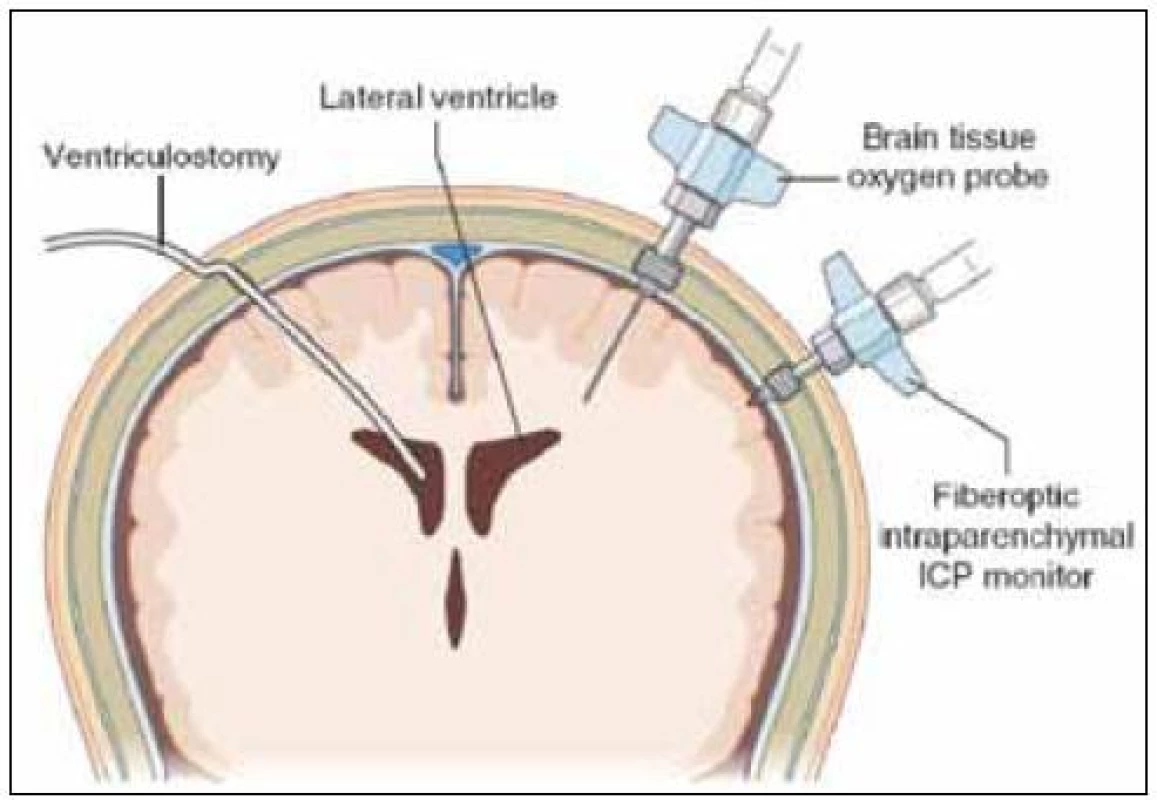
Při použití fibrooptického systému je nutno dbát na teplotu kalibračního roztoku (blízká tělesné teplotě) pro velký teplotní shift. Všechny dosud dostupné elektronické systémy pro intraventrikulární nebo intraparenchymové monitorování neumožňují rekalibraci již zavedeného systému. Výjimkou je intraventrikulární katétr s klasickým externím tlakovým převodníkem.
S více rutinním využíváním dekompresní kraniektomie (DK) u pacientů po těžkém poranění mozku je také stále častěji zvažována problematika ICP monitoringu v této situaci. Někteří autoři zpochybňují nutnost dalšího ICP monitoringu s odůvodněním, že provedením dekompresní kraniektomie již bylo uděláno maximum po stránce možného snížení ICP, a tudíž další ICP monitoring je zbytečný. Nejen dle našeho názoru je však i u pacientů po dekompresní kraniektomii monitorování ICP užitečné [13]. Jednak ze zkušenosti víme, že samotná DK nemusí nutně znamenat snížení ICP do normy. Subgaleální nebo intracerebrální hematom nebo edém mozku může nadále udržovat nitrolební hypertenzi. Navíc čidlem monitorujeme nejen ICP, ale i CPP, které můžeme ovlivnit bez ohledu na to, zda měl pacient provedenu DK nebo nikoliv. U pacientů po DK doporučujeme zavedení ICP čidla do hemisféry, kde kost zůstala, což umožní stabilní polohu čidla. Zavedení ICP čidla do dekomprimované hemisféry se nám neosvědčilo (obr. 3).
Komplikace ICP monitoringu
I když monitorování ICP je dnes považováno za minimálně invazivní postup, musí být součástí každodenního zhodnocení pacienta i úvaha o ukončení sledování ICP.
Mayhall et al (1984) uvádějí, že 85 % všech infekcí v souvislosti s ventrikulostomií bylo při době zavedení delší než pět dnů. U pacientů s dobou zavedení do tří dnů udávají nulový výskyt infekce [14]. Podle našich zkušeností se riziko infekce výrazně zvyšuje po 8–9 dnech. V případě nutnosti proto katétr po uplynutí této doby odstraňujeme a zavádíme znovu z nové trepanace. V současné době navíc existují katétry impregnované baktericidním přípravkem, které mohou být zavedeny i tři týdny. Další faktor zvyšující riziko infekce je frekvence evakuace likvoru. V souvislosti s infekcí je lepší pojmenování problému termínem bakteriální kolonizace, protože ve velkých prospektivních studiích – Mayhall et al, 1984, Narayan et al, 1982 – nebyla uvedena signifikantní intrakraniální infekce v souvislosti s ICP monitoringem. Bakteriální kolonizace snímačů je v úrovni 5 % (0–9,5 %) u ventrikulostomie, 14 % (11,7 %; 16,6 %) při intraparenchymové lokalizaci [14,15].
Vznik hemoragie nebo hematomu je udáván u ventrikulostomie na hodnotě 1,1 % [15]. V případě monitoringu intraparenchymově toto riziko představuje 2,8 % [16]. V souvislosti s ICP monitoringem je výskyt chirurgicky významného hematomu na souboru více než 200 pacientů udáván na hodnotě 0,5 % [17].
Porucha funkce nebo obstrukce ventrikulárního katétru je uváděna v 6,3 %. Při hodnotách ICP vyšších než 50 mmHg je incidence této komplikace daleko vyšší. Porucha funkce je u intraparenchymových snímačů uváděna ve výši 20,5 % [16]. Z našich zkušeností vyplývá, že častým důvodem poruchy je mechanická závada vzniklá například nevhodnou manipulací s pacientem.
Riziko epilepsie v souvislosti s intraventrikulární nebo intraparenchymovou lokalizací snímače je udáváno kolem 2–3 % [18].
Interpretace monitoringu ICP
Za normální hodnotu ICP je podle Lundberga považována hodnota 15 mmHg [19]. Její ekvivalent představuje 200 mm H2O nebo 2 kPa. Horní limit normálních hodnot ICP u dětí je mnohem nižší než Lundbergova hodnota platící pro dospělé. Pro děti ve věku 1–5 let je horní hranice normálních hodnot ICP 5 mmHg a u novorozenců 3 mmHg [20]. Za hranici terapeutické intervence u dospělých je dnes považováno rozmezí 15–25 mmHg s obecně akceptovanou střední hodnotou 20 mmHg.
Lundberg (1960) jasně prokázal, že nitrolební tlak může dosahovat extrémních hodnot u různých intrakraniálních postižení a klinické vyšetření nemusí predikovat vysoké hodnoty ICP. Popsal také dodnes akceptovanou variabilitu hodnot ICP v čase na A, B a C vlny [19].
A vlny (plateau waves) představují rychlý vzestup ICP z normálních hodnot na hodnoty 50 a více mmHg po dobu 5 až 20 min s následnou spontánní redukcí ICP do výchozích hodnot.
B vlny jsou popsány jako ostré vzestupy ICP z normálních hodnot na hodnoty ICP 30 mmHg a více s následným rychlým poklesem, jež se opakují každou 1 až 2 min.
C vlny jsou vzestupy ICP vyskytující se 5–6krát za minutu a jsou v úzkém vztahu s Traube-Hering-Mayerovými vlnami změn krevního tlaku.
Poslední stupeň těžké nitrolební hypertenze, kdy jsou mozkové cévy dilatovány a při výrazně redukovaném CBF jsou patrné pulzace ICP, nazval Langfitt (1969) termínem „vazomotorická paralýza“ [21]. V tomto stupni nitrolební hypertenze již nelze detekovat žádnou vazoaktivní odpověď na normální stimuly (např. snížení paCO2) a změny arteriálního tlaku vyvolávají pasivní změny ICP. Dále Langfitt demonstroval vznik tlakových gradientů při supratentoriální expanzi. Při vzestupu nitrolebního tlaku supratentoriálně, tlak infratentoriálně nejdříve stoupá, pak následuje jeho plateau fáze a potom nitrolební tlak infrantentoriálně začne klesat (měřeno v cisterna magna nebo lumbálně). Tento pokles tlaku nastává po anatomickém oddělení supratentoriální a infratentoriální oblasti blokádou ambientní cisterny při transtentoriální herniaci. Tyto poznatky shrnul do doporučení o nutnosti měření ICP supratentoriálně při supratentoriální expanzi.
Tlakové gradienty jsou detekovatelné i supratentoriálně. Při expanzivně se chovajících ložiskových lézích mohou dosahovat až 10–15 mmHg. Na základě těchto faktů někteří autoři preferuji lokalizaci snímače ICP (zvláště intraparenchymového) v typickém místě na straně nepoškozené a při difuzním poranění je preferována strana nedominantní hemisféry. Instalace čidla do oblasti perikontuzní nebo kontuzní může vést k zjištění hodnot ICP vyšších než průměrných v supratentoriálním kompartmentu a může zapříčinit kontraproduktivní léčebný postup.
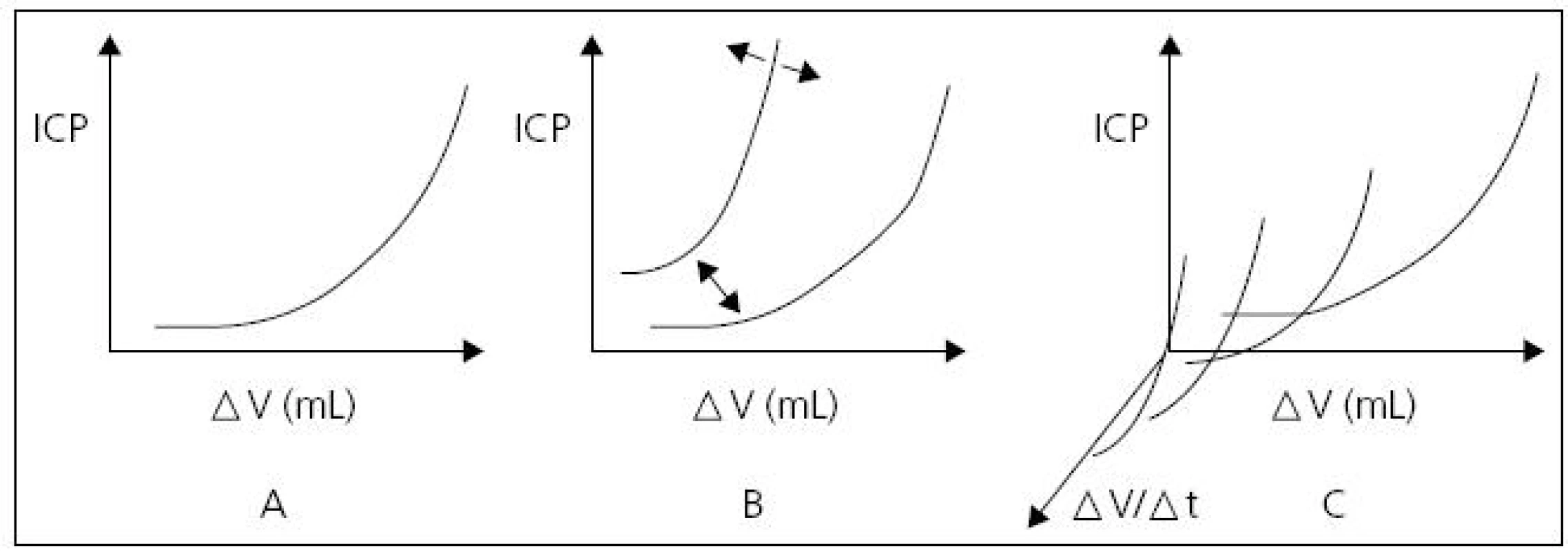
Vztah změny objemu likvoru (odčerpáním nebo aplikací) vůči změně ICP umožňuje posuzovat compliance a elastanci mozku. Závěry analýz ICP na tomto principu publikovali Miller et al (1973) se zavedením volume-pressure response – VPR [22] a také Maset et al (1987) se zavedením volume-pressure index – VPI [23]. Běžně pracujeme se střední hodnotou ICP. Při hodnocení vlastní tlakové křivky ICP je za normálních hodnot ICP patrná amplituda tlaku v rozmezí 3–5 mmHg. Dosud není zodpovězena otázka, zda tato pulzace ICP je primárně arteriálního, venózního nebo obojího původu. Důležité je si uvědomit, že amplituda ICP se zvětšuje úměrně vzestupu střední hodnoty nitrolebního tlaku. Změny tlaku v intrakraniu jsou úměrné rychlosti změny objemů v intrakraniu, velikosti změny těchto objemů a hodnotě nitrolební compliance. Vztah nitrolebního tlaku a nitrolebního objemu je exponenciální, tj. při vysokých hodnotách ICP i malá změna intrakraniálního objemu vyvolá velkou změnu intrakraniálního tlaku (obr. 4).
Monitoring mozkového perfuzního tlaku (CPP)
Mozkový perfuzní tlak je definován jako rozdíl mezi arteriálním tlakem (tlakem krve před vstupem do orgánu) a venózním tlakem (tlakem krve po výstupu z orgánu). Měřit arteriální tlak je poměrně jednoduché, ale měření tlaku v cerebrálních žilách je problematické. Protože se tento venózní tlak velmi blíží tlaku nitrolebnímu, k výpočtu CPP je v praxi používána rovnice: CPP = MAP – mean ICP
Současné monitorovací systémy na JIP z těchto dvou invazivních tlaků již automaticky CPP kalkulují, a máme tak vedle kontinuálního měření ICP také kontinuální monitoring CPP. Příliš nízký CPP způsobuje ischemii, příliš vysoký hyperemii. Autoregulace mozkového krevního průtoku je vlastnost, která brání rozvoji mozkové ischemie tím, že mezi určitými hodnotami CPP udržuje relativně konstantní krevní průtok. Krevní průtok je za fyziologických okolností konstantní mezi hodnotami CPP 40–100 mmHg (autoregulační křivka) (obr. 5).
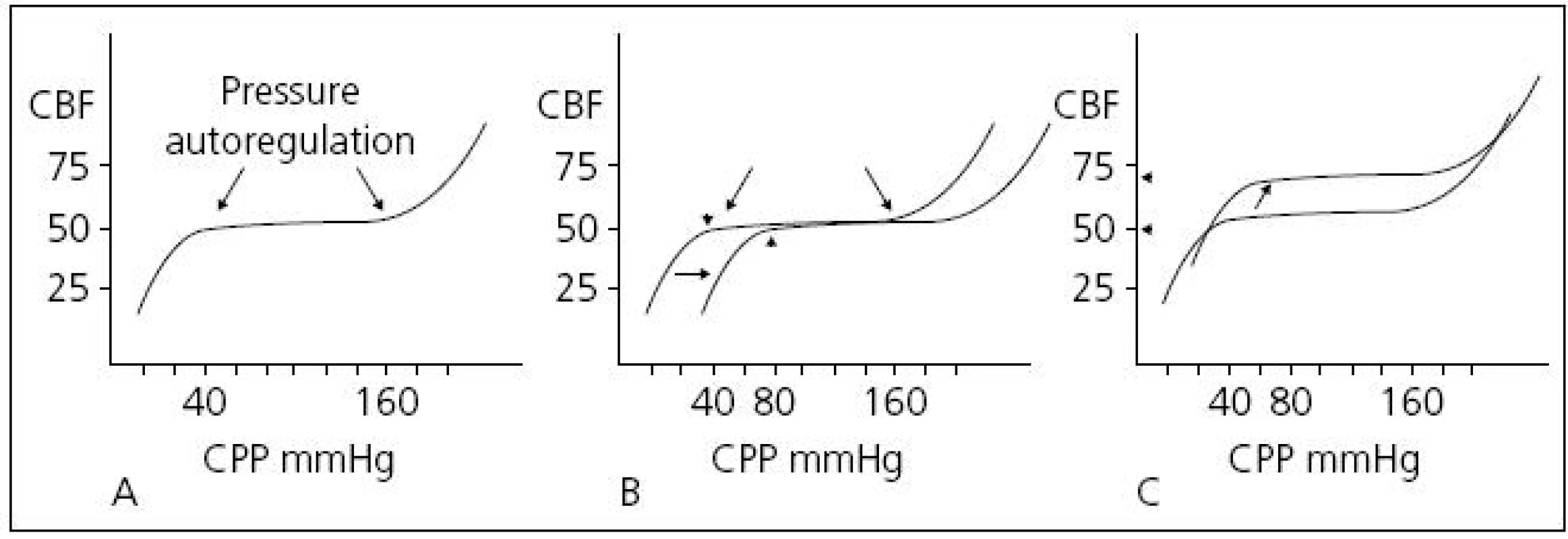
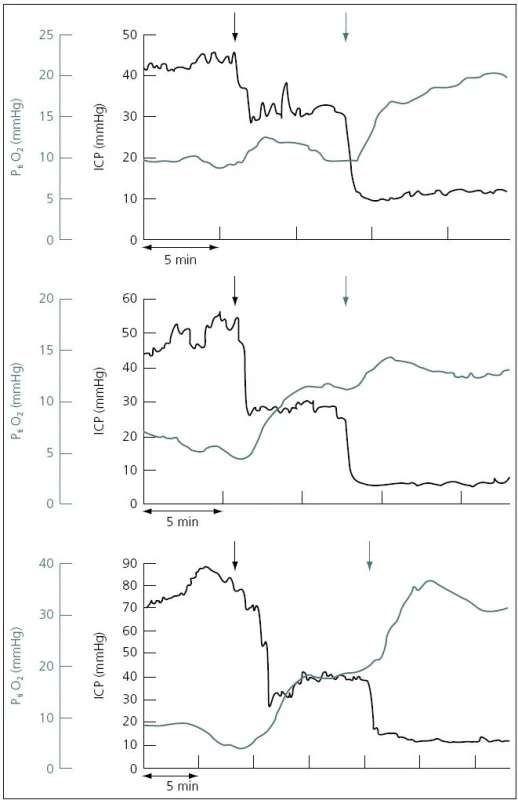
V současné době existují dva koncepty léčby zvýšeného ICP. Tzv. lundský koncept, který je preferován především ve Švédsku, se v léčbě těžkého poranění mozku orientuje zejména na snižování patologicky zvýšeného ICP. Podávání vazopresorů za účelem zvýšení mozkového perfuzního tlaku (CPP) považuje tento koncept za škodlivé. Většinový koncept CPP orientované terapie spočívá v tom, že prioritní je především udržet dostatečný CPP (podle současných amerických guidelines to má být nad 60 mmHg), a to i za cenu mírně zvýšeného ICP. V posledních době oba koncepty mírně konvergují, neboť evropské a americké guidelines již také považují za škodlivé zvyšování CPP nad 90 mmHg [24]. Doporučení Brain Trauma Foundation z roku 2007 je udržet CPP mezi 50 a 70 mmHg. Ke zjištění optimální hodnoty CPP pro individuálního pacienta je možné použít korelaci tzv. pressure reaktivity index (PRx) a CPP. PRx je korelační koeficient mezi ICP (pomalé vlny) a MAP. Ukazuje na schopnost autoregulace mozkových cév. Záporné hodnoty PRx (pokles ICP při zvyšování MAP) svědčí pro nepoškozenou autoregulaci, naopak kladné hodnoty PRx (pasivní zvyšování ICP při zvýšení MAP) znamenají poruchu autoregulace (obr. 6). Optimální CPP je takové, při kterém je nejnižší hodnota PRx [25] (obr. 7).
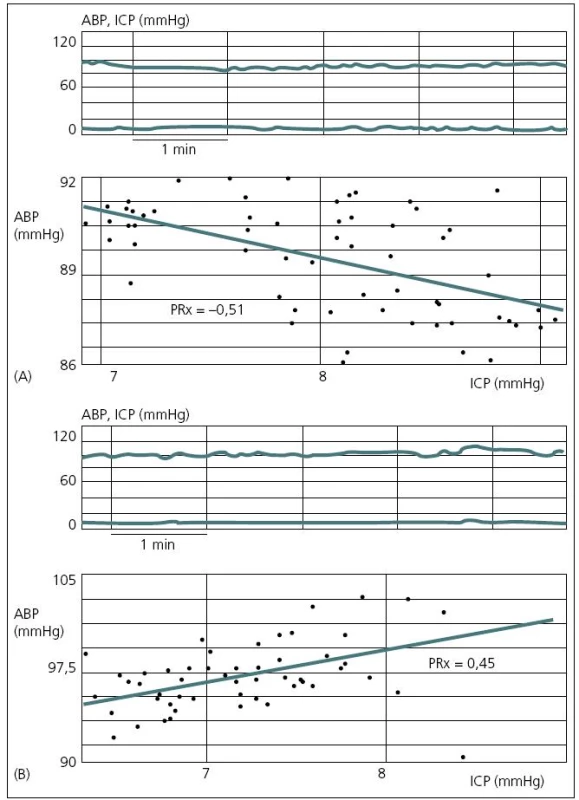
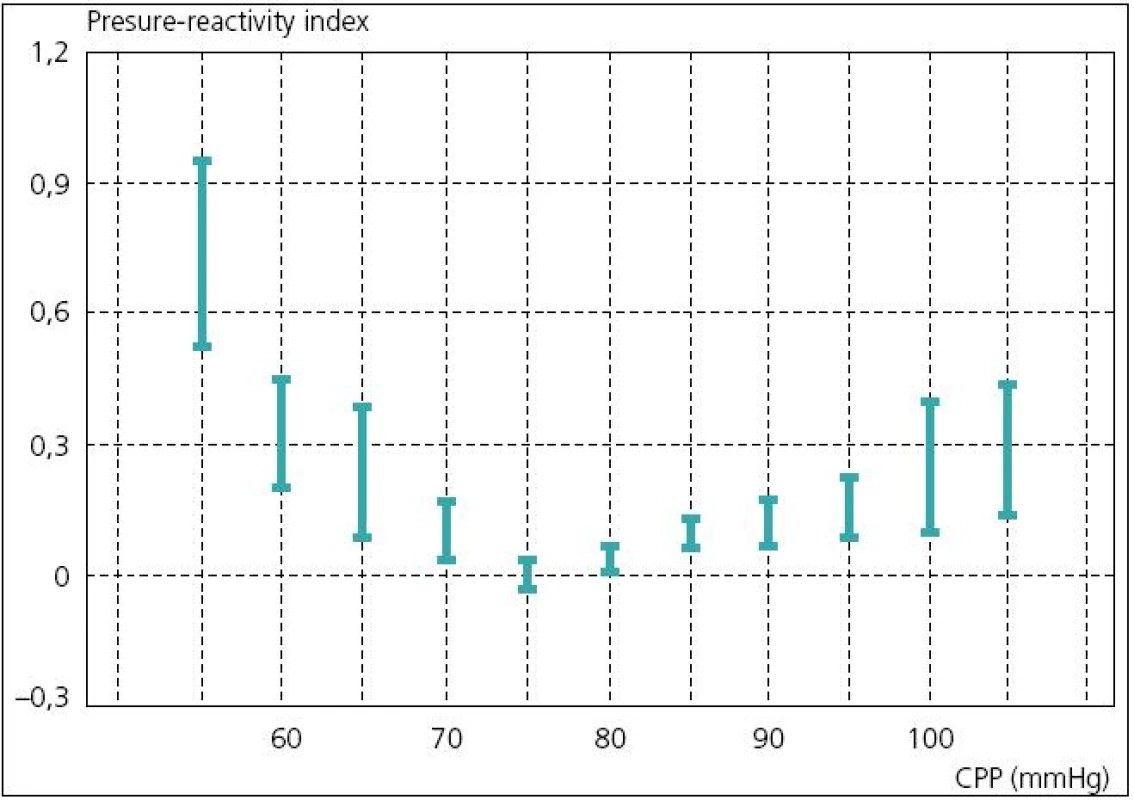
Současné monitorovací systémy mohou být vybaveny softwarem (např. ICM+, Cambridge), který kontinuálně zaznamenává veškeré monitorované parametry (ICP, CPP, ptiO2, CBF a další), vyhodnocuje trendy, dává jednotlivé parametry do nejrůznějších korelací a počítá indexy. Tímto způsobem je možno kontinuálně monitorovat např. změny cerebrovaskulární reaktivity, odvozené od nejrůznějších monitorovaných parametrů [26].
Jugulární oxymetrie
Kontinuální monitoring saturace kyslíku v jugulárním bulbu (SjO2) umožňuje detekci globální mozkové ischemie, která může být způsobena samotným poraněním nebo např. hyperventilačním režimem ventilátoru. Saturace v jugulárním bulbu by se měla držet mezi 55–75 %.
Indikace pro SvjO2 monitoring u poranění mozku nejsou jednoznačně určeny. Na základě četnosti výskytu desaturačních period (viz dále) se zdá indikační hranicí pro monitoring jugulární oxymetrie stav pacientů při přijetí vyjádřený v hodnotě GCS≤ 8, obzvlášť u pacientů s nitrolební hypertenzí.
Metodika monitoringu jugulární oxymetrie
Z hlediska stranové lokalizace jugulární oxymetrie je doporučována katetrizace dominantního bulbus venae jugularis internae. Z anatomického hlediska je za dominantní bulbus v. jugularis internae (VJI) považována pravá strana v 62 %, levá strana v 26 % a v 12 % má bulbus stejnou velikost [27]. Stoccheti et al (1994) při simultánním měření v obou bulbech u 32 pacientů s těžkým kraniocerebrálním poraněním demonstrovali v průměru jenom pětiprocentní stranovou diferenci v hodnotách SvjO2. Maximální zjištěný rozdíl byl u 15 pacientů vyšší než 15 % [28].
V praxi při rozvaze o tom, která vnitřní jugulární žíla je dominantní, může být nápomocno UZ vyšetření rozměru žíly, eventuálně srovnání velikosti průtoku. V případě, že je u pacienta monitorován ICP, lze střídavou jednostrannou kompresí jugulární žíly porovnat velikost a rychlost vzestupu ICP. Větší a rychlejší vzestup ICP je při kompresi dominantní VJI. Tento lokalizační test musí však být prováděn s přihlédnutím k absolutní hodnotě ICP a CPP. Jinak se rozhodujeme pravděpodobnostně podle předpokládané anatomické dominance pro katetrizaci pravého bulbu VJI.
Dle anatomické konstituce pacienta může být výhodná lehká rotace hlavy kontralaterálně od strany punkce. Vlastní místo vpichu je orientováno mediálně od m. sternocleidomastoideus a v těsné blízkosti laterálně od krkavice v úrovni štítné chrupavky. Za hmatné pulzace krkavice (prevence její punkce) punktujeme nejdříve obvykle „lokalizační“ jehlou v ostrém úhlu ke kůži s hrotem jehly orientovaným rostrálně. Obvykle v hloubce 1–2 cm aspirujeme krev z VJI. Vlastní katetrizační jehla (převážně 20-gauge) často komprimuje stěny VJI. Volné aspirace krve tak bývá dosaženo až při povytahování jehly a ne už při jejím zavádění jako při použití jehly „lokalizační“. Technikou dle Seldingera již při zavádění vodiče pocítíme asi v 13–15 cm vjem „nárazu na bazi lební“. Následuje zavedení sheetu a vlastního fibrooptického vlákna (4F) do hloubky zjištěné vodičem. Polohu vlákna verifikujeme laterálním rtg snímkem, kde hrot vlákna by měl přesahovat úroveň C1/2. Sheet je kontinuálně proplachován roztokem s heparinem (2,5 tis.j./500 ml F1/1). Vlastní fibrooptické vlákno, resp. jeho katétr je používán jenom k odběru vzorků krve (kalibrace, verifikace desaturační periody, laktát).
Možné komplikace související se zaváděním katétru jsou punkce krkavice, poranění krčních nervů. Komplikace při monitoringu mohou být infekce, vzestup ICP, trombóza. Vzhledem k retrográdní poloze vlákna představuje nejčetnější problém dislokace hrotu s následnými technickými obtížemi (nedostatečná intenzita signálu). Výměna katétru se doporučuje v intervalu 5–7 dnů.
Modifikace jugulární oxymetrie v podobě zavedení klasického katétru k intermitentnímu odběru vzorků namísto fibrooptického vlákna je nedostatečná a není doporučována.
Hodnocení parametrů jugulární oxymetrie
Jugulární oxymetrie (SvjO2) může být užitečným monitorem mozkové hypoxie nebo ischemie, protože odráží vztah mezi dodávkou kyslíku do mozku a spotřebou kyslíku v mozku. Parametr tohoto vztahu je označován jako oxygen extraction ratio – O2ER.
O2ER = spotřeba O2 /dodávka O2 = (SaO2 – SvjO2)/SaO2
Arterio-venózní rozdíl (diference) v obsahu kyslíku – AVDO2 po průtoku krve mozkem je definován vztahem:
AVDO2 = (SaO2 – SvjO2) × 1,34 × Hb + (PaO2 – PvjO2) × 0,0031
Vlastní spotřeba kyslíku v mozku je označována jako CMRO2 – cerebral metabolic rate of oxygen. Jakákoliv příčina, která vede ke zvýšení spotřeby kyslíku v mozku nebo snižuje dodávku kyslíku do mozku, může vést ke snížení hodnoty SvjO2. Ke zvýšení spotřeby kyslíku vede např. hypertermie nebo křeče. Příkladem snížení dodávky kyslíku je třeba nízký CBF (nitrolební hypertenze, hypotenze, hypokapnie, vazospazmy) nebo hypoxie a anémie.
Naopak při snížení spotřeby nebo zvýšení dodávky kyslíku může dojít k zvýšení hodnot SvjO2 (hypotermie, barbituráty).
Změny v parametrech dodávky a spotřeby kyslíku v mozkové tkáni za normálního stavu a po poranění mozku a hodnoty těchto parametrů při použití jugulární oxymetrie prezentuje tab. 1.
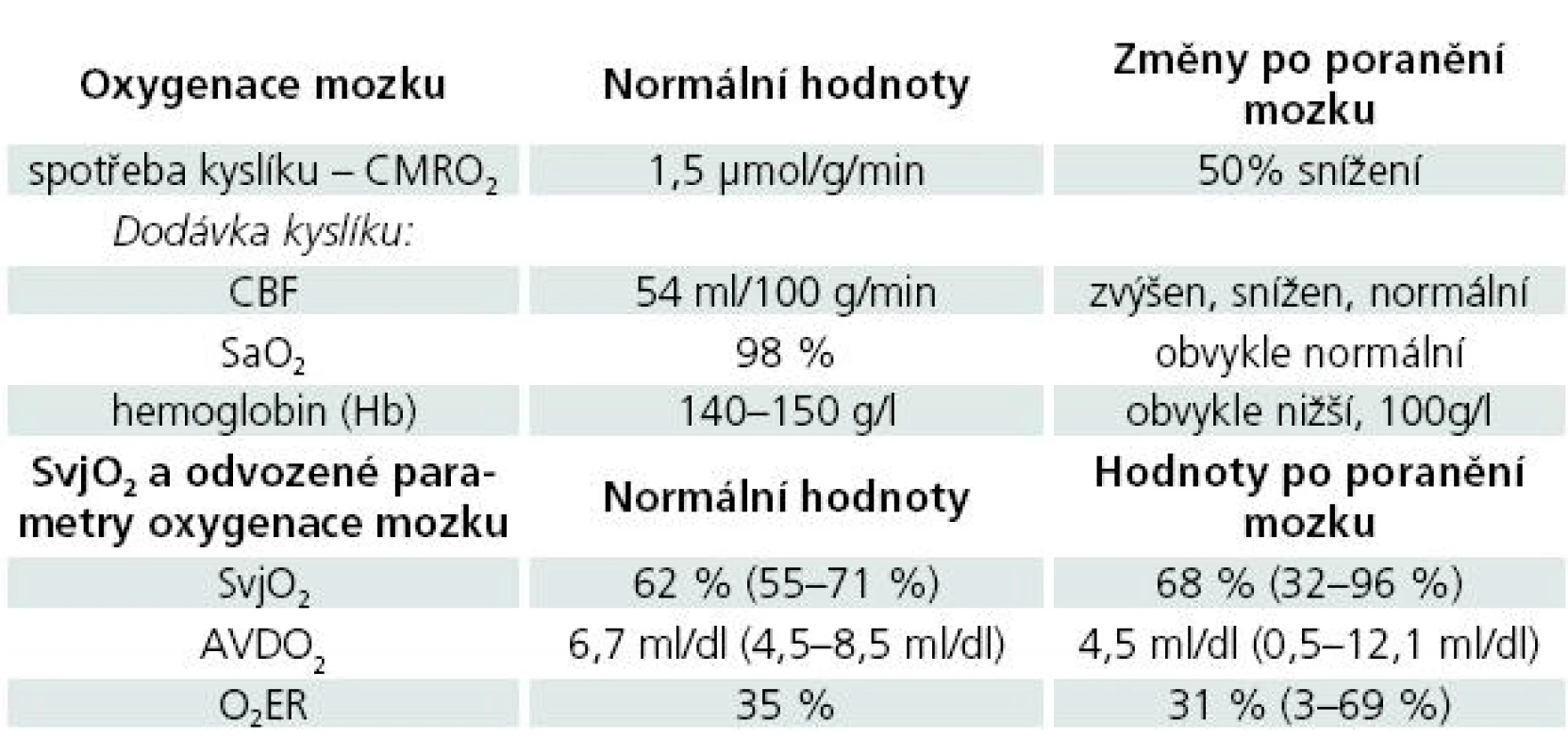
Gibbs et al uvádějí průměrnou hodnotu SvjO2 u zdravých mužů 61,8 % v intervalu 55 až 71 %. Tato hodnota je nižší než saturace kyslíkem u smíšené žilní krve a dokumentuje, že mozek extrahuje více kyslíku než jiné orgány [29].
U zdravého dospělého člověka dochází k manifestaci útlumu vědomí při SvjO2 45 %, bezvědomí s hypoxií při saturaci v bulbu 24 % a k depleci energetických substrátů s následným vzestupem ICP při 15 % [30].
Dosud dostupná data u pacientů s poraněním mozku vedou k závěru, že nejvýznamnějším prognostickým faktorem z hodnot jugulární oxymetrie je výskyt desaturačních period. Desaturační periody jsou definovány jako hodnoty SvjO2 < 50 % v trvání nejméně 10 min. Výskyt dokonce jedné desaturační periody je spojen s dvojnásobným vzestupem mortality, při vícečetných desaturacích mortalita vzrůstá čtyřikrát [31]. Trvání desaturačních period pod 50 % a pod 40 % bylo signifikantně delší u pacientů, kteří skončili ve vegetativním stavu nebo zemřeli [32]. V popředí našeho léčebného snažení v souvislosti s jugulární oxymetrií by mělo být udržení hodnot SvjO2 nad 50 %.
V praxi to znamená při výskytu SvjO2 pod 50 % ihned ověřit tento údaj odběrem vzorku krve. Pokud analýza odběru potvrdí desaturaci, následuje kontrola hodnoty SaO2 a vyloučení anémie. Po vyloučení těchto faktorů následuje navození kapnie (paCO2) v rozmezí 4,66–5,33 kPa a CPP na hodnotě vyšší než 60 mmHg. Po úpravě všech uvedených parametrů a přetrvávání desaturace následuje vyloučení mozkových vazospazmů pomocí transkraniálního UZ. V celém postupu je základním krokem ověření hodnoty desaturace na monitoru odběrem vzorku krve z jugulárního bulbu.
Jugulární oxymetrie může odlišit pacienty s hraničním CBF, u kterých by neměla být prováděna hyperventilace. U hyperventilovaných pacientů může včas zaznamenat snížení CBF. Za doporučovanou nejnižší hodnotu paCO2 je považována ta, při které je O2ER v normálních hodnotách [33].
Významnou limitací monitorování jugulární oxymetrie je bohužel častá náchylnost k technické chybě, která znemožní další měření. Hlavní omezení jugulární oxymetrie v detekci mozkové hypoxie nebo ischemie spočívá v nemožnosti monitorovat regionální mozkové oxygenace. Dalším limitem je skutečnost, že ani krev z dominantního bulbus v. jugularis internae není skutečně smíšenou krví z celého mozku a oblast s ischemií může být drénována do kontralaterální jugulární žíly. Při výrazném poklesu CBF stoupá podíl extrakraniální krve v bulbu v. jugularis internae a to vede k „arteficiálnímu“ zvýšení hodnot SvjO2. I přes tyto problémy jugulární oxymetrie umožňuje detekovat epizody hypoxie mozku, které dosud pozornosti lékaře unikaly. Největší přínos sledování SvjO2 spočívá v silné korelaci četnosti výskytu desaturačních period s výsledným stavem pacienta [34].
Monitoring tkáňové oxymetrie
V posledních letech se stává standardní součástí multimodálního sledování u těžkých mozkových traumat také měření tkáňového kyslíku v mozkové tkáni (PtiO2) [35]. Hodnota PtiO2 je závislá jak na systémové a místní koncentraci kyslíku, tak rovněž na mikrovaskulární perfuzi v mozkové tkáni [36]. Jedná se o fokální monitorování, i když v případě zavedení čidla do zdravé tkáně můžeme takto v podstatě dostávat informace o globální oxygenaci mozkové tkáně. Měřením PtiO2 získáváme kontinuální kvantitativní data, která napomáhají správnému vedení léčby, poskytují důležité prognostické a patofyziologické údaje k detekci sekundárního poranění mozku.
Metodika monitoringu tkáňové oxymetrie
V současnosti je nejběžněji užívaný systém Licox (GMS, Kiel-Mielkendorf, Germany) (obr. 8). Nově je k dispozici také multimodální čidlo Neurovent PTO (Raumedic). Čidlo Neurotrend (Johnson and Johnson) se již v praxi nepoužívá.

Čidlo se nejčastěji zavádí do Kocherova bodu – viz metodika zavedení ICP čidla. U kranicerebrálního traumatu se sonda může také zavést alternativně do oblasti, která dle CT nálezu znamená ohroženou oblast – tzv. penumbru. Místo zavedení čidla v takovém případě závisí na lokalizaci poranění, čidlo se však nikdy nezavádí přes elokventní oblasti nebo do nich. Méně často se při traumatech zavádí čidlo do zdravé tkáně.
Rozsah měřené oblasti je u čidla Licox menší než 1 cm3.
Po zavedení čidla následuje období stabilizace, jehož délka je variabilní a pohybuje se mezi 2–8 hod. V případě rozpojení a nového napojení se čidlo po určitou dobu opět stabilizuje, avšak tato doba je podstatně kratší (5–20 min). Pro správnou činnost systému Licox je nezbytný údaj o tkáňové teplotě, který lze buď vkládat do monitoru ručně, nebo měřit pomocí speciálního teplotního čidla (obr. 9). Dle údajů výrobce připadá na rozdíl 1°C chyba v naměřené hodnotě PtiO2 ± 4 % [37]. Podle výrobce je čidlo schopno poskytovat validní údaje minimálně po dobu pěti dní, naše zkušenosti ukazují, že tato doba je minimálně deset dní. Po deseti dnech Licox obvykle rušíme, abychom předešli riziku infekčních komplikací.
Interpretace monitoringu tkáňové oxymetrie
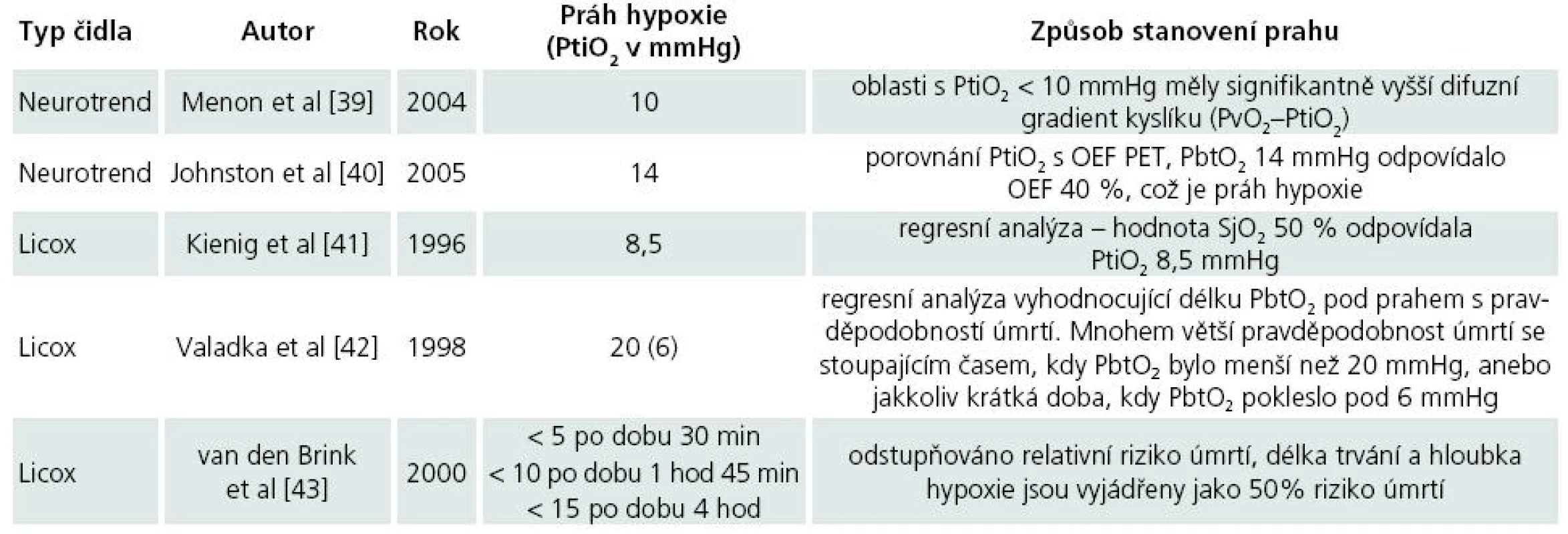
Protože reakce systému pro měření PtiO2 je rychlá [38], a hodnoty PtiO2 jsou tak okamžitě dostupné, můžeme terapeuticky reagovat na zjištěné změny a sledovat odezvy, jichž bylo terapií dosaženo. Hodnoty PtiO2, které jsou označeny za hypoxické, musí být ale zvažovány i v kontextu typu použité sondy, místa zavedení sondy, druhu patologie a také doby trvání hypoxie. Jako prahy hypoxie tak byly navrženy různé hodnoty PtiO2 (tab. 2).
Na základě doporučení uvedených v tab. 2 považujeme za dostatečnou hodnotu tkáňového kyslíku alespoň 20 mmHg. Za alarmující považujeme pak hodnotu 10 mmHg.
Hodnota PtiO2 ve zdravé tkáni koreluje se změnami CPP (tzn. roste při nárůstu MAP či poklesu ICP) [44]. Nárůst PtiO2 byl prokázán např. po provedení dekompresivní kraniektomie společně s poklesem ICP a nárůstem CPP (obr.10) [45,46]. PtiO2 také roste při zvýšení inspirační frakce kyslíku ve vdechované směsi (FiO2) u ventilovaných pacientů. Hodnota PtiO2 rovněž koreluje s poruchami fokální perfuze ve sledovaném povodí. Problematikou monitoringu ptiO2 u mozkových traumat se již několik let zabývají také čeští autoři [46–48].
Near-infrared spectroscopy (NIRS)
NIRS měří neinvazivně transkraniálně hladinu chromoforu oxygenovaného a deoxygenovaného hemoglobinu v mozku cestou rozptylu fotonů. Nejedná se tedy o měření tkáňového kyslíku, ale vlastně o měření saturace mozkového hemoglobinu kyslíkem [49]. Bohužel není přesně jasné, z jaké hloubky a objemu mozkové tkáně jsou tyto parametry snímány. Má se za to, že změny v těchto parametrech by měly odrážet relativní změny v PtiO2 nebo v mozkovém krevním průtoku (cerebral blood flow, CBF). Metoda by mohla být využitelná např. při kontinuálním monitoringu mozkové autoregulace CBF. Nedávno byl také odvozen od NIRS tzv. index THx (total hemoglobin index) sloužící k neinvazivnímu měření cerebrovaskulární reaktivity [50]. Jedná se o perspektivní technologii, jejíž hlavní předností je neinvazivita. Přestože dochází k dalšímu technickému rozvoji NIRS, zatím se jedná spíše o výzkumnou metodu [51].
Monitoring mozkového krevního průtoku (CBF)
Přímé měření mozkového krevního průtoku v absolutních hodnotách ( ml/100 g tkáně/min) je v současné době možné pomocí čidla na principu termodifuze (tzv. Bowmanův monitor – Hemedex) (obr. 11). Distální termistor na sondě se zahřívá na teplotu o 2–3 °C vyšší, než je teplota tkáně. Proximální termistor se nachází 8 mm nad distálním. Z rozdílů teplot a vodivosti mozkové tkáně je vypočítán CBF. Jedná se o fokální monitoring. Aplikace čidla je obdobná jako u PtiO2.
Normální hodnota průtoku krve mozkem je cca 50 ml/100 g/min, v bílé hmotě cca 30 ml/100 g/min. Hodnota CBF naměřená pomocí přístroje Hemedex koreluje také s jinými, již osvědčenými monitorovacími metodami, jako ICP, CPP, PbtO2 [52], a ukazuje se též jako přínosná ke zjištění mozkové autoregulace a vazoreaktivity [53]. Určitým negativem metody je asi pětiminutová hluchá perioda během opakované kalibrace přístroje, k níž dochází cca jednou za 1,5 hod. Analogická situace nastává při horečce pacienta nad 38 °C, kdy v rámci ochrany mozkové tkáně před rizikem termického poškození se přestává zahřívat distální termistor čidla, a tudíž je měření znemožněno.
Mikrodialýza mozkové tkáně
První zkušenosti s mikrodialýzou jsou ze 70. let [54]. Mikrodialýza se používá u těžkých poranění mozku stále více. Zkušeností s touto metodou je relativně hodně, více rozšířena byla již v 90. letech ve Švédsku [55]. Principem je fokální měření pomocí katétru s dvojitě dutou membránou. Do katétru je vháněna tekutina na bázi Ringerova roztoku a přes vnější membránu do něj difundují látky a metabolity z extracelulárního prostředí mozkové tkáně [56].
Pomocí mikrodialýzy se vyšetřuje těchto pět základních metabolitů: glukóza, laktát, pyruvát, glycerol a glutamát. V případě ischemie se glukóza a pyruvát metabolizují anaerobně za vzniku laktátu. Poměr mezi laktátem a pyruvátem (LP poměr) je významná monitorovaná hodnota. Zatímco vysoká hodnota laktátu může značit probíhající hypermetabolizmus, vysoký poměr mezi laktátem a pyruvátem indikuje probíhající ischemii. Při závažné ischemii také dochází k degradaci buněčných membrán. Z nich se vyplavuje glycerol coby základní stavební kámen fosfolipidů. Glutamát je excitační aminokyselina. Vyplavuje se z neuronů v průběhu ischemie a je také nepřímou známkou poškození buněk.
Prognostický význam pro výsledky léčby pacientů po těžkém poranění mozku mají hodnoty poměru laktát/pyruvát jako známky ischemie a též hodnoty glycerolu jako výrazu poškozené buněčné integrity. Někteří autoři uvádějí, že posuny v těchto parametrech mohou dokonce předcházet nitrolební hypertenzi [57]. Problematikou se zabývají i někteří naši autoři [58].
Teplota mozku
Sondy pro měření teploty mohou být samostatné nebo v kombinaci s jinými intraparenchymovými čidly (PtiO2, ICP, CBF) (obr. 9). Největší přínos má přímý monitoring mozkové teploty při použití mírné řízené hypotermie u těžkých poranění mozku (i když tato metoda není ještě všeobecně akceptována) a k prevenci hyperpyrexie [59].
CT monitoring
Stav nitrolebí po těžkém poranění mozku se často vyvíjí i v následujících minutách, hodinách, dnech i týdnech po úrazu. U závažných poranění, kdy je CT provedeno prakticky bezprostředně po úrazu, musíme určitě provést kontrolu například s odstupem 3–4 hod. Velmi často až druhé CT po několika hodinách nebo dokonce třetí CT následující den ráno ukáže chirurgickou lézi. CT kontrolu provádíme po eventuálním operačním výkonu, abychom zkontrolovali úspěšnost operace. Další plánovanou kontrolu můžeme u komatózního pacienta provést například za dva až tři dny a intervaly mezi CT kontrolami dále prodlužujeme. V těchto fázích může CT kontrola přispět např. k indikaci dekompresní kraniektomie z důvodu narůstajícího edému. Ještě později může dojít k vytvoření hygromu nebo posttraumatického hydrocefalu.
V současné době je určitá frustrace z nedokonalosti fokálního multimodálního monitoringu kompenzována na některých pracovištích ve světě zaváděním mobilních CT přístrojů na stanice neurointenzivní péče. Perfuzní CT pomůže velmi dobře zkorelovat fokálně měřený parametr se skutečnou hodnotou perfuze v mozku v měřené oblasti. Perfuzní CT nám ukáže, zda monitorujeme normální tkáň, penumbru nebo že je čidlo zavedeno do poškozené tkáně s porušenou perfuzí. Interpretace monitorovaných parametrů potom může být daleko přesnější a návrhy léčebných opatření cílenější [60].
Závěr
Je samozřejmé, že u pacientů po těžkém poranění mozku můžeme monitorovat ještě řadu dalších funkcí. Například k vyhodnocení „burst supression“ při tiopentalovém kómatu je nutný EEG monitoring. K posouzení průtoku krve mozkem, eventuálně stavu mozkové autoregulace může být využito také měření TCD, i když problémem zde zůstává korektní dlouhodobá fixace ultrazvukové sondy ke kalvě. Řada zkoumaných metod, které vyhodnocují mozkovou fyziologii, zůstává spíše v rovině experimentální. Výše uvedený text měl čtenáře seznámit s metodami nejvíce v praxi rozšířenými anebo nejperspektivnějšími. Velmi podstatné je, že žádná z těchto metod nemůže stát samostatně, a proto dnes hovoříme o tzv. multimodálním monitoringu u pacientů po těžkém poranění mozku. Invazivní metody, které jsou dnes v rámci multimodálního monitoringu nejpoužívanější, jsou monitoring ICP, CPP, PbtO2 a mikrodialýza. Na mnoha místech je stále populární jugulární oxymetrie. Do budoucna se jeví být perspektivní také přímé měření CBF a perfuzní CT. Podstatné je, že jednotlivé metody multimodálního monitoringu musejí být u konkrétního pacienta vyhodnocovány ve vzájemné souvislosti. Speciální softwary jsou schopny tyto korelace provádět on-line. Z vyhodnocených indexů cévní reaktivity se pak usuzuje na stav autoregulace mozkových cév a v současnosti se tento poznatek používá ke stanovení optimálního CPP pro konkrétního pacienta.
Monitoring mozkové fyziologie nesmí být samoúčelný, ale musí sloužit k časné diagnostice patologické situace a zároveň by měl být využíván jako kontrolní indikátor správné terapeutické intervence. Bohužel veškeré toto snažení zatím vede pouze ke zlepšení našich možností v ovlivnění sekundárního mozkového poranění.
prof.
MUDr. Martin Smrčka, CSc.
Neurochirurgická
klinika
LF
MU a FN Brno
Jihlavská
20
625
00 Brno
e-mail:
msmrcka@fnbrno.cz
Tento článek recenzovali:
prof. MUDr. Roman Gál, Ph.D.
MUDr. Aleš Hejčl, Ph.D.
MUDr. Martin Filaun, CSc.
Prof. MUDr. Martin Smrčka, Ph.D., MBA (1965)
Profesor Martin Smrčka se narodil 8. 2. 1965 v Brně. Po promoci až do roku 1992 pracoval na chirurgickém oddělení NsP Ivančice. Od roku 1992 dodnes pracuje na Neurochirurgické klinice LF MU a FN Brno. Od července 1995 do června 1996 absolvoval odbornou stáž u cévního neurochirurga prof. Ogilvyho v Massachusetts General Hospital, Harvard Medical School, Boston, USA. Zde se zúčastnil výzkumu mozkové ischemie v experimentu, jehož výsledkem bylo několik impaktovaných publikací a množství impaktovaných citací. V roce 1999 obhájil dizertační práci na téma „Vliv navozené systémové hypertenze na ložisko fokální mozkové ischemie“ a získal titul Ph.D. V roce 2000 obdržel cenu J. D. Miller Scholarship Award za práci v oblasti poranění mozku, kterou převzal na meetingu ICP 2000, 22.–27. 7. 2000 v Cambridge, UK. O tři roky později obhájil habilitační práci na téma „Diagnostika a léčba poruch mozkové perfuze u pacientů po těžkém kraniocerebrálním poranění“. Od roku 2005 je přednostou Neurochirurgické kliniky LF MU a FN Brno. V následujícím roce ukončil studium na Prague International Business School a získal titul MBA. 2. března 2009 byl jmenován profesorem chirurgie. Je autorem 65 původních prací v odborné literatuře. Jako pořadatel nebo autor kapitol se podílel na 12 monografiích a 11 pedagogických publikacích. Doma i v zahraničí odpřednášel více než 150 odborných sdělení. Je řešitelem nebo spoluřešitelem mnoha výzkumných grantů a klinických studií. Prof. Smrčka je členem výboru České neurochirurgické společnosti ČLS JEP, členem výboru Central European Neurosurgical Society (CENS) a členem European Association of Neurosurgical Societies (EANS) a World Federation of Neurosurgical Societies (WFNS), členem komise pro atestační zkoušky z oboru neurochirurgie, členem vědecké rady LF MU a vědecké rady MOÚ Brno. Hlavním odborným zájmem prof. Smrčky je cévní neurochirurgie, neuroonkologie včetně tumorů baze lební a tumorů komorového systému a neurointenzivní péče.
Vědomostní test
- Pacienti s těžkým
poraněním mozku jsou definováni jako:
a) pacienti s těžkým otřesem mozku
b) pacienti s GCS 8–15
c) pacienti s poresuscitačním stavem vědomí na úrovni GCS 3–8
d) pacienti s kontuzí v dominantní hemisféře - Označte, které tvrzení je
správné:
a) bradykardie v souvislosti se systémovou hypertenzí může znamenat nitrolební hypertenzi (Cushingův reflex)
b) bradykardie a hypertenze jsou projevy selhávání cirkulace
c) bradykardie v souvislosti se systémovou hypotenzí může znamenat nitrolební hypertenzi (Cushingův reflex)
d) nitrolební hypertenze se neprojevuje příznaky poruchy funkce kardiovaskulárního sytému - Které
z následujících tvrzení je správné?
a) CPP je rozdíl mezi středním arteriálním tlakem a intrakraniálním tlakem (CPP = MAP – ICP)
b) CPP je součet středního arteriálního tlaku a intrakraniálního tlaku (CPP = MAP + ICP)
c) CPP nezávisí na ICP a MAP
d) součet ICP a CPP je vždy nižší než MAP - Pressure reactivity index
(PRx):
a) je vyjádřením vztahu mezi ICP a MAP
b) odráží schopnost autoregulace mozkových cév
c) může být použit ke zjištění optimálního CPP
d) všechny odpovědi jsou správné -
Které laboratorní parametry
vyšetřujeme u pacientů po těžkém KCP:
a) krevní plyny, ETCO2
b) hemokoagulace, krevní obraz
c) ionty, glykemie, bilance tekutin
d) platí všechno uvedené - Do základního zhodnocení
neurologického nálezu nepatří:
a) stav vědomí pomocí Glasgow Coma Scale
b) šířka a fotoreakce zornic
c) izolované zhodnocení motorické odpovědi každé končetiny zvlášť
d) zhodnocení CT nálezu -
Označte správné tvrzení:
a) monitoring ICP je nezbytný k vedení správné terapie orientované na zachování normálního perfuzního tlaku
b) v současné době je doporučována jiná lokalizace snímače ICP než intraventrikulární nebo intraparenchymová
c) vždy je potřeba upřednostnit intraventrikulární polohu snímače ICP
d) monitorování ICP u pacientů po dekompresní kraniektomii je zbytečné - O komplikacích ICP
monitoringu platí:
a) zánětlivé komplikace jsou přímo úměrné délce implantace ICP čidla
b) hemoragie nebo hematom vzniká v 50 % případů
c) každý pacient s implantovaným ICP čidlem musí preventivně užívat antiepileptika
d) nevhodná manipulace s pacientem není důvod poruchy fungování ICP čidla - Označte, které tvrzení je
správné:
a) hodnota ICP 20 mmHg je obecně akceptována jako hranice terapeutické intervence
b) ICP měříme obvykle v supratentoriálním prostoru
c) v posledním stadiu nitrolební hypertenze dochází k herniaci mozkové tkáně
d) platí všechno uvedené - O jugulární oxymetrii
platí:
a) katetrizujeme vždy nedominantní bulbus venae jugularis internae
b) větší a rychlejší vzestup ICP je při kompresi dominantní VJI
c) polohu vlákna verifikujeme pomocí magnetické rezonance
d) výměna katétru se doporučuje v intervalu 14–21 dnů - Jaká je hlavní limitace
monitoringu jugulární oxymetrie v monitoringu mozkové
ischemie:
a) nemožnost monitorování regionální mozkové oxygenace
b) častá náchylnost k technické chybě
c) častý výskyt desaturačních period
d) jugulární oxymetrie je metoda neomezených možností - U jaké hladiny SvjO2
dochází k manifestaci útlumu vědomí:
a) 45 %
b) 24 %
c) 15 %
d) 100 % - Které z následujících
tvrzení je pravdivé:
a) zvýšená spotřeba kyslíku mozkem vede ke zvýšení SvjO2
b) čím delší je desaturační perioda, tím je lepší prognóza pacienta
c) při výskytu SvjO2 pod 50 % se musí tento údaj ihned ověřit odběrem vzorku krve
d) jugulární oxymetrie nijak nesouvisí s hodnotami CBF a nemá vliv na rozhodování se o hyperventilaci u indikovaných pacientů - O tkáňové oxymetrii
platí:
a) u každé implantace musíme bezpodmínečně trefit tzv. penumbru
b) ihned po implantaci čidla můžeme získávat validní hodnoty PtiO2
c) PtiO2 je možno s výhodou monitorovat i v elokventních oblastech mozku
d) všechny odpovědi jsou nesprávné - Interpretace monitoringu
tkáňové oxymetrie:
a) hodnoty PtiO2 nad 20 mmHg považujeme za normální
b) hodnota PtiO2 nekoreluje se změnami CPP
c) hladina tkáňového kyslíku po dekompresní kraniektomii obvykle nestoupá
d) poruchy fokální perfuze nelze detekovat pomocí měření PtiO2 - Near-infrared spectroscopy:
a) jedná se o invazivní metodu měření oxygenovaného hemoglobinu v mozkové tkáni
b) jedná se o měření saturace mozkového hemoglobinu kyslíkem cestou rozptylu fotonů
c) jedná se o obsoletní metodu využívanou v počátcích multimodálního monitoringu
d) parametry jsou snímány z hloubky přibližně 15 cm a monitorovaný objem tkáně představuje asi 450 ml - Monitoring průtoku krve
mozkem:
a) průtok krve mozkem nelze monitorovat přímo
b) jedná se o přínosnou metodu ke zjištění mozkové autoregulace a vazoreaktivity
c) horečka nad 40 °C nemá u systému Hemedex vliv na monitorování CBF
d) metoda je nespolehlivá, protože naměřené hodnoty nekorelují s hodnotami naměřenými pomocí jiných, již etablovaných metod -
Z následujících
tvrzení o mikrodialýze neplatí:
a) základních pět metabolitů, které se vyšetřují pomocí mikrodialýzy, jsou: glukóza, laktát, pyruvát, glycerol a glutamát
b) nejvýznamnějším monitorovaným parametrem v rámci mikrodialýzy je poměr laktát/pyruvát
c) vysoká hodnota laktátu může znamenat hypermetabolizmus mozkové tkáně
d) zatím se nejedná o etablovanou metodu v multimodálním monitoringu - O CT monitoringu platí:
a) pokud je CT provedeno těsně po závažném poranění mozku a není ihned indikace k operaci, je vhodné vyšetření opakovat za několik hodin znovu
b) nález narůstajícího edému na CT nemůže být indikací k dekompresní kraniektomii
c) po operaci pro mozkové trauma není již dále nutno pacienta kontrolovat pomocí CT vyšetření
d) pokud se CT vyšetření provede těsně po úrazu, není nutné ho opakovat dříve než za 24 hod - Multimodální monitoring:
a) veškerá naše snaha by měla vést k zamezení sekundárního ischemického poškození mozkové tkáně
b) jednotlivé metody multimodálního monitoringu musejí být u konkrétního pacienta vyhodnocovány ve vzájemné souvislosti
c) monitoring mozkové fyziologie nesmí být samoúčelný, ale musí sloužit k časné diagnostice patologické situace a zároveň by měl
sloužit jako kontrolní indikátor správné terapeutické intervence
d) platí všechno uvedené
Zdroje
1. Maas AI, Dearden M, Teasdale GM, Braakman R, Cohadon F, Iannotti F et al. EBIC-Guidelines for Management of Severe Head Injury in Adults. European Brain Injury Consortium. Acta Neurochir 1997; 139(4): 286–294.
2. The American Association of Neurological Surgeons. Brain Trauma Foundation. J Neurotrauma1996; 13(11): 639–734.
3. Zweifel C, Lavinio A, Steiner LA, Radolovich D, Smielewski P, Timofeev I et al. Continuous monitoring of cerebrovascular pressure reactivity in patients with head injury. Neurosurg Focus 2008; 25(4): E2.
4. Puccio AM, Fischer MR, Jankowitz BT, Yonas H, Darby JM, Okonkwo DO. Induced normothermia attenuates intracranial hypertension and reduces fever burden after severe traumatic brain injury. Neurocrit Care 2009; 11(1): 82–87.
5. Fox JL, Vu EN, Doyle-Waters M, Brubacher JR, Abu-Laban R, Hu Z. Prophylactic hypothermia for traumatic brain injury: a quantitative systematic review. CJEM 2010; 12(4): 355–364.
6. Moro N, Katayama Y, Igarashi T, Mori T, Kawamata T, Kojima J. Hyponatremia in patients with traumatic brain injury: incidence, mechanism, and response to sodium supplementation or retention therapy with hydrocortisone. Surg Neurol 2007; 68(4): 387–393.
7. Powner DJ, Miller ER, Levine RL. CVP and PAoP measurements are discordant during fluid therapy after traumatic brain injury. J Intensive Care Med 2005; 20(1): 28–33.
8. Rodling Wahlström M, Olivecrona M, Nyström F, Koskinen LO, Naredi S. Fluid therapy and the use of albumin in the treatment of severe traumatic brain injury. Acta Anaesthesiol Scand 2009; 53(1): 18–25.
9. Jiménez R, Casado-Flores J, Nieto M, García-Teresa MA. Cerebral salt wasting syndrome in children with acute central nervous system injury. Pediatr Neurol 2006; 35(4): 261–263.
10. Teasdale G, Jennett B. Assessment of coma and impaired consciousness. A practical scale. Lancet 1974; 2(7872): 81–84.
11. The Brain Trauma Foundation. The American Association of Neurological Surgeons. The Joint Section on Neurotrauma and Critical Care. Indications for intracranial pressure monitoring. J Neurotrauma 2007; 24 (Suppl 1): S37.
12. The Brain Trauma Foundation. The American Association of Neurological Surgeons. The Joint Section on Neurotrauma and Critical Care. Recommendations for intracranial pressure monitoring technology. J Neurotrauma 2007; 24 (Suppl 1): S45.
13. Schneider GH, Bardt T, Lanksch WR, Unterberg. A.Decompressive craniectomy following traumatic brain injury: ICP, CPP and neurological outcome. Acta Neurochir Suppl 2002; 81 : 77–79.
14. Mayhall CG, Archer NH, Lamb VA, Spadora AC, Baggett JW, Ward JD et al. Ventriculostomy related infections. A prospective epidemiologic study. N Engl J Med 1984; 310(9): 553–559.
15. Narayan RK, Kishore PRS, Becker DP, Ward JD, Enas GG, Greenbert RP et al. Intracranial pressure: to monitor or not to monitor? A review of our experience with severe head injury. J Neurosurg 1982; 56(5): 650–659.
16. Yablon JS, Lantner HJ, McCormack TM, Nair S, Barker E, Black P. Clinical experience with a fiberoptic intracranial pressure monitor. J Clin Monit 1993; 9(3): 171–175.
17. Paramore CG, Turner DA. Relative risks of ventriculostomy infection and morbidity. Acta Neurochir (Wien) 1994; 127(1–2): 79–84.
18. Piek J, Kosub B, Kuch F et al. A practical technique for continuous monitoring of cerebral tissue pressure in neurosurgical practice – Experiences with 100 patients. Intensive Care Med 1990; 16 : 184–188.
19. Lundberg N. Continuous recording and control of ventricular fluid pressure in neurosurgical practice. Acta Psychiatr Scand Suppl 1960; 36 (149): 1–193.
20. Welch K. The intracranial pressure in infants. J Neurosurg 1980; 52 : 693–699.
21. Langfitt TW. Increased intracranial pressure. Clin Neurosurg 1969; 16 : 436–471.
22. Miller JD, Garibi J, Pickard JD. Induced changes of cerebrospinal fluid volume: Effects during continuous monitoring of ventricular fluid pressure. Arch Neurol 1973; 28(4): 265–269.
23. Maset AL, Marmarou A, Ward JD, Choi S, Lutz HA, Brooks D et al. Pressure-volume index in head injury. J Neurosurg 1987; 67(6): 832–840.
24. White H, Venkatesh B. Cerebral perfusion pressure in neurotrauma: a review. Anesth Analg 2008; 107(3): 979–988.
25. Steiner LA, Czosnyka M, Piechnik SK, Smielewski P, Chatfield D, Menon DK et al. Continuous monitoring of cerebrovascular pressure reactivity allows determination of optimal cerebral perfusion pressure in patients with traumatic brain injury. Crit Care Med 2002 Apr; 30(4): 733–738.
26. Smielewski P, Lavinio A, Timofeev I, Radolovich D, Perkes I, Pickard JD, Czosnyka M. ICM+, a flexible platform for investigations of cerebrospinal dynamics in clinical practice. Acta Neurochir Suppl 2008; 102 : 145–151.
27. Hatiboğlu MT, Anil A. Structural variations in the jugular foramen of the human skull. J Anat 1992; 180(1): 191–196.
28. Stocchetti N, Paparella A, Bridelli F, Bacchi M, Piazza P, Zuccoli P. Cerebral venous oxygen saturation studied using bilateral samples in the jugular veins. Neurosurgery 1994; 34(1): 38–44.
29. Gibbs EL, Lennox WG, Nims, Gibbs FA. Arterial and cerebral venous blood: Arterial-venous differences in man. J Biol Chem 1942; 144 : 325–332.
30. Cruz J. On-line monitoring of global cerebral hypoxia in acute brain injury: Relationship to intracranial hypertension. J Neurosurg 1993; 79(2): 228–233.
31. Robertson CS, Contant CF, Gokaslan ZL, Narayan RK, Grossman RG. Cerebral blood flow, arteriovenous oxygen difference, and outcome in head injured patients. J Neurol Neurosurg Psychiatry 1992; 55(7): 594–603.
32. Contant CF, Robertson CS, Gopinath SP et al. Determination of clinically important thresholds in continuously monitored patients with head injury. J Neurotrauma 1993; 10 (Suppl 1): S102.
33. Cruz J. Combined continuous monitoring of systemic and cerebral oxygenation in acute brain injury: Preliminary observations. Crit Care Med 1993; 21(8): 1225–1232.
34. Poca MA, Sahuquillo J, Monforte R, Vilalta A. Global systems for monitoring cerebral hemodynamics in the neurocritical patient: basic concepts, controversies and recent advances in measuring jugular bulb oxygenation. Neurochirugia (Astur) 2005; 16(4): 301–322.
35. Hlatky R, Robertson CS. Multimodality monitoring in severe head injury. Curr Opin Anaesthesiol 2002; 15(5): 489–493.
36. Nortje J, Coles JP, Timofeev I, Fryer TD, Aigbirhio FI, Smielewski P et al. Effect of hyperoxia on regional oxygenation and metabolism after severe traumatic brain injury: preliminary findings. Crit Care Med 2008; 36(1): 273–381.
37. Dings J, Meixensberger J, Jager A, Roosen K. Clinical experience with 118 brain tissue oxygen partial pressure catheter probes. Neurosurgery 1998; 43(5): 1082–1095.
38. Hoelper BM, Alessandri B, Heimann A, Behr R, Kempski O. Brain oxygen monitoring: in-vitro accuracy, long--term drift and response-time of Licox - and Neurotrend sensors. Acta Neurochir (Wien) 2005; 147(7): 767–774.
39. Menon DK, Coles JP, Gupta AK, Fryer TD, Smielewski P, Chatfield DA et al. Diffusion limited oxygen delivery following head injury. Crit Care Med 2004; 32(6): 1384–1390.
40. Johnston AJ, Steiner LA, Coles JP, Chatfield DA, Fryer TD, Smielewski P et al. Effect of cerebral perfusion pressure augmentation on regional oxygenation and metabolism after head injury. Crit Care Med 2005; 33(1): 189–195.
41. Kiening KL, Unterberg AW, Bardt TF, Schneider GH, Lanksch WR. Monitoring of cerebral oxygenation in patients with severe head injuries: brain tissue PO2 versus jugular vein oxygen saturation. J Neurosurg 1996; 85(5): 751–757.
42. Valadka AB, Gopinath SP, Contant CF, Uzura M, Robertson CS. Relationship of brain tissue PO2 to outcome after severe head injury. Crit Care Med 1998; 26(9): 1576–1581.
43. van den Brink WA, van Santbrink H, Steyerberg EW, Avezaat CJ, Suazo JA, Hogesteeger C et al. Brain oxygen tension in severe head injury. Neurosurgery 2000; 46(4): 868–876.
44. Filippi R, Reisch R, Mauer D, Perneczky A. Brain tissue pO2 related to SjvO2, ICP, and CPP in severe brain injury. Neurosurg Rev 2000; 23(2): 94–97.
45. Jaeger M, Soehle M, Meixensberger J. Improvement of brain tissue oxygen and intracranial pressure during and after surgical decompression for diffuse brain oedema and space occupying infarction. Acta Neurochir Suppl 2005; 95 : 117–118.
46. Hejčl A, Bartoš R, Humhej I, Bolcha M, Bejšovec D, Procházka J, Sameš M. Dekompresivní kraniektomie v léčbě posttraumatického edému mozku a přínos nových monitorovacích metod. Čas Lék čes 2007; 146(4): 307–312.
47. Gál R, Smrčka M, Štourač P, Straževská E, Neuman E. Měření tkáňového kyslíku v mozku jako součást multimodálního monitorování: kazuistiky. Cesk Slov Neurol N 2007; 70/103(5): 562–566.
48. Filaun M, Horáček M, Steindler J, Pekař L, Cvachovec K. Monitorování mozkové oxygenece. Cesk Slov Neurol N 2008; 71/104(6): 657–663.
49. Kirkpatrick PJ, Smielewski P, Czosnyka M, Menon DK, Pickard JD. Near-infrared spectroscopy use in patients with head injury. J Neurosurg 1995; 83(6): 963–970.
50. Zweifel C, Castellani G, Czosnyka M, Helmy A, Manktelow A, Carrera E et al. Noninvasive monitoring of cerebrovascular reactivity with near infrared spectroscopy in head-injured patients. J Neurotrauma 2010; 27(11): 1951–1958.
51. Büchner K, Meixensberger J, Dings J, Roosen K. Near-infrared spectroscopy – not useful to monitor cerebral oxygenation after severe brain injury. Zentralbl Neurochir. 2000; 61(2): 69–73.
52. Jaeger M, Soehle M, Schuhmann MU, Winkler D, Meixensberger J. Correlation of continuously monitored regional cerebral blood flow and brain tissue oxygen. Acta Neurochir (Wien) 2005; 147(1): 51–56.
53. Rosenthal G, Sanchez-Mejia RO, Phan N, Hemphill JC, Martin C, Manley GT. Incorporating a parenchymal thermal diffusion cerebral blood flow probe in bedside assessment of cerebral autoregulation and vasoreactivity in patients with severe traumatic brain injury. J Neurosurg 2010; 114(1): 62–70.
54. Ungerstedt U, Pycock C. Functional correlates of dopamine neurotransmission. Bull Schweiz Akad Med Wiss 1974; 30(1–3): 44–55.
55. Ståhl N, Ungerstedt U, Nordström CH. Brain energy metabolism during controlled reduction of cerebral perfusion pressure in severe head injuries. Intensive Care Med 2001; 27(7): 1215–1223.
56. Gautschi OP, Seule M, Cadosch D, Land M, Fournier JY, Hildebrandt G. Cerebral microdialysis. Options and limits. Anasthesiol Intensivmed Notfallmed Schmerzther 2009; 44(4): 268–274.
57. Belli A, Sen J, Petzold A, Russo S, Kitchen N, Smith M. Metabolic failure precedes intracranial pressure rises in traumatic brain injury: a microdialysis study. Acta Neurochir (Wien) 2008; 150(5): 461–469.
58. Hejčl A, Sameš M. Mikrodialýza v neurochirurgii, Cesk Slov Neurol N 2009; 72/105(6): 511–517.
59. Sinclair HL, Andrews PJ. Bench-to-bedside review: Hypothermia in traumatic brain injury. Crit Care 2010; 14(1): 204.
60. Wintermark M, Sincic R, Sridhar D, Chien JD. Cerebral perfusion CT: technique and clinical applications. J Neuroradiol 2008; 35(5): 253–260.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie
2011 Číslo 1
-
Všechny články tohoto čísla
-
Výroční kongres České neurochirurgické společnosti ČLS JEP
3.–5. 11. 2010, Clarion Congress Hotel Ostrava
Neurochirurgická klinika Fakultní nemocnice Ostrava - Farmakologická neuroprotekce u akutní ischemické cévní mozkové příhody
- Účinnost piracetamu, vinpocetinu a Ginkgo biloba na poruchy učení a paměti vyvolané antipsychotiky.
- Neurologie v České a slovenské neurologii a neurochirurgii
- Validizační studie české verze dotazníku FAQ
- Resekční epileptochirurgie u pacientů s perirolandickou epilepsií
- 12-kDa FK 506-vážící protein zapojený do neuroprotektivního účinku dantrolenu v mozkové kůře potkanů po ischemicko-reperfuzním postižení
- Spasticita horní končetiny – modulace terapií botulotoxinem typu A a odraz v kortikální somatosenzitivní aktivaci
-
Botulotoxin v léčbě spasticity horní končetiny po cévní mozkové příhodě
Komentář k práci Opavského et al. Spasticita horní končetiny – modulace terapií botulotoxinem typu A a odraz v kortikální somatosenzitivní aktivaci - Peroperační kontrola funkce extra-intrakraniálního bypassu ultrazvukovými metodami
- Nadužívání léků pacienty s chronickou denní bolestí hlavy v České republice
- Extrémna hypertrofia periférnych nervových štruktúr pri CIDP – kazuistika
- Komentář k článku J. Michalika et al Extrémna hypertrofia periférnych nervových štruktúr pri CIDP
- Nokardiové abscesy mozku – dvě kazuistiky
- Komentář k práci Krajina et al Endovaskulární rekanalizace při léčbě akutních uzávěrů mozkových tepen
- Komentář ke komentáři Masopust et al k práci Matoušek et al Endoskopická transnazální chirurgie hypofýzy – výhody spolupráce otorinolaryngologa a neurochirurga
- Komentář k minimonografii Ošlejšková et al Autizmy: Poruchy autistického spektra v pohledu biomedicíny
- Prof. MUDr. Vladimír Beneš, DrSc., st. – devadesát let
- Lacosamid (Vimpat®) – nový lék pro přídatnou léčbu pacientů s fokální epilepsií
- Monitoring pacientů s těžkým poraněním mozku
- Webové okénko
-
Analýza dat v neurologii
XXV. Hodnocení diagnostických testů – senzitivita a specificita
-
Výroční kongres České neurochirurgické společnosti ČLS JEP
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle
- Monitoring pacientů s těžkým poraněním mozku
- Lacosamid (Vimpat®) – nový lék pro přídatnou léčbu pacientů s fokální epilepsií
- Účinnost piracetamu, vinpocetinu a Ginkgo biloba na poruchy učení a paměti vyvolané antipsychotiky.
- Nadužívání léků pacienty s chronickou denní bolestí hlavy v České republice

